作为代表性的亚热带水果和药食同源食品,龙眼(Dimocarpus longan Lour.)具有较高的营养价值和独特的风味,尤其是含有丰富的活性多酚和多糖,深受消费者喜爱[1-2]。龙眼鲜果采收上市时间集中且极易褐变腐烂,大部分通过干制以实现农产品保藏与转化[3-4],故干制加工技术研发对产业发展有重要现实意义。近年来,龙眼干制技术研究的方向发生明显转变,即由“高效节能技术的设计与创新”[5-7]转向“基于高品质产品制备的技术评价与优化”[8-9]。目前,对于龙眼干果肉的品质控制研究主要侧重于其食用特征(色泽、质地、外形、风味等)、基本营养成分以及抗氧化活性多酚的工艺影响[3-4,8-10],而对果肉营养功能有重要贡献的多糖则鲜有关注。
现代药理学研究证实,龙眼果肉多糖具有良好的抗氧化、抗肿瘤和免疫调节活性[2,11]。而本课题组前期研究发现,具有免疫调节活性的龙眼多糖含有少量蛋白质或氨基酸[12-13],这部分氨基化合物可能是在果肉热风干制过程中与多糖通过美拉德反应共价结合,并在一定程度上增强多糖的体外免疫刺激活性[14-17]。Huang Fei[18]和郭亚娟[19]等研究发现,不同方式干制荔枝果肉中多糖的理化特征、抗氧化和免疫调节活性呈现显著差异。直接的多糖提取液干制研究发现,因温度、时间和脱水机理等的差异,不同方法干制所得多糖的结构和活性有明显区别[20-23]。龙眼干果肉中多糖的存在状态对于其营养功能品质提升有重要意义,而不同干制方法对多糖理化特征和功能活性的影响鲜见报道。为此,本实验采用热风、真空、红外和冷冻方法分别干制龙眼果肉,提取分离其多糖组分,分析粗多糖的理化及生化特性,明确干制方式对龙眼果肉中多糖的影响,旨为龙眼果肉干制品质“提质增效”提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜龙眼(‘储良’)购于茂名市粤云山农业发展有限公司。
邻苯二甲醛 上海阿拉丁生化科技股份有限公司;1-苯基-3-甲基-5吡唑啉酮 北京化学试剂公司;甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖(均为色谱纯) 上海源叶生物科技有限公司;考马斯亮蓝试剂盒 南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrythydrazyl,DPPH) 东京化成工业株式会社;脂多糖(lipopolysaccharide,LPS) 北京博奥拓达科技有限公司;其他化学试剂均为国产分析纯。
人源胃癌细胞SGC7901、人源肝癌细胞HepG2、小鼠腹腔巨噬细胞RAW264.7 湖北百奥斯生物科技有限公司;细胞活力检测试剂盒CCK-8 南京恩晶生物科技有限公司;小鼠肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)酶联免疫试剂盒 武汉基因美科技有限公司;α-淀粉酶(酶活力50 U/g)、胃蛋白酶(1∶30 000)、胰酶(1∶4 000) 上海源叶生物科技有限公司。
1.2 仪器与设备
DZF-6050型真空干燥箱 上海精宏设备有限公司;12N冷冻干燥仪 宁波新芝生物科技股份有限公司;WS70-1红外快速干燥箱 杭州齐威仪器有限公司;SUNRISE酶标定量测定仪 瑞士Tecan公司;NEXUS-670傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪 美国尼高力仪器有限公司;L-8900全自动氨基酸分析仪 日本日立公司;1260高效液相色谱(high-performance liquid chromatography,HPLC)系统、ZORBAX Extend-C18色谱柱(4.6 mm×250 mm,5 μm)、PL aquagel-OH 40色谱柱(7.5 mm×300 mm,8 μm) 美国Agilent公司;DAWN HELEOS-II18多角度激光光散射(multi-angle laser light scattering,MALLS)检测器和Optilab rEX示差折光率(refractive index,RI)检测器 美国Wyatt公司。
1.3 方法
1.3.1 龙眼果肉干制及其粗多糖制备
1.3.1.1 龙眼果肉干制
热风干制(hot-air drying,HD):参考徐玉娟等[9]的方法,将龙眼果实采用60 ℃热风干制60 h,干制过程中间隔12 h静置回软12 h(回软时间不计入干制时间),干制果实于-20 ℃冰箱保存备用。
真空干制(vacuum drying,VD):参考肖维强等[24]的方法,将龙眼果实在80 ℃(真空度不高于0.07 MPa)下初焙12 h,在65 ℃(真空度不高于0.07 MPa)下复焙42 h,干制过程中间隔12 h静置回软处理12 h,干制果实于-20 ℃冰箱保存备用。
红外干制(infrared drying,ID):将龙眼果实在500 W功率下辐射干制6 h,干制过程中间隔1 h静置回软处理3 h,干制果实于-20 ℃冰箱保存备用。
冷冻干制(freeze drying,FD):将龙眼果实置于-20 ℃预冻12 h,在真空度约51 Pa及冷阱温度约-40 ℃的条件下干制39 h,干制果实于-20 ℃冰箱保存备用。
1.3.1.2 龙眼粗多糖制备
参考韩苗苗等[14]的方法提取制备龙眼多糖(longan polysaccharide,LP)。从新鲜(fresh,F)、热风干制、真空干制、红外干制和冷冻干制的果肉中制备所得的粗多糖分别记为FLP、HDLP、VDLP、IDLP和FDLP。
1.3.2 龙眼粗多糖的理化分析
总糖质量分数采用苯酚-硫酸法测定[25],以葡萄糖当量计算;蛋白质质量分数采用考马斯亮蓝试剂盒测定;氨基酸组成参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[26],采用氨基酸自动分析仪测定;单糖组成采用反相HPLC法测定[27];在4 000~400 cm-1波数范围内扫描多糖的FTIR光谱,并采用高效分子排阻色谱(high-pressure size exclusion chromatography,HPSEC)法结合MALLS和RI检测器分析多糖的分子质量[16]。
1.3.3 龙眼粗多糖的活性评价
多糖的DPPH自由基清除能力和羟自由基清除能力参考Yi Yang等[16]的方法。多糖的巨噬细胞免疫刺激活性参考韩苗苗等[14]的方法,将实验分为空白对照组、LPS刺激组、FLP组、HDLP组、VDLP组、IDLP组和FDLP组。采用一氧化氮(nitric oxide,NO)生成量和TNF-α表达量评价。
1.3.4 龙眼粗多糖的消化特性
参考Yi Yang等[28]的方法:制备模拟唾液、胃液和肠液;在各消化液中处理多糖,再进行消化液的检测前处理。消化液中的还原糖含量采用二硝基水杨酸法测定[29],而游离单糖组成采用反相HPLC法测定[27]。
1.4 数据处理与分析
实验数据采用平均值±标准偏差表示,组间数据在0.05水平的显著性差异通过SPSS 19.0软件进行S-N-K检验分析。FTIR光谱图通过ChemPattern 2017化学计量学分析软件积分,统计相对峰高值大于0.5的特征谱带。
2 结果与分析
2.1 不同方式干制龙眼果肉中粗多糖的理化特征比较
表1 不同方式干制龙眼果肉中粗多糖的基本组成
Table 1 Chemical composition of crude polysaccharides from longan pulp dried by different methods

注:表中总糖和蛋白质的质量分数均以相对物质干质量计,同行肩标小写字母不同表示存在显著性差异(P<0.05)。-.未检测出。
组成 龙眼粗多糖FLP HDLP VDLP IDLP FDLP总糖质量分数/% 52.59±0.63b54.80±1.71b63.13±0.99d59.61±1.75c46.80±0.52a蛋白质量分数/% 27.89±0.94a27.56±0.85a31.27±0.41b33.28±0.32c29.02±0.51a氨基酸质量分数/%(以总氨基酸质量计)天冬氨酸 17.70 18.59 11.11 12.67 21.60苏氨酸 2.65 1.83 1.75 2.33 2.66丝氨酸 5.01 2.88 3.51 4.00 0.71谷氨酰胺 20.06 21.99 27.19 25.67 20.41脯氨酸 4.72 5.50 4.68 4.67 4.14甘氨酸 2.06 2.62 1.75 22.67 2.37丙氨酸 18.58 15.97 20.18 22.67 12.57半胱氨酸 0.89 0.79 0.88 1.33 0.89缬氨酸 6.78 8.38 6.43 4.67 5.32蛋氨酸 1.18 1.31 1.46 1.00 0.03异亮氨酸 0.88 - 0.29 1.67 0.89亮氨酸 5.60 8.12 7.31 9.00 11.54酪氨酸 1.18 - 2.34 1.33 0.89苯丙氨酸 4.72 8.38 8.77 0.03 2.66组氨酸 0.89 1.31 0.58 0.33 0.59赖氨酸 4.13 2.36 1.75 3.00 2.37精氨酸 3.24 - - 1.33 -疏水性氨基酸 42.46 47.66 49.12 43.71 37.15
不同方式干制龙眼果肉制备所得粗多糖的基本组成存在明显差异,如表1所示。前期研究发现,龙眼果肉经连续热风干制60 h后粗多糖的多糖质量分数显著下降(P<0.05),而蛋白质量分数显著增加(P<0.05)[14],可能与大分子发生美拉德反应有关。然而,FLP与HDLP的总糖和蛋白质量分数无明显差异(P>0.05),相比之下,VDLP和IDLP具有更高的总糖和蛋白质量分数,FDLP的总糖质量分数最低。不同粗多糖中蛋白质的氨基酸组成也存在明显区别,FDLP中疏水性氨基酸占总氨基酸的质量分数(37.15%)明显低于其他4 种粗多糖。HDLP果肉所得粗多糖中疏水性氨基酸质量分数略高于FLP,可能与蛋白质的糖基化有关,导致蛋白质量分数增加。而对于不同方式干制荔枝果肉中粗多糖的组成差异,郭亚娟[19]认为与干制条件对多糖结构和蛋白质结构的影响以及进一步的大分子静电相互作用改变有关。
采用柱前衍生化HPLC法测定8 种单糖混合标准品的色谱峰依次为:甘露糖(13.151 min)、核糖(17.357 min)、鼠李糖(18.760 min)、葡萄糖醛酸(19.999 min)、半乳糖醛酸(22.751 min)、葡萄糖(27.106 min)、半乳糖(30.458 min)、阿拉伯糖(32.508 min)(图1)。同时,确定5 种龙眼粗多糖主要由葡萄糖组成,文献[14,16]报道的其余7 种单糖可能因含量过低而未被检出。

图1 不同方式干制龙眼果肉中粗多糖的单糖组成HPLC分析图谱
Fig. 1 HPLC chromatograms of monosaccharide compositions of crude polysaccharides from longan pulp dried by different methods
采用HPSEC-MALLS-RI法测定龙眼粗多糖的分子质量分布,结果如表2所示。5 种粗多糖的分子质量分布存在明显差异,FLP、HDLP、VDLP、IDLP和FDLP的平均分子质量之比为51.37∶28.33∶5.95∶7.86∶1.00;FLP以105~106 Da组分为主(相对含量70.4%),且大于107 Da组分相对含量达29.6%;干制龙眼果肉所得粗多糖中大于107 Da组分明显减少,105~106 Da组分增加,106~107 Da组分含量相对稳定;FDLP的分子质量分布明显不同于其他多糖,其组分主要集中在小于105 Da范围,相对含量达72.8%。研究表明,冷冻、真空、微波、热泵和热风干制均不同程度导致荔枝果肉中多糖分子质量降低[19]。韩苗苗等[14]研究发现,龙眼果肉经热风干制60 h后,多糖与蛋白质结合形成大分子复合物,导致分子质量增加。此外,Yan Jingkun等[30]研究发现,苦瓜片在热风干制和红外辐射干制过程中,其多糖均发生一定程度热降解。由此推测,龙眼果肉粗多糖分子质量分布存在差异的主要原因可能涉及3 个方面:1)热干制过程中多糖分子的降解使其分子质量降低;2)热干制过程中多糖和蛋白质可能发生羰氨缩合、Amadori重排、分子裂解、Strecker降解等反应,导致复合物的生成与分解,使分子质量先升后降;3)干制过程导致多糖和蛋白质分子结构改变,减弱了浓缩、醇沉及复溶冷冻干燥等制备过程中分子间的静电、氢键或疏水相互作用,导致大分子缠结、聚集或结合减弱,使分子质量降低。
表2 不同方式干制龙眼果肉中粗多糖的分子质量分布
Table 2 Molecular mass distribution of crude polysaccharides from longan pulp dried by different methods

6.845~10.736 8.352×107±20.194 29.6 FLP 14.175~15.321 5.353×106±6.544 6.9 15.321~18.097 9.449×105±6.539 59.2 18.097~20.842 5.582×106 ±6.606 4.3 6.473×106 6.694~11.340 6.049×107±22.813 23.0 HDLP 14.235~15.291 1.665×106±2.354 6.8 15.291~18.006 2.696×105±2.610 67.1 18.006~20.148 2.243×106±2.397 3.0 3.569×106 7.086~8.293 3.286×107±10.433 7.5 VDLP 8.293~10.887 9.913×106±1.469 11.2 13.873~15.291 8.010×105±2.109 8.4 15.291~17.916 17.916~20.420 7.500×105 1.252×105±2.393 2.584×105±2.023 60.4 12.4 6.905~8.263 3.584×107±8.141 9.0 IDLP 8.293~10.917 9.797×106±1.318 15.2 13.723~15.412 7.116×105±1.796 14.2 15.412~18.006 18.036~20.932 9.900×105 1.704×105±2.158 5.194×105±1.822 53.2 8.4 7.237~12.044 3.956×106±2.210 10.5 FDLP 12.064~14.175 3.178×105±4.494 16.7 14.175~15.291 8.043×104±7.768 19.1 15.291~18.730 3.995×104±14.715 53.7 1.260×105

图2 不同方式干制龙眼果肉中粗多糖的FTIR光谱特征
Fig. 2 FTIR characteristics of crude polysaccharides from longan pulp dried by different methods
A. FTIR光谱叠加图;B.FTIR光谱主要特征峰的平均相对峰高,峰高为0~1标准化值。
5 种龙眼多糖的红外光谱图都具有多糖和蛋白质的特征吸收(图2A)。糖类特征峰包括[14]:羟基O—H在3 422 cm-1附近产生的特征吸收峰属于分子间或分子内的伸缩、弯曲振动吸收峰;烷基C—H在2 926 cm-1附近产生的伸缩振动吸收峰;在1 180~953 cm-1范围由C—C和C—O伸缩振动以及C—H弯曲振动产生“糖带”吸收峰。蛋白质特征吸收峰包括:在1 616 cm-1附近产生的酰胺I区C=O伸缩振动吸收峰;在1 480 cm-1附近产生的酰胺II区N—H弯曲振动和C—N伸缩振动吸收峰;在1 330~1 260 cm-1范围的酰胺III区O—H弯曲振动吸收峰[14]。对FTIR光谱图进行积分,统计相对峰高值大于0.5的共有特征峰(图2B)。相比FLP,HDLP、VDLP、IDLP的烷基C—H特征吸收强度与酰胺区特征吸收强度均略有减弱,而FDLP的相关特征吸收均明显增强,说明热法干制(热风、真空、红外干制)和冷法干制(冷冻干制)对多糖和蛋白官能团产生不同的影响。
2.2 不同方式干制龙眼果肉中粗多糖的活性评价
抗氧化和免疫调节是龙眼多糖的重要生物功效[2,11],故对不同龙眼多糖的自由基清除能力和巨噬细胞刺激活性进行比较,结果如图3所示。5 种龙眼多糖对DPPH自由基和羟自由基的清除率随其质量浓度的增大而增加,但当质量浓度超过4 mg/mL后FDLP和FLP的DPPH清除率明显下降。相比热法干制果肉所得多糖,FDLP和FLD可能引入的取代基少,高浓度下反应体系中多糖的分子内或分子间氢键作用较强,活性羟基含量减少导致多糖作为氢供体的自由基清除能力减弱[31]。对于DPPH自由基清除能力和羟自由基清除能力,5 种多糖的强弱表现有所不同,可能与不同的反应机理有关(多糖的金属离子螯合能力直接影响羟自由基的产生)。HDLP的DPPH自由基清除能力最弱,FDLP的羟自由基清除能力最强。FDLP的自由基能力综合较强,可能因其分子质量较低,暴露的活性羟基较多。而果肉长时间热风干制过程中,HDLP的活性羟基可能被部分取代,导致其自由基清除能力减弱。
空白对照组和LPS刺激组的巨噬细胞NO生成量分别为55.60 μmol/L和71.62 μmol/L。由图3C可见,除FLP外,其他4 种粗多糖均能显著刺激巨噬细胞NO生成(P<0.05),且呈现量效正相关性。在相同质量浓度(100~400 μg/mL)下,VDLP与IDLP和FDLP刺激巨噬细胞NO生成量无显著差异(P>0.05),而HDLP在质量浓度400 μg/mL下NO生成量最高(P<0.05)。空白对照组和LPS刺激组的巨噬细胞TNF-α分泌量分别为63.45 pg/mL和183.14 pg/mL。由图3D可见,5 种多糖均能有效刺激巨噬细胞分泌TNF-α(P<0.05)。在100 μg/mL下,FLP刺激TNF-α分泌量与HDLP、VDLP和IDLP均无显著差异(P>0.05),但显著高于FDLP(P<0.05)。在400 μg/mL下,VDLP、IDLP和FDLP的TNF-α分泌量无显著差异(P>0.05),且显著低于HDLP(P<0.05),而FLP的TNF-α分泌量最高(P<0.05)。与羟自由基清除能力相反,龙眼多糖刺激巨噬细胞分泌TNF-α与分子质量呈正相关。前期研究发现,龙眼多糖主要通过Toll样受体4引发刺激信号转导[13],而Toll样受体4更易与高分子质量多糖亲合[32]。
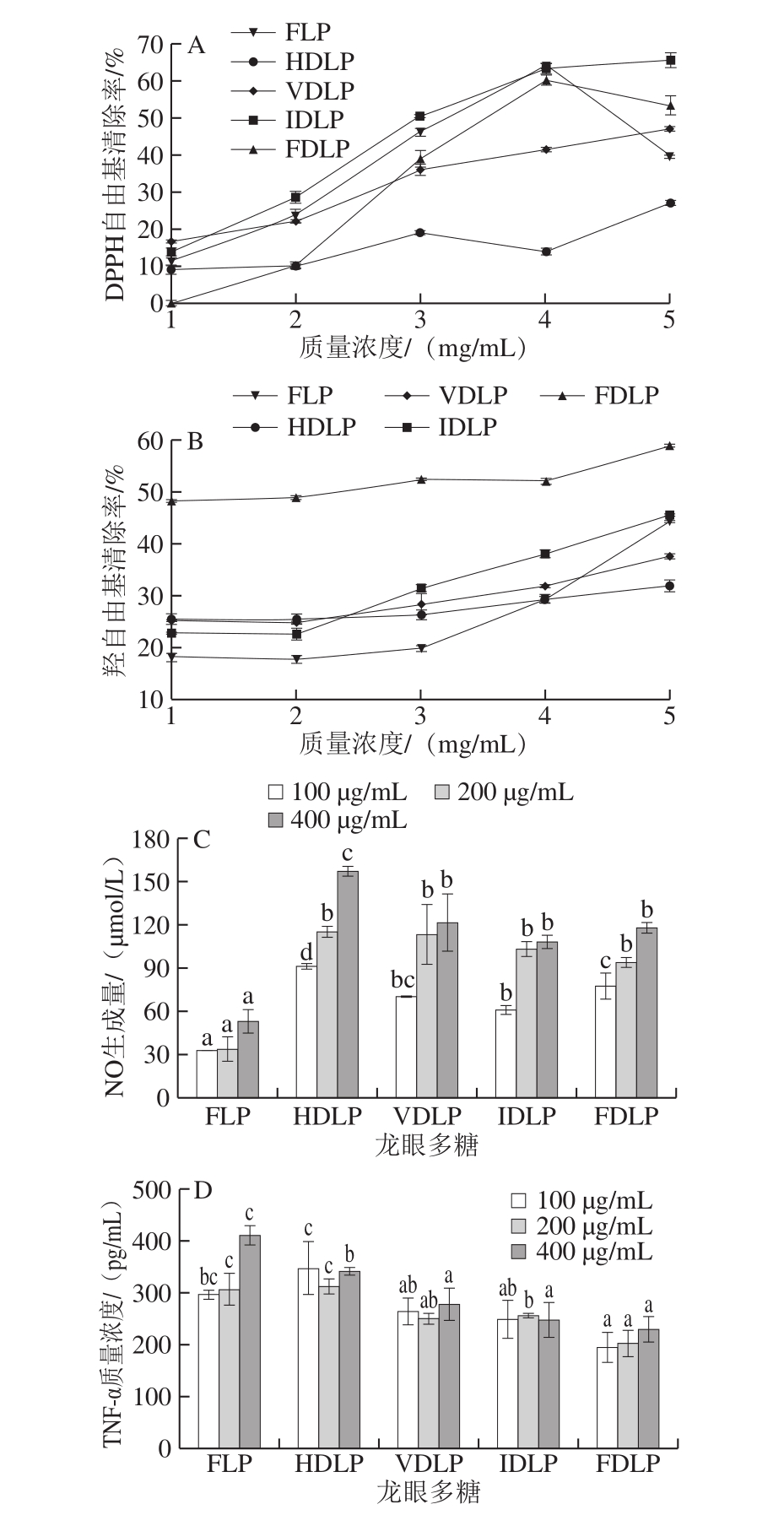
图3 不同方式干制龙眼果肉中粗多糖的抗氧化活性和巨噬细胞刺激活性
Fig. 3 Antioxidant and macrophage-stimulating activities of crude polysaccharides from longan pulp dried by different methods
A. DPPH自由基清除率;B.羟自由基清除率;C. NO生成量;D. TNF-α质量浓度。相同质量浓度不同龙眼多糖间小写字母不同表示差异显著(P<0.05)。
2.3 不同方式干制龙眼果肉中粗多糖的消化特性比较
多糖在消化过程可能因pH值、消化酶等作用发生降解,释放出还原糖,而结构上的变化可能改变其活性[28,33]。由图4可见,模拟唾液、胃液和肠液对5 种龙眼多糖有不同程度的消解作用,释放的还原糖质量浓度存在一定差异。模拟唾液消化2 h后,还原糖质量浓度均显著增加(P<0.05),但进一步延长消化时间其质量浓度未显著改变(P>0.05),而IDLP的消解程度明显低于其他多糖。相反,IDLP在模拟胃液中消解的还原糖质量浓度最高(P<0.05)。相比之下,龙眼多糖在模拟肠液中的消解程度微乎其微。采用HPLC法检测龙眼多糖经模拟消化6 h后的游离葡萄糖(图5),通过峰面积比较发现,胃液中游离葡萄糖含量最高,唾液次之,而肠液中的含量极低。唾液和胃液中还原糖和葡萄糖的含量高低不一致,说明龙眼多糖在不同消化体系中的消解机理存在差异。莲藕多糖为分子质量1.33~5.30 kDa的α-(1→6)-D-葡聚糖(或杂葡聚糖)[28],与龙眼多糖的组成相近[13,34],两者的消化特性存在异同:均在胃液中的葡萄糖消解量较高;莲藕多糖在肠液和胃液中的消解程度相近,且经肠液消解后分子质量降低。相对较高的分子质量可能是龙眼多糖消化特性有别于莲藕多糖的关键。

图4 不同方式干制龙眼果肉中粗多糖的消化特性
Fig. 4 Digestive characteristics of crude polysaccharides from longan pulp dried by different methods
A.模拟唾液消化;B.模拟胃液消化;C.模拟肠液消化;相同多糖在不同消化时间下小写字母不同表示差异显著(P<0.05)。
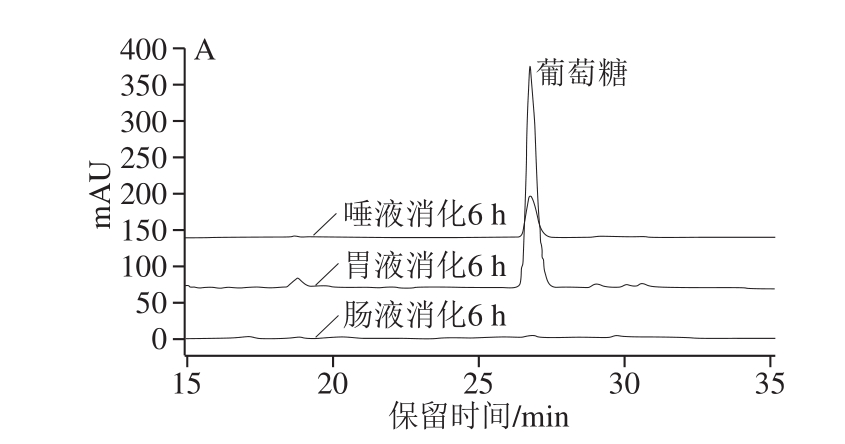

图5 龙眼粗多糖模拟消化6 h后消解单糖的HPLC分析图谱
Fig. 5 HPLC chromatograms of monosaccharides released from crude longan polysaccharides after simulated digestion for 6 hours
A. FLP;B. HDLP;C. VDLP;D. IDLP;E. FDLP。
3 结 论
从新鲜和干制龙眼果肉中分别提取分离粗多糖,即FLP、HDLP、VDLP、IDLP、FDLP,通过分析其基本组成、FTIR光谱特征和分子质量分布发现,不同干制方式对粗多糖组成及结构的影响有所差异,尤其是冷冻干制果肉所得多糖的分子质量明显低于其他多糖。同时,5 种粗多糖的抗氧化活性和免疫刺激活性也存在明显差异,综合比较,FDLP具有较强的自由基清除能力,而HDLP刺激巨噬细胞NO和TNF-α生成的能力更强。龙眼多糖在模拟唾液和胃液消化过程中发生不同程度消解,释放出以葡萄糖为主的少量还原糖。而不同方式干制可能导致其消化特性的改变,模拟唾液和胃液消化对IDLP的影响明显不同于其他多糖。干制工艺对龙眼果肉中活性多糖的理化和生化特性有一定影响,而多糖结构变化机制及相关构效关系有待于进一步探析。
[1] YANG B, JIANG Y, SHI J, et al. Extraction and pharmacological properties of bioactive compounds from longan (Dimocarpus longan Lour.) fruit: a review[J]. Food Research International, 2011, 44(7):1837-1842. DOI:10.1016/j.foodres.2010.10.019.
[2] ZHONG K, WANG Q, HE X, et al. Evaluation of radicals scavenging, immunity-modulatory and antitumor activities of longan polysaccharides with ultrasonic extraction on in S180 tumor mice models[J]. International Journal of Biological Macromolecules, 2010,47(3): 356-360. DOI:10.1016/j.ijbiomac.2010.05.022.
[3] 杨婧, 邓媛元, 张雁, 等. 不同温度热风预干燥对热风-真空冷冻联合干燥龙眼果干品质的影响[J]. 现代食品科技, 2019, 35(5): 175-183.DOI:10.13982/j.mfst.1673-9078.2019.5.025.
[4] 陈彦林. 不同干制方式龙眼果肉主要活性物质的比较[D]. 武汉: 华中农业大学, 2014: 7-8.
[5] TIPPAYAWONG N, TANTAKITTI C, THAVORNUN S. Energy efficiency improvements in longan drying practice[J]. Energy, 2008,33(7): 1137-1143. DOI:10.1016/j.energy.2008.02.007.
[6] NAGLE M, JUAN C G A, MAHAYOTHEE B, et al. Improved quality and energy performance of a fixed-bed longan dryer by thermodynamic modifications[J]. Journal of Food Engineering, 2010,99(3): 392-399. DOI:10.1016/j.jfoodeng.2010.03.006.
[7] NATHAKARANAKULE A, JAIBOON P, SOPONRONNARIT S.Far-infrared radiation assisted drying of longan fruit[J]. Journal of Food Engineering, 2010, 100(4): 662-668. DOI:10.1016/j.jfoodeng.2010.05.016.
[8] 田玉庭, 陈洁, 李淑婷, 等. 不同干燥方法对龙眼果肉品质特性的影响[J]. 西北农林科技大学学报(自然科学版), 2012, 40(8): 161-165.DOI:10.13207/j.cnki.jnwafu.2012.08.004.
[9] 徐玉娟, 邓彩玲, 林羡, 等. 龙眼高温热泵干制过程中主要活性成分变化研究[J]. 热带作物学报, 2014, 35(6): 1215-1220. DOI:10.3969/j.issn.1000-2561.2014.06.030.
[10] 石骏, 廖森泰, 张名位, 等. 干制加工对龙眼果肉多酚组成及抗氧化活性的影响[J]. 华南师范大学学报(自然科学版), 2011(4): 111-115.
[11] 郑少泉, 郑金贵. 龙眼多糖对S180肉瘤的抑制作用研究[J]. 营养学报, 2009, 31(6): 619-620. DOI:10.3321/j.issn:0512-7955.2009.06.025.
[12] YI Y, LIAO S T, ZHANG M W, et al. Immunomodulatory activity of polysaccharide-protein complex of longan (Dimocarpus longan Lour.) pulp[J]. Molecules, 2011, 16(12): 10324-10336. DOI:10.3390/molecules161210324.
[13] YI Y, WANG H, ZHANG R, et al. Characterization of polysaccharide from longan pulp as the macrophage stimulator[J]. RSC Advances,2015, 5(118): 97163-97170. DOI:10.1039/c5ra16044h.
[14] 韩苗苗, 姚娟, 易阳, 等. 龙眼果肉干燥过程中多糖的理化特征与活性变化规律[J]. 食品科学, 2017, 38(21): 67-73. DOI:10.7506/spkx1002-6630-201721011.
[15] YI Y, SUN J, WANG L M, et al. Comparison of physicochemical and immunomodulatory properties of polysaccharides from fresh and dried longan pulp products[J]. Modern Food Science and Technology, 2015,31(10): 53-62. DOI:10.13982/j.mfst.1673-9078.2015.10.010.
[16] YI Yang, HAN Miaomiao, HUANG Fei, et al. Effects of a lysineinvolved Maillard reaction on the structure and in vitro activities of polysaccharides from longan pulp[J]. Molecules, 2019, 24(5): 972.DOI:10.3390/molecules24050972.
[17] HAN M M, YI Y, WANG H X, et al. Investigation of the Maillard reaction between polysaccharides and proteins from longan pulp and the improvement in activities[J]. Molecules, 2017, 22(6): 938.DOI:10.3390/molecules22060938.
[18] HUANG Fei, GUO Yajuan, ZHANG Ruifen, et al. Effects of drying methods on physicochemical and immunomodulatory properties of polysaccharide-protein complexes from litchi pulp[J]. Molecules,2014, 19(8): 12760-12776. DOI:10.3390/molecules190812760.
[19] 郭亚娟. 不同干制方式对荔枝果干品质及其粗多糖理化特性的影响[D]. 武汉: 华中农业大学, 2013: 64-65. DOI:10.7666/d.Y2394020.
[20] WANG Y F, LIU Y Y, HUO J L, et al. Effect of different drying methods on chemical composition and bioactivity of tea polysaccharides[J].International Journal of Biological Macromolecules, 2013, 62: 714-719.DOI:10.1016/j.ijbiomac.2013.10.006.
[21] FAN L, LI J, DENG K, et al. Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J]. Carbohydrate Polymers, 2012, 87(2): 1849-1854.DOI:10.1016/j.carbpol.2011.10.018.
[22] MA L, CHEN H, ZHU W, et al. Effect of different drying methods on physicochemical properties and antioxidant activities of polysaccharides extracted from mushroom Inonotus obliquus[J]. Food Research International, 2013, 50(2): 633-640. DOI:10.1016/j.foodres.2011.05.005.
[23] ZHAO Q S, DONG B T, CHEN J J, et al. Effect of drying methods on physicochemical properties and antioxidant activities of wolfberry(Lycium barbarum) polysaccharide[J]. Carbohydrate Polymers, 2015,127: 176-181. DOI:10.1016/j.carbpol.2015.03.041.
[24] 肖维强, 蔡长河, 张爱玉, 等. 低温真空干燥焙制荔枝干、龙眼干的研究[J]. 食品科学, 2004, 25(8): 218-219. DOI:10.3321/j.issn:1002-6630.2004.08.052.
[25] 王文平, 郭祀远, 李琳, 等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学, 2007, 28(4): 276-279. DOI:10.3321/j.issn:1002-6630.2007.04.065.
[26] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中氨基酸的测定: GB5009.124—2016[S]. 北京:中国标准出版社, 2016.
[27] 刘恩超, 黄晓芸, 孙杰, 等. 莲藕多糖的单糖组成分析方法优化[J].食品科技, 2018, 43(6): 292-296. DOI:10.13684/j.cnki.spkj.2018.06.053.
[28] YI Yang, HUANG Xiaoyun, ZHONG Zhaotian, et al. Structural and biological properties of polysaccharides from lotus root[J].International Journal of Biological Macromolecules, 2019, 130: 454-461.DOI:10.1016/j.ijbiomac.2019.02.146.
[29] SAQIB A A N, WHITNEY P J. Differential behaviour of the dinitrosalicylic acid (DNS) reagent towards mono- and di-saccharide sugars[J]. Biomass and Bioenergy, 2011, 35(11): 4748-4750.DOI:10.1016/j.biombioe.2011.09.013.
[30] YAN Jingkun, WU Lixia, QIAO Zeru, et al. Effect of different drying methods on the product quality and bioactive polysaccharides of bitter gourd (Momordica charantia L.) slices[J]. Food Chemistry, 2019,271(15): 588-596. DOI:10.1016/j.foodchem.2018.08.012.
[31] CHEN Y, ZHANG H, WANG Y, et al. Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry,2014, 156: 279-288. DOI:10.1016/j.foodchem.2014.01.111.
[32] ZHANG X, QI C, GUO Y, et al. Toll-like receptor 4-related immunostimulatory polysaccharides: primary structure, activity relationships, and possible interaction models[J]. Carbohydrate Polymers, 2016, 149: 186-206. DOI:10.1016/j.carbpol.2016.04.097.
[33] LIU H, GONG F, WEI F, et al. Artificial simulation of salivary and gastrointestinal digestion, and fermentation by human fecal microbiota,of polysaccharides from Dendrobium aphyllum[J]. RSC Advances,2018, 8(25): 13954-13963. DOI:10.1039/C8RA01179F.
[34] ZHU Q Q, JIANG Y M, LIN S, et al. Structural identification of(1→6)-α-D-glucan, a key responsible for the health benefits of longan,and evaluation of anticancer activity[J]. Biomacromolecules, 2013,14(6): 1999-2003. DOI:10.1021/bm400349y.