大豆分离蛋白(soy protein isolate,SPI)具有良好的凝胶性,经常被添加到冷冻面、肉类制品中赋予产品良好的特性。冷冻食品经历冻融循环(freeze-thaw cycle,FTC)过程,形成的低密度冰晶在相变过程中体积膨胀,导致食品结构发生不可逆变化,改变食物的质地,产生收缩、析水、硬度增加等现象。冻融稳定性是许多凝胶食品在食用前需要保持的重要特性。王培森等[1]研究可得然胶对肌球蛋白冻融稳定性影响时发现,可得然胶的添加能够降低冻融时凝胶持水性和凝胶强度的变化程度。陈振家等[2]研究不同热处理SPI热诱导凝胶在冻藏时期凝胶特性变化,发现热处理会加速其凝胶品质冻藏劣变。
超声波处理过程中产生大量的空化气泡以及热、机械和化学效应。Madadlou等[3]研究高强度超声处理酪蛋白时发现,超声处理能够改变酸诱导酪蛋白凝胶形成的pH值,弹性也显著增加,且具有良好微观结构。Zisu等[4]研究发现超声增加了乳清蛋白热诱导凝胶强度,超声处理和热凝结乳制品的凝胶强度和持水性得到显著改善。Zhang Peipei等[5]研究经超声处理的肌纤维蛋白形成凝胶时,发现超声处理会增加凝胶的保水性。Cui Qiang等[6]研究发现超声处理大豆-乳清混合蛋白,其凝胶性得到改善。
目前,国内外研究主要通过蛋白改性来提高乳液冻融稳定性,但对提高蛋白凝胶冻融稳定性的相关报道较少。而采用超声与谷氨酰胺转氨酶(glutamine transaminase,TG)复合改性技术提高改性产物冻融稳定性的研究更鲜见报道。本实验以SPI为原料,采用超声改性SPI,然后通过TG交联形成凝胶,以粒径、表面疏水性分析以及内源性荧光光谱和傅里叶变换红外光谱等方法探究超声改性对SPI结构影响,以冻融循环过程中TG诱导的SPI凝胶的持水性、质构、微观结构及可溶性蛋白含量变化,研究超声处理的TG诱导SPI凝胶冻融稳定性,为冷冻食品专用SPI的产业化生产提供理论和技术指导。
1 材料与方法
1.1 材料与试剂
脱脂豆粕 山东禹王实业有限公司;TG 一鸣生物制品有限公司;其他试剂均为分析纯。
1.2 仪器与设备
超声波细胞破碎仪 宁波新芝生物科技股份有限公司;BCD-206L3CT型冰箱 合肥美菱股份有限公司;粒度分布仪 美国布鲁克海文仪器公司;F-4500荧光分光光度计 日本日立公司;FTIR-8400S型傅里叶变换红外光谱仪 日本岛津公司;TA-XT2i型质构仪 英国SMS公司;扫描电子显微镜 日立高新技术公司;LD4-2A型低速台式离心机 北京京立离心机有限公司。
1.3 方法
1.3.1 SPI的制备
参照Zhang Zeyu等[7]方法。脱脂豆粕粉碎过筛,以质量比1∶10溶于去离子水中,用2 mol/L NaOH溶液调pH值至8.5,室温搅拌2 h。然后4 000 r/min离心20 min,取上清液,用2 mol/L HCl溶液调pH值至4.5。4 000 r/min离心5 min,沉淀物即为SPI。水洗两次后复溶,用2 mol/L NaOH溶液中和至pH 7.0。冷冻干燥后,获得SPI粉末。
1.3.2 超声改性
将SPI溶于磷酸盐缓冲液(0.01 mol/L、pH 7.0),SPI质量浓度为40 mg/mL。加入叠氮钠,4 ℃水合过夜。超声处理参考Hu Hao等[8]的方法。将样品液分装至100 mL锥形瓶中,超声波处理器的钛探头浸入样品液中,距离瓶底约1 cm处,设置超声功率为360 W,以超声时间分别为0、10、20、30、40 min处理样品,备用。
1.3.3 粒径分布测定
用磷酸盐缓冲液(0.01 mol/L、pH 7.0)稀释样品液至蛋白质量浓度为1 mg/mL,颗粒折射率和分散剂折射率分别为1.460和1.330。
1.3.4 表面疏水性测定
用磷酸盐缓冲溶液(0.01 mol/L、pH 7.0)稀释成蛋白质量浓度分别为0.02、0.01、0.005、0.002 5 mg/mL的样品,8 mL样品中加入20 μL的8-苯氨基-1-萘磺酸(8 mmol/L,溶于0.01 mol/L的磷酸缓冲液,pH 7.0)荧光探针,混匀后,25 ℃避光15 min后测定荧光强度。设置激发和发射波长分别为390 nm和470 nm,狭缝5 nm[9]。测定荧光强度,对蛋白溶液质量浓度作图(y=0.135 1x+0.039 5,R2=0.999 1),线性良好,回归线斜率为蛋白质表面疏水性。
1.3.5 内源荧光光谱测定
将样品液用磷酸盐缓冲溶液(0.01 mol/L、pH 7.0)稀释至蛋白质量浓度为5 mg/mL,于激发波长347 nm、发射波长范围375~550 nm扫描[10]。样品液稀释至质量浓度为0.5 mg/mL,于激发波长290 nm、发射波长范围300~400 nm扫描。狭缝5.0 nm,扫描速率240 nm/min。
1.3.6 傅里叶变换红外光谱分析
将改性处理后的样品冷冻干燥,与KBr粉末混合研磨,将混合粉末压制成薄片,使用FTIR-8400型FTIR仪进行全波段扫描,设置分辨率为4 cm-1,扫描次数32 次,测量范围为4 000~400 cm-1[11]。
1.3.7 凝胶制备
将改性处理的样品配制成蛋白质量浓度为100 mg/mL的溶液,加入TG(TG和SPI质量比为3∶100)溶解,调pH值至7.0。将样品液分装至烧杯中,45 ℃水浴2 h后,90 ℃加热灭酶10 min。将制得的凝胶4 ℃下冷藏过夜。
1.3.8 冻融循环
将凝胶样品置于-20 ℃冷冻储存22 h后,25 ℃解冻2 h,随机选取出一批样品进行后续测定。如此为一次冻融循环(1 FTC),冻融循环共5 次。
1.3.9 持水性测定
参考Zhang Sha等[12]的方法,略加改动。 取一定凝胶置于离心管,记录凝胶质量m,离心管和凝胶总质量m1,4 000 r/min离心10 min后,小心除去离心管内水分,测离心管及凝胶质量m2。持水性按下式计算。
式中:m为凝胶质量/g;m1为离心管和凝胶离心前总质量/g;m2为离心管和凝胶离心后总质量/g。
1.3.10 质构特性测定
参考Jin等[13]的方法,略加改动。测定时使用P/0.5柱形探头为测定探头,探头下行速率为1 mm/s,检测速率和后撤速率均为 5 mm/s,触发力为5 g。
1.3.11 扫描电子显微镜观察
参考Aguirre-Mandujano等[14]的方法,将凝胶切成(2 mm×5 mm)小块,用体积分数为2.5%戊二醛溶液(pH 6.8)固定,4 ℃保存。用体积分数为50%、70%和90%的乙醇溶液分别脱水一次,无水乙醇脱水3 次,然后用混合液(无水乙醇与叔丁醇体积比1∶1)和纯叔丁醇各置换1 次,每次置换15 min。冷冻干燥后进行离子渐射镀金,于扫描电子显微镜(5 kV)下观察。
1.3.12 可溶性蛋白质量分数测定
参考Peng Xingyun等[15]的方法。将凝胶静置至室温,切取定量凝胶于磷酸盐缓冲液(0.01 mol/L、pH 7.0)研磨破碎,定容后磁力搅拌0.5 h,10 000 r/min离心30 min。取上清液,考马斯亮蓝法测定其可溶性蛋白质量分数。
1.4 数据处理与分析
所有实验重复3 次取平均值,采用SPSS 19.0软件进行数据处理和显著性分析(单因素方差分析,P<0.05表示差异显著),使用Origin 8.6软件作图,通过Peakfit 4.12软件计算蛋白二级结构。所有结果均以平均值±标准差表示。
2 结果与分析
2.1 粒径分析结果
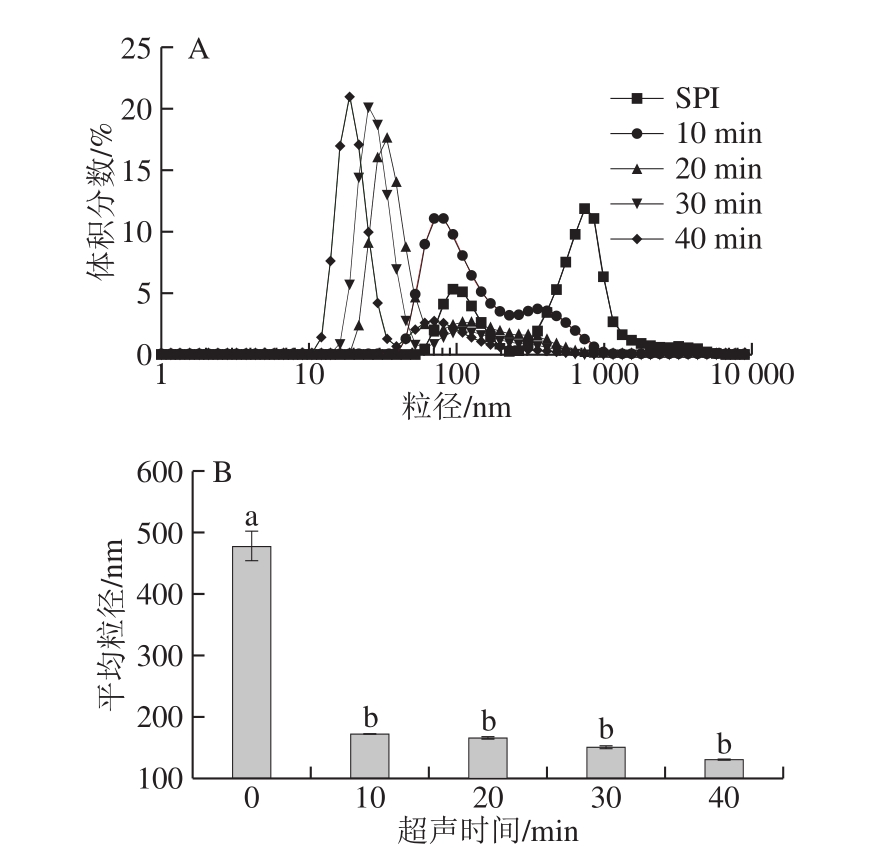
图1 超声时间对SPI蛋白溶液粒径的影响
Fig. 1 Particle size distribution of ultrasonic-treated SPI solutions
A.体积分布;B.平均粒径。组间不同小写字母表示差异显著(P<0.05),图2同。
超声处理后SPI粒度分布和粒径大小如图1所示,SPI样品双峰分布显著,随着超声时间延长,SPI粒径分布向更小且峰更窄的趋势发展,平均粒径随超声时间延长而降低。由图1B可知,与SPI相比,超声处理SPI溶液中蛋白质平均粒径显著降低,从489.2 nm降低至130.9 nm。王喜波等[16]研究超声处理SPI和乳清蛋白混合物时得到相似结论。其原因可能是超声处理产生的空化效应等,减弱了蛋白分子间的相互作用,减少蛋白聚集。
2.2 超声时间对SPI表面疏水性的影响

图2 超声时间对SPI表面疏水性的影响
Fig. 2 Effect of ultrasonication time on surface hydrophobicity of SPI
不同超声时间处理后SPI的表面疏水性变化如图2所示,未处理的SPI表面疏水性较低,经超声处理后,SPI的表面疏水性显著提高。Jiang Lianzhou等[17]研究高强度超声波处理对牛血清白蛋白功能和结构性质的影响时也得到类似结论。在一定超声时间范围内,SPI表面疏水性随着超声时间延长而增加,由5 013.9升至6 642.9。Hu Hao[18]和Sun Yanjun[19]等研究乳浓缩蛋白和SPI时也发现相似结果。这些结果表明超声处理改变蛋白三级结构,蛋白质分子发生去折叠和展开[3],蛋白分子变性,蛋白内部的疏水基团因超声处理而暴露[10],蛋白质表面疏水性增强。
2.3 内源荧光光谱分析结果

图3 不同蛋白样品的内源荧光光谱
Fig. 3 Fluorescence spectra of SPI ultrasonicated for different durations
在280 nm波长处,蛋白质的色氨酸和酪氨酸残基都将被激活,因此可以从荧光的波动确定蛋白质的三级结构的变化[20]。由图3可知,随着超声时间延长,SPI内源荧光强度降低,超声40 min时荧光强度最低。其原因可能是超声处理破坏蛋白质结构,疏水性氨基酸残基暴露,更多的生色团在溶剂中暴露,降低荧光强度。超声波处理后,SPI内源荧光的最大荧光强度λmax并未发生显著变化,表明色氨酸残基所在的微环境的极性没有变化[21]。Zhang Qiuting等[22]也得到相似的研究结果。
2.4 傅里叶变换红外光谱分析结果

图4 不同蛋白样品的傅里叶变换红外光谱图
Fig. 4 FTIR spectra of SPI ultrasonicated for different durations
图4 是SPI在4 000~400 cm-1范围内的傅里叶变换红外光谱图,利用PeakFit 4.12软件进行处理,通过去卷积计算可以得到蛋白质二级结构含量变化。酰胺I带中波长范围1 648~1 664 cm-1为α-螺旋结构,1 615~1 637 cm-1和1 682~1 700 cm-1为β-折叠结构,1 664~1 681 cm-1和1 637~1 648 cm-1分别为β-转角和无规卷曲结构[23]。从表1可以看出,超声SPI的二级结构较未处理发生变化,其α-螺旋结构相对含量减少,β-转角和无规卷曲结构相对含量增加,表明蛋白结构由有序向无序趋势发展。这可能是超声的空化效应破坏了刚性蛋白质结构,增加蛋白质分子柔性[24]。β-折叠相对含量能够反映蛋白质疏水作用力,β-折叠相对含量降低表明蛋白表面疏水基团暴露,疏水性增强[25],蛋白质在疏水作用力下聚集体被破坏。这与表面疏水性结果互相印证。
表1 不同蛋白样品二级结构相对含量
Table 1 Secondary structure composition of SPI ultrasonicated for different durations
%
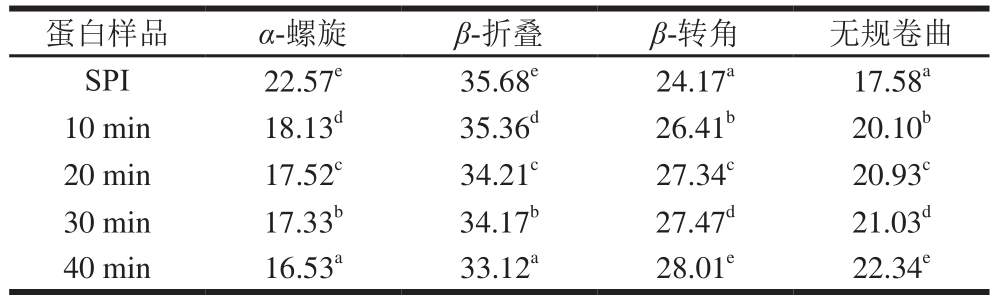
注:同列肩标小写字母不同表示差异显著(P<0.05)。
蛋白样品 α-螺旋 β-折叠 β-转角 无规卷曲SPI 22.57e 35.68e 24.17a 17.58a 10 min 18.13d 35.36d 26.41b 20.10b 20 min 17.52c 34.21c 27.34c 20.93c 30 min 17.33b 34.17b 27.47d 21.03d 40 min 16.53a 33.12a 28.01e 22.34e
2.5 超声时间对凝胶持水性的影响
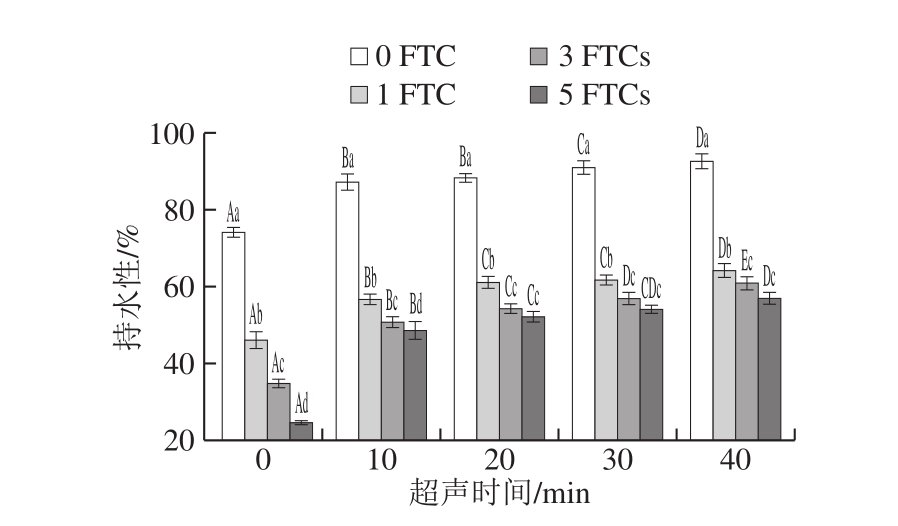
图5 超声时间对凝胶持水性的影响
Fig. 5 Effect of ultrasonication time on water-holding capacity of the gel
相同冻融循环、不同超声时间大写字母不同表示差异显著(P<0.05);相同超声时间、不同冻融循环小写字母不同表示差异显著(P<0.05)。图7、8同。
凝胶的持水性是凝胶品质评价重要指标之一,蛋白质凝胶的持水性取决于凝胶网络结合水的能力[26]。如图5所示,超声SPI凝胶的持水性显著高于SPI样品,且随超声时间的延长而增加,冻融循环0 次时,超声处理40 min,其凝胶的持水性最高为90.05%,较未超声处理凝胶增加了15.93%。超声处理改变蛋白结构,疏水基团暴露出来,TG交联形成二硫键,形成更加紧密且规则的三维网络结构,提高其凝胶性,凝胶持水性与蛋白质粒径和溶解度有关,提高溶解度和降低粒径都会提高凝胶持水性[27]。随着超声时间的延长,蛋白粒径降低和溶解度增加,都促使TG交联形成紧密、均一的凝胶结构,促进水在凝胶网络结构中聚集,增加凝胶持水性。Han Minyi等[28]发现凝胶持水性增加,其凝胶硬度和弹性等凝胶性也会增加,这也与本实验的凝胶硬度和弹性结果一致。
相同超声时间下,随着冻融循环次数的增加,凝胶的持水性随之降低。肖旭华[29]研究肌球蛋白凝胶冻融特性时,也得到相似结论。低温导致游离水和结合水冻结,形成低密度冰晶,反复冻结和解冻降低了晶体的总数,平均晶体尺寸增加,导致凝胶内部孔径随之增加,增大了水分在凝胶中流动空间[30],从而造成持水性的降低。SPI凝胶持水下降程度最大,降低了49.23%。超声40 min时,超声SPI凝胶冻融循环5 次时持水性较冻融循环0 次时降低了38.59%,由此可见超声处理SPI能提高凝胶的冻融稳定性。这可能与超声处理改变蛋白的分子结构有关,超声产生的空穴现象降低SPI粒径,有助于蛋白发生水合,提高蛋白-水分子间相互作用,增强对水分子的束缚作用,有助于形成更加紧密的网络结构[30]。此外,研究表明,TG通过催化肽结合的谷氨酰胺残基与赖氨酸残基的ε-氨基发生酰基转移,形成更强的ε-赖氨酸异肽键作用力,减小冰晶对凝胶网络的破坏[31],从而提高冻融过程中的持水性。
2.6 超声时间对凝胶微观结构的影响

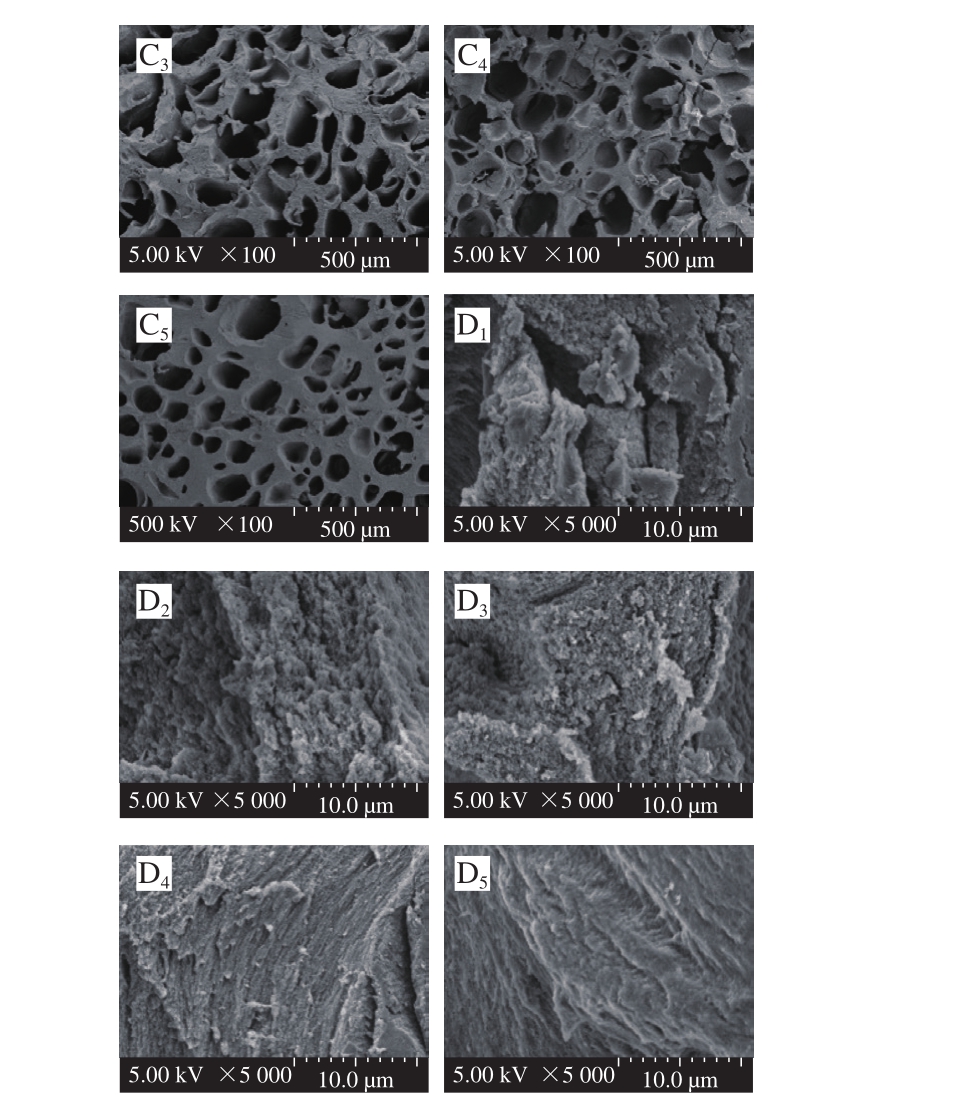
图6 不同样品凝胶冻融前后的扫描电子显微镜图
Fig. 6 Scanning electron microscope images of native and ultrasonictreated gel samples with different freeze-thaw cycles
A. 0 FTCs(×100);B. 0 FTCs(×5 000);C. 5 FTCs(×100);D. 5 FTCs(×5 000)。下标1~5.分别表示SPI和超声处理10、20、30、40 min SPI。
扫描电子显微镜可以更加直观地观察不同超声处理条件下TG诱导SPI凝胶在冻融循环过程中微观结构的三维网络。图6显示了超声处理前后SPI凝胶冻融循环0 次和5 次在100 倍和5 000 倍放大倍数下凝胶的微观结构图。从图6中可见,冻融循环0 次时,未超声的样品形成了表面粗糙、松散、孔洞较大的网络结构,超声后SPI凝胶组织形成了表面光滑、紧凑、均匀的孔隙小的网状结构。这种现象的产生可能是由于超声的空化现象显著降低蛋白粒径,增加了暴露于蛋白表面的活性基团,促进TG交联反应形成更加均匀致密的凝胶结构[32]。
冻融循环5 次后,凝胶的微观结构存在显著变化,呈明显的蜂窝状结构。Charoenrein等[33]观察冻融过程中淀粉凝胶微观结构变化,也发现冻融后淀粉凝胶网络变成海绵状结构。冷冻形成冰晶使凝胶整体平均孔径变大,凝胶网络结构形成具有冰晶嵌入的蜂窝状结构[33]。温度的升高引起冰晶融化,凝胶和水发生相分离,形成析水孔道,引起脱水缩和[34],导致凝胶呈现蜂窝状结构。这也解释了凝胶持水性随冻融次数增加而降低这一变化趋势。SPI凝胶网状结构较不规则,体现了较差的冻融稳定性。超声SPI凝胶表面光滑平整,基质紧密。冻融循环引起的脱水缩合作用破坏了凝胶网络结构,同时也会造成凝胶体系蛋白质的浓缩,在高放大倍数(×5 000)观察到凝胶纤维状结构。超声作用减小SPI粒径,有助于形成更加紧密的网络结构,超声的机械效应引起蛋白分子结构展开,促使形成键能更强的ε-赖氨酸异肽键,减弱冻结形成的冰晶对凝胶网络结构的破坏作用,从而降低冻融过程对凝胶的破坏作用。
2.7 超声时间对凝胶质构的影响

图7 超声时间对凝胶质构的影响
Fig. 7 Effect of ultrasonication time on texture of the gel
A.硬度;B.弹性。
凝胶硬度和弹性受凝胶网络形成的影响。如图7所示,在超声处理条件下,SPI凝胶的硬度和弹性均随处理时间的延长呈现增加趋势。超声40 min时,凝胶硬度和弹性达到最大,冻融循环0 次,其凝胶硬度和弹性分别为522.94 g和0.96 mm,分别是SPI的1.78 倍和1.14 倍,表明超声处理能改善TG诱导SPI凝胶的硬度和弹性。超声产生的空穴作用和微束流作用可以促进疏水基团的暴露,随着处理时间的延长,蛋白质变性,更多的疏水基团暴露,蛋白分子间的交联度提高,所形成的凝胶网络更加精细,促使凝胶硬度和弹性增加。Zhao等[35]也得到相似结论。
随着冻融循环次数的增加,所有样品凝胶的硬度和弹性也随之增加。Fuchigami等[36]研究高压冷冻豆腐发现豆腐在冷冻后硬度和弹性都会增加。冷冻使水分形成冰晶,引起蛋白浓缩的同时也会破坏凝胶结构,形成蜂窝状空洞型结构,而且蛋白质-蛋白质相互作用取代蛋白质-水作用,从而增大凝胶硬度和弹性[34]。冻融循环5 次后,SPI凝胶硬度和弹性较冻融循环0 次时分别增加了1 186.23 g和0.36 mm,超声40 min的凝胶样品经冻融循环5 次其凝胶硬度和弹性较冻融循环0 次时分别增加了510.23 g和0.07 mm,超声的SPI凝胶的硬度和弹性在冻融过程中变化程度小于SPI凝胶。说明超声处理能够减缓冻融过程中SPI凝胶劣变程度。
2.8 超声时间对凝胶可溶性蛋白质量分数的影响
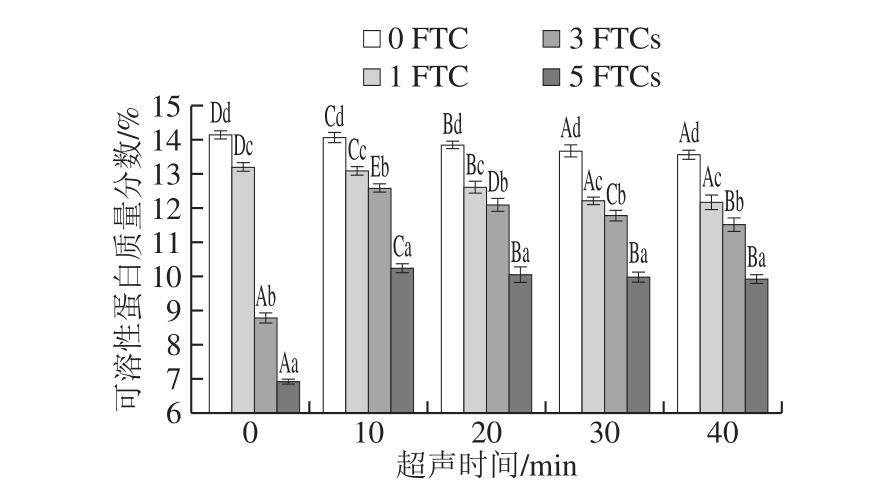
图8 超声时间对凝胶可溶性蛋白质量分数的影响
Fig. 8 Effect of ultrasonication time on soluble protein content of the gel
从图8可以看出,冻融循环0 次时,SPI凝胶的可溶性蛋白质量分数最高,为14.14%,超声处理后,凝胶的可溶性蛋白质量分数显著降低(P<0.05),且随超声时间的延长而降低,超声处理40 min时,凝胶可溶性蛋白质量分数达到最低,为13.56%。超声处理导致蛋白质的展开、肽键的破坏和亲水氨基酸残基在蛋白质内部的暴露,增加蛋白溶解度[37],有利于形成更加均匀致密的网络,这种网络结构的形成需要大量蛋白参与,因此可溶性蛋白含量降低。
冻融循环5 次后,SPI可溶性蛋白质量分数较冻融循环0 次显著降低(P<0.05),减少了7.23%。冷冻引起蛋白变性,发生聚集和肽链展开,导致凝胶结构进一步重排,可溶蛋白通过蛋白间相互作用结合到原有网络结构,使凝胶的网络结构变得粗糙,从而引起凝胶在冻藏过程中品质的劣变[2]。超声时间为40 min时,凝胶可溶性蛋白质量分数达到最低,为9.91%,较冻融循环0 次减少了3.65%,表明超声处理能改善TG诱导的SPI凝胶冻融稳定性。
3 结 论
随着冻融循环次数的增加,凝胶的持水性和可溶性蛋白质量分数都呈下降趋势,硬度随之而增加。扫描电子显微镜观察凝胶微观结构发现,冻融循环5 次后的凝胶孔洞大,蛋白基质松散,呈明显的蜂窝状结构。说明冻融导致凝胶劣变,冻融稳定性降低。
通过粒径、表面疏水性、内源荧光光谱分析和傅里叶变换红外光谱分析证明了超声处理导致SPI分子结构发生变化。超声处理能够提高SPI凝胶的持水性、硬度和弹性,且凝胶微观结构更加均匀致密。冻融循环过程中,超声SPI凝胶持水性、硬度、弹性和可溶性蛋白质量分数变化幅度明显小于SPI凝胶,表明超声处理能够提高凝胶冻融稳定性。
杜昱蒙等[38]研究湿热法制备SPI-葡萄糖糖基化产物热致凝胶的抗冻性,发现当葡萄糖与SPI质量比为1∶2、蛋白含量为40 mg/g、反应时间1.5 h时进行糖基化反应,其凝胶抗冻性最好。与其相比,本实验不需要添加糖,缩短了改性时间,提高效率、节省能源、降低成本。
[1] 王培森, 李倩如, 江文韬, 等. 可得然胶对肌球蛋白凝胶冻融稳定性的影响[J]. 食品与机械, 2017, 33(5): 30-34; 53. DOI:10.13652/j.issn.1003-5788.2017.05.006.
[2] 陈振家, 施小迪, 杜昱蒙, 等. 不同热处理大豆分离蛋白凝胶冻藏特性[J]. 农业工程学报, 2016, 32(11): 283-289. DOI:10.11975/j.issn.1002-6819.2016.11.040.
[3] MADADLOU A, EMAM-DJOMEH Z, MOUSAVI M E, et al.Acid-induced gelation behavior of sonicated casein solutions[J].Ultrasonics Sonochemistry, 2009, 17(1): 153-158. DOI:10.1016/j.ultsonch.2009.06.009.
[4] ZISU B, BHASKARACHARYA R, KENTISH S, et al.Ultrasonic processing of dairy systems in large scale reactors[J].Ultrasonics Sonochemistry, 2010, 17(6): 1075-1081. DOI:10.1016/j.ultsonch.2009.10.014.
[5] ZHANG Peipei, HU Tan, FENG Shaolong, et al. Effect of high intensity ultrasound on transglutaminase-catalyzed soy protein isolate cold set gel[J]. Ultrasonics Sonochemistry, 2016, 29: 380-387.DOI:10.1016/j.ultsonch.2015.10.014.
[6] CUI Qiang, WANG Xibo, WANG Guorong, et al. Effects of ultrasonic treatment on the gel properties of microbial transglutaminase crosslinked soy, whey and soy-whey proteins[J]. Food Science and Biotechnology,2019, 28: 1455-1464. DOI:10.1007/s10068-019-00583-y.
[7] ZHANG Zeyu, WANG Xibo, YU Jie, et al. Freeze-thaw stability of oil-in-water emulsions stabilized by soy protein isolate-dextran conjugates[J]. LWT-Food Science and Technology, 2017, 78: 241-249.DOI:10.1016/j.lwt.2016.12.051.
[8] HU Hao, WU Jiahui, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy; protein isolate(SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.DOI:10.1016/j.foodhyd.2012.08.001.
[9] 王健, 徐晔晔, 于洁, 等. 不同热处理大豆蛋白柔性与结构的关系[J].食品科学, 2018, 39(7): 85-90. DOI:10.7506/spkx1002-6630-201807013.
[10] YE Y X, GUO R W, XI B W, et al. Effects of homogenization on the molecular flexibility and emulsifying properties of soy protein isolate[J]. Food Science and Biotechnology, 2018, 27(5): 1293-1299.DOI:10.1007/s10068-018-0361-x.
[11] YU J, WANG G, WANG X, et al. Improving the freeze-thaw stability of soy protein emulsions via combing limited hydrolysis and Maillardinduced glycation[J]. LWT-Food Science and Technology, 2018, 91:63-69. DOI:10.1016/j.lwt.2018.01.031.
[12] ZHANG Sha, HSIEH F H, VARDHANABHUTI B. Acid-induced gelation properties of heated whey protein-pectin soluble complex(Part I): effect of initial pH[J]. Food Hydrocolloids, 2014, 36: 76-84.DOI:10.1016/j.foodhyd.2013.07.029.
[13] JIN I H, KIM J E, SEO J H, et al. Physicochemical properties of soy protein isolate gels emulsified with various oils using a microbial transglutaminase[J]. Food Science and Biotechnology, 2013, 22(Suppl 1):129-136. DOI:10.1007/s10068-013-0058-0.
[14] AGUIRRE-MANDUJANO E, LOBATO-CALLEROS C, BERISTAIN C I, et al. Microstructure and viscoelastic properties of low-fat yoghurt structured by monoglyceride gels[J]. LWT-Food Science and Technology, 2009, 42(5): 938-944. DOI:10.1016/j.lwt.2008.12.002.
[15] PENG Xingyun, GUO Shuntang. Texture characteristics of soymilk gels formed by lactic fermentation: a comparison of soymilk prepared by blanching soybeans under different temperatures[J]. Food Hydrocolloids, 2015, 43: 58-65. DOI:10.1016/j.foodhyd.2014.04.034.
[16] 王喜波, 崔强, 张安琪, 等. 超声处理改善不同比例大豆-乳清混合蛋白理化性质[J]. 农业工程学报, 2018, 34(22): 299-305.DOI:10.11975/j.issn.1002-6819.2018.22.037.
[17] JIANG Lianzhou, WANG Jing, LI Yang, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International, 2014, 62: 595-601. DOI:10.1016/j.foodres.2014.04.022.
[18] HU Hao, LI-CHAN E C Y, WAN Li, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2):303-311. DOI:10.1016/j.foodhyd.2013.01.016.
[19] SUN Yanjun, CHEN Jianhang, ZHANG Shuwen, et al. Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J]. Journal of Food Engineering, 2014, 124: 11-18. DOI:10.1016/j.jfoodeng.2013.09.013.
[20] SHEN L, TANG C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118. DOI:10.1016/j.foodres.2012.03.006.
[21] HAO G, LING M, TIAN Q L, et al. Impact of ultrasonic power on the structure and emulsifying properties of whey protein isolate under various pH conditions[J]. Process Biochemistry, 2019, 81: 113-122.DOI:10.1016/j.procbio.2019.03.012.
[22] ZHANG Qiuting, TU Zongcai, XIAO Hui, et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014,92(1): 30-37. DOI:10.1016/j.fbp.2013.07.006.
[23] ZHAO X, CHEN F, XUE W, et al. FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J]. Food Hydrocolloids, 2008,22(4): 568-575. DOI:10.1016/j.foodhyd.2007.01.019.
[24] 丁俭, 李杨, 史博瑞, 等. 超声改性大豆分离蛋白与大豆可溶性多糖复合乳化体系的冻融稳定性研究[J]. 食品科学, 2018, 39(9): 88-94.DOI:10.7506/spkx1002-6630-201809014.
[25] WANG Z J, LI Y, JIANG L Z, et al. Relationship between secondary structure and surface hydrophobicity of soybean protein isolate subjected to heat treatment[J]. Journal of Chemistry, 2014, 10(5): 1-10.DOI:10.1155/2014/475389.
[26] 贾丹, 刘茹, 刘明菲, 等. 转谷氨酰胺酶对鳙鱼糜热诱导胶凝特性的影响[J]. 食品科学, 2013, 34(9): 37-41. DOI:10.7506/spkx1002-6630-201309009.
[27] WU W, HUA Y, LIN Q, et al. Effects of oxidative modification on thermal aggregation and gel properties of soy protein by peroxyl radicals[J]. International Journal of Food Science and Technology,2011, 46(9): 1891-1897. DOI:10.1111/j.1365-2621.2011.02698.x.
[28] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[29] 肖旭华. 米渣及米渣蛋白对鲢鱼糜凝胶特性和冻融稳定性的影响[D].武汉: 华中农业大学, 2014: 1.
[30] 谢亚如, 刘庆, 熊善柏, 等. 高强度超声作用下鲢鱼肌球蛋白的结构及流变学特性变化[J]. 食品科学, 2019, 40(5): 77-84. DOI:10.7506/spkx1002-6630-20180205-064.
[31] DING X, ZHANG H, WANG L, et al. Effect of barley antifreeze protein on thermal properties and water state of dough during freezing and freeze-thaw cycles[J]. Food Hydrocolloids, 2015, 47: 32-40.DOI:10.1016/j.foodhyd.2014.12.025.
[32] POWRIE O R, MARTH W D. Low-temperature preservation of foods and living matter[M]. New York: Marcel Dekker Inc, 1973: 320-331.DOI:10.1016/S1010-7940(98)00228-0.
[33] CHAROENREIN S, TATIRAT O, MUADKLAY J. Use of centrifugation-filtration for determination of syneresis in freezethaw starch gels[J]. Carbohydrate Polymers, 2008, 73(1): 143-147.DOI:10.1016/j.carbpol.2007.11.012.
[34] XU Y, TAO Y, SHIVKUMAR S. Effect of freeze-thaw treatment on the structure and texture of soft and firm tofu[J]. Journal of Food Engineering,2016, 190: 116-122. DOI:10.1016/j.jfoodeng.2016.06.022.
[35] ZHAO L, ZHANG S, ULUKO H, et al. Effect of ultrasound pretreatment on rennet-induced coagulation properties of goat’s milk[J]. Food Chemistry, 2014, 165: 167-174. DOI:10.1016/j.foodchem.2014.05.081.
[36] FUCHIGAMI M, TERAMOTO A. Texture and cryo-scanning electron micrographs of pressure-shift-frozen tofu[J]. Progress in Biotechnology,1996, 13(6): 411-414. DOI:10.1016/S0921-0423(06)80070-5.
[37] ZHANG Q T, TU Z C, XIAO H, et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92(1): 30-37.DOI:10.1016/j.fbp.2013.07.006.
[38] 杜昱蒙, 陈振家, 施小迪, 等. 葡萄糖糖基化大豆分离蛋白的凝胶抗冻性研究[J]. 中国粮油学报, 2016, 31(10): 45-49; 55. DOI:10.3969/j.issn.1003-0174.2016.10.008.