当今社会,随着人口的增长和人均寿命的延长,老龄化已成为一个亟待解决的全球性问题。衰老是一种渐进的生理功能障碍过程,涉及多个组织和器官[1]。活性氧(reactive oxygen species,ROS)诱导的氧化损伤被认为是导致衰老的主要原因之一[2]。研究表明,叶瓜参多肽可以延长果蝇寿命,提高衰老小鼠体内抗氧化酶系活力、抑制脂质过氧化[3];姬松茸多肽组分能提高衰老小鼠血清过氧化氢酶活力,下调血清ROS含量及丙二醛(malondialdehyde,MDA)水平[4]。从膳食中筛选富肽功能性因子用于抗衰老食品研制已经成为研究趋势。
辣木(Moringa oleifera)是辣木科、辣木属的多年生木本植物,分布广泛且资源量十分丰富[5]。辣木叶和辣木籽蛋白质含量丰富(质量分数分别为25.0%~30.3%、29.4%~38.3%)[6-7],研究发现,辣木叶蛋白和辣木籽蛋白中必需氨基酸间的比例与人体所需较为接近,必需氨基酸占氨基酸总量的比例高于世界卫生组织/联合国粮食及农业组织推荐值[8-9],是优质的植物蛋白资源。但有报道指出,辣木叶中抗营养因子会影响辣木叶蛋白质的吸收和利用[10-11],所以将辣木叶蛋白质水解为利于人体消化吸收的多肽就显得尤为必要。目前对辣木籽的研究主要集中在辣木籽油[12-13]、辣木籽多酚[14]的提取分离技术方面,但对辣木籽多肽的研究则相对较少。本团队前期研究发现,以抗氧化活性为导向定向制备的辣木叶、辣木籽多肽组分经模拟胃肠道消化后,生成了抗氧化活性更强的小分子肽[15-16],表明辣木源多肽组分可作为潜在的膳食干预剂用于功能性食品加工,但其在动物体内拮抗氧化应激作用还未得到证实。
本实验采用酶法、乙醇分级沉淀法制备辣木叶多肽组分(MOL-P)、辣木籽多肽组分(MOS-P),构建D-半乳糖致衰小鼠模型,考察MOL-P和MOS-P在高、低两个剂量下连续灌胃小鼠8 周,对衰老小鼠体质量,肝脏和脑的脏器系数,血清、肝脏和脑的抗氧化酶活力以及MDA水平的影响,并采用苏木精-伊红(hematoxylineosin,HE)染色观察MOL-P和MOS-P对氧化损伤小鼠肝脏的保护作用。本研究对于以辣木源多肽为核心的功能性因子的抗衰老食品的研制具有理论和方法的参考意义,同时对促进我国辣木精深加工产业的健康发展具有一定的科学价值和意义。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明小鼠,购于广东省实验动物中心,使用许可证号:SYXK(粤)2011-0112。
辣木叶、辣木籽 广东华谷辣木生物科技有限公司;NS37071蛋白酶 丹麦诺维信公司;总蛋白定量测定试剂盒(二喹啉甲酸法)、MDA、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒 南京建成生物工程研究所。其他试剂均为分析纯,购于富宇化学有限公司。
1.2 仪器与设备
Sorvall ST16R高速冷冻离心机、Varioskan Flash全波长扫描多功能读数仪 美国Thermo Scientific公司;Alpha 1-4 LD冷冻干燥机 德国Christ公司;UV-754N紫外-可见分光光度计 上海佑科仪器仪表有限公司;T10 Basic ULTRA TURRAX高速分散机 德国IKA公司。
1.3 方法
1.3.1 辣木源多肽组分的制备
参考本团队前期采用酶法、乙醇分级沉淀法制备辣木叶多肽组分与辣木籽多肽组分的方法[15-16]。
1.3.2 动物分组及处理
将健康的昆明小鼠随机分成6 组:正常组、模型组、MOL-P低剂量组、MOL-P高剂量组、MOS-P低剂量组和MOS-P高剂量组,每组12 只。于每日上午9点,除正常组外其余各组颈背部皮下注射D-半乳糖100 mg/(kg mb·d);辣木源多肽剂低、高剂量组的灌胃量分别为200 mg/(kg mb·d)和500 mg/(kg mb·d),正常组颈背部皮下注射和灌胃给予等量的生理盐水。每天进行注射及灌胃样品,持续8 周。
1.3.3 检测样品的采集
最后一次灌胃后,小鼠禁食12 h,自由饮水。第二天摘眼球取血(血液取出后室温静置2 h使其凝固,然后在4 ℃、2 000×g条件下离心10 min,取上清液,即为血清),断颈处死后,于冰上摘取小鼠肝脏和脑组织,并剔去周围结缔组织。
1.3.4 脏器系数的测定
肝脏和脑组织于4 ℃生理盐水中洗去附着血液,用滤纸吸干水分,称质量,按下式计算脏器系数。
1.3.5 生化指标的测定
按照试剂盒说明书的要求制备肝脏和脑组织匀浆液,测定血清、肝脏和脑组织的SOD、GSH-Px活力及MDA水平。
1.3.6 肝脏组织切片HE染色
取小鼠肝脏组织,于组织固定液中固定,制片过程由南京建成生物工程研究所完成。
1.4 数据统计分析
所有数据均使用平均值±标准偏差的形式表示,由Microsoft Excel 2016软件处理完成;使用SPSS 24.0软件进行数据显著性分析,P<0.05为组间差异有统计学意义。
2 结果与分析
2.1 辣木源多肽组分对D-半乳糖致衰小鼠体质量的影响
通过连续注射一定剂量的D-半乳糖来模拟自然衰老过程是目前研究氧化应激所致衰老最常用的方法[17]。在众多关于衰老机制的学说中,自由基学说是被接受度最高的一种,其认为氧化应激会导致ROS水平增加,而后者在机体衰老的过程中起重要作用[18]。持续注射D-半乳糖后,其在细胞内被催化成不可降解的半乳糖醇,后者在细胞中累积并诱导产生ROS[19]。
如图1所示,相比于正常组,小鼠在注射D-半乳糖后出现体质量减轻的情况,尤其以模型组小鼠体质量最低;研究表明,在D-半乳糖致衰小鼠模型中,模型组小鼠的体质量明显低于正常组[20-22],这与本实验结果相符。与模型组相比,高、低剂量辣木源多肽组分均能在一定程度上改善小鼠体质量下降的情况,其中效果最显著的是高剂量MOL-P,从第6周开始,该组小鼠体质量已恢复至正常组水平。辣木源多肽组分没有毒副作用,且可作为改善D-半乳糖致衰小鼠氧化损伤潜在的膳食干预剂。

图1 辣木源多肽组分对D-半乳糖致衰小鼠体质量的影响
Fig. 1 Effects of MOL-P and MOS-P on body mass of D-galactose-induced aging mice
2.2 辣木源多肽组分对D-半乳糖致衰小鼠脏器系数的影响
脏器系数能够反映器官或组织结构的变化,从而可以间接地反映器官或组织功能的变化[20]。研究表明,线粒体通过电子传递链产生ATP,这个过程是ROS的重要来源,而肝脏是新陈代谢的重要场所,线粒体含量丰富,是最易受ROS攻击的器官[23];脑组织氧消耗最高,富含多聚不饱和脂肪酸而抗氧化酶活性较低,易受氧自由基的攻击[24]。
表1 辣木源多肽组分对D-半乳糖致衰小鼠脏器系数的影响
Table 1 Effects of MOL-P and MOS-P on organ indices of D-galactose-induced aging mice

注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
组别 脏器系数/(mg/g)肝脏 脑正常组 35.17±0.99a 7.40±0.35a模型组 31.67±0.76b 6.82±0.26b MOL-P低剂量组 31.44±1.12b 7.79±0.18a MOL-P高剂量组 32.50±1.03b 7.59±0.71a MOS-P低剂量组 32.11±1.09b 7.90±0.50a MOS-P高剂量组 31.89±1.24b 7.66±0.15a
如表1所示,模型组的肝脏系数和脑系数均显著低于正常组(P<0.05),可以推断模型组在注射D-半乳糖后,其肝脏和脑组织已受到一定程度的氧化损伤。与模型组相比,高、低剂量辣木源多肽组分对小鼠肝脏系数的提升作用均不显著(P>0.05);而高、低剂量辣木源多肽组分均能显著提高小鼠脑系数(P<0.05);辣木源多肽组分各剂量组小鼠脑系数与正常组无显著性差异(P>0.05),表明辣木源多肽组分可显著改善小鼠脑组织氧化损伤,起到延缓衰老的作用。
2.3 辣木源多肽组分对D-半乳糖致衰小鼠血清、肝脏GSH-Px活力的影响
GSH-Px是机体抗氧化系统中的一种重要的酶[25],其主要生物学作用是保护细胞免受超氧化物毒害,在机体内H2O2的分解和内源性过氧化物的代谢中起关键作用[26]。
表2 辣木源多肽组分对D-半乳糖致衰小鼠血清、肝脏GSH-Px活力的影响
Table 2 Effects of MOL-P and MOS-P on GSH-Px activities in serum and liver of D-galactose-induced aging mice

肝脏GSH-Px活力/(U/mg)正常组 210.86±10.20b 546.45±48.07a模型组 169.31±8.68c 444.73±43.25b MOL-P低剂量组 229.92±8.59a 478.71±61.39b MOL-P高剂量组 213.62±7.80b 383.46±44.28b MOS-P低剂量组 222.29±11.23ab 481.44±31.28b MOS-P高剂量组 231.90±12.38a 489.59±31.24b组别 血清GSH-Px活力/(U/mL)
由表2可知,模型组血清和肝脏GSH-Px活力显著低于正常组(P<0.05),研究表明,持续注射D-半乳糖会诱发一系列氧化还原变化,包括GSH-Px活力的降低[27],这与本实验结果相符。对于小鼠血清GSH-Px活力:与模型组相比,辣木源多肽组分各剂量组均能显著提高衰老小鼠血清GSH-Px活力(P<0.05),其中MOL-P低剂量组和MOS-P高剂量组的血清GSH-Px活力较模型组分别提高了35.80%和36.97%;值得注意的是,MOL-P低剂量组和MOS-P高剂量组的血清GSH-Px活力均显著高于正常组(P<0.05),MOL-P高剂量组的血清GSH-Px活力也达到了正常组水平(P>0.05),这表明辣木源多肽组分能有效提高衰老小鼠血清GSH-Px活力,提高血清抗氧化水平。研究表明,叶瓜参多肽能显著提升小鼠血清GSH-Px活力,较模型组提高了32.32%[3];Sun Yangying等[28]研究发现,鸡胸肉蛋白水解物能够提高衰老大鼠血清GSH-Px活力,较模型组提高了30.89%,这表明低剂量MOL-P和高剂量MOS-P在提高小鼠血清抗氧化性方面优势明显,即辣木源多肽组分能有效维护机体抗氧化防御系统,是良好的膳食干预剂,可用于抗衰老食品的研制。对于小鼠肝脏GSH-Px活力:MOL-P低剂量组、MOS-P低剂量组和MOS-P高剂量组肝脏GSH-Px活力高于模型组,但无显著性差异(P>0.05),表明辣木源多肽组分在提高衰老小鼠肝脏GSH-Px活力方面效果不明显。此外,依据试剂盒说明书要求,本研究未能检出小鼠脑组织GSH-Px活力。
2.4 辣木源多肽组分对D-半乳糖致衰小鼠血清、肝脏和脑组织SOD活力的影响
在机体内,SOD能够清除超氧阴离子自由基,避免其对细胞造成损伤,在拮抗氧化应激中起着十分重要的作用[29]。根据表3可知,模型组血清、脑SOD活力虽低于正常组,但是差异不显著(P>0.05),同时辣木源多肽组分各剂量组与模型组相比,血清、脑SOD活力差异同样不显著(P>0.05),故推测,辣木源多肽组分对小鼠血清和脑组织SOD活力的调控作用效果不明显。对于肝脏SOD活力:与模型组相比,辣木源多肽组分能显著提高衰老小鼠肝脏SOD活力(P<0.05),其中MOL-P高、低剂量组肝脏SOD活力较模型组分别提高了12.53%和21.47%,而MOS-P高、低剂量组则较模型组分别提高了26.08%和34.20%;此外MOL-P低剂量组、MOS-P低剂量组和MOS-P高剂量组肝脏SOD活力显著高于正常组(P<0.05),MOL-P高剂量组肝脏SOD活力达到正常组水平(P>0.05)。Sun Yangying等[28]研究了鸡胸肉蛋白水解物在D-半乳糖致衰小鼠体内的抗氧化功效,该样品组肝脏SOD活力较模型组提高了12.88%;此外还有研究表明,叶瓜参多肽高剂量组能显著提高衰老小鼠肝脏SOD活力,较模型组提高了26.80%[3]。研究结果再次验证了辣木源多肽组分对机体抗氧化防御系统的维护作用,尤其是MOS-P。
表3 辣木源多肽组分对D-半乳糖致衰小鼠血清、肝脏和脑SOD活力的影响
Table 3 Effects of MOL-P and MOS-P on SOD activity in serum, liver and brain of D-galactose-induced aging mice

脑SOD活力/(U/mg)正常组 115.69±6.11a 221.60±13.32c 61.59±6.96a模型组 112.58±9.30a 199.93±8.87d 60.95±8.86a MOL-P低剂量组 121.10±10.79a 242.86±16.82b 64.73±11.87a MOL-P高剂量组 119.57±13.63a 224.99±10.68c 56.02±7.26a MOS-P低剂量组 112.89±9.45a 268.30±12.71a 63.19±7.13a MOS-P高剂量组 110.89±10.85a 252.08±14.40ab 59.42±5.97a组别 血清SOD活力/(U/mL)肝脏SOD活力/(U/mg)
2.5 辣木源多肽组分对D-半乳糖致衰小鼠血清、肝脏和脑组织MDA水平的影响
MDA是由自由基诱导的脂质过氧化作用生成的内源性基因毒性产物,被认为是衡量体内氧化应激水平的重要指标[15]。在氧化应激的众多生物学靶标中,脂质是占比最大的一类,脂质过氧化产生许多醛类物质,其中MDA是最重要的一类醛类衍生物,被广泛用作氧化应激的生物标志[27]。
表4 辣木源多肽组分对D-半乳糖致衰小鼠血清、肝脏和脑MDA水平的影响
Table 4 Effects of MOL-P and MOS-P on MDA levels in serum, liver and brain of D-galactose-induced aging mice
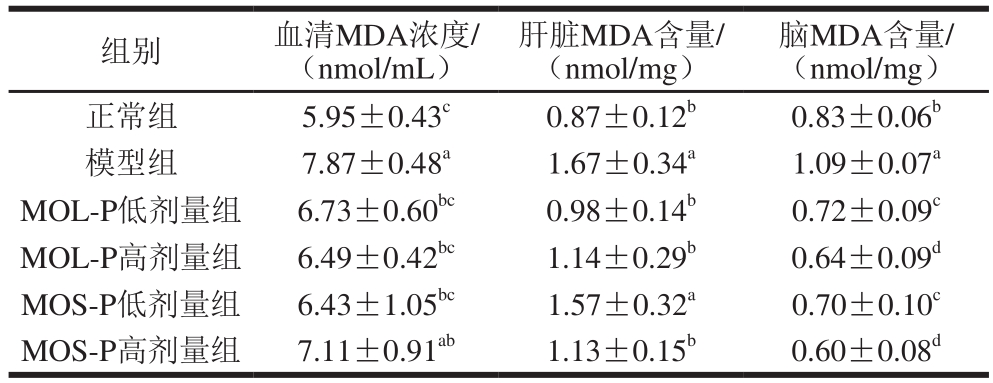
脑MDA含量/(nmol/mg)正常组 5.95±0.43c 0.87±0.12b 0.83±0.06b模型组 7.87±0.48a 1.67±0.34a 1.09±0.07a MOL-P低剂量组 6.73±0.60bc 0.98±0.14b 0.72±0.09c MOL-P高剂量组 6.49±0.42bc 1.14±0.29b 0.64±0.09d MOS-P低剂量组 6.43±1.05bc 1.57±0.32a 0.70±0.10c MOS-P高剂量组 7.11±0.91ab 1.13±0.15b 0.60±0.08d组别 血清MDA浓度/(nmol/mL)肝脏MDA含量/(nmol/mg)
由表4可知,模型组血清、肝脏和脑组织MDA水平均显著高于正常组(P<0.05),表明在持续注射D-半乳糖后,小鼠机体抗氧化能力下降。对于小鼠血清MDA水平:高、低剂量MOL-P和低剂量MOS-P均能显著降低衰老小鼠血清MDA水平(P<0.05),较模型组分别降低了17.53%、14.49%和18.30%;高剂量MOS-P虽能在一定程度上降低衰老小鼠血清MDA水平,但和模型组相比差异不显著(P>0.05)。对于小鼠肝脏MDA水平:高、低剂量MOL-P和高剂量MOS-P均能显著降低肝脏MDA水平(P<0.05),低剂量MOS-P虽然能在一定程度上降低肝脏MDA水平,但和模型组相比差异不显著(P>0.05)。对于小鼠脑组织MDA水平:辣木源多肽组分均能显著降低衰老小鼠脑组织MDA水平(P<0.05),其中效果最好的是高剂量MOL-P和高剂量MOS-P,较模型组分别降低了41.28%和44.95%;值得一提的是,辣木源多肽组分各剂量组脑组织MDA水平也显著低于正常组水平,表明辣木源多肽组分是卓越的体内抗氧化剂,能保护机体免受氧化应激所致损伤,具有潜在的开发利用前景。
2.6 辣木源多肽对D-半乳糖致衰老小鼠肝脏组织的影响

图2 小鼠肝脏组织切片(100×)
Fig. 2 Effects of MOL-P and MOS-P on histopathological changes of liver tissues in D-galactose-induced aging mice (100 ×)
A~F.分别为正常组、模型组、MOL-P低剂量组、MOL-P高剂量组、MOS-P低剂量组、MOS-P高剂量组。
如图2所示,正常组肝脏细胞排列紧密,细胞形态正常,肝细胞核清晰突出,以中央静脉为中心,肝索呈放射状排列;模型组肝细胞扩张,肝窦扩大且肝索排列紊乱,中央静脉附近有炎症细胞浸润的现象,细胞凋亡的现象亦很明显,说明肝脏组织已被损伤;辣木源多肽各剂量组肝细胞形态和肝索排列趋于正常,细胞凋亡明显减少,炎症细胞浸润的情况减少。再次说明辣木源多肽组分能保护肝脏免受氧化应激所致损伤。
本团队前期以抗氧化活性为导向,定向制备得到辣木源多肽组分,并基于生物可接受度来评价其抗氧化性,通过模拟胃、肠道消化,研究辣木源多肽组分胃、肠道消化物对氧化损伤红细胞的保护作用,结果表明,辣木源多肽组分经胃、肠道消化后,抗氧化活性增强,释放出更多短肽段,清除胞内ROS,下调MDA水平来保护氧化损伤红细胞[15-16]。在对氧化损伤红细胞的保护活性方面,辣木叶多肽组分胃、肠道消化物强于GSH,其中的一条二肽Leu-His的抗氧化活性与GSH相当;辣木籽多肽组分胃、肠道消化物中的一条二肽Gln-Met的抗氧化活性也能与GSH相媲美[15-16]。这些小分子抗氧化肽是辣木叶、辣木籽多肽组分发挥良好抗衰老活性的重要物质基础。
3 结 论
本研究在动物实验水平上证实辣木源多肽组分通过提高衰老小鼠血清GSH-Px活力和肝脏SOD活力,有效维护机体抗氧化防御系统,一定程度上降低血清、肝脏、脑组织MDA水平,抑制脂质过氧化,上调脑系数,改善小鼠肝脏、脑组织氧化损伤,起到延缓衰老的作用。结合本团队前期研究成果,辣木源多肽良好的体内抗氧化作用与其中所含抗氧化肽片段密切相关。本研究结果对于具有抗衰老活性膳食干预剂的筛选、以辣木源多肽为核心功能性因子的健康食品的研制以及辣木精深加工产业的健康发展方面具有理论和方法的指导意义。
[1] ZHOU Yue, DONG Ying, XU Qinggang, et al. Mussel oligopeptides ameliorate cognition deficit and attenuate brain senescence in D-galactose-induced aging mice[J]. Food & Chemical Toxicology,2013, 59(8): 412-420. DOI:10.1016/j.fct.2013.06.009.
[2] XU Lieqiang, XIE Youliang, GUI Shuhua, et al. Polydatin attenuates D-galactose-induced liver and brain damage through its anti-oxidative,anti-inflammatory and anti-apoptotic effects in mice[J]. Food &Function, 2016, 7(11): 4545-4555. DOI:10.1039/C6FO01057A.
[3] LIN Lianzhu, YANG Kun, ZHENG Lin, et al. Anti-aging effect of sea cucumber (Cucumaria frondosa) hydrolysate on fruit flies and,D-galactose-induced aging mice[J]. Journal of Functional Foods, 2018,47: 11-18. DOI:10.1016/j.jff.2018.05.033.
[4] 冯晴霞, 闫宇宁, 杨峄, 等. 姬松茸多肽提取物对D-半乳糖致衰老模型小鼠的保护作用[J]. 食品科学, 2020, 41(7): 164-170.DOI:10.7506/spkx1002-6630-20190319-249.
[5] 许敏, 赵三军, 宋晖, 等. 辣木的研究进展[J]. 食品科学, 2016,37(23): 291-301. DOI:10.7506/spkx1002-6630-201623048.
[6] 刘凤霞, 王苗苗, 赵有为, 等. 辣木中功能性成分提取及产品开发的研究进展[J]. 食品科学, 2015, 36(19): 282-286. DOI:10.7506/spkx1002-6630-201519051.
[7] BRILHANTE R S N, SALES J A, PEREIRA V S, et al. Research advances on the multiple uses of Moringa oleifera: a sustainable alternative for socially neglected population[J]. Asian Pacific Journal of Tropical Medicine, 2017, 10(7): 621-630. DOI:10.1016/j.apjtm.2017.07.002.
[8] 康丹丹, 李照莹, 董浩澜, 等. 辣木叶蛋白质酶解产物的制备及其抗菌活性研究[J]. 食品工业科技, 2019, 40(8): 114-119. DOI:10.13386/j.issn1002-0306.2019.08.020.
[9] MARTIN A M M, NYOBE E C, BAKWO BASSOGOG C, et al.A comparison on the nutritional quality of proteins from Moringa oleifera leaves and seeds[J]. Cogent Food & Agriculture, 2016, 2:1213618. DOI:10.1080/23311932.2016.1213618.
[10] MAKKAR H P S, BECKER K. Nutrional value and antinutritional components of whole and ethanol extracted Moringa oleifera leaves[J]. Animal Feed Science Technology, 1996, 63(1/2/3/4):211-228. DOI:10.1016/S0377-8401(96)01023-1.
[11] LESTIENNE I, BUISSON M, LULLIEN-PELLERIN V, et al. Losses of nutrients and anti-nutritional factors during abrasive decortication of two pearl millet cultivars (Pennisetum glaucum)[J]. Food Chemistry,2007, 100(4): 1316-1323. DOI:10.1016/j.foodchem.2005.11.027.
[12] BHUTADA P R, JADHAV A J, PINJARI D V, et al. Solvent assisted extraction of oil from Moringa oleifera Lam. seeds[J]. Industrial Crops and Products, 2016, 82: 74-80. DOI:10.1016/j.indcrop.2015.12.004.
[13] YUSOFF M M, GORDON M H, EZEH O, et al. High pressure pretreatment of Moringa oleifera seed kernels prior to aqueous enzymatic oil extraction[J]. Innovative Food Science & Emerging Technologies,2016, 39: 129-136. DOI:10.1016/j.ifset.2016.11.014.
[14] SINGH R S G, NEGI P S, RADHA C. Phenolic composition,antioxidant and antimicrobial activities of free and bound phenolic extracts of Moringa oleifera seed flour[J]. Journal of Functional Foods,2013, 5(4): 1883-1891. DOI:10.1016/j.jff.2013.09.009.
[15] LIN Lianzhu, ZHU Qiyuan, ZHAO Mouming, et al. Purification of peptide fraction with antioxidant activity from Moringa oleifera leaf hydrolysate and protective effect of its in vitro gastrointestinal digest on oxidatively damaged erythrocytes[J]. International Journal of Food Science & Technology, 2019, 54(1): 84-91. DOI:10.1111/ijfs.13907.
[16] 林恋竹, 朱启源, 赵谋明. 辣木籽抗氧化肽的制备及其对氧化损伤红细胞的保护作用[J]. 食品科学, 2019, 40(7): 40-46. DOI:10.7506/spkx1002-6630-20180319-241.
[17] ZHAO Jichun, TIAN Fengwei, YAN Shuang, et al. Lactobacillus plantarum CCFM10 alleviating oxidative stress and restoring the gut microbiota in D-galactose-induced aging mice[J]. Food & Function,2018, 9(2): 917-924. DOI:10.1039/C7FO01574G.
[18] SUN Jiazheng, ZHANG Liheng, ZHANG Jing, et al. Protective effects of ginsenoside Rg1 on splenocytes and thymocytes in an aging rat model induced by D-galactose[J]. International Immunopharmacology,2018, 58: 94-102. DOI:10.1016/j.intimp.2018.03.017.
[19] HO S C, LIU J H, WU R Y. Establishment of the mimetic aging effect in mice caused by D-galactose[J]. Biogerontology, 2003, 4(1): 15-18.DOI:10.1023/a:1022417102206.
[20] XIA Xuejuan, XING Yuxiao, LI Guannan, et al. Antioxidant activity of whole grain Qingke (Tibetan Hordeum vulgare L.) toward oxidative stress in D-galactose induced mouse model[J]. Journal of Functional Foods, 2018, 45: 355-362. DOI:10.1016/j.jff.2018.04.036.
[21] ZENG Huajin, LIU Zhe, WANG Yaping, et al. Studies on the antiaging activity of a glycoprotein isolated from Fupenzi (Rubus chingii Hu.) and its regulation on klotho gene expression in mice kidney[J].International Journal of Biological Macromolecules, 2018, 119: 470-476. DOI:10.1016/j.ijbiomac.2018.07.157.
[22] KONG Songzhi, LI Jicheng, LI Sidong, et al. Anti-aging effect of chitosan oligosaccharide on D-galactose-induced subacute aging in mice[J]. Marine Drugs, 2018, 16(6): 181. DOI:10.3390/md16060181.
[23] 王君明, 崔瑛, 王峥涛, 等. 超氧化物歧化酶参与肝损伤的研究进展[J]. 中国实验方剂学杂志, 2011(7): 265-269. DOI:10.3969/j.issn.1005-9903.2011.07.082.
[24] BAEK B S, KWON H J, LEE K H, et al. Regional difference of ROS generation, lipid peroxidaton, and antioxidant enzyme activity in rat brain and their dietary modulation[J]. Archives of Pharmacal Research(Seoul), 1999, 22(4): 361-366. DOI:10.1007/bf02979058.
[25] ZHAO Lei, YANG Huaqing, XU Meili, et al. Stevia residue extract ameliorates oxidative stress in D-galactose-induced aging mice via Akt/Nrf2/HO-1 pathway[J]. Journal of Functional Foods, 2019, 52:587-595. DOI:10.1016/j.jff.2018.11.044.
[26] PENG Xinyan, KONG Baohua, YU Haiyang, et al. Protective effect of whey protein hydrolysates against oxidative stress in D-galactoseinduced ageing rats[J]. International Dairy Journal, 2014, 34(1): 80-85.DOI:10.1016/j.idairyj.2013.08.004.
[27] YANG Qingming, PAN Xianhui, KONG Weibao, et al. Antioxidant activities of malt extract from barley (Hordeum vulgare L.) toward various oxidative stress in vitro and in vivo[J]. Food Chemistry, 2010,118(1): 84-89. DOI:10.1016/j.foodchem.2009.04.094.
[28] SUN Yangying, PAN Daodong, GUO Yuxing, et al. Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J]. Food and Chemical Toxicology, 2012, 50(10): 3397-3404.DOI:10.1016/j.fct.2012.07.047.
[29] SANG Ying, ZHANG Fan, WANG Heng, et al. Apigenin exhibits protective effects in a mouse model of D-galactose-induced aging via activating the Nrf2 pathway[J]. Food & Function, 2017, 8(6): 2331-2340. DOI:10.1039/c7fo00037e.