草莓(Fragaria × ananassa)果实风味鲜美、营养成分丰富,深受世界各地人们的喜爱[1]。但由于草莓果实质地柔软、果皮极薄,在采收和运输过程中容易遭受机械损伤和腐败微生物的侵染,导致草莓果实采后贮藏期短,因而经济损失严重[2]。软腐病、灰霉病、炭疽病等是导致草莓腐烂变质的主要病害,其中由灰葡萄孢菌(Botrytis cinerea)引起的灰霉病是最常发生和最具有破坏性的病害之一[3-5]。尽管化学药剂是控制草莓采后病害最高效普遍的方法,但是药剂残留对人类健康和环境带来的危害不容小觑,所以寻找新的安全有效的绿色方法控制草莓采后病害已成为当今的研究趋势[6-7]。越来越多的研究发现酵母及其产生的挥发性有机物(volatile organic compounds,VOCs)在拮抗果蔬采后病害过程中发挥重要作用[8-10]。由于VOCs不直接与果实接触,对病原菌具有较强的抑制作用甚至杀灭作用,此外在抑制病原菌过程中它们还表现出协同作用,从而逐渐成为关注热点[10]。
拮抗菌产生的VOCs被认为是控制果蔬采后病害的有效物质[11]。研究发现威克汉逊酵母(Wickerhamomyces anomalus)、美极梅奇酵母(Metschnikowia pulcherrima)、酿酒酵母(Saccharomyces cerevisiae)、掷孢酵母(Sporidiobolus pararoseus)、假丝酵母(Candida intermedia)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)产生的VOCs可以有效地抑制草莓果实采后腐烂以及灰霉病的发生[12-15]。这些VOCs包括酯类、醇类、醛类和酮类等,其不仅能够减少草莓灰霉病的发生,其挥发性单体物质如异辛醇、正癸烯、桂皮醛、2-壬酮、戊酸、3-甲基-1-丁醇等对灰霉孢子萌发和菌丝生长也有同样的抑制作用。
桂皮醛作为一种广谱抑菌物质,可以从肉桂、樟树等植物中提取,已被联合国粮农组织与世界卫生组织以及美国食品药品监督管理局认定为安全无毒物质[16]。Suwanamornlert等[17]发现桂皮醛蒸汽可以抑制桂圆中病原菌的生长,对白地霉(Geotrichum candidum)和拟茎点霉属(Phomopsis spp.)抑制效果明显。Mattson等[18]研究发现桂皮醛处理番茄可以有效地杀死沙门氏菌,但对品质的影响有待进一步研究。肉桂精油对杏中主要的采后腐败菌褐腐菌(Monilinia fructicola)和灰霉有抑制作用,并且这一作用主要来自于肉桂精油中的主要成分桂皮醛[19]。Fathi等[20]也发现桂皮醛对灰葡萄孢菌丝生长和孢子萌发具有明显的抑制作用,当剂量高于400 µL/L时可以完全抑制灰葡萄孢的生长。本课题组前期研究发现H. uvarum产生的VOCs对草莓灰霉病有抑制作用[15],离体实验发现21 种VOCs单体中桂皮醛对灰葡萄孢孢子萌发和菌丝生长的抑制效果最好[21]。为了进一步了解H. uvarum产生的VOCs单体对草莓果实抗灰霉病的作用机制,本实验以桂皮醛为研究对象,探索其不同处理参数对草莓品质、相关生理指标和抗性基因的影响,从而为拮抗酵母挥发性物质抑制草莓灰霉病的可能机理提供依据。
1 材料与方法
1.1 材料与试剂
供试材料为‘ 红颜’草莓果实(Fragaria×ananassa Duch.),清晨采摘于江苏省南京市江宁区锁石生态园,采后2 h内运回实验室。挑选色泽统一、大小一致、无机械损伤、无病虫害的完整果实用于实验。
病原菌为灰葡萄孢霉(Botrytis cinerea),保存于PDA培养基(4 ℃),接种处理前在PDA培养基中25 ℃培养7 d,用无菌水将孢子洗脱,经8 层纱布过滤,用血球计数板调节至所需浓度1×106 spores/mL,现用现配。
桂皮醛(纯度98%) 阿拉丁(上海)试剂有限公司。
1.2 仪器与设备
紫外-可见分光光度计 北京莱伯泰科仪器有限公司;TGL20M台式高速冷冻离心机 湘仪仪器有限公司;恒温恒湿培养箱 宁波海曙赛富实验仪器厂;XB-K-25血球计数板 国营上海医用光学仪器厂;HVE-50自动蒸气灭菌锅 日本Hirayama有限公司;HP-2136便携式色差仪 上海谱熙光电科技有限公司;WYT-4型手持糖量仪 绍兴市亿纳仪器制造有限公司;TMS-PRO食品物性分析仪 美国FTC公司;102光学显微镜日本尼康公司;恒温水浴锅HH-6 常州国华电器有限公司;QuantStudio™ 6 Flex实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)系统 美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 不同剂量桂皮醛对草莓灰霉病的影响
草莓果实用体积分数75%乙醇溶液消毒10 s后无菌水冲洗两遍,自然晾干,无菌打孔器于草莓赤道部位打孔(3 mm×3 mm),晾干后阳性对照组和桂皮醛处理组草莓伤口部位接种50 µL 1×106 spores/mL B. cinerea孢子悬浮液,阴性对照组草莓伤口部位接种50 µL无菌水。果实自然晾干后放置于小干燥器(容积约2 L)隔板上,干燥器底部放置滤纸片(4 cm×4 cm)。对照组(阴性对照:H2O处理;阳性对照:CK,接种B. cinerea,不做任何处理)中,滤纸片不添加桂皮醛。桂皮醛处理组中,处理I:滤纸片上添加桂皮醛31.25 µL(剂量为15.62 µL/L);处理II:滤纸片上添加桂皮醛62.5 µL(剂量为31.25 µL/L);处理III:滤纸片上添加桂皮醛125 µL(剂量为62.5 µL/L)。将干燥器密封后放置于25 ℃、相对湿度90%~95%的恒温恒湿培养箱,每天进行外观观察,5 d后分别对草莓病斑直径、色差、硬度、可溶性固形物质量分数和可滴定酸质量分数进行测定,以筛选出桂皮醛最佳熏蒸剂量。每个对照和处理3 个平行,每平行10 颗草莓;实验重复3 次。
1.3.2 桂皮醛不同熏蒸时间对草莓灰霉病的影响
草莓果实处理方法同1.3.1节,打孔后接种50 μL 1×106 spores/mL B. cinerea孢子悬浮液。对照:滤纸片不添加桂皮醛;处理:滤纸片上添加125 µL桂皮醛,对应剂量为62.5 µL/L。干燥器密封后放入25 ℃、相对湿度90%~95%的恒温恒湿培养箱中分别熏蒸1、2 d和3 d。熏蒸结束后将草莓果实放入保鲜盒中,继续在25 ℃培养箱中贮藏至第5天。每天观察病斑直径,并且取健康果肉用液氮冷冻后放入-80 ℃冰箱保存,用于测定熏蒸过程中酶活力和基因相对表达量等相关指标。每个对照和处理做3 个平行,每平行10 颗草莓,实验重复3 次。
1.3.3 指标测定
1.3.3.1 病斑直径测定
用游标卡尺十字交叉法测量草莓果实接种部位病斑直径的大小,大于0.3 cm的即为发病,单位为cm。
1.3.3.2 品质指标测定
色差采用便携式色差仪测定[22],结果用L*、a*、b*值表示,L*值代表亮度;a*值表示红绿度,值越大表示偏红;b*值表示黄蓝度,值越大表示偏黄。硬度采用TMS-PRO食品物性分析仪测定,设置参数为:下压速率60 mm/s,形变量40%,高度40 mm,两次压缩中间的停顿时间为5 s,触发力为4.0 N。可溶性固形物质量分数采用WYT-4型手持糖量仪测定,并进行温度校准。可滴定酸质量分数测定参考D’aquino等[23]的方法。
1.3.3.3 酶活力的测定
从5 个草莓果实上取样,1 g果肉组织中加入5 mL提取缓冲液(含1 g/100 mL聚乙烯吡咯烷酮)研磨混匀后,于4 ℃、10 000 r/min低温离心15 min,取上清液测定各酶活力。
超氧化物歧化酶(superoxide dismutase,SOD)活力测定:提取液为50 mmol/L pH 7.8磷酸缓冲液。SOD活力的测定参照Wang Luyao等[24]的方法,采用氮蓝四唑光还原法,以每克样品抑制反应的50%为1 个酶活力单位(U)。
过氧化氢酶(catalase,CAT)活力测定:提取液为100 mmol/L pH 7.0磷酸缓冲液。CAT活力的测定参照Wang Lei等[25]的方法,以每克样品每分钟240 nm波长处吸光度变化0.001为1 个酶活力单位(U)。
多酚氧化酶(polyphenol oxidase,PPO)活力测定:提取液为200 mmol/L pH 6.8柠檬酸-磷酸缓冲液。PPO活力的测定参照Cai Zikang等[26]的方法,以每克样品每秒398 nm波长处吸光度增加0.001为1 个酶活力单位(U)。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力的测定:提取液为50 mmol/L pH 7.8磷酸缓冲液。APX活力的测定参照Cai Zikang等[26]的方法,以每克样品每分钟290 nm波长处吸光度变化0.001为1 个酶活力单位(U)。
苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)活力测定:提取液为100 mmol/L pH 8.8柠檬酸-磷酸缓冲液。PAL活力测定参照Wei Yingying等[27]的方法,以每克样品每分钟290 nm波长处吸光度增加0.001为1 个酶活力单位(U)。
β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)活力的测定:提取液为50 mmol/L pH 5.0醋酸钠缓冲液。测定方法参照Wang Lei等[25]的方法,以每克样品每分钟在540 nm波长处吸光度增加0.001为1 个酶活力单位(U)。
1.3.3.4 基因表达量的测定
草莓RNA提取采用改良CTAB法[28]。反转录采用RR036A试剂盒进行,反转录后的cDNA -80 ℃存放备用。基因表达水平的测定采用RR420A试剂盒的方法进行,反应体系为20 µL,混匀后用QuantStudioTM 6 Flex仪器进行实时荧光定量PCR,上机反应条件为:95 ℃、30 s,然后95 ℃、5 s,60 ℃、34 s,共40 个循环。所用特异性引物序列见表1。将反应结果用阈值周期(CT值)进行归一化处理,用2−ΔΔCT法[29]来表示目标基因相对于管家基因(18S rRNA)的相对表达水平。
表1 草莓果实相关基因特异性引物序列
Table 1 Sequences of specific primers used for polymerase chain reaction amplification of defense-related genes in strawberry fruit

基因名称 序列(5’-3’)上游引物 下游引物FaCAT GTCTTCTTCGTCCGTGAT GTAGTTCCCAGCAGCAAT FaSOD ATGGTGCTCCTGAAGATGA TAGAGTGTGGTCCAGTGAG FaPPO GGAGGCGGAGCAATAGAGAC AGCCAGACCCCCTCAATACT FaAPX CACAAGGAACGGTCTGGATT CGCAGCGTATTTCTCAACAA FaPAL GTGAAAGAAGCGAAGAAGG GAAGCTCGGAGCAGTATG FaGlu TATAGATCAGTTTGTTATTTCTTCTTT TGTTATCTGTAGAGCAGGCATAA 18S rRNA TGTGAAACTGCGAATGGCTCATTAA GAAGTCGGGATTTGTTGCACGTATT
1.4 数据统计与分析
实验数据统计分析采用SAS 8.2软件进行Duncan’s多重比较,P<0.05表示差异显著。采用Excel软件作图。
2 结果与分析
2.1 不同剂量桂皮醛熏蒸对草莓灰霉病的影响
2.1.1 不同剂量桂皮醛熏蒸对草莓灰霉病的抑制作用

图1 不同剂量桂皮醛熏蒸处理对草莓外观(A)及病斑直径(B)的影响
Fig. 1 Effect of trans-cinnamaldehyde on appearance (A) and lesion diameter (B) of strawberry fruit artificially inoculated with B. cinerea
小写字母不同表示差异显著(P<0.05)。图2同。
由图1A可知,不同剂量的桂皮醛处理对B. cinerea均有抑制作用,剂量越高病斑直径越小,抑制效果越明显。从图1B可以看出,接种无菌水的草莓(阴性对照)病斑直径为0,接种B. cinerea但无桂皮醛熏蒸处理的草莓(CK组)病斑直径最大,为1.9 cm,而接种B. cinerea后分别采用15.62、31.25、62.5 µL/L的桂皮醛熏蒸处理5 d的草莓病斑直径分别只有阳性对照的79%、47%、40%。可见桂皮醛熏蒸处理能显著抑制草莓灰霉病的发展(P<0.05),其中剂量为62.5 µL/L时的抑制效果最好。
2.1.2 不同剂量桂皮醛熏蒸对草莓品质指标的影响


图2 不同剂量桂皮醛处理对草莓品质指标的影响
Fig. 2 Effect of different concentrations of trans-cinnamaldehyde on quality parameters of strawberry fruit
A. L*值;B. a*值;C. b*值;D.硬度;E.可溶性固形物质量分数;F.可滴定酸质量分数。
颜色是影响消费者选择果实的一个重要因素。L*值代表亮度,经常用来评价草莓贮藏期间的褐度和亮度。从图2A可知,草莓在25 ℃下放置5 d后,与处理前相比L*值呈下降趋势,与CK组相比,桂皮醛熏蒸处理能显著延缓草莓L*值的下降(P<0.05),62.5 µL/L桂皮醛处理效果最好,15.62 µL/L和31.25 µL/L处理组之间无显著差异。a*值表示红度,值越大表示颜色越红,可以反映果实的成熟度。从图2B可以看出,草莓贮藏后a*值上升,阳性对照组a*值最大(34.16),62.5 µL/L处理组a*值最小(29.73),桂皮醛处理能显著抑制草莓变红(P<0.05),但不同剂量处理组间无差异。b*值代表黄蓝度,正值表示偏黄[21]。如图2C所示,贮藏后所有草莓b*值都明显下降,两个对照组下降程度最大,而不同剂量桂皮醛处理的草莓b*值始终高于对照组,15.62 µL/L处理组b*值变化最小,31.25 µL/L和62.5 µL/L处理组之间无显著差异(P>0.05),说明桂皮醛剂量越高,对b*值影响越大。
硬度是草莓一个重要的品质指标,影响消费者对草莓的选择性和接受度。从图2D可以看出,草莓贮藏后硬度下降,与处理前相比,接种了B. cinerea的各组草莓硬度均显著下降(P<0.05)。不同剂量桂皮醛熏蒸处理组硬度均低于CK组,说明桂皮醛熏蒸处理在保持草莓硬度方面无明显作用。随着桂皮醛处理剂量的升高,草莓硬度逐渐增加,62.5 µL/L处理组硬度为22.05 N,与CK组无显著差异。
各处理组可溶性固形物质量分数如图2E所示,在25 ℃放置5 d后草莓可溶性固形物质量分数均下降,其中阳性对照组(CK组)可溶性固形物质量分数低于阴性对照组(H2O处理组);桂皮醛处理组可溶性固形物质量分数随着熏蒸剂量的升高而逐渐增加,并且均高于CK组,62.5 µL/L处理组可溶性固形物质量分数最高(7.6%),和CK组相比差异显著(P<0.05),15.62 µL/L和31.25 µL/L处理组同两个对照组均无显著差异。
可滴定酸含量可以影响草莓的口感。由图2F可知,贮藏5 d后两个对照之间可滴定酸质量分数相同,均为0.42%,高剂量桂皮醛处理可以保持果实可滴定酸质量分数,62.5 µL/L处理后的草莓可滴定酸质量分数最高,为0.47%,显著高于两个对照组(P<0.05)。说明适当剂量的桂皮醛熏蒸处理可以延缓草莓可滴定酸质量分数的下降。
2.2 桂皮醛熏蒸时间对草莓灰霉病的影响
2.2.1 桂皮醛熏蒸时间对草莓灰霉病的抑制作用

图3 桂皮醛不同熏蒸时间处理对草莓外观的影响
Fig. 3 Effect of trans-cinnamaldehyde fumigation time on appearance of strawberry fruit

图4 桂皮醛不同熏蒸时间对草莓病斑直径的影响
Fig. 4 Effect of trans-cinnamaldehyde fumigation time on lesion diameter of strawberry fruit
A.熏蒸结束后的病斑直径;B.贮藏结束后的病斑直径。相同熏蒸时间不同处理组之间小写字母不同表示差异显著(P<0.05),图6同。
由图3和图4A可以看出,果实经处理2 d和3 d时,对照组和处理组草莓出现了不同程度的病斑,但对照组病斑直径都大于处理组(P<0.05);桂皮醛熏蒸处理3 d时对照组病斑直径为处理组的3.9 倍。由图4B可知,当各处理组草莓继续在25 ℃放置到第5天时,草莓病斑都有明显的扩大,桂皮醛处理组草莓病斑直径始终显著小于对照组(P<0.05),熏蒸时间越长草莓病斑直径越小,相对于熏蒸1 d和2 d,桂皮醛熏蒸处理3 d对草莓灰霉病的抑制效果最好,此时对照组病斑直径为处理组的1.9 倍。
2.2.2 桂皮醛熏蒸过程中草莓抗性相关酶活力的变化


图5 桂皮醛熏蒸过程中草莓CAT (A)、SOD (B)、PPO(C)、APX(D)、PAL(E)、GLU(F)活力的变化
Fig. 5 Effect of trans-cinnamaldehyde fumigation time on CAT (A),SOD (B), PPO (C), APX (D), PAL (E) and GLU (F) activities in strawberry fruit
*.相同熏蒸时间,与对照组相比差异显著(P<0.05)。
CAT、SOD是植物体中重要的清除活性氧的关键酶。由图5A可知,CAT活力在接种B. cinerea后逐渐升高,对照组在熏蒸2 d时CAT活力达到最大值,第3天有所下降,而桂皮醛熏蒸处理组草莓CAT活力呈一直上升趋势,除了熏蒸2 d时处理组草莓的CAT活力比对照组低外,其余时间时处理组活力均显著高于对照组(P<0.05),由此可以看出桂皮醛熏蒸处理可以保持CAT较高的活力。
由图5B可知,草莓SOD活力在接种B. cinerea后有所降低,1 d以后桂皮醛处理的草莓SOD活力逐渐上升,而对照组草莓SOD活力变化不大,整个贮藏过程中处理组草莓的活力始终显著高于对照组(P<0.05),熏蒸第3天时处理组SOD活力是对照组的1.43 倍。
由图5C可知,PPO活力在熏蒸过程中呈先下降后上升的趋势,处理组和对照组趋势保持一致,但在整个贮藏过程中处理组的PPO活力始终比对照组高,并且在第1天和第2天处理组的活力与对照组间差异显著(P<0.05),说明桂皮醛处理可以延缓前期PPO活力的降低,并快速提高后期的PPO活力。
由图5D可知,APX活力在熏蒸期间呈先上升后下降趋势,熏蒸1 d时,桂皮醛处理组能快速诱导活力上升并显著高于对照组(P<0.05),之后对照组和处理组同在第2天时达到最大,第3天开始下降。
由图5E可知,PAL活力在熏蒸期间先上升后下降,第1天时对照组和处理组都达到最大,除了第2天处理组PAL活力低于对照组,其他时间处理组均高于对照组。
由图5F可知,GLU活力在贮藏期间先上升后下降,对照组和处理组分别在第1天和第2天达到最大值,第2天和第3天时处理组GLU活力均显著高于对照组(P<0.05),分别为对照组的1.95 倍和1.92 倍,说明桂皮醛熏蒸处理可以有效提高GLU活力并且延缓其下降。
2.2.3 桂皮醛不同熏蒸时间对草莓抗性相关基因表达量的影响
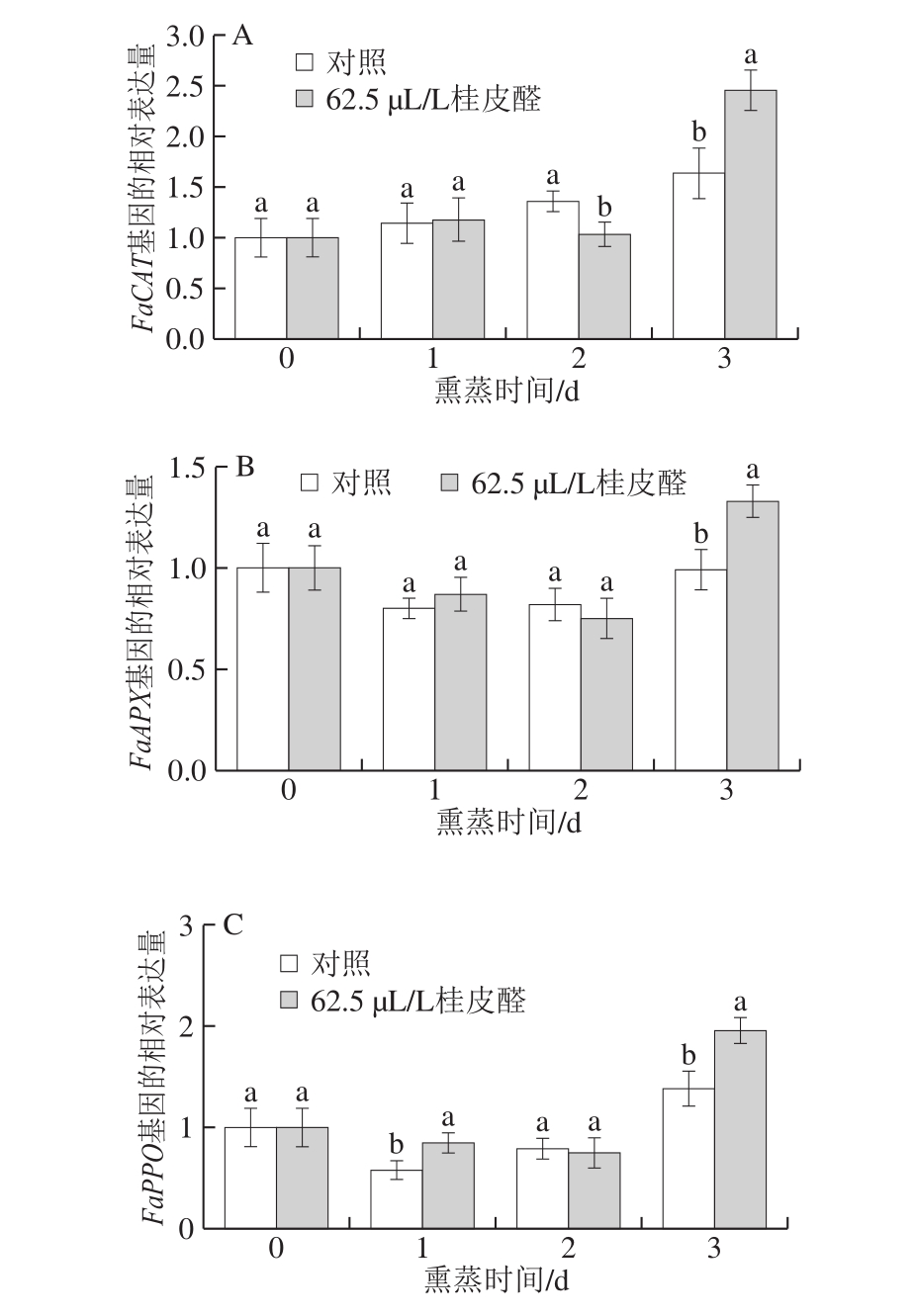

图6 桂皮醛不同熏蒸时间对草莓果实FaCAT(A)、FaAPX(B)、FaPPO(C)、FaSOD(D)、FaPAL(E)、FaGLU(F)基因表达量的影响
Fig. 6 Effect of trans-cinnamaldehyde fumigation time on expression levels of FaCAT (A), FaAPX (B), FaPPO (C), FaSOD (D), FaPAL (E), and FaGLU (F) in strawberry fruit
如图6A、B所示,桂皮醛熏蒸处理草莓在前期(熏蒸的前2 d)并不能快速诱导FaCAT和FaAPX基因相对表达量的提高,对照组和处理组之间无显著差异(P>0.05),当熏蒸至第3天时,处理组草莓的FaCAT和FaAPX基因相对表达量有明显的增加,显著高于对照组(P<0.05),分别为对照组的1.50 倍和1.34 倍。FaPPO基因的相对表达量在前期有所下降,第3天时相对表达量快速升高,处理组和对照组趋势一致,但桂皮醛熏蒸前期能延缓FaPPO基因相对表达量的下降,熏蒸后期时能显著诱导FaPPO基因的表达,熏蒸第3天时处理组为对照组的1.42 倍(图6C)。FaSOD基因相对表达量在熏蒸过程中无论是对照组还是处理组都有所下降,对照组熏蒸过程中相对表达量趋于稳定,而处理组草莓熏蒸1 d时FaSOD基因的相对表达量显著高于对照组(P<0.05),第3天时FaSOD基因相对表达量明显升高,说明桂皮醛熏蒸处理在后期能诱导该基因的相对表达(图6D)。如图6E所示,采用桂皮醛熏蒸处理并不能有效诱导草莓FaPAL基因的高相对表达,且在熏蒸过程中对照组和处理组草莓FaPAL基因相对表达量与第0天相比逐渐降低。草莓经过桂皮醛熏蒸处理并不能诱导草莓前期FaGLU基因相对表达量的提高,而第3天时处理组草莓该基因的相对表达量大幅度提高,显著高于对照组(P<0.05),熏蒸第1天和第2天时处理组FaGLU基因的相对表达量均比对照组低(图6F)。
3 讨 论
前期研究发现,葡萄汁有孢汉逊酵母挥发性代谢物能有效抑制草莓灰霉病的发生,且对酵母产生的挥发性单体进行的体外抑菌实验结果表明桂皮醛对B. cinerea的抑制效果最好[15,21],所以本实验研究桂皮醛对草莓灰霉病的抑制效果及其机理。张娜娜等[30]探讨了肉桂醛对番茄采后灰霉病的抑制作用以及对其品质的影响,发现离体条件下肉桂醛能有效抑制灰葡萄孢菌菌丝生长和孢子萌发,且在活体中能维持番茄硬度、可溶性固形物质量分数等指标,对番茄灰霉病有很好的抑制效果。本实验研究了不同剂量的桂皮醛熏蒸处理对草莓灰霉病的抑制作用以及对草莓品质的影响,从外观和病斑直径的结果来看,桂皮醛剂量越高,对灰霉病的抑制效果越好,62.5 µL/L桂皮醛熏蒸处理对草莓灰霉病的抑制作用最好,这一结果与Hassani等[19]的研究结果一致。不同剂量桂皮醛熏蒸处理对草莓品质的影响有差别,草莓经过桂皮醛熏蒸处理后能有效延缓L*值、b*值的下降和a*值的上升,说明桂皮醛能延缓草莓果实颜色变化,维持品质;此外,桂皮醛处理能有效保持草莓可溶性固形物和可滴定酸质量分数,但对维持草莓硬度方面作用不明显。
尽管桂皮醛抑制灰霉病已有研究,但其抑菌机理却少有报道,于是通过研究草莓熏蒸过程中相关抗性酶活力和抗性基因相对表达量的变化来初步研究其抑制灰霉病的机理。诱导抗性作为一种可持续性策略防治果蔬采后病害已经受到越来越多的关注,在植物体中诱导抗性主要包括两种方式:系统获得抗性和诱导系统抗性,这种诱导机制不能直接诱导植物抗性,而是在植物受到病原菌攻击时表现出更强更快的抗病防御反应,包括活性氧迸发和病程相关(pathogenesis related,PR)蛋白的积累等,这一反应称为敏化反应[31]。有研究显示,草莓能够有效地抵抗病原体首先依赖于受伤组织的生理状态(预防御机制),其次是通过植物表面的受体识别入侵者,然后通过广泛的诱导机制,包括细胞壁加固、活性氧的生产、植物抗毒素的产生和PR的积累来抵御病原菌的侵染[32]。Wang Luyao等[24]通过用葡萄汁有孢汉逊酵母产生的挥发性气体熏蒸草莓发现,熏蒸处理能有效降低草莓灰霉病发病率,诱导抗病相关酶CAT、SOD、APX、PPO、PAL活力的积累,并且增加这些酶相关基因的表达。而秦晓杰等[5]研究也发现水杨酸结合葡萄有孢汉逊酵母能显著提升草莓抗氧化酶SOD、CAT、APX等的活力,减少草莓病害发生,本实验研究结果与其一致,与对照组相比,草莓在桂皮醛熏蒸的过程中能显著提高CAT、APX和PPO的活力,延缓SOD活力的下降,在病害发生时CAT、SOD和APX活力升高有利于清除植物体内过量的活性氧,减少自由基对果实伤害从而增加果实对病害的抗性[29]。此外,有研究表明在植物受到微生物侵染的过程中,PPO将酚类物质氧化成醌类,而醌类物质可作为抗菌成分参与到抵御病害的过程中[6]。从基因表达情况来看,与对照相比,桂皮醛处理能诱导草莓果实中FaCAT、FaPPO和FaAPX基因表达的提高。PAL是苯丙氨酸代谢途径中的第一关键酶,在植物抗性反应中发挥重要作用,增加果实抗病性。GLU作为细胞水解酶可以分解病原菌细胞壁或菌丝从而减少病原菌的侵害[33]。一般来说,植物防御系统由细胞壁结构成分、植物化学物质和PR组成,Wang Xiaoran等[34]研究表明伯克霍尔德菌(Burkholderia contaminans)处理能显著提高草莓PAL等抗性酶活力。与对照组相比,桂皮醛熏蒸处理能延缓PAL活力的下降,桂皮醛处理的草莓在第1天时GLU活力低于对照组,然而在后期GLU活力快速提高,从而提高草莓抗性。FaPAL和FaGLU基因相对表达水平与PAL和GLU活力的变化基本一致,FaPAL相对表达水平可以反映PAL活力的变化趋势,而FaGLU在后期的表达水平有所提高,可以诱导GLU活力的增加,这一研究结果与Wang Meiyan等[35]的一致。
4 结 论
综上,62.5 µL/L剂量的桂皮醛熏蒸处理3 d对草莓灰霉病的抑制作用最好,草莓的发病程度最小,草莓品质最佳;与对照组相比,桂皮醛熏蒸处理过程中能有效诱导草莓中相关抗性基因的表达,提高草莓CAT、PPO、APX和GLU等相关抗性酶活力,因此推测桂皮醛通过诱导抗性来提高草莓果实的抗病性,从而抑制灰霉病发生。
[1] WEI Y Y, SHAO X F, WEI Y Z, et al. The combined effects of tea tree oil and hot air treatment on the quality and sensory characteristics and decay of strawberry[J]. Postharvest Biology and Technology, 2018,136: 139-144. DOI:10.1016/j.scienta.2018.06.077.
[2] SHAHBAZI Y. Application of carboxymethyl cellulose and chitosan coatings containing Mentha spicata essential oil in fresh strawberries[J]. International Journal of Biological Macromolecules,2018, 112: 264-272. DOI:10.1016/j.ijbiomac.2018.01.186.
[3] 曹婷婷, 高吉良, 陆丹, 等. 草莓灰霉病发病规律及综合防治技术研究进展[J]. 浙江农业科学, 2016, 57(12): 2045-2047. DOI:10.16178/j.issn.0528-9017.20161238.
[4] 郭小磊, 康明丽. 草莓采后灰霉病控制研究进展[J]. 保鲜与加工,2016, 16(2): 108-112. DOI:10.3969/j.issn.1009-6221.2016.02.020.
[5] 秦晓杰, 肖红梅, 罗凯, 等. 水杨酸结合拮抗酵母菌处理对冷藏草莓果实的抗性影响[J]. 食品科学, 2013, 34(18): 290-294. DOI:10.7506/spkx1002-6630-201318060.
[6] JIN P, WANG H Y, ZHANG Y, et al. UV-C enhances resistance against gray mold decay caused by Botrytis cinerea in strawberry fruit[J]. Scientia Horticulturae, 2017, 225: 106-111. DOI:10.1016/j.scienta.2017.06.062.
[7] 王焕宇, 姜璐璐, 王惠源, 等. 短波紫外线对草莓采后腐烂、苯丙烷类代谢和抗氧化活性的影响[J]. 食品科学, 2015, 36(10): 221-226.DOI:10.7506/spkx1002-6630-201510044.
[8] ORO L, FELIZIANI E, CIANIAL M, et al. Volatile organic compounds from Wickerhamomyces anomalus, Metschnikowia pulcherrima and Saccharomyces cerevisiae inhibit growth of decay causing fungi and control postharvest diseases of strawberries[J].International Journal of Food Microbiology, 2018, 265: 18-22.DOI:10.1016/j.ijfoodmicro.2017.10.027.
[9] JANISIEWICZ W J, KORSTEN L. Biological control of postharvest diseases of fruits[J]. Annual Review of Phytopathology, 2002, 40(1):411-441. DOI:10.1146/annurev.phyto.40.120401.130158.
[10] MACÍAS-RUBALCAVA M L, SÁNCHEZ-FERNÁNDEZET R E,OQUE-FLORES G, et al. Volatile organic compounds from Hypoxylon anthochroum endophytic strains as postharvest mycofumigation alternative for cherry tomatoes[J]. Food Microbiology, 2018, 76: 363-373. DOI:10.1016/j.fm.2018.06.014.
[11] MARI M, BAUTISTA-BANOS S, SIVAKUMAR D. Decay control in the postharvest system: role of microbial and plant volatile organic compounds[J]. Postharvest Biology and Technology, 2016, 122: 70-81.DOI:10.1016/j.postharvbio.2016.04.014.
[12] PARAFATI L, VITALE A, RESTUCCIA C, et al. Performance evaluation of volatile organic compounds by antagonistic yeasts immobilized on hydrogel spheres against gray, green and blue postharvest decays[J]. Food Microbiology, 2017, 63: 191-198.DOI:10.1016/j.fm.2016.11.021.
[13] HUANG R, CHE H J, ZHANG J, et al. Evaluation of Sporidiobolus pararoseus strain YCXT3 as biocontrol agent of Botrytis cinerea on post-harvest strawberry fruits[J]. Biological Control, 2012, 62(1): 53-63.DOI:10.1016/j.biocontrol.2012.02.010.
[14] HUANG R, LI G Q, ZHANG J, et al. Control of postharvest Botrytis fruit rot of strawberry by volatile organic compounds of Candida intermedia[J]. Phytopathology, 2011, 101(7): 859-869. DOI:10.1094/PHYTO-09-10-0255.
[15] QIN X J, XIAO H M, CHENG X, et al. Hanseniaspora uvarum prolongs shelf life of strawberry via volatile production[J]. Food Microbiology, 2017, 63: 205-212. DOI:10.1016/j.fm.2016.11.005.
[16] 孙琦. 肉桂醛对黄曲霉菌生长和产毒的影响机制研究[D]. 北京: 中国农业科学院, 2016: 112.
[17] SUWANAMORNLERT P, SANGCHOTE S, CHINSIRIKUL W,et al. Antifungal activity of plant-derived compounds and their synergism against major postharvest pathogens of longan fruit in vitro[J]. International Journal of Food Microbiology, 2018, 271: 8-14.DOI:10.1016/j.ijfoodmicro.2018.02.009.
[18] MATTSON T E, JOHNY A K, AMALARADIOU M A R, et al.Inactivation of Salmonella spp. on tomatoes by plant molecules[J].International Journal of Food Microbiology, 2011, 144(3): 464-468.DOI:10.1016/j.ijfoodmicro.2010.10.035.
[19] HASSANI A, FATHI Z, GHOSTA Y, et al. Evaluation of plant essential oils for control of postharvest brown and gray mold rots on apricot[J]. Journal of Food Safety, 2012, 32(1): 94-101. DOI:10.1111/j.1745-4565.2011.00353.
[20] FATHI Z, HASSANI A, GHOSTA Y, et al. The potential of thyme,clove, cinnamon and ajowan essential oils in inhibiting the growth of Botrytis cinerea and Monilinia fructicola[J]. Journal of Essential Oil Bearing Plants, 2012, 15(1): 38-47. DOI:10.1080/0972060X.2012.10644017.
[21] 余伟, 宋玥, 佘仲露, 等. 拮抗酵母菌挥发物单体对草莓灰霉病的防治效果[J]. 食品科学, 2018, 39(21): 230-236. DOI:10.7506/spkx1002-6630-201821035.
[22] 刘雪梅, 孟宪军, 李斌, 等. 不同解冻方法对速冻草莓品质的影响[J].食品科学, 2014, 35(22): 276-281. DOI:10.7506/spkx1002-6630-201422054.
[23] D’AQUINO S, MISTRIOTIS A, BRIASSOULIS D, et al. Influence of modified atmosphere packaging on postharvest quality of cherry tomatoes held at 20 ℃[J]. Postharvest Biology and Technology, 2016,115: 103-112. DOI:10.1016/j.postharvbio.2015.12.014.
[24] WANG Luyao, DOU Guoxia, GUO Hongna, et al. Volatile organic compounds of Hanseniaspora uvarum increase strawberry fruit flavor and defense during cold storage[J]. Food Science & Nutrition, 2019,7(8): 2625-2635. DOI:10.1002/fsn3.1116.
[25] WANG Lei, JIN Peng, WANG Jing, et al. Hot air treatment induces resistance against blue mold decay caused by Penicillium expansum in sweet cherry (Prunus cerasus L.) fruit[J]. Scientia Horticulturae, 2015,189: 74-80. DOI:10.1016/j.scienta.2015.03.039.
[26] CAI Zikang, YANG Rong, XIAO Hongmei, et al. Effect of preharvest application of Hanseniaspora uvarum on postharvest diseases in strawberries[J]. Postharvest Biology and Technology, 2015, 100: 52-58. DOI:10.1016/j.postharvbio.2014.09.004.
[27] WEI Yingying, SHAO Xingfeng, WEI Yanzhen, et al. Effect of preharvest application of tea tree oil on strawberry fruit quality parameters and possible disease resistance mechanisms[J]. Scientia Horticulturae, 2018, 241: 18-28. DOI:10.1016/j.scienta.2018.06.077.
[28] 张卿, 刘帅, 邢宇, 等. 草莓果实总RNA提取方法的比较[J]. 中国农学通报, 2015, 31(31): 146-149.
[29] 杨艺琳, 张正敏, 李美琳, 等. 2,4-表油菜素内酯对葡萄果实采后灰霉病的抑制作用机理[J]. 食品科学, 2019, 40(15): 231-238.DOI:10.7506/spkx1002-6630-20180821-222.
[30] 张娜娜, 张辉, 马丽, 等. 肉桂醛对番茄采后灰霉病的抑制作用及其对品质的影响[J]. 食品科学, 2014, 35(14): 251-255. DOI:10.7506/spkx1002-6630-201414048.
[31] ROMANAZZI G, SANZANI S M, BI Y, et al. Induced resistance to control postharvest decay of fruit and vegetables[J]. Postharvest Biology and Technology, 2016, 122: 82-94. DOI:10.1016/j.postharvbio.2016.08.003.
[32] AMIL-RUIZ F, BLANCO-PORTALES R, MUNOZ-BLANCO J, et al.The strawberry plant defense mechanism: a molecular review[J]. Plant Cell Physiology, 2011, 52(11): 1873-1903. DOI:10.1093/pcp/pcr136.
[33] 张红印, 马龙传, 姜松, 等. 臭氧结合拮抗酵母对草莓采后灰霉病的控制[J]. 农业工程学报, 2009. 25(5): 258-263. DOI:10.3969/j.issn.1002-6819.2009.05.048.
[34] WANG Xiaoran, SHI Junfeng, WANG Rufu. Effect of Burkholderia contaminans on postharvest diseases and induced resistance of strawberry fruits[J]. The Plant Pathology Journal, 2018, 34(5):403-411. DOI:10.5423/PPJ.OA.02.2018.0031.
[35] WANG Meiyan, ZHAO Lina, ZHANG Xiaoyun, et al. Study on biocontrol of postharvest decay of table grapes caused by Penicillium rubens and the possible resistance mechanisms by Yarrowia lipolytica[J]. Biological Control, 2019, 130: 110-117. DOI:10.1016/j.biocontrol.2018.11.004.