细菌生物被膜是细菌为适应自然环境,通过分泌胞外聚合物(extracellular polymeric substances,EPS),使细菌包裹在分泌物中而形成的大量细菌聚集膜状物,是细菌的一种自我保护性生长方式[1]。van Leeuwenhoek首先在牙齿表面发现细菌形成生物被膜的现象[2]。随着对生物被膜认识的不断深入,研究发现,医疗设备、工业或饮水系统管道以及食品等表面均可以形成细菌生物被膜。同时生物被膜能够保护细菌免受环境胁迫,且对噬菌体、多种化学杀菌剂、宿主免疫系统以及抗生素具有抗性或耐药性[3],因此容易造成环境污染以及人类与动物感染等问题。细菌生物被膜最典型的感染方式是由致病细菌,如铜绿假单胞菌、金黄色葡萄球菌和致病性大肠杆菌等侵染引发的慢性感染,可导致持续性炎症和组织损伤[4]。每年约有570万 人死于致病细菌引起的人类感染性疾病,其中有65%~80%的感染是由可形成生物被膜的细菌引起的[5]。如铜绿假单胞菌是引起囊性纤维化患者严重慢性肺部感染的主要病原体,由铜绿假单胞菌生物被膜引起的肺部损伤,通常会导致患有囊性纤维化的儿童死亡[6]。
细菌能自发产生和释放一些与群体密度相关的信号分子,调控细菌的群体行为,这一调控系统称为群体感应[7]。生物被膜形成是细菌群体感应调控的一种主要表型。细菌合成分泌信号分子,并在周围环境中积累,随着细菌密度的增大,信号分子水平达到临界阈值时,信号分子与受体结合,刺激与生物被膜形成相关基因表达,从而调控细菌生物被膜的形成。群体感应系统在调控细菌生物被膜形成过程中发挥至关重要的作用;因此干扰这种调控作用为控制细菌生物被膜的危害提供了重要靶标[8]。群体感应抑制剂是一类通过影响群体感应系统来干扰细菌生物被膜形成和毒力因子合成等行为的物质。同时,群体感应抑制剂不会对细菌生长产生胁迫,避免了细菌抗药性的产生[9]。对群体感应抑制剂的研究为干扰环境和人类疾病中生物被膜形成的策略提供了重要基础。
1 群体感应对细菌生物被膜形成的调控作用
1.1 细菌生物被膜
细菌包裹在自身产生的胞外基质中,并黏附在惰性或有生命的物体表面,形成生物被膜[10]。对于相同物种的浮游细胞,生物被膜中的细菌具有不同的代谢和基因表达[11-12]。细菌生物被膜由EPS和细菌菌体两部分构成。EPS基质厚度为0.2~1.0 μm,占生物被膜体积的65%~95%,其组成包括蛋白质(>2%(质量分数,下同))、多糖(1%~2%)、DNA(<1%)、RNA(<1%)和水(97%)等,且水分质量分数决定了生物被膜中必需营养物质的流动[13]。细菌生物被膜的形成取决于细菌、附着表面和周围介质三者间的相互作用[14]。
细菌生物被膜的形成一般分为3 个阶段[15]。第1阶段,细菌初始黏附于表面。细菌通过菌毛和鞭毛等附属物或范德华力、静电相互作用等物理作用附着于表面。附着表面的性质是影响细菌附着的重要因素。随着附着表面疏水性的增强,细菌与附着表面之间斥力降低,因此,细菌更容易附着在疏水性和非极性的表面,如聚四氟乙烯和其他塑料等[13]。第2阶段,生物被膜的成熟。当细菌附着在生物或非生物表面并稳定后,细菌开始分泌EPS,这是一个不可逆的过程,EPS连续分泌直到生物被膜完全成熟。完全成熟的生物被膜呈三维塔状结构,内部由小通道组成,输送养分、水和废物[16]。第3阶段,生物被膜的分散。这一阶段,生物被膜内的细菌群落产生不同的糖化酶,并上调鞭毛形成相关蛋白质的表达,帮助细菌释放[13]。生物被膜的分散在生物被膜相关感染中具有重要作用,这是因为细菌从生物被膜中分离出后,通过血液和其他体液扩散到新的感染部位,再次形成生物被膜引起感染[17]。铜绿假单胞菌生物被膜形成的过程如图1所示。
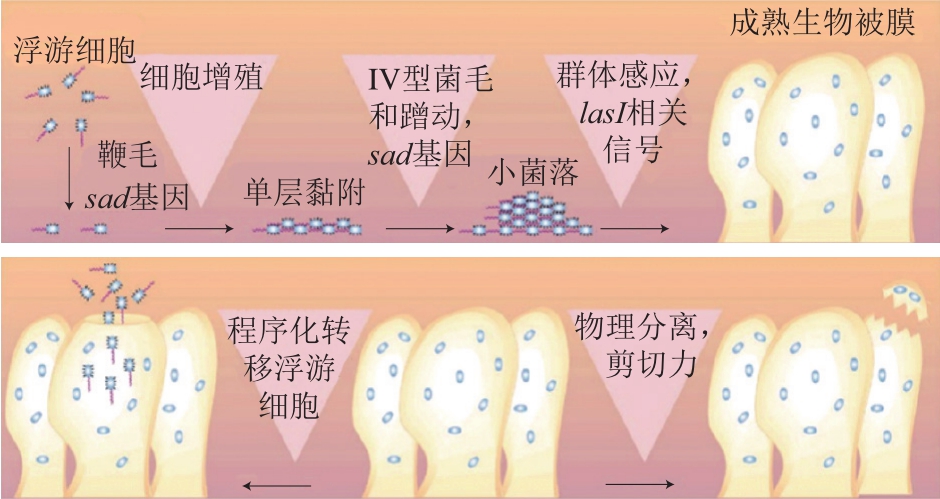
图1 铜绿假单胞菌生物被膜形成过程[18]
Fig. 1 Biofilm formation process of Pseudomonas aeruginosa[18]
1.2 细菌群体感应
细菌在生长过程中,合成并分泌自诱导因子(autoinducer,AI)作为信号分子,AI随着细菌密度的增加而在周围环境中积累,当达到临界阈值水平时,AI通过与受体结合抑制或激活特异性基因的表达,调控相关的生物学功能,这种现象称为细菌的群体感应[19]。群体感应是细菌之间用来沟通和协调相互行为和功能的过程,调控多种生理过程,如生物发光、抗生素的合成、质粒接合转移、生物被膜形成以及毒力因子的产生等[20]。细菌的群体感应主要存在以AI-1、AI-2、AI-3为信号分子的3 种群体感应系统。
1.2.1 以AI-1为信号分子的群体感应系统
革兰氏阳性菌的AI-1为自诱导肽(autoinducing peptides,AIP)。AIP通常是由5~87 个氨基酸组成的线性或环状肽,在某种情况下会通过内酯和硫代内酯键环化起到氨基酸修饰和内酯化作用,从而提高AIP在细胞外环境中的稳定性[21]。AIP在细胞内进行翻译,在跨膜转运前和期间进行修饰,经ATP结合盒(ATP-binding cassette,ABC)转运蛋白运输到细胞外,当细胞外的AIP积累到阈值水平时,双组分传感器激酶检测到AIP,进而引发一系列磷酸化反应,最终导致同源反应调节蛋白磷酸化,磷酸化反应调节蛋白结合DNA的基因启动子区,调节靶基因的转录[22]。
革兰氏阴性菌的AI-1为N-酰基高丝氨酸内酯(N-acyl homoserine lactones,AHL)类物质。不同细菌甚至同一细菌的不同AHL合成系统,其合成的AHL结构不尽相同,酰基碳链长度为4~16个碳原子,通常是以2 个碳原子为基本单元(如C4、C6和C8等)[23]。AHL是由AHL合成酶LuxI家族蛋白以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)和酰基载体蛋白为底物,将与酰基载体蛋白结合的脂肪酰基衍生物转移到SAM的氨基上进行合成[15]。当AHL浓度达到临界阈值时,AHL与LuxR家族的DNA结合受体蛋白相互作用形成AHL-LuxR复合体,AHL-LuxR复合体再与DNA的基因启动子区结合,启动下游基因的表达。早期研究发现,来自海洋的费氏弧菌中含有发光基因lux,其群体感应信号分子为N-3-氧代己酰基-1-高丝氨酸内酯(N-3-oxohexanoyl-1-homoserine lactone,3OC6-HSL),luxI基因编码3OC6-HSL合成所需的自诱导合成酶LuxI,luxR基因编码3OC6-HSL的反应转录激活因子LuxR[24]。
1.2.2 以AI-2为信号分子的群体感应系统
AI-2群体感应系统最早在哈维弧菌中被发现,是一些革兰氏阳性菌和阴性菌产生的群体感应信号,涉及种间交流,AI-2为呋喃酰硼酸二酯,由luxS基因合成,luxS基因存在于大量细菌中[25]。AI-2合成涉及2 个主要的酶促步骤。首先,由pfs基因编码的甲硫腺苷核苷酶去除S-腺苷同型半胱氨酸(S-adenosyl-homocysteine,SAH)的腺嘌呤,生成S-核糖同型半胱氨酸(S-ribosyl homocysteine,SRH);然后,由luxS基因编码的SRH酶将SRH转化为同型半胱氨酸和4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD);最后,DPD自发重新排列形成AI-2[26]。
1.2.3 以AI-3为信号分子的群体感应系统
AI-3是一种芳香化合物,其结构未被准确描述,与肾上腺素/去甲肾上腺素具有交叉作用,构成AI-3/肾上腺素/去甲肾上腺素信号级联系统。AI-3/肾上腺素/去甲肾上腺素信号级联系统存在于一些细菌中,例如志贺氏菌、沙门氏菌、欧文氏杆菌、多杀巴斯德杆菌、流感嗜血杆菌、胸膜肺炎放线杆菌、青紫色素杆菌、柯氏杆菌、耶尔森氏鼠疫杆菌、土拉热杆菌和青枯雷尔氏菌[27]。肠出血性大肠杆菌可感知AI-3(正常肠道菌群产生)和肾上腺素/去甲肾上腺素(宿主产生),激活肠细胞脱落位点毒力岛基因和鞭毛调节因子的表达。
1.3 群体感应对细菌生物被膜的调控
群体感应是细菌生物被膜形成的调控途径之一,其通过调节鞭毛、胞外多糖、黏附素、表面活性剂等物质的合成基因从而影响细菌生物被膜的形成。铜绿假单胞菌、金黄色葡萄球菌、大肠杆菌作为主要的细菌被膜侵染菌,已被广泛用于群体感应对细菌生物被膜调控作用的研究中。
1.3.1 铜绿假单胞菌
大多数慢性细菌感染是由于生物被膜的形成,慢性肺部感染是患有囊性纤维化患者的常见感染,也是典型的生物被膜疾病。铜绿假单胞菌是主要的囊性纤维化病原菌之一[28]。由于囊性纤维化基因缺陷导致肺部上皮细胞顶膜的氯离子通道丢失,有利于铜绿假单胞菌的定植,造成肺部持续的细菌感染,引起肺损伤。
铜绿假单胞菌具有3 个主要的群体感应系统,分别是lasI/lasR系统、rhlI/rhlR系统以及基于喹诺酮信号(Pseudomonas aeruginosa quinolone signal,PQS)的群体感应系统[29](图2)。lasI/lasR系统的信号分子为N-(3-氧代十二烷酰基)-L-高丝氨酸内酯(N-(3-oxododecanoyl)-L-homoserine lactone,3-oxo-C12-HSL),其激活lasI、lasB、lasA、toxA基因的表达;rhlI/rhlR系统的信号分子为N-丁酰基-L-高丝氨酸内酯(N-butyryl-L-homoserine lactone,C4-HSL),其激活rhlI、rhlAB基因的表达,rhlAB编码鼠李糖脂(热稳定的溶血素)合成所需的鼠李糖基转移酶[30-31]。las系统和rhl系统之间相互联系,las系统通过2 种方式控制rhl系统:LasR和3-oxo-C12-HSL的复合物激活rhlR基因的转录;以及3-oxo-C12-HSL阻止C4-HSL与RhlR结合,从而抑制rhlAB的表达[31]。PQS系统的信号分子为2-庚基-3-羟基-4-喹诺酮,属于2-烷基-4-喹诺酮家族,其前体为2-庚基-4-喹诺酮(2-heptyl-4-quinolone,HHQ),2-庚基-3-羟基-4-喹诺酮的合成由pqsABCDE操纵子编码。3-oxo-C12-HSL-LasR复合物正向调控PqsR转录调节器,PqsR结合pqsABCDE基因的启动子,pqsABCDE基因产物指导HHQ的合成,HHQ通过PqsH的作用转化为2-庚基-3-羟基-4-喹诺酮[32]。PQS系统也会调控RhlR和RhlI的表达,从而影响C4-HSL的积累,las和rhl系统对pqsR调节起拮抗作用,因此,pqsABCDE的表达取决于3-oxo-C12-HSL和C4-HSL之间的比例[32]。
群体感应信号分子3-oxo-C12-HSL是铜绿假单胞菌生物被膜形成所必需的,阻止3-Oxo-C12-HSL的合成会导致铜绿假单胞菌生物被膜的分化受阻,形成异常的生物被膜[33]。铜绿假单胞菌主要产生3 种胞外多糖:藻酸盐、Pel和Psl,它们对生物被膜形成和对抗生素抗性具有关键作用。rhl系统可以正向调控Pel多糖的生物合成;LasR通过结合到psl操纵子的启动子区域,从而调节Psl多糖的生物合成;PQS系统与生物被膜形成过程中的eDNA(与野生型生物被膜形成相关)释放相关,pqsA突变体形成的生物被膜含有更少的eDNA[34]。这些结果表明,铜绿假单胞菌生物被膜的形成受到已知的3 个群体感应系统调控。此外,鼠李糖脂可作为生物表面活性剂和毒力因子,其在rhl系统控制下合成,在铜绿假单胞菌生物被膜的形成中发挥多种作用,促进铜绿假单胞菌生物被膜中三维蘑菇状结构的形成,但鼠李糖脂的过量合成会导致生物被膜的分散。铜绿假单胞菌生物被膜的形成除了受到群体感应系统的调控,还受到第2信使双-(3’-5’)-环二聚鸟苷单磷酸(bis-(3’-5’)-cyclic dimeric guanosine monophosphate,C-di-GMP)的调控,高水平的C-di-GMP通过促进多糖(藻酸盐和Pel)的生物合成从而促进生物被膜的形成,低水平的C-di-GMP通过增强鞭毛形成和细菌分散从而引起生物被膜的分散[35]。
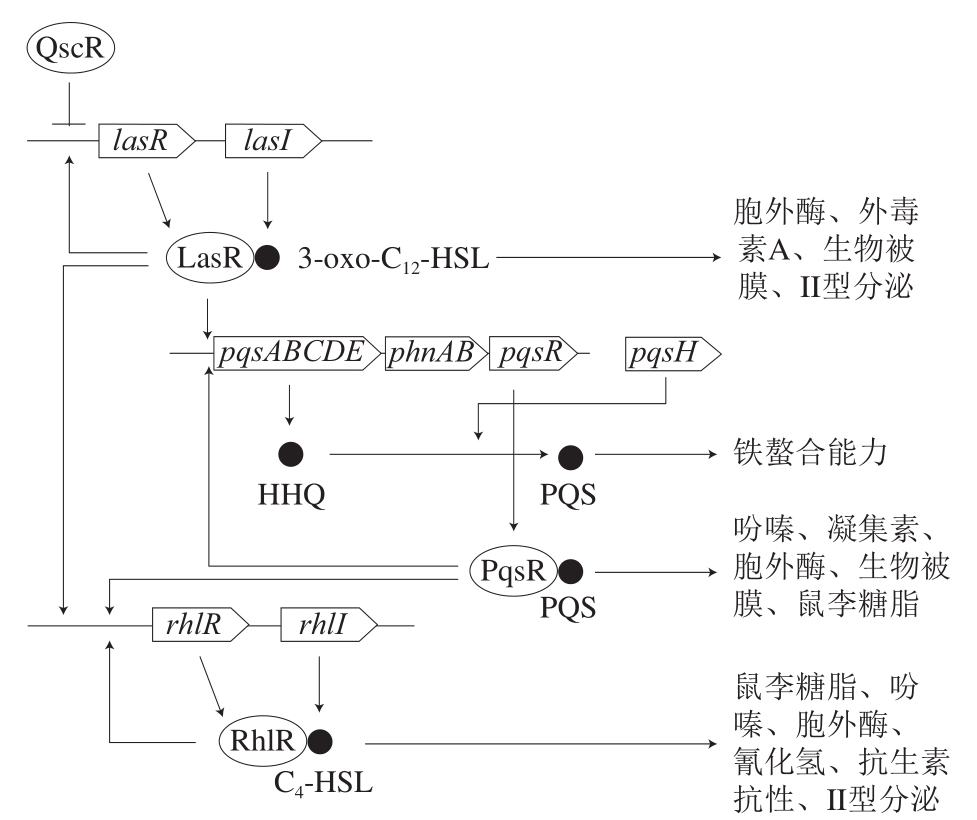
图2 铜绿假单胞菌的群体感应系统[36]
Fig. 2 Quorum sensing circuits in Pseudomonas aeruginosa[36]
1.3.2 金黄色葡萄球菌
金黄色葡萄球菌为革兰氏阳性菌,能够产生多种细胞表面毒力因子和外毒素,在人体组织和医疗设备表面定植并形成生物被膜,导致严重的医疗问题。金黄色葡萄球菌产生的生物被膜相关感染包括牙周炎、慢性鼻窦炎、眼部感染、慢性伤口感染、骨髓炎、心内膜炎和住院医疗设备污染等[37-38]。
金黄色葡萄球菌毒力因子的产生以及生物被膜的形成主要是受到由信号分子AIP介导的agr群体感应系统的调控(图3)。agr基因由2 个分开的转录单元RNAII和RNAIII组成,分别从P2和P3启动子上启动转录[37]。P2驱动的操纵子包含agrBDCA基因,agrD编码的产物经过AgrB修饰,在内部半胱氨酸和羧基末端之间形成环状硫代内酯键,从而形成特征性含硫代内酯的AIP,AIP激活双组分AgrC/AgrA调节系统,跨膜蛋白AgrC(组氨酸激酶)与细胞外AIP结合,AgrC磷酸化后激活细胞内AgrA蛋白;P3驱动的操纵子编码δ-溶血素(hld基因编码),RNAIII上调包括TS-1和其他溶血素等毒力因子的转录,并降低以纤连蛋白结合蛋白A为主的几种表面黏附素的表达[22]。
Vuong等[39]研究105 株金黄色葡萄球菌菌株agr系统与其对聚苯乙烯表面黏附能力的相关性,发现约有78%的agr阴性菌株和6%的agr阳性菌株形成了生物被膜,证明agr基因对生物被膜的形成有很重要的影响。agr对生物被膜的影响不是由自溶素或细胞间黏附素的合成引起的,而是取决于毒素的表面活性剂性质。群体感应对表面活性剂分子表达的调控对生物被膜成熟过程至关重要。这些表面活性剂通过破坏生物被膜细胞与基质成分间的非共价相互作用,导致生物被膜扩散。δ-溶血素具有表面活性剂的作用,由agr系统调控合成,可能有助于细胞从金黄色葡萄球菌生物被膜上脱离[40]。酚溶性调节蛋白(phenol-soluble modulin,PSM)是具有α-螺旋结构的两亲性葡萄球菌肽,具有表面活性剂特性,psm操纵子的转录受AgrA反应调节蛋白严格控制,psm基因的表达促进了生物被膜通道的形成、生物被膜分散和再生等过程[41]。由于agr基因的表达,从生物被膜中脱落的细胞不仅可以在宿主中建立其他感染位点,而且还可能导致与急性金黄色葡萄球菌感染相关的毒血症。因此,抑制agr基因的表达,通常导致黏附素因子表达的增加以及分散因子表达的降低,从而导致急性感染转化为慢性感染。

图3 金黄色葡萄球菌的agr型群体感应系统[42]
Fig. 3 agr quorum sensing system in Staphylococcus aureus[42]
此外,金黄色葡萄球菌还具有其他的群体感应系统,如sae系统参与毒力因子的调控,sae突变体产生的溶血素和凝固酶明显减少;arl系统抑制溶血素和外切酶的产生,调节自溶活性以及金黄色葡萄球菌的多药外排泵NorA;srr系统调节能量代谢过程,该系统的信号分子可能是甲萘醌,一种氧化呼吸途径的中间体[40]。
1.3.3 大肠杆菌
大肠杆菌为革兰氏阴性菌,是引起复发性尿路感染、脑膜炎、败血症和出血性结肠炎等疾病以及医疗器械感染的主要细菌[43-44]。大肠杆菌运动性、生物被膜形成、毒力因子产生等相关基因的表达与群体感应系统的调控密切相关。由旋转鞭毛介导的细菌运动是生物被膜形成的关键特征,细菌运动到固体表面定植并进一步形成生物被膜;鞭毛是细菌最初到达固体表面所必需的,随后鞭毛物理黏附在固体表面[45]。大肠杆菌中不含有编码AHL合成酶的luxI基因,因此无法合成AHL,但菌体自身含有LuxR同源物SdiA,可响应环境中其他细菌产生的AHL以调节uvrY(毒力因子调控)和csrA(负责细菌的运动性和鞭毛的生物合成)等基因的表达,从而促进大肠杆菌生物被膜形成、运动性和毒力因子的合成[46]。大肠杆菌luxS基因合成AI-2[47]。AI-2合成后被释放到细胞外环境中,当达到临界阈值时,通过转运蛋白LsrABCD(一种ABC转运蛋白)进入细胞,然后AI-2被LsrK激酶磷酸化,磷酸化AI-2结合同源转录调节因子LsrR并抑制基因表达(图4)[48]。肠道致病性大肠杆菌还可利用AI-3群体感应系统控制黏附素和其他毒力因子的合成。

图4 大肠杆菌的LsrR/AI-2型群体感应系统[48]
Fig. 4 LsrR/AI-2 quorum sensing system in E. coli[48]
Bai等[46]研究N-丁酰高丝氨酸内酯和N-己酰高丝氨酸内酯对大肠杆菌生物被膜形成(附着能力和EPS产生)的影响,发现1 μmol/mL的N-丁酰高丝氨酸内酯和N-己酰高丝氨酸内酯均可以增强大肠杆菌对固体表面的附着力和提高EPS产生量,促进生物被膜的形成。近年的研究发现,大肠杆菌生物被膜中的胞外多糖主要为β-1,6-N-乙酰基-D-葡糖胺聚合物(β-1,6-N-acetyl-D-glucosamine polymer,PGA)、纤维素和荚膜异多糖酸这3 种。PGA介导细胞间黏附和附着于表面帮助生物被膜的形成;纤维素介导形成刚性生物被膜;荚膜异多糖酸在细菌细胞周围形成囊并保护它们免受恶劣环境的影响,但同时也有抑制生物被膜形成的作用[44]。有研究表明,AI-2与LsrR结合,协调荚膜异多糖酸合成调节基因wza和flu的相互作用,介导生物被膜的形成。在lsrR和lsrK突变体中,大肠杆菌生物被膜的形成和结构被显著改变,与野生型相比,突变体细菌菌毛和EPS结构以及厚度存在差异[3]。抑制AI-2合成必需的甲硫腺苷核苷酶表达干扰了大肠杆菌生物被膜形成并减弱了毒力因子的合成[49]。这些结果表明,群体感应系统对大肠杆菌生物被膜的形成不可或缺。
2 群体感应抑制剂干扰细菌生物被膜形成的研究
细菌引起的感染由于生物被膜的形成难以根除,常规抗生素(如头孢菌素、亚胺培南、庆大霉素、林可霉素)较难渗透,使细胞对抗生素的敏感性下降,因此,迫切需要寻找替代抗生素的物质来治疗细菌生物被膜引起的感染。群体感应抑制剂是一类以群体感应系统为靶标,干扰细菌生物被膜形成、毒力因子产生或致病基因表达的物质,与传统抗生素不同的是,在不影响细菌生长的情况下,可以特异性地抑制细菌致病性状的表达,最大限度减少耐药突变体的出现[9]。群体感应抑制剂通过不同机制干扰细菌生物被膜的形成,主要包括:1)抑制信号分子合成;2)酶解信号分子;3)利用信号分子类似物与信号分子竞争结合受体[5](图5)。这些具有生物活性的群体感应抑制剂的使用,通过破坏生物被膜和减少抗生素剂量优化了感染性疾病治疗的效果。
2.1 抑制信号分子合成
AHL以SAM和酰基载体蛋白为底物合成,因此,可以将SAM合成的抑制剂用作AHL的群体感应抑制剂。SAH、5-甲基硫代腺苷(5-methyl thioadenosine,MTA)等SAM类似物和环亮氨酸等SAM生物合成抑制剂均可以抑制AHL的合成。抑制AHL合成过程中某一种酶的活性,也可阻断AHL的合成。Christensen等[50]研究发现,色氨酸衍生物吲哚-3-乙酸(即植物激素生长素)可抑制鼻疽伯克霍尔德氏菌AHL合成酶BmaI1的活性。由于甲硫腺苷核苷酶和SRH酶是AI-2信号分子合成中的关键酶,且仅存在于细菌中,因此可以作为群体感应抑制剂的靶标,从而抑制AI-2信号分子的合成[51]。有研究发现,Ambuic acid是一种真菌次生代谢物,它可以通过抑制AgrB合酶的活性,进而抑制不同革兰氏阳性菌(如金黄色葡萄球菌和单核增生李斯特菌)AIP的生物合成[52]。
2.2 酶解信号分子
信号分子合成后,对其酶解可防止其积累和激活群体感应系统。降解群体感应信号分子的酶称为群体猝灭(quorum quenching,QQ)酶。常见的芽孢杆菌属、铜绿假单胞菌、不动杆菌属、代尔夫特食酸菌、鞘氨醇单胞菌属、根癌农杆菌、节杆菌属和肺炎克雷伯菌均可以产生能够降解AHL的酶。目前,关于降解AIP和AI-2的QQ酶研究较少。
AHL降解主要有以下4 种方式:AHL内酰胺酶和AHL酰基酶分别水解AHL的高丝氨酸内酯环和酰胺键;AHL氧化酶和还原酶修饰AHL改变其活性[26]。其中AHL的内酯分解是最典型的一种信号分子酶解方式,通过添加水分子,AHL在水溶液中可自发打开内酯环,且在高温和碱性条件下,酯解更易发生[53]。Gui Meng等[54]研究AHL内酯酶AiiAAI96对维氏气单胞菌LP-11群体感应系统的猝灭作用,发现AiiAAI96通过酶解作用使维氏气单胞菌LP-11产生的AHLs失活,从而抑制群体感应系统,导致维氏气单胞菌LP-11的蛋白酶活性和运动性降低。Vanelslander等[55]研究发现,来自底栖硅藻透明带的天然卤过氧化物酶通过H2O2依赖的方式降解AHL侧链的卤代基团,从而使AHL失活。虽然降解信号分子的酶有很多种,但这些酶存在活性偏低、活性受环境影响较大、且专一性不够高等缺点,因此,仍需要进一步对群体感应信号分子降解酶进行筛选和改性研究[56]。
2.3 信号分子类似物
AIP的截短类似物、修饰AHL酰基侧链和内酯后形成的AHL类似物以及AI-2和DPD类似物,可以竞争性地抑制信号分子与受体结合,从而阻断群体感应通路的激活。卤代呋喃酮与AHL结构相似,可参与铜绿假单胞菌群体感应的rhl系统,影响生物被膜形成相关基因的表达,改变生物被膜的结构,促进细菌从生物被膜中脱落。Chang Yiqun等[57]设计合成了带烷基链、乙烯基溴和芳香环的呋喃酮类物质,研究其对铜绿假单胞菌生物被膜的抑制率,发现C5芳香族取代的呋喃酮对铜绿假单胞菌生物被膜形成以及毒力因子的产生具有显著抑制作用。间溴硫代内酯(meta-bromo-thiolactone,mBTL)为AHL的类似物,可引起LuxR受体的构象变化,削弱LuxR受体与RNA聚合酶的相互作用,降低LuxR受体的转录激活电位,从而抑制铜绿假单胞菌毒力因子基因的表达,阻止生物被膜的形成[58]。Vuong等[39]通过合成表皮葡萄球菌的信号分子及其衍生物抑制了金黄色葡萄球菌RN6390的agr系统激活,发现其与聚苯乙烯塑料的黏附性降低。但这些结果表明,群体感应抑制剂在抗金黄色葡萄球菌治疗中的应用仅限于急性感染,将急性感染转化为慢性感染。Roy等[59]证明了AI-2类似物异丁基-DPD可以显著抑制体外培养大肠杆菌生物被膜的成熟,并且异丁基-DPD与抗生素庆大霉素联合使用可以清除已形成的大肠杆菌生物被膜。使用群体感应抑制剂与传统抗生素治疗相结合的方法为清除细菌生物被膜提供了新的途径。
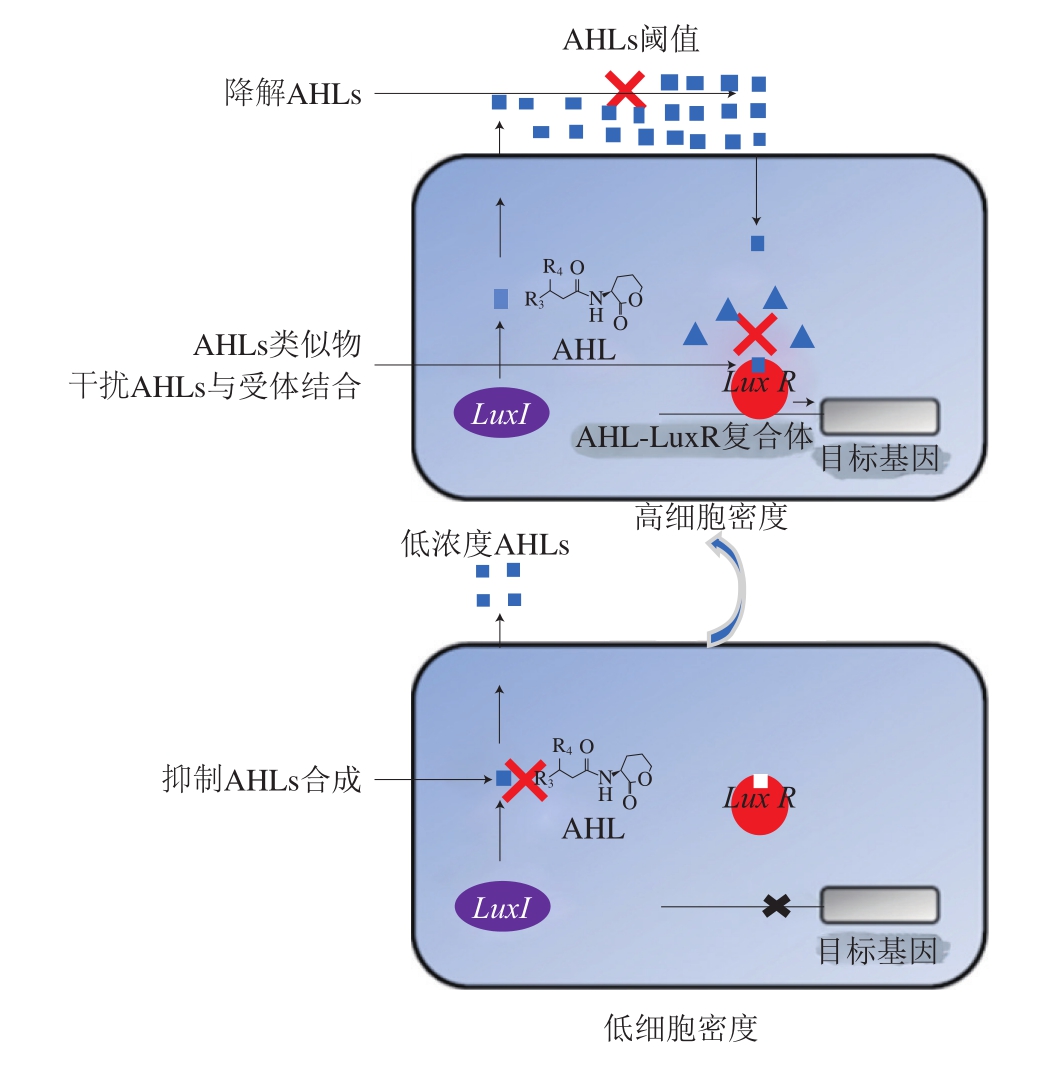
图5 群体感应抑制剂机制示意图[60]
Fig. 5 Schematic diagram of the mechanism underlying quorum sensing inhibition[60]
3 结 语
由于生物被膜可以保护细菌在恶劣环境中生存,常规的抗生素和杀菌剂不能穿透胞外基质,导致细菌对抗生素和杀菌剂敏感性下降,因此与生物被膜相关的污染在环境、食品以及人类与动物感染性疾病方面造成了严重的问题。群体感应是调控细菌生物被膜形成的关键。尽管目前关于群体感应调控生物被膜的形成、成熟和分散过程的机制尚不清晰,但已提出群体感应抑制剂可作为新型抗生物被膜剂。目前,许多已知的群体感应抑制剂具有细胞毒性,但对其抑制群体感应系统的机理知之甚少,并且这些群体感应抑制剂的安全性有待进一步探究。因此,需要进行更深入的研究以确定群体感应抑制剂在生物被膜形成、维持和扩散中的作用,结合体内以及临床实验,开发低毒、高活性的群体感应抑制剂,为未来在细菌感染的治疗中提供更大的应用价值。
[1] 朱欣娜, 史贤明. 病原菌菌膜形成相关基因的研究进展[J]. 上海交通大学学报(农业科学版), 2009, 27(5): 535-539.
[2] DONLAN R M. Biofilms: microbial life on surfaces[J]. Emerging Infectious Diseases, 2002, 8(9): 881-890. DOI:10.3201/eid0809.020063.
[3] VU B, CHEN Miao, CRAWFORD R J, et al. Bacterial extracellular polysaccharides involved in biofilm formation[J]. Molecules, 2009,14(7): 2535-2554. DOI:10.3390/molecules14072535.
[4] HØIBY N, BJARNSHOLT T, GIVSKOV M, et al. Antibiotic resistance of bacterial biofilms[J]. International Journal of Antimicrobial Agents,2010, 35(4): 322-332. DOI:10.1016/j.ijantimicag.2009.12.011.
[5] KALIA V C, PATEL S K S, KANG Y C, et al. Quorum sensing inhibitors as antipathogens: biotechnological applications[J].Biotechnology Advances, 2019, 37(1): 68-90. DOI:10.1016/j.biotechadv.2018.11.006.
[6] ANWAR H, COSTERTON J W. Enhanced activity of combination of tobramycin and piperacillin for eradication of sessile biofilm cells of Pseudomonas aeruginosa[J]. Antimicrobial Agents and Chemotherapy,1990, 34(9): 1666-1671. DOI:10.1128/AAC.34.9.1666.
[7] 李军, 张旭, 马长伟, 等. 群体感应信号肽介导的产细菌素乳杆菌在发酵肠中的应用[J]. 中国农业大学学报, 2015, 20(6): 256-262.DOI:10.11841/j.issn.1007-4333.2015.06.33.
[8] DOBRETSOV S, TEPLITSKI M, PAUL V. Mini-review: quorum sensing in the marine environment and its relationship to biofouling[J].Biofouling, 2009, 25(5): 413-427. DOI:10.1080/08927010902853516.
[9] 郭冰怡, 董燕红. 细菌群体感应抑制剂研究进展[J]. 农药学学报,2018, 20(4): 408-424. DOI:10.16801/j.issn.1008-7303.2018.0054.
[10] ELIAS S, BANIN E. Multi-species biofilms: living with friendly neighbors[J]. FEMS Microbiology Reviews, 2012, 36(5): 990-1004.DOI:10.1111/j.1574-6976.2012.00325.x.
[11] TURKINA M V, VIKSTRÖM E. Bacteria-host crosstalk: sensing of the quorum in the context of Pseudomonas aeruginosa infections[J]. Journal of Innate Immunity, 2019, 11(3): 263-279.DOI:10.1159/000494069.
[12] 刘蕾, 武瑞赟, 李军, 等. 基于AI-2介导的类植物乳杆菌生物被膜态与浮游态抗胁迫能力比较与分析[J]. 食品科学, 2017, 38(22): 41-47.DOI:10.7506/spkx1002-6630-201722007.
[13] JAMAL M, AHMAD W, ANDLEEB S, et al. Bacterial biofilm and associated infections[J]. Journal of the Chinese Medical Association,2018, 81(1): 7-11. DOI:10.1016/j.jcma.2017.07.012.
[14] VAN HOUDT R, MICHIELS C W. Biofilm formation and the food industry, a focus on the bacterial outer surface[J]. Journal of Applied Microbiology, 2010, 109(4): 1117-1131. DOI:10.1111/j.1365-2672.2010.04756.x.
[15] PARSEK M R, GREENBERG E P. Sociomicrobiology: the connections between quorum sensing and biofilms[J]. Trends in Microbiology, 2005, 13(1): 27-33. DOI:10.1016/j.tim.2004.11.007.
[16] ROY R, TIWARI M, DONELLI G, et al. Strategies for combating bacterial biofilms: a focus on anti-biofilm agents and their mechanisms of action[J]. Virulence, 2018, 9(1): 522-554. DOI:10.1080/21505594.2017.1313372.
[17] OTTO M. Staphylococcal infections: mechanisms of biofilm maturation and detachment as critical determinants of pathogenicity[J].Annual Review of Medicine, 2013, 64: 175-188. DOI:10.1146/annurev-med-042711-140023.
[18] COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999,284: 1318-1322. DOI:10.1126/science.284.5418.1318.
[19] ABISADO R G, BENOMAR S, KLAUS J R, et al. Bacterial quorum sensing and microbial community interactions[J]. mBio, 2018, 9(3):e02331-17. DOI:10.1128/mBio.01749-18.
[20] JUHAS M, EBERL L, TÜMMLER B. Quorum sensing: the power of cooperation in the world of Pseudomonas[J]. Environmental Microbiology, 2005, 7(4): 459-471. DOI:10.1111/j.1462-2920.2005.00769.x.
[21] IRIE Y, PARSEK M R. Quorum sensing and microbial biofilms[M]//ROMEO T. Bacterial biofilms. Heidelberg: Springer, 2008: 67-84.
[22] MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 2001, 55(1): 165-199. DOI:10.1146/annurev.micro.55.1.165.
[23] FUQUA C, GREENBERG E P. Listening in on bacteria: acylhomoserine lactone signaling[J]. Nature Reviews Molecular Cell Biology, 2002, 3(9): 685-695. DOI:10.1038/nrm907.
[24] WHITELEY M, DIGGLE S P, GREENBERG E P. Progress in and promise of bacterial quorum sensing research[J]. Nature, 2017, 551:313-320. DOI:10.1038/nature25977.
[25] LIU Lei, WU Ruiyun, ZHANG Jinlan, et al. D-Ribose interferes with quorum sensing to inhibit biofilm formation of Lactobacillus paraplantarum L-ZS9[J]. Frontiers in Microbiology, 2017, 8: 1860.DOI:10.3389/fmicb.2017.01860.
[26] BRACKMAN G, COENYE T. Quorum sensing inhibitors as antibiofilm agents[J]. Current Pharmaceutical Design, 2015, 21(1): 5-11.DOI:10.1111/j.1574-6968.2005.00001.x.
[27] READING N C, SPERANDIO V. Quorum sensing: the many languages of bacteria[J]. FEMS Microbiology Letter, 2006, 254(1):1-11. DOI:10.1111/j.1574-6968.2005.00001.x.
[28] CIOFU O, TOLKER-NIELSEN T, JENSEN P Ø, et al. Antimicrobial resistance, respiratory tract infections and role of biofilms in lung infections in cystic fibrosis patients[J]. Advanced Drug Delivery Reviews, 2015, 85: 7-23. DOI:10.1016/j.addr.2014.11.017.
[29] THOMPSON L S, WEBB J S, RICE S A, et al. The alternative sigma factor RpoN regulates the quorum sensing gene rhlI in Pseudomonas aeruginosa[J]. FEMS Microbiology Letter, 2003, 220(2): 187-195.DOI:10.1016/S0378-1097(03)00097-1.
[30] ANGUIGE K, KING J R, WARD J P. A multi-phase mathematical model of quorum sensing in a maturing Pseudomonas aeruginosa biofilm[J]. Mathematical Biosciences, 2006, 203(2): 240-276.DOI:10.1016/j.mbs.2006.05.009.
[31] PESCI E C, PEARSON J P, SEED P C, et al. Regulation of las and rhl quorum sensing in Pseudomonas aeruginosa[J]. Journal of Bacteriology, 1997, 179(10): 3127-3132. DOI:10.1128/jb.179.10.3127-3132.1997.
[32] DUBERN J, DIGGLE S P. Quorum sensing by 2-alkyl-4-quinolones in Pseudomonas aeruginosa and other bacterial species[J]. Molecular Biosystems, 2008, 4(9): 882-888. DOI:10.1039/b803796p.
[33] DAVIES D G, PARSEK M R, PEARSON J P, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm[J]. Science, 1998, 280(5361): 295-298. DOI:10.1126/science.280.5361.295.
[34] RASAMIRAVAKA T, LABTANI Q, DUEZ P, et al. The formation of biofilms by Pseudomonas aeruginosa: a review of the natural and synthetic compounds interfering with control mechanisms[J]. BioMed Research International, 2015: 759348. DOI:10.1155/2015/759348.
[35] HENGGE R. Principles of C-di-GMP signalling in bacteria[J].Nature Reviews Microbiology, 2009, 7(4): 263-273. DOI:10.1038/nrmicro2109.
[36] TASHIRO Y, YAWATA Y, TOYOFUKU M, et al. Interspecies interaction between Pseudomonas aeruginosa and other microorganisms[J]. Microbes and Environments, 2013, 28(1): 13-24.DOI:10.1264/jsme2.ME12167.
[37] YARWOOD J M, BARTELS D J, VOLPER E M, et al. Quorum sensing in Staphylococcus aureus biofilms[J]. Journal of Bacteriology,2004, 186(6): 1838-1850. DOI:10.1128/JB.186.6.1838-1850.2004.
[38] WOLSKA K I, GRUDNIAK A M, RUDNICKA Z, et al. Genetic control of bacterial biofilms[J]. Journal of Applied Genetics, 2016,57(2): 225-238. DOI:10.1007/s13353-015-0309-2.
[39] VUONG C, SAENZ H L, GÖTZ F, et al. Impact of the agr quorumsensing system on adherence to polystyrene in Staphylococcus aureus[J]. The Journal of Infectious Diseases, 2000, 182(6): 1688-1693. DOI:10.1086/317606.
[40] YARWOOD J M, SCHLIEVERT P M. Quorum sensing in Staphylococcus infections[J]. The Journal of Clinical Investigation,2003, 112(11): 1620-1625. DOI:10.1172/JCI200320442.
[41] PERIASAMY S, JOO H, DUONG A C, et al. How Staphylococcus aureus biofilms develop their characteristic structure[J]. Proceedings of the National Academy of Sciences of the United States of America,2012, 109(4): 1281-1286. DOI:10.1073/pnas.1115006109.
[42] SALAM A M, QUAVE C L. Targeting virulence in Staphylococcus aureus by chemical inhibition of the accessory gene regulator system in vivo[J]. mSphere, 2018, 3(1): e00500-171. DOI:10.1128/mSphere.00500-17.
[43] NIZALAPUR S, KIMYON O, YEE E, et al. Synthesis and biological evaluation of novel acyclic and cyclic glyoxamide based derivatives as bacterial quorum sensing and biofilm inhibitors[J]. Organic &Biomolecular Chemistry, 2017, 15(27): 5743-5755. DOI:10.1039/c7ob01011g.
[44] SHARMA G, SHARMA S, SHARMA P, et al. Escherichia coli biofilm: development and therapeutic strategies[J]. Journal of Applied Microbiology, 2016, 121(2): 309-319. DOI:10.1111/jam.13078.
[45] WITSØ I L, BENNECHE T, VESTBY L K, et al. Thiophenone and furanone in control of Escherichia coli O103:H2 virulence[J].Pathogens and Disease, 2014, 70(3): 297-306. DOI:10.1111/2049-632X.12128.
[46] BAI J A, RAI R V. Effect of small chain N-acyl homoserine lactone quorum sensing signals on biofilms of food-borne pathogens[J].Journal of Food Science and Technology, 2016, 53(9): 3609-3614.DOI:10.1007/s13197-016-2346-1.
[47] REN Dacheng, SIMS J J, WOOD T K. Inhibition of biofilm formation and swarming of Escherichia coli by (5Z)-4-bromo-5(bromomethylene)-3-butyl-2(5H)-furanone[J]. Environmental Microbiology, 2001, 3(11): 731-736. DOI:10.1046/j.1472-765x.2002.01087.x.
[48] LI Jun, ATTILA C, WANG Liang, et al. Quorum sensing in Escherichia coli is signaled by AI-2/LsrR: effects on small RNA and biofilm architecture[J]. Journal of Bacteriology, 2007, 189(16): 6011-6020. DOI:10.1128/JB.00014-07.
[49] HAN Tian, LI Yanhua, SHAN Qiuli, et al. Characterization of S-adenosylhomocysteine/methylthioadenosine nucleosidase on secretion of AI-2 and biofilm formation of Escherichia coli[J].Microbial Pathogenesis, 2017, 108: 78-84. DOI:10.1016/j.micpath.2017.05.015.
[50] CHRISTENSEN Q H, GROVE T L, BOOKER S J, et al. A highthroughput screen for quorum-sensing inhibitors that target acylhomoserine lactone synthases[J]. Proceedings of the National Academy of Sciences, 2013, 110(34): 13815-13820. DOI:10.1073/pnas.1313098110.
[51] 刘蕾, 桂萌, 武瑞赟, 等. LuxS/AI-2型群体感应系统调控细菌生物被膜形成研究进展[J]. 食品科学, 2016, 37(19): 254-262. DOI:10.7506/spkx1002-6630-201619043.
[52] NAKAYAMA J, UEMURA Y, NISHIGUCHI K, et al. Ambuic acid inhibits the biosynthesis of cyclic peptide quormones in gram-positive bacteria[J]. Antimicrobial Agents and Chemotherapy, 2009, 53(2):580-586. DOI:10.1128/AAC.00995-08.
[53] GRANDCLÉMENT C, TANNIÈRES M, MORÉRA S, et al. Quorum quenching: role in nature and applied developments[J]. FEMS Microbiology Reviews, 2016, 40(1): 86-116. DOI:10.1093/femsre/fuv038.
[54] GUI Meng, WU Ruiyun, LIU Lei, et al. Effects of quorum quenching by AHL lactonase on AHLs, protease, motility and proteome patterns in Aeromonas veronii LP-11[J]. International Journal of Food Microbiology, 2017, 252: 61-68. DOI:10.1016/j.ijfoodmicro.2017.04.005.
[55] VANELSLANDER B, PAUL C, GRUENEBERG J, et al. Daily bursts of biogenic cyanogen bromide (BrCN) control biofilm formation around a marine benthic diatom[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(7):2412-2417. DOI:10.1073/pnas.1108062109.
[56] 齐莉莉, 陈炳, 王进波. 群体感应抑制剂研究进展[J]. 生命的化学,2016, 36(3): 311-314. DOI:10.13488/j.smhx.20160307.
[57] CHANG Yiqun, WANG Pengcheng, MA Hongming, et al. Design,synthesis and evaluation of halogenated furanone derivatives as quorum sensing inhibitors in Pseudomonas aeruginosa[J]. European Journal of Pharmaceutical Sciences, 2019, 140: 105058. DOI:10.1016/j.ejps.2019.105058.
[58] O’LOUGHLIN C T, MILLER L C, SIRYAPORN A, et al. A quorumsensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation[J]. Proceedings of the National Academy of Sciences, 2013,110(44): 17981-17986. DOI:10.1073/pnas.1316981110.
[59] ROY V, MEYER M T, SMITH J A I, et al. AI-2 analogs and antibiotics: a synergistic approach to reduce bacterial biofilms[J].Applied Microbiology and Biotechnology, 2013, 97(6): 2627-2638.DOI:10.1007/s00253-012-4404-6.
[60] LADE H, PAUL D, KWEON J H. Quorum quenching mediated approaches for control of membrane biofouling[J]. International Journal of Biological Sciences, 2014, 10(5): 550-565. DOI:10.7150/ijbs.9028.