五环三萜类化合物是以6 个异戊二烯构成的萜类化合物,在自然界中分布广泛[1]。因其具有多种生物功能和药理活性,得到了食品界及医药领域学者的普遍关注[2-6]。按照结构不同,五环三萜可分为羽扇豆烷型、齐墩果烷型、木栓烷型和乌苏烷型等类型。近年来,越来越多结构复杂、新颖的羽扇豆烷型三萜被发现,它们广泛存在于桦树皮、皱皮木瓜、酸枣仁、芍药、甘草、毛叶枣、芒果、芦荟、腰果等植物中[7-8],在抗肿瘤[9]、抗炎[10]、降糖[11]、护肝[12-13]、抗病毒[14]及免疫调节[15]等方面显示出了良好的功能性,已成为天然产物五环三萜中的研究热点。目前,常见的羽扇豆烷型五环三萜有桦木酸、桦木醇、羽扇豆醇、桦木酮酸等(图1)。本文针对这4 种羽扇豆烷型五环三萜的抗肿瘤、抗炎、护肝、抗糖尿病生物活性及机制的最新研究进行综述,以期为羽扇豆烷型五环三萜类化合物的深入研究和应用提供参考。
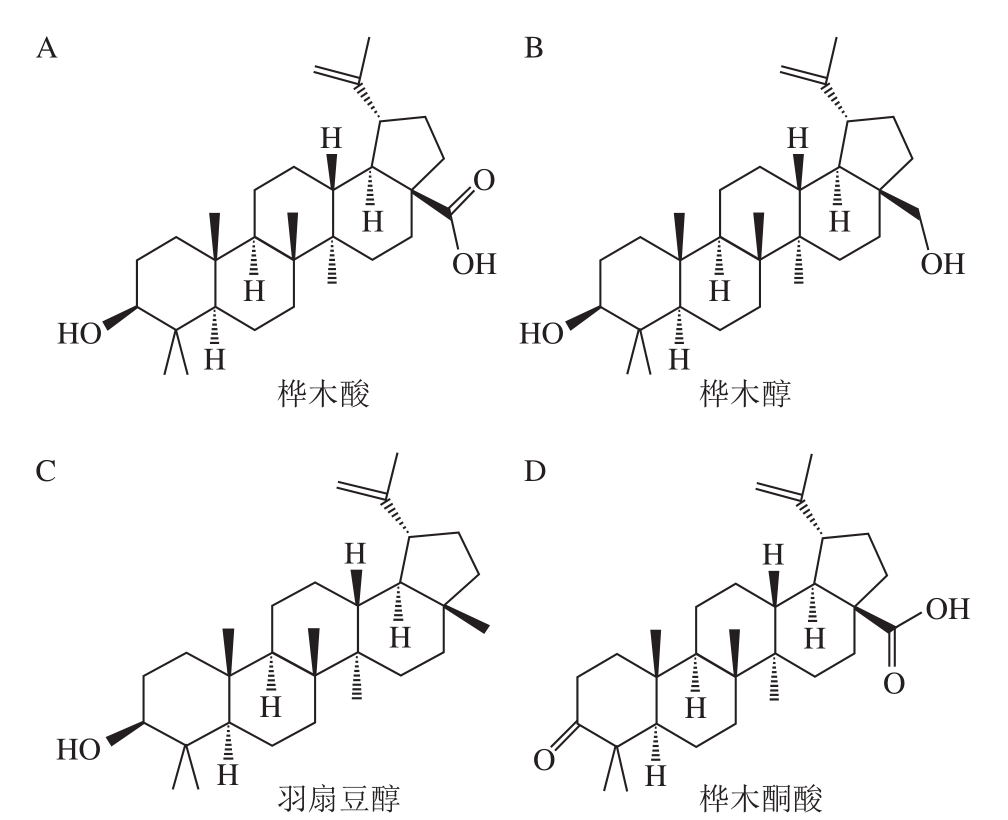
图1 常见的羽扇豆烷型五环三萜[8]
Fig. 1 Common lupinane-type pentacyclic triterpenoids[8]
1 抗肿瘤作用
表1 羽扇豆烷型五环三萜抗肿瘤活性
Table 1 Antineoplastic activity of lupinane-type pentacyclic triterpenoids
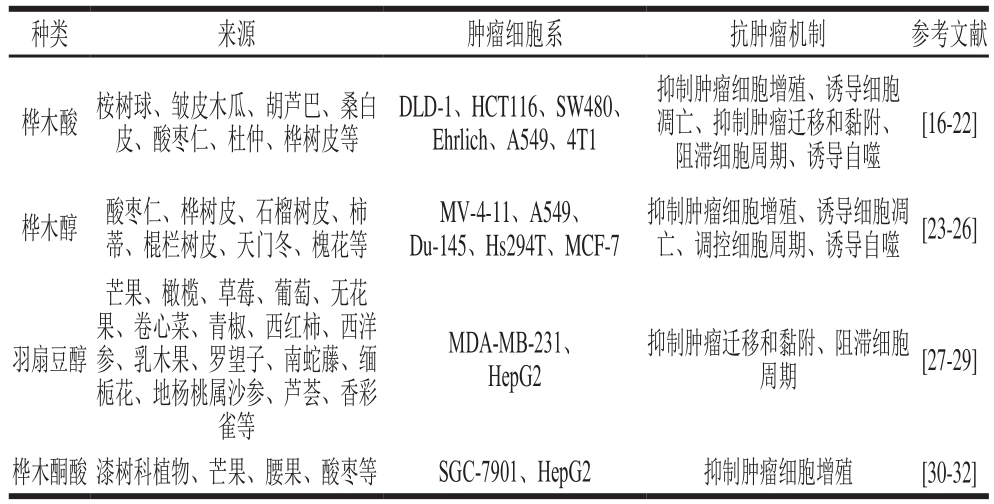
种类 来源 肿瘤细胞系 抗肿瘤机制 参考文献桦木酸 桉树球、皱皮木瓜、胡芦巴、桑白皮、酸枣仁、杜仲、桦树皮等DLD-1、HCT116、SW480、Ehrlich、A549、4T1抑制肿瘤细胞增殖、诱导细胞凋亡、抑制肿瘤迁移和黏附、阻滞细胞周期、诱导自噬[16-22]桦木醇 酸枣仁、桦树皮、石榴树皮、柿蒂、棍栏树皮、天门冬、槐花等MV-4-11、A549、Du-145、Hs294T、MCF-7抑制肿瘤细胞增殖、诱导细胞凋亡、调控细胞周期、诱导自噬 [23-26]羽扇豆醇芒果、橄榄、草莓、葡萄、无花果、卷心菜、青椒、西红柿、西洋参、乳木果、罗望子、南蛇藤、缅栀花、地杨桃属沙参、芦荟、香彩雀等MDA-MB-231、HepG2抑制肿瘤迁移和黏附、阻滞细胞周期 [27-29]桦木酮酸 漆树科植物、芒果、腰果、酸枣等 SGC-7901、HepG2 抑制肿瘤细胞增殖 [30-32]
据报道,羽扇豆烷型五环三萜对结肠癌、乳腺癌、肺癌、肝癌、卵巢癌、前列腺癌、胃癌、黑色素瘤等肿瘤均有显著的抑制作用(表1),主要的抗肿瘤作用机制有:抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤细胞迁移和黏附、调控肿瘤细胞周期、诱导肿瘤细胞自噬。
1.1 抑制肿瘤细胞增殖
抑制肿瘤细胞的增殖是羽扇豆烷型五环三萜抗癌的细胞学基础,是其抗肿瘤作用的主要机制。Jiao Lin等[16]研究发现,乳腺癌细胞MCF-7经过桦木酸处理后,可显著上调Caveolin-1的表达,继而抑制磷酸化NF-κB/p65抑制蛋白(phosphorylated NF-kappa-B-inhibitor alpha,p-IκBα)表达,上调IκBα表达,增加NF-κB/p65稳定性,导致p65核转运减少,抑制c-Myc基因的转录。而c-Myc表达的下调会抑制乳腺癌细胞中的有氧糖酵解,从而抑制MCF-7细胞增殖起到抗肿瘤作用(图2)。张玲莉等[27]研究发现羽扇豆醇能通过活化Caspase通路,上调p53表达,诱导细胞凋亡及周期改变,最终抑制人高转移肝癌HCCLM3细胞增殖,研究结果表明羽扇豆醇对肝癌的预防和治疗具有一定的协同作用。Li Jizhen等[17]设计并合成了5 种桦木酸的氟化物,评估了它们对5 种肿瘤细胞系的抗增殖活性,发现它们能同时抑制拓扑异构酶I和II的活性,从而抑制癌细胞生长和增殖。Shakhtshneider等[33]利用桦木醇和阿拉伯半乳聚糖制备的复合物薄膜,对不同的癌细胞系如腹水癌细胞和肺癌细胞,均显示出了较高的抑制作用。Wang Gang等[34]发现羽扇豆烷型五环三萜类化合物可以抑制钙调神经磷酸酶信号通路,从而有效地抑制结肠癌细胞SW620的生长和侵袭。
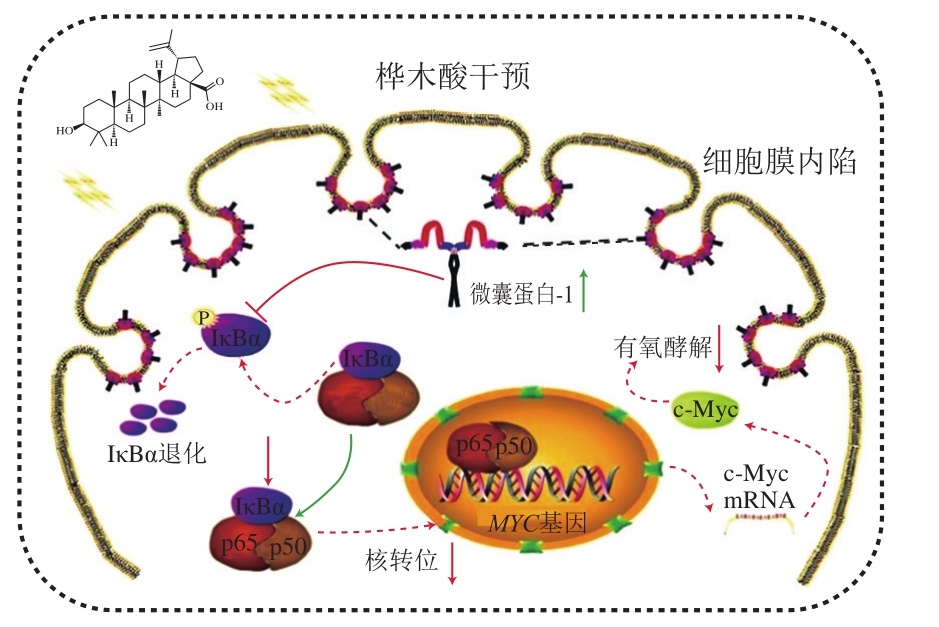
图2 桦木酸抑制肿瘤细胞增殖作用机制[16]
Fig. 2 Mechanism of action of betulinic acid in inhibiting tumor cell proliferation[16]
1.2 诱导肿瘤细胞凋亡
研究表明,羽扇豆烷型五环三萜能够通过调节凋亡相关蛋白的表达,诱导肿瘤细胞发生凋亡,进而起到抗肿瘤作用[35]。Wang Wei等[18]发现桦木酸能上调促凋亡蛋白Bax和裂解Caspase-3的表达,下调抗凋亡蛋白Bcl-2的表达,诱导HepG2、LM3和MHCC97H等肝癌细胞凋亡并抑制癌细胞的转移。Li Yang等[23]研究发现桦木醇可以显著下调胃癌细胞SGC7901抗凋亡蛋白Bcl-2的表达,诱导细胞凋亡。Leong等[30]从白桦树皮中分离提取出桦木酮酸,发现桦木酮酸可通过影响线粒体凋亡途径,上调Bax和Bcl-2的比例,从而诱导细胞凋亡,对白血病干细胞起到抑制作用。Li Yang等[23]合成了一系列桦木醇和桦木醛的3-取代衍生物,其中,3-甲基邻苯二甲酸酯三萜化合物显著降低Du-145、MCF-7和Hs294T细胞中的抗凋亡蛋白Bcl-2的含量,具有对肿瘤细胞的促凋亡作用。
1.3 抑制肿瘤细胞迁移和黏附
羽扇豆烷型五环三萜可以抑制多种肿瘤细胞的迁移和黏附,有效抑制肿瘤病灶的转移。Zeng Anqi等[19]发现桦木酸可以下调基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达并增加MMPs抑制剂(TIMP-2)的表达,显著抑制结直肠癌细胞的迁移和侵袭,从而起到抗肿瘤作用。王明等[28]研究发现羽扇豆醇能够下调相关蛋白COX-2、MMP-2、MMP-9的表达,从而对人乳腺癌细胞MDA-MB-231的黏附、迁移产生明显的抑制作用。Zehra等[25]从栎树中分离出桦木醇,并研究了其对肺癌细胞的抗迁移活性,结果显示,桦木醇能够通过抑制MMP-2、MMP-9的表达,从而抑制肿瘤细胞的迁移,发挥抗肿瘤作用。Ledeţi等[31]利用桦木酮酸分别与氨基、羟基、正丁基和氨基硫脲缩合,获得了4 种官能化衍生物,发现在引入氨基后,桦木酮酸的抗肿瘤活性大大增强,能够有效减少肿瘤病灶的转移。
1.4 调控肿瘤细胞周期
细胞周期的阻滞是羽扇豆烷型五环三萜发挥抗肿瘤效应的重要机制[36],不同的三萜对于不同的肿瘤细胞周期的阻滞时间点不尽相同。穆晓婷等[32]研究了经桦木酮酸处理的乳腺癌细胞MCF-7和宫颈癌细胞C-33A的周期变化,结果显示:桦木酮酸可阻滞MCF-7细胞周期在S期,阻滞C-33A细胞周期在G1-S期,从而抑制肿瘤细胞的增殖。Majeed等[20]研究发现桦木酸的衍生物可以抑制PI3K的表达,在人白血病和乳腺癌模型中将肿瘤细胞周期阻滞在G0期或G1期。Wang Ruoning等[21]制备了紫杉醇-桦木酸混合纳米悬浮液,作用于乳腺癌细胞MCF-7,使其细胞周期阻滞在G0期或G1期,较少的细胞周期停滞在G2期或M期。田孜博[29]利用羽扇豆醇干预人肝癌细胞HepG2,发现羽扇豆醇可能阻断了Wnt信号转导通路,将HepG2的细胞周期阻滞于S期,从而抑制肿瘤细胞增殖。
1.5 诱导肿瘤细胞自噬
针对耐药型肿瘤细胞,羽扇豆烷型五环三萜主要通过诱导细胞自噬的机制起到抗肿瘤作用[37]。Yan Xiaoning等[26]研究发现桦木醇可以上调人乳腺癌细胞MCF-7中BECLIN-1、LC 3-II的水平,同时下调P62的水平,从而诱导肿瘤细胞自噬,发挥抗肿瘤作用。Gonzalez等[22]制备了一种桦木酸的糖基化衍生物,能够上调自噬相关蛋白ATG7、ATG5和BECLIN-1的水平,诱导肿瘤细胞自噬,起到良好的抗肿瘤效果,对桦木酸在抗肿瘤方面的应用开发具有重要意义。
羽扇豆烷型五环三萜化合物及其衍生物具有较强的、广谱的抗肿瘤活性,在肿瘤形成的不同阶段发挥着不同的作用。不仅可以引起细胞周期阻滞,抑制肿瘤细胞增殖,还可以诱导细胞凋亡或自噬,可以抑制肿瘤的形成、发展,而且也可以有效地抑制剂肿瘤细胞再生、入侵和转移,是一种非常理想的抗肿瘤天然产物。目前,国内外学者针对桦木酸、桦木醇、羽扇豆醇等羽扇豆烷型五环三萜的抗肿瘤研究进行了大量的体内和体外实验,并取得了良好的抗癌效果,但实际在临床应用并具有较高价值的制剂并不多见,有待于进一步开发药剂应用于临床进行验证。
2 抗炎作用
近年来,大量研究发现,羽扇豆烷型五环三萜在炎症治疗中具有良好的药理学活性,由于其所连官能团的不同导致在药理学和机制方面具有不同的效果,主要的抗炎作用机制有:调节细胞因子、降低氧化应激、影响花生四烯酸代谢过程。
2.1 调节细胞因子
在炎症反应期间,免疫细胞可以分泌多种类型的细胞因子,如干扰素、白细胞介素(interleukin,IL)和肿瘤坏死因子(tumor necrosis factor,TNF)等。研究发现羽扇豆烷型五环三萜能够调节这些细胞因子从而发挥抗炎作用。Halder等[38]制备了乳铁蛋白修饰的负载桦木酸的聚乳酸-羟基乙酸共聚物纳米颗粒,能够上调IL-10抗炎因子,同时抑制诱导型一氧化氮合酶的表达从而产生抗炎功效。Mathew等[39]也发现桦木酸可以上调IL-10抗炎因子水平。Kasinathan等[40]研究发现羽扇豆醇可以减轻葡聚糖硫酸钠诱导的小鼠结肠炎,其作用机制是通过降低促炎因子TNF-α、IL-1β、IL-6的水平来发挥抗炎作用。Laavola等[41]研究了桦木酸、桦木醇及其衍生物的抗炎特性,发现一种桦木醇衍生物能够抑制IL-6细胞因子和MCP-1单核细胞趋化蛋白的表达,具有广谱的抗炎活性。Xu Guangmen等[42]在研究桦木醇抑制脂多糖诱导的小鼠急性肝损伤时发现,桦木醇可以显著降低血清和肝组织中IL-1β和TNF-α的水平,从而起到抗炎作用。
2.2 降低氧化应激
羽扇豆烷型五环三萜可以降低氧化应激,而氧化应激和炎症在炎性环境下具有互相依赖的共存关系[43]。Kalra等[44]利用桦木酸缓解小鼠葡聚糖硫酸钠诱导的结肠炎和内脏疼痛,结果显示桦木酸可以明显改善结肠组织中炎症损伤等重要生化指标,如髓过氧化物酶和丙二醛的含量,同时减少血浆中亚硝酸盐的含量,并恢复超氧化物歧化酶、过氧化氢酶和还原型谷胱甘肽水平。朱利娟等[45]发现桦木酸对地塞米松造成的氧化损伤具有防护作用,桦木酸能有效增强小鼠免疫器官中超氧化物歧化酶和还原性谷胱甘肽活性,降低丙二醛含量,从而增强免疫器官的抗氧化能力,起到抗炎作用。侯辰等[46]研究羽扇豆醇对脑缺血再灌注大鼠氧化应激损伤和炎性反应的调节作用及机制,结果表明:经羽扇豆醇干预的大鼠体内超氧化物歧化酶和还原性谷胱甘肽水平显著升高,丙二醛水平显著降低,炎性反应明显减轻。
2.3 影响花生四烯酸代谢过程
在炎性环境下,花生四烯酸先通过COX-1/2形成环过氧化物,随后在酶的催化下形成前列腺素类PGE2[47],加剧炎症反应。羽扇豆烷型五环三萜能够影响花生四烯酸代谢过程,减少PGE2的产生,从而起到抑制炎症的作用。Siddiqui等[48]通过水肿和疼痛实验,发现桦木酸可抑制人外周血单核细胞培养物中COX-2的表达,从而降低PGE2的产生量。Gonçalves等[49]研究发现新型桦木醇衍生物可以抑制IFN-γ并调节COX-2表达,影响花生四烯酸代谢过程,进而产生抗炎效应。Cao Hongmei等[50]采用脉冲超滤液相色谱-质谱法进行了环氧合酶的筛选,结果发现桦木酸能够显著抑制人淋巴瘤Raji细胞和人乳腺癌细胞MCF-7中COX-1的表达,起到抗炎效果。
羽扇豆烷型五环三萜可以通过调节细胞因子、减轻氧化应激、影响花生四烯酸代谢过程等机制发挥抗炎功效,并已经在炎症治疗方面显示出令人关注的药理特性。炎症与动脉粥样硬化等众多疾病的发生相关,今后有望利用羽扇豆烷型五环三萜抗炎活性研究,进一步明确其药理学作用机制和药物代谢规律,设计出更合理的给药途径、方法和剂量,更加深入、更加广泛地应用于临床,使更多患者受益。
3 抗糖尿病作用
羽扇豆烷型五环三萜对糖尿病及其并发症有一定治疗作用,主要的抗糖尿病作用机制有:改善胰岛功能、调节葡萄糖摄取和转化、抑制α-葡萄糖苷酶活性。
3.1 改善胰岛功能
研究表明,羽扇豆烷型五环三萜能够通过促进胰岛素分泌,增加胰岛素敏感性,从而起到抗糖尿病活性。Castro等[51]研究报道,桦木酸能够诱导ATP敏感性钾通道(KATP)关闭,进而打开L型电压依赖性钙通道(L-type voltage-dependent calcium channel,L-VDCC)和钙激活氯离子通道(calcium-activated chloride channels,CaCCs),引起钙内流和细胞膜去极化。胞内Ca2+浓度的升高会激活蛋白激酶C(protein kinase C,PKC),PKC诱导与胰岛素颗粒易位到细胞膜相关蛋白的磷酸化,从而促进胰岛素颗粒移动至细胞膜并释放胰岛素。此外,桦木酸还能够通过调控氯离子通道ClC-3,促进胰岛素颗粒的酸化成熟,刺激胰岛素分泌,从而起到抗糖尿病的作用(图3)。Ahangarpour等[52]研究了桦木酸对链脲佐菌素-烟酰胺诱导的糖尿病小鼠中瘦素、脂联素、肝酶水平和脂质谱的影响,发现桦木酸可以显著降低糖尿病小鼠血浆瘦素水平、胆固醇水平和肝酶天冬氨酸氨基转移酶水平,升高血浆脂联素水平,从而起到改善胰岛素抵抗的作用。Ramu等[53]发现在给予羽扇豆醇后,组织学观察显示药物治疗的糖尿病大鼠中胰岛β细胞显著再生,胰岛素水平升高,血糖浓度也显著恢复正常,这证明了羽扇豆醇能够改善血糖和胰岛β细胞再生以恢复机体正常的胰岛素水平,从而起到抗糖尿病作用。Ghazanfar等[54]研究了羽扇豆醇对糖尿病大鼠代谢异常的抑制作用,发现其对大鼠的胰岛β细胞具有再生和保护作用,能够增加胰岛素含量。
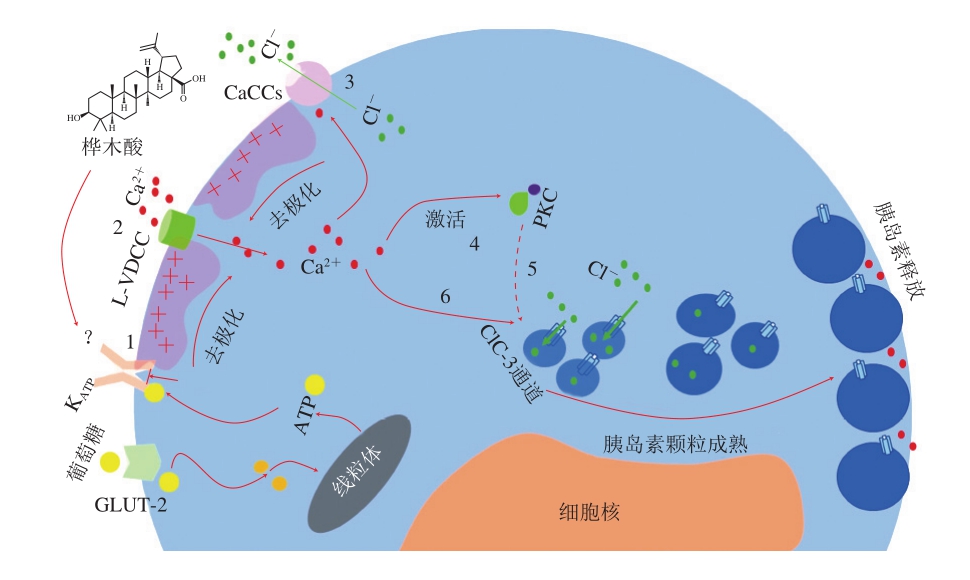
图3 桦木酸具有促进胰岛素分泌的抗糖尿病作用[51]
Fig. 3 Betulinic acid plays an anti-diabetic role by promoting insulin secretion[51]
3.2 调节葡萄糖摄取和转化
羽扇豆烷型五环三萜可以调节葡萄糖摄取和转化(包括增加葡萄糖摄取和抑制糖异生)从而起到抗糖尿病作用。Ko等[55]发现桦木醇可以刺激3T3-L1脂肪细胞中的胰岛素信号传导,导致肝脏蛋白激酶B(protein kinase B,Akt)和丝氨酸激酶(glycogen synthase kinase 3 beta,GSK-3β)的磷酸化水平显著升高,磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)的表达显著降低,从而增强胰岛素刺激的葡萄糖摄取,降低糖尿病风险。Brusotti等[56]研究发现桦木酸是PPARγ拮抗剂,能够改善葡萄糖摄取,促进骨生成并抑制脂肪生成,可以维持胰岛素敏感性,起到抗糖尿病作用。Kim等[57]研究发现桦木酸可以通过调节AMP激活的蛋白激酶(AMP activated protein kinase,AMPK)信号传导途径抑制肝脏糖异生,即抑制生物体将多种非糖物质转变成葡萄糖或糖原,从而有效改善高血糖症。
3.3 抑制α-葡萄糖苷酶活性
α-葡萄糖苷酶活性的降低可以延缓机体对碳水化合物的吸收,降低餐后血糖水平。Ding Huafang等[58]探讨了桦木酸对α-葡萄糖苷酶抑制机制的新认识,采用计算机模拟分子对接技术展示了桦木酸可与α-葡萄糖苷酶活性中心的紧密结合,从而阻碍碳水化合物与酶活性中心的结合,导致α-葡萄糖苷酶活性下降,从而起到抗糖尿病的作用。Li Guoliang等[59]利用可以筛选α-葡萄糖苷酶抑制剂的荧光传感器证实了桦木酮酸的α-葡萄糖苷酶抑制活性。Khusnutdinova等[60]则对桦木酮酸进行修饰,合成了一系列新三萜,发现这些新三萜化合物均显示出比桦木酮酸更高的α-葡萄糖苷酶抑制活性,起到了更为显著的抗糖尿病效果。Seong等[61]发现葛根中的羽扇豆醇可以通过抑制蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase-1B,PTP-1B)和α-葡萄糖苷酶的活性起到抗糖尿病作用。
糖尿病发病率的逐年升高,同时伴随的慢性并发症成为困扰人类健康的重要原因之一。羽扇豆烷型五环三萜通过改善胰岛功能、调节葡萄糖摄取和转化、抑制α-葡萄糖苷酶活性等作用机制,对I型和II型糖尿病都具有良好的治疗效果,基于其抗糖尿病作用,开发出应用于糖尿病预防和治疗的食品和药物具有重要意义。但目前,羽扇豆烷型五环三萜在抗糖尿病临床实验数据支撑以及对羽扇豆烷型五环三萜对糖尿病并发症的预防的研究尚鲜见报道,因此,其实际应用仍需进一步的验证性研究。
4 护肝作用
肝脏是人体重要的代谢器官和最大的解毒器官,一旦发生病变,将对人体健康产生严重的影响,因此对于肝病的防护具有重要的意义。羽扇豆烷型五环三萜具有良好的护肝作用,主要的护肝作用机制有:调节相关酶活性、减缓肝脏脂质过氧化等。
4.1 调节相关酶活性
AMP激活的AMPK持续性激活,可以引发细胞的凋亡[62]。Bai Ting等[63]发现桦木醇通过影响SIRT1/AMPK信号通路,降低AMPK的表达,从而抑制大鼠肝细胞的凋亡,显著降低乙醇诱导的小鼠酒精性肝损伤。王存琴等[64]的研究发现,羽扇豆醇可以显著降低氧嗪酸钾诱导的高尿酸血症小鼠肝组织中的黄嘌呤氧化酶活性,起到保护肝脏的作用。Song Peifang等[65]发现桦木酸可以选择性地抑制羧酸酯酶1活性,从而抑制肝脏病变,起到护肝的作用。狄英波等[66]研究发现桦木醇可以显著抑制髓过氧化物酶、血清丙氨酸氨基转移酶和天冬氨酸氨基转移酶活性,从而显著减轻肝脏病变。
4.2 减缓肝脏脂质过氧化
羽扇豆烷五环三萜能够减缓肝脏脂质过氧化。肝脏的氧化程度过大,会引起氧化系统和抗氧化系统失衡,诱导肝组织损伤。夏伟等[67]研究桦木酸对小鼠酒精性肝损伤的保护作用,发现桦木酸能够缓解体内乙醇代谢产物的氧化应激,降低脂质过氧化物的生成,阻止总胆固醇和总甘油三酯在肝脏的积累,减少脂肪肝的形成,从而起到护肝作用。Fernández-Martínez等[68]在蓟花中提取羽扇豆醇,发现其可以减少四氯化碳诱导的急性肝损伤时的脂质过氧化从而起到保护肝脏的作用。
综上所述,羽扇豆烷型五环三萜通过改善肝脏组织中的氧化还原体系,降低脂质过氧化物的生成,维护抗氧化系统,抑制肝损伤的发生,从而发挥有效的护肝作用。同时,羽扇豆烷型五环三萜对酒精肝、脂肪肝等肝脏疾病具有一定的缓解作用。
5 结 语
羽扇豆烷型五环三萜广泛分布在多种植物中,种类繁多、资源丰富。近年来国内外学者研究发现一些羽扇豆烷型萜类表现出了丰富而重要的生物活性和药理作用,除了上文提到的抗肿瘤、抗炎、抗糖尿病、护肝作用外,在抗菌、抗病毒、机体免疫调节等方面也有着巨大潜力。然而,目前羽扇豆烷型五环三萜的部分生物活性作用机制尚未明确,各种活性可能的作用靶点尚不完全清楚。此外,现有对于羽扇豆烷五环三萜的研究报道主要集中于其中的少数化合物,对其余化合物的研究还有很大的空间。
与其他天然产物抗肿瘤活性成分相比,羽扇豆烷型五环三萜最显著的特点是其在具有广谱抗肿瘤活性的同时,还有显著的护肝活性。因此,考虑将羽扇豆烷型五环三萜与其他经典化疗药物联合使用,既有可能产生协同增效作用,又可能起到降低毒副作用的特效,在未来一段时期应为相关领域研究的主要方向之一。已有研究表明,基于天然羽扇豆烷型五环三萜化合物的结构改性,有望合成出活性更强的衍生物,因此,羽扇豆烷型五环三萜改性及其构效关系研究也有很大的潜在价值。交叉学科新兴技术的应用,如利用计算机模拟分子对接技术研究羽扇豆烷型五环三萜与关键细胞因子结合特性,对于揭示其作用机制具有很大的推进意义。相信随着生物材料科学、药理学、分子生物学、生物信息学等领域相关技术的不断发展进步,羽扇豆烷型五环三萜的应用前景将更加广阔。
[1] ZHANG X X, ZHANG S, YANG Y R, et al. Natural barrigenollike triterpenoids: a comprehensive review of their contributions to medicinal chemistry[J]. Phytochemistry, 2019, 161: 41-74.DOI:10.1016/j.phytochem.2019.01.017.
[2] LIANG S B, LI M, YU X J, et al. Synthesis and structure-activity relationship studies of water-soluble β-cyclodextrin-glycyrrhetinic acid conjugates as potential anti-influenza virus agents[J]. European Journal of Medicinal Chemistry, 2019, 166: 328-338. DOI:10.1016/j.ejmech.2019.01.074.
[3] ZHAI H J, YU J H, ZHANG Q Q, et al. Cytotoxic and antibacterial triterpenoids from the roots of Morinda officinalis var. officinalis[J].Fitoterapia, 2019, 133: 56-61. DOI:10.1016/j.fitote.2018.12.011.
[4] SHAMSEE Z R, AL-SAFFAR A Z, AL-SHANON A F, et al.Cytotoxic and cell cycle arrest induction of pentacyclic triterpenoides separated from Lantana camara leaves against MCF-7 cell line in vitro[J]. Molecular Biology Reports, 2019, 46(1): 381-390.DOI:10.1007/s11033-018-4482-3.
[5] 易想炼, 朱利娟, 赵静, 等. 桦木酸对环磷酰胺致小鼠免疫器官氧化损伤的保护作用[J]. 动物营养学报, 2018, 30(3): 1199-1206.DOI:10.3969/j.issn.1006-267x.2018.03.047.
[6] 励建荣, 夏道宗. 山茱萸有效成分和药理作用的研究进展及其在食品工业中的应用[J]. 食品科学, 2003, 24(3): 161-163. DOI:10.3321/j.issn:1002-6630.2003.03.044.
[7] 潘江球, 袁天祈, 陈民, 等. 毛叶枣果汁饮料及果酱加工技术的研究[J].食品科学, 1999, 20(9): 73-74. DOI:10.1088/0256-307X/16/9/020.
[8] 刘向前, 邹亲朋, 陆昌洙. 天然产物中羽扇豆烷型三萜波谱特征[J].湖南中医药大学学报, 2013, 33(9): 10-32. DOI:10.3969/j.issn.1674-070X.2013.09.002.010.23.
[9] AMIRI S, DASTGHAIB S, AHMADI M, et al. Betulin and its derivatives as novel compounds with different pharmacological effects[J]. Biotechnology Advances, 2020, 38: 107409. DOI:10.1016/j.biotechadv.2019.06.008.
[10] CHANIAD P, SUDSAI T, SEPTAMA A W, et al. Evaluation of anti-HIV-1 integrase and anti-inflammatory activities of compounds from Betula alnoides Buch-Ham[J]. Advances in Pharmacological Sciences,2019: 11. DOI:10.1155/2019/2573965.
[11] BRUSOTTI G, MONTANARI R, CAPELLI D, et al. Betulinic acid is a PPARγ antagonist that improves glucose uptake, promotes osteogenesis and inhibits adipogenesis[J]. Scientific Reports, 2017,7(1): 5777. DOI:10.1038/s41598-017-05666-6.
[12] XU G, ZAN T, LI H, et al. Betulin inhibits lipopolysaccharide/D-galactosamine-induced acute liver injury in mice through activating PPAR-γ[J]. Biomedicine and Pharmacotherapy, 2018, 106: 941-945.DOI:10.1016/j.biopha.2018.07.011.
[13] 蔡天娇, 王瑞珍, 魏君慧, 等. 白桦脂酸与红枣总三萜酸对小鼠酒精肝损伤的保护作用[J]. 食品科学, 2018, 39(11): 191-195.DOI:10.7506/spkx1002-6630-201811030.
[14] BELLAMPALLI S S, JI Y, MOUTAL A, et al. Betulinic acid, derived from the desert lavender Hyptis emoryi, attenuates paclitaxel-, HIV-,and nerve injury-associated peripheral sensory neuropathy via block of N-and T-type calcium channels[J]. Pain, 2019, 160(1): 117-135.DOI:10.1097/j.pain.0000000000001385.
[15] 程晓华, 熊玉卿. 五环三萜皂苷的药理作用研究进展[J]. 中草药,2007, 38(5): 792-795. DOI:10.3321/j.issn:0253-2670.2007.05.056.
[16] JIAO Lin, WANG Shengqi, ZHENG Yifeng, et al. Betulinic acid suppresses breast cancer aerobic glycolysis via caveolin-1/NF-κB/c-Myc pathway[J]. Biochemical Pharmacology, 2019, 161: 149-162.DOI:10.1016/j.bcp.2019.01.016.
[17] LI Jizhen, CHANG Lingchu, HSIEH K Y, et al. Design, synthesis and evaluation of antiproliferative activity of fluorinated betulinic acid[J].Bioorganic and Medicinal Chemistry, 2019, 27(13): 2871-2882.DOI:10.3390/molecules21050579.
[18] WANG Wei, WANG Yang, LIU Mingxing, et al. Betulinic acid induces apoptosis and suppresses metastasis in hepatocellular carcinoma cell lines in vitro and in vivo[J]. Journal of Cellular and Molecular Medicine, 2019, 23(1): 586-595. DOI:10.1111/jcmm.13964.
[19] ZENG Anqi, HUA Hua, LIU Li, et al. Betulinic acid induces apoptosis and inhibits metastasis of human colorectal cancer cells in vitro and in vivo[J]. Bioorganic and Medicinal Chemistry, 2019, 27(12): 2546-2552. DOI:10.1016/j.bmc.2019.03.033.
[20] MAJEED R, HAMID A, SANGWAN P L, et al. Inhibition of phosphotidylinositol-3 kinase pathway by a novel naphthol derivative of betulinic acid induces cell cycle arrest and apoptosis in cancer cells of different origin[J]. Cell Death and Disease, 2014, 5(10): e1459.DOI:10.1038/cddis.2014.387.
[21] WANG Ruoning, YANG Mengmeng, LI Guoyuan, et al. Paclitaxelbetulinic acid hybrid nanosuspensions for enhanced anti-breast cancer activity[J]. Colloids and Surfaces B: Biointerfaces, 2019, 174: 270-279. DOI:10.1016/j.colsurfb.2018.11.029.
[22] GONZALEZ P, MADER I, TCHOGHANDJIAN A, et al. Impairment of lysosomal integrity by B10, a glycosylated derivative of betulinic acid, leads to lysosomal cell death and converts autophagy into a detrimental process[J]. Cell Death and Differentiation, 2012, 19(8):1337. DOI:10.1038/cdd.2012.10.
[23] LI Yang, LIU Xiaokang, JIANG Dan, et al. Betulin induces reactive oxygen species-dependent apoptosis in human gastric cancer SGC7901 cells[J]. Archives of Pharmacal Research, 2016, 39(9): 1257-1265.DOI:10.1007/s12272-016-0761-5.
[24] SZUSTER-CIESIELSKA A, PLEWKA K, DANILUK J, et al. Betulin and betulinic acid attenuate ethanol-induced liver stellate cell activation by inhibiting reactive oxygen species (ROS), cytokine (TNF-α, TGF-β)production and by influencing intracellular signaling[J]. Toxicology,2011, 280(3): 152-163. DOI:10.1016/j.tox.2010.12.006.
[25] ZEHRA B, AHMED A, SARWAR R, et al. Apoptotic and antimetastatic activities of betulin isolated from Quercus incana against non-small cell lung cancer cells[J]. Cancer Management and Research, 2019, 11: 1667. DOI:10.2147/CMAR.S186956.
[26] YAN Xiaoning, YANG Lei, FENG Gaili, et al. Lup-20 (29)-en-3β,28-di-yl-nitrooxy acetate affects MCF-7 proliferation through the crosstalk between apoptosis and autophagy in mitochondria[J]. Cell Death and Disease, 2018, 9(2): 241. DOI:10.1038/s41419-017-0255-5.
[27] 张玲莉, 邱振鹏, 彭燕. 羽扇豆醇对人高转移肝癌HCCLM3增殖影响的机制研究[J]. 中国药师, 2015, 18(6): 897-901. DOI:10.3969/j.issn.1008-049X.2015.06.006.
[28] 王明, 崔红霞, 孙超, 等. 羽扇豆醇对人乳腺癌MDA-MB-231细胞侵袭转移作用及机制研究[J]. 药学学报, 2016, 51(4): 558-562.DOI:10.16438/j.0513-4870.2015-0948.
[29] 田孜博. 羽扇豆醇对人肝癌细胞Wnt通路影响的研究[D]. 石家庄:河北医科大学, 2014: 29-31.
[30] LEONG K H, MAHDZIR M A, DIN M F M, et al. Induction of intrinsic apoptosis in leukaemia stem cells and in vivo zebrafish model by betulonic acid isolated from Walsura pinnata Hassk (Meliaceae)[J].Phytomedicine, 2017, 26: 11-21. DOI:10.1016/j.phymed.2016.12.018.
[31] LEDEŢI I, AVRAM Ş, BERCEAN V, et al. Solid-state characterization and biological activity of betulonic acid derivatives[J]. Molecules, 2015, 20(12): 22691-22702. DOI:10.3390/molecules201219876.
[32] 穆晓婷, 钱平, 蒋璐璐, 等. 路路通酸对乳腺癌MCF-7细胞和宫颈癌C-33A细胞增殖的影响[J]. 实用药物与临床, 2017, 20(3): 254-257.DOI:10.14053/j.cnki.ppcr.201703004.
[33] SHAKHTSHNEIDER T P, KUZNETSOVA S A, ZAMAY A S, et al.New composites of betulin esters with arabinogalactan as highly potent anti-cancer agents[J]. Natural Product Research, 2016, 30(12): 1382-1387. DOI:10.1080/14786419.2015.1060591.
[34] WANG Gang, WANG Yuzhu, YU Yang, et al. Inhibitory ASIC2-mediated calcineurin/NFAT against colorectal cancer by triterpenoids extracted from Rhus chinensis Mill[J]. Journal of Ethnopharmacology,2019, 235: 255-267. DOI:10.1016/j.jep.2019.029.029.
[35] 王艺玮, 徐盛涛, 徐进宜. 五环三萜羽扇豆烷型天然产物抗肿瘤活性研究进展[J]. 药学与临床研究, 2017, 25(4): 336-342.DOI:10.13664/j.cnki.pcr.2017.04.016.
[36] LI Q R, ZHAO H, ZHANG X S, et al. Novel-smoothened inhibitors for therapeutic targeting of naïve and drug-resistant hedgehog pathway-driven cancers[J]. Acta Pharmacologica Sinica, 2018, 40(2):257-267. DOI:10.1038/s41401-018-0019-5.
[37] 曹建平, 夏大静. 自噬与肿瘤关系研究新进展[J]. 浙江大学学报(医学版), 2015, 44(2): 204-210. DOI:10.3785/j.issn.1008-9292.2015.03.014.
[38] HALDER A, SHUKLA D, DAS S, et al. Lactoferrin-modified betulinic acid-loaded PLGA nanoparticles are strong anti-leishmanials[J].Cytokine, 2018, 110: 412-415. DOI:10.1016/j.cyto.2018.05.010.
[39] MATHEW L E, RAJAGOPAL V, HELEN A. Betulinic acid and fluvastatin exhibits synergistic effect on toll-like receptor-4 mediated anti-atherogenic mechanism in type II collagen induced arthritis[J].Biomedicine and Pharmacotherapy, 2017, 93: 681-694. DOI:10.1016/j.biopha.2017.06.053.
[40] KASINATHAN N K, SUBRAMANIYA B, SIVASITHAMPARAM N D.NF-κB/twist mediated regulation of colonic inflammation by lupeol in abating dextran sodium sulfate induced colitis in mice[J]. Journal of Functional Foods, 2018, 41: 240-249. DOI:10.1016/j.jff.2017.12.048.
[41] LAAVOLA M, HAAVIKKO R, HÄMÄLÄINEN M, et al. Betulin derivatives effectively suppress inflammation in vitro and in vivo[J].Journal of Natural Products, 2016, 79(2): 274-280. DOI:10.1021/acs.jnatprod.5b00709.
[42] XU Guangmen, ZAN Tao, LI Hongyan, et al. Betulin inhibits lipopolysaccharide/D-galactosamine-induced acute liver injury in mice through activating PPAR-γ[J]. Biomedicine and Pharmacotherapy,2018, 106: 941-945. DOI:10.1016/j.biopha.2018.07.011.
[43] REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inflammation, and cancer: how are they linked[J]. Free Radical Biology and Medicine, 2010, 49(11): 1603-1616. DOI:10.1016/j.freeradbiomed.2018.03.042.
[44] KALRA J, LINGARAJU M C, MATHESH K, et al. Betulinic acid alleviates dextran sulfate sodium-induced colitis and visceral pain in mice[J]. Naunyn-Schmiedeberg’s Archives of Pharmacology, 2018,391(3): 285-297. DOI:10.1007/s00210-017-1455-3.
[45] 朱利娟, 易想炼, 赵静, 等. 桦木酸对地塞米松致小鼠氧化应激的机制研究[J]. 动物营养学报, 2018, 30(3): 1035-1043. DOI:10.3969/j.issn.1006/267x.2018.03.028.
[46] 侯辰, 唐鹏, 刘玥, 等. 羽扇豆醇对脑缺血再灌注大鼠氧化应激损伤和炎性反应的调节作用及机制研究[J]. 解放军医药杂志, 2018,30(10): 6-10. DOI:10.3969/j.issn.2095-140X.2018.10.002.
[47] LEE J O, JEONG D, KIM M Y, et al. ATP-binding pocket-targeted suppression of Src and Syk by luteolin contributes to its antiinflammatory action[J]. Mediators of Inflammation, 2015: 1-12.DOI:10.1155/2015/967053.
[48] SIDDIQUI S A, RAHMAN A, RAHMAN M O, et al. A novel triterpenoid 16-hydroxy betulinic acid isolated from Mikania cordata attributes multi-faced pharmacological activities[J]. Saudi Journal of Biological Sciences, 2019, 26(3): 554-562. DOI:10.1016/j.sjbs.2018.03.002.
[49] GONÇALVES S M C, SILVA G N, PITTA I R, et al. Novel betulin derivatives inhibit IFN-γ and modulates COX-2 expression[J]. Natural Product Research, 2018: 1-10. DOI:10.1080/14786419.2018.1528581.
[50] CAO Hongmei, YU Rui, CHOI Y, et al. Discovery of cyclooxygenase inhibitors from medicinal plants used to treat inflammation[J].Pharmacological Research, 2010, 61(6): 519-524. DOI:10.1016/j.phrs.2010.02.007.
[51] CASTRO A J G, CAZAROLLI L H, BRETANHA L C, et al. The potent insulin secretagogue effect of betulinic acid is mediated by potassium and chloride channels[J]. Archives of Biochemistry and Biophysics, 2018, 648: 20-26. DOI:10.1016/j.abb.2018.04.015.
[52] AHANGARPOUR A, SHABANI R, FARBOOD Y. The effect of betulinic acid on leptin, adiponectin, hepatic enzyme levels and lipid profiles in streptozotocin-nicotinamide-induced diabetic mice[J]. Research in Pharmaceutical Sciences, 2018, 13(2): 142-148.DOI:10.4103/1735-5362.223796.
[53] RAMU R, SHIRAHATTI P S, ZAMEER F, et al. Assessment of in vivo antidiabetic properties of umbelliferone and lupeol constituents of banana (Musa sp. var. Nanjangud Rasa Bale) flower in hyperglycaemic rodent model[J]. PLoS ONE, 2016, 11(3): 1-17. DOI:10.1371/journal.pone.0151135.
[54] GHAZANFAR K, MUBASHIR K, DAR S A, et al. Gentiana kurroo Royle attenuates the metabolic aberrations in diabetic rats;swertiamarin, swertisin and lupeol being the possible bioactive principles[J]. Journal of Complementary and Integrative Medicine,2017, 14(3): 385-411. DOI:10.1515/jcim-2017-0002.
[55] KO B S, KANG S, MOON B R, et al. A 70% ethanol extract of mistletoe rich in betulin, betulinic acid, and oleanolic acid potentiated β-cell function and mass and enhanced hepatic insulin sensitivity[J].Evidence-Based Complementary and Alternative Medicine, 2016:1-13. DOI:10.1155/2016/7836823.
[56] BRUSOTTI G, MONTANARI R, CAPELLI D, et al. Betulinic acid is a PPARγ antagonist that improves glucose uptake, promotes osteogenesis and inhibits adipogenesis[J]. Scientific Reports, 2017,7(1): 5777. DOI:10.1038/s41598-017-05666-6.
[57] KIM S J, QUAN H Y, JEONG K J, et al. Beneficial effect of betulinic acid on hyperglycemia via suppression of hepatic glucose production[J]. Journal of Agricultural and Food Chemistry, 2013,62(2): 434-442. DOI:10.1021/jf4030739.
[58] DING Huafang, WU Xiaqing, PAN Junhui, et al. New insights into the inhibition mechanism of betulinic acid on α-glucosidase[J].Journal of Agricultural and Food Chemistry, 2018, 66(27): 7065-7075.DOI:10.1021/acs.jafc.8b02992.
[59] LI Guoliang, KONG Weiheng, ZHAO Mei, et al. A fluorescence resonance energy transfer (FRET) based “Turn-On” nanofluorescence sensor using a nitrogen-doped carbon dot-hexagonal cobalt oxyhydroxide nanosheet architecture and application to α-glucosidase inhibitor screening[J]. Biosensors and Bioelectronics, 2016, 79: 728-735. DOI:10.1016/j.bios.2015.12.094.
[60] KHUSNUTDINOVA E F, PETROVA A V, THU H N T, et al.Structural modifications of 2,3-indolobetulinic acid: design and synthesis of highly potent α-glucosidase inhibitors[J]. Bioorganic Chemistry, 2019, 88: 102957. DOI:10.1016/j.bioorg.2019.102957.
[61] SEONG S H, ROY A, JUNG H A, et al. Protein tyrosine phosphatase 1B and α-glucosidase inhibitory activities of Pueraria lobata root and its constituents[J]. Journal of Ethnopharmacology, 2016, 194: 706-716. DOI:10.1016/j.jff.2014.04.017.
[62] 肖洁, 尹松梅, 谢双锋, 等. 槲皮素调控AMPK活性诱导HL-60细胞自噬与凋亡[J]. 中山大学学报(医学版), 2018, 39(4): 501-509.DOI:10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).20180607.019.
[63] BAI Ting, YANG Yong, YAO Youli, et al. Betulin alleviated ethanol-induced alcoholic liver injury via SIRT1/AMPK signaling pathway[J]. Pharmacological Research, 2016, 105: 1-12. DOI:10.1016/j.phrs.2015.12.022.
[64] 王存琴, 张艳华. 大叶冬青的化学成分及药理活性研究进展[J]. 中国药房, 2014, 25(11): 1052-1054. DOI:10.6039/j.issn.1001-0408.2014.11.32.
[65] SONG Peifang, ZHU Yadi, MA Hongying, et al. Discovery of natural pentacyclic triterpenoids as potent and selective inhibitors against human carboxylesterase 1[J]. Fitoterapia, 2019, 137: 104199.DOI:10.1016/j.fitote.2019.104199.
[66] 狄英波, 张桂英, 吴光健, 等. 白桦脂醇对大鼠酒精性肝损伤的保护作用[J]. 吉林大学学报(医学版), 2009, 35(2): 210-213.DOI:10.13481/j.1671-587x.2009.02.008.
[67] 夏伟, 朱若岑, 蒋维维, 等. 桦木酸对小鼠酒精性肝损伤的保护作用[J]. 营养学报, 2015, 37(1): 68-72. DOI:10.13325/j.cnki.acta.nutr.sin.2015.01.025.
[68] FERNÁNDEZ-MARTÍNEZ E, JIMÉNEZ-SANTANA M,CENTENO-ÁLVAREZ M, et al. Hepatoprotective effects of nonpolar extracts from inflorescences of thistles Cirsium vulgare and Cirsium ehrenbergii on acute liver damage in rat[J]. Pharmacognosy Magazine,2017, 13(Suppl 4): S860-S867. DOI:10.4103/pm.pm_260_17.