随着人们对食品由需求型向质量型转变,食品安全问题已成为全世界关注的一个焦点。食品安全问题主要包括农兽药残留超标、重金属超标、生物毒素、微生物性危害和食品掺假等安全性问题。近年来食品安全问题频发,这不仅威胁到人类的健康和生命财产安全,同时还制约着整个国家的进出口贸易及经济发展。实施有效的食品安全监管是保障食品安全的重要手段,而有效的食品安全监管离不开相应的食品安全监测技术[1],国内食品安全监管部门也将监管模式由部门监督逐步向技术监管转变[2]。因此,发展快速、高灵敏食品安全检测方法显得尤其重要。
目前常用的食品安全检测技术主要有色谱分析法[3]、免疫分析法[4]、荧光分析法[5]和传感器技术[6]。色谱法是目前国家标准中的常规检测技术之一,与质谱技术的联用是我国大部分食品安全监测的重要手段[7],但是该分析方法操作相对繁琐、处理时间长、仪器设备昂贵、维护成本高,需要操作熟练的技术人员。免疫分析法是以抗原与抗体的特异性、可逆性结合反应为基础的分析方法,最常见的就是酶联免疫吸附测试法(enzyme-linked immunosorbent assay,ELISA),是目前一类重要的快速筛选方法,适用于现场检测,但灵敏度有待提高。荧光分析法是使用荧光物质或潜荧光物质作为标记物的分析方法,由于背景干扰较大等原因,灵敏度不高,适合做定性分析,而在定量分析方面难以实现较高精密度[8]。目前快速发展的传感器是一种能感受到被测量的信息,并能将感受到的信息按一定规律变换成为电信号或其他所需形式的信息输出的检测装置。它具有简单快速、灵敏和易操作等特点。传感器通常由敏感元件和转换元件组成。依据敏感元件的不同可分为三大类:第一类是基于力、热、光、电、磁和声等物理效应的物理传感器;第二类是基于化学反应的化学传感器;第三类是基于酶、抗体等分子识别功能的生物传感器。研究者借助传感器可以直接获取大量人类感官无法直接获取的信息,这使得它在科学研究中具有非常重要的地位。随着化学、生物、计算机等学科的快速发展,目前开发的传感器与纳米材料、生物材料等相结合,在食品安全检测领域发挥了越来越重要的作用。
食品基质复杂且大部分有害残留物残留浓度低,现有的食品安全检测技术很难满足既快速又灵敏的检测要求,故急需发展更快、更敏感的检测方法,以保证食品安全。传感器技术是目前研究较多的食品安全快速检测方法。其中表面等离子体共振(surface plasmon resonance,SPR)传感器因灵敏度高、检测速度快、检测限低、可连续监测、所需试剂量少等优点在食品安全检测领域发展迅速[9-11]。SPR传感器技术于20世纪80年代由瑞典科学家Liedberg等首次运用于免疫球蛋白G抗体与其抗原相互反应的测定,随后该技术被引入生物传感器领域并迅速渗透到其中,在20世纪90年代开始陆续出现了较为成熟的SPR技术测量的商业化产品[12],此后SPR传感器的研究进入飞速发展的阶段[13-14]。SPR传感器相对于传统的检测手段更加快速灵敏,不仅能通过检测获得被分析物的浓度、亲和力、动力学常数和特异性等信息,还能对其进行实时监测,在食品安全检测领域得到了广泛的关注。
1 SPR传感器的基本原理
SPR是一种光学物理现象,一束P偏振光在一定的角度范围内(入射角大于临界角)入射到棱镜端面,在棱镜与金属膜表面发生全反射现象,会形成消逝波进入到光疏介质中,并引发金属薄膜中的自由电子形成表面等离子体(surface plasmon,SP)。SP的集体振荡能够产生一种沿着界面传播的横向电磁波,即表面等离子波(surface plasmon wave,SPW)。当消逝波的波矢量与SPW的波矢量相等时,引起金属膜内自由电子产生共振,即SPR。当发生SPR时,检测到的反射光强会大幅度减弱。此时,光子转移到表面等离子,入射光的大部分能量被表面等离子波吸收,使反射光的能量急剧减少,其中反射光完全消失的角就是SPR角。SPR角随金属薄膜表面折射率的改变而改变,任何附着在金属薄膜表面物质的量、构型等发生改变时,均可被检测出来[8],其原理见图1。在对样品分析检测时,先在传感芯片表面固定一层分子识别膜,然后将待测样品流过芯片表面,若样品中有能够与芯片表面的分子识别膜相互作用的分子,会引起金膜表面折射率变化,最终导致SPR角度变化。通过检测SPR角度变化,获得被分析物的浓度、亲和力、动力学常数和特异性等信息,并且能够实时直接观察分子相互作用[8-9,15]。
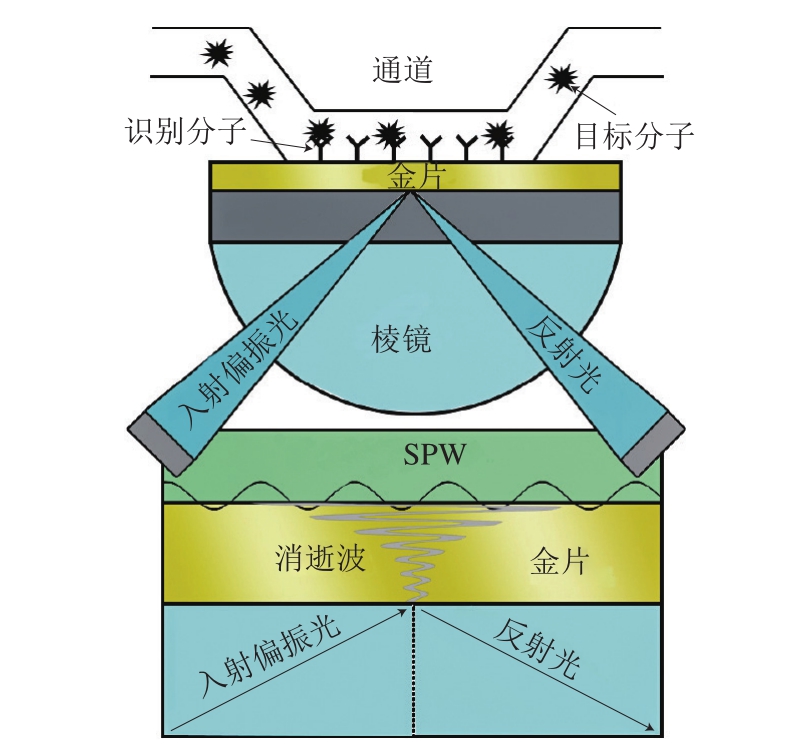
图1 SPR传感器原理图
Fig. 1 Schematic diagram of the principle of SPR sensor
2 SPR传感器在食品检测中的应用
SPR传感器由于其快速、高灵敏且无需标记的特点已成为食品安全检测中一项先进的检测技术[16]。目前SPR传感器在食品安全检测中的应用研究主要在检测农兽药残留、重金属、有害微生物及生物毒素等方面。
SPR传感器的检测方法主要有3 种,即直接法、夹心法和竞争法(图2)[8,17]。直接法是将可特异性识别待测物的配体(如抗体、适配体等大分子物质)偶联到SPR传感芯片上直接与受体(待测物)结合,适用于检测分子质量大于10 kDa的物质,因为分子质量小的物质引起的折射率小,使检测的灵敏度降低。夹心法也称为三明治法,该方法在直接法的基础上再引入第二种配体,用两个配体来固定待测物,提高了检测的灵敏度和特异性。这种方法只适用于检测至少有两个抗原决定簇的分子。竞争法也称为间接法,分为表面竞争法和溶液竞争法,常用于检测小分子。表面竞争法是将配体固定到传感芯片表面上,让混合有待测物以及与待测物结合的大分子物质的溶液流过传感芯片表面,使待测物同时与芯片表面的配体和溶液中的大分子物质竞争结合,因为大分子物质的用量是一定的,故可间接检测到待测物的浓度。溶液竞争法是将待测物通过一定的方法固定到传感器芯片,注入的样品溶液混合有待测物和能与待测物特异性结合的配体,样品溶液中待测物与芯片表面固定的待测物竞争性的结合溶液中的配体,此时SPR响应信号与样品溶液待测物浓度成反比,可间接获得待测物浓度。
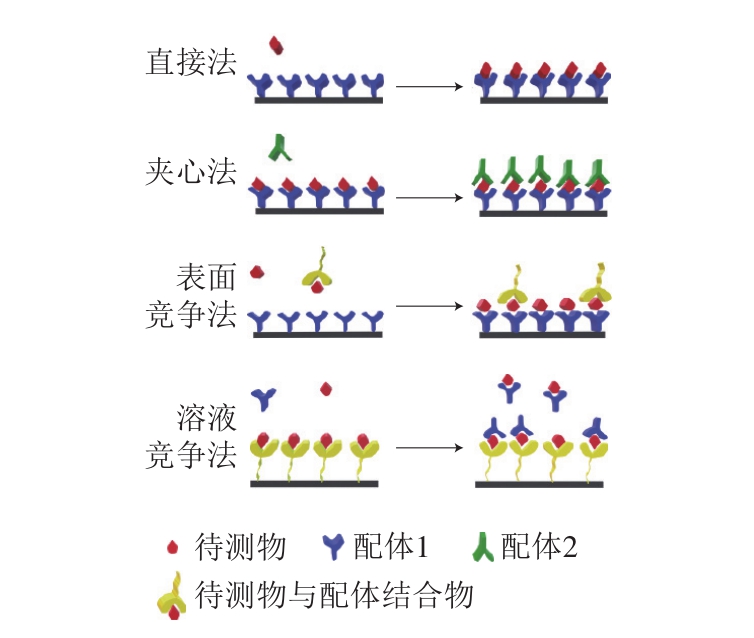
图2 SPR传感器检测待测物的方法示意图
Fig. 2 Schematic diagram of using SPR sensor for detecting targets
2.1 食品中农药残留的检测
随着农药大量生产和广泛使用,农药残留问题逐渐成为影响食品安全的重要隐患。果蔬中残留农药在人体内长期蓄积、滞留还会引发慢性中毒,诱发许多慢性疾病。目前,用SPR传感技术检测食品中农药残留已取得了很好的效果。
21世纪初,Oyama等[18]建立了一种基于核酸适配体来检测阿特拉津的新型的SPR传感器方法。该方法将含有P450 mRNA部分互补序列的DNA和肽核酸两种探针固定在传感器芯片上,成功检测到了10 ng/L的阿特拉津,这种方法可以敏感、快速和简单地检测农药残留。为了提高SPR传感器的灵敏度,降低检测下限,金属纳米材料常用来增强SPR响应信号[19]。如Li Qian等[20]利用Au/Fe3O4纳米复合材料和单克隆抗体对SPR传感器金片表面进行进一步修饰,获得了多菌灵的实时检测传感器,由于使用了纳米复合材料,进而放大了SPR响应信号,获得了更高的灵敏度。结果表明,该方法检测多菌灵在0.05~150 ng/mL范围内线性关系良好,检出限为0.44 ng/mL。枸杞样品的加标回收率为102.4%~115.0%,证明了这种基于Au/Fe3O4纳米复合材料的SPR传感器方法,对于微量分析物的检测具有很大的潜力。
近年来,纳米材料与分子印迹技术的结合给SPR传感器带来了创新的检测方法,如基于磁纳米粒子与分子印迹技术的磁分子印迹纳米粒子,相对于抗体检测成本得到了极大得降低,又保持了一定的分子特异性识别和放大SPR信号的能力,且磁性可以加快样品前处理的速度,节省时间。Yao Guihong等[21]报道了一种应用磁分子印迹聚合物提高SPR传感器检测毒死蜱灵敏度的方法,该方法在0.001~10 mmol/L范围内显示出良好的线性关系,检出限为0.76 nmol/L。Liu Xia等[22]发明了一种将SPR传感器技术与磁性纳米粒子相结合的直接检测大豆中溴氰菊酯的新方法。与抗原特异性结合的免疫磁性纳米粒子既可作为标记,又能够增强SPR的折射率变化。结果表明,在0.01~1 ng/mL范围内SPR的折射率变化与溴氰菊酯质量浓度呈良好的线性关系,检测下限为0.01 ng/mL,与SPR传感器直接检测相比,灵敏度提高了4 个数量级。上述SPR传感器的成功构建,实现了样品前处理和传感器检测的完美结合,不仅检测时间大大缩短,且检测的准确性和灵敏度也得到了提高,为样品前处理与传感器检测一体化开辟了新的途径。
2018年,Hirakawa等[23]开发了多通道同时测定3 种农药——啶酰菌胺、噻虫胺和烯啶虫胺的SPR免疫传感器。他们将3 种农药与牛血清白蛋白的缀合物固定在同一传感器芯片的不同通道上。当3 种单克隆抗体的混合物注入SPR免疫传感器时,每种通道会显示出特异性反应性。该方法对啶酰菌胺、噻虫胺和烯敏丙胺的检测线性范围分别为15~93、6.7~27 ng/mL和7.3~62 ng/mL。使用掺有啶酰菌胺、噻虫胺和烯啶虫胺混合物的蔬菜进行的回收率实验显示出良好的结果,回收率分别为75%~90%、88%~104%和72%~105%。该方法论证了SPR传感器可用于同时测定蔬菜中的多种农药残留。同年,Thepudom等[24]将SPR与化学传感器相结合,成功开发了使用SPR增强的光电化学传感系统检测农药毒死蜱。当样品以不同浓度注入电解质时,基于短路光电流的增加能够检测到毒死蜱的存在。通过金纳米颗粒的局部SPR和光栅耦合传播SPR的效果增强了短路光电流信号,使其可检测浓度低至7.5 nmol/L的毒死蜱。这项工作表明,多种传感的结合是传统检测农药残留技术的有前途的替代品。他们所提出的基于短路光电流信号的设计思想,可为传感器敏感元件的创新构建提供新的方向。
2.2 食品中兽药残留的检测
动物源食品中的兽药残留对人体健康产生了潜在的危险[25-26],而待测物质具有浓度低、浓度差异大、样品基质复杂、干扰物质多、残留种类及代谢产物多样等特点。目前动物源食品中主要的兽药残留包括四环素类、磺胺类、大环内酯类和喹诺酮类抗生素。SPR传感器在兽药残留检测中的应用非常早,20世纪90年代Sternesjö等[27]就应用SPR传感器建立了一种测定牛奶中磺胺嘧啶(sulfamethazine,SMZ)的方法,该方法将SMZ共价固定到羧甲基右旋糖酐修饰的金膜上,添加了已知浓度SMZ的牛奶样品,并建立了标准曲线。在样品中加入SMZ的多克隆抗体,利用固定表面通过SPR传感器检测确定游离抗体的量。在牛奶样品检测中,该方法的平均相对标准偏差约为2%,检出限小于1 mg/kg。
芯片表面的再生是很困难的,而不适当的再生也会缩短传感器芯片的使用寿命,造成结果的不准确性,Li Hui等[28]建立了磺胺甲基嘧啶(sulfamerazine,SMT)的SPR传感器连续检测方法。将SMT-牛血清白蛋白偶联物固定在羧甲基右旋糖酐修饰的金膜上,通过研究抗原的固定条件和优化抗体的稀释浓度实现了金片再生和连续检测。用磷酸盐缓冲液配制不同浓度的SMT抗体,建立了标准曲线,检出限为0.5 ng/mL。近年来,科研人员开发了更低廉更灵敏的SPR检测兽药残留的方法,用于检测动物源食品中的兽药残留,如蜂蜜[29]、牛奶[30]等样品。在2013年,Verma等[31]利用SPR传感器和分子印迹聚合物,以盐酸四环素和盐酸氧四环素两种四环素作为模板分子,构建了SPR检测四环素类抗生素的新方法,检测范围为0.0~0.96 mmol/L,该传感器适用于食品中四环素类抗生素的商业化检测,具有成本低、操作方便、探头小型化、响应速度快、选择性高、可重复性好等优点。Shrivastav等[32]开发了一种利用表层有分子印迹纳米镀银涂层的光纤芯来检测红霉素的SPR传感器,线性范围为1.62 nmol/L~100 μmol/L,最低检测限为1.62 nmol/L,该团队还对传感器在实际样品中的适用性进行了研究,发现该传感器与工业应用吻合较好、响应速度快(响应时间不到15 s)、简单、成本低、选择性强等优点,具有对分析物进行在线监测和遥感的能力。随后,Sari等[33]在2018年开发了一种新的SPR纳米传感器,其结合了微乳液聚合、分子印迹和SPR这3 种技术,建立了更快速、更有选择性地测定水溶液中红霉素的传感器检测方法。SPR在食品兽药残留检测中的开发利用,使得痕量的残留能被检测,提高了食品安全检测的灵敏度,更加利于对食品安全的监督管理,也为以后食品安全标准法规的建立提供了参考。
2.3 食品中致病菌的检测
致病菌的检测是预防发生食源性疾病的关键。如果不能及时发现致病菌污染,可能会产生极其严重的食源性疾病。这要求在尽可能短的时间内获得致病菌检测分析的结果,但传统和标准的致病菌检测方法可能需要7~8 d才能得到结果。
20世纪90年代,科学家们对用SPR传感器检测致病菌已进行了初步的探索并取得了很好的效果。1998年,Fratamico等[34]开发了用于快速、实时检测大肠杆菌O157:H7的SPR传感器。他们在芯片上固定了蛋白A或蛋白G捕获抗体,这些抗体又能与大肠杆菌结合,从而实现对大肠杆菌的检测。此后,应用SPR传感器检测致病菌成为了热门的研究方向[35-37]。2006年,Zezza等[38]开发了一种基于DNA分子杂交的SPR传感器,对小麦中的真菌病原体黄色镰孢菌进行检测。以0.57 kb的黄色镰孢菌DNA杂交片段的聚合酶链式反应扩增产物作为核苷酸探针,将探针固定在链球菌传感器芯片上,并测试其与黄色镰孢菌聚合酶链式反应产物的生物特异性相互作用。该传感器成功用于检测不同培养方式以及小麦样品中自然感染的黄色镰孢菌,结果表明,该传感器对黄色镰孢菌具有良好的特异性,对检测溶液中含30 ng硬质小麦的样品,其检测下限为0.06 pg,所开发的SPR传感器显示了更高的灵敏度。在2012年,Torun等[39]对基于4 种不同传感芯片检测大肠杆菌的SPR传感器进行了比对分析:1)将抗体非特异性地固定到SPR芯片表面检测大肠杆菌;2)通过亲和素-生物素相互作用将抗体定向固定到SPR芯片表面检测大肠杆菌;3)自组装单层共价固定抗体到SPR芯片表面检测大肠杆菌;4)大肠杆菌用免疫镀金磁纳米分离并进行SPR传感器测量(图3)。结果表明,4 种方法中最有效的方法是基于镀金磁纳米粒子的方法。这种方法可以从样品中快速简单分离大肠杆菌,并在没有任何标记的情况下快速检测量化。该方法的线性范围在30~3.0×104 CFU/mL之间,检测限为3 CFU/mL。
此后,Vaisocherová-Lísalová等[40]也报道了一种利用三步检测法快速、灵敏地检测食品中致病菌的多通道SPR传感器,该传感器可以同时检测大肠杆菌O157:H7和沙门氏菌,并在对实际样品汉堡包和黄瓜检测时显示了良好的敏感性和特异性。对黄瓜和汉堡提取物中大肠杆菌O157:H7的检出限分别为57、17 CFU/mL和7 CFU/mL,沙门氏菌分别为4×103 CFU/mL和11.7×103 CFU/mL。此后,开发多通道SPR传感器致病菌检测技术成为了热门[41-42]。
SPR传感器在致病菌检测方法的开发和创新,已经实现了快速、高灵敏、低检测限和多通道检测,因此可以在初期就能发现致病菌的存在,对于预防食源性疾病的发生具有重要意义。
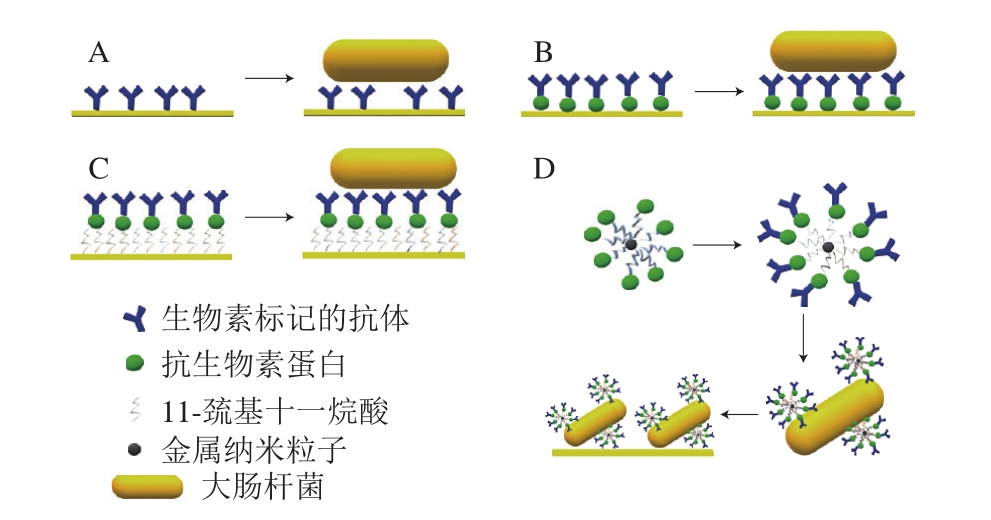
图3 SPR生物传感器传感策略示意图
Fig. 3 Schematic illustration of sensing strategies in SPR biosensors
A.将抗体非特异性地固定到SPR芯片表面检测大肠杆菌;B.通过亲和素-生物素相互作用将抗体定向固定到SPR芯片表面检测大肠杆菌;C.自组装单层共价固定抗体到SPR芯片表面检测大肠杆菌;D.大肠杆菌用免疫镀金磁纳米分离并进行SPR传感器检测。
2.4 食品中重金属的检测
食品中重金属主要包括汞、镉、铅、铬以及类金属砷等生物毒性显著的金属元素,由于重金属难以被生物降解,因此会通过食物链成千百倍地富集进入人体,对人体造成严重的健康危害。利用SPR传感技术检测食品中的重金属残留是日渐成熟的一种方法。
Wu等[43]开发了基于哺乳动物金属硫蛋白(metallothionein,MT)检测金属离子的SPR传感器。该方法通过在传感器芯片上的羧甲基葡聚糖固定MT,可以结合镉、锌或镍,而不结合镁、锰和钙。他们在确定了MT固定化的最适pH值(pH 4.0)和结合金属离子的最佳温度(30 ℃)的条件下,检测镉、锌或镍的浓度可以达到mmol/L水平,可以用于定性和定量检测金属离子镉、锌和镍。Caglayan等[44]采用自组装方法将牛血清白蛋白和特异性适配体固定在传感器芯片上,开发了两种检测汞离子的SPR传感器方法。结果显示,基于蛋白质的SPR传感器检测限为40.7 nmol/L,而基于适配体的SPR传感器检测限为26.0 pmol/L,且基于适配体的SPR传感器的选择性高于基于蛋白质的SPR传感器。银与汞离子可以形成汞合金,汞离子的吸附、氧化还原反应以及汞齐化会影响银纳米粒子的SPR效应,而大多数过渡金属离子不会发生这种反应。基于该原理,Ramesh等[45]制备了银纳米粒子包埋聚乙烯醇的薄膜,并将其作为SPR传感器芯片,对金属汞离子进行了快速、高效和选择性的检测。该传感器检测汞离子的线性范围为10 μg/kg~1 mg/kg,检测下限为1 μg/kg,有效解决了检出的汞浓度难以达到微克级的问题。更重要的是,这种传感器可以在现场使用,可用于监管部门现场检测以便及时发现食品安全隐患,也可以应用在食品原产地、工厂和市场的检验过程,筛选出不合格产品。
2.5 食品中生物毒素的检测
生物毒素又称天然毒素,是指生物来源并不可自复制的有毒化学物质,包括动物、植物、微生物产生的对其他生物物种有毒害作用的各种化学物质。早在1998年,Hsieh等[46]就利用SPR传感器建立了一种快速检测产气荚膜梭菌β毒素的分析方法,通过传感器芯片对产气荚膜梭菌β毒素单克隆抗体的发酵液进行离线免疫,在20 min内可以得到结果,在实验过程中还可实时监测生产过程中β毒素的积累。同期,Mullett等[47]开发一种用来测定真菌毒素——伏马菌素B1的SPR传感器。将伏马菌素B1的多克隆抗体固定在金膜表面后,通入含有伏马菌素B1的样品,进行直接检测。在抗体固定化步骤优化后,SPR传感器直接检测的检出限为50 ng/mL,分析时间短于10 min。
此后,Homola等[48]开发了一种用于检测牛奶中葡萄球菌肠毒素B的SPR传感器,并用直接法和夹心法两种方法检测了葡萄球菌肠毒素B。结果表明该传感器可直接检测葡萄球菌肠毒素B,最低检测限为5 ng/mL,而在夹心检测模式下最低检测限为0.5 ng/mL,可用于检测复杂食品基质中各种微量的生物毒素。此后,SPR传感器检测生物毒素的检测技术也在不断地发展成熟[49]。所构建的SPR传感器检测时间短、灵敏度高、特异性强,能够及时检测出食品中含有的微量生物毒素,避免食品中毒事件的发生。
2.6 SPR在食品中其他有害物检测中的应用
除了农兽药残留、致病菌、重金属和生物毒素以外,SPR传感器还被应用到检测食品中其他有害物质,如非法添加物[50]、过敏原[51]和其他化学成分[52]等。2008年,Thompson等[53]为了监测欧洲境内非法使用莱克多巴胺的状况,建立了一种基于溶液竞争法的SPR免疫传感器。将所建立的方法与液相色谱-串联质谱验证性方法进行了比较。结果表明,两种检测方法都能够检测出尿液和肝脏中低含量(μg/kg)的莱克多巴胺,且结果一致。Li Ying等[54]建立了一种基于SPR的盐酸克伦特罗快速检测技术。他们首先应用直接法,通过研究盐酸克伦特罗与抗体相结合的动力学过程,获得其亲和力,对盐酸克伦特罗的抗体进行了筛选和。选用亲和力最强的抗体,应用竞争方法对盐酸克伦特罗进行了检测,该方法的检出限低于2 μg/L。检测猪肉提取物样品中盐酸克伦特罗的质量浓度为2.75 μg/L。
此后,Kabiraz等[55]开发了一种用于高灵敏度检测盐酸克伦特罗的SPR免疫传感器。由于尿液中含有免疫反应抑制剂,而这种抑制剂不能通过物理方法去除。该研究提出了用羧基改性的二氧化硅去除尿样中抑制剂的过滤方法,有效地除去了免疫反应抑制剂。结果显示,去除免疫反应抑制剂后,该传感器对盐酸克伦特罗的检测限达到了100 fg/mL。牛奶中非法添加三聚氰胺,导致婴幼儿健康受到极大的威胁,近年来研究人员开发了多种SPR传感器检测三聚氰胺的方法。其中,Zhang Lili等[56]在2018年开发了用于检测牛奶和奶粉中痕量的三聚氰胺的SPR传感器方法,该方法在0.1~10.0 nmol/L范围线性关系良好,相关系数为0.999 1,用于检测牛奶和奶粉的检测限分别为62.6 pmol/L和56.4 pmol/L。这些研究为食品中其他有害物的检测提供了新的思路,通过不断地创新发展,实现了从低浓度检测到痕量检测的飞跃,极大提高了检测的灵敏度,保障了食品安全。
3 结 语
经过几十年的发展与应用,SPR传感器仪器及其检测方法得到了进一步发展与成熟。从单通道SPR传感器到多通道SPR传感器,实现了高灵敏多组分同时检测。而便携式SPR传感器可实现现场实时筛选与监测,有望走出实验室走向大众化。随着SPR仪器的不断完善和分子识别芯片构建能力的不断增强,未来SPR传感器仪器更加便携和智能化,可实现大量样品的实时检测和分子水平的快速、超痕量分析。同时,与电化学传感技术、色谱技术等的联用也必将拓宽SPR传感器在检测领域的应用。虽然目前国内外用于食品安全检测的主要仪器还是液相色谱、质谱等传统仪器,相信在不久的将来,SPR传感器在食品安全领域会得到更加广泛的应用。可以期待SPR传感器在现场对食品中危害物进行筛查和快速定性定量检测,以消除食品安全隐患,保障国民的生命健康。
[1] 王静, 王淼. 我国食品安全快速检测技术发展现状研究[J]. 农产品质量与安全, 2014(2): 42-47. DOI:10.3969/j.issn.1674-8255.2014.02.014.
[2] 李波, 李雪, 刘师卜, 等. 中国食品安全检查员监管制度构建探索[J].食品科学, 2019, 40(15): 352-358. DOI:10.7506/spkx1002-6630-20190130-384.
[3] ANA M, SUAREZ-VARELA M M, LLOPIS-GONZALEZ A, et al.Determination of pesticides and veterinary drug residues in food by liquid chromatography-mass spectrometry: a review[J]. Analytica Chimica Acta, 2016, 936: 40-61. DOI:10.1016/j.aca.2016.07.023.
[4] ZHAO L. Detection of penicillinase in milk by sandwich ELISA based polyclonal and monoclonal antibody[J]. Journal of Immunoassay and Immunochemistry, 2016, 37(1): 80-89.DOI:10.1080/15321819.2015.1050108.
[5] 李研东, 韩雪, 吴雨洋, 等. 动物性食品中四环素类药物残留量子点荧光免疫技术研究[J]. 农产品质量与安全, 2017(5): 83-86; 91.DOI:10.3969/j.issn.1674-8255. 2017.05.016.
[6] 邱清华, 邓绍云. 我国食品检测技术发展现状与展望[J]. 江苏科技信息, 2014(21): 47-48. DOI:10.3969/j.issn.1004-7530.2014.21.019.
[7] 李佐卿, 倪梅林, 俞雪钧, 等. 液相色谱-串联质谱法检测水产品中磺胺类和喹诺酮类药物残留[J]. 分析测试学报, 2007(4): 508-510; 514.DOI:10.3969/j.issn.1004-4957.2007.04.013.
[8] 刘霞, 李蕾, 李文进, 等. 表面等离子共振传感器快速检测农药残留的研究进展[J]. 食品安全质量检测学报, 2013, 4(2): 321-327.
[9] 许春华. 表面等离子共振生物传感器在食品检测中的应用现状[J].粮食与食品工业, 2017, 24(4): 55-57.
[10] HOA X D, KIRK A G, TABRIZIAN M. Towards integrated and sensitive surface plasmon resonance biosensors: a review of recent progress[J]. Biosens Bioelectron, 2007, 23(2): 151-160. DOI:10.1016/j.bios.2007.07.001.
[11] 缪璐, 张水华, 刘仲明. SPR传感器在食品检测中的应用[J]. 食品科技,2006, 31(8): 266-268; 279. DOI:10.3969/j.issn.1005-9989.2006.08.080.
[12] 鲍蕾, 许艳丽, 梁成珠, 等. 表面等离子共振生物传感器在食品检测中的应用[J]. 检验检疫学刊, 2012, 22(4): 45; 73-76. DOI:10.3969/j.issn.1674-5354.2012.04.019.
[13] HUET A C, DELAHAUT P. Advances in biosensor-based analysis for antimicrobial residues in foods[J]. Trends in Analytical Chemistry,2010, 29(11): 1281-1294. DOI:10.1016/j.trac.2010.07.017.
[14] SINGH P K, JAIRATH G, AHLAWAT S S, et al. Biosensor: an emerging safety tool for meat industry[J]. Journal of Food Science and Technology, 2015, 53(4): 1759-1765. DOI:10.1007/s13197-015-2041-7.
[15] 赵晓君, 陈焕文, 宋大千, 等. 表面等离子体子共振传感器I: 基本原理[J].分析仪器, 2000(4): 1-8. DOI:10.3969/j.issn.1001-232X.2000.04.001.
[16] YAKES B J, BUIJS J, ELLIOTT C T, et al. Surface plasmon resonance biosensing: approaches for screening and characterising antibodies for food diagnostics[J]. Talanta, 2016, 156: 55-63. DOI:10.1016/j.talanta.2016.05.008.
[17] 魏星华, 闵成军, 凡强胜, 等. 利用SPR生物传感器检测盐酸克伦特罗[J]. 肉类工业, 2013(2): 38-41. DOI:10.3969/j.issn.1008-5467.2013.02.011.
[18] OYAMA M, IKEDA T, LIM T, et al. Detection of toxic chemicals with high sensitivity by measuring the quantity of induced P450 mRNAs based on surface plasmon resonance[J]. Biotechnology and Bioengineering, 2000, 73(3): 217-222. DOI:10.1002/1097-0290(2000)71:3<217::aid-bit1011>3.0.co;2-w.
[19] JIAN W, YING S, WANG L Y, et al. Surface plasmon resonance biosensor based on Fe3O4/Au nanocomposites[J]. Colloids &Surfaces B-Biointerfaces, 2010, 81(2): 600-606. DOI:10.1016/j.colsurfb.2010.08.007.
[20] LI Qian, DOU Xiaowen, ZHAO Xiangsheng, et al. A gold/Fe3O4 nanocomposite for use in a surface plasmon resonance immunosensor for carbendazim[J]. Microchimica Acta, 2019, 186(5): 313.DOI:10.1007/s00604-019-3402-0.
[21] YAO Guihong, LIANG Ruping, HUANG Chunfang, et al. Surface plasmon resonance sensor based on magnetic molecularly imprinted polymers amplification for pesticide recognition[J]. Analytical Chemistry, 2013, 85(24): 11944-11951. DOI:10.1021/ac402848x.
[22] LIU Xia, LI Lei, LIU Youqian, et al. Ultrasensitive detection of deltamethrin by immune magnetic nanoparticles separation coupled with surface plasmon resonance sensor[J]. Biosensors &Bioelectronics, 2014, 59: 328-334. DOI:10.1016/j.bios.2014.03.020.
[23] HIRAKAWA Y, YAMASAKI T, HARADA A, et al. Development of an immunosensor based on surface plasmon resonance for simultaneous residue analysis of three pesticides: boscalid, clothianidin, and nitenpyram: in vegetables[J]. Analytical Sciences, 2018, 34(5): 533-539. DOI:10.2116/analsci.17P487.
[24] THEPUDOM T, LERTVACHIRAPAIBOON C, SHINBO K, et al.Surface plasmon resonance-enhanced photoelectrochemical sensor for detection of an organophosphate pesticide chlorpyrifos[J]. MRS Communications, 2018, 8(1): 107-112. DOI:10.1557/mrc.2017.131.
[25] TUYET-HANH T T, SINH D X, PHUC P D, et al. Exposure assessment of chemical hazards in pork meat, liver, and kidney, and health impact implication in Hung Yen and Nghe An provinces,Vietnam[J]. International Journal of Public Health, 2016, 62(Suppl 1):75-82. DOI:10.1007/s00038-016-0912-y.
[26] BAYNES R E, DEDONDER K, KISSELL L, et al. Health concerns and management of select veterinary drug residues[J].Food and Chemical Toxicology, 2016, 88: 22-112. DOI:10.1016/j.fct.2015.12.020.
[27] STERNESJÖ A, MELLGREN C, BJÖRCK L. Determination of sulfamethazine residues in milk by a surface plasmon resonance-based biosensor assay[J]. Analytical Biochemistry, 1995, 266(1): 175-181.DOI:10.1006/abio.1995.1206.
[28] LI Hui, CAI Haoyuan, CHEN Xing, et al. Continuous immunoassay for sulfamethazine by surface plasmon resonancebased biosensor[J]. Analytical Letters, 2010, 43(3): 499-507.DOI:10.1080/00032710903402556.
[29] WANG S, DONG Y Y, LIANG X G. Development of a SPR aptasensor containing oriented aptamer for direct capture and detection of tetracycline in multiple honey samples[J]. Biosensors and Bioelectronics, 2018, 109: 1-7. DOI:10.1016/j.bios.2018.02.051.
[30] LI H B, LI J, QIAO Y F, et al. Nano-gold plasmon coupled with dualfunction quercetin for enhanced photoelectrochemical aptasensor of tetracycline[J]. Sensors & Actuators B-Chemical, 2017, 243: 1027-1033. DOI:10.1016/j.snb.2016.12.032.
[31] VERMA R, GUPTA B D. Optical fiber sensor for the detection of tetracycline using surface plasmon resonance and molecular imprinting[J]. Analyst, 2013(23): 7254-7263. DOI:10.1039/C3AN01098H.
[32] SHRIVASTAV A M, USHA S P, GUPTA B D. Highly sensitive and selective erythromycin nanosensor employing fiber optic SPR/ERY imprinted nanostructure: application in milk and honey[J]. Biosens Bioelectron, 2016, 90: 516-524. DOI:10.1016/j.bios.2016.10.041.
[33] SARI E, ÜZEK R, DUMAN M, et al. Detection of ciprofloxacin through surface plasmon resonance nanosensor with specific recognition sites[J]. Journal of Biomaterials Science, Polymer Edition,2018, 29(11): 1302-1318. DOI:10.1080/09205063.2018.1457417.
[34] FRATAMICO P M, STROBAUGH T P, MEDINA M B, et al.Detection of Escherichia coli O157:H7 using a surface plasmon resonance biosensor[J]. Biotechnology Techniques, 1998, 12(7): 571-576. DOI:10.1023/A:1008872002336.
[35] WANG Y X, YE Z Z, SI C Y, et al. Subtractive inhibition assay for the detection of E. coli O157:H7 using surface plasmon resonance[J].Sensors, 2011, 11(12): 2728-2739. DOI:10.3390/s110302728.
[36] MEDINA M B, FRATAMICO P. Binding interactions of collagen I,laminin and fibronectin with immobilized Escherichia coli O157:H7 using a surface plasmon resonance biosensor[J]. Biotechnology Techniques, 1998, 12(3): 235-240. DOI:10.1023/A:1008829609813.
[37] LIU X, HU Y X, ZHENG S, et al. Surface plasmon resonance immunosensor for fast, highly sensitive, and in situ detection of the magnetic nanoparticles-enriched Salmonella enteritidis[J]. Sensors &Actuators: B. Chemical, 2016, 230: 191-198. DOI:10.1016/j.snb.2016.02.043.
[38] ZEZZA F, PASCALE M, MULÈ G, et al. Detection of Fusarium culmorum in wheat by a surface plasmon resonance-based DNA sensor[J]. Journal of Microbiological Methods, 2006, 66(3): 529-537.DOI:10.1016/j.mimet.2006.02.003.
[39] TORUN O, BOYACI I H, EMÜR E, et al. Comparison of sensing strategies in SPR biosensor for rapid and sensitive enumeration of bacteria[J]. Biosens Bioelectron, 2012, 37(1): 53-60. DOI:10.1016/j.bios.2012.04.034.
[40] VAISOCHEROVÁ-LÍSALOVÁ H, VÍŠOVÁ I, ERMINI M L, et al.Low-fouling surface plasmon resonance biosensor for multi-step detection of foodborne bacterial pathogens in complex food samples[J]. Biosensors and Bioelectronics, 2016, 80: 84-90. DOI:10.1016/j.bios.2016.01.040.
[41] TAYLOR A D, LADD J, YU Q M, et al. Quantitative and simultaneous detection of four foodborne bacterial pathogens with a multi-channel SPR sensor[J]. Biosensors and Bioelectronics, 2006, 22(5): 752-758.DOI:10.1016/j.bios.2006.03.012.
[42] ZHANG X G, TSUJI S, KITAOKA H, et al. Simultaneous detection of Escherichia coli O157:H7, Salmonella enteritidis, and Listeria monocytogenes at a very low level using simultaneous enrichment broth and multichannel SPR biosensor[J]. Journal of Food Science,2017, 82(10): 2357-2363. DOI:10.1111/1750-3841.13843.
[43] WU C M, LIN L Y. Immobilization of metallothionein as a sensitive biosensor chip for the detection of metal ions by surface plasmon resonance[J]. Biosens Bioelectron, 2004, 20(4): 864-871.
[44] CAGLAYAN M O. Plasmon resonance-enhanced internal reflection ellipsometry for the trace detection of mercuric ion[J]. International Journal of Environmental Science and Technology, 2018, 15(4): 909-914. DOI:10.1007/s13762-017-1450-8.
[45] RAMESH G V, RADHAKRISHNAN T P. A universal sensor for mercury (Hg, Hg-I, Hg-II) based on silver nanoparticle-embedded polymer thin film[J]. ACS Applied Materials & Interfaces, 2011, 3(4):988-994. DOI:10.1021/am200023w.
[46] HSIEH H V, STEWART B, HAUER P, et al. Measurement of Clostridium perfringens beta-toxin production by surface plasmon resonance immunoassay[J]. Vaccine, 1998, 16(9): 997-1003.DOI:10.1016/S0264-410X(97)00282-X.
[47] MULLETT W, LAI E P, YEUNG J M. Immunoassay of fumonisins by a surface plasmon resonance biosensor[J]. Analytical Biochemistry,1998, 258(2): 161-167. DOI:10.1006/abio.1998.2616.
[48] HOMOLA J, DOSTÁLEK J, CHEN S F, et al. Spectral surface plasmon resonance biosensor for detection of staphylococcal enterotoxin B in milk[J]. International Journal of Food Microbiology,2002, 75(1): 61-69. DOI:10.1016/s0168-1605(02)00010-7.
[49] MCNAMEE S E, ELLIOTT C T, DELAHAUT P, et al. Multiplex biotoxin surface plasmon resonance method for marine biotoxins in algal and seawater samples[J]. Environmental Science and Pollution Research International, 2012, 20(10): 6794-6807. DOI:10.1007/s11356-012-1329-7.
[50] HU J D, CHEN R P, WANG S, et al. Detection of clenbuterol hydrochloride residuals in pork liver using a customized surface plasmon resonance bioanalyzer[J]. PLoS ONE, 2015, 10(3): e0122005.DOI:10.1371/journal.pone.0122005.
[51] ASHLEY J, D’AURELIO R, PIEKARSKA M, et al. Development of a β-lactoglobulin sensor based on SPR for milk allergens detection[J].Biosensors (Basel), 2018, 8(2): 32. DOI:10.3390/bios8020032.
[52] HOSSAIN M B, RANA M M, ABDULRAZAK L F, et al. Graphene-MoS2 with TiO2-SiO2 layers based surface plasmon resonance biosensor: numerical development for formalin detection[J].Biochemistry and Biophysics Reports, 2019, 18: 100639.DOI:10.1016/j.bbrep.2019.100639.
[53] TOMPSON C S, HAUGHEY S A, TRAYNOR I M, et al. Effective monitoring for ractopamine residues in samples of animal origin by SPR biosensor and mass spectrometry[J]. Analytica Chimica Acta,2008, 608: 217-225. DOI:10.1016/j.aca.2007.12.019.
[54] LI Ying, QI Pan, MA Xiao, et al. Quick detection technique for clenbuterol hydrochloride by using surface plasmon resonance biosensor[J]. European Food Research and Technology, 2014, 239(2):195-197. DOI:10.1007/s00217-014-2201-4.
[55] KABIRAZ D C, MORITA K, SAKAMOTO K, et al. Highly sensitive detection of clenbuterol in urine sample by using surface plasmon resonance immunosensor[J]. Talanta, 2018, 186: 521-526.DOI:10.1016/j.talanta.2018.04.011.
[56] ZHANG Lili, LI Jie, CHEN Changbao, et al. Preparation of melamine molecularly imprinted surface plasmon resonance sensorandits analytical application[J]. Chinese Journal of Analytical Chemistry,2018, 46(1): 1153-1158.