淡奶油是一种以乳脂肪、蛋白质为原料,制成相对稳定的水包油型乳液,经搅打充气后形成由蛋白质稳定液相和脂肪球稳定气泡共存的泡沫结构产品[1],淡奶油与普通乳液相比更容易出现聚结、絮凝、乳析、奥氏熟化等不稳定现象[2],严重影响货架期。普通乳液只需在静置条件下保持稳定,而淡奶油既要满足在静置时保持相对稳定,又要在搅打过程中发生去稳定作用,促使脂肪球发生部分聚结[3]。
传统淡奶油是以鲜稀奶油为原料,鲜稀奶油常温下为液态,不便于贮藏和运输,且成本高。黄油是从牛乳中分离得到的脂肪质量分数大于80%的乳脂肪,常温下以固体状态存在,具有贮存期长、运输方便等优势,使黄油基奶油成为近些年研发的热点[4-8]。蛋白质是淡奶油的重要成分之一,研究表明,它可以吸附水油界面形成茹弹性界面膜以稳定乳液[9],还能与小分子乳化剂发生竞争性吸附作用促进脂肪部分聚结以稳定泡沫结构[10]。赵谋明等[11]研究表明酪蛋白酸钠添加量对淡奶油乳液的粒度分布、界面蛋白及流变学特性均有较大影响;Matsumiya等[12]证明了脂肪球膜上吸附蛋白质的含量是影响乳液稳定性的主要因素;Long Zhao等[13]研究表明酪蛋白酸钠和乳清蛋白的组合可以提高淡奶油泡沫的稳定性;Sajedi等[14]研究发现浓缩乳清蛋白可以增加搅打稀奶油的茹度、坚固性,改善其搅打性能;因此,研究蛋白质用量对黄油基淡奶油乳液性质及搅打性能的影响可为深入研究黄油基淡奶油提供理论指导。
本实验以黄油基淡奶油为研究对象,探究蛋白质用量对其搅打前乳液性质及搅打性能的影响。通过表征搅打前乳液的界面蛋白浓度、脂肪部分聚结率、微观结构、粒度分布、表观茹度,明晰蛋白质用量对乳液性质的影响,在此基础上进一步探究蛋白质用量对搅打过程中脂肪部分聚结率、平均粒径、搅打起泡率及泡沫稳定性的影响,并初步建立起乳液性质与搅打性能之间的联系,旨在为开发高品质、低成本的黄油基淡奶油产品提供理论指导。
1 材料与方法
1.1 材料与试剂
安佳无盐黄油(油脂质量分数82.9%)、酪蛋白酸钠(蛋白质质量分数90%) 新西兰恒天然集团;全脂奶粉(蛋白质质量分数24%) 雀巢(中国)有限公司;吐温80、大豆磷脂 丹尼斯克有限公司;卡拉胶肇庆海星生物科技有限公司;聚甘油脂肪酸酯 帕斯嘉(上海)食品添加剂有限公司;金龙鱼玉米油 益海嘉里粮油工业有限公司;油红O(分析纯) 上海麦克林生化科技有限公司;浓硫酸、氢氧化钠(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
AH-BASIC II高压均质机 德国ATS工程公司;FD50A立式压力蒸汽灭菌器 上海创萌生物科技有限公司;Mastersizer 2000型激光粒度分析仪 英国Malvern公司;SorvaII ST 16R高速离心机 德国Thermo Fisher科技公司;UV754N紫外-可见分光光度计 上海佑科仪器仪表有限公司;KDN-2C型凯氏定氮仪 上海纤检仪器有限公司;HAAKE MARS III旋转流变仪 德国Thermo Haake公司;CX31光学显微镜 日本奥林巴斯公司;WT-L01A型依时发奶油专用打发机 深圳市伟程日用品有限公司。
1.3 方法
1.3.1 黄油基淡奶油的基本配方
本实验用黄油基淡奶油配方如表1所示,其中蛋白质由酪蛋白酸钠和全脂奶粉以1∶3的质量比组成,其中酪蛋白酸钠中蛋白质质量分数90%,全脂奶粉中蛋白质质量分数24%。
表1 黄油基淡奶油的基本配方
Table 1Formulation of butter-based whipping cream

注:a、b、c、d、e分别表示蛋白质用量为1.0%、1.5%、2.0%、2.5%、3.0%时酪蛋白酸钠和全脂奶粉的添加量。
组分 质量分数/% 组分 质量分数/%黄油 41 吐温80 0.1卡拉胶 0.02 酪蛋白酸钠 0.66a;0.93b;1.25c;1.54d;1.87e聚甘油脂肪酸酯 0.2 全脂奶粉 1.98a;2.79b;3.75c;4.62d;5.61e大豆磷脂 0.1 去离子水 补至100
1.3.2 黄油基淡奶油的制备
黄油在60 ℃条件下融化,将混合均匀的酪蛋白酸钠、全脂奶粉、吐温80、大豆磷脂、卡拉胶等加入黄油中,搅拌均匀后,加入去离子水,于(60±1)℃恒温水箱中水化30 min,在30 MPa的压力下均质一次,然后灌装和灭菌(115 ℃,20 min),冷却后得到黄油基淡奶油乳液。将乳液放置在4 ℃冰箱中贮存24 h后,一部分用来测定乳液性质;另一部分用奶油打发机以160 r/min的速率进行搅打,每隔40 s取样一次进行搅打性能的测定。
1.3.3 界面蛋白浓度测定
参照Long Zhao等[15]的方法,准确称取20 g乳液,在30 ℃、10 000 r/min条件下离心30 min。由于未乳化的油脂密度最小,其次是乳化的油脂,而水的密度最大,故离心后从上至下形成游离油脂层、乳相层和水相层;离心结束时温度较高,迅速将离心管置于0 ℃左右的环境下,待上层游离油脂凝固后,用药匙小心将其移除,收集乳相层并准确称其质量,用凯氏定氮法测定乳相层中的蛋白质,界面蛋白浓度的计算公式如下:
式中:SSA为比表面积,由Mastersizer 2000型激光粒度分析仪测得。
1.3.4 脂肪部分聚结率测定
称取油红O色素0.015 g,加入1 000 g玉米油中,在(25±1)℃的条件下慢速搅拌12 h以上,确保油红O色素充分溶解,制备的油红O溶液需避光保存。准确称取乳液20 g和油红O溶液10 g置于100 mL离心管中,混合均匀,在(30±1)℃、10 000 r/min条件下离心30 min。离心后移取上层澄清透明的红色油液倒入比色皿,以未经处理的玉米油作为空白对照,在520 nm波长条件下测定吸光度[16]。计算公式如下:

式中:φd为脂肪部分聚结率/%;ϕ为乳液中脂肪的质量分数/%;m0为加入的油红O溶液的质量/g;me为乳液的质量/g;A1为离心前油红O溶液的吸光度;A2为离心后油红O溶液的吸光度。
1.3.5 粒度分布测定
参照Zhao Qiangzhong等[17]的方法,将乳液样品按体积比1∶1 000用去离子水稀释,激光粒度分析仪的参数设定如下:分析模式为通用模式,进样器Hydro 2000MU(A),颗粒折射率1.414,颗粒吸收率为0.001,分散剂为水,分散剂折射率1.330,泵的转速2 500 r/min。体积平均直径d4,3的计算公式如下:
式中:ni为直径di脂肪球的数量;di为脂肪球的直径/μm。
1.3.6 显微结构测定
乳液样品用去离子水稀释10 倍,混合均匀,吸取稀释液滴在载玻片中心,并附上盖玻片,确保没有气泡产生。通过光学显微镜观察乳液的微观结构(目镜10×,物镜40×)。
1.3.7 表观茹度测定
参照邝婉湄[18]的方法,采用P35 TiL Polished转子(抛光型,直径为35 mm),设置参数如下:测量温度为(25±1)℃,板测试间距为1 mm,设定控制速率模式,剪切速率为0.1~100 s-1,测试时间为300 s,以线性取点方式采集数据,采集数为60;测试的数据均采用软件Rheowin Data Manager software Version 4.30对剪切应力和剪切速率之间的流变曲线进行分析处理,选择Herschel-Bulkley模型进行拟合分析。
1.3.8 搅打起泡率测定
在(25±1)℃条件下,奶油打发机以160 r/min的速率进行搅打,时间为0~200 s,每隔40 s取样一次并记录此时的质量。搅打起泡率的计算公式[19]如下:
式中:M1为同体积搅打前乳液的质量/g;M2为同体积搅打后淡奶油的质量/g。
1.3.9 泡沫稳定性测定
参照Sajedi等[14]的方法稍作修改,称取一定量搅打好的淡奶油(即达到最大打发率)放在漏斗上,然后将漏斗置于25 ℃的培养箱中3 h,用烧杯收集奶油水析的质量。泡沫稳定性的计算公式如下:
1.4 数据处理
每组实验重复3 次,最后结果以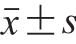 表示,采用数据分析软件SPSS 20.0进行数据单因素方差分析,多组数据间差异显著性分析通过Duncan模型检验获得,P<0.05,差异显著。
表示,采用数据分析软件SPSS 20.0进行数据单因素方差分析,多组数据间差异显著性分析通过Duncan模型检验获得,P<0.05,差异显著。
2 结果与分析
2.1 蛋白质用量对搅打前黄油基淡奶油乳液性质的影响
2.1.1 乳液界面蛋白浓度和脂肪部分聚结率

图1 蛋白质用量对乳液界面蛋白浓度和脂肪部分聚结率的影响
Fig. 1 Effect of protein concentration on interfacial protein concentration and partial coalescence of fat in the emulsion
如图1所示,蛋白质用量在1.0%~2.5%范围内,随蛋白质用量的增加,界面蛋白浓度以较快速度增加,由(4.87±0.03)mg/m2增加至(8.91±0.38)mg/m2,而脂肪部分聚结率则不断降低,由(4.47±0.36)%降低至(1.57±0.15)%;蛋白质用量由2.5%增加至3.0%时,界面蛋白浓度缓慢增加,脂肪部分聚结率出现增高现象。在乳液的均质过程中,蛋白质迅速从连续相吸附到新形成的小油滴表面上,阻止液滴间的重新聚结,进而起到降低脂肪部分聚结率的作用[20]。蛋白质用量由1.0%增加至2.5%,吸附到脂肪球界面的蛋白质不断增多,引起界面蛋白浓度的快速增加;而蛋白质是两亲分子,具有一定的乳化作用,在界面膜上可以通过空间位阻和静电排斥作用达到稳定和分散脂肪球的目的[21],故脂肪部分聚结率不断降低。蛋白质用量由2.5%增加至3.0%时,可能是脂肪球界面膜上吸附的蛋白质己逐渐达到饱和,继续增加蛋白质用量,界面蛋白浓度缓慢增加;而未被吸附的蛋白质与乳液中的其他物质发生相互作用或蛋白质自身结构的改变与重组,增加乳液的不稳定性,使得脂肪球发生排斥絮凝[22],从而脂肪部分聚结率增高。
2.1.2 乳液显微结构及粒度分布


图2 蛋白质用量对乳液显微结构和粒度分布的影响
Fig. 2 Effect of protein concentration on microstructure and particle size distribution of the emulsion
如图2所示,显微结构图中,蛋白质用量在1.0%~2.5%范围内,随着蛋白质用量的增加,脂肪球不断变小;蛋白质用量为3.0%时,出现大脂肪球。同时,粒度分布曲线进一步显示了蛋白质用量对乳液中脂肪球粒径的影响。蛋白质用量在1.0%~2.0%范围内,粒度分布曲线呈现三峰分布,由一个小峰、主峰和拖尾峰组成,且随蛋白质用量的增加,拖尾峰的面积不断减小;当蛋白质用量增加至2.5%时,拖尾峰消失,说明拖尾峰主要是由大脂肪球形成的;而蛋白质用量由2.5%增加至3.0%时,粒度分布曲线整体向右偏移,总分布范围由0.32~19.95 μm变为0.28~34.67 μm,表明乳液中大粒径的脂肪球增多。
微观结构和粒径分布是衡量乳液稳定性的重要指标。当蛋白质用量在1.0%~2.5%范围内,随蛋白质用量的增加,界面蛋白浓度增加,脂肪部分聚结率降低(图1),故乳液脂肪球不断变小;而脂肪球的变化是造成粒度分布曲线中拖尾峰面积变化的主要原因,随蛋白质用量的增加,脂肪球不断减小,拖尾峰面积不断减小;当蛋白质用量为2.5%时,乳液的脂肪部分聚结率最低,形成的脂肪球最小,导致拖尾峰消失;当蛋白质用量由2.5%增加至3.0%时,脂肪部分聚结率升高,大脂肪球的数量增多,粒度分布曲线向大粒径方向偏移。
2.1.3 乳液表观茹度
由图3可知,表观茹度均随剪切速率的增大而降低,高剪切速率下表观茹度趋于定值,样品都呈现剪切稀化的性质。在相同剪切速率的作用下,蛋白质用量在1.0%~2.5%范围内,随着蛋白质用量的增加,表观茹度不断升高;当蛋白质用量由2.5%升高至3.0%时,表观茹度出现降低现象。表2为不同蛋白质用量的乳液剪切流变特性拟合Herschel-Bulkley模型的参数。R2>0.997 3可知模型拟合程度良好;n为流动指数,所有样品n<1,即呈现剪切稀化特点;K为稠度系数,其值越大代表样品越茹稠;τ0为屈服应力,即样品开始流动时所需要的最小应力,其值越大表示样品越难流动;随蛋白质用量的增加,τ0和K都呈现先增大后减小的趋势,与表观茹度的变化保持一致。

图3 蛋白质用量对乳液表观黏度的影响
Fig. 3 Effect of protein concentration on apparent viscosity of the emulsion
表2 蛋白质用量对乳液Herschel-Bulkley模型参数的影响
Table 2Effect of protein concentration on parameters of Herschel-Bulkley model of the emulsion

蛋白质用量/% τ0/Pa K/(Pa·sn) n R2 1.0 0.238 1 0.472 3 0.516 8 0.998 8 1.5 0.317 9 0.721 7 0.466 4 0.998 7 2.0 0.591 5 0.745 7 0.524 5 0.997 3 2.5 0.900 2 1.707 0 0.422 9 0.998 1 3.0 0.752 3 1.149 0 0.474 8 0.997 5
脂肪球粒度对乳液表观茹度有很大的影响,粒度越小,分散相体积分数相同的情况下,液滴数目会增多且液滴间的平均距离减小,液滴之间的相互作用越强,乳液表观茹度越高[23]。蛋白质用量在1.0%~2.5%范围内,随蛋白质用量的增加,脂肪部分聚结率不断降低(图1),脂肪球减小,液滴间的流动阻力增大,故表观茹度不断升高;而蛋白质用量由2.5%增加至3.0%时,显微结构图中大脂肪球数量增多(图2),液滴之间的相互作用减弱,故表观茹度降低。屈服应力可以抵消一部分脂肪球的重力沉降作用,防止乳液在搅打前发生相分离[24],蛋白质用量(1.0%~2.5%)的增加,屈服力不断增大,乳液抗水析能力不断提高。
黄油基淡奶油乳液性质的测定结果表明:随蛋白质用量(1.0%~2.5%)的增加,界面蛋白浓度不断增加,脂肪部分聚结率降低,脂肪球减小,表观茹度升高,乳液的稳定性不断提高;而蛋白质用量由2.5%增加至3.0%时,脂肪部分聚结率升高,大脂肪球增多,乳液稳定性降低。
2.2 蛋白质用量对搅打过程中黄油基淡奶油搅打性能的影响
2.2.1 脂肪部分聚结率

图4 蛋白质用量对搅打过程中黄油基淡奶油脂肪部分聚结率的影响
Fig. 4 Effect of protein concentration on partial coalescence of fat in butter-based whipping cream during whipping
如图4所示,随搅打时间的延长,黄油基淡奶油脂肪部分聚结率均不断升高,且在蛋白质用量为1.0%~1.5%范围内快速增加,在2.5%~3.0%范围内缓慢增加。在0~80 s搅打阶段,随蛋白质用量的增加,脂肪部分聚结率呈现先降低后升高的趋势,蛋白质用量在2.5%时出现最小值;蛋白质用量增加至3.0%时,搅打200 s后的脂肪部分聚结率仅有26.45%;而120~200 s搅打阶段,随蛋白质用量的增加,脂肪部分聚结率则不断降低。
搅打过程中,导致脂肪部分聚结率不断升高的原因主要有两方面。一方面机械搅打和充气作用易引起结晶脂肪刺破相互之间的脂肪球膜,加剧脂肪球的部分聚结[25];另一方面乳化剂与蛋白质在脂肪球界面膜上发生竞争性吸附,部分蛋白质被解析[10],界面稳定性下降,促进脂肪球部分聚结。蛋白质用量在1.0%~1.5%范围内时,乳液的界面蛋白浓度较低(图1),界面稳定性相对差,搅打过程中更容易发生脂肪部分聚结,故脂肪部分聚结率快度增加;而在2.5%~3.0%范围内,界面蛋白浓度较高,且表观茹度较高(图3),搅打过程脂肪球膜不易被刺破,脂肪部分聚结率缓慢增加。在0~80 s搅打阶段,随蛋白质用量的增加,脂肪部分聚结率先降低后升高,主要是此阶段脂肪部分聚结的发生受乳液稳定性的影响较大,乳液越稳定,抗机械搅打能力越强,脂肪球部分聚结率越低;而80~200 s搅打阶段,可能是随蛋白质用量的增加,界面蛋白浓度增加,界面膜稳定性升高,脂肪部分聚结率降低。
2.2.2 平均粒径
如表3所示,随搅打时间的延长,平均粒径d4,3都呈现先减小后增大的趋势。在0~40 s搅打阶段,d4,3出现减小,且乳液越稳定,d4,3减小的幅度越小;蛋白质用量1.0%时的d4,3由(6.538±0.286)μm降至(2.223±0.019)μm,而蛋白质用量2.5%时,d4,3仅由(4.059±0.163)μm降至(4.054±0.074)μm;在80~200 s搅打阶段,d4,3不断增大,且d4,3在蛋白质用量为1.0%~1.5%范围内快速增大,在2.5%~3.0%范围内缓慢增大。
表3 蛋白质用量对搅打过程中黄油基淡奶油平均粒径(d4,3)的影响
Table 3 Effect of protein concentration on average particle size (d4,3) of butter-based whipping cream during whipping μm

注:不同小写字母表示相同搅打时间内样品的平均粒径差异显著,P<0.05。
40 80 120 160 200 1.0 6.538±0.286e2.223±0.019a29.135±1.020e37.084±0.764d41.911±1.104d \1.5 5.928±0.038d3.366±0.093a9.667±0.476c19.140±0.715c25.432±0.396c30.221±1.637d 2.0 5.591±0.074c3.127±0.128a7.668±0.559b15.876±0.908b25.857±0.988c27.275±0.100c 2.5 4.059±0.163a4.054±0.074b4.415±0.067a8.549±0.351a10.259±0.866a23.129±0.643b 3.0 5.270±0.1384.790±0.28210.505±0.16315.321±0.14117.549±0.60820.345±0.082 bcdbba蛋白质用量/%搅打时间/s 0
在0~40 s搅打阶段内,d4,3出现减小现象,主要是由于搅打机械作用将分布紧密的脂肪球迅速分开[26],短期内造成脂肪球粒径减小。而乳液稳定性越高,脂肪部分聚结率越低,脂肪球越小,表观茹度越高(图1~3),故搅打机械作用促使脂肪球分散的效果越差,d4,3减小的幅度越小。在80~200 s搅打阶段,由于脂肪部分聚结率不断增高,界面膜由以蛋白质为主的吸附层,逐渐成为一个脂肪球聚集的网络结构[27],促使d4,3不断增大;而脂肪部分聚结率在蛋白质用量在1.0%~1.5%范围内快速增加,在2.5%~3.0%范围内缓慢增加(图4),故d4,3也呈现一致性的变化趋势。
2.2.3 搅打起泡率

图5 蛋白质用量对搅打过程中黄油基淡奶油搅打起泡率的影响
Fig. 5 Effect of protein concentration on overrun of butter-based whipping cream during whipping
如图5所示,随搅打时间的延长,搅打起泡率呈现先升高后降低的趋势,且蛋白质用量越少,越早出现搅打起泡率降低的现象。蛋白质用量1.0%在120 s时就出现明显降低,而蛋白质用量3.0%在200 s时才出现降低。随蛋白质用量的增加,最大搅打起泡率不断降低,蛋白质用量1.5%的最大起泡率达到(173.44±2.29)%,而蛋白质用量3.0%的只有(127.16±3.75)%。
搅打起泡率不仅取决于液相中的蛋白质浓度,还与脂肪部分聚结的速度和程度相关[28]。搅打过程中,乳化剂与蛋白质在界面膜上发生竞争性吸附,液相中蛋白质浓度增大,起泡性增加[20],同时脂肪球部分聚结的增加,形成的界面膜能够稳定气泡,故搅打起泡率不断增加。搅打起泡率降低是进入了过度搅打阶段,过多的机械搅打会破坏奶油内部的网络结构,导致脂肪球过度聚结,泡沫破裂;而蛋白质用量越少越早出现过度搅打现象,可能是界面蛋白浓度低,界面膜薄弱,脂肪球部分聚结率较高(图4),过度搅打会破坏泡沫结构,导致搅打起泡率下降。搅打过程中,随蛋白质用量的增加,最大搅打起泡率不断降低,一方面由于脂肪部分聚结率随蛋白质用量的增加而降低,脂肪聚结率过低不足以稳定气泡,搅打起泡率降低;另一方面蛋白质用量的增加,表观茹度升高、乳液稳定性提高,搅打过程中空气不易快速充入[29],搅打起泡率降低。
2.3 蛋白质用量对黄油基淡奶油泡沫稳定性的影响

图6 蛋白质用量对黄油基淡奶油泡沫稳定性的影响
Fig. 6 Effect of protein concentration on foam stability of butter-based whipping cream
如图6所示,随蛋白质用量的增加,黄油基淡奶油的泡沫稳定性不断提高,蛋白质用量为1.0%时泡沫稳定性只有(22.09±3.73)%;蛋白质用量3.0%时泡沫稳定性提高至(74.79±3.61)%;蛋白质用量超过2.0%后泡沫稳定性不再显著提高(P>0.05)。
泡沫稳定性也被称作抗塌陷性,泡沫坍塌的原因主要是泡沫结构的水析、气泡的聚合及气体的扩散。泡沫稳定性不仅与液相的流变性质和界面膜茹弹性相关[30],同时也受脂肪部分聚结程度的影响。随蛋白质用量的增加,一方面黄油基淡奶油液相中的固形物增多,表观茹度升高,屈服应力增加,抗水析的能力提高[31];另一方面界面蛋白浓度增加,界面膜稳定性提高,且最大搅打起泡率较低,形成的泡沫较小,气泡不容易聚合和扩散[21],故泡沫稳定性不断提高。黄油基淡奶油中的气泡主要由脂肪部分聚结形成的脂肪球膜稳定,在室温放置过程中,蛋白质用量低,脂肪部分聚结率较高,更容易刺破气泡间的界面膜,故其泡沫稳定性较差。
3 结 论
本实验通过研究蛋白质用量对黄油基淡奶油搅打前乳液性质及搅打性能的影响,发现蛋白质用量在1.0%~2.5%范围内,随着蛋白质用量的增加,乳液的稳定性不断提高,主要表现为脂肪部分聚结率降低,脂肪球粒径减小;当蛋白质用量由2.5%增加至3.0%时,乳液的稳定性降低。当乳液稳定性提高时,黄油基淡奶油的脂肪部分聚结率和搅打起泡率不断降低,搅打性能变差,泡沫稳定性增加。蛋白质用量为1.0%~1.5%时,脂肪部分聚结率和搅打起泡率高,搅打性能好,但泡沫稳定性差;蛋白质用量为2.0%~2.5%时,搅打性能下降,而泡沫稳定性不断提高;蛋白质用量为3.0%时,脂肪部分聚结率和搅打起泡率最低,搅打性能最差。而在实际生产应用中既要满足搅打性能好,又要保证泡沫稳定性高,故蛋白质用量控制在2.0%~2.5%范围内较适宜。这为生产品质好、成本低的黄油基淡奶油提供了理论指导。
[1] GOFF H D. Instability and partial coalescence in whippable dairy emulsions[J]. Journal of Dairy Science, 1997, 80(10): 2620-2630.DOI:10.3168/jds.s.0022-0302(97)76219-2.
[2] BOUYER E, MEKHLOUFI G, ROSILIO V, et al. Proteins,polysaccharides, and their complexes used as stabilizers for emulsions:alternatives to synthetic surfactants in the pharmaceutical field?[J].International Journal of Pharmaceutics, 2012, 436(1/2): 359-378.DOI:10.1016/j. ijpharm.2012.06.052.
[3] 赵强忠. 搅打稀奶油的搅打性能和品质的变化规律及其机理研究[D].广州: 华南理工大学, 2006: 19-22.
[4] FREDRICK E, MOENS K, HEYMAN B, et al. Monoacylglycerols in dairy recombined cream: I. the effect on milk fat crystallization[J].Food Research International, 2013, 51(2): 892-898. DOI:10.1016/j.foodres.2013.02.007.
[5] 阚传浦, 李妍, 李海梅, 等. 乳化剂对以黄油为原料生产UHT搅打稀奶油稳定性的影响[J]. 中国乳品工业, 2013, 41(3): 8-11.DOI:10.3969/j.issn.1001-2230.2013.03.002.
[6] PHAN T T Q, MOENS K, LE T T, et al. Potential of milk fat globule membrane enriched materials to improve the whipping properties of recombined cream[J]. International Dairy Journal, 2014, 39(1): 16-23.DOI:10.1016/j.idairyj.2014.05.003.
[7] 刘洁. 稀奶油搅打流变学特性及奶油分馏组分加工特性研究[D].北京: 中国农业科学院, 2015: 21-50.
[8] 周绪霞, 戚雅楠, 丁玉庭. 黄油-代可可脂基奶油生产工艺优化及其晶型形成分析[J]. 食品科学, 2018, 39(12): 276-282. DOI:10.7506/spkx.1002-6630-201812042.
[9] FOEGEDING E A, DAVIS J P. Food protein functionality: a comprehensive approach[J]. Food Hydrocolloids, 2011, 25(8): 1853-1864. DOI:10.1016/j.foodhyd.2011.05.008.
[10] ROUIMI S, SCHORSCH C, VALENTINI C, et al. Foam stability and interfacial properties of milk protein-surfactant systems[J].Food Hydrocolloids, 2005, 19(3): 467-478. DOI:10.1016/j.foodhyd.2004.10.032.
[11] 赵谋明, 龙肇, 赵强忠, 等. 蛋白质用量和比例对淡奶油理化性质的影响[J]. 吉林大学学报(工学版), 2014, 44(5): 1531-1536.DOI:10.7964/jdxbgxb201405048.
[12] MATSUMIYA K, HORIGUCHI S, KOSUGI T, et al. Effects of heat treatment and homogenization on milk fat globules and proteins in whipping creams[J]. Food Structure, 2017, 12: 94-102. DOI:10.1016/j.foostr.2017.02.003.
[13] LONG Z, ZHAO M M, SUNWATERHOUSE D, et al. Effects of sterilization conditions and milk protein composition on the rheological and whipping properties of whipping cream[J]. Food Hydrocolloids,2016, 52: 11-18. DOI:10.1016/j.foodhyd.2015. 06.015.
[14] SAJEDI M, NASIRPOUR A, KERAMAT J, et al. Effect of modified whey protein concentrate on physical properties and stability of whipped cream[J]. Food Hydrocolloids, 2014, 36: 93-101.DOI:10.1016/j.foodhyd.2013.09.007.
[15] LONG Z, ZHAO Q, LIU T, et al. Role and properties of guar gum in sodium caseinate solution and sodium caseinate stabilized emulsion[J].Food Research International, 2012, 49(1): 545-552. DOI:10.1016/j.foodres.2012.07.032.
[16] PALANUWECH J, POTINENI R, ROBERTS R F, et al. A method to determine free fat in emulsions[J]. Food Hydrocolloids, 2003, 17(1):55-62. DOI:10.1016/S0268-005X(02)00035-8.
[17] ZHAO Q Z, KUANG W M, LONG Z, et al. Effect of sorbitan monostearate on the physical characteristics and whipping properties of whipped cream[J]. Food Chemistry, 2013, 141(3): 1834-1840.DOI:10.1016/j.foodchem.2013.04.086.
[18] 邝婉湄. 流变学分析在搅打奶油品质评价中的应用[D]. 广州: 华南理工大学, 2014: 16-18.
[19] KOVÁČOVÁ R, ŠTĚTINA J, ČURDA L. Influence of processing and κ-carrageenan on properties of whipping cream[J]. Journal of Food Engineering, 2010, 99(4): 471-478. DOI:10.1016/j.jfoodeng.2010.02.010.
[20] 邓欣伦, 方敏, 赵强忠. 蛋白质用量对粉末植脂奶油品质的影响[J]. 食品工业科技, 2015, 36(4): 92-96. DOI:10.13386/j.issn1002-0306.2015.04.011.
[21] YE A Q. Functional properties of milk protein concentrates: emulsifying properties, adsorption and stability of emulsions[J]. International Dairy Journal, 2011, 21(1): 14-20. DOI:10.1016/j.idairyj.2010.07.005.
[22] DICKINSON E, GOLDING M. Depletion flocculation of emulsions containing unadsorbed sodium caseinate[J]. Food Hydrocolloids, 1997,11(1): 13-18. DOI:10.1016/S0268-005X(97)80005-7.
[23] GENOVESE D B, LOZANO J E, RAO M A. The rheology of colloidal and noncolloidal food dispersions[J]. Journal of Food Science, 2010,72(2): R11-R20. DOI:10.1111/j.1750-3841.2006.00253.x.
[24] TZOUMAKI M V, MOSCHAKIS T, KIOSSEOGLOU V, et al.Oil-in-water emulsions stabilized by chitin nanocrystal particles[J].Food Hydrocolloids, 2011, 25(6): 1521-1529. DOI:10.1016/j.foodhyd.2011.02.008.
[25] AKEN G A V. Aeration of emulsions by whipping[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2001, 190(3):333-354. DOI:10.1016/S0927-7757(01)00709-9.
[26] PETRUT R F, DANTHINE S, BLECKER C. Assessment of partial coalescence in whippable oil-in-water food emulsions[J]. Advances in Colloid and Interface Science, 2016, 229: 25-33. DOI:10.1016/j.cis.2015.12.004.
[27] GOFF H D. Instability and partial coalescence in whippable dairy emulsions[J]. Journal of Dairy Science, 1997, 80(10): 2620-2630.DOI:10.3168/jds.s0022-0302(97)76219-2.
[28] STANLEY D W, GOFF H D, SMITH A K. Texture-structure relationships in foamed dairy emulsions[J]. Food Research International, 1996, 29(1): 1-13. DOI:10.1016/0963-9969(95)00063-1.
[29] 赵强忠, 赵谋明, 林伟锋, 等. 搅打稀奶油的搅打机理研究[J].食品与发酵工业, 2005, 31(6): 12-15. DOI:10.3321/j.issn:0253-990X.2005.06.004.
[30] BÉNÉDICTE R, AXELOS M A V, LANGEVIN D, et al.β-Lactoglobulin aggregates in foam films: effect of the concentration and size of the protein aggregates[J]. Journal of Colloid and Interface Science, 2010, 343(1): 330-337. DOI:10.1016/ j.jcis.2009. 11.015.
[31] 王筠钠, 李妍, 韩洁, 等. 搅打稀奶油制备技术与影响因素研究进展[J]. 中国乳品工业, 2016(11): 24-28. DOI:10.3969/j.issn.1001-2230.2016.11.006.