腌制是腌腊肉制品加工的关键工序,传统的腌制方法包括干腌和湿腌法。干腌法是在肉的表面揉搓腌制混合物(主要是氯化钠、硝酸盐或亚硝酸盐、糖和香料),湿腌法是将肉浸泡在盐水里进行腌制。近年来,己有腌制方法缩短了盐渍时间,提高了腌腊肉制品盐分布的均匀性,改善产品的外观同时取代了亚硝酸盐的添加,例如超声波辅助腌制技术[1]、脉冲加压辅助腌制技术[2]、介质阻挡放电腌制技术[3]、等离子体活性水(plasmaactivated water,PAW)腌制技术[4]等。
大气压低温等离子体作为一种新技术,可以产生紫外光、电子、正负离子、原子、活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)等活性物质[5]。射流等离子体具有灵活多变的电极结构,通过在大气压下将电场和气流共同作用迫使其放电产生的等离子体从其产生区域喷出,让其产生的等离子体在外界开放的环境中朝着工作区域方向作定向移动,从而获得大气压射流等离子体[6]。
通过腌制可以改善肉制品的风味、多汁性和嫩度,并延长其保质期。PAW作为一种新型、有前途的肉类加工技术己经应用于乳化肠的加工[4],从而取代亚硝酸盐的添加,降低成本;也被应用在猪肉脯的加工过程中[7],不仅可以改善产品颜色同时也可以降低亚硝酸盐残留量。本实验PAW由等离子体射流装置处理纯水制成,在制备过程中会产生大量的活性物质,这些成分可能会导致肉类肌原纤维蛋白质的氧化以及结构的变化[8]。所以,应该考虑到这种加工工艺对促进蛋白质氧化反应可能会产生的影响。
本实验考察不同处理时间制备的PAW腌制对猪肉肌原纤维蛋白氧化及结构的影响,为PAW腌制技术在肉类腌制中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
屠宰后48 h的黄山黑母猪背长肌,黄山黑猪日龄为6 个月左右,由黄山全江生态农业科技有限公司提供;食盐、白砂糖等配料 市售。
1.2 仪器与设备
CTP-2000K等离子体射流发生器 南京苏曼等离子科技有限公司;IKA T25高速匀浆机 德国艾卡仪器设备有限公司;UV-2501分光光度计 日本岛津公司;Allegra高速冷冻离心机 美国Beckman Coulter公司;FD-1A-50真空冷冻干燥机 中国思昊科技有限公司;Nicolet 6700傅里叶变换红外光谱仪 美国Thermo Fisher科技有限公司;L-8900氨基酸分析仪、F-7000荧光分光光度计 日本Hitachi公司。
1.3 方法
1.3.1 等离子体射流处理

图1 等离子体射流放电装置示意图
Fig. 1 Schematic diagram of the plasma jet discharge experimental setup
如图1所示,在500 mL烧杯中,加入300 mL去离子水,用空气作为载气,流量为22.5 L/min,输出电压为20 kV,电流为0.025 mA,用等离子体射流装置分别处理0、40、60 s和80 s。为保证液体样品的一致性,防止盐分及其他成分溶解对等离子体处理过程中样品的干扰,实验中,先对去离子水进行等离子体处理制备PAW,随后将各处理组配制成相同浓度的腌制液。
1.3.2 样品的腌制
腌制液的制备:等离子体处理后,在PAW和纯水中分别加入8% NaCl、3%白糖、0.5%焦磷酸钠,配制成腌制液。其中一组用未处理组腌制液腌制,为对照组(n=10),另3 组分别为40、60 s和80 s等离子体射流装置处理制备的PAW腌制液处理组(n=90)。每组猪里脊样品在10 ℃环境中腌制12 h,腌制液和肉块的质量比为2∶1,全部样品腌制后立即取出并用滤纸吸干表面,真空包装后在-20 ℃冷冻贮藏备用。
1.3.3 肌原纤维蛋白的提取
根据汪媛等[9]的方法并进行适当的修改。称取5 g腌制后的样品进行搅碎,将3 g肉糜加入到30 mL磷酸缓冲液(100 mmol/L磷酸盐缓冲液、0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0)中匀浆(10 000 r/min,1 min),随后将制得的悬浮液进行高速冷冻离心(10 000×g,15 min,4 ℃),弃去上清液,收集沉淀。将沉淀用相同的缓冲液冲洗3 次。再将沉淀溶解到4 倍体积的20 mmol/L磷酸缓冲液中(0.7 mol/L KI、0.02% NaN3,pH 7.0),用相同条件离心,收集沉淀即为肌原纤维蛋白。随后将沉淀溶解在20 mmol/L磷酸缓冲液中(0.1 mol/L NaCl,pH 7.0),采用双缩脲法测定肌原纤维蛋白溶液浓度。
标准曲线:吸取10 mg/mL的牛血清蛋白0、0.2、0.4、0.6、0.8、1.0 mL于试管中,分别用超纯水补充至1 mL,加入4 mL双缩脲试剂剧烈振荡后在室温下静置30 min,于波长540 nm处测定吸光度。以吸光度为横坐标,牛血清蛋白浓度为纵坐标,绘制标准曲线。
样品蛋白浓度测定:肌原纤维蛋白溶液用0.5 mol/L NaOH溶液稀释5 倍后,取1 mL稀释液于试管中与4 mL双缩脲试剂混合,随后在波长540 nm处测定吸光度,测定肌原纤维蛋白浓度。吸取每组分中部分肌原纤维蛋白溶液于-20 ℃冰箱中预冻12 h,过后于冷阱温度-40 ℃,真空度低于40 Pa条件下进行抽真空冷冻干燥24 h,得到肌原纤维蛋白粉末,用于傅里叶变换红外光谱分析。
1.3.4 PAW腌制后蛋白氧化水平测定
1.3.4.1 蛋白质羰基含量测定
采用贾娜等[10]的方法。取各处理组的猪肉样品1 g切碎后,在10 mL焦磷酸缓冲液(含2 mmol/L Na2P4O7、10 mmol/L Tris-maleate、100 mmol/L KCl、2 mmol/L MgCl2和2 mmol/L EGTA,pH 7.4)中均质15 s。随后加入1 mL 20%三氯乙酸溶液到200 μL均质液中,离心5 min(4 ℃,12 000×g)。沉淀用10%三氯乙酸溶液清洗后离心5 min(4 ℃,12 000×g),随后去除悬浮液,在蛋白沉淀中加入1 mL 2,4-二硝基苯肼溶液(2,4-二硝基苯肼溶解于2 mol/L HCl溶液中,浓度为10 mmol/L),空白对照组加入1 mL 2 mol/L HCl溶液,在室温下避光反应30 min。反应结束后,相同条件离心,弃去上清液,加入1 mL 20%三氯乙酸沉淀蛋白。用1 mL乙酸乙酯-乙醇(1∶1,V/V)溶液冲洗沉淀3 次,去除2,4-二硝基苯肼。提取后,将沉淀溶解于1 mL含有6 mol/L盐酸胍的20 mmol/L磷酸盐缓冲液(pH 7.0)中,37 ℃振荡30 min。再用相同条件离心后取上清液于波长370 nm处测定吸光度。蛋白质羰基摩尔吸光系数为22 000 L/(mol·cm),以盐酸胍溶液为空白调零,HCl为对照组,结果以每毫克蛋白所含的羰基物质的量表示(nmol/mg)。
1.3.4.2 总巯基含量测定
采用Ellman试剂进行测定[11]。将4.5 mL含有8 mol/L尿素,10 mmol/L EDTA和0.6 mol/L KCl(pH 8.0)的溶液加入到0.5 mL肌原纤维蛋白溶液(5 mg/mL)中,再加入100 μL 5,5-二硫代双(2-硝基苯甲酸)反应液(100 mmol/L Tris-HCl,pH 7.0)。在室温(25 ℃)条件下孵育25 min,使硫醇基与5,5-二硫代双(2-硝基苯甲酸)反应,随后在4 ℃,12 000×g离心5 min,在波长412 nm处测定上清液吸光度。总巯基含量用摩尔消光系数13 600 L/(mol·cm)进行计算。结果以每毫克蛋白所含的巯基物质的量表示(nmol/mg)。
1.3.5 游离氨基酸含量测定
采用Lorenzo等[12]的方法从腌制后的肉中提取游离氨基酸。分别将2 g不同处理组的肉干在25 mL的三氯乙酸中静置1 h,随后吸取5 mL溶液用0.45 μm过滤膜过滤。用L-8900全自动氨基酸分析仪对滤液进行定性和定量分析。每个样品的游离氨基酸含量重复测定3 次。游离氨基酸含量以干物质表示(mg/100 g)。
1.3.6 表面疏水性测定
采用1-苯氨基-8-萘磺酸盐(1-anilino naphthalene-8-sulfonic acid,ANS)荧光探针法测定蛋白质表面疏水性[13]。将提取的肌原纤维蛋白在磷酸盐缓冲液中(含0.01 mmol/L K2HPO4,pH 7.0)按2 倍梯度稀释至质量浓度0.5~5 mg/mL。每个质量浓度取2 mL与25 μL 8 mmol/L ANS溶液(含0.1 mmol/L NaH2PO4缓冲溶液,pH 6.0)混合,在25 ℃条件下暗置孵育25 min。采用荧光分光光度计在激发波长374 nm、发射波长485 nm处测定每个蛋白质量浓度的荧光强度,不加ANS的为空白对照组。
1.3.7 傅里叶变换红外光谱分析
将2 mg肌原纤维蛋白粉末和100 mg KBr混合后,用研钵研磨成均匀粉末,压制成薄片。用傅里叶变换红外光谱仪在400~4 000 cm-1之间进行扫描,光谱分辨率为4 cm-1,扫描次数为128 次[14]。采用OMNICTM软件(Thermo Nicolet Inc., IL, USA)对酰胺I波段(1 700~1 600 cm-1)区域进行分析。参考Kong Jilie等[15]的方法评价二级结构的变化,每种二级结构的含量表示为各峰面积占总酰胺I带峰面积的百分比。
1.4 数据处理
采用SPSS 19.0统计软件(SPSS Inc., Chicago, USA)对不同处理组进行单因素方差分析。采用Duncan多重比较法对不同处理组均值进行显著性分析(P<0.05)。所有实验重复3 次,每一次取3 个样品进行平行实验,以保证准确性。数据以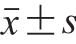 表示。
表示。
2 结果与分析
2.1 PAW腌制对蛋白质氧化程度的影响
羰基是评定肉类中蛋白质氧化程度最常用的指标,通常由氨基酸残基侧链氧化而成[16]。通过测定肌原纤维蛋白羰基和总巯基含量,研究PAW处理对蛋白质的氧化的影响。由图2可以看出,蛋白质的羰基含量随着等离子体处理时间的延长而显著增加(P<0.05),40、60 s和80 s处理组羰基含量分别比对照组增加0.67、1.42 nmol/g和1.57 nmol/g。可能的原因是PAW中含有大量的高能粒子以及活性氧和活性氮自由基(ROS和RNS)[17],ROS和RNS可以氧化氨基酸残基侧链,尤其是侧链上有NH-或NH2基团的氨基酸,从而导致蛋白质氧化[18]。随着处理时间的延长,ROS和RNS含量上升导致蛋白质氧化程度上升。有研究表明,芳香型和含硫氨基酸侧链极容易被氧化[19],由图2可知,PAW处理后的总巯基含量逐渐下降,40、60 s和80 s处理组总巯基含量分别比对照组下降14.51%、19.35%和30.65%,说明PAW处理能够促进半胱氨酸巯基基团的损失,巯基基团的减少意味着二硫键的形成,从而导致磺酸的产生,同时半胱氨酸支链的硫醇基容易脱氢,导致(2Cys-2H)H+的形成,可以进一步被氧化成磺基(—SO3)[20]。

图2 PAW处理对蛋白质羰基和总巯基含量的影响
Fig. 2 Effect of PAW treatment on carbonyl and total sulfhydryl contents of myofibrillar protein
2.2 PAW腌制对游离氨基酸含量的影响
表1 PAW处理对游离氨基酸含量的影响
Table 1 Effect of PAW treatment on free amino acid contents

注:同行不同字母表示差异显著(P<0.05)。
游离氨基酸 含量/(mg/100 g)0 s 40 s 60 s 80 s疏水性氨基酸酪氨酸Tyr 32.82±2.15c 27.25±1.05d 69.48±2.22b 92.12±4.11a丙氨酸Ala 212.62±4.02c 165.67±3.65d 404.17±5.04b 488.57±5.28a缬氨酸Val 117.73±4.15c 43.54±1.25d 182.64±6.22b 201.90±7.13a蛋氨酸Met 55.07±1.43c 34.25±2.18d 66.64±2.15b 78.91±3.12a异亮氨酸Ile 43.02±1.45c 31.44±1.55d 77.22±5.22b 95.54±8.05a亮氨酸Leu 48.67±5.35c 31.88±1.85d 154.84±3.24b 177.47±5.11a苯丙氨酸Phe 66.78±3.26c 44.61±1.47d 106.72±5.12b 147.97±8.11a脯氨酸Pro 204.61±6.66c 145.79±3.29d 272.38±4.58b 297.46±8.27a小计 781.32±21.24c 524.43±20.78d 1 334.09±28.34b1 579.94±25.15a亲水性氨基酸丝氨酸Ser 22.02±0.45c 37.82±0.81b 127.58±5.95a 129.71±3.82a苏氨酸Thr 52.46±2.15c 33.58±5.45d 155.11±5.02a 137.69±2.28b半胱氨酸Cys 36.46±3.12b 27.09±1.44c 49.17±2.27a 37.51±1.85b甘氨酸Gly 31.54±1.81d 50.75±5.27c 119.44±6.02a 92.89±4.03b精氨酸Arg 22.11±0.22d 35.07±4.92c 177.48±5.95b 199.54±2.23a天冬氨酸Asp 16.05±0.11b 18.86±0.59b 49.66±2.27a 25.81±0.55b组氨酸His 101.56±1.59c 70.16±2.55d 166.92±4.35b 346.24±6.75a谷氨酸Glu 241.85±7.65c 118.87±4.95d 489.53±6.15a 374.59±5.25b赖氨酸Lys 127.24±5.47c 69.94±1.24d 453.39±7.15a 385.25±6.86b小计 651.29±24.29b 462.14±18.35c 1 788.28±38.87a1 729.23±33.52a游离氨基酸总量 1 432.61±36.75b 986.57±28.21c 3 122.37±46.37a3 309.17±48.21a
由表1可知,相对于对照组,40 s处理组的游离氨基酸总量显著下降,这可能由于游离巯基被氧化成二硫键导致蛋白质出现大量的聚集相关[21]。而60 s和80 s处理组的游离氨基酸总量显著上升(P<0.05),表明长时间处理可能破坏二硫键,从而加速了部分蛋白质降解为游离氨基酸组分。疏水性氨基酸的含量呈现相似的趋势,这可能与蛋白质的不断氧化增加了蛋白质表面的疏水性有关[22]。与甜味相关的氨基酸如丙氨酸、丝氨酸、脯氨酸、苏氨酸和甘氨酸;以及与成熟风味相关的赖氨酸、酪氨酸、天冬氨酸均随着处理时间的延长呈上升趋势。60 s和80 s处理组中与鲜味相关的谷氨酸、天冬氨酸、苯丙氨酸、丙氨酸、甘氨酸、酪氨酸和精氨酸含量显著大于对照组,说明60 s和80 s处理组有助于改善产品的滋味。
2.3 PAW腌制对蛋白质表面疏水性的影响

图3 PAW处理对蛋白质表面疏水性的影响
Fig. 3 Effect of PAW treatment on surface hydrophobicity of myofibrillar protein
如图3所示,蛋白质表面疏水性可以用来评价蛋白质的变性情况[23]。相对于对照组,40 s处理组的疏水性指数显著下降,可能是低氧化程度会引起蛋白质重新折叠,团聚阻碍了非极性氨基酸暴露于蛋白质表面[24];然而随着处理时间的延长,蛋白质疏水性指数显著增加,60 s和80 s处理组疏水性指数分别增加12.72%和36.36%,这可能是由于PAW腌制后,蛋白质分子结构的拉伸和展开使构象结构变得松散和不稳定[25],导致埋在蛋白质的内部原先被非极性环境包围的疏水基团,暴露在水环境中,使得更多的ANS可以结合蛋白分子的非极性部分,从而增加表面疏水性[26]。PAW处理结果表明,随着等离子体处理时间的延长,蛋白质的展开量也可能增加,从而使疏水性基团的暴露量增加,这与疏水性氨基酸结果一致。随着等离子体处理时间的延长,PAW中越来越多的ROS自由基和羟自由基对疏水性氨基酸的攻击也会导致蛋白质表面疏水性的增加[27]。
2.4 傅里叶变换红外光谱分析结果
如图4所示,酰胺I带(1 600~1 700 cm-1)的吸光光谱可以反映蛋白质二级结构的信息,α-螺旋位于1 646~1 664 cm-1,β-折叠位于1 615~1 637 cm-1和1 682~1 700 cm-1,β-转角位于1 664~1 681 cm-1,而1 637~1 645 cm-1对应无规卷曲[28]。实验结果表明,经PAW腌制处理后,虽然蛋白质各组分的峰位没有明显的变化,但其部分区域受到PAW处理的影响,酰胺I带变化明显,尤其是80 s处理组图谱比其他处理组图谱更加平坦。通过二阶求导去卷积技术对酰胺I带进行处理,并用PeakFit 4.12软件(SPSS Inc., Chicago, IL, USA)对各处理组肌原纤维蛋白二级结构进行曲线拟合分析得到不同处理组中蛋白质二级结构组分的相对含量,如图5所示。与对照组相比,40、60、80 s处理组的α-螺旋相对含量分别减少了10.73%、20.71%和33.32%,而β-折叠相对含量增加了7.78%、11.87%和16.41%,无规卷曲相对含量增加了6.50%、17.38%和26.23%,β-转角组无显著变化。α-螺旋相对含量与蛋白质的水合能力相关,α-螺旋含量的降低可能导致蛋白质疏水性的增加,α-螺旋结构的解旋会导致分子间相互作用的变化[29]。随着处理强度的增加,肌原纤维蛋白的展开会使非极性氨基酸暴露在蛋白表面从而增加蛋白质表面疏水性,这与2.2节结果一致。β-折叠含量的增加与PAW腌制过程产生的氧化体系相关[22],这可能导致肉蛋白质的聚合。α-螺旋的稳定性主要由多肽链中羰基氧(—CO)和氨基氢(NH—)之间的氢键维持,PAW中的ROS和RNS会破坏维持α-螺旋稳定的氢键[30],从而引起α-螺旋含量下降,β-折叠和无规卷曲含量的上升。这些结果表明PAW处理能改变肌原纤维蛋白二级结构。

图4 肌原纤维蛋白酰胺I带去卷积傅里叶变换红外图谱
Fig. 4 Deconvoluted amide I FTIR spectra of myofibrillar protein

图5 蛋白质二级结构相对含量的变化
Fig. 5 Changes in relative contents of secondary structures of myofibrillar protein
3 结 论
本实验利用等离子体射流装置制备的PAW作为一种新型腌制工艺腌制猪背最长肌。相比对照组,PAW腌制组的蛋白质羰基含量显著增加,巯基含量显著减少(P<0.05),说明蛋白质的氧化程度加剧。随着处理时间的延长,60 s和80 s处理组的游离氨基酸总量显著增加(P<0.05),尤其是呈味氨基酸含量的增加,有利于滋味的形成;PAW处理组疏水性氨基酸的变化趋势与蛋白质表面疏水性的变化趋势一致,说明60 s和80 s处理组会破坏蛋白质的二硫键。随着处理时间的延长,样品中α-螺旋发生解旋,β-折叠组分增加,说明蛋白质结构逐渐展开,由紧密变松散,有助于暴露肌原纤维蛋白中的疏水基团。综上所述,PAW腌制能促使猪肉肌原纤维蛋白发生氧化同时改变蛋白质的结构;PAW腌制能够作为一种新型的腌制方法应用于肉制品的加工过程中,但目前低温等离子体技术在食品方面的应用研究仍处于探索阶段,PAW对肉制品风味品质的影响还有待进一步研究。
[1] ZOU Y H, KANG D C, LIU R, et al. Effects of ultrasonic assisted cooking on the chemical profiles of taste and flavor of spiced beef[J]. Ultrasonics Sonochemistry, 2018, 46: 36-45. DOI:10.1016/j.ultsonch.2018.04.005.
[2] JIN G F, HE L C, WANG Q L, et al. Pulsed pressure assisted brining of porcine meat[J]. Innovative Food Science & Emerging Technologies,2014, 22: 76-80. DOI:10.1016/j.ifset.2013.12.014.
[3] LEE J, JO K, LIM Y, et al. The use of atmospheric pressure plasma as a curing process for canned ground ham[J]. Food Chemistry, 2018,240: 430-436. DOI:10.1016/j.foodchem.2017.07.148.
[4] JUNG S, KIM H J, PARK S, et al. The use of atmospheric pressure plasma-treated water as a source of nitrite for emulsion-type sausage[J].Meat Science, 2015, 108: 132-137. DOI:10.1016/j.meatsci.2015.06.009.
[5] JURGEN M, MARTIN S, RALF S, et al. Nonthermal plasma chemistry and physics[M]. Boca Raton: Taylor & Francis Group, 2013:1-5. DOI:10.1201/b12956.
[6] ZDENKO M, KAROL H, YURI A. Plasma for bio-decontamination,medicine and food security[M]. Netherlands: Springer, 2012: 25-27.DOI:10.1007/978-94-007-2852-3.
[7] YONG H I, LEE S H, KIM S Y, et al. Color development,physiochemical properties, and microbiological safety of pork jerky processed with atmospheric pressure plasma[J]. Innovative Food Science and Emerging Technologies, 2019, 53: 78-84. DOI:10.1016/j.ifset.2017.09.005.
[8] 季慧, 陈野. 常压低温等离子处理提高花生分离蛋白水合性质的研究[J]. 中国粮油学报, 2019, 34(8): 61-65; 72.
[9] 汪媛, 张立彦, 齐宏超. NaCl及温度对猪肉脱水过程中蛋白质性质的影响[J]. 肉类研究, 2018, 32(7): 1-6. DOI:10.7506/rlyj1001-8123-201807001.
[10] 贾娜, 孙嘉, 王乐田, 等. 没食子酸对猪肉糜脂肪和蛋白氧化的抑制作用及对肉糜品质特性的影响[J]. 肉类研究, 2019, 33(3): 1-6.DOI:10.7506/rlyj1001-8123-20181228-243.
[11] ZHANG Z Y, YANG Y L, ZHOU P, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217: 678-686. DOI:10.1016/j.foodchem.2016.09.040.
[12] LORENZO J M, CITTADINIA, BERMUDEZ R, et al. Influence of partial replacement of NaCl with KCl, CaCl2 and MgCl2 on proteolysis, lipolysis and sensory properties during the manufacture of dry-cured lacón[J]. Food Control, 2015, 55: 90-96. DOI:10.1016/j.foodcont.2015.02.035.
[13] QI J, ZHANG W W, FENG X C, et al. Thermal degradation of gelatin enhances its ability to bind aroma compounds: investigation of underlying mechanisms[J]. Food Hydrocolloids, 2018, 83: 497-510.DOI:10.1016/j.foodhyd.2018.03.021.
[14] SHARIFIAN A, SOLTANIZADEH N, ABBASZADEH R. Effects of dielectric barrier discharge plasma on the physicochemical and functional properties of myofibrillar proteins[J]. Innovative Food Science & Emerging Technologies, 2019, 54: 1-8. DOI:10.1007/s11947-017-2015-z.
[15] KONG J L, YU S. Fourier transform infrared spectroscopic analysis of protein secondary structures[J]. Acta Biochimica et Biophysica Sinica,2007, 39(8): 549-559. DOI:10.1016/0003-2697(91)90155-M.
[16] ESTEVEZ M, VENTANAS S, HEINONEN M. Formation of Strecker aldehydes between protein carbonyls: α-aminoadipic and γ-glutamic semialdehydes-and leucine and isoleucine[J]. Food Chemistry, 2011,128(4): 1051-1057. DOI:10.1016/j.foodchem.2011.04.012.
[17] EKEZIE F C, CHENG J H, SUN D W. Effects of atmospheric pressure plasma jet on the conformation and physicochemical properties of myofibrillar proteins from king prawn (Litopenaeus vannamei)[J]. Food Chemistry, 2019, 276: 147-156. DOI:10.1016/j.foodchem.2018.09.113.
[18] OEHMIGEN K, HAHNEL M, BRANDENBURG R, et al. The role of acidification for antimicrobial activity of atmospheric pressure plasma in liquids[J]. Plasma Processes and Polymers, 2010, 7(3): 250-257.DOI:10.1002/ppap.200900077.
[19] HUANG M M, WANG J M, ZHUANG H, et al. Effect of in-package high voltage dielectric barrier discharge on microbiological, color and oxidation properties of pork in modified atmosphere packaging during storage[J]. Meat Science, 2019, 149: 107-113. DOI:10.1016/j.fm.2014.07.009.
[20] ZHOU R W, ZHOU R S, ZHUANG J X, et al. Interaction of atmospheric-pressure air microplasmas with amino acids as fundamental processes in aqueous solution[J]. PLoS ONE, 2016,11(5): e0155584. DOI:10.1371/journal.pone.0155584.
[21] LI C L, HE L C, MA S M, et al. Effect of irradiation modification on conformation and gelation properties of pork myofibrillar and sarcoplasmic protein[J]. Food Hydrocolloids, 2018, 84: 181-192.DOI:10.1016/j.foodhyd.2018.05.047.
[22] SUN W, ZHOU F, SUN D W, et al. Effect of oxidation on the emulsifying properties of myofibrillar proteins[J]. Food and Bioprocess Technology, 2012, 6(7): 1703-1712. DOI:10.1007/s11947-012-0823-8.
[23] ZHOU F, ZHAO M, SU G, et al. Binding of aroma compounds with myofibrillar proteins modified by a hydroxyl-radical-induced oxidative system[J]. Journal of Agricultural and Food Chemistry, 2014, 62(39):9544-9552. DOI:10.1021/jf502540p.
[24] YANG R, LIU Y Q, MENG D M, et al. Effect of atmospheric cold plasma on structure, activity, and reversible assembly of the phytoferritin[J]. Food Chemistry, 2018, 264: 41-48. DOI:10.1016/j.foodchem.2018.04.049.
[25] JIANG L Z, WANG J, LI Y, et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International, 2014, 62: 595-601. DOI:10.1016/j.foodres.2014.04.022.
[26] KANG D C, ZOU Y H, CHENG Y P, et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J].Ultrasonics Sonochemistry, 2016, 33: 47-53. DOI:10.1016/j.ultsonch.2016.04.024.
[27] STADTMAN E R, BARBARA S B. Protein oxidation in aging,disease, and oxidative stress[J]. The Journal of Biological Chemistry,1997, 272: 20313-20316. DOI:10.1074/jbc.272.33.20313.
[28] JI H, DONG S, HAN F, et al. Effects of dielectric barrier discharge(DBD) cold plasma treatment on physicochemical and functional properties of peanut protein[J]. Food and Bioprocess Technology,2017, 11(31): 344-354. DOI:10.1007/s11947-017-2015-z.
[29] VISESSANGUAN W, BENJAKULS, RIEBROY S, et al. Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J]. Meat Science, 2004, 66(3):579-588. DOI:10.1016/S0309-1740(03)00172-4.
[30] CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015,180: 235-243. DOI:10.1016/j.foodchem.2015.02.036.