胶原蛋白是一种白色、无异味的纤维蛋白,是动物体内含量最多的蛋白,约占总蛋白的30%,也是细胞外基质的主要结构蛋白,主要存在于动物的皮、软骨、肌腱、血管、角膜等结缔组织中[1]。其中,II型胶原蛋白与一些蛋白多糖结合,主要分布于软骨、玻璃体、髓核、胚胎角膜、视网神经膜等组织中,是构成软骨基质的主要成分之一。它能够促进软骨细胞的分化,增进骨骼健康,口服II型胶原蛋白还可诱导自身免疫耐受,抑制关节炎的发生和发展[2-6]。鸡胸软骨作为鸡肉加工中的废弃物,不但造成极大的浪费而且污染环境。研究发现鸡胸软骨中II型胶原蛋白的含量高达50%以上,因此可作为提取II型胶原蛋白的优质原料。
虽然II型胶原蛋白对关节炎有明显改善作用,但它的三螺旋结构极易被破坏,并且可能伴随生物活性的丧失[7-8]。而II型胶原蛋白的三螺旋结构的维持依赖于分子间和分子内各种作用的协同效应,如氢键、范德华力、水合作用及二硫键在维持其分子结构上共同发挥作用,疏水作用和离子作用提供了分子间作用力,因此,II型胶原蛋白的三螺旋结构的热稳定性受到众多因素的影响,包括内因和外因。内因主要有蛋白质来源、氨基酸组成、氨基酸序列和翻译后修饰等,而外因主要有pH值、离子浓度、溶剂、温度等[9-11]。由于II型胶原蛋白在生产加工过程中,所处环境的pH值和温度可能发生变化,这会对其结构性质和生物活性的发挥产生影响,从而探究温度和pH值对II型胶原蛋白的结构和物理化学性质的影响是目前亟待解决的问题之一。茹度是II型胶原蛋白的一个重要特性,且II型胶原蛋白的茹度与维系三螺旋结构的分子间和分子内的静电作用和氢键有着密切的联系[12-13],从而在一定程度上可以通过茹度的变化推测其结构以及物理化学性质的变化。虽然II型胶原蛋白的三螺旋结构和茹度特性己有相关研究,但其茹度的变化与结构的改变及热稳定性之间的关系鲜见报道。因此,本实验通过研究温度和pH值对II型胶原蛋白结构、茹度的影响,并探讨茹度变化、结构改变及热稳定性之间的关系,以期为II型胶原蛋白的生产加工及其在胃肠道发挥生物活性机理的探究提供参考。
1 材料与方法
1.1 材料与试剂
鸡胸软骨非变性II型胶原蛋白 广东华肽生物科技有限公司;氢氧化钠、氯化钠、冰乙酸、盐酸 广州精科化玻仪器公司;溴酚蓝、考马斯亮蓝R250、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、巯基乙醇、甘油、丙烯酰胺、过硫酸铵、四甲基乙二胺美国Geniview公司。
1.2 仪器与设备
pHS-3E pH计 北京雷磁仪器有限公司;CR22N高速冷冻离心机 日本日立公司;Mini-PROTEAN 3 Cell电泳仪 美国Bio-Rad公司;JB-1磁力搅拌器 上海雷磁新泾仪器有限公司;傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪 德国Bruker公司;圆二色光谱(circular dichroism,CD)仪英国Applied Photophysics公司;ME 204电子天平 瑞士Mettler Toledo公司;HAAKE MARS III旋转流变仪美国Thermo Scientific公司;A300全自动氨基酸分析仪德国曼默博尔公司。
1.3 方法
1.3.1 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析
电泳条件:分离胶体积分数7.5%,浓缩胶体积分数5%。称取一定质量鸡胸软骨II型胶原蛋白样品,溶于还原型上样缓冲液中,配制质量浓度为2 mg/mL溶液,于沸水浴中煮沸5 min,10 000 r/min离心10 min,收集上清液用于电泳分析,上样量为10 μL。染色液为0.25%考马斯亮蓝R-250溶液,脱色液为10%冰醋酸+10%甲醇+80%蒸馏水混合。电流30 mA,电泳时间约2 h。
1.3.2 氨基酸组成测定
精确称取10 mg鸡胸软骨II型胶原蛋白样品于水解管中,加入5 mL浓度为6 mol/L盐酸密封,110 ℃水解24 h。待水解液冷却至室温,过滤,用旋转蒸发仪50 ℃脱酸处理,将残留物用0.1 mol/L盐酸定容至25 mL。取0.1 mL待测液放入氨基酸自动分析仪中,测定总氨基酸组成。
1.3.3 FTIR分析
取适量鸡胸软骨II型胶原蛋白样品和溴化钾,置于玛瑙研钵中,研磨成粉,装样压片,用FTIR仪对样品在400~4 000 cm-1区间进行扫描,绘制光谱曲线。
1.3.4 CD分析
称取一定质量鸡胸软骨II型胶原蛋白样品溶于0.1 mol/L醋酸溶液中,配成0.15 mg/mL的II型胶原蛋白溶液。
1.3.4.1 不同pH值下的结构分析
将配好的II型胶原蛋白溶液用2 mol/L盐酸和2 mol/L氢氧化钠溶液节pH值至2、3、4、5、6、7、8、9、10,加入1 mm比色皿中,放入CD仪中于28 ℃(低于鸡胸软骨II型胶原蛋白的最低变性温度)进行光谱扫描,绘制各光谱曲线。
1.3.4.2 pH值对热稳定性的影响
取上述pH 2、3、5、7的II型胶原蛋白溶液,分别加入1 mm比色皿中,放入CD仪中于28、30、32、34、36、38、40、42 ℃进行光谱扫描,绘制各光谱曲线,并在其正吸收峰波长处,绘制不同温度下椭圆率的变化曲线。
1.3.5 茹度测定
称取一定质量鸡胸软骨II型胶原蛋白样品溶于0.1 mol/L醋酸溶液中,配成10 mg/mL的II型胶原蛋白溶液。
1.3.5.1 pH值对茹度的影响
将配好的II型胶原蛋白溶液用2 mol/L盐酸和2 mol/L氢氧化钠溶液调节pH值至2、3、4、5、6、7、8、9、10,用哈克旋转流变仪于28 ℃测定其茹度。
1.3.5.2 温度对茹度的影响
取上述pH 2、3、5、7的II型胶原蛋白溶液,用哈克旋转流变仪分别于28、32、34、36、38、42 ℃条件下测定其茹度。
1.4 数据统计分析
每个实验重复3 次,结果以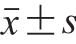 表示。使用SPSS 24.0软件的方差分析方法进行数据显著性分析,P<0.05,差异显著。采用Origin 2018软件作图。
表示。使用SPSS 24.0软件的方差分析方法进行数据显著性分析,P<0.05,差异显著。采用Origin 2018软件作图。
2 结果与分析
2.1 鸡胸软骨非变性II型胶原蛋白的表征
2.1.1 SDS-PAGE分析
由图1可看出,条带中分子质量为130 kDa的α1链颜色较深,含量较高,在200 kDa左右含有少量的β二聚体[14],几乎不含α2链,故II型胶原蛋白纯度较高[1,15-16]。
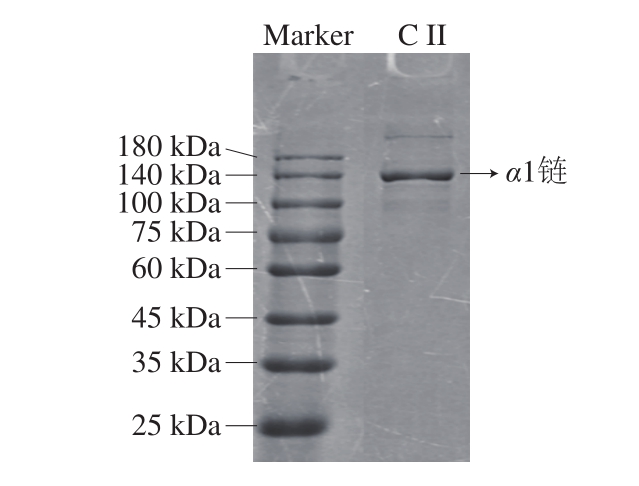
图1 II型胶原蛋白电泳图
Fig. 1 SDS-PAGE pattern of type II collagen
2.1.2 氨基酸组成分析
表1 鸡胸软骨II型胶原蛋白的总氨基酸组成
Table 1 Amino acid composition of type II collagen
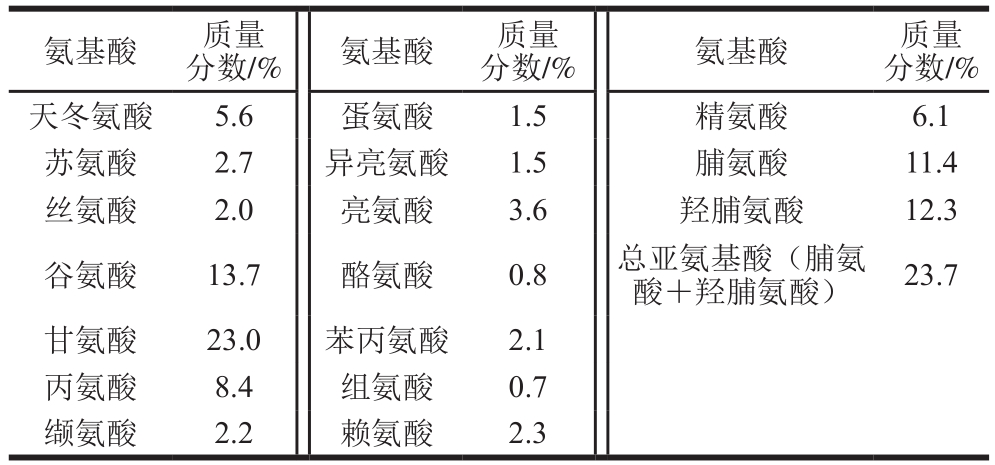
分数/%氨基酸质量分数/%氨基酸质量分数/%天冬氨酸 5.6 蛋氨酸 1.5 精氨酸 6.1苏氨酸 2.7 异亮氨酸 1.5 脯氨酸 11.4丝氨酸 2.0 亮氨酸 3.6 羟脯氨酸 12.3氨基酸 质量谷氨酸 13.7 酪氨酸 0.8 总亚氨基酸(脯氨酸+羟脯氨酸) 23.7甘氨酸 23.0 苯丙氨酸 2.1丙氨酸 8.4 组氨酸 0.7缬氨酸 2.2 赖氨酸 2.3
由表1可以看出,该鸡胸软骨II型胶原蛋白的甘氨酸、谷氨酸、羟脯氨酸和脯氨酸含量最高,质量分数分别约为23%、14%、12%和11%。亚氨基酸(脯氨酸和羟脯氨酸)质量分数约为24%,其在维持胶原蛋白三螺旋结构的稳定性方面发挥重要作用,一般亚氨基酸含量越高,胶原蛋白三螺旋结构越稳定,因为亚氨基酸中的吡咯环有助于形成三螺旋结构稳定的非共价键[2,9],且羟脯氨酸中羟基形成的氢键有助于维持胶原蛋白三螺旋结构的稳定性[17],而组氨酸和酪氨酸含量较低,与前人研究结果一致[1-2,18]。
2.1.3 FTIR分析
FTIR图中,酰胺A带是由N—H的伸缩振动产生的,酰胺B带是由—CH2非对称和对称伸缩振动产生的,酰胺I、II和III带与II型胶原蛋白的分子序列及三螺旋结构有关,酰胺I带是C=O的伸缩振动和N—H的弯曲振动产生的,酰胺II带是N—H的弯曲振动和C—N的伸缩振动产生的,为β-折叠和无规卷曲叠加产生的吸收带,酰胺III带是由蛋白酰胺键的C—N伸缩振动和N—H变形及甘氨酸中—CH2基团和脯氨酸侧链的摇摆振动共同产生[3]。1 200~1 400 cm-1为N—H的伸缩振动峰和COO—的对称收缩振动峰,可能是由于II型胶原蛋白的甘氨酸和羟脯氨酸及脯氨酸的含量较高,使得胶原蛋白在1 200~1 400 cm-1光谱范围内具有其他蛋白质所没有的红外光谱特征[17,19]。
由图2可知,该鸡胸软骨II型胶原蛋白有5 个吸收峰,即酰胺A带、酰胺B带、酰胺I带、酰胺II和酰胺Ⅲ带,分别位于3 448、2 937、1 642、1 560、1 243 cm-1处,与研究中报道的II型胶原吸收峰的位置基本一致[17,20-23],且酰胺III带与1 450 cm-1处吸收峰比值大于1,说明所提取的II型胶原蛋白的三螺旋结构保持完整[24-26]。

图2 II型胶原蛋白的FTIR图谱
Fig. 2 FTIR spectrum of type II collagen
2.1.4 CD分析
图3为该鸡胸软骨II型胶原蛋白在pH 3.0和28 ℃条件下的CD图,可以看出214 nm波长处椭圆率为0,222 nm波长处有一正吸收峰,这是左旋聚脯氨酸构型肽链CD的典型特征;200 nm波长处有一强的负吸收峰,这是II型胶原蛋白三螺旋结构中无规卷曲的典型特征,与文献[16,27]中报道的结果相似。且正吸收峰的强度可反映II型胶原蛋白三螺旋结构的完整性,当II型胶原蛋白的三螺旋结构被完全破坏时,正吸收峰会完全消失,负吸收峰会明显红移,而部分变性的蛋白质正吸收峰会红移,强度明显下降[2,28-29]。
CD法是常用的检测蛋白二级结构的方法,且由上述结果可知,该方法能较快速准确地检测出II型胶原蛋白在不同条件下的三螺旋结构,因此本实验采用此法来测定不同pH值和温度下II型胶原蛋白的结构变化是可行的。

图3 II型胶原蛋白的CD图谱
Fig. 3 CD spectrum of type II collagen
2.2 pH值对II型胶原蛋白结构的影响

图4 pH对II型胶原蛋白的CD图谱和椭圆率的影响
Fig. 4 Effect of pH on the CD spectrum and ellipticity of type II collagen
由图4可知,pH值对II型胶原蛋白的结构影响较大。在pH 2.0~9.0范围内,随着pH值的升高,CD的正吸收峰和负吸收峰均发生明显红移,且吸收强度也有所降低,依据椭圆率的变化可知,II型胶原蛋白三螺旋结构部分解旋(28%~57%),即II型胶原蛋白发生轻微变性;当pH值升高到10.0时,正负吸收峰又出现蓝移现象且强度增强,解旋程度降为7%,表明II型胶原蛋白三螺旋结构有所恢复。因此,在pH 2.0~4.0的酸性条件下,II型胶原蛋白三螺旋结构最完整;pH 5.0~9.0的弱酸至弱碱性条件下,II型胶原蛋白有28%~57%发生变性;pH 10.0时,仅7% II型胶原蛋白发生变性。
2.3 pH值对II型胶原蛋白热稳定性的影响

图5 温度对II型胶原蛋白CD图谱及椭圆率变化的影响
Fig. 5 Effect of temperature on the CD spectrum and ellipticity of type II collagen
由图5a~d可知,随温度升高,不同pH值II型胶原蛋白正吸收峰处椭圆率均逐渐减小,表明其三螺旋结构逐渐解旋而发生变性,因此可根据椭圆率的变化情况来推测不同pH值条件下II型胶原蛋白的变性温度,从而判断其热稳定性。由图5e可知,pH 2.0时,II型胶原蛋白的变性温度约为37 ℃(即1/2椭圆率时的温度),完全变性温度约为39 ℃(正吸收峰消失点,即曲线与x轴的交点);pH 3.0时,II型胶原蛋白的变性温度约为39 ℃,完全变性温度约为42 ℃;pH 5.0时,II型胶原蛋白的变性温度约为40 ℃,完全变性温度约为46 ℃;pH 7.0时,II型胶原蛋白的变性温度约为43 ℃,完全变性温度约为48 ℃。因此,pH 2.0~4.0时,变性温度在37~39 ℃之间,热稳定性较低;pH 5.0~7.0时,变性温度在40~43 ℃之间,且完全变性温度为46~48 ℃,热稳定性高。即pH值越低,II型胶原蛋白热稳定性也越低,弱酸性至中性范围内较酸性条件下热稳定性高。
2.4 pH值对II型胶原蛋白茹度的影响

图6 pH值对II型胶原蛋白的黏度的影响
Fig. 6 Effect of pH on the viscosity of type II collagen
由图6可知,pH值对II型胶原蛋白茹度有很大影响。pH 2.0~5.0之间,II型胶原蛋白的茹度先增大后减小,且在pH 3.0时茹度达到最大值;pH 5.0~9.0之间茹度最小,且基本保持不变;pH 10.0时茹度又增大。由于pH 2.0时酸性较强,II型胶原蛋白溶解度大,分子溶胀伸展,氢键等引起的分子间作用力小,因此茹度较小;pH 3.0时,II型胶原蛋白三螺旋结构完整,且分子上带较多正电荷,电荷相互排斥导致分子运动阻力增大,表观茹度增大;pH 5.0~9.0的弱酸性至弱碱性范围,接近II型胶原蛋白的等电点,膨胀度及溶解度小,整个分子趋向于蜷曲状态,三螺旋结构发生轻微改变,且分子上带电荷较少,电荷相互排斥作用弱,从而分子间运动阻力减小,故茹度较小[30-31];pH 10.0与pH 3.0的原理相似,由于分子上的净负电荷增多,电荷间较强烈的排斥作用,使得分子运动阻力增大,导致茹度增加。结合2.2节CD分析结果知,茹度大小与三螺旋结构的完整性、溶液中正负电荷间静电作用力及分子间氢键有关,因此,pH值变化引起II型胶原蛋白茹度大小的变化,一定程度上能够反映其三螺旋结构的改变,即在pH 3.0~9.0范围内,pH值升高,茹度降低,三螺旋结构解旋程度增大。
2.5 温度和pH值对II型胶原蛋白茹度的影响
由于pH值对鸡胸软骨II型胶原蛋白茹度变化影响较大,因此为了进一步考察其茹度随温度的变化,选取pH 2.0、3.0、5.0、7.0条件下具有不同茹度特性的II型胶原蛋白,测定其在28~42 ℃的茹度。由图7可知,在不同pH值下,鸡胸软骨II型胶原蛋白的茹度均随温度的升高而降低,与胡建平[31]不同骨胶原的茹度研究结果一致。因温度越高,II型胶原蛋白变性程度越大,分子内各种次级键被破坏,高度有序的三螺旋结构向无规卷曲转变,因此物理化学性质发生改变,导致茹度下降[9]。pH 2.0时,茹度随温度变化在34~38 ℃之间存在一个突变,这是因为II型胶原蛋白发生了严重变性,导致茹度突然下降,pH 3.0时茹度随温度变化突变区在38~40 ℃之间,而pH 5.0和pH 7.0均不存在茹度下降突变区,说明此时II型胶原蛋白未发生明显变性,热稳定性高,因此,弱酸性至中性条件较酸性条件下热稳定性高。上述结果与2.3节CD分析所得的结果一致,从而得知,相同pH值下,温度升高可导致II型胶原蛋白茹度减小,表明II型胶原蛋白的三螺旋结构发生了改变。
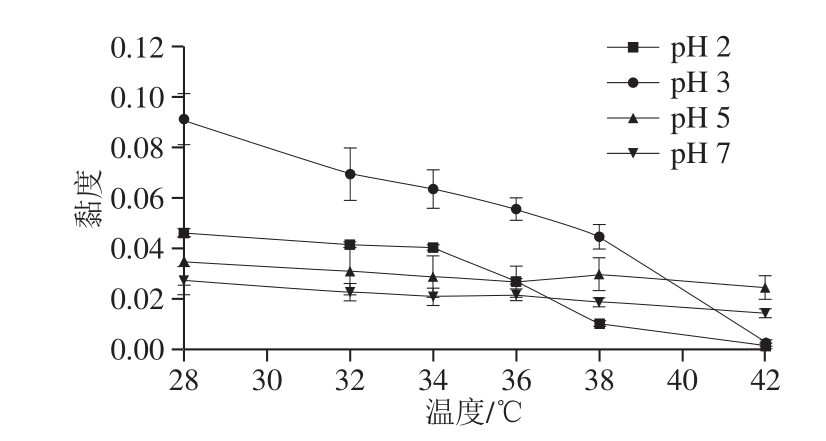
图7 pH值和温度对II型胶原蛋白的黏度的影响
Fig. 7 Effect of pH and temperature on the viscosity of type II collagen
2.6 结构和茹度的相关性分析
由2.5节结果可知,随着温度和pH值升高,鸡胸软骨II型胶原蛋白茹度的变化与CD正吸收峰处椭圆率的变化有相似的趋势。为了更清晰地看出鸡胸软骨II型胶原蛋白茹度变化与结构改变之间的关系,对II型胶原蛋白在不同温度以及不同pH值下的茹度和CD吸收峰椭圆率之间进行相关性分析。
表2 II型胶原蛋白黏度和椭圆率的相关性分析
Table 2 Correlation analysis between viscosity and structure of type II collagen
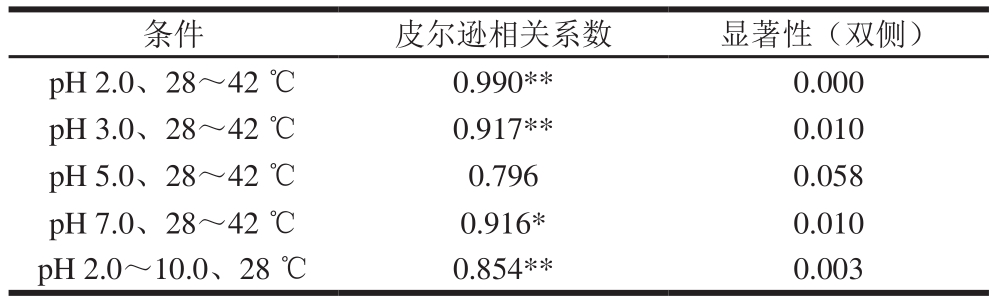
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
条件 皮尔逊相关系数 显著性(双侧)pH 2.0、28~42 ℃ 0.990** 0.000 pH 3.0、28~42 ℃ 0.917** 0.010 pH 5.0、28~42 ℃ 0.796 0.058 pH 7.0、28~42 ℃ 0.916* 0.010 pH 2.0~10.0、28 ℃ 0.854** 0.003
由表2可知,pH 2.0时,II型胶原蛋白的茹度和椭圆率随温度的变化在0.000水平上具有强相关性;pH 3.0和pH 7.0时,二者在0.010水平上具有强相关性;pH 5.0时二者相关性较弱,且相关性不显著。在相同温度下,II型胶原蛋白茹度和椭圆率随pH值变化在0.003水平上具有相关性,相关系数为0.854。因此,II型胶原蛋白在不同温度下的茹度变化与结构改变之间具有相关性,温度越高,其茹度则越低,三螺旋结构解旋程度也越大;II型胶原蛋白在不同pH值条件下的茹度变化与其结构改变也具有相关性,一定范围内,pH值升高,分子上的静电作用力减小,三螺旋结构发生轻微改变,茹度降低,而当pH升高到一定值时,静电作用力增大,三螺旋结构又有所恢复,茹度也因此增大。
3 结 论
鸡胸软骨II型胶原蛋白的三螺旋在pH 2.0~4.0之间较为完整,在pH 5.0~9.0的弱酸至弱碱性范围内轻微解旋(28%~57%),pH 10.0时仅7%发生解旋。茹度在pH 2.0~5.0之间先增大后减小,且pH 3.0~4.0时达到最大值;在pH 5.0~9.0之间最小且基本保持不变;pH 10.0时又增大。pH 2.0~4.0时,变性温度在37~39 ℃之间,热稳定性较低;pH 5.0~7.0时,变性温度在40~43 ℃之间,且完全变性温度为46~48 ℃,热稳定性很高。茹度和结构随温度变化具有显著的强相关性(P<0.05),温度越高,茹度越低,三螺旋结构解旋程度越大;在pH 3.0~9.0范围内,pH值升高,分子上的静电作用力减弱,溶液茹度降低,三螺旋结构解旋程度也增大(P<0.01)。
[1] 曹慧. 鸡胸软骨II型胶原的制备及功能性研究[D]. 无锡: 江南大学,2008.
[2] 卜永士. II型胶原蛋白分子结构特征与免疫耐受特性关系的研究[D].上海: 上海海洋大学, 2017.
[3] DAI M, LIU X, WANG N, et al. Squid type II collagen as a novel biomaterial: isolation, characterization, immunogenicity and relieving effect on degenerative osteoarthritis via inhibiting STAT1 signaling in pro-inf l ammatory macrophages[J]. Materials Science and Engineering:C, 2018, 89: 283-294. DOI:10.1016/j.msec.2018.04.021.
[4] BAGI C M, BERRYMAN E R, TEO S, et al. Oral administration of undenatured native chicken type II collagen (UC-II) diminished deterioration of articular cartilage in a rat model of osteoarthritis(OA)[J]. Osteoarthritis and Cartilage, 2017, 25(12): 2080-2090.DOI:10.1016/j.joca.2017.08.013.
[5] 宋晓娣. 天然II型胶原蛋白抗关节炎功能研究[D]. 天津: 天津科技大学, 2014.
[6] 刘安军, 宋晓娣, 郑捷, 等. 猪II型胶原及胶原肽抗关节炎的研究[J].现代食品科技, 2014, 30(3): 1-6.
[7] BIGI A, PANZAVOLTA S, RUBINI K. Relationship between triple-helix content and mechanical properties of gelatin films[J]. Biomaterials, 2004, 25(25): 5675-5680. DOI:10.1016/j.biomaterials.2004.01.033.
[8] PATI F, ADHIKARI B, DHARA S. Isolation and characterization of fish scale collagen of higher thermal stability[J]. Bioresource Technology, 2010, 101(10): 3737-3742. DOI:10.1016/j.biortech.2009.12.133.
[9] 高玲玲, 侯成立, 高远, 等. 胶原蛋白热稳定性研究进展[J]. 中国食品学报, 2018, 18(5): 195-207.
[10] HIPPEL P H V, WONG K Y. The effect of ions on the kinetics of formation and the stability of the collagen-fold[J]. Biochemistry, 1962,1(4): 664-674. DOI:10.1021/bi00910a020.
[11] BOUDKO S P, ENGEL J, BÄCHINGER H P. The crucial role of trimerization domains in collagen folding[J]. The International Journal of Biochemistry & Cell Biology, 2012, 44(1): 21-32. DOI:10.1016/j.biocel.2011.09.009.
[12] 王碧, 王坤余, 贾冬英, 等. 胶原蛋白及多肽的茹度特性[J]. 中国皮革, 2003(11): 23-26.
[13] 郭文宇, 李俊刚, 罗英. 超声波降解胶原蛋白茹度性能变化的研究[J].中国皮革, 2016, 45(5): 31-35.
[14] JEEVITHAN E, BAO B, BU Y, et al. Type II collagen and gelatin from silvertip shark (Carcharhinus albimarginatus) cartilage: isolation,purification, physicochemical and antioxidant properties[J]. Marine Drugs, 2014, 12(7): 3852-3873. DOI:10.3390/md12073852.
[15] CREMER M A, ROSLONIEC E F, KANG A H. The cartilage collagens: a review of their structure, organization, and role in the pathogenesis of experimental arthritis in animals and in human rheumatic disease[J]. Journal of Molecular Medicine, 1998, 76(3):275-288. DOI:10.1007/s001090050217.
[16] MILLER E J. Isolation and characterization of a collagen from chick cartilage containing three identical alpha chains[J]. Biochemistry,1971, 10(9): 1652-1659.
[17] BOSKEY A, PLESHKOCAMACHO N. FT-IR imaging of native and tissue-engineered bone and cartilage[J]. Biomaterials, 2007, 28(15):2465-2478. DOI:10.1016/j.biomaterials.2006.11.043.
[18] 张艳艳, 刘海英. 鸡胸软骨胶原的提取及其结构表征[J]. 安徽农业科学, 2018, 46(15): 155-157.
[19] 车帅, 杜芬, 刘楚怡, 等. 中华鲟软骨II型胶原蛋白的结构分析[J].食品工业科技, 2018, 39(4): 60-63.
[20] 杨平, 刘影, 公丽艳, 等. 酸法和酶法提取草鱼鱼鳞胶原蛋白的特性分析[J]. 食品工业, 2018, 39(7): 129-132.
[21] NOREEN R, MOENNER M, HWU Y, et al. FTIR spectro-imaging of collagens for characterization and grading of gliomas[J].Biotechnology Advances, 2012, 30(6): 1432-1446. DOI:10.1016/j.biotechadv.2012.03.009.
[22] MUYONGA J H, COLEC G B, DUODU K G. Fourier transform infrared (FTIR) spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 86(3): 325-332. DOI:10.1016/j.foodchem.2003.09.038.
[23] GELSE K. Collagens: structure, function, and biosynthesis[J].Advanced Drug Delivery Reviews, 2003, 55(12): 1531-1546.DOI:10.1016/j.addr.2003.08.002.
[24] 张金伟, 曹念, 陈武勇. 微波辐照对胶原蛋白三股螺旋结构的影响[J].光谱学与光谱分析, 2018, 38(5): 1353-1357.
[25] NAZEER R A, KAVITHA R, GANESH R J, et al. Detection of collagen through FTIR and HPLC from the body and foot of donax cuneatus linnaeus, 1758[J]. Journal of Food Science and Technology,2014, 51(4): 750-755. DOI:10.1007/s13197-011-0539-1.
[26] 张云凤, 王煜, 吴棒, 等. 牛跟腱中胶原蛋白的提取及表征[J]. 山西化工, 2015, 35(2): 8-11.
[27] HUANG C, KUO J, WU S, et al. Isolation and characterization of fish scale collagen from tilapia (Oreochromis sp.) by a novel extrusionhydro-extraction process[J]. Food Chemistry, 2016, 190: 997-1006.DOI:10.1016/j.foodchem.2015.06.066.
[28] KELLY S M, JESS T J, PRICE N C. How to study proteins by circular dichroism[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2005, 1751(2): 119-139. DOI:10.1016/j.bbapap.2005.06.005.
[29] WHITMORE L, WALLACE B A. Protein secondary structure analyses from circular dichroism spectroscopy: methods and reference databases[J]. Biopolymers, 2008, 89(5): 392-400. DOI:10.1002/bip.20853.
[30] 冯建慧, 吴晓洒, 蔡路昀, 等. 鲢鱼鱼皮和鱼骨胶原蛋白的提取及理化性质分析[J]. 中国食品学报, 2017, 17(7): 102-108.
[31] 胡建平. 鱼骨胶原蛋白的茹度特性研究[J]. 食品与发酵科技, 2009,45(6): 36-40.