近年来,随着人们健康意识的增强,益生菌在饮食科学与商业领域引起广泛关注。大多数乳酸菌都是益生菌,乳酸菌在肠道定植后,可以促使人体更好地吸收食物中的营养成分,缓解部分人群的乳糖不耐症,控制由肠道感染引起的疾病以及抑制某些类型癌症等[1]。目前人体摄入的益生菌主要来源于发酵乳制品,然而人们食用发酵乳制品仍然受到乳糖不耐受、胆固醇含量以及存在致敏原等因素限制[2]。随着素食消费者增加,一些发达国家对于素食益生菌食品的需求也大大增加[3]。因此富含益生菌的非乳制品开发具有广阔的前景。苹果是世界上消费最多的水果之一,富含糖类、有机酸、多酚、维生素等营养成分。食用苹果可以抑制心血管疾病、糖尿病等慢性疾病[4]。草莓浆果富含酚类物质,常温下贮藏保鲜时间短,极易腐烂,浪费严重[5]。大多数的水果、蔬菜对人体的益处主要源于类黄酮、异黄酮和酚酸等酚类物质,而苹果、草莓等常见水果及其加工产品是人类饮食中酚类物质的主要来源之一[1]。利用乳酸菌发酵果汁既可以产生乳酸发酵的风味,又不失果蔬原料的自然风味,从而构成了发酵果汁的独特风味。
植物乳杆菌(Lactobacillus plantarum)在果蔬发酵领域应用广泛,如果蔬汁的发酵和泡菜的制备[6]、葡萄酒的苹果酸-乳酸发酵[7]等。植物乳杆菌能够产生多种酶,一方面水解释放酚类物质,另一方面转化酚类物质产生高附加值的生物活性物质[8]。植物乳杆菌利用单宁酶水解单宁酸释放没食子酸[9];肉桂酸类物质通常与植物细胞壁结合,需经过酶解作用释放,以供肠道细胞吸收[10];植物乳杆菌可产生阿魏酰酯酶,将阿魏酸和咖啡酸等从结合态释放出来[11];没食子酸、表儿茶酸以及黄酮醇、黄烷-3-醇的释放也与酯酶活性有关[12-14]。此外,植物乳杆菌可产生酚酸脱羧酶、还原酶等酶,将p-香豆酸、阿魏酸、咖啡酸等酚酸转化成重要的风味物质,如4-乙烯基苯酚、4-乙烯基愈创木酚等,进而还原成相应的4-乙基衍生物,从而影响发酵果蔬的风味特征[15]。其次,没食子酸、咖啡酸等酚酸经植物乳杆菌代谢可转化为具有强抗氧化活性的焦棓酸、二氢咖啡酸等,提高了果蔬制品的营养功能[8,16-17]。
近年来,许多研究表明低频超声波(20~50 kHz)可以促进发酵中细胞增长,缩短发酵时间;提高酶活性,促进微生物的代谢和相关生物转化。罗娟[18]研究发现,低场强功率超声波促进了枯草芽孢杆菌液态发酵豆粕,发酵后可溶性蛋白和多肽产量明显提高,蛋白加工特性得到改善。低频超声波还可提高乳酸菌产乳酸的能力[19]。Huang Guoping等[20]研究发现低频超声波(28 kHz、100 W/L)可以提高L. paracasei发酵脱脂乳中多肽产量,增加活菌数,推测多肽产量增加可能与超声瞬间激活胞外酶有关。Yeo等[21]发现超声在L. casei FTDC 2113发酵甘露醇-豆奶中增强了菌体细胞的增长,促进胞内胞外β-葡萄糖苷酶的活性,异黄酮转化增加。然而,目前关于超声波辅助植物乳杆菌发酵果蔬汁的研究鲜有报道。本研究选择富含酚类物质的苹果汁和草莓汁作为发酵基质,选取不同强度超声波辅助植物乳杆菌发酵,旨在探明超声波对植物乳杆菌发酵苹果汁和草莓汁过程中菌体生长、基本营养代谢以及酚类物质变化的影响,以期为超声辅助植物乳杆菌发酵果蔬汁的应用提供理论依据,进而为超声波对植物乳杆菌发酵果蔬过程中酚类物质变化影响的机理研究提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
‘红富士’苹果 江苏徐州大沙河果园;‘丰香’草莓鲜果 江苏镇江市句容市白兔镇草莓园。植物乳杆菌BNCC337796冻干粉 北京北纳生物保藏中心。
福林-酚、2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-amino-di (3-ethylbenzothiazoline-6-sulphonic acid) ammonium salt,ABTS)、2,4,6-三(2-吡啶基)三嗪(2,4,6-tri(2-pyridyl)striazine,TPTZ)、酚类物质、糖、有机酸等标准品 上海源叶生物科技有限公司;甲醇、乙腈、冰醋酸(均为色谱纯) 国药集团化学试剂有限公司;MRS琼脂、MRS肉汤 上海博微生物科技有限公司;果胶酶(活力≥60 000 U/g) 浙江一诺生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
液相色谱仪 日本岛津公司;1200系列液相色谱仪美国安捷伦公司;UV5100B紫外-可见光分光光度计上海元析仪器有限公司;GL-20G-II冷冻离心机 上海安亭科学仪器厂;PHS-3C型pH计 上海仪电科学仪器股份有限公司;JA2003型电子天平 上海精密科学仪器有限公司;WYT-J糖度计 成都豪创光电仪器有限公司;VCX 130超声细胞破碎仪 美国Sonics公司。
1.3 方法
1.3.1 菌种活化
植物乳杆菌BNCC337796冻干粉混匀在MRS肉汤中,37 ℃活化24 h后,与50%甘油溶液按照1∶1混合,于-20 ℃长期保存。另外取培养液转接到斜面培养基上,37 ℃培养24 h后放置于4 ℃短期保存,作为整个研究中的种子液制备菌种。挑取斜面菌落接种于50 mL无菌MRS肉汤中,37 ℃培养24 h后作为活化的种子液使用。
1.3.2 苹果汁和草莓汁制备
苹果汁制备参照Liao Hongmei等[22]方法并修改。将苹果去皮、去核,加入0.15% L-抗坏血酸钠和10%的纯净水,打浆,4 层纱布过滤,4 000 r/min离心20 min,用葡萄糖调节可溶性固形物质量分数为13%,用碳酸钠调节pH值至6.5(苹果汁的自然pH值约为4.3),110 ℃灭菌10 min,灭菌后在无菌条件下进行分装。
草莓汁制备参照陈玮等[23]方法并修改。草莓经清洗、去柄除萼后,破碎打浆,加入0.04%果胶酶,45 ℃水浴酶解90 min,4 层纱布过滤,4 000 r/min离心20 min,保留上清液,加葡萄糖调节至可溶性固形物质量分数为13%,用碳酸钠调节pH值至4.0(基于前期实验)。85 ℃水浴20 min灭菌,灭菌后在无菌条件下进行分装。
1.3.3 发酵体系建立
将种子液以2%的接种量接种到苹果汁和草莓汁中,初始菌数约为7.5(lg(CFU/mL)),37 ℃发酵。超声频率为20 kHz,超声探头位于液面以下约1 cm,设置58.3 W/L和93.6 W/L两个超声强度,每组在接种0、4、8、12、16、24、32 h后均超声处理2 min,模式为5 s开、5 s关,整个发酵过程共计超声7 次。每次超声前,取发酵0、4、8、12、16、24、32、40 h后的发酵液,测定相应指标。以相同条件下发酵未超声处理的苹果汁和草莓汁作为对照。
1.3.4 指标测定
1.3.4.1 菌落数测定
采用平板菌落计数法测定发酵液中的植物乳杆菌数量,以lg(CFU/mL)表示。
1.3.4.2 糖含量测定
参照Vervoort等[24]方法,并稍作修改。采用安捷伦1200系列液相色谱仪,外部连接Alltech 3300蒸发光散射检测器。色谱柱为Prevail carbohydrate ES column(250 mm×4.6 mm,5 μm)并连接一个Prevail C18柱(7.5 mm×4.6 mm,5 μm)作为保护柱。柱温:30 ℃;流动相:乙腈-水(75∶25,V/V);流速:1 mL/min;运行时间:23 min;漂移管温度:80 ℃;氮气流速:1.5 L/min;进样量:10 μL。采用标准品获得保留时间和标准曲线对发酵液中游离糖进行定性和定量,结果表示为g/L。
1.3.4.3 有机酸含量测定
有机酸含量测定采用Lima等[25]的方法,并有所修改。采用液相色谱法,色谱柱为安捷伦TC-C18柱(4.6 mm×25 mm,5 μm);检测波长:210 nm;流动相:0.08 mol/L KH2PO4溶液(用磷酸调pH 2.9)进行等梯度洗脱;柱温:30 ℃;流速:0.7 mL/min;进样量:20 μL。采用标准品获得保留时间和标准曲线对发酵液中有机酸进行定性和定量,结果表示为mg/L。
1.3.4.4 总酚含量测定
采用福林-酚法[26],没食子酸构建标准曲线,结果以没食子酸当量(mg/L)表示。
1.3.4.5 单体酚含量测定[27]
酚酸和黄酮醇类的高效液相色谱分析采用Inertsil ODS-3柱(4.6 mm×250 mm,5 µm),柱温:25 ℃;流动相:A液为1%醋酸溶液,B液为1%醋酸-甲醇溶液;流速:0.6 mL/min;梯度按如下方式设定:0~10 min,90%~74% A,10%~26% B;10~25 min,74%~60%A,26%~40% B;25~45 min,60%~35% A,40%~65% B;45~55 min,35%~5% A,65%~95% B;55~58 min,5%~90% A,95%~10% B;58~65 min,90% A,10% B。酚酸类测定波长280 nm,黄酮醇类测定波长350 nm;进样量20 µL。通过标准品建立标准曲线进行定量分析,结果表示为mg/L。
1.3.4.6 抗氧化活性测定
ABTS阳离子自由基清除能力测定参照Re等[28]的方法,以标准品Trolox制作标准曲线,结果以Trolox当量(mmol/L)表示。Fe3+还原力测定参照Benzie等[29]的方法,以FeSO4为标准物制作标准曲线,结果以Fe2+当量(mmol/L)表示。
1.4 数据分析
所有实验均重复3 次,采用Excel 2007进行图表制作,SPSS 20.0进行显著性差异分析,Minitab 17进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 超声对发酵过程中菌落生长的影响
植物乳杆菌在苹果汁中发酵至24 h,基本进入稳定期,菌落数达到8.59(lg(CFU/mL))(图1A);在草莓汁中发酵至8 h即进入稳定期,菌落数为8.21(lg(CFU/mL))(图1B)。这可能是由于两种果汁的初始pH值不同,灭菌后苹果汁初始的pH值为5.52,而草莓汁的初始pH值为4.04。植物乳杆菌生长的最适pH值为6.5[30],较低的pH值环境限制了植物乳杆菌在草莓汁中的生长,因此草莓汁中植物乳杆菌较早进入稳定期,且稳定期菌落数低于苹果汁中菌落数。由图1A可知,58.3 W/L超声处理提高了苹果汁中乳杆菌的生长速率。从趋势上看,在发酵过程中,58.3 W/L超声处理的苹果汁中乳杆菌数量一直高于未超声组,特别是在32 h,58.3 W/L超声处理的苹果汁中植物乳杆菌数量为8.8 0(l g(C F U/m L)),比未超声组高1.73%(P<0.05),而93.6 W/L超声处理对苹果汁中乳杆菌的生长无明显影响(P>0.05),表明适当强度的超声处理可以提高乳杆菌生长速率。在草莓汁发酵中,超声处理延长了草莓汁中微生物生长的对数期。58.3 W/L和93.6 W/L超声处理的菌落数在32 h后显著高于未超声组(P<0.05),40 h后分别高于未超声组4.73%和2.55%,这与Dahroud等[31]研究结果一致,其研究发现超声处理(60%振幅,超声15 s,10 g/L的蛋白胨)能够延长对数期,提高菌体增长速率,对菌体细胞的生长繁殖有促进作用。这一方面可能是因为超声有助于分散培养过程中形成的微生物细胞簇,促进菌体细胞与营养物质的接触[32],另一方面较低强度超声可改变菌体细胞的通透性和形态变化,加快细胞内外物质交换速率,从而加快微生物的生长速度[20]。此外超声还可能会对细胞成分、功能或者遗传方面产生影响,也可加快微生物的繁殖[32]。
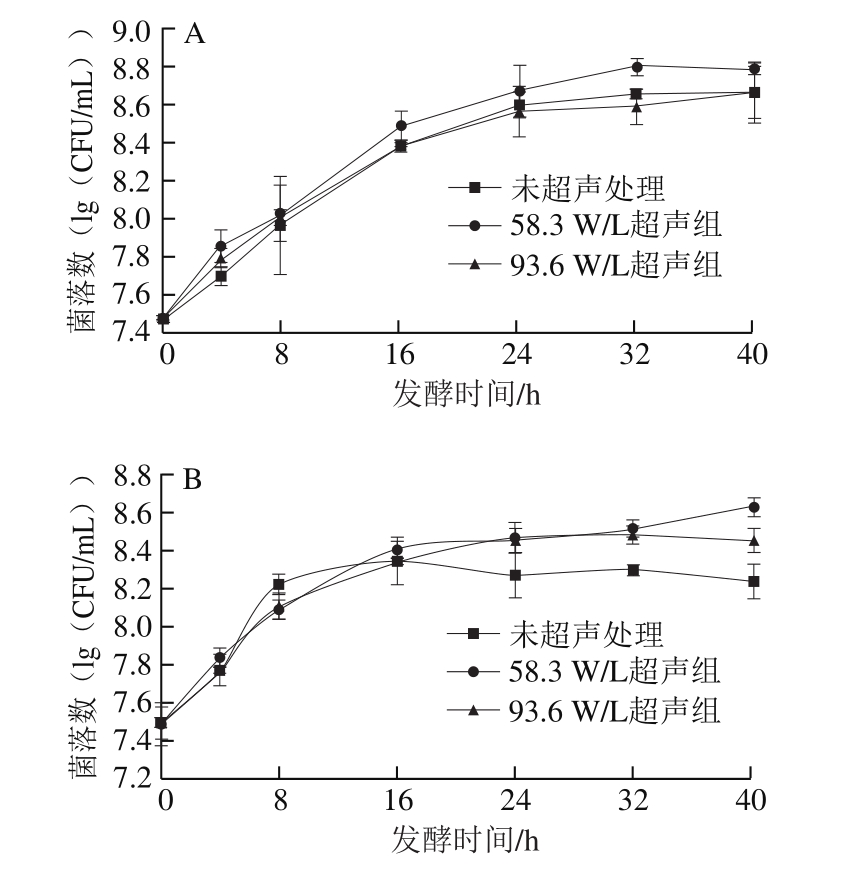
图1 超声对苹果汁(A)和草莓汁(B)发酵过程中的植物乳杆菌数量的影响
Fig. 1 Effects of ultrasound on the quantity of L. plantarum during the fermentation of apple juice (A) and strawberry juice (B)
2.2 超声对发酵过程中糖和有机酸类代谢的影响
表1 植物乳杆菌发酵苹果汁过程中糖和有机酸含量变化
Table 1 Changes in sugar and organic acid contents in apple juice during fermentation by L. plantarum

注:大写字母不同表示不同发酵时间之间差异显著(P<0.05);小写字母不同表示不同处理组之间差异显著(P<0.05),下同。
时间/h 组别 乳酸/(mg/L)葡萄糖/(g/L)0 0.00±0.00A 159.18±26.43A1 659.71±82.67A60.79±10.82A13.24±0.05A32.76±0.03A3.85±0.01A16.33±0.07A柠檬酸/(mg/L)苹果酸/(mg/L)丙酮酸/(mg/L)蔗糖/(g/L)果糖/(g/L)山梨醇/(g/L)8未超声 1 057.67±93.64Ba562.30±81.54Ba676.91±23.57Ba105.55±1.10Ba13.17±0.11Aa32.27±0.03Ba3.71±0.10Aa15.78±0.08Ba 58.3 W/L1 119.22±109.93Ba1 438.76±28.57Cb680.83±23.78Ba106.15±0.41Ba13.09±0.09ABa32.19±0.21ABa3.63±0.02ABa15.70±0.12Ba 93.6 W/L1 112.82±130.13Ba2 020.84±147.52Dc690.28±29.19Ba106.51±1.43Ba13.23±0.10Aa32.47±0.22Aa3.74±0.02Aa16.12±0.10Ab 24未超声 2 651.36±128.84Ca566.37±117.06Ba306.88±25.16Ca104.84±2.62Ba13.16±0.07Aab32.04±0.10Cb3.37±0.15Ba15.14±0.11Ca 58.3 W/L 2 699.53±86.73Ca861.26±174.74Bab324.98±19.81Ca111.57±2.35Bb12.95±0.12Bb31.80±0.13Ba3.40±0.09Bab14.79±0.05Cb 93.6 W/L2 797.95±238.25Ca1 074.60±229.49Cb327.33±29.00Ca112.63±4.09Bb13.32±0.19Aa32.33±0.05Ac3.64±0.13Ab14.79±0.15Bb 40未超声 3 479.55±29.34Da163.90±86.97Aa303.89±38.40Ca59.61±1.78Aa13.10±0.06Aab31.92±0.13Ca3.43±0.07Ba14.10±0.39Da 58.3 W/L 3 376.68±97.78Da326.19±210.00Aab322.21±37.94Ca64.12±0.19Ab13.32±0.21Aa32.41±0.72ABa3.45±0.26Ba14.26±0.49Da 93.6 W/L 3 313.52±95.17Da550.44±90.02Bb328.81±27.17Ca65.41±3.07Ab12.92±0.05Bb31.64±0.38Ba3.13±0.16Ba14.24±0.46Ca
表1包含乳酸、苹果酸、葡萄糖和果糖等8 个变量。PCA可将包含多个变量的数据进行降维处理,将主要信息保留在几个不相关的主成分中,苹果汁发酵样本经PCA后得到得分图和载荷图如图2所示。由图2A可见,发酵后苹果汁样本PC1值由正值变为负值,而在图2B中,果糖、山梨醇、葡萄糖在PC1上的载荷值较高,且为正值,表明苹果汁经发酵后果糖、山梨醇和葡萄糖含量下降。以未超声样品为例,发酵前苹果汁中果糖、山梨醇和葡萄糖质量浓度分别为(32.76±0.03)、(3.85±0.01)g/L和(16.33±0.07)g/L,发酵至40 h,果糖、山梨醇和葡萄糖质量浓度分别为(31.92±0.13)、(3.4 3±0.0 7)g/L和(1 4.1 0±0.3 9)g/L,葡萄糖下降最多,这可能与细菌细胞调控中的碳分解代谢物抑制现象有关,即当细菌暴露在两种或两种以上的碳源时,细菌会选择性优先利用能够使自身快速生长的一种碳源,通常是葡萄糖[33]。由表1可知,发酵至24 h,93.6 W/L超声组的葡萄糖含量显著低于未超声组,说明超声可能促进了植物乳杆菌对葡萄糖的利用。
发酵前苹果汁中最主要的有机酸是苹果酸,质量浓度为(1 659.71±82.67)mg/L,其次为柠檬酸,质量浓度为(159.18±26.43)mg/L。结合图2A、B可知,在发酵过程中,苹果汁样品的PC1值逐渐减小,而苹果酸在PC1上载荷较大,且为正值,表明含量持续下降,反之,乳酸在载荷图中PC1为负值,因此含量增加。另外,柠檬酸和丙酮酸在PC2上的载荷较大,且为正值,在发酵过程中,苹果汁样品的PC2值先增大后减小,表明柠檬酸和丙酮酸含量先增加后减小。至发酵结束时苹果酸质量浓度减少至(303.89±38.40)mg/L,这是因为植物乳杆菌发酵苹果汁中存在苹果酸-乳酸发酵,将苹果酸转化生成乳酸[34],因此发酵苹果汁中的乳酸不仅来源于糖的代谢,也来源于苹果酸代谢。发酵早期丙酮酸含量上升可能是作为糖酵解产物积累,而后期下降可能是因为丙酮酸转化为乳酸或者其他代谢产物[33];由表1可知,发酵24 h后,两个不同强度超声处理下,丙酮酸含量均显著高于未超声组,结合前述超声可能促进了葡萄糖的利用,因此进一步推测超声可能促进了糖酵解。柠檬酸是三羧酸循环的中间代谢产物,其含量处于动态变化中。早期由于发酵体系中残留部分氧,乳酸菌进行有氧呼吸,使得丙酮酸代谢产生柠檬酸[35],因此含量增加,后期柠檬酸含量降低可能是由于乳酸菌降解生成乳酸、乙酸和双乙酰等产物[36];乳酸含量上升,成为发酵苹果汁中的主要有机酸。发酵8 h,柠檬酸含量在整个发酵过程中最高,58.3 W/L和93.6 W/L超声组的柠檬酸质量浓度分别为(1 438.76±28.57)mg/L和(2 020.84±147.52)mg/L,比未超声组高155.87%和259.39%(P<0.05),这可能是因为超声过程中导致果汁中溶氧增多,从而促进了植物乳杆菌的有氧呼吸[37]。
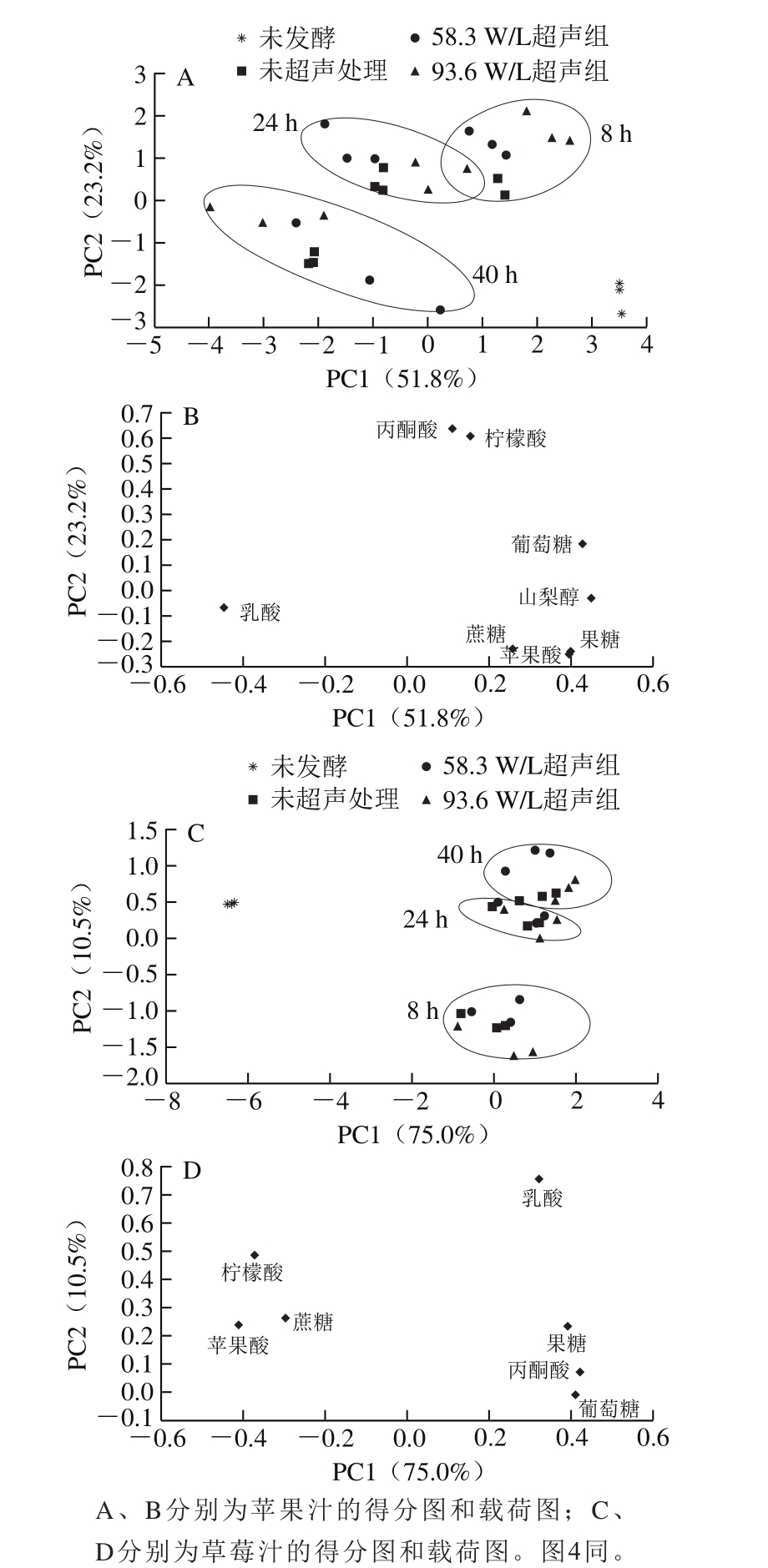
图2 植物乳杆菌发酵苹果汁和草莓汁过程中糖和有机酸PCA
Fig. 2 Principal component analysis of sugars and organic acids in apple juice and strawberry juice during fermentation by L. plantarum
表2 植物乳杆菌发酵草莓汁过程中糖和有机酸含量变化
Table 2 Changes in sugar and organic acid contents in strawberry juice during fermentation by L. plantarum
时间/h 组别 乳酸/(mg/L)蔗糖/(g/L)0 0.00±0.00A 4 949.641±0.00A 230.8±20.55A 24.42±2.66A 44.18±0.00A 11.10±0.04A 9.65±0.06A柠檬酸/(mg/L)苹果酸/(mg/L)丙酮酸/(mg/L)葡萄糖/(g/L)果糖/(g/L)8未超声 733.89±43.63Ba3 725.518±99.86Ca11.76±1.52Ba 61.75±3.66Ba 51.71±1.03Ba 11.99±0.32Ba 9.38±0.18Ba 58.3 W/L 763.28±44.25Ba3 736.371±125.80Ba11.34±1.78Ca 64.06±3.11Ba 52.90±1.52Ba 12.11±0.38Ba 9.43±0.07Ca 93.6 W/L 752.86±21.76Ba3 743.23±117.09Ca10.83±1.89Ca 61.12±5.55Ba 51.70±2.38Ba 12.00±0.38Ba 9.18±0.24Ba 24未超声 2 045.43±135.16Ca3 970.33±176.28Ba12.97±0.62Ba 66.00±1.71BCa 52.45±1.03Ba 12.21±0.28Ba 9.30±0.03Bb 58.3 W/L 1 987.88±132.65Ca3 952.16±191.74Ba12.53±0.69Ca 65.90±3.21Ba 53.55±0.86Ba 12.33±0.29Ba 9.35±0.02Da 93.6 W/L 2 047.70±44.97Ca3 963.91±174.47Ba12.05±1.00Ca 66.58±1.82BCa 53.54±1.33Ba 12.32±0.31BCa 9.24±0.03Bc 40未超声 2 458.60±68.10Da3 915.31±47.62BCa13.17±0.27Ba 70.33±1.05Ca 52.98±1.33Ba 12.25±0.27Ba 9.28±0.07Bb 58.3 W/L 2 492.01±118.89Da3 912.60±40.85Ba 16.74±3.37Ba 71.64±3.11Ca 53.37±2.07Ba 12.43±0.29Bab 9.55±0.00Ba 93.6 W/L 2 533.46±39.54Da3 898.66±49.75BCa16.04±2.97Ba 71.08±2.86Ca 52.89±1.85Ba 12.76±0.04Cb 9.15±0.06Bc
表2为草莓汁发酵过程中糖和有机酸组分变化,PCA见图2C、D。发酵24 h与发酵40 h的样品在图2C中很靠近,说明两个时间样品糖和有机酸组分接近,因此,植物乳杆菌发酵对草莓汁中糖和有机酸含量的影响主要是在前24 h。这可能也是由于草莓汁初始较低的pH值环境限制了植物乳杆菌的生长。草莓汁发酵结束时,与未发酵草莓汁相比,主要表现在PC1值增大,而在载荷图2D中显示柠檬酸、苹果酸、蔗糖PC1值为负值,表明这3 种成分含量下降,而乳酸、丙酮酸、葡萄糖、果糖PC1值为正值,其对应含量增加。蔗糖含量下降说明植物乳杆菌能够产生蔗糖水解酶等分解利用蔗糖,一部分为微生物生长代谢提供能量,另一部分积累使得葡萄糖、果糖含量增加[33]。另外植物乳杆菌在pH值较低的草莓汁中发酵时,可能优先利用柠檬酸和苹果酸作为碳源[38]。发酵至40 h,93.6 W/L超声处理的蔗糖质量浓度(9.15±0.06)g/L显著低于未超声处理(9.28±0.07)g/L,而且9 3.6 W/L超声处理草莓汁的果糖质量浓度(12.76±0.04)g/L也显著高于未超声组(12.25±0.27)g/L,说明超声促进了蔗糖的分解。
2.3 超声对发酵过程中酚类物质代谢的影响
2.3.1 对总酚含量的影响
由图3A可知,苹果汁发酵前的总酚质量浓度为(1 531.33±2.36)mg/L,未超声处理组发酵8 h后,总酚含量增加了0.87%,发酵8~40 h期间,总酚含量下降,发酵结束后,总酚质量浓度为(1 519.67±2.36)mg/L。由图3B可知,草莓汁的总酚含量持续升高。在0~8 h,未超声处理组总酚质量浓度由(1 314.67±2.36)mg/L增加至(1 374.67±21.21)mg/L,在8~40 h,总酚含量仍有小幅增加,但是增速大大减缓,这可能是因为一些不溶性的酚类物质经乳酸菌的水解作用在前8 h大量释放出来,所以总酚含量大幅提升,而在8 h后植物乳杆菌生长减缓,代谢也减弱,所以总酚含量变化较小[39]。苹果汁与草莓汁中总酚含量的变化趋势不同,说明发酵对酚类化合物的影响与发酵原料有关,这可能是不同果汁体系中酚类物质存在形式不同所致。在现有乳酸发酵果蔬研究中,总酚含量的变化趋势也不尽相同,Ricci[40]、Kwaw等[41]分别发酵接骨木汁和桑葚汁,发现总酚含量上升。而Hashemi[42]、Ankolekar[43]等分别发酵青柠和苹果后发现总酚含量下降。总酚含量增加可能是发酵前的一些可溶性结合酚的羟基部分与长链醇等物质结合,不能被测定,而植物乳杆菌能够产生某些水解酶,将一些结构复杂的植物化学成分水解为小分子,比如将糖基化酚类物质脱糖,从植物细胞壁中释放出可溶性或不可溶性的结合性酚类化合物[41]。总酚含量下降则可能是因为乳酸菌可产生酚酸脱羧酶等将一些酚类物质转化成乙烯基儿茶酚、乙烯基苯酚和乙烯基愈创木酚,进一步还原得到对应的乙基衍生物等挥发性酚[44]。在苹果汁发酵至24 h和40 h时,58.3 W/L超声处理组总酚含量显著低于未超声组。在草莓汁发酵过程中,两个不同强度的超声处理下总酚含量的变化与未超声组无明显差异,这说明在不同发酵体系中超声对酚类物质代谢的影响也是不同的。
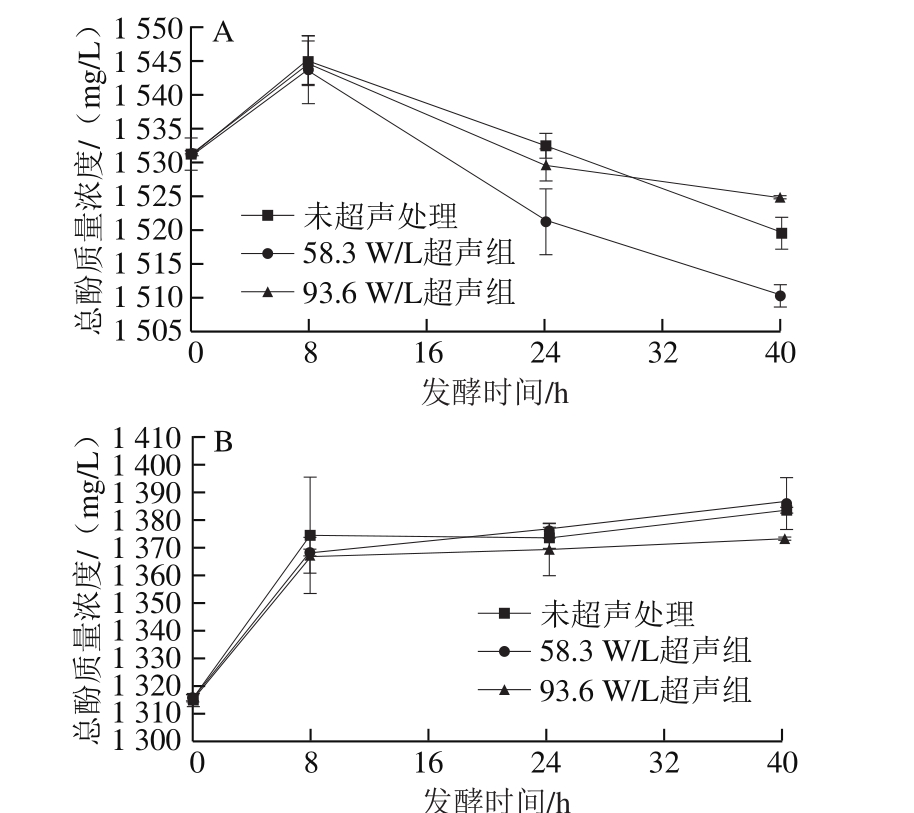
图3 超声对植物乳杆菌发酵苹果汁(A)和草莓汁(B)过程中总酚含量的影响
Fig. 3 Effect of ultrasound on total phenol content in apple juice (A)and strawberry juice (B) during fermentation by L. plantarum
2.3.2 对单体酚代谢的影响
表3 植物乳杆菌发酵苹果汁过程中酚类物质含量变化
Table 3 Changes in phenolic contents in apple juice during fermentation by L. plantarum
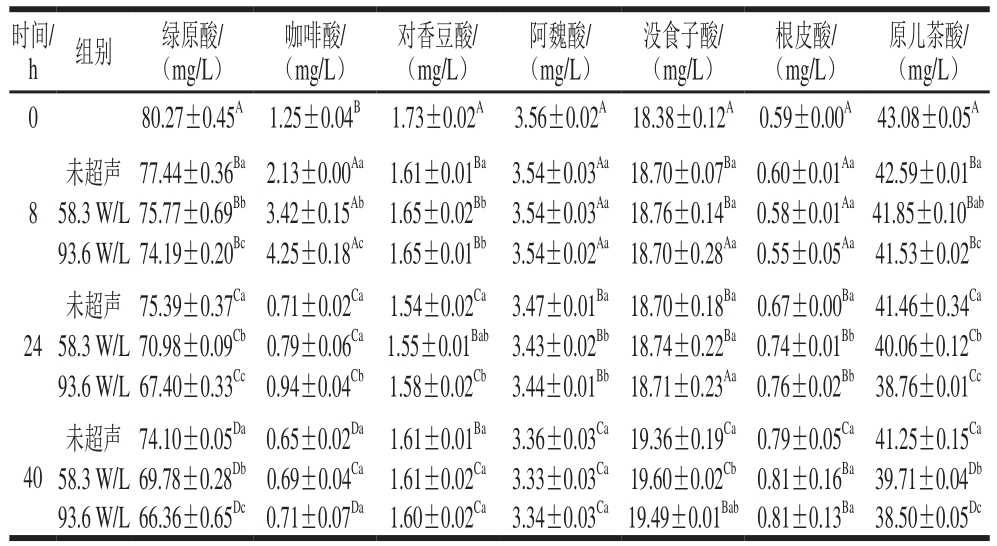
时间/h 组别 绿原酸/(mg/L)咖啡酸/(mg/L)对香豆酸/(mg/L)阿魏酸/(mg/L)没食子酸/(mg/L)根皮酸/(mg/L)原儿茶酸/(mg/L)0 80.27±0.45A 1.25±0.04B 1.73±0.02A 3.56±0.02A 18.38±0.12A 0.59±0.00A 43.08±0.05A 8未超声 77.44±0.36Ba2.13±0.00Aa 1.61±0.01Ba 3.54±0.03Aa18.70±0.07Ba0.60±0.01Aa42.59±0.01Ba 58.3 W/L 75.77±0.69Bb3.42±0.15Ab 1.65±0.02Bb 3.54±0.03Aa18.76±0.14Ba0.58±0.01Aa41.85±0.10Bab 93.6 W/L 74.19±0.20Bc4.25±0.18Ac 1.65±0.01Bb 3.54±0.02Aa18.70±0.28Aa0.55±0.05Aa41.53±0.02Bc 24未超声 75.39±0.37Ca0.71±0.02Ca 1.54±0.02Ca 3.47±0.01Ba18.70±0.18Ba0.67±0.00Ba41.46±0.34Ca 58.3 W/L 70.98±0.09Cb0.79±0.06Ca 1.55±0.01Bab 3.43±0.02Bb18.74±0.22Ba0.74±0.01Bb40.06±0.12Cb 93.6 W/L 67.40±0.33Cc0.94±0.04Cb 1.58±0.02Cb 3.44±0.01Bb18.71±0.23Aa0.76±0.02Bb38.76±0.01Cc 40未超声 74.10±0.05Da0.65±0.02Da 1.61±0.01Ba 3.36±0.03Ca19.36±0.19Ca0.79±0.05Ca41.25±0.15Ca 58.3 W/L 69.78±0.28Db0.69±0.04Ca 1.61±0.02Ca 3.33±0.03Ca19.60±0.02Cb0.81±0.16Ba39.71±0.04Db 93.6 W/L 66.36±0.65Dc0.71±0.07Da 1.60±0.02Ca 3.34±0.03Ca19.49±0.01Bab0.81±0.13Ba38.50±0.05Dc

图4 植物乳杆菌发酵苹果汁和草莓汁过程中酚类物质PCA
Fig. 4 Principal component analysis of phenolic substances in apple and strawberry juices fermented by L. plantarum
苹果汁发酵过程中酚类物质含量变化如表3所示,经过PCA得到图4A、B。图4A中,苹果汁发酵样本的PC1值随发酵时间延长而逐渐减小,其中,未发酵的样品和发酵8 h后的样品分布于PC1的正区间,发酵24 h和40 h的样品分布于PC1的负区间。而在载荷图(图4B)中对香豆酸、绿原酸、咖啡酸、原儿茶酸和阿魏酸对应的PC1值为正值,说明这几种酚类物质含量在发酵后均降低。以未超声样品为例,发酵前对香豆酸、绿原酸、咖啡酸、原儿茶酸和阿魏酸质量浓度分别为(1.73±0.02)、(80.27±0.45)、(1.25±0.04)、(43.08±0.05)mg/L和(3.56±0.02)mg/L,发酵结束后分别降低了6.94%、7.69%、48%、4.25%和5.62%。与之相反,没食子酸、根皮酸在载荷图中对应的PC1值为负值,经发酵后含量增加。以未超声样品为例,发酵前没食子酸和根皮酸质量浓度分别为(18.38±0.12)mg/L和(0.59±0.00)mg/L,发酵结束后分别增加了5.33%和33.90%。咖啡酸含量在发酵过程中先增加后减小,在8 h含量最高,为(2.13±0.00)mg/L。己有文献报道[45-46],一些乳酸菌能将绿原酸分解代谢生成咖啡酸,因此发酵前期咖啡酸含量的增加与绿原酸在植物乳杆菌产生的酯酶作用下降解为咖啡酸和奎尼酸有关,其后的下降可能是因为咖啡酸又在酚酸脱羧酶和还原酶等作用下转化生成乙烯基儿茶酚、乙基儿茶酚和二氢咖啡酸等衍生物,这与Markkinen等[38]研究结果相似。与咖啡酸类似,对香豆酸和阿魏酸也可作为乳酸菌的一种外部电子受体在酚酸脱羧酶和还原酶的作用下发生转化从而产生系列衍生物,如对香豆酸被还原转化为根皮酸[44],本研究中根皮酸含量的增加进一步佐证了植物乳杆菌具有将对香豆酸还原生成根皮酸的能力。没食子酸含量上升可能与一些酯型的没食子酸衍生物的水解释放有关,己有研究报道乳酸菌在发酵过程中具有移除糖基、水解没食子酸酰基等作用[14]。这些乳酸菌对酚类物质的分解代谢产物,相较于其母体酚类物质而言,能够发挥出与人类健康更加相关的生物活性,Silva等[47]报道二氢咖啡酸是一种比咖啡酸更有效的抗氧化剂。
由图4A也可以看出,在不同的时间段,未超声组与超声组在酚类组分方面存在一定差异。在发酵8 h,58.3 W/L超声组和93.6 W/L超声组在PC2的分值均高于未超声样品,而在图4B中对香豆酸和没食子酸在PC2上的载荷较大,且为正值,其酚类差异主要存在于对香豆酸和没食子酸,结合表3可知,超声组对香豆酸显著高于未超声处理,没食子酸含量也高于未超声处理,但差异不显著。另外,由表3可知,58.3 W/L和93.6 W/L的咖啡酸质量浓度分别为(3.42±0.15)、(4.25±0.18)mg/L,分别比未超声组高60.56%和99.53%。之后,超声组与未超声组的差异主要表现在PC1,发酵至24 h,93.6 W/L超声组咖啡酸和对香豆酸仍然显著高于未超声处理组,而阿魏酸与之相反,93.6 W/L超声组根皮酸质量浓度为(0.76±0.02)mg/L,比未超声组高13.43%(P<0.05)。在发酵40 h内,超声处理的绿原酸和原儿茶酸含量始终显著低于未超声组。而且在40 h,93.6 W/L超声处理的绿原酸含量比未超声组低10.44%(P<0.05)。由图4C可以看出,发酵过程中的草莓汁样本主要分布在3 个不同的区域。发酵8 h后的草莓汁样本与未发酵样品比较,PC1值减小,而在图4D中绿原酸、咖啡酸和对香豆酸在PC1上的载荷较大,且为正值,所以绿原酸、咖啡酸和对香豆酸含量减少,相反对羟基苯甲酸和没食子酸含量增加。发酵24 h样品和发酵8 h样品相比,样品PC2值增大,而绿原酸、对香豆酸、对羟基苯甲酸和没食子酸的PC2在图4D中为负值,说明含量降低,而咖啡酸PC2为正值,含量升高。发酵40 h与发酵24 h样品在得分图中很靠近,说明2 个时间样品酚类组分相似。儿茶素在图4D中靠近原点,说明此变量对PC1和PC2影响较小,由表4可知,儿茶素含量在发酵过程中先增加后减小。草莓汁发酵至8 h和24 h,93.6 W/L超声处理组的对香豆酸含量均显著低于未超声组。结合苹果汁和草莓汁中酚类物质的变化看,超声在发酵前期可提高分解咖啡酰酚类物质的水解酶活性,从而使绿原酸含量更低,而咖啡酸含量更高;而在发酵后期超声可提高酚酸还原酶的活性,从而促进对香豆酸、阿魏酸的转化,这一现象可在后续研究中通过测定转化途径中关键酶,以及利用转录组学和蛋白组学手段进一步研究验证。
表4 植物乳杆菌发酵草莓汁过程中酚类物质含量变化
Table 4 Changes in phenolic contents in strawberry juice during fermentation by L. plantarum
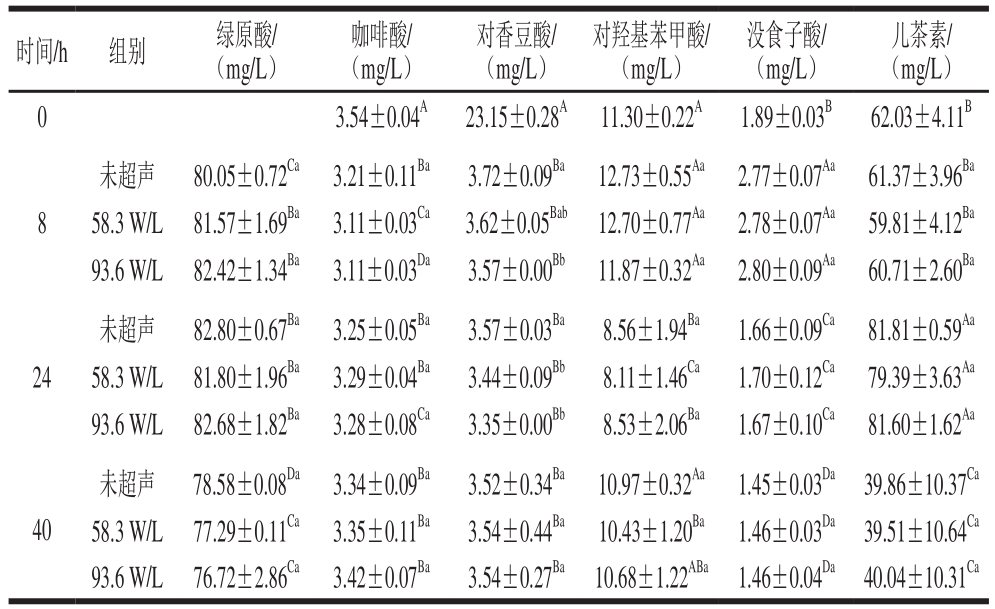
时间/h 组别 绿原酸/(mg/L)咖啡酸/(mg/L)对香豆酸/(mg/L)对羟基苯甲酸/(mg/L)没食子酸/(mg/L)儿茶素/(mg/L)0 3.54±0.04A 23.15±0.28A 11.30±0.22A 1.89±0.03B 62.03±4.11B 8未超声 80.05±0.72Ca 3.21±0.11Ba 3.72±0.09Ba 12.73±0.55Aa 2.77±0.07Aa 61.37±3.96Ba 58.3 W/L 81.57±1.69Ba 3.11±0.03Ca 3.62±0.05Bab 12.70±0.77Aa 2.78±0.07Aa 59.81±4.12Ba 93.6 W/L 82.42±1.34Ba 3.11±0.03Da 3.57±0.00Bb 11.87±0.32Aa 2.80±0.09Aa 60.71±2.60Ba 24未超声 82.80±0.67Ba 3.25±0.05Ba 3.57±0.03Ba 8.56±1.94Ba 1.66±0.09Ca 81.81±0.59Aa 58.3 W/L 81.80±1.96Ba 3.29±0.04Ba 3.44±0.09Bb 8.11±1.46Ca 1.70±0.12Ca 79.39±3.63Aa 93.6 W/L 82.68±1.82Ba 3.28±0.08Ca 3.35±0.00Bb 8.53±2.06Ba 1.67±0.10Ca 81.60±1.62Aa 40未超声 78.58±0.08Da 3.34±0.09Ba 3.52±0.34Ba 10.97±0.32Aa 1.45±0.03Da 39.86±10.37Ca 58.3 W/L 77.29±0.11Ca 3.35±0.11Ba 3.54±0.44Ba 10.43±1.20Ba 1.46±0.03Da 39.51±10.64Ca 93.6 W/L 76.72±2.86Ca 3.42±0.07Ba 3.54±0.27Ba 10.68±1.22ABa 1.46±0.04Da 40.04±10.31Ca
2.4 超声对果汁发酵液抗氧化活性的影响
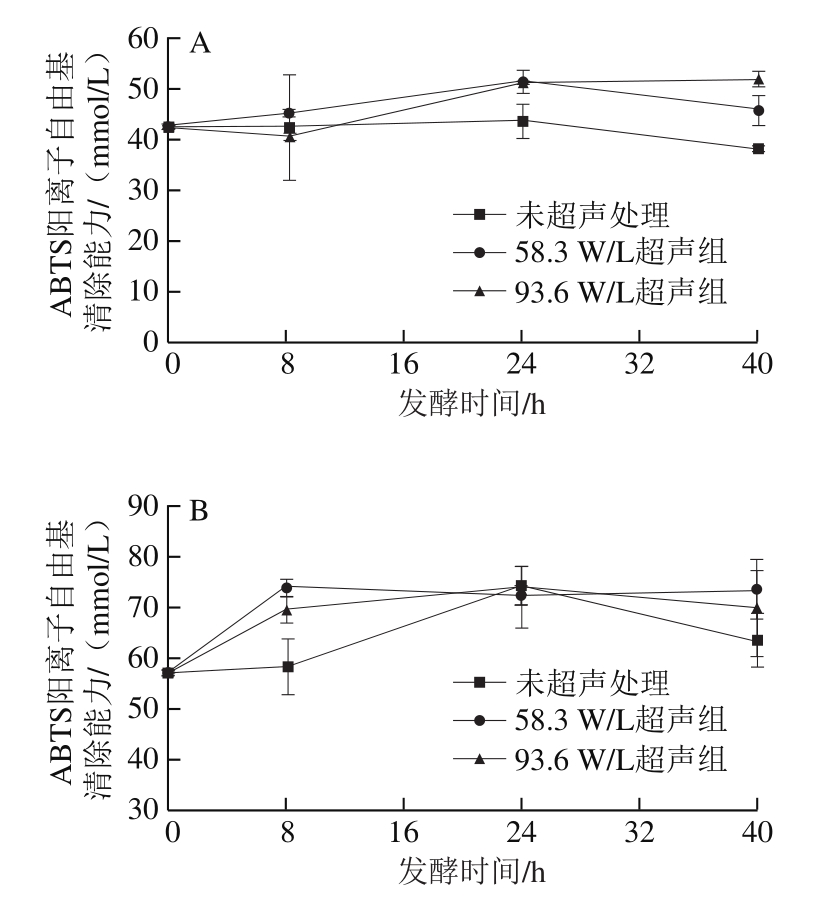
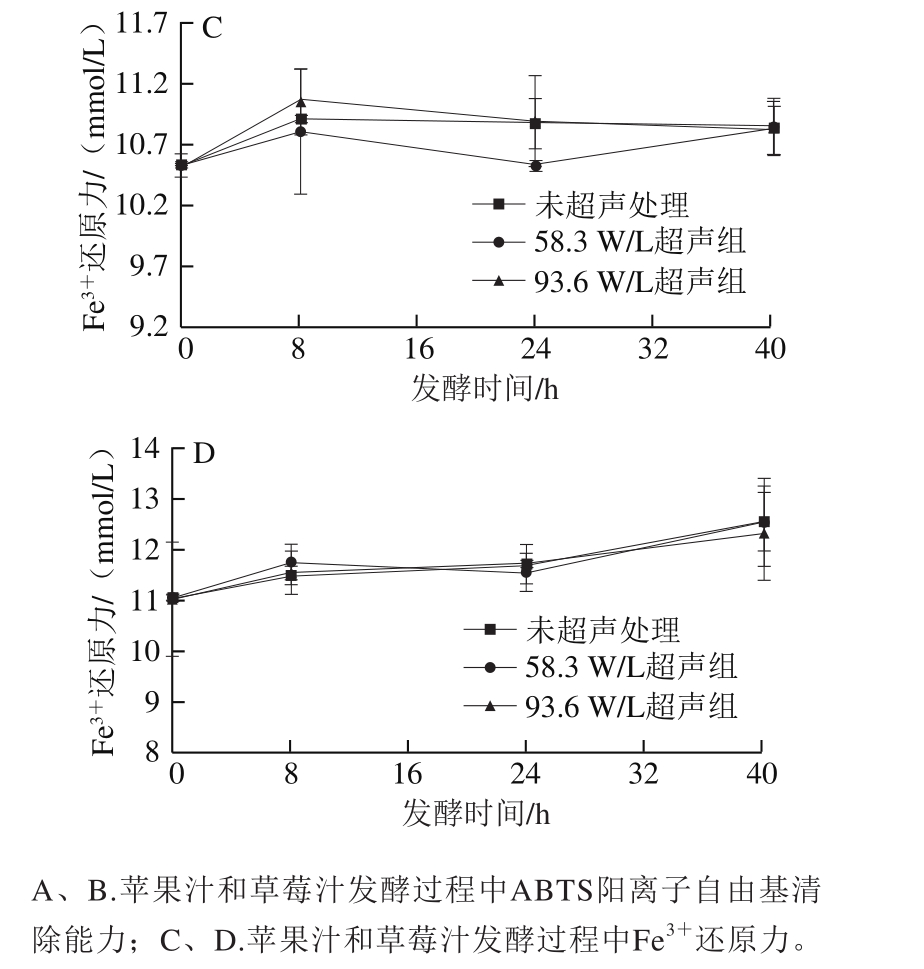
图5 超声辅助发酵过程中抗氧化活性变化
Fig. 5 Changes in antioxidant activity of apple and strawberry juices during ultrasound-assisted fermentation
由图5A可知,93.6 W/L超声组植物乳杆菌发酵的苹果汁在发酵24 h后ABTS阳离子自由基清除能力显著提高。直至40 h,其抗氧化活性达到最高,为(52.17±1.59)mmol/L,分别比58.3 W/L超声组和未超声组高13.14%和36.21%(P<0.05)。58.3 W/L超声组苹果汁在发酵过程中其清除ABTS阳离子自由基能力先增加后下降,在24 h抗氧化活性最高,为(51.76±2.18)mmol/L,与93.6 W/L超声处理组((51.31±0.28)mmol/L)无显著差异,但是显著高于未超声组((43.92±3.46)mmol/L)。未超声组的ABTS阳离子自由基清除能力在发酵过程中无明显变化。如图5B所示,植物乳杆菌发酵草莓汁过程中,ABTS阳离子自由基清除能力在发酵过程中均为先增大后减小。58.3 W/L超声组经发酵8 h后,对ABTS阳离子自由基的清除能力显著提高,达到(73.55±1.69)mmol/L,显著高于未超声组((58.31±5.40)mmol/L),但与93.6 W/L超声组((69.45±2.47)mmol/L)无显著差异。93.6 W/L超声组和未超声组草莓汁清除ABTS阳离子自由基能力均在发酵24 h达到最大值,分别为(73.59±0.99)、(74.01±3.67)mmol/L。以上结果表明,超声辅助发酵的苹果汁和草莓汁的抗氧化活性均有一定的提升。与Kwaw等[41]采用L. plantarum、L. paracasei和L. acidophilus三种乳酸菌发酵桑葚汁后,抗氧化活性提高的研究结果类似。Hur等[48]认为利用发酵提高植物性食品的抗氧化活性可能受到微生物种类、pH值、温度、溶剂、含水量、发酵时间、食品种类和有氧条件等多种因素的影响。本研究中苹果汁和草莓汁对ABTS阳离子自由基的清除能力与总酚含量变化不相关,这可能是因为抗氧化活性还受到酚类物质的组分以及其他抗氧化物质的影响。此外苹果汁中绿原酸含量和原儿茶酸含量与ABTS阳离子自由基清除能力呈显著负相关,这说明绿原酸和原儿茶酸分解转化后可生成一些对ABTS阳离子自由基清除能力更强的物质,其具体机制有待进一步研究。此外很多乳酸菌具有酶促和非酶氧化机制,本身也具有一定的抗氧化活性。超声处理促进了发酵苹果汁和草莓汁ABTS阳离子自由基清除能力的提高,一方面可能是因为超声过程中产生自由基[49],诱导乳酸菌产生一些保护自己免受氧化损伤的酶促抗氧化剂和非酶抗氧化剂;另一方面超声可能促进了酚类物质转化相关酶的活性,产生更多强抗氧化活性衍生物,从而提高整个发酵体系的抗氧化活性。由图5C、D可知,苹果汁和草莓汁经植物乳杆菌发酵后,其Fe3+还原力无明显变化(P>0.05)。测定ABTS阳离子自由基清除能力是通过在特定条件下,样品对检测体系中自由基的清除能力以反映被测物的抗氧化活性;Fe3+还原力测定法是在特定条件下,测定样品的还原能力以反映被测物的抗氧化活性。两种方法基于不同的机制,可能会得到不同的结果[50]。
3 结 论
本研究发现在不同的水果汁基质中,植物乳杆菌的生长代谢有所不同。相比于草莓汁,植物乳杆菌更适宜于在经过调整的苹果汁中生长。超声处理在苹果汁和草莓汁的发酵过程中对植物乳杆菌的生长有一定的促进作用。发酵至32 h,58.3 W/L超声处理的苹果汁中植物乳杆菌数量比未超声组高0.15(lg(CFU/mL))(P<0.05)。在草莓汁发酵过程中,58.3 W/L和93.6 W/L超声处理延长了植物乳杆菌的对数期,且40 h后菌落数分别比未超声组高0.39、0.21(lg(CFU/mL))(P<0.05)。超声促进了植物乳杆菌对葡萄糖的利用,苹果汁发酵24 h,93.6 W/L超声组葡萄糖含量显著低于未超声组,因此作为糖酵解的产物,超声组丙酮酸含量也显著高于未超声组。超声促进蔗糖的分解,草莓汁发酵24 h后,93.6 W/L超声组蔗糖含量显著低于未超声组,发酵40 h后,超声组果糖含量更高。此外,苹果汁中柠檬酸含量先增加后减小,58.3 W/L和93.6 W/L超声处理的柠檬酸含量在发酵8 h分别比未超声组高155.87%和259.39%(P<0.05),超声对柠檬酸代谢的影响机制有待进一步研究。在苹果汁发酵中,超声影响了多种酚类物质的变化,主要促进了苹果汁中绿原酸水解转化为咖啡酸。超声组的绿原酸含量一直低于未超声组(P<0.05),40 h后58.3 W/L和93.6 W/L超声处理组分别比未超声组低5.82%和10.44%,而且发酵后8~24 h超声组咖啡酸含量高于未超声组(P<0.05),发酵8 h后,58.3 W/L和93.6 W/L超声处理分别比未超声组高60.56%和99.53%。与未超声相比,超声处理在苹果汁发酵后期和草莓汁发酵前期提高了ABTS阳离子自由基清除能力。
综上所述,超声波可促进植物乳杆菌的增长、苹果汁中绿原酸的水解、糖的分解利用以及苹果汁发酵前期柠檬酸的合成,而且提高了两种发酵果汁的ABTS阳离子自由基清除能力。该结果可为超声辅助植物乳杆菌发酵果蔬汁的应用提供理论依据。除超声强度外,其他超声条件对乳酸发酵中菌体生长、基本代谢、酚类物质转化的影响需要进一步研究,以便更好地将超声应用到发酵果蔬汁的生产中。
[1] ANKOLEKAR C, JOHNSON K, PRINTOM, et al. Fermentation of whole apple juice using Lactobacillus acidophilus for potential dietary management of hyperglycemia, hypertension, and modulation of beneficial bacterial responses[J]. Journal of Food Biochemistry, 2012,36(6): 718-738. DOI:10.1111/j.1745-4514.2011.00596.x.
[2] BETORET E, BETORET N, ARILLA A, et al. No invasive methodology to produce a probiotic low humid apple snack with potential effect against Helicobacter pylori[J]. Journal of Food Engineering, 2012, 110(2): 289-293. DOI:10.1016/j.jfoodeng.2011.04.027.
[3] DIMITROVSKI D, VELICKOVA E, LANGERHOLC T, et al. Apple juice as a medium for fermentation by the probiotic Lactobacillus plantarum PCS 26 strain[J]. Annals of Microbiology, 2015, 65(4):2161-2170. DOI:10.1007/s13213-015-1056-7.
[4] BOYER J, LIU R H. Apple phytochemicals and their health benefits[J]. Nutrition Journal, 2004, 3(1): 5.
[5] 郭春宝, 张万忠, 吕秋兰, 等. 乳酸发酵草莓汁的研制[J]. 食品科学,2001, 22(9): 52-55. DOI:10.3321/j.issn:1002-6630.2001.09.014.
[6] SON S H, JEON H L, JEON E B, et al. Potential probiotic Lactobacillus plantarum Ln4 from kimchi: evaluation of β-galactosidase and antioxidant activities[J]. LWT-Food Science and Technology, 2017, 85: 181-186. DOI:10.1016/j.lwt.2017.07.018.
[7] WANG S Y, LI S Y, ZHAO H M, et al. Acetaldehyde released by Lactobacillus plantarum enhances accumulation of pyranoanthocyanins in wine during malolactic fermentation[J].Food Research International, 2018, 108: 254-263. DOI:10.1016/j.foodres.2018.03.032.
[8] RODRIGUEZ H, CURIEL J A, IRANZO J M, et al. Food phenolics and lactic acid bacteria[J]. International Journal of Food Microbiology,2009, 132(2/3): 79-90. DOI:10.1016/j.ijfoodmicro.2009.03.025.
[9] VAQUERO I, MARCOBAL A, MUNOZ R. Tannase activity by lactic acid bacteria isolated from grape must and wine[J]. International Journal of Food Microbiology, 2004, 96(2): 199-204. DOI:10.1016/j.ijfoodmicro.2004.04.004.
[10] SCALBERT A, MANACH C, MORAND C, et al. Dietary polyphenols and the prevention of diseases[J]. Food Science and Nutrition, 2005,45: 287-306. DOI:10.1080/1040869059096.
[11] AXELLE S-M, REMIZE F, POUCHERET P. Fruits and vegetables,as a source of nutritional compounds and phytochemicals: changes in bioactive compounds during lactic fermentation[J]. Food Research International, 2018, 104: 86-99. DOI:10.1016/j.foodres.2017.09.031.
[12] CURIEL J A, PINTO D, MARZANI B, et al. Lactic acid fermentation as a tool to enhance the antioxidant properties of Myrtus communis berries[J]. Microbial Cell Factories, 2015, 14: 1-10. DOI:10.1186/s12934-015-0250-4.
[13] FILANNINO P, CAVOSKI I, THLIGENE N, et al. Lactic acid fermentation of cactus cladodes (Opuntia ficus-indica L.) generates flavonoid derivatives with antioxidant and anti-inflammatory properties[J]. PLoS ONE, 2016, 11(3): e0152575. DOI:10.1371/journal.pone.0152575.
[14] ZHAO D Y, SHAH N P. Lactic acid bacterial fermentation modified phenolic composition in tea extracts and enhanced their antioxidant activity and cellular uptake of phenolic compounds following in vitro digestion[J]. Journal of Functional Foods, 2016, 20: 182-194.DOI:10.1016/j.jff.2015.10.033.
[15] CAPPELLO M S, ZAPPAROLI G, LOGRIECO A, et al. Linking wine lactic acid bacteria diversity with wine aroma and flavour[J].International Journal of Food Microbiology, 2016, 243: 16-27.DOI:10.1016/j.ijfoodmicro.2016.11.025.
[16] OKCU G, AYHAN K, ALTUNTAS E G, et al. Determination of phenolic acid decarboxylase produced by lactic acid bacteria isolated from shalgam (şalgam) juice using green analytical chemistry method[J]. LWT-Food Science and Technology, 2016, 66: 615-621.DOI:10.1016/j.lwt.2015.10.072.
[17] BAEZA G, BACHMAIR E M, WOOD S, et al. The colonic metabolites dihydrocaffeic acid and dihydroferulic acid are more effective inhibitors of in vitro platelet activation than their phenolic precursors[J]. Food & Function, 2017, 8(3): 1333-1342. DOI:10.1039/c6fo01404f.
[18] 罗娟. 超声波对枯草芽孢杆菌液态发酵豆粕及其产物功能特性的影响[D]. 镇江: 江苏大学, 2016: 83-84.
[19] OJHAK S, KERRY J P, ALVAREZ C, et al. Effect of high intensity ultrasound on the fermentation profile of Lactobacillus sakei in a meat model system[J]. Ultrasonics Sonochemistry, 2016, 31: 539-545.DOI:10.1016/j.ultsonch.2016.01.001.
[20] HUANG G P, CHEN S W, TANG Y X, et al. Stimulation of low intensity ultrasound on fermentation of skim milk medium for yield of yoghurt peptides by Lactobacillus paracasei[J]. Ultrasonics Sonochemistry, 2019,51: 315-324. DOI:10.1016/j.ultsonch.2018.09.033.
[21] YEO S K, LIONG M T. Effect of ultrasound on bioconversion of isoflavones and probiotic properties of parent organisms and subsequent passages of Lactobacillus[J]. LWT-Food Science and Technology, 2013, 51(1): 289-295. DOI:10.1016/j.lwt.2012.09.026.
[22] LIAO H M, JIANG L F, CHENG Y L, et al. Application of nisinassisted thermosonication processing for preservation and quality retention of fresh apple juice[J]. Ultrasonics Sonochemistry, 2017(42):244-249. DOI:10.1016/j.ultsonch.2017.11.020.
[23] 陈玮, 黄蓓蓓. 草莓果醋生产工艺研究[J]. 中国酿造, 2008, 27(13):93-96. DOI:10.3969/j.issn.0254-5071.2008.07.030.
[24] VERVOORT L, VAN DER PLANCKEN I, GRAUWET T, et al.Comparing equivalent thermal, high pressure and pulsed electric field processes for mild pasteurization of orange juice: part II: impact on specific chemical and biochemical quality parameters[J]. Innovative Food Science & Emerging Technologies, 2011, 12(4): 466-477.DOI:10.1016/j.ifset.2011.06.003.
[25] LIMA M D S, SILANII I D S V, TOALDO I M, et al. Phenolic compounds, organic acids and antioxidant activity of grape juices produced from new Brazilian varieties planted in the Northeast Region of Brazil[J]. Food Chemistry, 2014, 161(6): 94-103. DOI:10.1016/j.foodchem.2014.03.109.
[26] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology & Viticulture, 1965, 16(3): 144-158.
[27] ZHANG W, HAN F, HE J, et al. HPLC-DAD-ESI-MS/MS Analysis and antioxidant activities of nonanthocyanin phenolics in mulberry(Morus alba L.)[J]. Journal of Food Science, 2008, 73(6): C512-C518.DOI:10.1111/j.1750-3841.2008.00854.x.
[28] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology Medicine, 1999, 26(9/10): 1231-1237.DOI:10.1016/S0891-5849(98)00315-3.
[29] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant power”: the FRAP assay[J].Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[30] 肖仔君, 钟瑞敏, 陈惠音, 等. 植物乳杆菌的生理功能与应用[J]. 中国食品添加剂, 2005(2): 87-89. DOI:10.3969/j.issn.1006-2513.2005.02.023.
[31] DAHROUD B D, MOKARRAM R R, KHIABANI M S, et al.Low intensity ultrasound increases the fermentation efficiency of Lactobacillus casei subsp. casei ATTC 39392[J]. International Journal of Biological Macromolecules, 2016, 86: 462-467. DOI:10.1016/j.ijbiomac.2016.01.103.
[32] HUANG G P, CHEN S W, DAI C H, et al. Effects of ultrasound on microbial growth and enzyme activity[J]. Ultrasonics Sonochemistry,2017, 37: 144-147. DOI:10.1016/j.ultsonch.2016.12.018.
[33] WANG Y C, TAO Y, ZHANG X Y, et al. Metabolic profile of ginkgo kernel juice fermented with lactic aicd bacteria: a potential way to degrade ginkgolic acids and enrich terpene lactones and phenolics[J]. Process Biochemistry, 2019, 76: 25-33. DOI:10.1016/j.procbio.2018.11.006.
[34] OGURO Y, NISHIWAKI T, SHINADA R, et al. Metabolite profile of koji amazake and its lactic acid fermentation product by Lactobacillus sakei UONUMA[J]. Journal of Bioscience and Bioengineering, 2017,124(2): 178-183. DOI:10.1016/j.jbiosc.2017.03.011.
[35] ZOTTA T, PARENTE E, RICCIARDI A. Aerobic metabolism in the genus Lactobacillus: impact on stress response and potential applications in the food industry[J]. Journal of Applied Microbiology,2017, 122: 857-869. DOI:10.1111/jam.13399.
[36] 袁星星, 余元善, 徐玉娟. 柠檬酸的乳酸菌发酵降解途径及其应用[J]. 食品研究与开发, 2017, 38(10): 204-208. DOI:10.3969/j.issn.1005-6521.2017.10.046.
[37] 时兰春. 低强度超声波对啤酒酵母生物效应的实验研究[D]. 重庆:重庆大学, 2002. DOI:10.7666/d.y795894.
[38] MARKKINEN N, LAAKSONEN O, NAHKU R, et al. Impact of lactic acid fermentation on acids, sugars, and phenolic compounds in black chokeberry and sea buckthorn juices[J]. Food Chemistry, 2019,286: 204-215. DOI:10.1016/j.foodchem.2019.01.189.
[39] 赖婷, 刘磊, 张名位, 等. 不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J]. 中国农业科学, 2016, 49(10): 1979-1989.DOI:10.3864/j.issn.0578-1752.2016.10.013.
[40] RICCI A, CIRLINI M, CALANI L, et al. In vitro metabolism of elderberry juice polyphenols by lactic acid bacteria[J]. Food Chemistry,2019, 276: 692-699. DOI:10.1016/j.foodchem.2018.10.046.
[41] KWAW E, MA Y, TCHABO W, et al. Effect of lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J]. Food Chemistry, 2018, 250:148-154. DOI:10.1016/j.foodchem.2018.01.009.
[42] HASHEMI S M B, MOUSAVI KHANEGHAH A, BARBA F J, et al.Fermented sweet lemon juice (Citrus limetta) using Lactobacillus plantarum LS5: chemical composition, antioxidant and antibacterial activities[J]. Journal of Functional Foods, 2017, 38: 409-414.DOI:10.1016/j.jff.2017.09.040.
[43] ANKOLEKAR C, JOHNSON K, PINTO M, et al. Fermentation of whole apple juice using Lactobacillus acidophilus for potential dietary management of hyperglycemia hypertension, and modulation of beneficial bacterial responses[J]. Journal of Food Biochemistry, 2012,36: 718-738. DOI:10.1111/j.1745-4514.2011.00596.x.
[44] FILANNINO P, GOBBETT M, ANGELIS M D, et al.Hydroxycinnamic acids used as external acceptors of electrons:an energetic advantage for strictly heterofermentative lactic acid bacteria[J]. Applied and Environmental Microbiology, 2014, 80(24):7574-7582. DOI:10.1128/AEM.02413-14.
[45] FRITSCH C, HEINRICH V, VOGEL R F, et al. Phenolic acid degradation potential and growth behavior of lactic acid bacteria in sunflower substrates[J]. Food Microbiology, 2016, 57: 178-186.DOI:10.1016/j.fm.2016.03.003.
[46] FILANNINO P, BAI Y, CAGNO R D, et al. Metabolism of phenolic compounds by Lactobacillus spp. during fermentation of cherry juice and broccoli puree[J]. Food Microbiology, 2015, 46: 272-279.DOI:10.1016/j.fm.2014.08.018.
[47] SILVA F, BORGES F, GUIMARAES C, et al. Phenolic acids and derivatives: studies on the relationship among structure, radical scavenging activity, and physicochemical parameters[J]. Journal of Agricultural and Food Chemistry, 2000, 48(6): 2122-2126.DOI:10.1021/jf9913110.
[48] HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry, 2014,160: 346-356. DOI:10.1016/j.foodchem.2014.03.112.
[49] REHMAN M U, JAWAID P, UCHIYAMA H, et al. Comparison of free radicals formation induced by cold atmospheric plasma,ultrasound, and ionizing radiation[J]. Archives of Biochemistry and Biophysics, 2016, 605: 19-25. DOI:10.1016/j.abb.2016.04.005.
[50] 高月红, 郑建普, 朱春赟, 等. 抗氧化能力检测方法评估及微型化[J].中国药学杂志, 2008, 43(24): 1863-1867. DOI:10.3321/j.issn:1001-2494.2008.24.007.