黑糯米又称紫米,营养价值很高,含有人体所需的多种物质,具有补血养气、健脾、促进人体微循环等多种生理功能,被誉称为“黑珍珠”[1]。以黑糯米作为原料发酵酿制的酒晶莹透明,香气幽雅悦人,别具一番风味[2-3]。黑糯米酒富含蛋白质、低聚糖、多肽、氨基酸、维生素和矿物质等[4],具有一定的营养价值及保健功能。传统黑糯米酒的主要特点是乙醇体积分数低和糖分含量高。为了提供更多的选择,高度黑糯米酒的开发具有较大市场空间,其生产工艺与低度黑糯米酒不同之处是在后发酵开始阶段用高度基酒调配之后发酵而成。然而,后发酵过程是一个关键的步骤,它极大地改变了酒的化学成分,随后改变了酒的风味、香气和生物学特征[5]。
代谢组学是以生物样品中的低分子质量代谢产物(如有机酸、脂肪酸、氨基酸、糖等)为研究对象,通过高通量检测和数据处理,进行信息整合及生物标记物鉴定的科学[6]。作为系统生物学的重要组成部分,代谢组学能够检测出数十种甚至数百种内源性代谢物,己被广泛应用于食品研究中[7-10]。用于代谢组学的分析技术主要有1H-核磁共振、气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)和液相色谱-质谱等[11]。与其他方法相比,GC-MS成本较低,具有重复性好、分辨率高、基体效应小的优点[12],至今仍是代谢组学研究中的主要分析平台之一。如Jang等[13]对7 种商业醋和2 种传统醋的代谢物谱进行分析,研究表明基于气相色谱-飞行时间质谱(gas chromatography-time of flight-mass spectrometry,GC-TOF-MS)联用的代谢物分析有助于了解商业和传统醋的代谢物差异。Hao Ruijuan等[14]通过GC-TOF-MS技术分析不同生长速度的大珠贝母的代谢物变化,并探讨了它们不同生长的机制。Zeng Qi等[15]利用GC-TOF-MS技术对饮食摄入猕猴桃酒后的大鼠代谢指纹图谱进行研究,揭示猕猴桃酒可能对健康有积极的作用。
然而,目前关于黑糯米酒的报道主要集中在发酵过程中风味物质变化,对发酵过程中代谢产物的差异以及动态变化的研究较少,尤其是高度黑糯米酒。本研究采用GC-TOF-MS结合多元统计分析方法全面描述高度黑糯米酒在后发酵过程中代谢物的差异,有助于深入了解后发酵过程中风味形成的潜在机制,为高度黑糯米酒工业化发展提供理论依据。
1 材料与方法
1.1 材料与试剂
36°高度黑糯米酒取自贵州省惠水县永红酒厂;取样时间2018年9月13日—2019年2月13日,取样间隔时间1 个月,共6 次(1~6分别代表每次取样)。
甲醇(色谱纯) 美国CNW Technologies公司;氯仿、吡啶(均为色谱纯) 中国Adamas公司;甲氧铵盐(分析纯) 日本TCI公司;核糖醇(纯度≥99%)美国Sigma公司;双(三甲基硅基)三氟乙酰胺(1%三甲基氯硅烷) 美国REGIS Technologies公司;饱和脂肪酸甲酯 德国Dr. Ehrenstorfer公司。
1.2 仪器与设备
PEGASUS HT质谱仪 美国LECO公司;7890A气相色谱仪、DB-5MS色谱柱(30 m×250 μm,0.25 μm)美国Agilent公司;Heraeus Fresco17离心机、Forma 900 series超低温冰箱 美国Thermo Fisher Scientific公司;明澈D24 UV纯水仪 美国Merck Millipore公司;PS-60AL超声仪 深圳市雷德邦电子有限公司;DHG-9023A烘箱 上海一恒科学仪器有限公司;TNG-T98真空干燥仪 太仓市华美生化仪器厂。
1.3 方法
1.3.1 黑糯米酒发酵工艺流程
黑糯米→洗净→浸泡→清洗→沥干→蒸煮→淋饭冷却→加酒曲(0.5%),拌料→入缸糖化→主发酵→加水(料液比1∶4(g/mL))→加入基酒(1 kg酒糟∶30 kg基酒)→后发酵→压榨→澄清→灭菌→灌装→成品。
1.3.2 样品前处理
采集样品后发酵总时长6 个月。所有样品经无菌密封后放入-80 ℃超低温冰箱保存备用。
1.3.3 理化指标的测定
高度黑糯米酒后发酵过程中的pH值、总糖、还原糖、总酸、氨基酸态氮、非糖固形物检测均参照GB/T 13662—2018《黄酒》[16]测定。
1.3.4 代谢物提取
取100 μL样本于1.5 mL EP管中,加入300 μL提取液(甲醇),再加入5 μL核糖醇,涡旋30 s;超声10 min(冰水浴);将样本4 ℃、12 000 r/min离心15 min;移取30 μL上清液于1.5 mL EP管中,每个样本各取10 μL混合成QC样本;在真空浓缩器中干燥提取物;向干燥后的代谢物加入100 μL甲氧胺盐试剂(甲氧胺盐酸盐溶于吡啶20 mg/mL),轻轻混匀后,放入烘箱中80 ℃孵育30 min;向每个样品中加入100 μL双(三甲基硅基)三氟乙酰胺,将混合物70 ℃孵育1.5 h;冷却至室温,向混合的样本中加入5 μL饱和脂肪酸甲酯(溶于氯仿);随机顺序上机检测。
1.3.5 GC-MS分析
GC条件:DB-5MS毛细管柱(30 m×250 μm,0.25 μm);升温程序:50 ℃保持1 min,以10 ℃/min升至310 ℃,保持8 min;载气(He)流速1 mL/min,进样量1 μL;分流模式:不分流。
MS条件:电子电离源;电子能量-70 eV;进样口温度280 ℃;传输线温度280 ℃;离子源温度250 ℃;质量扫描范围m/z 50~500;扫描速率12.5 光谱/s;溶剂延迟时间6.27 min。
1.4 数据处理
使用ChromaTOF软件(V 4.3xLECO)对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析[17]。对物质定性工作中,使用了LECO-Fiehn Rtx5数据库,包括质谱匹配及保留时间指数匹配。最后将QC样本中检出率50%以下或相对标准偏差大于30%的峰去除[18]。将得到的数据(包括峰数值,样品名称和相对物质含量)输入SIMCA 14.1软件进行主成分分析(principal components analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discrimination analysis,OPLS-DA)。使用R2和Q2评估所构建的PCA和OPLS-DA模型的质量。通过OPLS-DA模型,选择变量重要性投影(variable importance for the projection,VIP)值大于1的代谢物作为候选差异代谢物。将候选差异代谢物的相对含量进行t检验,只有P值小于0.05的代谢物定义为差异代谢物。为进一步阐明差异代谢物的生物学意义,使用MetaboAnalyst(https://www.metaboanalyst.ca/)模块,将差异代谢物富集在代谢途径上,使用超几何分布法计算富集。
2 结果与分析
2.1 基本理化指标分析
表1 高度黑糯米酒后发酵阶段理化指标
Table 1 Physicochemical indicators of high black glutinous rice wine fermentation stage

注:同行不同字母表示差异显著(P<0.05)。*.发酵取样的1~6 个月,下同。
理化指标 发酵阶段*1 2 3 4 5 6总酸质量浓度/(g/L) 5.0±0.22a 5.1±0.12b 5.2±0.08b 5.4±0.14c 5.5±0.24cd 5.6±0.22d总糖质量浓度/(g/L) 86.9±0.88a 83.9±0.50b 68.13±0.5c 55.8±0.65d 51.47±0.54e44.63±0.68f pH 4.17±0.05a 4.22±0.04a 4.32±0.03ab 4.68±0.08c 4.74±0.07cd 4.82±0.07d氨基酸态氮质量浓度/(g/L) 0.46±0.03a 0.52±0.03b 0.57±0.02c 0.64±0.02d 0.68±0.02e 0.72±0.03f还原糖质量浓度/(g/L) 77.47±0.54a 71.6±0.65b 58.83±1.37c 49.7±1.06d 44.33±0.46e 40.27±0.95f非糖固形物质量浓度/(g/L)81.97±1.03b82.53±0.79a 62.20±1.22c 36.47±0.40d 15.63±0.79e 9.1±0.14f
由表1可知,总酸含量和pH值在后发酵过程中呈缓慢上升趋势。总酸在发酵过程中由微生物代谢产生,此外,污染杂菌也会使酸度增加。后发酵过程中由于乙醇的累积、大分子物质的分解及弱碱性(碱性氨基酸 、核苷酸、高级醇等)缓冲物质的大量增加,使pH值值缓慢升高[19]。总糖和还原糖含量在后发酵开始前2 个月变化不大,而在第3个月显著下降(P<0.05)。其主要原因在于前发酵结束时,发酵醪中还有部分未水解的淀粉,经混匀和装坛后,发酵醪中的好氧微生物开始繁殖并水解淀粉,所以后发酵初期总糖含量变化不大。随着发酵时间延长糖类物质被降解转化成有机酸、氨基酸等,以及乙醇发酵的进行而导致总糖含量下降。此外,后发酵过程中氨基酸态氮含量变化也呈上升趋势,文献[20-21]报道酵母自溶会释放出蛋白酶A、多肽和氨基酸,因此醪液中的蛋白质极有可能在酒曲中的蛋白酶和酵母释放的酸性蛋白酶双重作用下被分解,导致酵母的代谢活动减弱,从而利用的氨基酸速率也会减慢,但是酵母自溶会释放氨基酸[22],使得醪液中氨基酸态氮含量呈现上升的趋势。非糖固形物含量随发酵时间的延长而降低,可能是进入后发酵温度降低,酵母发酵产乙醇作用减弱,产生其他风味成分增加[23],所以非糖固形物含量也开始减少。
2.2 多元统计分析
PCA得分图的聚散程度反映了样本代谢物的相近程度,即发酵过程中代谢物的聚类情况,代谢水平越接近的点在得分图上越接近[24]。利用SIMCA14.1软件对不同发酵时间段的高度黑糯米酒样本数据进行PCA,样品PCA中R2X为0.867大于0.5表明模型的拟合准确性好,且得分图的所有样品均在95% Hotelling的T2椭圆内,说明分析的样品中没有异常值。由图1可知,发酵1、2、4、5、6 个月后的样本在得分图上能明显分开,而发酵2、3 个月后的样本在得分图上区分不明显,可能是刚进入后发酵时加入基酒使得乙醇体积分数升高代谢物变化较大,导致发酵1、2 个月后的样本之间存在分离。在此之后,原料中的糖基本上被酵母消耗,同时由于环境因素和总酸含量增高,酵母的发酵作用减弱,代谢物变化缓慢,从而导致发酵2、3 个月后的样本分离不明显。随着发酵时间的延长,由于代谢物之间的相互作用,产生酯等各种风味物质,导致3、4、5、6 个月后的样本之间存在明显分离。
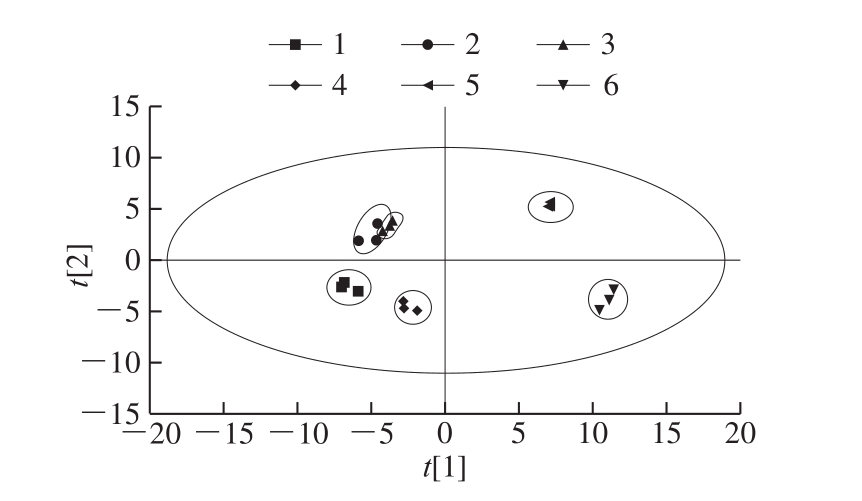
图1 不同后发酵时间的PCA
Fig. 1 Principal component analysis for different post-fermentation times
为了确定不同发酵阶段之间的差异代谢物,进一步使用OPLS-DA模型对样品进行分类,R2X、R2Y、Q2用于评估OPLS-DA模型的有效性,当R2X、R2Y、Q2值越接近于1,说明所构建的模型越好[25]。由图2可知,不同发酵阶段的样品能够完全分离,其中每组R2X、R2Y和Q2值分别为(0.867,0.992,0.976)、(0.795,0.995,0.972)、(0.775,0.989,0.823)、(0.921,0.993,0.994)、(0.915,0.994,0.990),说明OPLS-DA模型构建成功,具有很高的拟合度和预测能力,适合探索高度黑糯米酒后发酵过程中的代谢物差异。
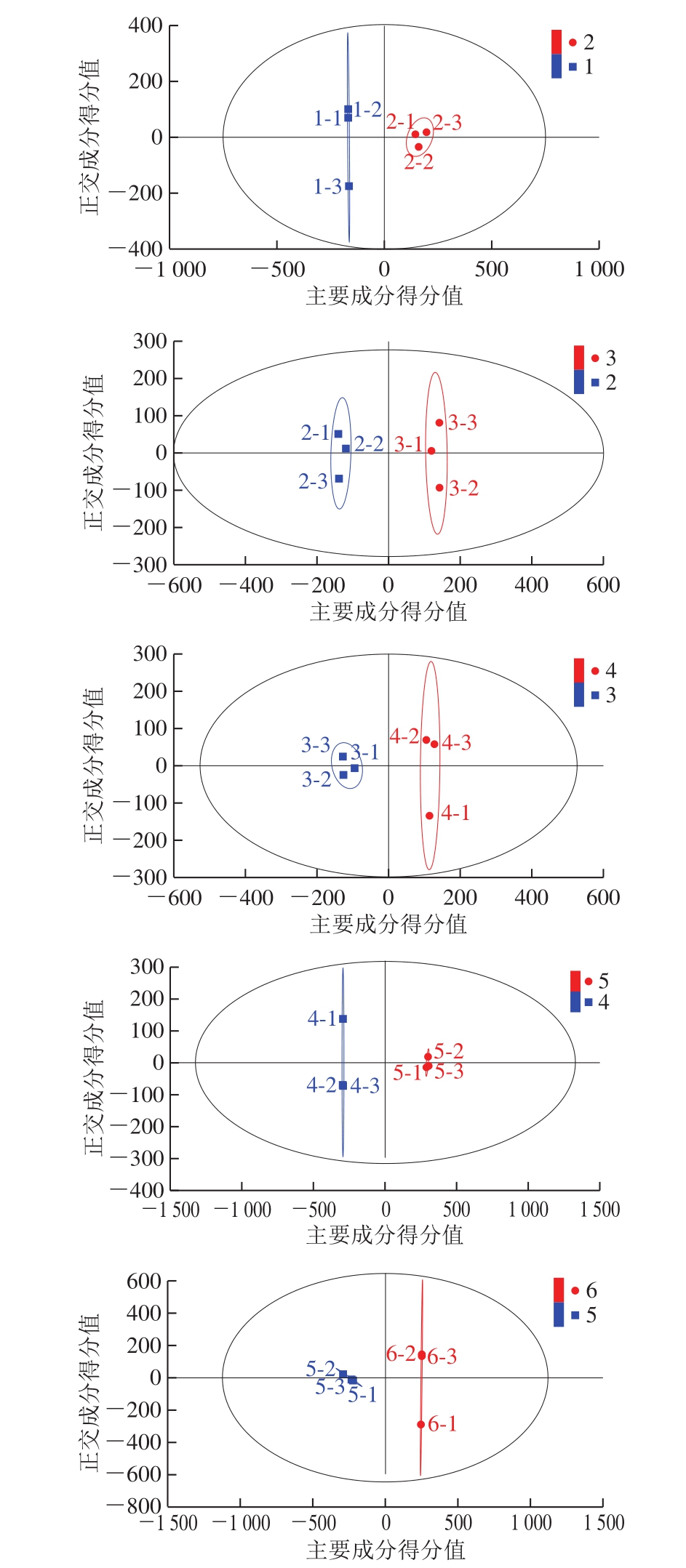
图2 不同发酵阶段的高度黑糯米酒OPLS-DA得分图
Fig. 2 Orthogonal partial least squares discriminant analysis score map of high black glutinous rice wine in different fermentation stages
2.3 差异代谢物的筛选与分析
基于OPLS-DA模型分析结果,将VIP值大于1且P值小于0.05的代谢物作为后发酵阶段的差异代谢物,结果共鉴定出40 种,包括有机酸13 种,氨基酸7 种,糖类及其衍生物11 种,酮类5 种,其他代谢物4 种,结果如表2所示。代谢物分布可在视觉上分为上调和下调[26],为了直观观察不同发酵阶段差异代谢物的浓度变化趋势,依据每个差异代谢物的相对含量做出热图(图3)。图3中接近砖红色表示代谢物含量上调,接近蓝色表示代谢物含量下调。通过图3可以看到在后发酵初期代谢物的相对含量较低,随着发酵时间的延长代谢物被上调的逐渐增多。此外发酵1、4、6 个月的代谢物聚为一类,主要由II区的代谢物主导;而发酵2、3、5 个月后的代谢物聚为一类,主要由I区的代谢物主导。
有机酸在酒中既有呈香和呈味作用,同时也可在发酵过程中抑制杂菌[27-28]。酒中的有机酸一部分来源于酒母或酸度调节,另一部分来源于米酒发酵过程中微生物代谢产生。如酵母菌在米酒发酵过程中能产生琥珀酸,根霉菌产生富马酸,乳酸菌产生乳酸、乙酸等有机酸,这些有机酸各具独特的风味,只有当各种有机酸比例相互协调时,才能保证米酒的品质。本研究在差异代谢物中检测到的有机酸有草酸、乳酸、琥珀酸、棕榈酸、硬脂酸等13 种。在发酵过程中草酸的含量前4 个月变化较小,在发酵第5个月后达到最高(106.5±7.77)μg/L,发酵结束后又下降。乳酸是由丙酮酸通过乳酸脱氢酶产生,乳酸比较柔和,给米酒带来良好的风味,起到增加醇厚感的作用[29]。在发酵过程中乳酸含量在后发酵过程呈先下降后升高趋势,直到发酵结束时达到最高(212.97±4.09) μg/L。琥珀酸、棕榈酸、硬脂酸、2-酮丁酸含量在后发酵过程中占优势,其中棕榈酸和硬脂酸为脂肪酸,有研究报道脂肪酸对米酒的风味形成有很大的作用[30],它们主要来源于原料。琥珀酸是三羧酸循环代谢和糖酵解的重要中间产物[31],在后发酵过程中琥珀酸的含量总体随发酵时间延长增加,在发酵结束时达到最高(5 800.42±44.65)μg/L。右旋奎宁酸、二十四酸、D-氨基葡萄糖-1-磷酸和3-苯基乳酸的含量变化趋势一致,均为先上升后下降再上升,且都在6 个月后达到最高。此外,还检测到果糖-6-磷酸,是生物体内的常见分子之一,也是糖酵解过程中所生成的产物之一,属于酮糖。去氢抗坏血酸是VC在有氧条件下氧化生成,但它容易分解为二酮古洛糖酸,再进一步分解成苏氨酸和草酸。
氨基酸因其具有的鲜、甜、苦、涩、酸等诸多味感赋予黄酒丰富的味觉层次,使其具有鲜美、柔和、浓郁、柔润和协调的特征[32]。在后酵期间氨基酸的增长可能主要是由微生物细胞中的氨基酸溶出造成,具有一定的呈味作用,对黑糯米酒的风味及感官品质的形成具有重要贡献[33]。从高度黑糯米酒中筛选出的氨基酸差异代谢物有N-乙酰-L-天冬氨酸、蛋氨酸、赖氨酸、L-别苏氨酸、瓜氨酸、脯氨酸、天冬氨酸,其中有2 种是人体必需氨基酸(蛋氨酸和赖氨酸)。在发酵过程蛋氨酸含量只在发酵3 个月后检测到,而赖氨酸的含量相对较高,在发酵第5个月后达到最高(1 642.82±36.57) μg/L。瓜氨酸在后发酵过程中含量变化不大,在发酵6 个月之后达到最高(8 943.64±637.55)μg/L,它是从鸟氨酸及胺基甲酰磷酸盐在尿素循环中生成。脯氨酸是甜味氨基酸,在发酵6 个月后增长为第1个月的1.8 倍。天冬氨酸是20 种蛋白质氨基酸之一,和谷氨酸同属酸性氨基酸[34],在发酵1 个月后和发酵6 个月后未检测到,在发酵2~4 个月之间变化趋势是先降低后升高。
糖作为主要的碳源被消耗,通过碳水化合物代谢途径为微生物的生长提供能量[35]。葡萄糖、果糖、阿洛糖、D-塔洛糖、麦芽三糖等11 种糖类及其衍生物被鉴定为差异代谢物。果糖在后发酵初期的质量浓度为(654.98±40.22) μg/L,到发酵5 个月后含量达到最高。葡萄糖、景天[酮庚]糖、苯基β-D-葡聚糖、D-塔洛糖在发酵过程中含量占优势,但葡萄糖在发酵3 个月后和5 个月后含量急剧下降。景天[酮庚]糖含量随发酵时间延长呈上升趋势,但在发酵5 个月后未检出。麦芽三糖和毛地黄毒糖的含量变化趋势相同,均为先增加后再降低最后再增加,麦芽三糖质量浓度在发酵结束后最高为(182.1±11.53) μg/L,毛地黄毒糖则是在3 个月后质量浓度最高为(294.73±13.14)μg/L。此外,本研究还发现肌醇半乳糖苷和甘露醇,它们的含量变化规律大致相似,且都在3 个月后含量最高。肌醇半乳糖苷的主要生理功能是作为生物合成低聚糖的半乳糖供体,而甘露醇作为抗氧化剂以及不可代替的甜味剂对酒的风味有贡献作用。
酮类物质香气绵柔细腻,能带给酒体愉快的香气。在差异代谢物中含量占优势的是7-羟基-4-雄甾烯-3,17-二酮和9-芴酮,它们都在第5个月时质量浓度最高分别达到(767.14±10.65)μg/L和(648.22±37.05)μg/L。除此之外二聚丙三醇、甘油磷酸、顺-1,2-二氢苯基-1,2-二醇、3-丙酸尿苷也被鉴定为差异代谢物,二聚丙三醇的含量在发酵第4个月达到最高后开始下降,但变化不大。顺-1,2-二氢苯基-1,2-二醇的含量先上升到第3个月达到峰值后开始下降,在第5个月又缓慢上升。而整个后发酵过程中甘油磷酸只在第4个月检测到,3-丙酸尿苷只在第1个月检测到。
表2 高度黑糯米酒后发酵阶段差异代谢物含量
Table 2 The relative contents of differential metabolites in the post-fermentation stage of high black glutinous rice wine
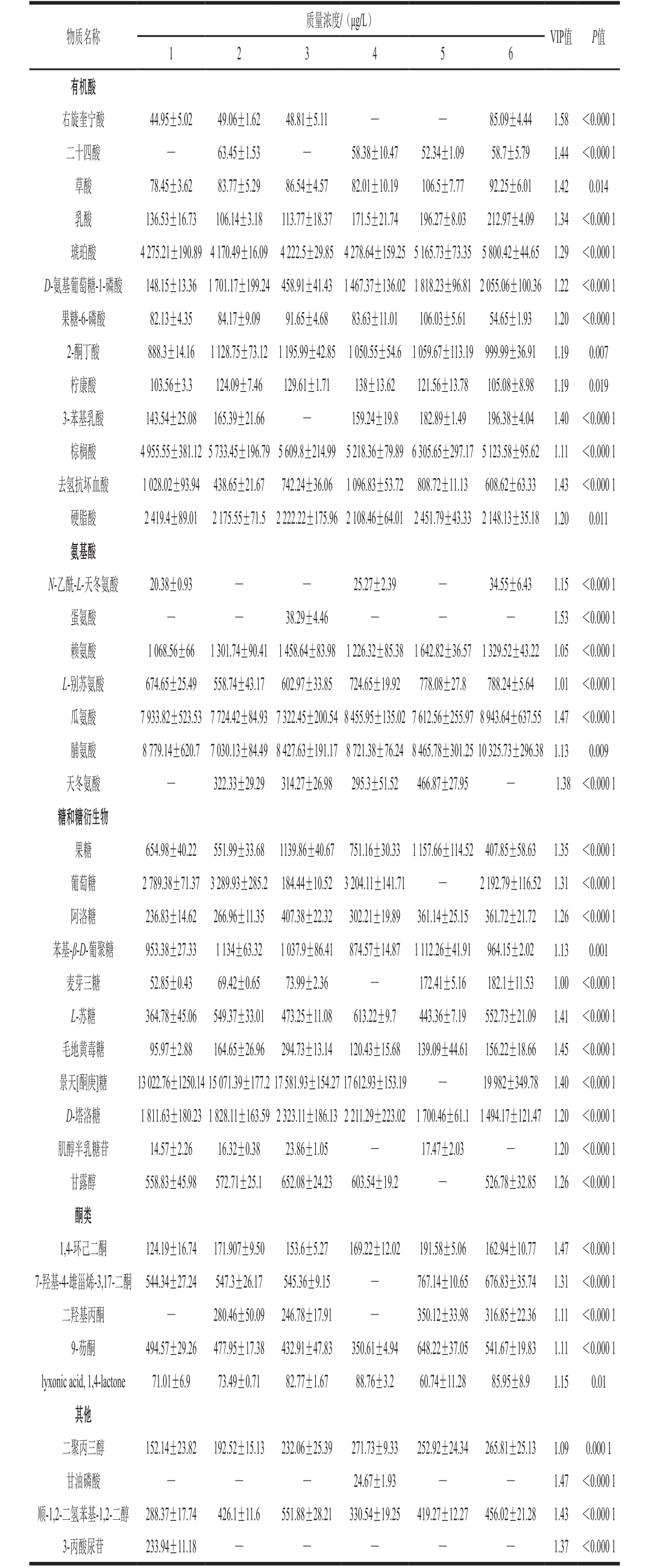
注:—.未检出。
质量浓度/(μg/L)物质名称VIP值 P值1 2 3 4 5 6有机酸右旋奎宁酸 44.95±5.02 49.06±1.62 48.81±5.11 — — 85.09±4.44 1.58 <0.000 1二十四酸 — 63.45±1.53 — 58.38±10.47 52.34±1.09 58.7±5.79 1.44 <0.000 1草酸 78.45±3.62 83.77±5.29 86.54±4.57 82.01±10.19 106.5±7.77 92.25±6.01 1.42 0.014乳酸 136.53±16.73 106.14±3.18 113.77±18.37 171.5±21.74 196.27±8.03 212.97±4.09 1.34 <0.000 1琥珀酸 4 275.21±190.89 4 170.49±16.09 4 222.5±29.854 278.64±159.25 5 165.73±73.355 800.42±44.65 1.29 <0.000 1 D-氨基葡萄糖-1-磷酸 148.15±13.36 1 701.17±199.24458.91±41.431 467.37±136.02 1 818.23±96.81 2 055.06±100.36 1.22 <0.000 1果糖-6-磷酸 82.13±4.35 84.17±9.09 91.65±4.68 83.63±11.01 106.03±5.61 54.65±1.93 1.20 <0.000 1 2-酮丁酸 888.3±14.16 1 128.75±73.121 195.99±42.85 1 050.55±54.61 059.67±113.19 999.99±36.91 1.19 0.007柠康酸 103.56±3.3 124.09±7.46 129.61±1.71 138±13.62 121.56±13.78 105.08±8.98 1.19 0.019 3-苯基乳酸 143.54±25.08 165.39±21.66 — 159.24±19.8 182.89±1.49 196.38±4.04 1.40 <0.000 1棕榈酸 4 955.55±381.12 5 733.45±196.79 5 609.8±214.995 218.36±79.89 6 305.65±297.17 5 123.58±95.62 1.11 <0.000 1去氢抗坏血酸 1 028.02±93.94 438.65±21.67 742.24±36.06 1 096.83±53.72 808.72±11.13 608.62±63.33 1.43 <0.000 1硬脂酸 2 419.4±89.01 2 175.55±71.52 222.22±175.96 2 108.46±64.012 451.79±43.332 148.13±35.18 1.20 0.011氨基酸N-乙酰-L-天冬氨酸 20.38±0.93 — — 25.27±2.39 — 34.55±6.43 1.15 <0.000 1蛋氨酸 — — 38.29±4.46 — — — 1.53 <0.000 1赖氨酸 1 068.56±66 1 301.74±90.411 458.64±83.981 226.32±85.381 642.82±36.571 329.52±43.22 1.05 <0.000 1 L-别苏氨酸 674.65±25.49 558.74±43.17 602.97±33.85 724.65±19.92 778.08±27.8 788.24±5.64 1.01 <0.000 1瓜氨酸 7 933.82±523.53 7 724.42±84.93 7 322.45±200.54 8 455.95±135.02 7 612.56±255.97 8 943.64±637.55 1.47 <0.000 1脯氨酸 8 779.14±620.77 030.13±84.49 8 427.63±191.17 8 721.38±76.24 8 465.78±301.25 10 325.73±296.381.13 0.009天冬氨酸 — 322.33±29.29 314.27±26.98 295.3±51.52 466.87±27.95 — 1.38 <0.000 1糖和糖衍生物果糖 654.98±40.22 551.99±33.68 1139.86±40.67 751.16±30.33 1 157.66±114.52 407.85±58.63 1.35 <0.000 1葡萄糖 2 789.38±71.373 289.93±285.2 184.44±10.523 204.11±141.71 — 2 192.79±116.52 1.31 <0.000 1阿洛糖 236.83±14.62 266.96±11.35 407.38±22.32 302.21±19.89 361.14±25.15 361.72±21.72 1.26 <0.000 1苯基-β-D-葡聚糖 953.38±27.33 1 134±63.32 1 037.9±86.41 874.57±14.87 1 112.26±41.91 964.15±2.02 1.13 0.001麦芽三糖 52.85±0.43 69.42±0.65 73.99±2.36 — 172.41±5.16 182.1±11.53 1.00 <0.000 1 L-苏糖 364.78±45.06 549.37±33.01 473.25±11.08 613.22±9.7 443.36±7.19 552.73±21.09 1.41 <0.000 1毛地黄毒糖 95.97±2.88 164.65±26.96 294.73±13.14 120.43±15.68 139.09±44.61 156.22±18.66 1.45 <0.000 1景天[酮庚]糖 13 022.76±1250.14 15 071.39±177.2 17 581.93±154.27 17 612.93±153.19 — 19 982±349.78 1.40 <0.000 1 D-塔洛糖 1 811.63±180.23 1 828.11±163.59 2 323.11±186.13 2 211.29±223.021 700.46±61.11 494.17±121.47 1.20 <0.000 1肌醇半乳糖苷 14.57±2.26 16.32±0.38 23.86±1.05 — 17.47±2.03 — 1.20 <0.000 1甘露醇 558.83±45.98 572.71±25.1 652.08±24.23 603.54±19.2 — 526.78±32.85 1.26 <0.000 1酮类1,4-环己二酮 124.19±16.74 171.907±9.50 153.6±5.27 169.22±12.02 191.58±5.06 162.94±10.77 1.47 <0.000 1 7-羟基-4-雄甾烯-3,17-二酮 544.34±27.24 547.3±26.17 545.36±9.15 — 767.14±10.65 676.83±35.74 1.31 <0.000 1二羟基丙酮 — 280.46±50.09 246.78±17.91 — 350.12±33.98 316.85±22.36 1.11 <0.000 1 9-芴酮 494.57±29.26 477.95±17.38 432.91±47.83 350.61±4.94 648.22±37.05 541.67±19.83 1.11 <0.000 1 lyxonic acid, 1,4-lactone 71.01±6.9 73.49±0.71 82.77±1.67 88.76±3.2 60.74±11.28 85.95±8.9 1.15 0.01其他二聚丙三醇 152.14±23.82 192.52±15.13 232.06±25.39 271.73±9.33 252.92±24.34 265.81±25.13 1.09 0.000 1甘油磷酸 — — — 24.67±1.93 — — 1.47 <0.000 1顺-1,2-二氢苯基-1,2-二醇 288.37±17.74 426.1±11.6 551.88±28.21 330.54±19.25 419.27±12.27 456.02±21.28 1.43 <0.000 1 3-丙酸尿苷 233.94±11.18 — — — — — 1.37 <0.000 1
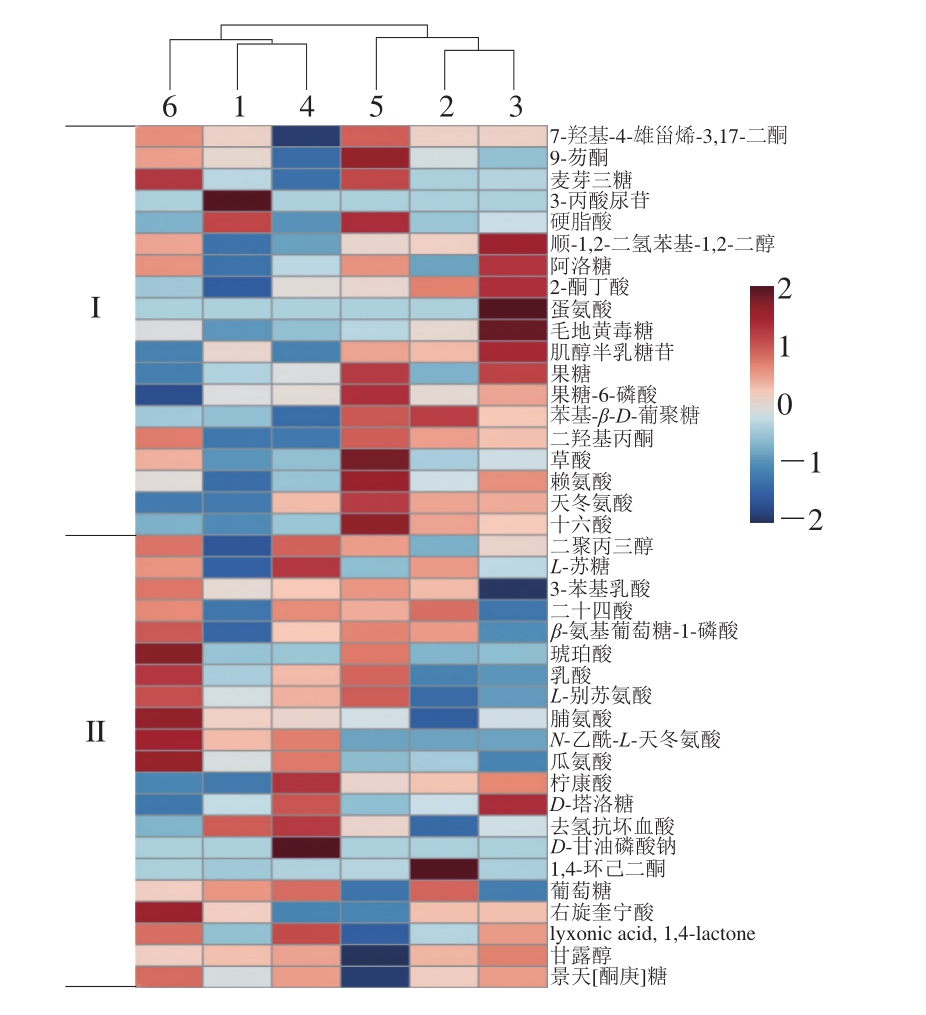
图3 高度黑糯米酒后发酵阶段差异代谢物热图和聚类图
Fig. 3 Heat map of differential metabolites and cluster map of high black glutinous rice after fermentation
2.4 关键代谢途径分析
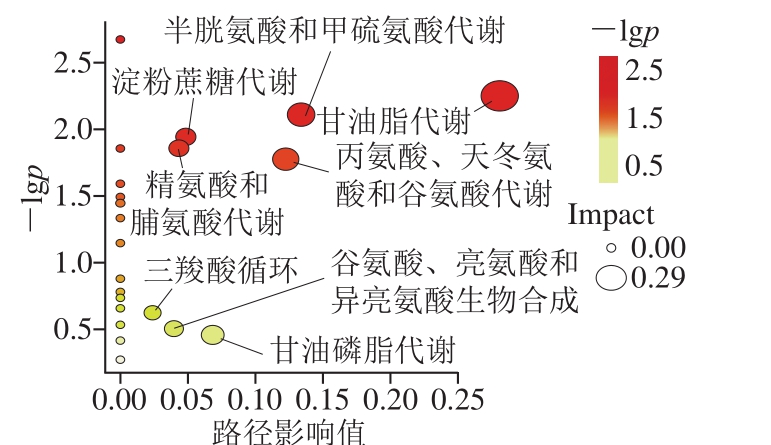
图4 差异代谢物通路富集分析
Fig. 4 Enrichment analysis of differential metabolite pathways
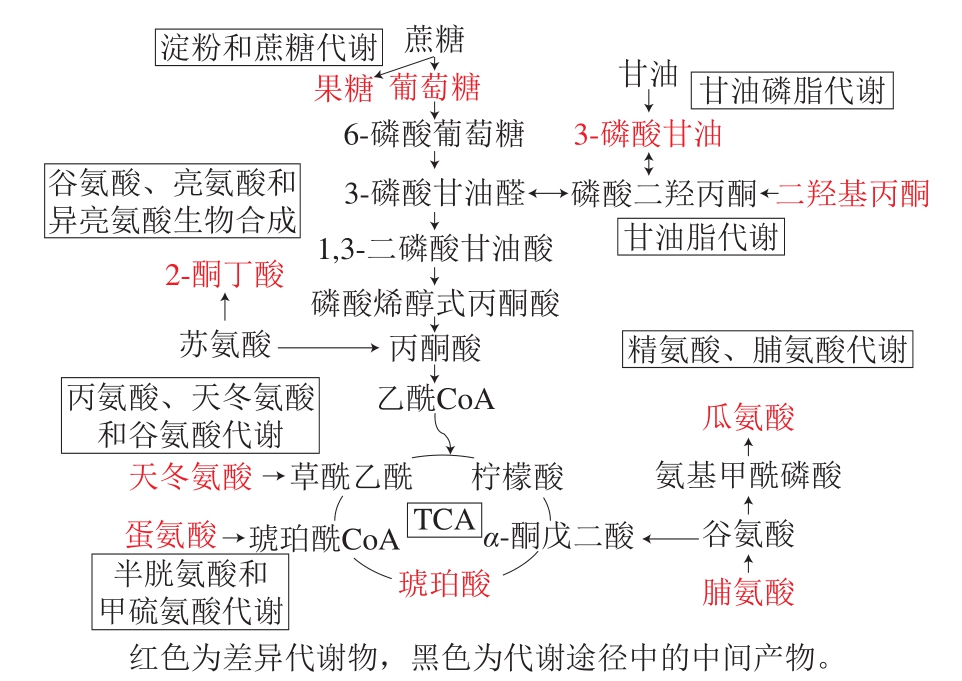
图5 差异代谢物代谢途径分析
Fig. 5 Metabolic pathway analysis of differential metabolites
为了探索高度黑糯米酒后发酵阶段潜在代谢途径,使用MetaboAnalyst 4.0进行差异代谢物的代谢途径分析,由图4可知,通路分析结果显示共获得26 个途径,基于影响值大于0.01对关键代谢途径进行筛选[36],结果发现有8 条关键代谢途径。这些途径包括甘油脂代谢、半胱氨酸和甲硫氨酸代谢、淀粉和蔗糖代谢、精氨酸和脯氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、三羧酸循环、谷氨酸、亮氨酸和异亮氨酸生物合成、甘油磷脂代谢,影响值分别为0.281 25、0.134 08、0.048 8、0.043 54、0.122 55、0.023 83、0.039 74、0.068 48。
如图5所示,8 条关键代谢途径中主要参与的差异代谢物主要有天冬氨酸、瓜氨酸、脯氨酸、蛋氨酸、2-酮丁酸、果糖、葡萄糖、3-磷酸甘油、二羟基丙酮和琥珀酸。发酵过程中首先是原料中的淀粉水解成葡萄糖和果糖,在糖酵解途径中葡萄糖在葡萄糖激酶的作用下生成6-磷酸葡萄糖,再经果糖-6-磷酸激酶-1、醛缩酶、磷酸丙酮异构酶、丙酮酸激酶等酶作用下生成丙酮酸进入三羧酸循环。然而,在甘油磷脂代谢途径中首先由原料中的脂肪降解成甘油,甘油被认为是酵母乙醇发酵中最重要的副产物,帮助细胞适应不断变化的环境条件。随后甘油在甘油激酶的而作用下可生成3-磷酸甘油,接着在磷酸甘脱氢酶作用下生成磷酸二羟丙酮,在转变成3-磷酸甘油醛从而经糖酵解途径进入三羧酸循环。2-酮丁酸可在谷氨酸、亮氨酸和异亮氨酸生物合成途径中由苏氨酸转变而来,2-酮丁酸具有刺激性气味,可以在乙酰羧酸合成酶催化作用下生成异亮氨酸的前体乙酰羟基丁酸,有助于异亮氨酸合成[37]。天冬氨酸和蛋氨酸分别在丙氨酸、天冬氨酸和谷氨酸代谢以及半胱氨酸和甲硫氨酸代谢代谢途径中生成。脯氨酸是谷氨酸的前体,与瓜氨酸一样在精氨酸和脯氨酸代谢途径中生成,这些氨基酸均可在酶的作用下进入三羧酸循环有助于一些有机酸生成,共同助力黑糯米酒风味的形成。
3 结 论
本研究采用化学方法和GC-TOF-MS技术对高度黑糯米酒后发酵阶段的理化指标以及代谢物进行监测分析。结果表明,高度黑糯米酒后发酵阶段总酸,pH值和氨基酸态氮含量呈上升趋势,而总糖、还原糖和非糖固形物则相反。通过PCA结果发现,高度黑糯米酒在发酵1、4、5、6 个月之后的样品存在明显的分离,这种分离表明这些代谢物有着显著的差异;然而,发酵2、3 个月后的样品之间分离不明显,说明代谢物变化较小。OPLSDA结果表明,后发酵阶段差异代谢物共有40 种。使用MetaboAnalyst 4.0对40 种差异代谢物的代谢通路进行分析发现28 条代谢途径与高度黑糯米酒后发酵有关,其中有8 条被鉴定为关键代谢途径。本研究有助于了解高度黑糯米发酵后过程中的代谢产物的差异及其变化,因此可根据发酵过程中有机酸、糖类、氨基酸等生物活性物质的含量变化确定发酵过程的发酵周期,为高度黑糯米酒的生产和开发提供一定的技术支撑和理论指导。
[1] 苏伟, 母雨, 齐琦, 等. 黑糯米酒及黑糯米保健酒品质分析[J]. 中国酿造, 2018, 37(12): 186-191. DOI:10.11882/j.issn.0254-5071.2018.12.035.
[2] 苏伟, 徐本刚, 母应春. 贵州不同地区黑糯米酒曲的品质比较[J]. 贵州农业科学, 2012, 40(2): 51-55. DOI:10.3969/j.issn.1001-3601.2012.02.016.
[3] 杨春芳, 伍慧方. 糯米酒生产工艺及质量控制的研究进展[J]. 轻工科技, 2014(3): 8-9.
[4] MENG L P, LIN H, PAN S L, et al. Chinese rice wine polyphenol compounds inhibit vascular smooth muscle cell dedifferentiation and its mechanism[J]. Internationa Journal of Clinical and Experimental Medicine, 2016, 9(9): 17539-17548.
[5] PARKER M, SMITH P A, BIRSE M, et al. The effect of pre- and postferment additions of grape derived tannin on Shiraz wine sensory properties and phenolic composition[J]. Australian Journal of Grape & Wine Research,2010, 13(1): 30-37. DOI:10.1111/j.1755-0238.2007.tb00069.x.
[6] 王鹏飞, 王倩倩, 李先恩, 等. GC-MS技术在延胡索块茎代谢产物研究中的应用[J]. 植物学报, 2012, 47(2): 149-154. DOI:10.3724/SP.J.1259.2012.00149.
[7] DAGIA M, ANTIOCHIA R, SOBLEV A P, et al. Untargeted and targeted methodologies in the study of tea (Camellia sinensis L.)[J].Food Research International, 2014, 63: 275-289. DOI:10.1016/j.foodres.2014.03.070.
[8] JIANG L H, SHEN X J, TOSHIHIKO S, et al. Characterization and activity of anthocyanins in Zijuan Tea (Camellia sinensis var.kitamura)[J]. Journal of Agricultural and Food Chemistry, 2013, 61:3306-3310. DOI:10.1021/jf304860u.
[9] LEE J E, LEE B J, HWANG J A, et al. Metabolic dependence of green tea on plucking positions revisited: a metabolomic study[J]. Journal of Agricultural and Food Chemistry, 2011, 59(19): 10579-10585.DOI:10.1021/jf202304z.
[10] SCHMEDA-HIRSCHMANN G, QUISPE C, GONZALEZ B, et al.Phenolic profiling of the South American “Baylahuen” tea(Haplopappus spp. Asteraceae) by HPLC-DAD-ESI-MS[J].Molecules, 2015, 20(1): 913-928. DOI:10.3390/molecules20010913.
[11] 倪建伟, 杨秀艳, 张华新, 等. 代谢组学在植物逆境胁迫研究中的应用[J]. 世界林业研究, 2014, 27(5): 11-17. DOI:10.13348/j.cnki.sjlyyj.2014.05.003.
[12] KOPKA J. Current challenges and developments in GC-MS based metabolite profiling technology[J]. Journal of Biotechnology, 2006,124: 312-322. DOI:10.1016/j.jbiotec.2005.12.012.
[13] JANG Y K, LEE M Y, KIM H Y, et al. Comparison of traditional and commercial vinegars based on metabolite profiling and antioxidant activity[J]. Journal of Microbiology and Biotechnology, 2015, 25(2):217-226. DOI:10.4014/jmb.1408.08021.
[14] HAO R J, WANG Z M, YANG C Y, et al. Metabolomic responses of juvenile pearl oyster, Pinctada maxima, to different growth performances[J]. Aquaculture, 2018, 491: 258-265. DOI:10.1016/j.aquaculture.2018.03.050.
[15] ZENG Q, SONG H J, XU X Y, et al. Health effects of kiwi wine on rats: an untargeted metabolic fingerprint study based on GC-MS/TOF[J]. RSC Advances, 2019, 9: 13797-13807. DOI:10.1039/C9RA02138H.
[16] 国家质量监督检验检疫总局. 黄酒: GB/T 13662—2018[S]. 北京:中国标准出版社, 2018.
[17] KIND T, WOHLGEMUTH G, LEE D Y, et al. FiehnLib: mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J].Analytical chemistry, 2009, 81(24): 10038-10048. DOI:10.1021/ac9019522.
[18] DUNN W B, BROADHURST D, BEGLEY P, et al. Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry[J]. Nature Protocols, 2011, 6(7): 1060-1083.DOI:10.1038/nprot.2011.335.
[19] KANEHISA M, SATO Y, KAWASHIMA M, et al. KEGG as a reference resource for gene and protein annotation[J]. Nucleic Acids Research, 2016, 44(1): 457-462. DOI:10.1093/nar/gkv1070.
[20] 毛青钟. 黄酒发酵过程中pH值变化的研究[J]. 江苏调味副食品,2010, 27(1): 23-26. DOI:10.3969/j.issn.1006-8481.2010.01.007.
[21] ALEXANDRE H, HEINTZ D, CHASSAGNE D, et al. Protease a activity and nitrogen fractions released during alcoholic fermentation and autolysis in enological conditions[J]. Journal of Industrial Microbiology & Biotechnology, 2001, 26(4): 235-240. DOI:10.1038/sj.jim.7000119.
[22] 潘慧青, 曹钰, 石慧媛, 等. 黄酒酿造后酵工艺对氨基酸态氮生成的影响[J]. 食品与生物技术学报, 2016, 35(2): 144-150. DOI:10.3969/j.issn.1673-1689.2016.02.005.
[23] 郭柯洋. 机械化黄酒发酵过程中固形物的变化[J]. 酿酒科技,2012(5): 72-73. DOI:1001-9286(2012)05-0081-02.
[24] CEBOLLERO E, CARRASCOSA A V, GONZALEZ R. Evidence for yeast autophagy during simulation of sparkling wine aging:a reappraisal of the mechanism of yeast autolysis in wine[J].Biotechnology Progress, 2010, 21(2): 614-616. DOI:10.1021/bp049708y.
[25] 钟成, 刘伶普, 李清亮, 等. 采用代谢组学分析技术分析工业啤酒发酵过程中风味物质生成规律[J]. 中国生物工程杂志, 2016, 36(12):49-58. DOI:10.13523/j.cb.20161208.
[26] YANG Y, DONG G, WANG Z, et al. Rumen and plasma metabolomics profiling by UHPLC-QTOF/MS revealed metabolic alterations associated with a high-corn diet in beef steers[J]. PLoS ONE, 2018,13(11): e0208031. DOI:10.1371/journal.pone.0208031.
[27] 陈青柳, 刘双平, 唐雅凤, 等. 绍兴机械黄酒发酵过程中风味物质变化[J]. 食品科学, 2018, 39(14): 221-228. DOI:10.7506/spkx1002-6630-201814033.
[28] 沙坤, 张泽俊, 张松山, 等. 不同类型新疆风干牛肉挥发性风味成分差异分析[J]. 肉类研究, 2018, 32(4): 33-38. DOI:10.7506/rlyj1001-8123-201804006.
[29] YANG C, HAO R, DU X, et al. GC-TOF/MS-based metabolomics studies on the effect of protein sources in formulated diet for pearl oyster, Pinctada fucata martensii[J]. Aquaculture, 2018, 486: 139-147.DOI:10.1016/j.aquaculture.2017.12.020.
[30] 冯德明, 朱长俊, 王玉洁, 等. 黄酒发酵过程中乳酸含量分析及变化规律的研究[J]. 中国酿造, 2009, 28(7): 158-160. DOI:10.3969/j.issn.0254-5071.2009.07.050.
[31] SON E Y, LEE S M, KIM M, et al. Comparison of volatile and nonvolatile metabolites in rice wine fermented by, koji, inoculated with, Saccharomycopsis fibuligera and Aspergillus oryzae[J]. Food Research International, 2018, 109(7): 596-605. DOI:10.1016/j.foodres.2018.05.008.
[32] WANG P, MAO J, MENG X, et al. Changes in flavour characteristics and bacterial diversity during the traditional fermentation of Chinese rice wines from Shaoxing region[J]. Food Control, 2014, 44: 58-63.DOI:10.1016/j.foodcont.2014.03.018.
[33] XIAO Z B, DAI X, ZHU J C, et al. Classification of Chinese rice wine according to geographic origin and wine age based on chemometric methods and SBSE-TD-GC-MS analysis of volatile compounds[J].Food Science and Technology Research, 2015, 21(3): 371-380.DOI:10.3136/fstr.21.371.
[34] 徐煜, 蒋德意, 韩迪. 植物乳杆菌Lp-G18谷氨酰胺合成酶活力发酵工艺优化[J]. 乳业科学与技术, 2019, 42(2): 13-17. DOI:10.15922/j.cnki.jdst.2019.02.003.
[35] DA L, SNUMIN L, EUN J, et al. Metabolomic profiles of Aspergillus oryzae and Bacillus amyloliquefaciens during rice koji fermentation[J].Molecules, 2016, 21(6): 773. DOI:10.3390/molecules21060773.
[36] WEN B, JIN S R, CHEN Z Z, et al. Physiological responses to cold stress in the gills of discus fish (Symphysodon aequifasciatus)revealed by conventional biochemical assays and GC-TOF-MS metabolomics[J]. Science of the total Environment, 2018, 640/641(11):1372-1381. DOI:10.1016/j.scitotenv.2018.05.401.
[37] 张伟国, 郭燕风. 支链氨基酸生物合成及其代谢工程育种研究进展[J]. 食品与生物技术学报, 2014, 33(8): 120-126. DOI:10.3969/j.issn.1673-1689.2014.02.002.