单宁酶(EC 3.1.1.20)是可将单宁中的酯键与缩酚羧键断裂,生成葡萄糖和没食子酸等物质一类酶的总称,在速溶茶、葡萄酒和啤酒等食品加工领域具有巨大的应用潜力[1-2]。虽然对单宁酶的研究广泛且具有较长历史,但是到目前为止,主要集中在产酶微生物的筛选及产酶特性分析方面[3-5]。单宁酶蛋白往往需要形成二硫键、氨基酸的糖基化及蛋白的正确折叠等表达后加工,才能够成为具有活性的酶蛋白分子[6-7],这使得仅有数个单宁酶基因被克隆并表达,涉及的微生物有米曲霉、黑曲霉、植物乳杆菌等[8-11]。巴斯德毕赤酵母(Pichia pastoris)作为优良的表达宿主,己经实现了上百种酶基因的高效表达[12],探究影响单宁酶在巴斯德毕赤酵母正确表达因素的意义重大。
本课题组前期从浓香大曲中筛选获得产单宁酶嗜热真菌烟曲霉(Aspergillus fumigatus)HBHF5,该菌属条件致病菌,具有一定潜在的安全风险。巴斯德毕赤酵母GS115菌株为毕赤酵母表达系统常用菌株,其生理学背景清楚,属于安全菌株。为此,将烟曲霉菌株中的单宁酶afTanA基因在巴斯德毕赤酵母GS115中进行表达。研究发现毕赤酵母表达的重组单宁酶(AfTanA)由2 个30 kDa左右大小亚基组成,且酶的稳定性降低,推测这些性质的改变与Kex2蛋白酶作用相关[13-14]。单宁酶中普遍含有1~2 个Kex2位点,到目前为止,只有Koseki等[15]对米曲霉来源的单宁酶中Kex2位点进行了研究,而单宁酶AfTanA中Kex2位点对酶学特性影响还不清楚。因此,亟待深入开展Kex2位点对单宁酶AfTanA性质影响的研究工作。
本研究以前期获得的重组单宁酶AfTanA为材料,构建AfTanA蛋白质三维结构模型,分析Kex2位点在单宁酶蛋白结构中的位置及其作用;对比单点突变体(R316A)和双点缺失突变体(ΔRK:Lys315-Arg316)酶学性质及应用效果的差异,探讨Kex2蛋白酶酶切位点对该酶酶学性质及在柿子汁应用效果的影响,以期为单宁酶的生产及性能改造提供一定的理论指导。
1 材料与方法
1.1 材料与试剂
pMDTM19T-afTanA质粒由本课题组构建并提供;巴斯德毕赤酵母GS115菌株、pPIC9k质粒 美国Invitrogen公司;FastPfu DNA聚合酶 北京全式金生物技术有限公司;T4 DNA连接酶、限制性内切酶Spe I、Not I和Sal I大连宝生物有限公司;没食子酸丙酯 浙江匝海化工试剂厂;罗丹宁 生工生物工程(上海)股份有限公司;单宁酸 上海化学试剂公司;其他试剂均为分析纯。
营养肉汤(Luria Broth,LB)培养基、酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD)培养基、最少葡萄糖(minimal dextrase,MD)琼脂培养基、甘油(buffered glycerol,BMGY)培养基和甲醇诱导(buffered methanol,BMMY)培养基参照Invitrogen公司Multi-Copy Pichia Expression Kit操作手册配制。
1.2 仪器与设备
立式高速低温离心机 中国湘仪离心机公司;Tprofessional聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;TU-1810紫外分光光度计北京普析通用仪器有限公司;细胞电穿孔仪 美国伯乐公司;JY04S-3E型凝胶成像系统 北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 AfTanA中Kex2酶切位点及其作用分析
使用蛋白质在线建模软件I-TASSER(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)构建AfTanA突变体的三维结构模型,通过PyMOL软件进行蛋白结构分析。使用BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行Kex2位点氨基酸序列比对分析。使用NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)软件预测N-糖基化位点。
1.3.2 引物的设计与合成
参照前期获得的单宁酶afTanA基因序列信息(XP_746534.1),依据Fast MultiSite Mutagenesis System要求设计单宁酶afTanA中Kex2位点突变引物,如表1所示,突变引物由北京六合华大基因科技有限公司合成。
表1 实验所用引物
Table 1 Primers used in this study
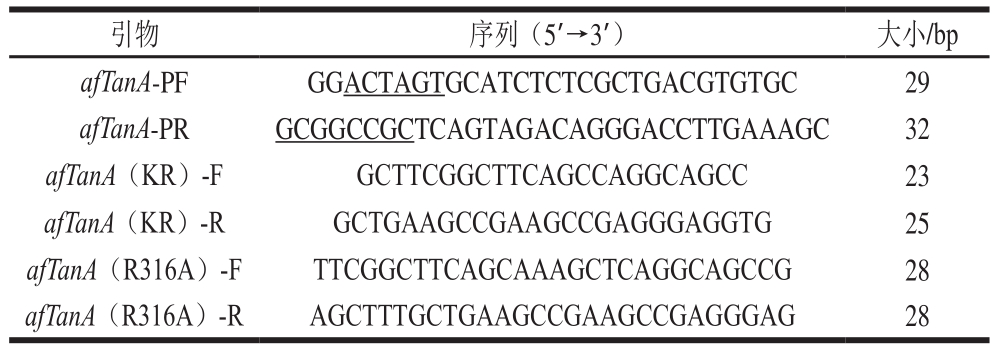
注:下划线表示酶切位点。
引物 序列(5’→3’) 大小/bp afTanA-PF GCGGCCGCTCAGTAGACAGGGACCTTGAAAGC 32 afTanA(KR)-F GCTTCGGCTTCAGCCAGGCAGCC 23 afTanA(KR)-R GCTGAAGCCGAAGCCGAGGGAGGTG 25 afTanA(R316A)-F TTCGGCTTCAGCAAAGCTCAGGCAGCCG 28 afTanA(R316A)-R AGCTTTGCTGAAGCCGAAGCCGAGGGAG 28 GGACTAGTGCATCTCTCGCTGACGTGTGC 29 afTanA-PR
1.3.3 Kex2突变基因的构建
以pMDTM19T-afTanA质粒为模板,PCR参数:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸4 min,25 个循环;72 ℃保温10 min。参照Fast MultiSite Mutagenesis System说明书进行单宁酶afTanA基因Kex2位点的定点突变,分别构建pMDTM19T-afTanR316A和pMDTM19T-afTanΔKR突变质粒,将阳性克隆子送至北京六合华大基因科技有限公司进行测序。
1.3.4 单宁酶突变体的构建
分别将pMDTM19T-afTanR316A、pMDTM19T-afTanΔKR和pPIC-9k质粒进行双酶切,利用胶回收试剂盒对目的酶切产物进行回收,进行afTanA和pPIC-9k的连接反应,分别构建表达质粒pPIC9k-afTanR316A和pPIC9kafTanΔKR。采用5’AOX和3’AOX通用引物对转化子进行验证,将筛选重组表达质粒阳性转化子进行测序鉴定。
测序正确的pPIC9k-afTanR316A和pPIC9k-afTanΔKR质粒经Sal I将表达质粒进行线性化处理后,电转化至巴斯德毕赤酵母GS115感受态细胞中,利用酶活力筛选方法对转化子进行筛选,获得阳性转化子。
1.3.5 诱导表达及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
挑取单阳性转化子至50 mL YPD培养基中,30 ℃、250 r/min培养12 h。以1%的接种量接种于200 mL BMGY中,在摇床中30 ℃、250~300 r/min生长至OD600 nm为2~6(约16~18 h),室温、8 000×g离心5 min收集细胞,去除上清液,100 mL BMMY重悬细胞,放入摇床继续培养至48 h,维持甲醇终体积分数为0.5%,离心收集发酵液,即为粗酶液,进行酶活力测定及SDS-PAGE分析。
1.3.6 单宁酶酶学性质分析
酶活力测定参考Sharma等[16]的方法。取100 μL适当稀释酶液与400 μL没食子酸丙酯溶液(1.25 mmol/L,pH 5.0)混匀,于25 ℃条件反应,10 min后加入300 μL罗丹宁终止反应,加入200 μL的KOH(0.5 mol/L)溶液显色,稳定5 min后在520 nm波长处测定吸光度。以每分钟生成1 μmol没食子酸所需的酶量为一个酶活力单位(U)。
1.3.6.1 pH值对突变体酶活力的影响
分别测定突变体AfTanR316A和AfTanΔKR酶液样品在不同pH值缓冲液体系(pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、1.0)中的酶活力,确定其最适反应pH值。将突变体AfTanR316A和AfTanΔKR在pH 2.0~12.0的条件下,37 ℃处理1 h,对照为未进行处理的酶,按照标准酶活力测定方法测定酶活力,以未加金属离子和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的酶活力计为100%,分析其pH值耐受性。
1.3.6.2 温度对突变体酶活力的影响
将突变体AfTanR316A和AfTanΔKR在最适pH值下,分别测定0、10、20、30、40、50、60、70 ℃和80 ℃反应温度下的酶活力,确定其最适温度。将重组酶在40 ℃和50 ℃条件下,孵育0、5、10、20、30 min和60 min后,测定酶活力,分析其热稳定性。
1.3.6.3 金属离子和化学试剂对酶活力的影响
在标准反应条件下,分别测定终浓度为1 mmol/L和5 mmol/L的金属离子(Fe3+、Cu2+、K+、Zn2+、Na+、Mg2+、Ca2+、Li+和Mn2+)、EDTA和SDS下的单宁酶活力。
1.3.7 动力学参数Km和Vmax分析
分别配制底物浓度为0.2、0.4、0.6、0.8、1.0 mmol/L的没食子酸丙酯溶液,在最适条件下反应5 min,测定520 nm波长处的吸光度,计算酶活力和反应速率,利用米氏方程双倒数法求得Km及Vmax值。
1.4 数据分析及处理
每次实验重复测定3 次,利用GraphPad Prism 5.0软件对数据进行统计分析,数据结果采用平均值±标准误差表示。
2 结果与分析
2.1 单宁酶afTanA基因Kex2位点分析
2013年,第一个植物乳杆菌来源的单宁酶晶体结构才被解析(PDB:4JUI)[17]。单宁酶家族的AoFaeB晶体结构(PDB:3WMT) [18]由一个具有典型的a/β丝氨酸水解酶结构区域和盖子结构域所组成,虽然该酶属于单宁酶家族中的阿魏酸脂酶,这使得该晶体结构还无法完全提供充足真菌来源单宁酶的结构信息,但是对真菌单宁酶的分子机制提供了一定的借鉴。经对多个单宁酶序列比对分析发现,位于盖子结构区域中的LoopFK中的K315-R316位点氨基酸普遍存在单宁酶中(图1)。不同来源的单宁酶在该区域中表现出较强的趋异进化,其中米曲霉单宁酶(ABJ51876.1)差异最大,除在该区域有2 个连续的Kex2酶切位点外,同时还有较长的Loop结构,这表明AfTan中的Kex2位点对酶的影响很可能与之有明显差异。
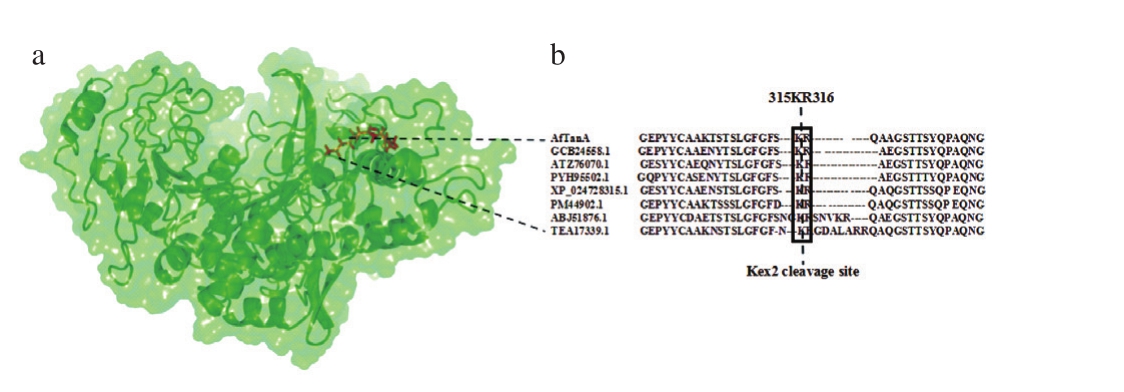
图1 使用I-TASSER构建的AfTanA分子模型(a)及Kex2位点(b)分析
Fig. 1 Molecular model of AfTanA constructed using the I-TASSER server (a) and analysis of Kex2 sites (b)
2.2 Kex2位点突变体的构建
采用一步式定点突变对afTan基因进行突变,对测序结果分析,分别成功构建突变pMDTM19T-afTanR316A、pMDTM19T-afTanΔKR克隆载体。随后,将突变基因分别连接至pPIC9K质粒中,并成功转入GS11中,经过对阳性克隆子诱导表达,各筛选出1 株高产菌株。
2.3 突变体的诱导表达及SDS-PAGE分析
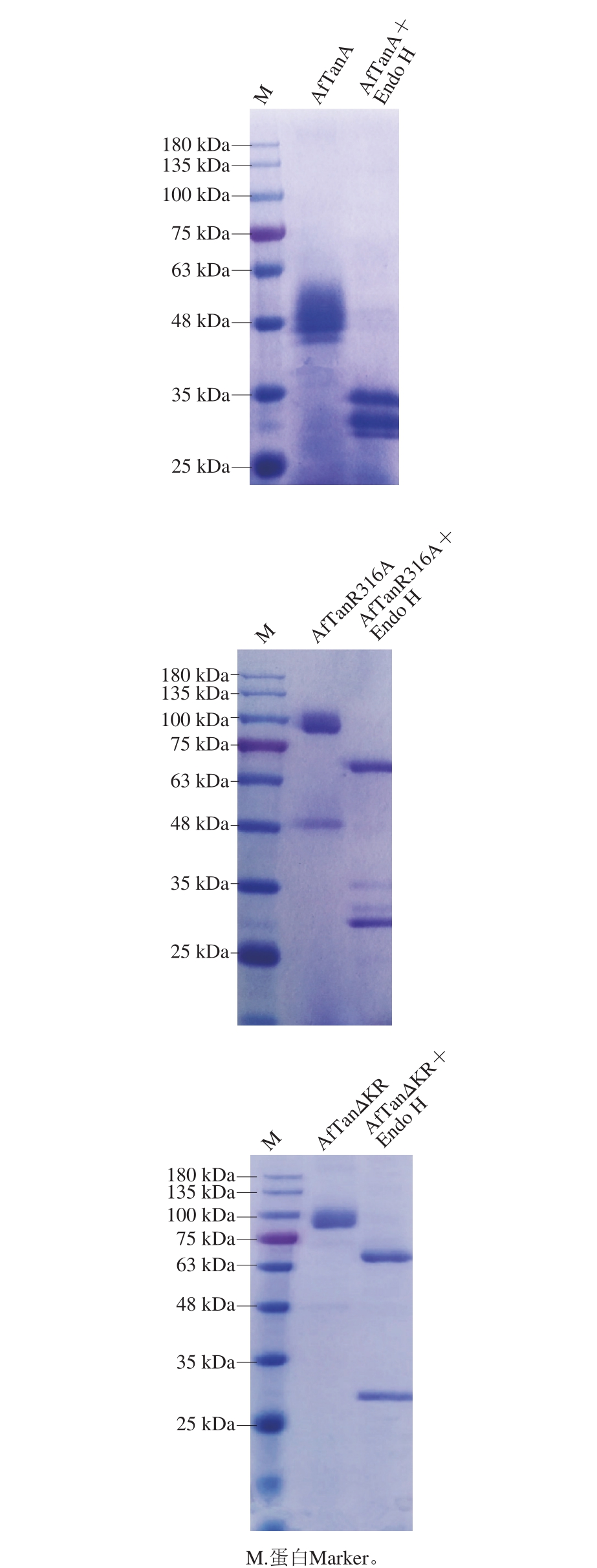
图2 野生型AfTanA及其突变体的SDS-PAGE分析
Fig. 2 SDS-PAGE analysis of wild-type AfTanA and mutants
将重组菌株按1.3.5节方法进行培养和诱导表达之后,对AfTanR316A和AfTanΔKR发酵液进行酶活力测定,25 ℃培养2 d发酵液中单宁酶活力分别为793 U/mL和830 U/mL。
通过对比野生型AfTanA、突变体AfTanR316A和AfTanΔKR发酵液SDS-PAGE结果(图2),发现野生型发酵产物在约45~60 kDa区域内处出现蛋白条带,明显低于理论分子质量(61.9 kDa);而突变体AfTanR316A和AfTanΔKR样品全部在100 kDa出现目标蛋白条带,分子质量明显偏大,这与野生型结果差异明显。分别对上述3 种酶经去糖基化酶Endo H处理,分子质量均不同程度变小,并且从结果中能明显发现野生型单宁酶是由2 个亚基组成(其分子质量分别为31.7 kDa和30.4 kDa),而2 个突变体均未出现类似的现象,表明Kex2位点突变体对Kex2蛋白酶的抗性明显增强。经去糖基化处理后,两突变体的分子质量均为70 kDa左右,较理论值大10kDa左右。经NetNGlyc 1.0分析,单宁酶AfTanA中具有8 个潜在的N-糖基化位点,经NetOGlyc 4.0分析AfTanA中含有14 处O-糖基化位点,表明单宁酶AfTanA的糖基化修饰使其分子质量明显增大。
2.4 突变体AfTanR316A和AfTanΔKR酶学特性分析
为探究Kex2酶切位点(K315-R316)对突变体酶学特性的影响,对2 个突变体的酶学特性进行测定,结果如图3所示。
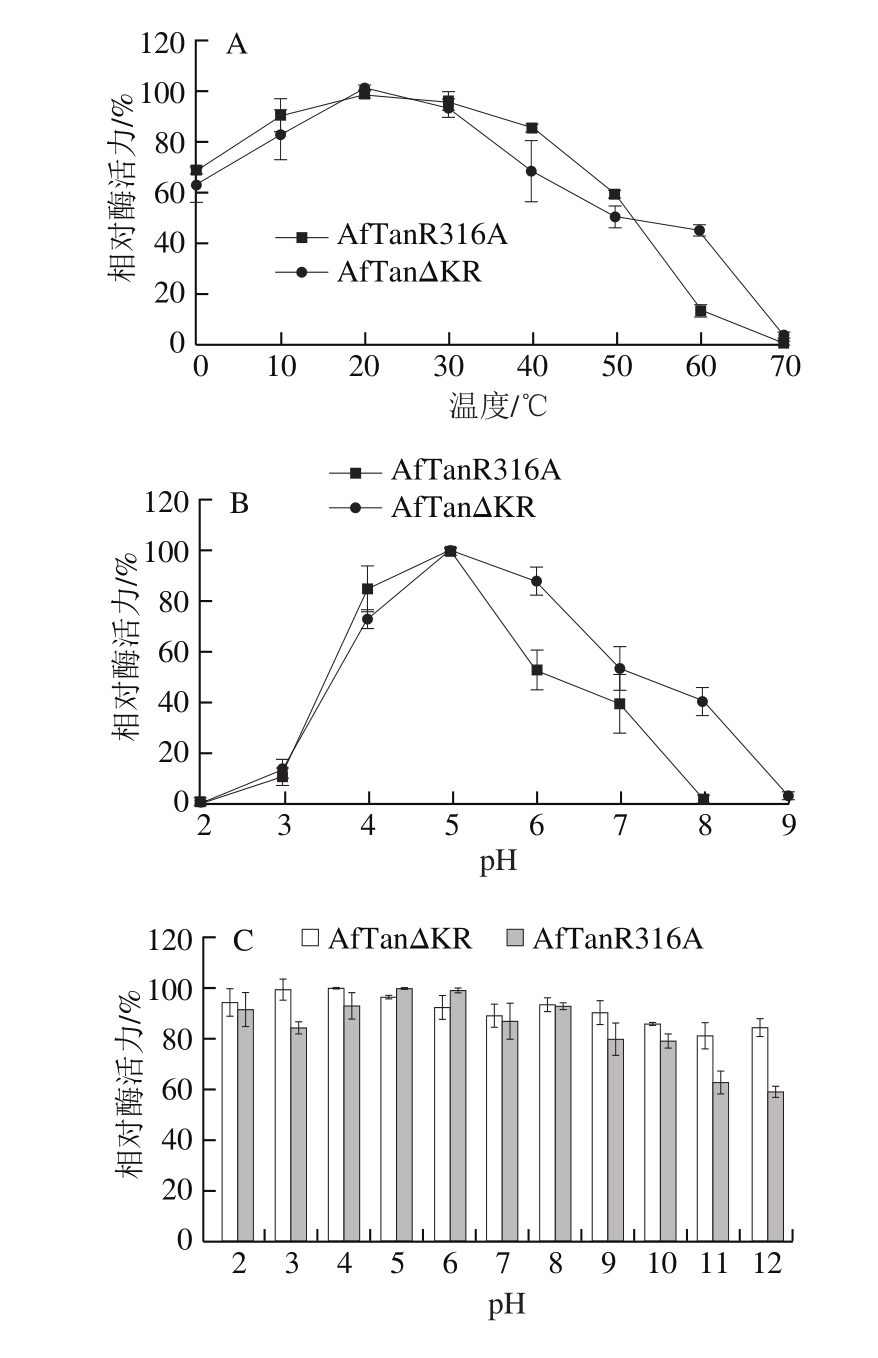
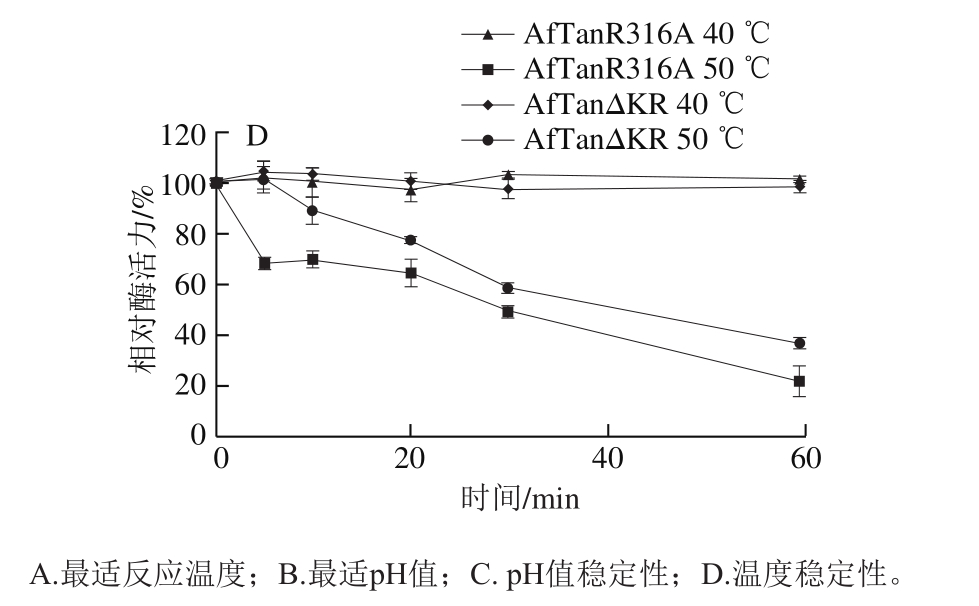
图3 单宁酶突变体的酶学性质比较分析
Fig. 3 Characterization of AfTanR316A and AfTanΔKR
由图3A可知,突变体在0~70 ℃范围内均有活性,最适反应温度均为20 ℃,属于低温酶。在反应温度为0 ℃时,突变体AfTanR316A和AfTanΔKR的酶活力分别维持68%和63%以上,在60 ℃条件下,突变体AfTanR316A能够维持10%左右酶活力,而突变体AfTanΔKR则表现出40%左右的酶活力。由图3B可知,突变体AfTanR316A和AfTanΔKR的pH值反应范围分别为2.0~8.0和2.0~9.0,最适反应pH值均为5.0左右。整体而言,在pH 2.0~5.0区间内,突变体AfTanR316A较AfTanΔKR活性高,而在pH 5.0~9.0区间内时,突变体AfTanΔKR较AfTanR316A活性高。由图3C可知,2 个突变体在pH值稳定性方面存在差异。在pH 2.0~12.0分别处理1 h后,突变体AfTanR316A和AfTanΔKR分别能够维持60%和85%以上酶活力。突变体AfTanR316A在pH 4~8区间内相对稳定,能够达到85%以上酶活力,而在碱性范围内,酶活力大幅度降低,在pH值12.0处理1 h后,AfTanR316A酶活力损失40%;由图3D可知,2 个突变体在40 ℃处理时,酶相对稳定,基本没有活性的损失。50 ℃处理条件,2 个突变体的热稳定性能差异明显,尤其当处理10 min以内时,AfTanΔKR能够维持90%以上活性,而AfTanR316A则维持70%左右活性,突变体AfTanΔKR表现出相对较高的稳定性,这表明“KR”位点不仅可以影响AfTan对Kex2酶的敏感性,同样对酶蛋白的热稳定性造成了影响,这很可能是“KR”所处的Loop结构的改变所造成的。Loop结构具有较强的柔性,继而会增加蛋白空间结构的摇摆性,而Loop结构中氨基酸的缺失,会使得Loop结构的刚性增强,继而提高酶的热稳定性。
2.5 金属离子和化学试剂对酶活力的影响及动力学参数
如表2所示,离子浓度对酶活力影响存在差异,且不同离子种类也存在较大差异。总体而言,两种突变体普遍被金属离子和化学试剂抑制,且高浓度条件(5 mmol/L)下抑制更加明显,而突变体AfTanΔKR较AfTanR316A受金属离子和化学试剂影响大。Fe3+对2 个突变体酶活力的抑制效应最显著,在高浓度下,对突变体AfTanR316A和AfTanΔKR能够抑制76%和97%酶活力。在低浓度(1 mmol/L)的条件下,除Fe3+外,其他金属离子和化学试剂均未对突变体AfTanR316A酶活力造成影响,而突变体AfTanΔKR均不同程度受到15%~80%抑制,Mg2+对酶活力影响最低。在高浓度(5 mmol/L)条件下,除Li+外,其他金属离子和化学试剂均对两突变体酶活力造成显著影响。除Fe3+离子外,Mn2+和Zn2+对酶活力均能抑制50%左右。
表2 金属离子和化学试剂对突变体相对酶活力的影响
Table 2 Effects of metal ions and chemical reagents on the activities of mutants%
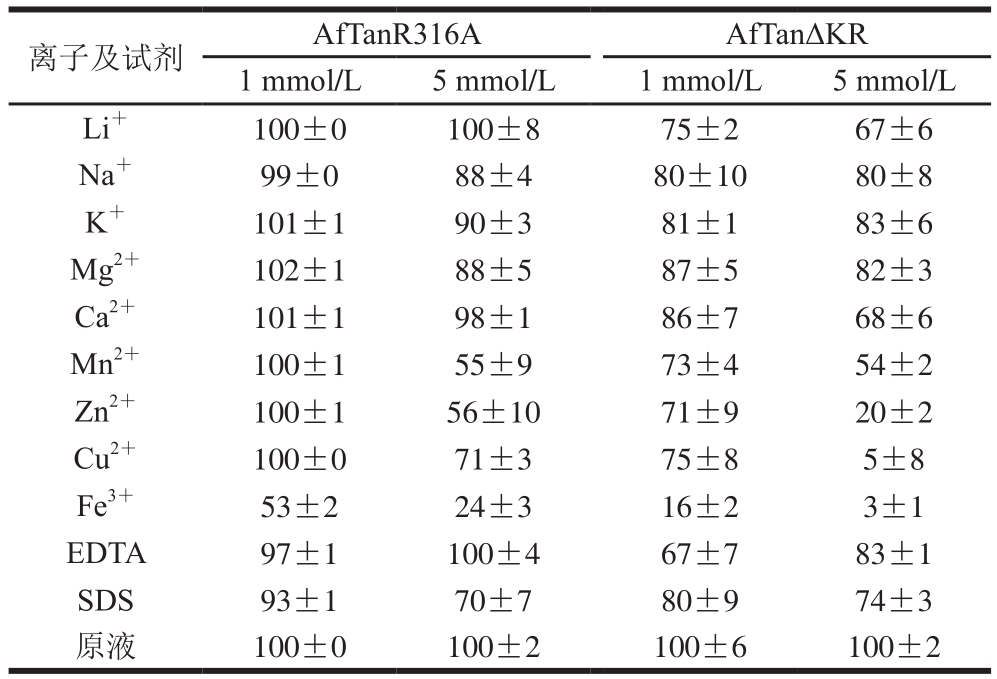
离子及试剂 AfTanR316A AfTanΔKR 1 mmol/L 5 mmol/L 1 mmol/L 5 mmol/L Li+ 100±0 100±8 75±2 67±6 Na+ 99±0 88±4 80±10 80±8 K+ 101±1 90±3 81±1 83±6 Mg2+ 102±1 88±5 87±5 82±3 Ca2+ 101±1 98±1 86±7 68±6 Mn2+ 100±1 55±9 73±4 54±2 Zn2+ 100±1 56±10 71±9 20±2 Cu2+ 100±0 71±3 75±8 5±8 Fe3+ 53±2 24±3 16±2 3±1 EDTA 97±1 100±4 67±7 83±1 SDS 93±1 70±7 80±9 74±3原液 100±0 100±2 100±6 100±2
以没食子酸甲酯为底物,经动力学曲线回归方程计算,AfTanR316A Km为1.149 mmol/L,Vmax为10.427 mmol/(L·min);AfTanΔKR Km为1.46 mmol/L,Vmax为35.84 mmol/(L·min)。两者的Km差异不明显,但是Vmax改变较大,AfTanΔKR的催化提高了2 倍左右。结果表明,K315-R316位点不仅可以对酶的稳定性有影响,对于酶的催化效率影响也较为显著。
2.6 突变单宁酶在柿子汁中的应用
柿子中富含单宁物质,经水解可生成儿茶素没食子酸酯、没食子儿茶素和没食子儿茶素没食子酸酯等小分子的酚类化合物[19],这些物质具有较强的生物活性。本研究通过测定野生型单宁酶AfTanA和2 个突变体AfTanR316A和AfTanΔKR处理柿子后的多酚类物质变化,探讨在柿子汁加工中的应用潜力,结果如图4所示。
柿子汁中多酚经单宁酶处理后差异变化较明显,2 种突变体表现出与野生型单宁酶相似的催化效果。多酚含量平均提高约50%(约43 mg/L),这是由于大分子多酚物质(单宁)降解为小分子的酚类化合物所致,从而显著增强柿子汁多酚含量,突变体酶同野生单宁酶一样可应用在柿子果汁的加工中。
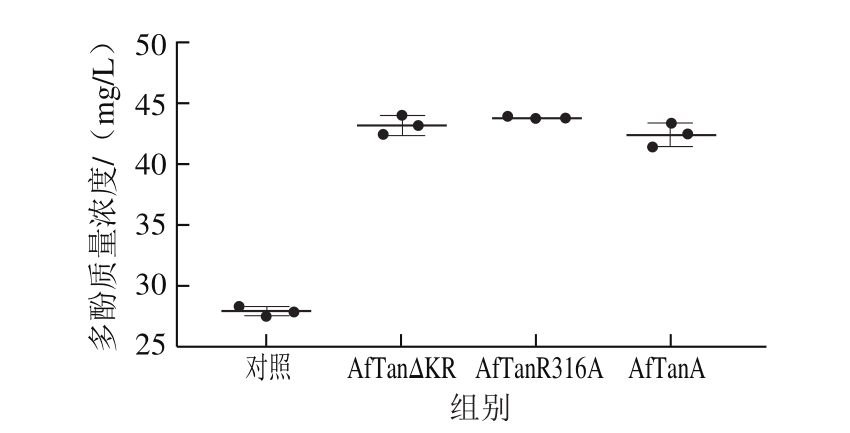
图4 柿子汁水解前后多酚类物质含量分析
Fig. 4 Total phenolic concentration of persimmon juice before and after hydrolysis with wild-type AfTanA and mutants, separately
3 讨 论
目前,巴斯德毕赤酵母GS115表达系统能够使外源蛋白被正确修饰,己成功对上百种外源基因进行了表达,是最成熟的真核表达系统之一。随着研究不断深入发现,单宁酶是由2 个或2 个以上亚基单位(30 kDa和34 kDa)连接组成一个蛋白分子质量范围为50~320 kDa的多聚体。其中,造成这2 个亚单位产生的原因是由于Kex2蛋白酶的切割[20]。Kex2蛋白酶是毕赤酵母内源性蛋白酶,主要在蛋白合成加工过程中发挥作用[21],而该酶对外源蛋白的过度切割,必然会影响到蛋白的稳定性和活性,因此探索单宁酶中的Kex2位点对酶学特性的影响意义重大。
经分析,两种突变体AfTanR316A和AfTanΔKR的电泳条带都显现为单一的电泳条带,表明AfTanA中Kex2位点(K315-R316)的替换和缺失都使得酶对Kex2蛋白酶抗性明显增强,而这与Koseki等[15]发现Kex2位点氨基酸的精氨酸替换并不能增强单宁酶AoTanA对Kex2蛋白酶的抗性结论不一致。通过对这2 个单宁酶结构分析,两者的氨基酸一致性只有21%,这使得空间结构上存在差异。进一步分析发现单宁酶AoTanA中存在2 个Kex2位点(Lys310-Arg311,Lys315-Arg316),而单宁酶AfTanA仅存在1 个Kex2位点(Lys315-Arg316)。虽然它们全部处在LoopFK区域中,但是单宁酶AoTanA较单宁酶AfTanA长7 个氨基酸,这使得单宁酶AoTanA中的该区域暴露在蛋白的表面较多,更容易被Kex2蛋白酶所识别切割。突变菌株的发酵液中单宁酶活力较野生AfTanA提高了12%和22%左右,进一步说明Kex2位点的改造有利于单宁酶的发酵生产。
本课题组前期己对AfTanA进行了异源表达和性质测定,通过对比AfTanA、AfTanR316A和AfTanΔKR的酶性质发现,突变体和野生型单宁酶的酶学性质差异明显。如单宁酶AfTanA的最适反应温度为40 ℃,而两种突变体最适反应温度均为20 ℃,由常温酶转变为低温酶[22]。大部分己报道的单宁酶最适反应温度范围为30~60 ℃,最适pH值为5.0~6.0,单宁酶活力能够稳定的pH值范围为3.0~8.0[23-24]。Fuentes等[25]从黑曲霉GH1中首次获得了嗜冷单宁酶,而随后鲜有低温单宁酶的报道。本研究分析造成反应温度发生改变的原因,很可能是由于野生型单宁酶AfTanA中2 个亚基(Kex2蛋白酶切割产物)通过C202-C502间的二硫键连接,而突变后的两蛋白片段是由高键能的肽键所连接,同时精氨酸的缺失使得结构中的次级键数目大大减少,继而该区域柔性增强,更有利于酶适应低温的反应条件[26]。因此,K315-R316位点可以作为温度突变体相关研究的选择位点。参考己报道单宁酶的晶体结构可知,单宁酶AftanA可以分为“Lid”和“Catalytic”2 个模块,并且具有保守的“CS-D-HC”序列,相似的结构也出现在脂肪酶中[27]。本研究单宁酶AfTanA中的Kex2位点(K315-R316)位于“Lid”模块LoopFK区域中,该区域与酶的催化效率和稳定性有较大相关性。Xiao Xunjun等[28]研究发现脂肪酶中的“Lid”模块虽然不是酶的催化区域,但是在底物的接合和产物的释放过程中发挥着重要作用。Johnson等[29]在探究磷酸烯醇丙酮酸羧激酶中的“Lid”模块中的Loop结构功能时,同样发现该结构与酶的催化效率有很大相关性。因此,Kex2酶切位点(K315-R316)对AftanA酶学性质的影响,很可能该位点所处的Loop区域结构的特性所造成的[30],而内在的分子机制还需进一步探明。
经对突变体和野生型单宁酶在柿子汁的应用对比分析发现,Kex2位点(K315-R316)的单点替换突变AfTanR316A和双点缺失突变AfTanΔKR对柿子中多酚物质(单宁)的降解能力并未发生改变,具有野生型单宁酶相同的应用效果。
本研究通过对单宁酶AfTanA中Kex2蛋白酶位点(K315-R316)对酶性质的影响分析,明确该位点对于酶的催化效率和稳定性影响较大,双点的缺失突变AfTanΔKR单宁酶表现出更加优良的酶学特性,具有在食品工业中发挥巨大作用的潜力。
[1] GOVINDARAJAN R K, REVATHI S, RAMESHKUMAR N, et al.Microbial tannase: current perspectives and biotechnological advances[J]. Biocatalysis and Agricultural Biotechnology, 2016, 6(1):168-175. DOI:10.1016/j.bcab.2016.03.011.
[2] AGUILAR C N, RODRÍGUEZ R, GUTIÉRREZ G, et al. Microbial tannases: advances and perspectives[J]. Applied Microbiology and Biotechnology, 2007, 76(1): 47-59. DOI:10.1007/s00253-007-1000-2.
[3] 张帅, 曹庸, 梁晓莹, 等. 黑曲霉N5-5单宁酶的纯化及酶学性质测定[J].食品科学, 2017, 38(6): 148-152. DOI:10.7506/spkx1002-6630-201706022.
[4] 谷新晰, 卢海强, 刘亚娟, 等. 1 株产单宁酶嗜热真菌的鉴定、酶学性质分析及碳水化合物活性酶表达[J]. 食品科学, 2018, 39(1):88-93. DOI:10.7506/spkx1002-6630-201818014.
[5] WU C, ZHANG F, LI L, et al. Novel optimization strategy for tannase production through a modified solid-state fermentation system[J].Biotechnology for Biofuels, 2018, 11: 92. DOI:10.1186/s13068-018-1093-0.
[6] RIVAS D L B, RODRÍG H, ANGUITA J, et al. Bacterial tannases:classification and biochemical properties[J]. Applied Microbiology and Biotechnology, 2019, 103(2): 603-623. DOI:10.1007/s00253-018-9519-y.
[7] LIU F, WANG B, YE Y, et al. High level expression and characterization of tannase tan7 using Aspergillus niger SH-2 with low-background endogenous secretory proteins as the host[J].Protein Expression and Purification, 2018, 144: 71-75. DOI:10.1016/j.pep.2017.11.003.
[8] HATAMOTO O, WATARAI T, KIKUCHI M, et al. Cloning and sequencing of the gene encoding tannase and a structural study of the tannase subunit from Aspergillus oryzae[J]. Gene, 1996, 175(12): 215-221. DOI:10.1016/0378-1119(96)00153-9.
[9] KANPIENGJAI A, UNBAN K, NGUYEN T H, et al. Expression and biochemical characterization of a new alkaline tannase from Lactobacillus pentosus[J]. Protein Expression and Purification, 2019,157(1): 36-41. DOI:10.1016/j.pep.2019.01.005.
[10] TAKUYA K, KYOTARO I, KATSUTO S, et al. Characterization of a novel Aspergillus oryzae tannase expressed in Pichia pastoris[J].Journal of Bioscience and Bioengineering, 2018, 126(5): 553-558.DOI:10.1016/j.jbiosc.2018.05.010.
[11] REVERÓN I, JIMÉNEZ N, CURIEL J A, et al. Differential gene expression by Lactobacillus plantarum WCFS1 in response to phenolic compounds reveals new genes involved in tannin degradation[J].Applied and Environmental Microbiology, 2017, 83(7): e03387-16.DOI:10.1128/AEM.03387-16.
[12] YANG Z, ZHANG Z. Engineering strategies for enhanced production of protein and bio-products in Pichia pastoris: a review[J].Biotechnology Advances, 2017, 36(1): 182-195. DOI:10.1016/j.biotechadv.2017.11.002.
[13] MANDUJANO G V, VILLA T L, ANDUCHO R M A, et al. Secreted fungal aspartic proteases: a review[J]. Revista Iberoamericana De Micologia, 2016, 33(2): 76-82. DOI:10.1016/j.riam.2015.10.003.
[14] SREENIVAS S, KRISHNAIAH S M, MOHAN A H S, et al. Disruption of KEX1 gene reduces the proteolytic degradation of secreted twochain Insulin glargine in Pichia pastoris[J]. Protein Expression and Purification, 2016, 118: 1-9. DOI:10.1016/j.pep.2015.10.002.
[15] KOSEKI T, OTSUKA M, MIZUNO T, et al. Mutational analysis of Kex2 recognition sites and a disulfide bond in tannase from Aspergillus oryzae[J]. Biochemical and Biophysical Research Communications,2017, 482(4): 1165-1169. DOI:10.1016/j.bbrc.2016.12.006.
[16] SHARMA S, BHAT T K, DAWRA R K. A spectrophotometric method for assay of tannase using rhodanine[J]. Analytical Biochemistry,2000, 279(1): 85-89. DOI:10.1006/abio.1999.4405.
[17] SUZUKI K, HORI A, KAWAMOTO K, et al. Crystal structure of a feruloyl esterase belonging to the tannase family: a disulfide bond near a catalytic triad[J]. Proteins Structure Function and Bioinformatics,2014, 82(10): 2857-2867. DOI:10.1002/prot.24649.
[18] REN B, WU M, WANG Q, et al. Crystal structure of tannase from Lactobacillus plantarum[J]. Journal of Molecular Biology, 2013,425(15): 2737-2751. DOI:10.1016/j.jmb.2013.04.032.
[19] 辛国贤, 凌敏, 李慧玲, 等. 柿子单宁提取新工艺及对5 类臭味化合物脱臭性能分析[J]. 中国食品学报, 2013, 13(5): 230-236.DOI:10.16429/j.1009-7848.2013.05.030.
[20] HATAMOTO O, WATARAI T, KIKUCHI M, et al. Cloning and sequencing of the gene encoding tannase and a structural study of the tannase subunit from Aspergillus oryzae[J]. Gene, 1996, 175(1/2):215-221. DOI:10.1016/0378-1119(96)00153-9.
[21] CUNNINGHAM K W, WICKNER W T. Yeast Kex2 protease and mannosyltransferase I are localized to distinct compartments of the secretory pathway[J]. Yeast, 1989, 5(1): 25-33. DOI:10.1002/yea.320050105.
[22] PARIKOVA A, FRONEK J P, VIKLICKY O. Bacterial tannases: production, properties and applications[J]. Revista Mexicana De Ingenieria Quimica, 2014, 13(1): 2579-2586.DOI:10.1177/0021998311401111.
[23] ZHANG S, GAO X, HE L, et al. Novel trends for use of microbial tannases[J]. Preparative Biochemistry, 2015, 45(3): 221-232. DOI:10.1 080/10826068.2014.907182.
[24] FELLER G, GERDAY C. Psychrophilic enzymes: molecular basis of cold adaptation[J]. CMLS Cellular and Molecular Life Sciences, 1997,53(10): 830-841. DOI:10.1007/s000180050103.
[25] FUENTES J A, AGUILAR C N, RODR A R, et al. Tannase sequence from a xerophilic Aspergillus niger strain and production of the enzyme in Pichia pastoris[J]. Molecular Biotechnology, 2015, 57(5):439-447. DOI:10.1007/s12033-014-9836-z.
[26] MERLINO A, KRAUSS I R, CASTELLANO I, et al. Structure and flexibility in cold-adapted iron superoxide dismutases: the case of the enzyme isolated from Pseudoalteromonas haloplanktis[J].Journal of Structural Biology, 2010, 172(3): 343-352. DOI:10.1016/j.jsb.2010.08.008.
[27] JAKOB S-J Ø, VIND J, MOROZ O V, et al. Controlled lid-opening in Thermomyces lanuginosus lipase-an engineered switch for studying lipase function[J]. Biochimicaet Biophysica Acta (BBA)-Proteins Proteomics, 2016, 1865(1): 20-27. DOI:10.1016/j.bbapap.2016.09.016.
[28] XIAO X J, LOWE M E. The β5-loop and lid domain contribute to the substrate specificity of pancreatic lipase-related protein 2[J]. Journal of Biological Chemistry, 2015, 290(48): 28847-28856. DOI:10.1074/jbc.M115.683375.
[29] JOHNSON T A, HOLYOAK T. The ω-loop lid domain of phosphoenolpyruvate carboxykinase is essential for catalytic function[J].Biochemistry, 2012, 51(47): 9547-9559. DOI:10.1021/bi301278t.
[30] WU M, WANG Q, MCKINSTRYW J, et al. Characterization of a tannin acyl hydrolase from Streptomyces sviceus with substrate preference for digalloyl ester bonds[J]. Applied Microbiology and Biotechnology, 2015,99(6): 2663-2672. DOI:10.1007/s00253-014-6085-9.