蜡样芽孢杆菌是一种条件致病菌,容易引起食源性疾病的爆发[1],对食品加工的耐受能力强,在多种市售的食品中均有检出[2-4]。根据国家食源性疾病监测网对中国食源性疾病爆发的监测资料分析,由蜡样芽孢杆菌引起的疾病占所有食源性微生物疾病的8.6%,排在第4位[5]。蜡样芽孢杆菌容易茹附在食品加工设备表面,且具有很高的生物被膜形成能力,在食品设备的清洗中难以被清除,从而成为该菌残留在终产品中的主要原因之一[6]。
生物被膜是细菌茹附在固体表面并被一种基质(包括胞外多糖)包裹在内的微生物聚集体。细胞外基质对其内的菌体具有保护作用,减少杀菌清洗剂的渗透,提高细菌对杀菌剂、紫外线、高温等不利因素的抗性[7-8]。生物被膜态细菌比浮游态微生物更难清除,是原料、产品以及人员的反复污染源[9]。研究证实,与浮游细菌相比形成生物膜的细菌对消毒剂和抗菌素的耐受性提高了1 000多倍[10]。因此,蜡样芽孢杆菌生物被膜的清除是食品安全控制的一大挑战。
在食品工业中,对微生物污染的控制主要依靠加工过程中的就地清洗(clean-in-place,CIP)系统,它是在无需拆分加工设备的前提下能够有效地清洗加工设备内表面的一种设备清洗程序[11]。由于生物被膜态菌的耐酸碱性增强,工厂中常用的CIP程序可能无法将蜡样芽孢杆菌彻底清除。有研究报道,标准的CIP程序(先用水洗,然后使用10.0 g/L氢氧化钠溶液65 ℃冲洗10 min,接着使用10.0 g/L硝酸溶液65 ℃冲洗10 min)对茹附在机械表面的蜡样芽孢杆菌的清除效果并不显著,仅能成功降低2 个数量级[12]。因此,对现有的CIP系统进行优化对于能有效清除蜡样芽孢杆菌生物被膜非常重要。
由于生物被膜对化学或物理的处理有一定的抗性,所以单纯的依靠酸碱冲刷对其的清除达不到理想的效果[13]。有研究表明,将酶、表面活性剂、杀菌剂等复合使用时,对生物被膜的清除效果显著高于单一成分的作用[14-15]。因此,将CIP中的酸碱清洗剂与其他物质联合使用,能更好更快地清除生物被膜,并且更好地适应生产环节,提高企业效益。
本实验对从食品生产线分离出的蜡样芽孢杆菌的生物被膜形成能力及酸碱耐受性进行评估,挑选出生物被膜形成能力强、酸碱耐受性高的菌株作为研究对象,通过正交试验探究能彻底清除蜡样芽孢杆菌生物被膜的最优酸碱CIP条件。并且进一步研究酸碱清洗剂与杀菌剂过氧乙酸联合使用对蜡样芽孢杆菌生物被膜的清除效果,探索最佳清洗条件,为生产过程中的清洗消毒试剂的选用参数提供科学依据。
1 材料与方法
1.1 材料与试剂
菌株A1~A4菌均分离自食品工厂生产线管道内,分离方法依照GB 4798.14—2014《食品微生物学检验 蜡样芽孢杆菌检验》,经过16S rRNA及理化指标鉴定为蜡样芽孢杆菌,菌种保藏号为CGMCC NO.16908。菌株活化参考Lin Yingying等[16]的方法。
标准菌株蜡样芽孢杆菌ATCC 14579(产生物被膜阴性对照菌株)、标准菌株蜡样芽孢杆菌ATCC 10987(产生物被膜阳性对照菌株) 中国科学院微生物所菌种保藏中心;不锈钢片(食品级304不锈钢,长宽为1 cm×1 cm) 李通金属有限公司。
蛋白胨、牛肉膏、氯化钠、胰蛋白胨、葡萄糖(均为分析纯) 北京易秀博谷生物科技有限公司;磷酸氢二钠、结晶紫、过氧乙酸、苯扎溴铵、次氯酸钠(均为分析纯) 科百奥生物技术公司。
营养琼脂培养基(pH 7.2):蛋白胨10 g、牛肉膏5 g、氯化钠5 g、蒸馏水1 000 mL,用于平板计数;脑心浸出液培养基(pH 7.4):胰蛋白胨20 g、氯化钠10 g、磷酸氢二钠5 g、葡萄糖4 g、牛心浸出粉10 g、蒸馏水1 000 mL,用于菌株的培养;0.10%结晶紫:结晶紫乙醇饱和液(结晶紫2 g溶于20 mL 95%乙醇中)20 mL,1%草酸铵溶液80 mL将两液混匀置24 h后过滤即可;0.01 mol/L磷酸缓冲液溶液:KCl 0.2 g、NaCl 8.5 g、Na2HPO4·12H2O 2.9 g、KH2PO4 0.27 g、蒸馏水1 000 mL;中和剂:3.0%吐温-80和0.3%卵磷脂溶于0.01 mol/L磷酸缓冲液。
1.2 仪器与设备
ZWY-C2112培养振荡器 上海智城分析仪器制造有限公司;SmartspecTM3000分光光度计 美国Bio-Rad公司;SPX-250B-Z生化培养箱 上海博迅实业有限责任公司医疗设备厂;LMS 780共聚焦显微镜 德国卡尔·蔡司公司。
1.3 方法
1.3.1 蜡样芽孢杆菌生物被膜的制备
参照Lin Yingying等[16]的方法进行。
1.3.2 生物被膜形成能力评价
采用结晶紫染色法[17]进行评价。
1.3.3 生物被膜态菌耐酸碱性测定
耐碱性测定:将培养72 h含有菌膜的不锈钢片置于2.00%的氢氧化钠溶液中,80 ℃作用15 min。无菌水冲洗后将不锈钢片放入己灭菌的15 mL离心管中,管内含有0.5 g的玻璃珠(100~150 μm),涡旋振荡1 min。进行平板计数。
耐酸性测定:将培养72 h含有菌膜的不锈钢片置于1.50%的硝酸溶液中,在80 ℃作用15 min。无菌水冲洗后将不锈钢片放入以灭菌的15 mL离心管中,管内含有0.5 g的玻璃珠(100~150 μm),涡旋振荡1 min。进行平板计数。耐受性(D)按下式计算:
式中:A为未处理不锈钢片上的菌数;B为处理后不锈钢片的菌数;t为作用时间/min。
1.3.4 不锈钢片上活菌数的测定
不锈钢片经过不同的CIP程序处理后,将不锈钢片置于无菌的15 mL离心管中,内含0.5 g直径为100 μm的玻璃珠以及3 mL无菌磷酸缓冲液,旋涡振荡1 min后,在营养琼脂培养基上进行平板计数。
1.3.5 生物被膜的微观结构观察
生物被膜在黑暗中用碘化丙啶染色15 min,然后在共聚焦显微镜下观察其微观结构[18]。用氩离子激发荧光,激发波长为488 nm,40 倍镜,图片面积为220 mm(x轴)×220 mm(y轴),z轴扫描的宽度为0.92 μm。
1.3.6 各因素对蜡样芽孢杆菌生物被膜清除效果量效关系的单因素试验
1.3.6.1 氢氧化钠质量浓度
当氢氧化钠作用时间20 min、硝酸质量浓度15 g/L、硝酸作用时间20 min、整个CIP程序温度85 ℃时,改变氢氧化钠质量浓度分别为10、15 g/L和20 g/L,采用1.3.4节方法测定活菌数。
1.3.6.2 氢氧化钠作用时间
当氢氧化钠质量浓度20 g/L、硝酸质量浓度15 g/L、硝酸作用时间20 min、整个CIP程序温度85 ℃时,改变氢氧化钠作用时间分别为10、15 min和20 min,采用1.3.4节方法测定活菌数。
1.3.6.3 硝酸质量浓度
当氢氧化钠质量浓度20 g/L、氢氧化钠作用时间20 min、硝酸作用时间20 min、整个CIP程序温度85 ℃时,改变硝酸质量浓度分别为5、10、15 g/L,采用1.3.4节方法测定活菌数。
1.3.6.4 硝酸作用时间
当氢氧化钠质量浓度20 g/L、氢氧化钠作用时间20 min、硝酸质量浓度15 g/L、整个CIP程序温度85 ℃时,改变硝酸作用时间分别为10、15 min和20 min,采用1.3.4节方法测定活菌数。
1.3.7 正交试验设计
根据单因素试验结果,拟定4因素3水平正交试验,因素与水平设计见表1。
表1 正交试验因素与水平
Table 1 Factors and their coded levels used in orthogonal array design

水平D硝酸作用时间/min 1 15 10 10 10 2 17.5 15 12.5 15 3 20 20 15 20因素A氢氧化钠质量浓度/(g/L)B氢氧化钠作用时间/min C硝酸质量浓度/(g/L)
1.3.8 酸碱清洗剂与过氧乙酸联合使用对蜡样芽孢杆菌生物被膜清除效果的量效关系
采用目前食品加工厂普遍使用的CIP程序,该CIP程序为氢氧化钠质量浓度15 g/L、氢氧化钠作用时间10 min、硝酸质量浓度10 g/L、硝酸作用时间10 min、整个CIP程序温度85 ℃基础上,在酸洗步骤后加入过氧乙酸清洗的步骤,过氧乙酸的质量浓度分别为1、2 g/L和3 g/L。采用1.3.4节方法测定活菌数。
1.4 数据统计分析
实验数据以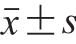 表示,利用SPSS 20.0软件分析各组之间的差异,采用单因素方差分析(One-way ANOVA)并伴随Duncan多重比较检验组间差异,P<0.05,差异显著。
表示,利用SPSS 20.0软件分析各组之间的差异,采用单因素方差分析(One-way ANOVA)并伴随Duncan多重比较检验组间差异,P<0.05,差异显著。
2 结果与分析
2.1 蜡样芽孢杆菌的生物被膜形成能力及酸碱耐受性

图1 蜡样芽孢杆菌在不锈钢片上的生物被膜形成能力
Fig. 1 Biofilm formation ability of B. cereus on stainless steel sheets
表2 蜡样芽孢杆菌对15 g/L氢氧化钠和10 g/L硝酸在85 ℃的耐受性
Table 2 Tolerance of the biofilm of B. cereus to 15 g/L NaOH and 10 g/L HNO3 at 85 ℃

菌株 耐受性/min 15 g/L氢氧化钠 10 g/L硝酸A1 10.57±0.48 6.09±0.02 A2 9.81±0.22 6.05±0.18 A3 5.58±0.22 6.74±0.07 A4 8.78±0.27 4.53±0.05 ATCC 10987 7.52±0.05 5.17±0.40 ATCC 14579 4.33±0.10 3.23±0.12
由图1可知,不同菌株的生物被膜形成能力存在差异,4 株菌株的生物被膜形成能力均低于阳性对照菌株ATCC 10987,均高于阴性对照菌株ATCC 14579,且在这4 株菌株中,菌株A1的生物被膜形成能力最强。从表2可知,4 株菌株对酸碱都存在耐受性,且对酸碱耐受性均高于生物被膜形成能力最低的菌株ATCC 14579,说明生物被膜的形成有利于提高菌株的酸碱耐受性,对菌体起保护作用。菌株A1对氢氧化钠的耐受性最高,菌株A3对硝酸的耐受性最高。在4 株菌中,菌株A1的生物被膜形成能力最强,对氢氧化钠的耐受性最高,对硝酸也有较高的耐受性,在经受CIP程序清洗之后容易残存于管道中形成生物被膜最终污染产品,所以菌株A1作为以下清除实验中的研究对象。
2.2 单因素试验结果
2.2.1 氢氧化钠质量浓度

图2 氢氧化钠质量浓度对蜡样芽孢杆菌生物被膜的清除效果
Fig. 2 Removal efficiency of different concentrations of NaOH on B. cereus biofilm
由图2可知,蜡样芽孢杆菌的清除效果随氢氧化钠质量浓度的增加而增加。当氢氧化钠质量浓度为10 g/L时,大多数的生物被膜己经被清除,不锈钢片上残留的菌数为2.08(lg(CFU/cm2)),减少了5.5(lg(CFU/cm2)),清除率为72.5%。随着氢氧化钠质量浓度的增加,生物被膜的清除率进一步提高,达到93.5%。当质量浓度增加到20 g/L时,蜡样芽孢杆菌生物被膜的清除效果最好,不锈钢片上未有蜡样芽孢杆菌检出。因此,氢氧化钠质量浓度范围选定15~20 g/L。
2.2.2 硝酸质量浓度

图3 硝酸质量浓度对蜡样芽孢杆菌生物被膜的清除效果
Fig. 3 Removal efficiency of different concentrations of HNO3 on B. cereus biofilm
由图3可知,蜡样芽孢杆菌的清除效果随硝酸质量浓度的增加而增加。当硝酸质量浓度为5 g/L时,大多数的生物被膜己经被清除,不锈钢片上残留的菌数为1.64(lg(CFU/cm2)),减少了5.94(lg(CFU/cm2)),清除率为78.3%。随着硝酸质量浓度的增加,生物被膜的清除率进一步提高,达到85.4%。当硝酸质量浓度为15 g/L时,蜡样芽孢杆菌生物被膜的清除效果最好,不锈钢片上未有蜡样芽孢杆菌检出。因此,硝酸质量浓度范围选定10~15 g/L。
2.2.3 氢氧化钠作用时间

图4 氢氧化钠作用时间对蜡样芽孢杆菌生物被膜的清除效果
Fig. 4 Effect of NaOH treatment time on removal of B. cereus biofilm
由图4可知,蜡样芽孢杆菌的清除效果随氢氧化钠作用时间的延长而增加。当氢氧化钠作用时间为10 min时,大多数的生物被膜己经被清除,不锈钢片上残留的菌数为0.84(lg(CFU/cm2)),减少了6.74(lg(CFU/cm2)),清除率为88.9%。随着氢氧化钠作用时间的延长,生物被膜的清除率进一步提高,达到92.7%。当作用时间延长到20 min时,蜡样芽孢杆菌生物被膜的清除效果最好,不锈钢片上未有蜡样芽孢杆菌检出。因此,氢氧化钠作用时间范围选定10~20 min。
2.2.4 硝酸作用时间

图5 硝酸处理时间对蜡样芽孢杆菌生物被膜的清除效果
Fig. 5 Effect of HNO3 treatment time on removal of B. cereus biofilm
由图5可知,蜡样芽孢杆菌的清除效果随硝酸作用时间的延长而增加。当硝酸作用时间为10 min时,大多数的生物被膜己经被清除,不锈钢片上残留的菌数为1.06(lg(CFU/cm2)),减少了6.52(lg(CFU/cm2)),清除率为86.0%。随着硝酸作用时间的延长,生物被膜的清除率进一步提高,达到94.6%。当作用时间延长到20 min时,蜡样芽孢杆菌生物被膜的清除效果最好,不锈钢片上未有蜡样芽孢杆菌检出。因此,氢氧化钠作用时间范围选定10~20 min。
2.3 优化CIP程序的正交试验结果
由表3可知,4 个因素对蜡样芽孢杆菌生物被膜清除效果的影响依次为硝酸质量浓度>氢氧化钠质量浓度>硝酸作用时间>氢氧化钠作用时间。由于正交表各列均被因素排满,表中未留下空列,故做重复实验,估算试验误差,进行方差分析,以确定各因素的显著性水平,方差分析结果见表4。通过F检验表明:4 个因素对蜡样芽孢杆菌的清除率都有显著的影响。综上,CIP程序清除蜡样芽孢杆菌生物被膜的最优条件为A2B3C3D3,即先使用17.5 g/L氢氧化钠溶液85 ℃冲洗20 min,然后使用纯水冲洗,接着使用15 g/L硝酸溶液在85 ℃冲洗20 min,最后使用纯水冲洗。按照以上条件做3 次平行实验,在不锈钢片上未检测出蜡样芽孢杆菌。该条件下蜡样芽孢杆菌的清除率达到100%,优于表3中任一组合的试验结果,此条件为最佳结果。
表3 不同CIP处理条件对蜡样芽孢杆菌生物被膜清除效果的正交试验设计及结果
Table 3 Orthogonal array design with experimental results for the optimization of CIP conditions

试验号 A氢氧化钠质量浓度/(g/L)清除率/%I II III 1 15 10 10 10 63.7 64.1 63.5 2 15 15 12.5 15 79.6 78.6 80.1 3 15 20 15 20 93.6 91.9 93.6 4 17.5 15 10 20 89.6 90.6 91.9 5 17.5 20 12.5 10 88.7 87.9 88.7 6 17.5 10 15 15 100 95.9 95.9 7 20 20 10 15 85.6 84.7 83.9 8 20 10 12.5 20 86.6 87.3 89.6 9 20 15 15 10 93.6 95.9 90.7 K1j 708.7 746.6 717.6 736.8 K2j 829.2 790.6 767.1 784.3 K3j 797.9 798.6 851.1 814.7¯K1j 78.74 82.96 79.73 81.87¯K2j 92.13 87.84 85.23 87.14 K3j 88.65 88.73 94.57 90.52 R 13.39 5.78 14.83 8.66 B氢氧化钠作用时间/min C硝酸质量浓度/(g/L)D硝酸作用时间/min
表4 正交试验方差分析
Table 4 Analysis of variance for the effect of CIP conditions on removal of B. cereus biofilm as per orthogonal array design

注:F0.05=3.63。
变异来源 平方和 自由度 均方 F值区组间 1.01 2 0.51 <1 A氢氧化钠质量浓度 868.76 2 434.38 190.51 B氢氧化钠作用时间 174.22 2 87.11 38.21 C硝酸质量浓度 1 012.17 2 506.08 221.96 D硝酸作用时间 342.55 2 171.27 75.11重复误差 36.51 16 2.28总变异 2 435.22 26
2.4 酸碱清洗剂与杀菌剂联合使用对蜡样芽孢杆菌生物被膜的清除效果
仅使用CIP程序中的酸碱清洗剂清除蜡样芽孢杆菌生物被膜,存在着酸碱浓度高,作用时间长的问题。为了减少酸碱清洗剂的使用量和清洗强度,本研究拟将酸碱清洗剂与杀菌剂联合使用的方法,从而使食品设备的清洗更高效、更环保。
2.4.1 3 种杀菌剂对蜡样芽孢杆菌生物被膜清除效果

图6 不同杀菌剂对蜡样芽孢杆菌生物被膜的清除效果
Fig. 6 Removal efficiency of different disinfectants on B. cereus biofilm
苯扎溴铵、次氯酸钠、过氧乙酸均是食品工厂中经常使用的杀菌剂。由图6可知,菌株A1不同杀菌剂的耐受性不同。在3 种杀菌剂中,蜡样芽孢杆菌生物被膜清除效果最好的是过氧乙酸,接着是苯扎溴铵,效果最差是次氯酸钠,它们对蜡样芽孢杆菌生物被膜的清除率依次为64.6%、56.9%、54.4%。因此,选用过氧乙酸与CIP酸碱清洗剂联合使用。
2.4.2 CIP清洗与过氧乙酸联合使用清除蜡样芽孢杆菌生物被膜

图7 CIP与过氧乙酸联合使用对蜡样芽孢杆菌生物被膜的清除效果
Fig. 7 Removal efficiency of CIP regime combined with peracetic acid on B. cereus biofilm
由图7可知,蜡样芽孢杆菌的清除效果随过氧乙酸质量浓度的增加而增加。当过氧乙酸质量浓度为1 g/L时,大多数的生物被膜己经被清除,不锈钢片上残留的菌数为2.36(lg(CFU/cm2)),减少了5.09(lg(CFU/cm2)),清除率为68.3%。随着过氧乙酸质量浓度的增加,生物被膜的清除率进一步提高,达到87.2%。当质量浓度增加到3 g/L时,蜡样芽孢杆菌生物被膜的清除效果最好,不锈钢片上未有蜡样芽孢杆菌检出。因此,CIP清洗与过氧乙酸联合使用的程序为先使用15 g/L氢氧化钠溶液85 ℃冲洗10 min,然后使用纯水冲洗,接着使用10 g/L硝酸溶液85 ℃冲洗10 min,然后使用3 g/L过氧乙酸溶液25 ℃冲洗10 min,最后使用中和剂冲洗。
2.4.3 CIP清洗与过氧乙酸联合使用前后蜡样芽孢杆菌生物被膜的微观结构

图8 经过CIP与过氧乙酸联合处理后的蜡样芽孢杆菌在共聚焦显微镜下的微观结构
Fig. 8 Confocal laser scanning microscopic images of B. cereus biofilms treated with CIP combined with peracetic acid
如图8所示,蜡样芽孢杆菌生物被膜是非均匀的,由菌体缠绕聚合成的网状结构。未经过处理的生物被膜的厚度大约为30 μm,结构致密。经过CIP清洗处理后的生物被膜结构被破坏,仅余下单层的细菌,厚度约为10 μm。经过CIP清洗与过氧乙酸联合处理后的生物被膜几乎被完全清除,仅留下几个单独的菌体残留在不锈钢片上。从该结果看,CIP程序清洗与过氧乙酸联合使用能有效进一步地清除蜡样芽孢杆菌生物被膜,该结果也与活菌计数的结果相符合。
3 讨 论
蜡样芽孢杆菌在食品加工机械的表面上表现出较强的生物被膜形成能力,而生物被膜能够对其内的菌体起保护作用,降低清洗剂、杀菌剂对菌体的危害[19],生物被膜态细菌比浮游态细菌更难清除。生物被膜态细菌抗逆性的提高,使蜡样芽孢杆菌的清除成为食品加工中一个重大的挑战。CIP程序是在加工生产中控制与清除微生物一项基本且关键的措施。有报道蜡样芽孢杆菌生物被膜经CIP程序为先使用纯水冲洗,再使用5 g/L氢氧化钠溶液65 ℃冲洗10 min后,再使用纯水冲洗,仅能降低1 个数量级[20];经过程序为先使用15 g/L氢氧化钠溶液65 ℃冲洗30 min,再使用纯水冲洗洗,然后使用10 g/L硝酸溶液65 ℃冲洗10 min,最后用纯水冲洗处理后,菌数降低约5 个数量级[21]。因为菌体酸碱耐受性提高,它容易在CIP过程中存活下来,残留在机械表面上最后导致产品的污染。因此,探究能将蜡样芽孢杆菌彻底清除的CIP工艺对于食品加工过程是一项至关重要的任务。本研究中,通过正交试验探究清除蜡样芽孢杆菌的最佳CIP清洗程序,该程序为采用17.5 g/L氢氧化钠溶液85 ℃冲洗20 min,使用纯水冲洗,然后使用15 g/L硝酸溶液85 ℃冲洗20 min,最后使用纯水冲洗,能彻底清除不锈钢片上的蜡样芽孢杆菌,菌落数约降低7 个数量级,与其他优化方法相比,多降低2 个数量级[22-23],清除效率更高。
对于食品企业来说,降低清洗剂的浓度、缩短清洗的时间有利于企业利益。次氯酸钠为弱碱性氧化型杀菌剂,通过水解释放次氯酸氧化细胞内含巯基的酶,并损害细胞膜[24]。过氧乙酸为弱酸性氧化型杀菌剂,通过水解释放初生态氧使菌体蛋白变性,抑制细胞内酶的活性,而达到杀菌的目的[25-26]。苯扎溴铵为非氧化型杀菌剂,带正电荷,能够吸附在带负电荷细胞表面,其长链烷基能够刺破细胞膜,使菌体内容物外泄而达到杀菌目的[27]。过氧乙酸是食品工厂中常见的杀菌剂,具有广谱的抗菌作用[25]。过氧乙酸对清除生物被膜有显著的效果,金黄色葡萄球菌生物被膜再经0.3%过氧乙酸溶液处理15 s后,几乎100%的菌体细胞失活[28]。铜绿假单胞菌生物被膜经过1.61%过氧乙酸溶液处理15 min后,清除率可以达到100%[26]。有研究报道,在过氧乙酸、苯扎溴铵、过氧化氢、碘消灵和次氯酸钠中,对蜡样芽孢杆菌生物被膜清除作用最好的是过氧乙酸,最差为次氯酸钠[29-30],这与本实验结果一致。鉴于其清洁低毒特性与其对蜡样芽孢杆菌的清除效果高于其他杀菌剂,本实验进一步研究了CIP清洗剂与杀菌剂过氧乙酸联合使用对蜡样芽孢杆菌生物被膜的清除效果。当3 g/L的过氧乙酸与CIP联合使用后,能够达到彻底清除不锈钢片上蜡样芽孢杆菌生物被膜的效果,而且与从正交试验优化CIP清洗程序相比,降低酸碱清洗剂的使用浓度,缩短了整个CIP清洗程序的时间。
4 结 论
本实验从工厂生产线上分离出的蜡样芽孢杆菌的生物被膜形成能力及酸碱耐受性,并挑选出生物被膜形成能力最强、酸碱耐受性高的菌株A1作为正交试验的研究对象。从正交试验的结果发现,采用氢氧化钠质量浓度17.5 g/L、氢氧化钠作用时间20 min、硝酸质量浓度15 g/L、硝酸作用时间20 min清洗条件,可以彻底清除蜡样芽孢杆菌生物被膜。进而研究酸碱清洗剂与过氧乙酸联合使用对蜡样芽孢杆菌生物被膜的清除效果,得到的最佳清洗程序为先使用15 g/L氢氧化钠溶液85 ℃冲洗10 min,然后使用纯水冲洗,接着使用10 g/L硝酸溶液85 ℃冲洗10 min,然后使用3 g/L过氧乙酸溶液25 ℃冲洗10 min,最后使用中和剂冲洗。该程序在彻底清除蜡样芽孢杆菌生物被膜的同时,降低了酸碱清洗液的浓度、缩短了程序的清洗时间,为食品加工设备的清洗提供了一种更高效、更环保的方法。
[1] ZHANG Y, CHEN J, FENG C, et al. Quantitative prevalence,phenotypic and genotypic characteristics of Bacillus cereus isolated from retail infant foods in China[J]. Foodborne Pathogens & Disease,2017, 42(10): 43-51. DOI:10.1089/fpd.2017.2287.
[2] 张金兰, 鲁绯, 张伟伟, 等. 腐乳中蜡样芽孢杆菌污染情况的调查分析[J]. 中国酿造, 2010, 29(10): 15-18. DOI:10.3969/j.issn.0254-5071.2010.10.005.
[3] 吴海清, 陈庆森, 庞广昌, 等. 我国部分地区原料奶中蜡样芽孢杆菌污染情况调查[J]. 中国乳品工业, 2009, 37(9): 22-26. DOI:10.3969/j.issn.1001-2230.2009.09.007.
[4] ELHARIRY H M. Attachment strength and biofilm forming ability of Bacillus cereus on green-leafy vegetables: cabbage and lettuce[J]. Food Microbiology, 2011, 28(7): 1266-1274. DOI:10.1016/j.fm.2011.05.004.
[5] 褚小菊. 米饭中蜡样芽孢杆菌引起食物中毒的风险分析[J].粮食与饲料工业, 2011, 12(3): 12-15. DOI:10.3969/j.issn.1003-6202.2011.03.004.
[6] RIBIRO M C, MEG D S F, YOSHITERU K A, et al. Preconditioning of the stainless steel surface affects the adhesion of Bacillus cereus spores[J]. International Dairy Journal, 2017, 66: 108-114.DOI:10.1016/j.idairyj.2016.11.015.
[7] RAMALINGAM V, RAJARAM R, ANANTH S, et al. Development of thermostable amylase enzyme from Bacillus cereus for potential antibiofilm activity[J]. Bioorganic Chemistry, 2018, 77: 494-506.DOI:10.1016/j.bioorg.2018.02.014.
[8] FINK R, ODER M, EVA S, et al. Efficacy of cleaning methods for the removal of Bacillus cereus biofilm from polyurethane conveyor belts in bakeries[J]. Food Control, 2017, 80: 267-272. DOI:10.1016/j.foodcont.2017.05.009.
[9] KUMARI S, SARKAR P K. Optimisation of Bacillus cereus biofilm removal in the dairy industry using an in vitro model of cleaning-inplace incorporating serine protease[J]. International Journal of Dairy Technology, 2017, 2: 512-518. DOI:10.1111/1471-0307.12454.
[10] SOKUNROTANK S, LQBAL K J, et al. Biofilm formation in food industries: a food safety concern[J]. Food Control, 2013, 31(2):572-585. DOI:10.1016/j.foodcont.2012.12.001.
[11] BUABENG B E, MAFUKIDZE N, PAL J, et al. Study of water reuse opportunities in a large-scale milk processing plant through process integration[J]. Chemical Engineering Research and Design, 2017, 121:81-91. DOI:10.1016/j.cherd.2017.02.031.
[12] BREMER P J, FILLERY S, MCQUILLAN A J. Laboratory scale clean-in-place (CIP) studies on the effectiveness of different caustic and acid wash steps on the removal of dairy biofilms[J]. International Journal of Food Microbiology, 2006, 106(3): 254-262. DOI:10.1016/j.ijfoodmicro.2005.07.004.
[13] NIDHII G, COLIN H, ROSS P R, et al. The prevalence and control of Bacillus and related spore-forming bacteria in the dairy industry[J]. Frontiers in Microbiology, 2015, 6: 18-14. DOI:10.3389/fmicb.2015.01418.
[14] BENEZECH T, FAILLE C. Two-phase kinetics of biofilm removal during CIP: respective roles of mechanical and chemical effects on the detachment of single cells vs cell clusters from a Pseudomonas fluorescens biofilm[J]. Journal of Food Engineering, 2018, 219:121-128. DOI:10.1016/j.jfoodeng.2017.09.013.
[15] 刘珏玲, 杨伟峰, 王毅. 细菌生物膜与表面活性剂抗菌的研究进展[J]. 中国病原生物学杂志, 2016, 11(9): 858-860. DOI:10.13350/j.cjpb.160922.
[16] LIN Y Y, REN F, ZHAO L, et al. Genotypes and the persistence survival phenotypes of Bacillus cereus, isolated from UHT milk processing lines[J]. Food Control, 2017, 82: 48-56. DOI:10.1016/j.foodcont.2017.06.025.
[17] 马胜龙, 凡肖, 姚俊敏, 等. 苏云金芽胞杆菌XL6 BTXL6-11095基因对生物被膜相关表型的调控[J]. 中国生物防治学报, 2019, 35(1):55-64. DOI:10.16409/j.cnki.2095-039x.2019.01.009.
[18] FAILLE C, BENEZECH T, MIDELET B G, et al. Sporulation of Bacillus spp. within biofilms: a potential source of contamination in food processing environments[J]. Food Microbiology, 2014, 40: 64-74.DOI:10.1016/j.fm.2013.12.004.
[19] KLOTZ M, KRETSCHMER M, GOETZ A, et al. Importance of the biofilm matrix for the erosion stability of Bacillus subtilis NCIB 3610 biofilms[J].RSC Advances, 2019, 9(20): 11521-11529. DOI:10.1039/C9RA01955C.
[20] KUMRI S, SARKAR P K. Bacillus cereus hazard and control in industrial dairy processing environment[J]. Food Control, 2016, 69:20-29. DOI:10.1016/j.foodcont.2016.04.012.
[21] KUMARI S, SARKAR P K. In vitro model study for biofilm formation by Bacillus cereus, in dairy chilling tanks and optimization of cleanin-place (CIP) regimes using response surface methodology[J]. Food Control, 2014, 36(1): 153-158. DOI:10.1016/j.foodcont.2013.08.014.
[22] RYU J H, BEUCHAT L R. Biofilm formation and sporulation by Bacillus cereus on a stainless steel surface and subsequent resistance of vegetative cells and spores to chlorine, chlorine dioxide, and a peroxyacetic acid-based sanitizer[J]. Journal of Food Protection, 2005,68(12): 2614-2622. DOI:10.1089/cmb.2005.12.1328.
[23] BOYCE A, PITERINA A V, WALSH G. Assessment of the potential suitability of selected commercially available enzymes for cleaning-inplace (CIP) in the dairy industry[J]. Biofouling, 2010, 26(7): 837-850.DOI:10.1080/08927014.2010.522705.
[24] 华萍, 傅绍斌, 刘泽强, 等. 催化电解杀菌与次氯酸钠杀菌的对比[J]. 地质科技情报, 2005, 24(4): 91-93. DOI:10.3969/j.issn.1000-7849.2005.04.017.
[25] MARTIN-ESPADA M C, DORS A, BARTOLOME M C, et al.Peracetic acid disinfectant efficacy against Pseudomonas aeruginosa biofilms on polystyrene surfaces and comparison between methods to measure it[J]. LWT-Food Science and Technology, 2014, 56(1): 58-61.DOI:10.1016/j.lwt.2013.11.013.
[26] ELAINE B, KRISTA O, RICHARD S, et al. Evaluation of AISI Type 304 stainless steel as a suitable surface material for evaluating the efficacy of peracetic acid-based disinfectants against Clostridium difficile spores[J]. PLoS ONE, 2017, 12(10): e1087074. DOI:10.1371/journal.pone.0187074.
[27] LEE S H I, CAPPATO L P, CORASSIN C H, et al. Effect of peracetic acid on biofilms formed by Staphylococcus aureus and Listeria monocytogenes isolated from dairy plants[J]. Journal of Dairy Science,2015, 99(3): 2384-2390. DOI:10.3168/jds.2015-10007.
[28] WANG X, LIU Z, YE X, et al. A facile one-pot method to two kinds of graphene oxide-based hydrogels with broad-spectrum antimicrobial properties[J]. The Chemical Engineering Journal, 2015, 260: 331-337.DOI:10.1016/j.cej.2014.08.102.
[29] 范鑫丽, 李南薇, 高苏娟, 等. 5 种杀菌剂对蜡样芽孢杆菌生物被膜的杀灭[J]. 食品工业, 2016(7): 104-107.
[30] PENG J S, TSAI W C, CHOU C C. Inactivation and removal of Bacillus cereus by sanitizer and detergent[J]. International Journal of Food Microbiology, 2002, 77(1/2): 11-18. DOI:10.1016/s0168-1605(02)00060-0.