乳酸菌是一类无芽孢、革兰氏染色阳性细菌的总称,可利用碳源发酵产生乳酸。在乳酸菌中,乳杆菌是最大的一个属。乳杆菌一般利用葡萄糖和乳糖等还原糖作为碳源,但在某些环境下也可利用非还原糖如淀粉和蔗糖,通过产淀粉酶与蔗糖酶等酶系,将非还原糖转化为还原糖,以供自身利用[1],目前己有较多乳杆菌利用多糖或二糖作为碳源的文献报道。Lee等[2]从猪肠道内分离了20 株乳酸菌,通过观察3 种菌株生长过程中淀粉在肉汤培养基中的消失情况测定淀粉的水解情况,其中3 株乳杆菌所产淀粉酶拥有高酶活力,3 株菌中A-4和L23菌株确定为嗜酸乳杆菌,L9菌株为发酵乳杆菌。Kocabay等[3]研究了1 株可产β-淀粉酶的发酵乳杆菌,探究了其淀粉酶的最适温度及pH值。Giraud等[4]发现,从发酵木薯中分离得到的植物乳杆菌A6可以分解未发酵的木薯原淀粉,Humblot等[5]研究了植物乳杆菌A6发酵过程中淀粉代谢相关基因的表达及其所产淀粉酶的活性。Chookietwattana[6]研究了其分离所得的1 株植物乳杆菌MSUL 903,证实该菌株是一种高效的木薯淀粉水解乳酸菌。Panda等[7]通过响应面法优化了1 株植物乳杆菌 MTCC 1407在深层发酵下淀粉酶的产酶条件。赵志丹等[8]从健康仔猪肠道分离筛选出1 株具较强产淀粉酶能力的乳杆菌G8-5,经鉴定为罗伊氏乳杆菌。Bai Yuxiang等[9]对罗伊氏乳杆菌35-5在淀粉和蔗糖中形成的胞外多糖进行了表征,发现淀粉与蔗糖对罗伊氏乳杆菌35-5的胞外多糖形成有一定程度的影响。张莉力等[10]从自然发酵的甘薯酸浆中,分离筛选得到1 株能产淀粉酶的副干酪乳杆菌,命名为副干酪乳杆菌L1,孙竹萍等[11]进一步研究了温度与pH值对副干酪乳杆菌 L1所产淀粉酶活力的影响,优化了其产淀粉酶的条件。Padmavathi等[12]研究了乳杆菌sp G3_4_1TO2的产淀粉酶能力,与发酵乳杆菌相比其所产淀粉酶的活力更高,是一种潜在高产淀粉酶的益生菌。Hyeyeon等[13]提取并纯化了植物乳杆菌ST-III所产淀粉酶LpMA,发现该酶不仅可将直链淀粉和支链淀粉作为底物生产麦芽糖,还可将麦芽三糖、麦芽五糖作为底物。吴鹏[14]从发酵米浆中筛选出3 株干酪乳杆菌,验证其均可利用蔗糖作为碳源。
乳杆菌可利用淀粉作为碳源在大米淀粉体系中发酵,广泛应用于以淀粉为主要原料的发酵类食品中,如米发糕、米乳饮料、发酵米粉等[15-17]。乳杆菌利用淀粉的能力可在不加入或少加入其他碳源的情况下用于制作低糖型发酵食品,产品不仅更有利于健康,从工业化生产的角度还可以节省成本,简化生产步骤。乳杆菌在发酵过程中所产的细菌素可抑制其他微生物的生长[18],通过发酵还可消减米类制品中的重金属如镉等[19],从而提高产品的安全性。此外,乳杆菌发酵后的淀粉类食品如大米的理化特性会发生改变[20],可改善口感与营养成分。因而研究乳杆菌降解大米淀粉的能力具有一定的应用价值,可为制作大米发酵食品提供新的菌种和发酵工艺思路。籼米粉浆是制作传统大米发酵食品的一种前体,为了使籼米粉浆经发酵后的风味更为多样化,需要探究不同种类的产淀粉酶乳杆菌,及其在籼米粉浆中的生长状况。本研究通过预实验筛选3 株具有降解淀粉能力的乳杆菌为嗜酸乳杆菌14(Lactobacillus acidophilus 14,La)、干酪乳杆菌M(L. casei M,Lc)与植物乳杆菌115(L. plantarum 115,Lp),构建嗜酸乳杆菌-籼米粉浆发酵体系(L. acidophilus-indica rice flour slurry,La-IRFS),干酪乳杆菌-籼米粉浆发酵体系(L. casei-indica rice flour slurry,Lc-IRFS)和植物乳杆菌-籼米粉浆发酵体系(L. plantarum-indica rice flour slurry,Lp-IRFS),研究3 种乳杆菌在籼米粉浆体系中的单菌发酵过程,及其所产淀粉酶嗜酸乳杆菌淀粉酶(L. acidophilus-amylase,La-a)、干酪乳杆菌淀粉酶(L. casei-amylase,Lc-a)和植物乳杆菌淀粉酶(L. plantarum-amylase,Lp-a)的酶学特性。分析比较3 株乳杆菌在籼米粉浆中的生长能力,降解淀粉能力,产淀粉酶活力。同时,研究3 株乳杆菌所产淀粉酶的酶学特性,包括其最适反应温度和pH值、耐高温能力与pH值稳定性,以期对大米发酵食品的发酵工艺起一定指导作用。
1 材料与方法
1.1 材料与试剂
籼米粉 市售;La、Lc、Lp均保存于华南理工大学食品科学与工程学院实验室,直投式菌粉,活菌数分别为1.83×1010、6.34×1010、1.08×1011 CFU/g。
直链淀粉、支链淀粉(均为标准物) 北京北方伟业计量技术研究院;可溶性淀粉 赛默飞世尔科技公司;麦芽糖、葡萄糖 上海奥博生物试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)国药集团化学试剂有限公司;碘试剂 上海银碘化工有限公司;MRS培养基 广东环凯微生物科技有限公司。所有试剂均为分析纯。
1.2 仪器与设备
DGX-9243B-2干热灭菌器 上海福玛实验设备有限公司;XSP-104光学显微镜 宁波湛京光学仪器有限公司;SW-CJ-ECU超净工作台 苏州净化设备有限公司;LRH-70恒温生化培养箱 上海恒科仪器有限公司;HWS-24电热恒温水浴锅 上海齐欣科学仪器有限公司;pHS-25数显pH计 上海精密仪器有限公司;TGL-16gR高速冷冻离心机 上海安亭科学仪器厂;752N紫外-可见分光光度计 上海棱光技术有限公司。
1.3 方法
1.3.1 乳杆菌-籼米粉浆发酵体系的构建
籼米粉铺成薄层,于干热灭菌器中以180 ℃干热灭菌45 min,冷却后与无菌水以1∶1的质量比混合调成米浆,于超净工作台接入直投式乳杆菌菌粉La、Lc和Lp(接种量均为9×109 CFU/mL),于恒温培养箱发酵后得到乳杆菌-籼米粉浆体系La-IRFS、Lc-IRFS和Lp-IRFS,体系初始总淀粉质量分数为33.78%,直链淀粉质量分数为10.26%。
1.3.2 乳杆菌生长曲线测定
接种后取初始样,之后每隔2 h取一次样,采用GB 4789.35—2016《食品微生物学检验 乳酸菌检验》[21]方法测活菌数。
1.3.3 籼米粉灭菌前后及发酵后淀粉颗粒形态的观察
取适量灭菌前籼米粉于载玻片上,以50%乙醇溶液分散后,滴加1 滴0.01 mol/L碘试剂进行染色,滴加香柏油,以油镜观察淀粉颗粒形态;取适量灭菌后的籼米粉或发酵后的籼米粉浆于载玻片上,重复上述操作,对比灭菌前后及发酵前后淀粉颗粒形态的变化。
1.3.4 发酵前后体系淀粉含量变化分析
总淀粉含量的测定:采用酸水解法[22],样品除去脂肪和可溶性糖类,淀粉酸水解为还原性单糖后按还原糖测定并折算。取9 支25 mL具塞刻度试管,分别加入质量浓度为1 mg/mL的葡萄糖标准液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,蒸馏水2、1.8、1.6、1.4、1.2、1.0、0.8、0.6 mL,再各加入1.5 mL DNS液,配成不同葡萄糖含量的反应液,沸水浴5 min,冰浴冷却至室温,用蒸馏水定容至25 mL,混匀,在分光光度计上进行比色。于波长540 nm处测吸光度。以吸光度为纵坐标,葡萄糖质量(mg)为横坐标,绘制标准曲线:y=0.548 8x-0.009 2,R2=0.999 6。样品按酸水解法处理后在波长540 nm处读取吸光度,根据标准曲线计算葡萄糖含量,乘0.9折算为淀粉含量。
直链淀粉含量的测定:采用GB/T 15683—2008《大米直链淀粉含量的测定》[23]方法测定直链淀粉占总淀粉的比例。分别量取1 mg/mL直链淀粉标准溶液0、2、4、5、6、7 mL和1 mg/mL支链淀粉标准溶液18、16、14、13、12、11 mL于100 mL容量瓶中,各加入0.09 mol/L氢氧化钠溶液2 mL。另取1 个100 mL容量瓶,加入0.09 mol/L氢氧化钠溶液5 mL作空白。于各瓶中依次加入50 mL水、1 mL 1 mol/L乙酸溶液及2 mL碘试剂,用水定容后发色10 min,空白调零,在波长720 nm处读取吸光度。以直链淀粉含量为横坐标,吸光度为纵坐标,绘制标准工作曲线:y=0.021 0x+0.127 9,R2=0.999 4。待测样品按国标方法预处理,稀释1 倍后在波长720 nm处读取吸光度,根据标准曲线计算直链淀粉占比,乘2得样品直链淀粉含量。
1.3.5 淀粉酶粗酶活力的测定
采用DNS法测定总酶活力[24]。取7 支25 mL具刻度试管,分别加入1 mg/mL麦芽糖标准液0、0.1、0.2、0.4、0.6、0.8、1.0 mL,蒸馏水1、0.9、0.8、0.6、0.4、0.2、0 mL,再各加入1 mL DNS液,摇匀后沸水浴5 min,冷却后加蒸馏水定容至20 mL,在550 nm波长处比色测定吸光度,对应麦芽糖含量绘制得标准曲线:y=0.916 1x-0.016 4,R2=0.999 7。
粗酶液的提取:发酵籼米粉浆8 000 r/min、4 ℃离心15 min,取上清液即为粗酶液(含麦芽糖)。
酶活力的测定:粗酶液稀释10 倍后取1 mL与1 mL 1%淀粉标准溶液混合,加入1 mL DNS液,摇匀后沸水浴5 min,冷却至室温,定容至20 mL,测波长550 nm处吸光度,得麦芽糖含量A0。粗酶液稀释10 倍后取1 mL与1 mL 1%淀粉标准溶液混合,37 ℃放置1 h后加入1 mL DNS液,摇匀后沸水浴5 min,冷却至室温,定容至20 mL,测波长550 nm处吸光度,得麦芽糖含量A。
酶活力定义:每1 h从1 mL 1%淀粉标准溶液中释放出1 mg麦芽糖所需的酶量为1 个酶活力单位。计算公式如下:
式中:A为加酶处理1 h后麦芽糖量/mg;A0为原粗酶液中麦芽糖量/mg;N为总稀释倍数。
1.3.6 pH值与总酸的测定
pH值:使用pH计测定;总酸:采用GB 5009.239—2016《食品酸度的测定》[25]第二法测定。
1.3.7 酶学特性分析
温度对淀粉酶的影响:用1.3.5节方法测定酶活力,水浴锅温度分别设为30、35、40、45、50、55、60、65、70 ℃;pH值对淀粉酶的影响:用1.3.5节方法测定酶活力,粗酶液与淀粉标准溶液混匀后,将pH值分别调为3.0、4.0、5.0、6.0、7.0、8.0、9.0后再放入水浴锅中37 ℃放置1 h。
酶热稳定性:取粗酶液在50、60、70、80、90 ℃保温30、60、120、180 min后,用1.3.5节方法测定酶活力;酶pH值稳定性:取粗酶液分别将pH值调节为3.0、4.0、5.0、8.0、9.0后放置30、60、120、180 min,用1.3.5节方法测定酶活力。
La-a粗酶液提取于发酵6 h的La-IRFS,Lc-a粗酶液提取于发酵8 h的Lc-IRFS,Lp-a粗酶液提取于发酵8 h的Lp-IRFS,以相对酶活力作为最终结果。
1.4 数据处理
用Origin 9.0处理数据并绘制图表。
2 结果与分析
2.1 乳杆菌发酵过程分析
2.1.1 3 株乳杆菌的生长曲线
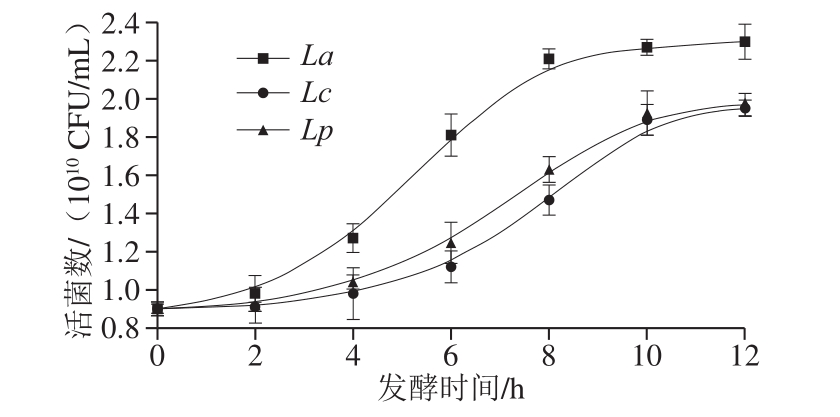
图1 3 株乳杆菌在籼米粉浆中的生长曲线
Fig. 1 Growth curves of three strains of Lactobacillus in indica rice flour slurry
由图1可得,3 株乳杆菌在籼米粉浆中生长状况良好,La活菌数增长速率明显快于Lc与Lp,在2~8 h阶段活菌数翻倍,在发酵8 h后生长开始趋于平缓,活菌数变化较小;Lc与Lp活菌数变化趋势相近,在2~8 h的阶段活菌数增长较快,但增长量明显小于La,发酵10 h后生长趋于平缓。在发酵12 h后La的活菌数可达2.3×1010 CFU/mL,Lc与Lp的活菌数皆达1.9×1010 CFU/mL。
2.1.2 灭菌及发酵前后淀粉颗粒形态的变化
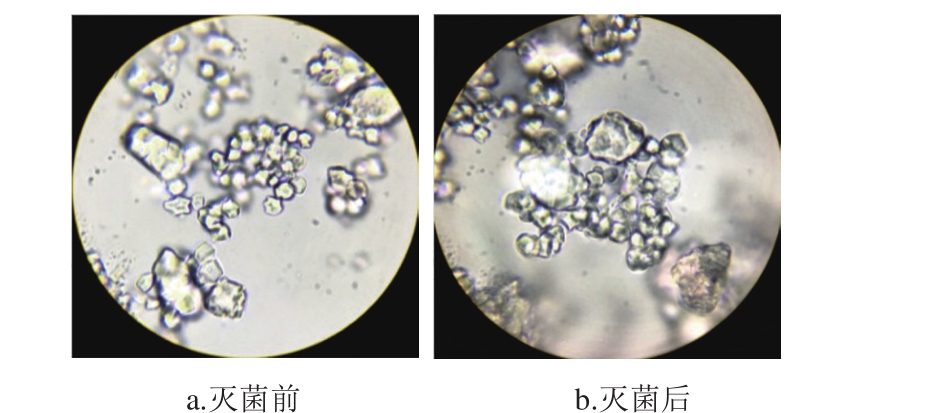
图2 灭菌前后的淀粉颗粒形态(目镜×16,物镜×100)
Fig. 2 Morphology of starch granules before and after sterilization(eyepiece ×16, objective lens ×100)
由图2可看出,灭菌前后淀粉颗粒变化不大,淀粉在灭菌后仍保持完整颗粒,没有出现涨破的现象,说明本实验的灭菌方法不会使籼米粉中的淀粉糊化,其仍为生淀粉。
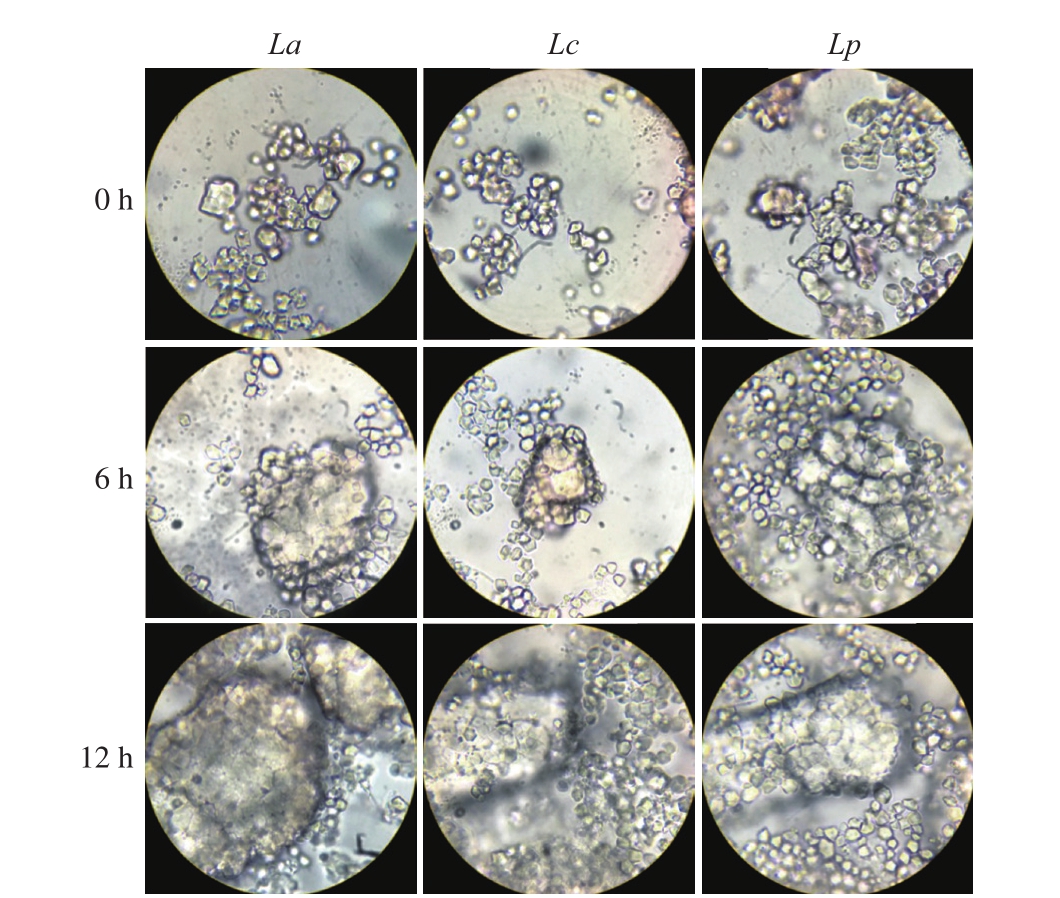
图3 发酵前后的淀粉颗粒形态(目镜×16,物镜×100)
Fig. 3 Morphology of starch granules before and after fermentation(eyepiece ×16, objective lens ×100)
由图3可看出,与发酵前相比,经3 株乳杆菌发酵后的籼米粉浆中淀粉颗粒的形态均有不同程度的破裂,这说明3 株乳杆菌都具有一定降解生淀粉的能力,可产淀粉酶使淀粉中的α-1,4-糖苷键水解生成小分子糊精,这一过程会使淀粉颗粒形态遭到破坏,因而在显微镜下呈现出许多淀粉颗粒破裂呈糊的状态。3 株乳杆菌发酵6 h后,显微镜下均可观测到小面积的淀粉颗粒破裂,发酵12 h后,均可观测到较大面积的淀粉颗粒破裂,可见随发酵时间的延长有更多淀粉被乳杆菌所产的淀粉酶酶解导致结构崩坏。
2.1.3 发酵前后淀粉含量的变化

图4 发酵过程中总淀粉含量及直链淀粉占比的变化
Fig. 4 Changes in starch content and amylose proportion during fermentation
由图4可得,经3 株乳杆菌发酵过后,乳杆菌-籼米粉浆体系中的总淀粉含量均显著降低,进一步证实3 株乳杆菌都有一定利用生淀粉作为碳源的能力。通过总淀粉含量降低的速率可知,3 株乳杆菌中La降解生淀粉的能力较强,Lc与Lp较弱。在发酵时间为4~8 h阶段,La降解淀粉的速率最快,6~8 h阶段,Lc与Lp降解淀粉速率最快,这是由于4~8 h期间La-a活力最大,6~10 h期间Lc-a与Lp-a活力最大。发酵12 h后,La-IRFS中直链淀粉在总淀粉中占比从30%增大到60%,Lc-IRFS和Lp-IRFS中直链淀粉在总淀粉中的占比则从30%增大到55%,随着总淀粉含量的降低,直链淀粉在总淀粉中的占比增大,说明在体系中淀粉酶活力较高时,直链淀粉的占比迅速上升,初步推测原因为乳杆菌所产淀粉酶中,有一定量的异淀粉酶,该酶只水解支链淀粉分枝点的α-1,6-糖苷链,切下整个侧枝,形成长短不一的直链淀粉,因而体系中淀粉酶活力性高时,异淀粉酶迅速将支链淀粉转化为直链淀粉,从而导致发酵过后直链淀粉的占比增大,这与文献报道中乳酸菌发酵淀粉的特性一致[26-27]。
2.1.4 3 株乳杆菌产淀粉酶的粗酶活力
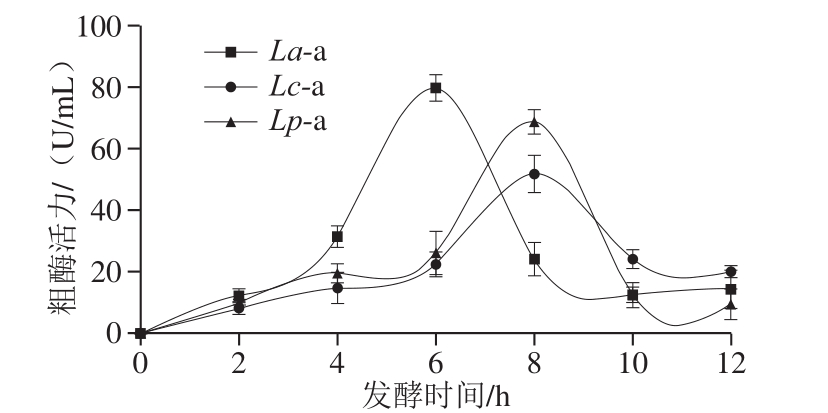
图5 3 株乳杆菌产淀粉酶的粗酶活力
Fig. 5 Production of amylase activity by three strains of Lactobacillus
由图5可得,La-a活力在发酵第6小时达最大,为79.78 U/mL,整个发酵过程中4~8 h时酶活力较大,相对应的该阶段La活菌数增长速率最快,这是因为在淀粉酶的作用下La-IRFS体系内还原糖含量显著增大,可直接利用的碳源充足,La的生长环境最佳。而Lc-a与Lp-a活力则在8 h达最大,分别为51.89 U/mL和68.77 U/mL,同样,6~10 h阶段Lc-IRFS与Lp-IRFS中充足的还原糖使得该阶段Lc与Lp活菌数增长速率最快。
2.1.5 pH值与总酸测定结果
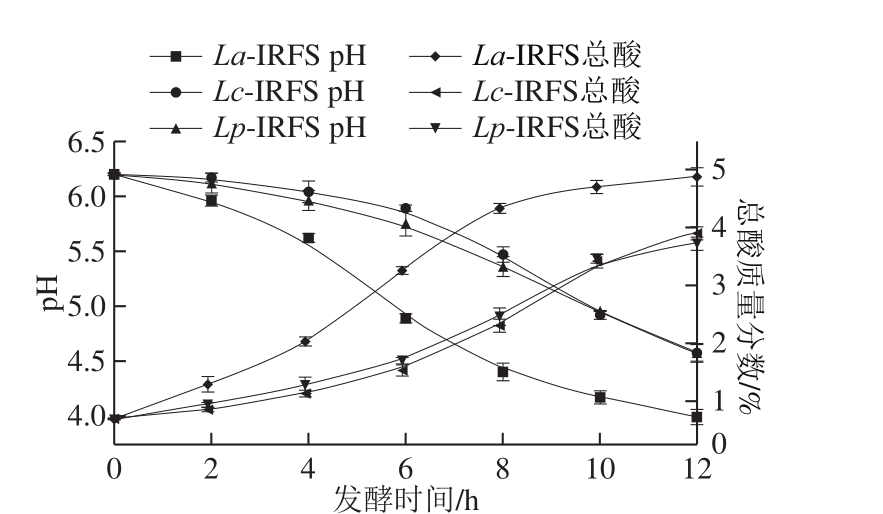
图63 种乳杆菌-籼米粉浆体系发酵过程中pH值与总酸的变化
Fig. 6 Changes in pH and total acid content during fermentation of indica rice flour slurry by three Lactobacillus strains
由图6可得,3 种乳杆菌在籼米粉浆中均具有一定产酸能力,Lc的产酸能力与Lp相近,而La的产酸能力强于Lc和Lp,发酵12 h后能使La-IRFS体系的pH值降至4.0以下,而Lc-IRFS与Lp-IRFS的pH值则在4.5以上;发酵12 h后La-IRFS的总酸约为5%,Lc-IRFS与Lp-IRFS总酸皆低于4%。这是由于发酵时间在12 h内,La在籼米粉浆中的活菌数高于Lc与Lp,且其所产淀粉酶的最高总酶活力大于Lc与Lp,这使得La-IRFS中由淀粉转化成的乳酸及乙酸等有机酸的含量更高,因而La-IRFS的pH值下降更快且总酸更高。其中,La-IRFS的pH值在4~8 h下降最快,总酸升高最快,这是由于6 h的La-a活力最高,淀粉大量降解为还原糖乳杆菌可利用的碳源量充足,活菌数增长较快,使更多的还原糖转化为有机酸。Lc-IRFS与Lp-IRFS的pH值下降速率及总酸升高速率在6~10 h最快,同样是因为Lc-a与Lp-a在8 h活力达到最高。
2.2 3 种淀粉酶的酶学特性
2.2.1 温度与pH值对3 种淀粉酶的影响
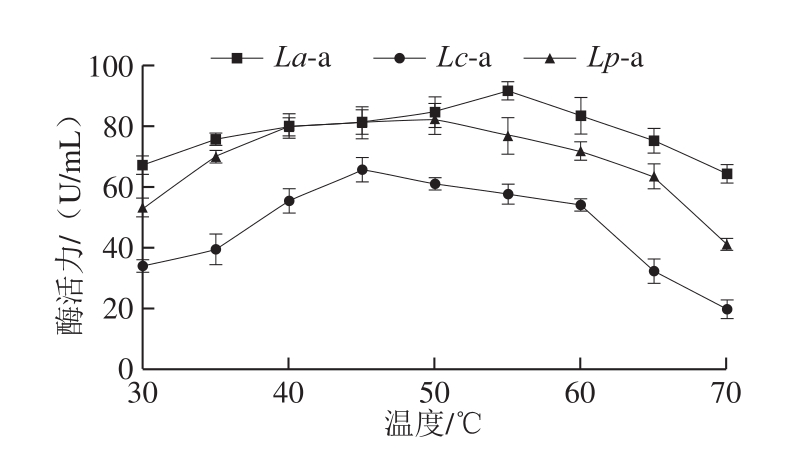
图7 温度对淀粉酶活力的影响
Fig. 7 Effect of temperature on amylase activity
从图7可看出,温度为55 ℃时La-a活力最大,大于90 U/mL,30~70 ℃范围内La-a活力变化不大,因而La-a的较适温度范围为30~70 ℃;温度为45 ℃时Lc-a活力最大,约为65 U/mL,40~60 ℃为Lc-a的较适温度范围;温度为50 ℃时Lp-a活力最大,约为80 U/mL,35~65 ℃为Lp-a的较适温度范围。La-a在30~50 ℃与60~70 ℃活力仍保持较高,Lc-a和Lp-a在较低或较高温度时活力较低,且在70 ℃时最低,分别低于20 U/mL和40 U/mL,说明La-a受温度的影响较小,Lc-a和Lp-a受温度的影响较大。
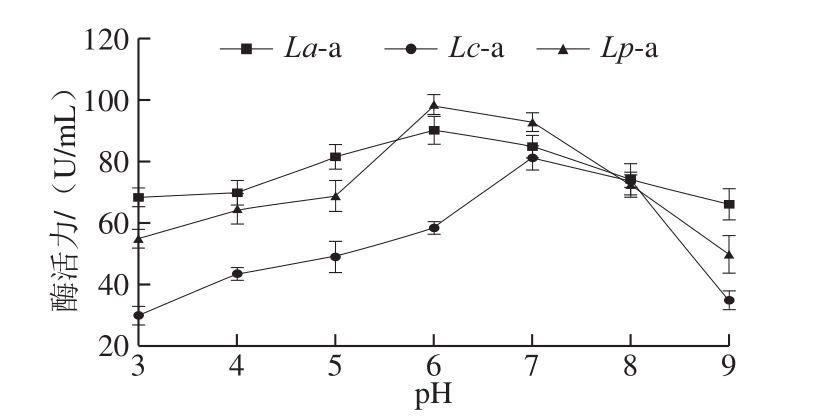
图8 pH值对淀粉酶活力的影响
Fig. 8 Effect of pH on amylase activity
从图8可看出,La-a和Lp-a的最适pH值为6,该pH值下其酶活力分别大于85 U/mL和95 U/mL,Lc-a的最适pH值为7,该pH值下酶活力约为80 U/mL。La-a在较低与较高pH值下仍保持较高的酶活力,在pH值为3、4、9时酶活力都在65 U/mL以上;而Lc-a和Lp-a在较低或较高pH值时,酶活力明显较低。综上表明,La-a活力受pH值的影响较小,Lc-a和Lp-a受pH值的影响较大,三者皆为中性酶。pH值对酶活力性的影响是由于其改变了酶活性中心或与之有关的基团的解离状态,一般淀粉酶都在中性偏酸性环境下酶活力较大[28],而Lc-a则在中性偏碱性环境下酶活力较大,可能是由于Lc-a活性部位有关的基团在中性偏碱性状态下达到最大解离状态。此外,α-淀粉酶和异淀粉酶的最适pH值存在差异,Lc-a所产淀粉酶中α-淀粉酶、异淀粉酶的比例与La-a和Lp-a存在差异也可能导致这一现象。
2.2.2 3 种淀粉酶热稳定性
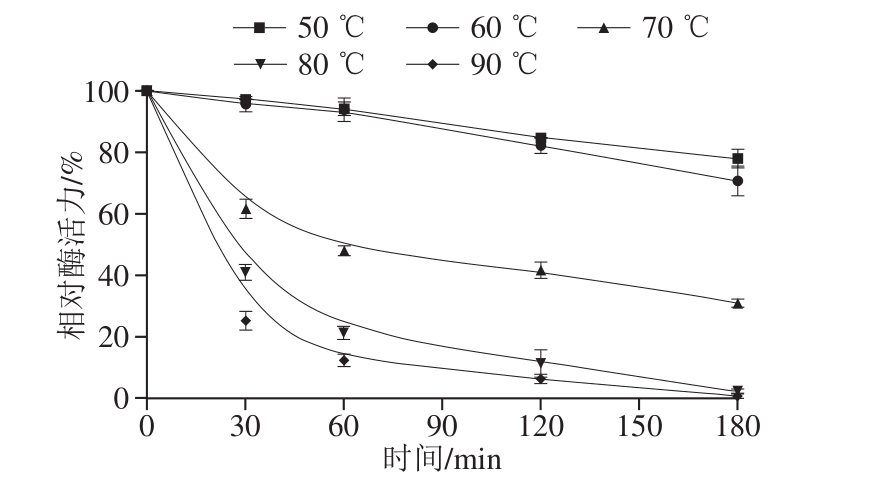
图9 温度和处理时间对La-a活力的影响
Fig. 9 Effects of temperature and treatment time on La-a activity
如图9所示,La-a在50~60 ℃处理180 min仍保持80%左右的相对酶活力,但当温度升高至70 ℃以上时,酶活力快速下降,经70 ℃处理60 min后相对酶活力降至50%左右,180 min后相对酶活力降至30%,80 ℃以上处理60 min相对酶活力即降至20%左右,180 min后几乎完全失活。可见La-a在50~60 ℃酶活力非常稳定,但不可耐受70 ℃以上的高温,80 ℃以上则失活速率极快。

图10 温度和处理时间对Lc-a活力的影响
Fig. 10 Effects of temperature and treatment time on Lc-a activity
如图10所示,Lc-a在50 ℃处理180 min仍保持有60%以上的相对酶活力,在60 ℃处理180 min后降至40%,70、80、90 ℃处理60 min后相对酶活力分别降至40%、30%、20%以下,在70 ℃以上处理180 min后几乎完全失活。即Lc-a在50~60 ℃范围内具有一定耐热能力,70 ℃以上时失活速率较快。

图11 温度和处理时间对Lp-a活力的影响
Fig. 11 Effects of temperature and treatment time on Lp-a activity
如图11所示,Lp-a在50 ℃处理180 min后仍保持90%的相对酶活力,在60℃处理180 min后仍保持有60%以上的相对酶活力,在70 ℃处理60 min后降至40%左右,80 ℃以上处理60 min后仍有超过30%的相对酶活力,处理180 min后几乎完全失活。可见Lp-a可长时间耐受50 ℃的温度,在60 ℃也具有一定耐热性,不可耐受70 ℃以上的高温,70 ℃以上时失活速率较快。
比较3 种乳杆菌所产的淀粉酶,Lp-a的耐热性相对最强。
2.2.3 3 种淀粉酶pH值稳定性
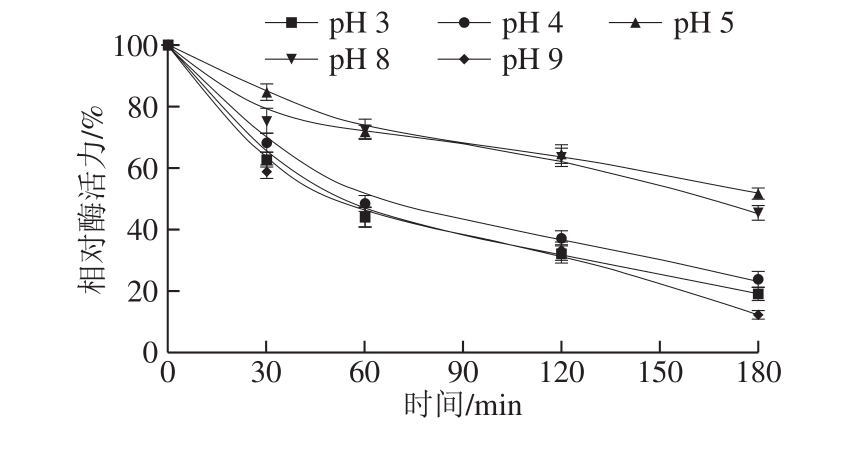
图12 pH值和处理时间对La-a活力的影响
Fig. 12 Effects of pH and treatment time on La-a activity
如图12所示,La-a在pH值为5时的稳定性较强,处理180 min后仍保持50%以上的相对酶活力,但pH值为4或更低时,60 min后La-a相对酶活力降至50%以下,180 min后降至30%以下;La-a在pH值为8时的耐碱能力较强,处理180 min后仍保持50%以上的相对酶活力,而当pH值增大到9时,La-a失活速率较快,60 min后降至50%以下,180 min后相对酶活力在20%以下。可见La-a在pH 5~8范围内稳定性较强。
如图13所示,Lc-a的耐酸能力差,在pH值为5时处理60 min相对酶活力降至30%,pH值为3时处理30 min相对酶活力降至30%以下,60 min后降至10%以下,pH值为4以下处理180 min后几乎完全失活。pH值为8时耐碱能力较好,处理120 min后仍保持50%以上相对酶活力,但pH值增大至9后耐碱能力骤降,处理60 min相对酶活力仅为10%,180 min后几乎完全失活。可见Lc-a的pH值稳定性很差,不可长时间处于pH 6~8以外的环境中。

图13 pH值和处理时间对Lc-a活力的影响
Fig. 13 Effects of pH and treatment time on Lc-a activity
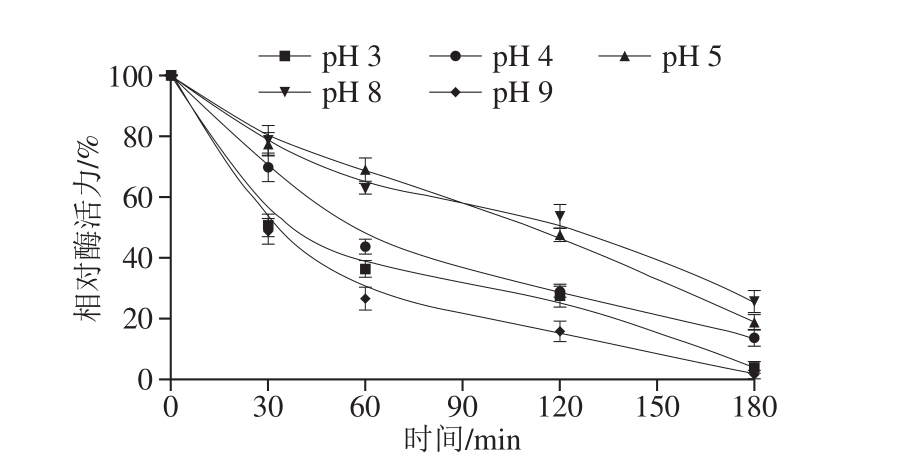
图14 pH值和处理时间对Lp-a活力的影响
Fig. 14 Effects of pH and treatment time on Lp-a activity
如图14所示,Lp-a处于pH值为5和8的环境下120 min后相对酶活力仍有50%以上,在pH值为3、4或9的环境下处理60 min后相对酶活力即降至50%以下。在pH值为4、5、8的环境下180 min后,相对酶活力均降至30%以下,在pH值为3和9的环境中180 min后,几乎完全失活。可见Lp-a的酸碱耐受能力较差,但略优于Lc-a。
综上可得,La-a在3 种乳杆菌所产淀粉酶中pH值稳定性最好,Lp-a次之,Lc-a的pH值稳定性最差。
3 结 论
本实验通过构建乳杆菌-籼米粉浆体系,研究3 株具有降解淀粉能力的乳杆菌La、Lc与Lp在籼米粉浆体系中单菌发酵过程,并研究其所产淀粉酶的酶学特性,同时也对发酵过程体系中淀粉含量,直链淀粉占比进行测定。结果表明,3 株乳杆菌中最适合在籼米粉浆体系中生长的为La,其在经过12 h发酵后可使La-IRFS体系的pH值降至4.0以下,总酸达到5%,La在籼米粉浆体系中的产酸能力强于Lc与Lp,发酵过程中La活菌数始终大于Lc与Lp,且所产淀粉酶的最大酶活力亦大于Lc与Lp,能在6 h内达到最大。在3 株乳杆菌所产的淀粉酶中,55 ℃时La-a活力最高,45 ℃时Lc-a活力最高,而Lp-a最适温度为50 ℃,三者均不可耐受70 ℃以上的高温,但其中Lp-a的耐热性相对较强。La-a和Lp-a的最适pH值为6,Lc-a最适pH值为7,三者皆为中性酶,pH值稳定性的排序为:La-a>Lp-a>Lc-a。发酵过后,乳杆菌-籼米粉浆体系中的总淀粉含量均显著降低,直链淀粉在总淀粉中的占比增大,说明乳杆菌所产淀粉酶中有一定量的异淀粉酶,可将体系中的支链淀粉转化为直链淀粉,从而导致发酵过后直链淀粉的占比增大。乳酸菌一般不产淀粉酶,但有些乳酸菌在碳饥饿的情况下会利用替代碳源[29],在发酵过程中某些多糖降解基因(如apu、yucG)会超量表达[30]。初步推测本实验中的3 株乳杆菌在籼米粉浆体系中由于缺乏碳源进入碳饥饿状态,其与淀粉酶相关的基因被诱导表达,从而拥有生产淀粉酶的能力。
[1] 顾旭峰, 郭雯莉, 夏永军, 等. 水解淀粉乳酸菌的筛选[J]. 食品与发酵科技, 2016, 52(4): 54-57. DOI:10.3969/j.issn.1674-506X.2016.04-012.
[2] LEE H, GILLILAND S, CARTER S. Amylolytic cultures of Lactobacillus acidophilus: potential probiotics to improve dietary starch utilization[J]. Journal of Food Science, 2010, 66(2): 338-344.DOI:10.1111/j.1365-2621.2001.tb11343.x.
[3] KOCABAY S, ÇETINKAYA S, AKKAYA B, et al. Characterization of thermostable β-amylase isozymes from Lactobacillus fermentum[J].International Journal of Biological Macromolecules, 2016, 93: 195-202. DOI:10.1016/j.ijbiomac.2016.08.078.
[4] GIRAUD E, CHAMPAILLER A, RAIMBAULT M. Degradation of raw starch by a wild amylolytic strain of Lactobacillus plantarum[J].Applied and Environmental Microbiology, 1995, 60(12): 4319-4323.DOI:10.1016/0922-338X(95)92742-U.
[5] HUMBLOT C, TURPIN W, CHEVALIER F, et al. Determination of expression and activity of genes involved in starch metabolism in Lactobacillus plantarum A6 during fermentation of a cereal-based gruel[J]. International Journal of Food Microbiology, 2014, 185: 103-111. DOI:10.1016/j.ijfoodmicro.2014.05.016.
[6] CHOOKIETWATTANA K. Lactic acid production from simultaneous saccharification and fermentation of cassava starch by Lactobacillus plantarum MSUL 903[J]. APCBEE Procedia, 2014, 8: 156-160.DOI:10.1016/j.apcbee.2014.03.019.
[7] PANDA S H, SWAIN M R, KAR S, et al. Statistical optimization of alpha-amylase production by probiotic Lactobacillus plantarum MTCC 1407 in submerged fermentation[J]. Polish Journal of Microbiology, 2008, 57(2): 149-155.
[8] 赵志丹, 郭小华, 熊海容. 产淀粉酶益生乳杆菌的筛选及鉴定[J]. 中国微生态学杂志, 2011, 23(9): 769-773.
[9] BAI Y X, DOBRUCHOWSKA J M, VAN DER KAAIJ R M, et al.Structural basis for the roles of starch and sucrose in homoexopolysaccharide formation by Lactobacillus reuteri 35-5[J].Carbohydrate Polymers, 2016, 142: 1-23. DOI:10.1016/j.carbpol.2016.05.048.
[10] 张莉力, 许云贺, 李新华. 对甘薯淀粉具有絮凝活性的乳酸菌的分离鉴定及其特性研究[J]. 食品科学, 2010, 31(7): 228-231.
[11] 孙竹萍, 张莉力, 王玉田. 副干酪乳酸菌L1产淀粉酶条件优化及温度、pH对淀粉酶酶活力的影响[J]. 食品工业科技, 2014, 35(1): 144-149.
[12] PADMAVATHI T, BHARGAVI R, PRIYANKA P R, et al. Screening of potential probiotic lactic acid bacteria and production of amylase and its partial purification[J]. Journal of Genetic Engineering and Biotechnology, 2018, 16(1): 1-6. DOI:10.1016/j.jgeb.2018.03.005.
[13] HYEYEON J, NARI K, HYEWON L, et al. Characterization of a novel maltose-forming α-amylasefrom Lactobacillus plantarum subsp.plantarum ST-III[J]. Journal of Agricultural & Food Chemistry, 2016,64(50): 2307-2314. DOI:10.1021/acs.jafc.6b05450.
[14] 吴鹏. 米发糕发酵菌株筛选、发酵条件优化及香气成分研究[D].武汉: 华中农业大学, 2009: 16-17. DOI:10.7666/d.Y1598253.
[15] 杨韵, 吴卫国, 李敏, 等. 米发糕发酵工艺条件的研究[J]. 农产品加工:学刊(中), 2014(2): 42-45. DOI:10.3969/jissn.1671-9646(X).2014.02.014.
[16] ZHU L J, FANG Y Y, CHEN Y J, et al. Study on characters of fermented germinated brown rice milk prepared with combination of two lactic acid bacteria[J]. Science & Technology of Food Industry,2016, 37(22): 195-199. DOI:10.13386/j.issn1002-0306.2016.22.030.
[17] 马霞, 李路遥, 何艳, 等. 发酵鲜湿米粉的优良菌种选育及品质研究[J].食品科学, 2017, 38(2): 116-121. DOI:10.7506/spkx1002-6630-201702016.
[18] 马佳歌, 于微, 李佳君, 等. 干酪乳杆菌细菌素的抗菌机制分析[J].食品科学, 2018, 39(10): 199-204. DOI:10.7506/spkx1002-6630-201810030.
[19] 陈瑶, 廖卢艳, 吴卫国. 混菌发酵消减大米中镉的工艺优化[J]. 食品与机械, 2017(8): 44-49.
[20] 周显青, 李亚军, 张玉荣. 不同微生物发酵对大米理化特性及米粉食味品质的影响[J]. 河南工业大学学报(自然科学版), 2010, 31(1): 4-8.
[21] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. 乳酸菌计数: GB 4789.35—2016[S]. 北京: 中国标准出版社, 2016: 2-4.
[22] 侯曼玲. 食品分析[M]. 北京: 化学工业出版社, 2004: 79-80.
[23] 国家质量监督检验检疫总局. 大米直链淀粉含量的测定: GB/T 15683—2008[S]. 北京: 中国标准出版社, 2008: 3.
[24] 曾东方, 杨帆, 聂欢欢. DNS法对食用菌发酵液淀粉酶活力的测定[J]. 现代农业科技, 2011(11): 16; 18. DOI:10.3969/j.issn.1007-5739.2011.11.003.
[25] 国家卫生和计划生育委员会. 食品酸度的测定: GB 5009.239—2016[S]. 北京: 中国标准出版社, 2016: 7-8.
[26] 张玉荣, 周显青, 李庆光, 等. 植物乳杆菌发酵大米粉及其淀粉特性变化[J]. 粮食与饲料工业, 2012(8): 18-22. DOI:10.3969/j.issn.1003-6202.2012.08.005.
[27] 李芸, 杨梦妍, 陈小雪, 等. 微生物强化发酵对米粉品质的影响[J]. 中国粮油学报, 2016, 31(11): 1-6. DOI:10.3969/j.issn.1003-0174.2016.11.001.
[28] 陈石根, 周润琦. 酶学[M]. 上海: 复旦大学出版社, 2001: 194.
[29] 郭兴华. 益生乳酸细菌[M]. 北京: 科学出版社, 2008: 110.
[30] REDON E, LOUBIERE P, COCAIGN-BOUSQUET M. Transcriptome analysis of the progressive adaptation of Lactococcus lactis to carbon starvation[J]. Journal of Bacteriology, 2005, 187(10): 3589-3592.DOI:10.1128/JB.187.10.3589-3592.2005.