酱香型白酒作为典型的传统固态发酵食品,酿造历史悠久,深受世界人民尤其是东亚国家消费者的喜爱[1]。其酿造工艺特点可概括为高温制曲、高温堆积、高温发酵、高温流酒,生产周期长、贮存时间长,用曲量大,多轮次取酒[2]。酒体风格特征为清亮透明、无色或微黄、酱香突出、幽雅细腻、酒体醇厚、空杯留香持久[3]。
堆积发酵是酱香白酒酿造的独特关键工序,属于边糖化边发酵方式,通过堆积发酵可显著富集微生物和酶类,生成酱香或酱香前体物质[4],为入窖发酵创造条件,相当于“二次制曲”[5-7],也是完成入窖发酵前的糖化基础。细菌及细菌代谢产物在高温堆积发酵过程的富集为形成后期窖池发酵的发酵动力和风味动力奠定了基础。堆积发酵结束后,酒醅入窖池发酵,窖池发酵阶段微生物菌群结构继续推进发酵,并进一步促进酱香风味化合物的增加[8]。因此,堆积和窖池发酵的细菌菌群结构及其变化对产酒和生香具有举足轻重的作用,而研究酱香型白酒发酵过程细菌菌群结构是解析发酵机理和风味形成的关键,近年引起很多研究人员的关注。如戴奕杰等[8]分析了酱香白酒酿造的下沙、造沙和7轮次堆积、窖池发酵糟醅的细菌多样性,结果表明酒醅在发酵酿酒阶段的优势微生物为埃希氏菌属(Escherichia-Shigella)、乳酸杆菌属(Lactobacillus)、Clostridium_sensu_stricto_1、链球菌属(Streptococcus)、放线杆菌属(Actinobacillus)、双歧杆菌属(Bifidobacterium)和链格孢属(Alternaria)。韩兴林等[9]分析了酱香型白酒酿造8 个轮次堆积酒醅中的原核微生物结构,结果指出其优势原核类微生物细菌属主要为不动杆菌属(Acinetobacter)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、高温放线菌属(Thermoactinomyces)、葡萄球菌属(Staphylococcus)、Lactobacillus、片球菌属(Pediococcus)、嗜麦糖寡养食单胞菌(Stenotrophomonas)、栖水菌属(Enhydrobacter)、醋酸杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)和伯克霍尔德菌属(Burkholderia)共12 种及未知菌属Desmospora、Serpens 2 种属。黄蕴利等[10]研究了酱香型白酒第2轮次堆积及窖池发酵过程酒醅中的微生物,发现堆积酒醅中优势细菌有Bacillus、肠球菌属(Enterococcus)、Lactococcus、Lactobacillus、Lentibacillus、克罗彭斯特菌属(Kroppenstedtia)、肠杆菌科(Enterobacteriaceae)、嗜碱菌属(Alkaliphilus)、海洋杆菌属(Oceanobacillus)、Thermoactinomyces等10 种;而窖池发酵酒醅中的最优势细菌属类有Lactobacillus、Acetobacter、Bacillus、Lactobacillus和Bacillus。郭敏等[11]运用高通量测序技术对酱香型白酒3轮次和7轮次窖池发酵酒醅微生物开展研究,发现两个轮次的微生态多样性存在较大的差异性特征,3轮次酒醅中Lactobacillus和Bacillus是绝对优势细菌,而7轮次酒醅中则是Halomonas为最优势细菌。
无论在堆积发酵还是窖内发酵过程,酱香风味都主要来源于多种微生物的共同作用[12],其中细菌的贡献尤其重要。基于此,本课题组多年来一直聚焦于酱香型白酒酿造微生物多样性及其生态结构的研究,运用高通量测序技术等多组学策略对酱香型白酒酿造的全轮次(1~7轮次)微生物菌群结构特征进行系统研究。本研究将1轮次堆积和窖池发酵过程的细菌菌群结构进行归纳总结,以期为传统白酒固态发酵机制及产业发展提供借鉴和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品取自贵州XJ公司2车间12班酿造窖池第1轮次的堆积和窖池发酵酒醅。堆积酒醅样品从堆积1 d开始取样,周期为2 d(1轮次酿酒时节自然气温相对较低,堆升温较慢,以2 d间隔取样)。取样点如图1a所示,分别取堆子上层A点,中层B、C两点,下层D、E两点,取样后混匀样品(B、C两点混匀为一个样,D、E两点混匀为一个样),再将上、中、下3 个样品混合为1 个样品。后期所取样品如同上法。

图1 堆积(a)和窖池(b)酒醅取样点
Fig. 1 Sampling points of fermented grains during pile (a) and pit (b) fermentation
窖池发酵过程从酒醅堆积发酵结束入窖开始取样,记为发酵0 d(即堆积发酵最后一天,7 d),以后每隔5 d取样一次,取至窖池发酵35 d为止(窖池发酵共35 d)。窖池取样点如图1b所示,同一层面分别取3 个点,将同一层面的3 个点所取酒醅混匀为1 个样,代表窖池1 个层面的酒醅样(即A、B、C三点的取样混匀后为1 个样),同样将D、E、F三点的取样混匀为1 个样,G、H、I三点的取样混匀为1 个样,分别代表窖池上、中、下3 个层面的酒醅样。再将上中下3 个样品混合为1 个样品。研究共采集83 个发酵酒醅小样,最终混合成DJ 1 d、DJ 3 d、DJ 5 d、DJ 7 d(FJ 0 d)、FJ 5 d、FJ 10 d、FJ 15 d、FJ 20 d、FJ 25 d、FJ 30 d、FJ 35 d共11 个样品。
1.1.2 试剂
DNA Marker 宝生物工程(大连)有限公司;磷酸盐缓冲液(phosphate buffer solution,PBS)、引物合成 生工生物工程(上海)股份有限公司;E.Z.N.A. Soil DNA Kit美国Omega BioTek公司;异丙醇(分析纯)、TAE(Tris Acetate-EDTA)缓冲液 北京索莱宝科技有限公司;琼脂糖 南京生兴生物技术有限公司;Goldview染料上海赛百盛有限公司;rTaq DNA聚合酶试剂盒 北京全式金生物技术有限公司。
1.2 仪器与设备
Zealway G154DW高压蒸汽灭菌锅 致徽(厦门)仪器有限公司;台式高速冷冻离心机 德国Sigma公司;GeneAmp® 9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;DYY-8C型电泳仪 北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司。
1.3 方法
1.3.1 样品预处理[10]及DNA抽提
分别称取混合好的每个样品各10 g,用15 mL灭菌后的0.1 mol/L PBS悬浮,加入3 颗玻璃珠,旋涡振荡10 min。300 r/min离心5 min,取上清液,沉淀用PBS重复洗涤3 次,离心后收集上清液,混匀所收集上清液。将上清液于12 000 r/min离心5 min,弃上清液,收集细胞沉淀。用5 mL PBS洗3 次沉淀,每次于12 000 r/min离心5 min后去上清液,收集并混匀沉淀。预处理结束后,根据E.Z.N.A. Soil DNA Kit的操作说明提取各样品中的微生物总DNA。
1.3.2 PCR扩增
利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×Fast Pfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL Fast Pfu聚合酶;10 ng DNA模板。
1.3.3 Illumina MiSeq测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300文库。构建文库步骤:1)连接“Y”字形接头;2)使用磁珠筛选去除接头的自连片段;3)利用PCR扩增进行文库模板的富集;4)氢氧化钠变性,产生单链DNA片段。再利用Illumina公司的MiSeq PE300平台进行测序。
1.3.4 酒醅理化指标的测定[13]
水分的测定:恒温烘干法;酸度的测定:酸碱中和滴定法;淀粉及还原糖的测定:斐林试剂法。
1.4 数据统计分析及图像处理
原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接。使用UPARSE软件,根据97%的相似度对序列进行可操作分类单元(operational taxonomic unit,OTU)聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对silva123/16s_bacteria数据库,设置比对阈值为70%。采用Microsoft Office Excel 2016进行数据计算和分析,群落组成图、Heatmap图利用R语言进行绘制,物种相关性网络图运用Cytoscape软件进行绘制。
2 结果与分析
2.1 α多样性分析
通过USEARCH将标签分组成具有97%相似性的OTU。计算Chao指数和ACE指数(以确定物种丰富度)、Shannon指数和Simpson指数(以确定物种多样性)及检测到的物种数目,以描述堆积、窖池发酵酒醅样品中的细菌菌群多样性,其分析测序指数结果见表1。
表1 样本细菌群落α多样性指数
Table 1 α Diversity of bacterial samples
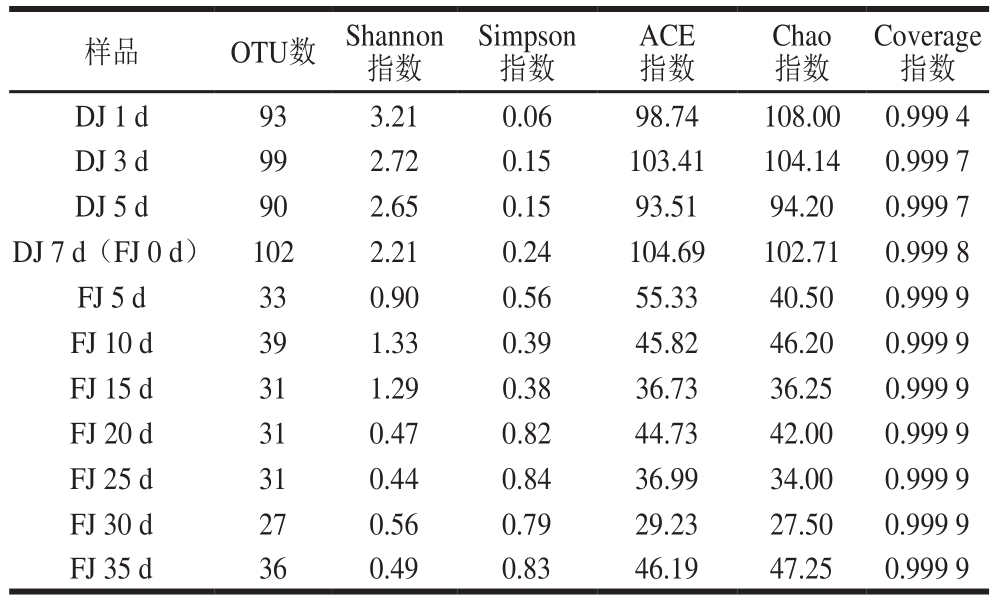
Coverage指数DJ 1 d 93 3.21 0.06 98.74 108.00 0.999 4 DJ 3 d 99 2.72 0.15 103.41 104.14 0.999 7 DJ 5 d 90 2.65 0.15 93.51 94.20 0.999 7 DJ 7 d(FJ 0 d) 102 2.21 0.24 104.69 102.71 0.999 8 FJ 5 d 33 0.90 0.56 55.33 40.50 0.999 9 FJ 10 d 39 1.33 0.39 45.82 46.20 0.999 9 FJ 15 d 31 1.29 0.38 36.73 36.25 0.999 9 FJ 20 d 31 0.47 0.82 44.73 42.00 0.999 9 FJ 25 d 31 0.44 0.84 36.99 34.00 0.999 9 FJ 30 d 27 0.56 0.79 29.23 27.50 0.999 9 FJ 35 d 36 0.49 0.83 46.19 47.25 0.999 9样品 OTU数 Shannon指数Simpson指数ACE指数Chao指数
97%水平下共得到OTU数为122,堆积发酵结束即窖池发酵开始时OTU数最高,为102。酒醅样品的Shannon指数和Simpson指数表明,堆积发酵酒醅的细菌多样性和丰富度明显高于窖池发酵酒醅。并且在堆积过程中,随着堆积时间的延长,样品的细菌多样性呈现下降趋势。而在窖池发酵过程中,窖池发酵0 d的丰富度指数和多样性指数最高,窖池发酵开始后,细菌多样性和丰富度急剧大幅下降。所有样品的Coverage指数均大于0.999,说明各采样酒醅样品文库的覆盖率足够大,样品中的序列基本被全部测出,测序结果可体现酒醅样品细菌群落多样性的真实情况。
2.2 细菌菌群结构多样性
2.2.1 基于门水平的细菌菌群结构多样性分析
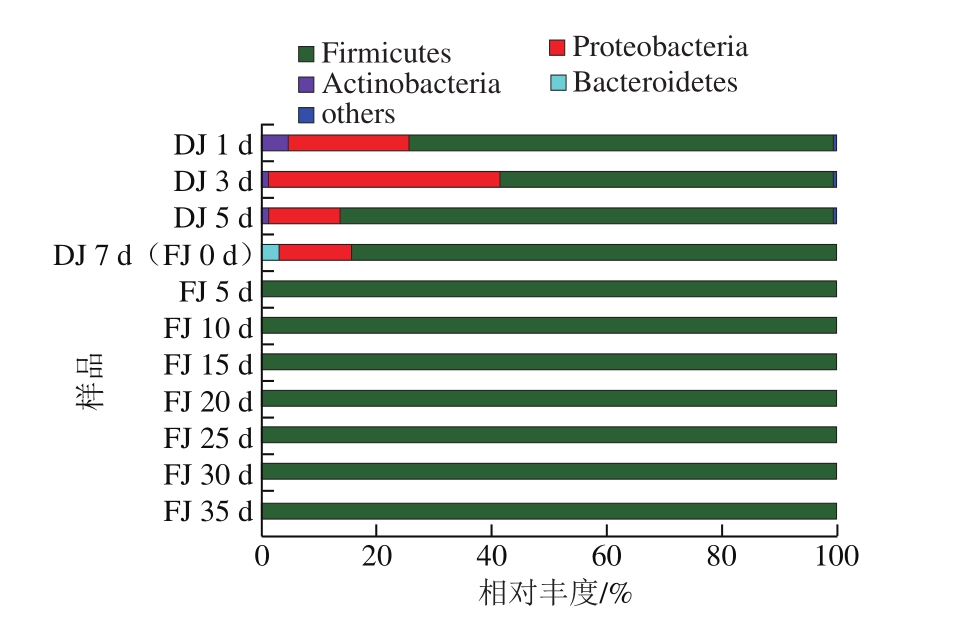
图2 酒醅样品中的细菌菌群结构(门水平)
Fig. 2 Bacterial community structure of fermented grain samples at the phylum level
酱香型白酒1轮次堆积和窖池发酵过程不同样本序列经RDP classifier软件进行分类分析,在门水平上,其各样本的细菌群落结构组成如图2所示。从酱香型白酒1轮次堆积和窖池发酵酒醅中共检测到8 个门。从堆积发酵酒醅中检测到厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌(Cyanobacteria)、梭杆菌门(Fusobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus)、芽单胞菌门(Gemmatimonadetes)8 个门;从窖池发酵酒醅中检测到除Deinococcus-Thermus外的其他7 个门,而在入窖池发酵后5~35 d中共检出Firmicutes、Proteobacteria、Actinobacteria、Bacteroidetes、Gemmatimonadetes 5 个门(图2)。
在门水平,堆积发酵优势细菌(平均相对丰度大于1%)为Firmicutes、Proteobacteria和Actinobacteria,其中Firmicutes和Proteobacteria占主导地位(平均相对丰度大于10%),平均相对丰度分别为75.58%和21.53%。窖池发酵酒醅中优势细菌为Firmicutes和Proteobacteria,Firmicutes占绝对主导地位(平均相对丰度为98.01%);在堆积发酵结束即窖池发酵开始时,Firmicutes、Proteobacteria和Bacteroidetes平均相对丰度大于1%。窖池发酵开始后,Proteobacteria的相对丰度由12.42%(窖池发酵0 d)急剧下降至0.01%(窖池发酵5 d)以下,直至窖池发酵结束时相对丰度也不超过0.06%;Bacteroidetes则从2.91%下降并一直维持在0.01%以下。从窖池发酵的5~35 d,平均相对丰度大于1%的菌门仅有Firmicutes。黄蕴莉等[10]对相同车间第2轮次堆积和窖池发酵酒醅进行了研究,发现其酒醅样品中同样是Firmicutes占绝对主导地位,相对丰度均占92%以上,这与王雪山等[14]报道的白酒发酵过程中由多菌种演替为单一厚壁菌门为主导的典型发酵模式相符,不同的是1轮次堆积发酵过程中Proteobacteria相对丰度(21.53%)占比显著高于2轮次(小于1%)。
2.2.2 基于属水平的细菌菌群结构多样性分析

图3 酒醅样品中的细菌菌群结构(属水平)
Fig. 3 Bacterial community structure of fermented grain samples at the genus level
在属水平上,从酱香型白酒1轮次堆积和窖池发酵酒醅中共检出71 个属,图3为平均相对丰度至少在一个酒醅样品中大于1%的菌群结构。从堆积和窖池发酵酒醅中分别检出69 个和63 个属,堆积发酵结束即窖池发酵开始检出61 个属。窖池发酵0~5 d,有47 个属的相对丰度大幅下降至低于检出限,Lactobacillus相对丰度从79.42%上升至99.96%,成为主要菌群,从而也导致发酵酒醅酸度升高(从0.65 mmol/10 g上升至1.43 mmol/10 g)。上述47 个菌属含量大幅下降可能源于发酵环境改变或者Lactobacillus对其生物性抑制所致。窖池发酵5~35 d,新检出19 个属,其中梭菌属(Clostridium_sensu_stricto_1)和g__unclassified_f__Peptostreptococcaceae 2 个属在堆积发酵酒醅中未检出,该两种菌属属于专性厌氧菌[15-16],适宜于厌氧发酵环境。气球菌属(Aerococcus)、明串珠菌属(Leuconostoc)、类芽孢杆菌属(Paenibacillus)、嗜热杆菌(Thermus)、Xylella及3 个未分类菌属则只出现在堆积发酵中。这8 种菌属在堆积酒醅样品中平均相对丰度和占0.13%。
在属水平,堆积发酵优势细菌属有13 个,分别为Lactobacillus、Escherichia-Shigella、Bacillus、Lentibacillus、Kroppenstedtia、g__unclassified_f__Enterobacteriaceae、Thermoactinomyces、Pediococcus、Acetobacter、Oceanobacillus、Acinetobacter、Lactococcus和糖多孢菌属(Saccharopolyspora),其中Lactobacillus、Escherichia-Shigella和Bacillus占主导地位,平均相对丰度分别为35.93%、12.19%和11.63%。近年有报道分析了酱香白酒酿造全轮次及第2轮次发酵酒醅的细菌群落结构[8-10]。本研究结论再次证实了上述研究者的结果:Lactobacillus、Escherichia-Shigella、Bacillus、Thermoactinomyces、Pediococcus、Acetobacter、Acinetobacter、Lactococcus是酱香白酒第1轮次酒醅堆积发酵的优势菌属,同时本研究还新发现Lentibacillus、Kroppenstedtia、g__unclassified_f__Enterobacteriaceae、Oceanobacillus、Saccharopolyspora也是酱香型白酒第1轮次酒醅堆积发酵的优势细菌属。酱香型白酒酿造第1轮次和第2轮次发酵酒醅的优势细菌属相比,Lactobacillus、Bacillus、g__unclassified_f__Enterobacteriaceae、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Oceanobacillus、Lactococcus是2 个轮次堆积发酵酒醅中共有的优势细菌属;而Lactobacillus则在2 个轮次窖池发酵酒醅中均占绝对主导地位。
13 个优势细菌属中,Escherichia-Shigella、Thermoactinomyces、Lentibacillus、g__unclassified_f__Enterobacteriaceae、Pediococcus、Oceanobacillus、Lactococcus和Saccharopolyspora 8 个属随发酵时间的延长其丰度总体呈下降趋势,且在堆积发酵结束时相对丰度小于1%;Bacillus同样随着发酵时间延长相对丰度下降,但在堆积发酵结束时其相对丰度大于1%。这些优势微生物相对丰度下降与发酵过程中营养物质消耗(如淀粉质量分数从DJ 1 d的34.52%下降至DJ 7 d的29.84%)、微生物代谢产物累积导致发酵环境改变(如酸度从DJ 1 d的0.61 mmol/10 g上升至DJ 7 d的0.65 mmol/10 g)和微生物之间的相互作用相关。窖池发酵酒醅中平均相对丰度超过1%的菌属只有Lactobacillus,平均相对丰度占79.42%,该菌属在窖池发酵中也占绝对主导地位。窖池发酵开始时(即堆积发酵结束),优势细菌属有Lactobacillus、Acinetobacter、丛毛单胞菌属(Comamonas)、Acetobacter、Kroppenstedtia和Bacillus。窖池发酵开始后,除Lactobacillus相对丰度从79.42%急剧上升至99.96%并维持在99.84%~99.96%之间,其余5 个菌属相对丰度均从大于1%急剧下降至0.04%以下,发酵窖池的菌群结构由多菌种演替为单一的Lactobacillus为主导,这与戴奕杰等[8]关于随着酱香型白酒发酵时间的推移,细菌群落形成单一菌类为主导环境的说法相符。Acinetobacter以葡萄糖和其他碳水化合物代谢产酸,为酱香型白酒各轮次堆积酒醅中的优势细菌菌属[9]。Acetobacter以乙醇、甘油和乳酸为碳源,能利用正丙醇、正丁醇和D-葡萄糖产酸,但不水解乳糖和淀粉[15],是酱香型大曲[17]和酒醅中常见的微生物[10-11]。Comamonas属好氧或兼性好氧异养微生物[18-20],革兰氏阴性杆菌,于1985年由De Vos等[21]发现,具有降解苯酚[22]和木质素[23-24]的功能,在白酒酿造中鲜有报道,2017年由Wang Xueshan等[25]第一次在浓香型白酒中检出,本研究是第一次在酱香型白酒中发现。Kroppenstedtia属于高温放线菌科(Thermoactinomycetaceae),Thermoactinomycetaceae多数在高温下生长[26],是高温大曲[27]和酱香型白酒堆积酒醅中的优势菌[10]。Bacillus是酱香型白酒生产过程中的主要功能菌[6,28]。菌群检出结果表明,窖池发酵开始后,Lactobacillus含量急剧上升,Acinetobacter、Comamonas、Acetobacter、Kroppenstedtia和Bacillus含量急剧下降。进入窖池发酵,微生物生态从好氧及兼氧环境转入厌氧环境,大量厌氧微生物开始代谢产酸等,导致发酵酒醅环境酸度升高,乳酸菌耐酸性好,其含量随之上升,占绝对优势地位,并代谢产生大量乳酸,更致使酒醅环境pH值显著降低,进而抑制其他微生物的生长,同时也通过产生的抑菌素(如Nisin、lactacin、pediocin)抑制革兰氏阳性细菌的生长繁殖[29]。革兰氏阳性菌Kroppenstedtia和Bacillus生物量的降低也说明其生态调控机制。Comamonas只在DJ 7 d(FJ 0 d)时相对丰度较大(3.26%),在其余样品中均小于0.01%,关于此菌,还有待进一步研究。
堆积发酵和窖池发酵是酱香型白酒酿造过程中两个不同的发酵体系,因发酵场和物态、生态上差异较大,所以两种发酵体系中的细菌菌群结构会存在明显的差异。又由于堆积发酵和窖池发酵是一个连续的工艺体系,所以在堆积和窖池整个发酵过程有87.5%的细菌门和85.92%的细菌属同时出现在两个阶段,这些微生物从堆积发酵迁移到窖池发酵。随发酵时间延长,发酵环境参数发生改变,微生物的分布也发生了变化,堆积发酵结束即窖池发酵开始是这些共有微生物迁移、发酵的过渡期。
2.3 相关性网络分析
为进一步研究上述主要微生物之间的相互关系,选取属水平总丰度前25的物种,并计算物种之间的斯皮尔曼等级相关系数,对其进行物种之间的相关性分析,结果如图4所示。
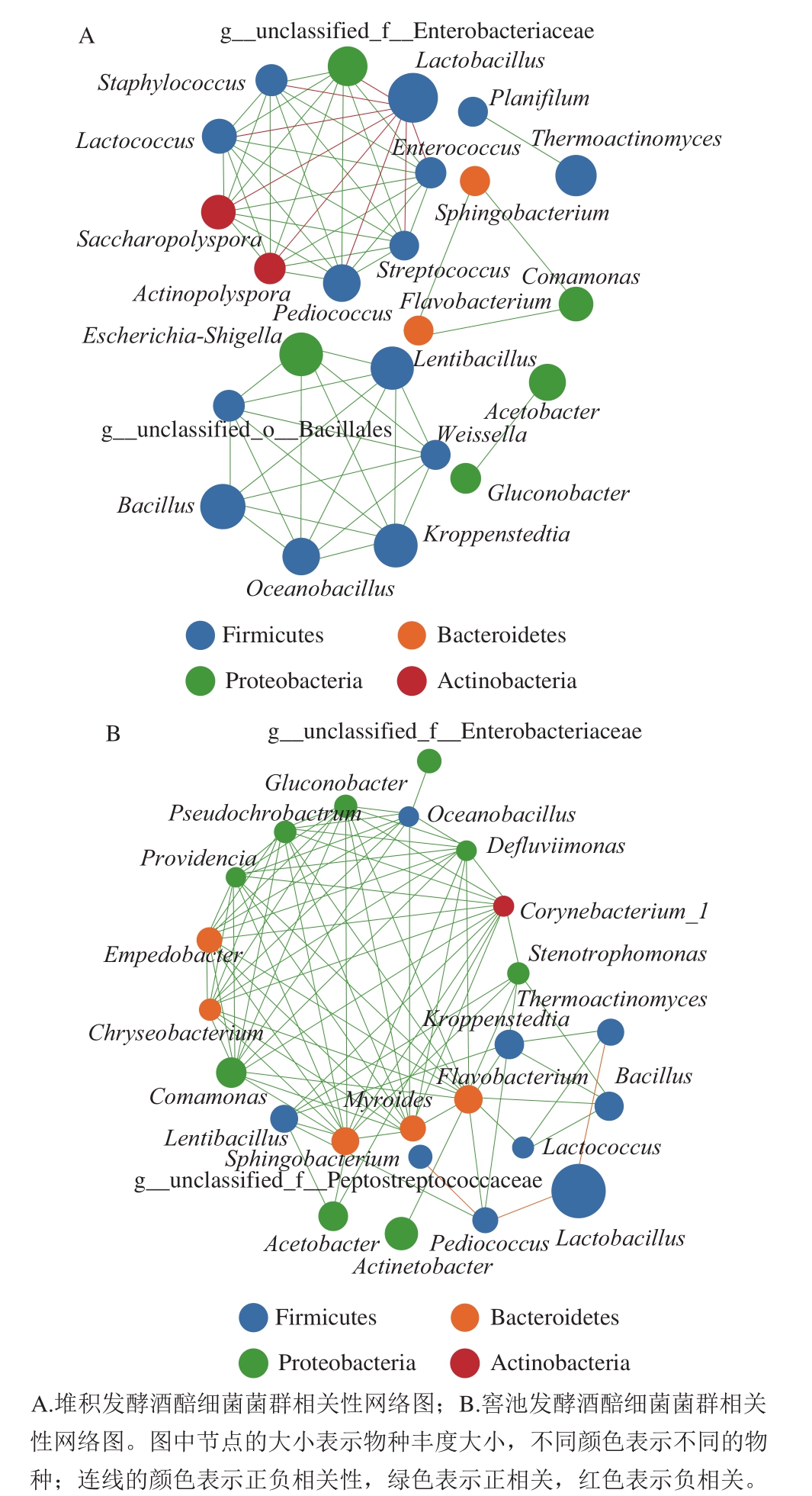
图4 堆积和发酵酒醅样品中的细菌菌群相关性网络图(属水平)
Fig. 4 Correlation network diagram of bacterial communities in fermented grain samples during pile and pit fermentation at the genus level
堆积和窖池发酵酒醅细菌菌群之间的相关性结果(图4)表明,多数微生物菌属之间呈显著正相关调节机制。堆积发酵中有8 个菌属间呈显著负相关,54 个菌属间呈显著正相关。而窖池发酵中有3 个菌属间呈显著负相关,85 个菌属间呈显著正相关。这些相互生物学关系构成了发酵过程的基本生物学调控机制,也是发酵过程发酵动力、风味动力形成和调控机制的基本组成。
高相关性节点是指与一定数量的其他微生物均有相关性的一类微生物,也称为Hub节点[30]。Hubs种类及多少在一定程度上可反映特定环境中微生物菌群结构的稳定性。从堆积发酵酒醅细菌菌群的相关性网络(图4A)中发现Lactobacillus一个负相关Hub(这里指至少与其他8 个属的微生物存在负相关性的节点)。Lactobacillus和Enterococcus、Pediococcus、多孢放线菌属(Actinopolyspora)、Saccharopolyspora、Streptococcus、Lactococcus、g__unclassified_f__Enterobacteriaceae、Staphylococcus之间呈显著负相关性。这8 种菌属在堆积发酵过程含量全部呈现下降态势,堆积发酵结束时,相对丰度均小于1%。堆积发酵过程,Lactobacillus含量逐渐上升,从DJ 0 d的7.30%上升到FJ 0 d的79.42%,为堆积发酵的优势菌属。Enterococcus、Pediococcus、Actinopolyspora、Lactococcus、Saccharopolyspora、Streptococcus、Staphylococcus、g__unclassified_f__Enterobacteriaceae 8 个菌属之间两两显著正相关,是网络图谱中的正相关Hubs(这里指至少与其他6 个属的微生物存在正相关性节点)。Escherichia-Shigella、g__unclassified_o__Bacillales、Bacillus、Oceanobacillus、Kroppenstedtia、Weissella、Lentibacillus 7 个菌属之间,除Escherichia-Shigella和Bacillus相关性不显著外,其余全部都两两显著正相关,g__unclassified_o__Bacillales、Oceanobacillus、Kroppenstedtia、Weissella、Lentibacillus也是网络图谱中的正相关Hubs,这5 种菌属相对丰度含量总体呈下降趋势。
从窖池发酵酒醅细菌菌群相关性网络(图4 B)中发现存在1 4 个正相关H u b s,分别为Bacteroidetes下的稳杆菌属(Empedobacter)、金黄杆菌属(Chryseobacterium)、鞘脂杆菌属(Sphingobacterium)、Myroides、黄杆菌属(Flavobacterium)、Proteobacteria下的葡糖杆菌属(Gluconobacter)、Pseudochrobactrum、普罗威登斯菌属(Providencia)、Comamonas、Stenotrophomonas、Defluviimonas,Firmicutes下的Lentibacillus、Oceanobacillus,Actinobacteria下的Corynebacterium_1。仅有Lactobacillus和Thermoactinomyces、Pediococcus、Pediococcus和g__unclassified_f__Peptostreptococcaceae之间呈显著负相关。
在堆积发酵过程,Lactobacillus与8 个正相关Hubs呈现显著负相关机制,而在窖池发酵过程中,Lactobacillus仅与Thermoactinomyces和Pediococcus显著负相关,Thermoactinomyces和Pediococcus节点连通性都不是很高,说明在堆积发酵阶段Lactobacillus对其他微生物的抑制作用强于窖池发酵阶段,且Lactobacillus在窖池发酵过程中含量比堆积发酵过程多,由此可推断,窖池发酵过程中微生物种类较少,以及除Lactobacillus以外的其他微生物含量很低的主要原因并不在于Lactobacillus对其他微生物的生物学抑制作用,其真正的内在调节机制本课题组正在开展进一步的研究论证。
3 结 论
酱香型白酒1轮次堆积发酵过程细菌的多样性和丰富度明显高于窖池酒醅,随着堆积发酵时间的延长,细菌多样性呈现下降趋势;随着窖池发酵开始,细菌的多样性和丰富度呈现急剧大幅下降。在门和属水平上,堆积发酵检出的总细菌、主要细菌和优势细菌种类均比窖池发酵同比数据多。从酱香型白酒1轮次堆积和窖池发酵过程一共检出8 个门,71 个属。从堆积发酵酒醅中检出8 个门,69 个属;从窖池发酵酒醅中检出7 个门,63 个属。堆积发酵优势细菌门为Firmicutes、Proteobacteria和Actinobacteria,其中Firmicutes和Proteobacteria占主导地位;优势细菌属有Lactobacillus、Escherichia-Shigella、Bacillus、Lentibacillus、Kroppenstedtia、g__unclassified_f__Enterobacteriaceae、Thermoactinomyces、Pediococcus、Acetobacter、Oceanobacillus、Acinetobacter、Lactococcus和Saccharopolyspora 13 个,其中Lactobacillus、Escherichia-Shigella和Bacillus占主导地位。窖池发酵酒醅中优势细菌门为Firmicutes和Proteobacteria,Firmicutes占绝对主导地位。窖池发酵优势细菌属是Lactobacillus,其占绝对主导地位。
细菌菌群结构相关性调节机制上绝大多数菌属之间呈显著正相关性机制,这种机制对堆积和窖池发酵过程稳定的菌群形成具有重要调控作用。堆积发酵过程存在Enterococcus、Pediococcus和Actinopolyspora等13 个正相关Hubs,Lactobacillus 1 个负相关Hub;窖池发酵中存在Empedobacter、Chryseobacterium和鞘脂杆菌属(Sphingobacterium)等14 个正相关Hubs。
[1] JIN G, ZHU Y, XU Y. Mystery behind Chinese liquor fermentation[J].Trends in Food Science & Technology, 2017, 63: 18-28. DOI:10.1016/j.tifs.2017.02.016.
[2] 徐岩. 酒庄酒对中国白酒发展的启发[J]. 酿酒科技, 2014, 35(7): 1-3.DOI:10.13746/j.njkj.2014.0017.
[3] 杨国华, 邱树毅, 黄永光, 等. 酱香白酒生产中产香微生物研究[J]. 中国酿造, 2011, 30(4): 24-27. DOI:10.3969/j.issn.0254-5071.2011.04.006.
[4] 韩兴林, 尚柯, 王德良, 等. 酱香白酒堆积发酵过程中代谢风味生成规律的分析[J]. 酿酒, 2018, 45(4): 37-44. DOI:10.3969/j.issn.1002-8110.2018.04.013.
[5] 杨漫江. 堆积发酵对酱香型白酒风味风味物质形成的影响[J]. 酿酒科技, 2011, 32(7): 72-73. DOI:10.13746/j.njkj.2011.07.035.
[6] 刘晓光, 谢和, 屈直. 酱香型白酒风味物质的形成与微生物关系的研究现状与进展[J]. 贵州农业科学, 2007, 35(2): 131-134.DOI:10.3969/j.issn.1001-3601.2007.02.050.
[7] 刘宇驰, 蒋英丽, 邓皖玉, 等. 引入“酱香功能菌”概念探索酱香型白酒风味成因[J]. 酿酒科技, 2009, 30(12): 47-50. DOI:10.13746/j.njkj.2009.12.014.
[8] 戴奕杰, 李宗军, 田志强. 酱香型白酒大曲和糟醅的细菌多样性分析[J]. 食品科学, 2019, 40(4): 152-159. DOI:10.7506/spkx1002-6630-20180228-251.
[9] 韩兴林, 潘学森, 尚柯, 等. 酱香高温堆积酒醅中原核微生物构成的分析[J]. 酿酒, 2017, 44(1): 22-27. DOI:10.3969/j.issn.1002-8110.2018.04.013.
[10] 黄蕴利, 黄永光, 胡建峰, 等. 酱香型白酒第二轮次酒发酵过程微生物多样性研究[J]. 中国酿造, 2017, 36(9): 30-35. DOI:10.11882/j.issn.0254-5071.2017.09.007.
[11] 郭敏, 黄永光, 邱树毅, 等. 高通量测序在酱香白酒微生态多样性研究中的应用[J]. 中国酿造, 2017, 36(5): 146-151. DOI:10.11882/j.issn.0254-5071.2017.05.031.
[12] 李欣, 王彦华, 林静怡, 等. 高通量测序技术分析酱香型白酒酒醅的微生物多样性[J]. 福建师范大学学报(自然科学版), 2017, 33(1):51-59. DOI:10.12046/j.issn.1000-5277.2017.01.009.
[13] 王福荣. 酿酒分析与检测[M]. 北京: 化学工业出版社, 2005: 31-33
[14] 王雪山, 杜海, 徐岩. 清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业, 2018, 44(9): 1-8. DOI:10.13995/j.cnki.11-1802/ts.017334.
[15] 周德庆, 徐士菊. 微生物学词典[M]. 天津: 天津科学技术出版社,2005: 144-985.
[16] LAWSON P A. The taxonomy of the genus Clostridium: current status and future perspectives[J]. 微生物学通报, 2016, 43(5): 1070-1074.DOI:10.13344/j.microbiol.china.166105.
[17] WANG C, SHI D, GONG G. Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J]. World Journal of Microbiology and Biotechnology, 2008, 24(10): 2183-2190.DOI:10.1007/s11274-008-9728-0.
[18] 项慕飞. 好氧反硝化菌的分离筛选和鉴别研究[D]. 北京: 北京工商大学, 2007: 11.
[19] PATUREAU D, ZUMSTEIN E, DELGENES J P, et al. Aerobic denitrifiers isolated from diverse natural and managed ecosystems[J].Microbial Ecology, 2000, 39(2): 145-152. DOI:10.1007/s002480000009.
[20] 周莉, 李正魁, 王易超, 等. 纯种氨氧化菌短程反硝化特性[J].环境工程学报, 2013, 7(4): 1219-1224. DOI:10.12030/j.cj ee.1673-9108(2013)04-1219-06.
[21] DE VOS P, KERSTERS K, FALSEN E, et al. Comamonas Davis and Park 1962 gen. nov., nom. rev. emend., and Comamonas terrigena Hugh 1962 sp. nov., nom. rev[J]. International Journal of Systematic and Evolutionary Microbiology, 1985, 35(4): 443-453.DOI:10.1099/00207713-35-4-443.
[22] ARAI H, OHISHI T, CHANG M Y, et al. Arrangement and regulation of the genes for meta-pathway enzymes required for degradation of phenol in Comamonas testosteroni TA441[J]. Microbiology, 2000,146(7): 1707-1715. DOI:10.1099/00221287-146-7-1707.
[23] ZHU D C, XIE C X, HUANG Y, et al. Description of Comamonas serinivorans sp. nov., isolated from wheat straw compost[J].International Journal of Systematic And Evolutionary Microbiology,2014, 64(12): 4141-4146. DOI:10.1099/ijs.0.066688-0.
[24] CHEN Y H, CHAI L Y, ZHU Y H, et al. Biodegradation of kraft lignin by a bacterial strain Comamonas sp. B-9 isolated from eroded bamboo slips[J]. Journal of Applied Microbiology, 2012, 112(5): 900-906. DOI:10.1111/j.1365-2672.2012.05275.x.
[25] WANG X S, DU H, XU Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].International Journal of Food Microbiology, 2017, 244: 27-35.DOI:10.1016/j.ijfoodmicro.2016.12.018.
[26] 鲜文东, 明红, 李文均. 高温放线菌科最新研究进展[J]. 微生物学报,2015, 55(1): 1-11. DOI:10.13343/j.cnki.wsxb.20140237.
[27] GOU M, WANG H Z, YUAN H W, et al. Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J]. Journal of the Institute of Brewing, 2015,121(4): 620-627. DOI:10.1002/jib.272.
[28] 黄永光, 杨国华, 张肖克, 等. 产酱香风味芽孢杆菌类菌株发酵代谢产物及其酶分析研究[J]. 酿酒科技, 2013, 34(1): 41-45.DOI:10.13746/j.njkj.2013.01.010.
[29] 胡晓龙. 浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D]. 无锡: 江南大学, 2015: 27-28.