中国白酒品种繁多,其风格和香型也有所不同,酱香型白酒是中国传统白酒的典型香型之一,以贵州茅台酒为代表,深受消费者的欢迎[1-2]。酱香型白酒的生产属于传统酿造,是多菌种自然固态双边发酵过程,发酵产率、质量与酿造过程的微生物密切相关。其酿造涉及的微生物主要包括细菌、霉菌、酵母和放线菌。其中,细菌是重要的功能微生物菌群,可代谢多种酶类并产生丰富的酒体香味物质和其前体物质[3],赋予酒体酱香突出、优雅细腻、酒体醇厚、回味悠长、空杯留香持久的独特风格[1,4]。因此,对其细菌菌群结构多样性的系统性研究及其功能分析,是充分认识其酿造微生物资源、解析酱香型白酒发酵机理、提升产品质量的前提和基础。
酱香型白酒酿造微生物主要来源于添加的大曲和酿造环境富集[5-6],其中,高温大曲素有细菌曲之说,与产品风味特征密切相关,前人也对其中的可培养微生物开展了一系列的研究,如Wang Changlu等[7]通过表型及传统可培养法对大曲生产发酵过程的微生物进行了分离鉴定,发现4 种细菌及5 种酵母,结果表明Bacillus spp.和Saccaromyces spp.是各自的优势种属。吴徐建[1]通过可培养结合分子鉴定手段,追踪研究酱香型白酒2~7轮次酿造大曲与酒醅中的细菌群落结构,并分析了不同细菌种属对酱香风味物质形成的贡献,及优势细菌解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的功能,结果表明细菌产生的丰富酶系能够降解酿造原料中的大分子物质,为窖池发酵生香提供部分前体物质。上述研究主要集中于单一酒厂或单一轮次的生产大曲,所获得的菌株有限,同时也无法全面表征大曲中的细菌菌群结构及其变化规律。酱香型白酒的特殊风格还得益于其得天独厚的酿造环境,如“离开茅台,酿不出茅台酒”。目前对于酱香型白酒酿造环境微生物的研究较少,尤其对茅台镇酿造环境微生物的研究。仅有,张亚丽[2]通过可培养手段对茅台镇空气中的微生物菌种进行可培养分析鉴定,发现空气中的优势细菌属为芽孢杆菌属、葡萄球菌属、微球菌属和链霉菌属。王雪山[5]利用高通量测序技术对清香型白酒酿造环境微生物开展研究,发现环境微生物的改变会驱动白酒发酵过程微生物的演替。但高通量测序技术并不能充分认识和获取其中的可培养微生物资源及其主要功能,特别是一些关键功能微生物。因此,可培养技术仍然是充分认识复杂微生物体系中的关键微生物的支撑[8]。
为系统性揭示茅台镇酱香白酒酿造体系的内在生态资源及其核心机制,解析不同轮次酱香白酒酿造微生物菌群内部可培养菌群结构及其差异,研究环境和大曲中可培养细菌之间关联性及其对酿造生产的潜在性调控机制。本研究主要对茅台镇酱香型白酒酿造环境(7 个主要酿造区域)及其生产大曲(1~7轮次,2018—2019酿造年度)中的可培养细菌群落结构多样性及其功能进行解析,旨在揭示茅台镇酿酒区域性可培养细菌的多样性特征及其功能,并建立微生物生态资源库,为后续研究酱香型白酒微生物奠定基础,也为酱香型白酒生产工艺优化提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
大曲样品为茅台镇7 个主要酿造区域内的17 个酿酒企业酿造车间生产用大曲粉,取各企业酿造现场用曲粉500 g(己混匀曲粉,2018—2019酿造年度1~7轮次酿造用大曲,取样时间2018年1—9月),样品取样后用干净自封袋包装,运回实验室备用,共计119 个大曲样品。
环境样品取样点包括酒厂生产车间的晾堂地面、窗台、墙面、墙角、窗户玻璃、行车梯梯子及行车梯顶部、配电箱表面、消防箱表面、尾酒储酒罐及其他一些平时不易被打扫的角落等地面、表面灰尘,一个企业收集取混合样500 g,取样后均匀混合为一个样品(取样时间同前述,共取1~7轮次酿造生产环境样品119 个)。
取样过程每个取样点1~7轮次均固定为同一点(每个取样点作固定标记,以防被破坏),每轮次采集样品时间为2 d,所采集样品均用无菌自封袋包装、专用箱转运,样品采集完立即运回实验室分析,留存样低温保存。
1.1.2 试剂
营养琼脂(nutrient agar,NA)培养基、LB肉汤培养基 上海博微生物科技有限公司;TAE(50×)北京索莱宝科技有限公司;琼脂糖 南京生兴生物技术有限公司;核酸染料(GenGreen) 上海赛百盛有限公司;DL2000 Marker 北京康为世纪生物科技有限公司;TIANamp Bacteria DNA Kit试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
超净工作台 苏州金净科技有限公司;高压蒸汽灭菌锅、恒温鼓风干燥箱、台式高速冷冻离心机 美国Thermo Fisher Scientific公司;恒温培养箱 上海琅轩实验设备有限公司;数显恒温水浴锅 常州澳华仪器有限公司;恒温调速摇床 上海杜科自动化设备有限公司;电子天平 上海精密科学仪器有限公司;旋涡混合器海门市其林贝尔仪器制造有限公司;冰箱(-20 ℃)青岛海尔股份有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 美国伯乐公司;DYY-8C型电泳仪 北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司。
1.3 方法
1.3.1 菌株分离纯化
在无菌条件下,称取10 g样品放入装有90 mL生理盐水及少许玻璃珠的三角瓶内,室温下120 r/min振荡混匀30 min后,依次稀释为10-4、10-5、10-6和10-7梯度样品悬液,各稀释度取0.2 mL均匀涂布于NA培养基上,各稀释度做3 个平行,最后将平板置于37 ℃培养箱中培养1~2 d。根据菌株生长状况选择合适的梯度,根据菌落的大小、形态、颜色等形态学特征挑取不同的单菌落,并划线纯化培养3 次。将纯化培养的单细菌用1.5 mL的甘油管保藏(3 管),保存液为40%甘油和菌悬液以1∶1的比例混合均匀,-80 ℃保藏。
1.3.2 菌株DNA提取
将菌株接种于LB肉汤培养基中,37 ℃、140 r/min摇瓶培养24 h,用TIANamp Bacteria DNA Kit试剂盒提取菌株DNA,置于-20 ℃备用。菌株DNA提取参考TIANamp Bacteria DNA Kit试剂盒的操作说明书。
1.3.3 16S rDNA PCR扩增及凝胶电泳
细菌PCR扩增引物:27F(5’-AGAGTTTGATCC TGGCTCA-3’)和1492R(5’-GGTTACCTTGTT ACGACTT-3’)。PCR体系:细菌DNA 2 μL,27F 1 μL,1492R 1 μL,Mastermix 12.5 μL,d d H2O 8.5 μ L,总计2 5 μ L反应体系。P C R条件:95 ℃预变性3 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸60 s,35 个循环;72 ℃再延伸10 min。
凝胶电泳:1%琼脂糖凝胶,1×TAE电泳缓冲液,核酸染料(GenGreen)10 μL,PCR产物进样量5 μL,电压50 V,电泳时间40 min。
1.3.4 DNA测序
将大小合适和条带清晰的PCR扩增产物送检生工生物工程(上海)股份有限公司进行测序分析。
1.3.5 同源性分析
根据测序所得的产物序列,登陆NCBI(http://www.ncbi.nlm.nih.gov/blast),提交到GenBank,用BLAST进行同源性比较分析。
1.4 数据及图像处理
根据晋方佑等[9]方法,采用分离频率(isolation frequency,IF)比较判断可培养细菌的优势菌群。IF为分离到的某一指定类型微生物的菌株数占该样品分离总的微生物菌株数的百分率。
采用Shannon-Wiener指数(H’)和Simpson指数(D)为物种丰富度指数,分析获得的可培养细菌群落生物多样性,Pielou指数(J)分析群落物种分布的均匀程度。公式如下:

式中:Pi为菌种i的个体在全部个体中的比例;S为总物种数。
采用Sorenson相似性指数(CS)比较两样本间细菌种类组成的相似程度。如式(4)所示:
式中:j为两类样本的共有种数或属数;a、b分别为待比较的环境样本和大曲样本各自含有的物种数。
根据IF在Origin 9.0中绘制柱状图和折线图,在R语言中绘制气泡图。
2 结果与分析
2.1 可培养细菌多样性分析
从不同酿造轮次环境及生产用大曲样品中共分离获得1 370 株细菌,其中大曲样品657 株,环境样品713 株。经菌落形态相似性感官初筛,获得302 株菌并将其16S rDNA PCR扩增产物送外检测序,测序结果经NCBI序列比对,结果表明送检细菌在分类水平上归属于5 个门的28 个属下的59 个种。大曲样品中有34 个种,环境样品中有44 个种。其中,Bacillus solani、B. gottheilii、B. paralicheniformis、Brevibacillus agri、Pseudomonas xanthomarina、Lelliottia nimipressuralis、Aureimonas sp.、Sphingobacterium daejeonense、Oceanobacillus indicireducens、Cronobacter sakazakii、Mixta gaviniae、Paraburkholderia fungorum、Viridibacillus arvi、Atlantibacter hermannii鲜见在酱香白酒酿造领域报道。
为进一步统计分析所分离细菌在大曲和环境样本中的总体关联度及其具体分布,计算大曲与环境样品中可培养细菌的多样性指数(表1),图1为大曲与环境样品中可培养细菌的菌群类别。
表1 大曲样品与环境样品中可培养细菌的多样性指数
Table 1 Diversity indexes of culturable bacteria in Daqu and environmental samples

样本 Shannon-Wiener指数 Simpson指数 Pielou指数 Sorenson指数大曲 2.92 0.92 0.83 0.46环境 3.00 0.93 0.79
从表1可知,大曲与环境样品中的细菌种类组成相似程度(Sorenson指数)略低(0.46),而大曲样品的物种多样性(Shannon-Wiener指数和Simpson指数)低于环境样品,但其物种分布均匀度(Pielou指数)高于环境样品。由此可知,环境样品的细菌多样性较大曲样品丰富,这为大曲开放式制曲网络微生物菌群提供了环境微生物来源基础。
如图1A、B所示,Bacillus subtilis、Bacillus licheniformis、Bacillus sp.、Lysinibacillus fusiformis、Micrococcus sp.、B. subtilis subsp. subtilis、Virgibacillus sp.、Bacillus velezensis、Bacillus megaterium、B. agri、M. gaviniae、Staphylococcus sp.、C. sakazakii、Acinetobacter lwoffii、B. paralicheniformis在大曲中的IF在2.13%~13.70%之间,其总计IF达到86.00%,为大曲样品中的优势细菌;高温大曲在制曲发酵过程中其温度可高达65 ℃左右,上述细菌在高温条件下依然大量存活,证明这些优势细菌是经过酿造过程长期驯化后稳定留存下来的酿造资源。
同样,如图1A、C所示,Alcaligenes faecalis、Bacillus sp.、B. amyloliquefaciens、B. licheniformis、Bacillus tequilensis、Micrococcus sp.、bacterium strain、B. subtilis、B. subtilis subsp. subtilis、Staphylococcus saprophyticus、B. velezensis、uncultured bacterium在环境样品中的IF在2.10%~13.18%之间,其总计IF达到81.07%,为环境样品中的优势细菌。细菌是构成茅台镇酿造环境微生物的重要来源,尤其是耐高温芽孢杆菌,由于长期的酿酒产业发展导致其低空发布生态微生物的富集和结构优化。张亚丽[2]通过对茅台镇空气中细菌的筛选与鉴定,获得了B. subtilis subsp. subtilis、B. amyloliquefaciens、B. megaterium等可培养细菌,而本研究的大曲与环境样品也分离到了与此相同的可培养细菌。可见,酿造环境的细菌不仅来自于茅台镇的空气环境,还来自于酒厂的地面环境,这主要为长期酿造产生的曲粉等物料飞扬与空气物质的交互作用。
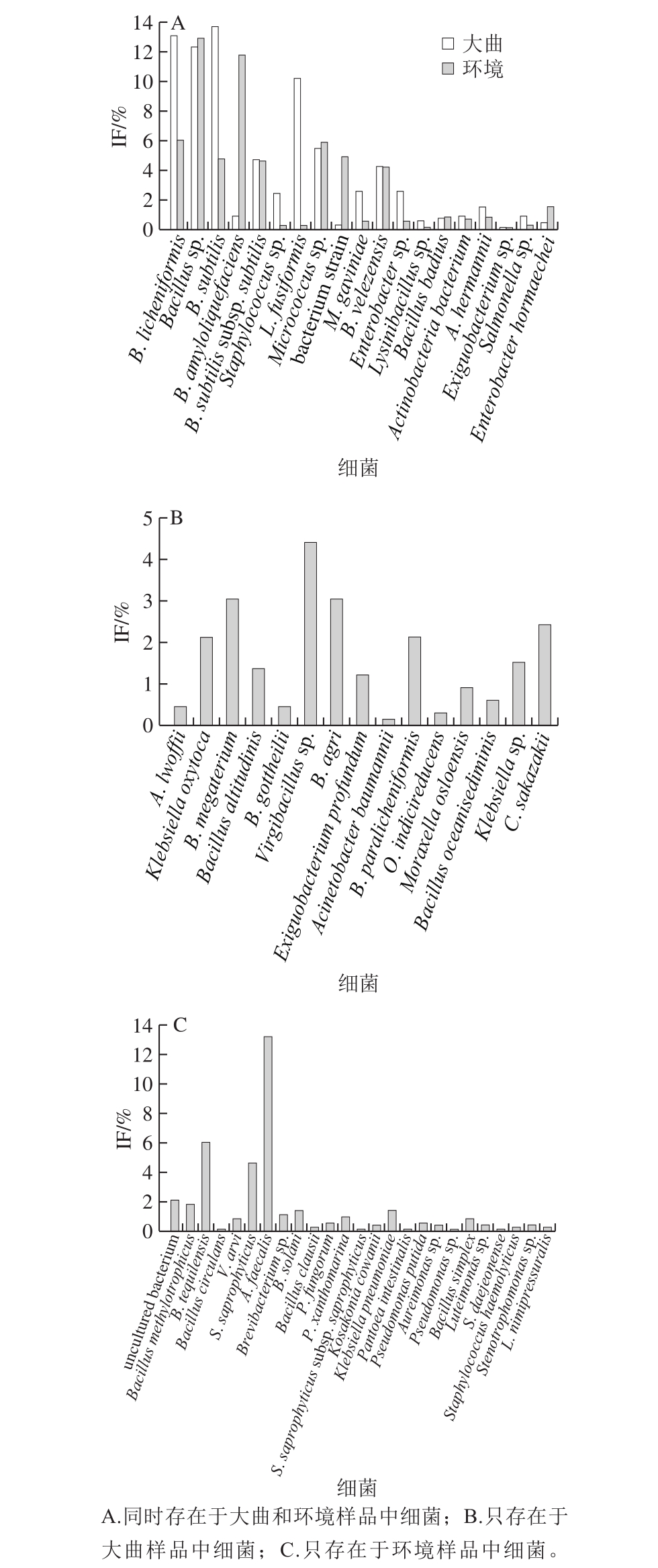
图1 大曲与环境样品可培养细菌菌群结构
Fig. 1 Culturable bacterial community structure of Daqu and environmental samples
通过图1A可知,从大曲和环境样品中检出共有细菌19 个种,占检出总细菌种数的32.20%,其中Bacillus sp.、B. licheniformis、B. subtilis、Micrococcus sp.、B. subtilis subsp. subtilis、B. velezensis为大曲与环境样品中共有的优势细菌种类,而且相对稳定,极可能为酱香白酒酿造可培养核心微生物,其功能需进一步研究分析、论证。
菌群多样性作为群落稳定性的一种指标[10]。一般认为群落的结构越复杂,多样性越高,而上述结论也说明,大曲与环境样品的细菌菌群结构在组成上有所不同,但在主要优势类群上又保持一定的相似性和稳定性,更进一步说明酱香型白酒在长期酿造过程中大曲与环境中的细菌菌群结构存在相互迁移和交互富集现象。
2.2 不同酿造轮次可培养细菌菌群结构多样性差异及其变化
为了进一步分析大曲和环境样品中可培养细菌的多样性差异,对所采集的不同酿造轮次样品中可培养细菌的分离鉴定结果进行多样性指数分析,分析其多样性变化和差异,结果见图2。
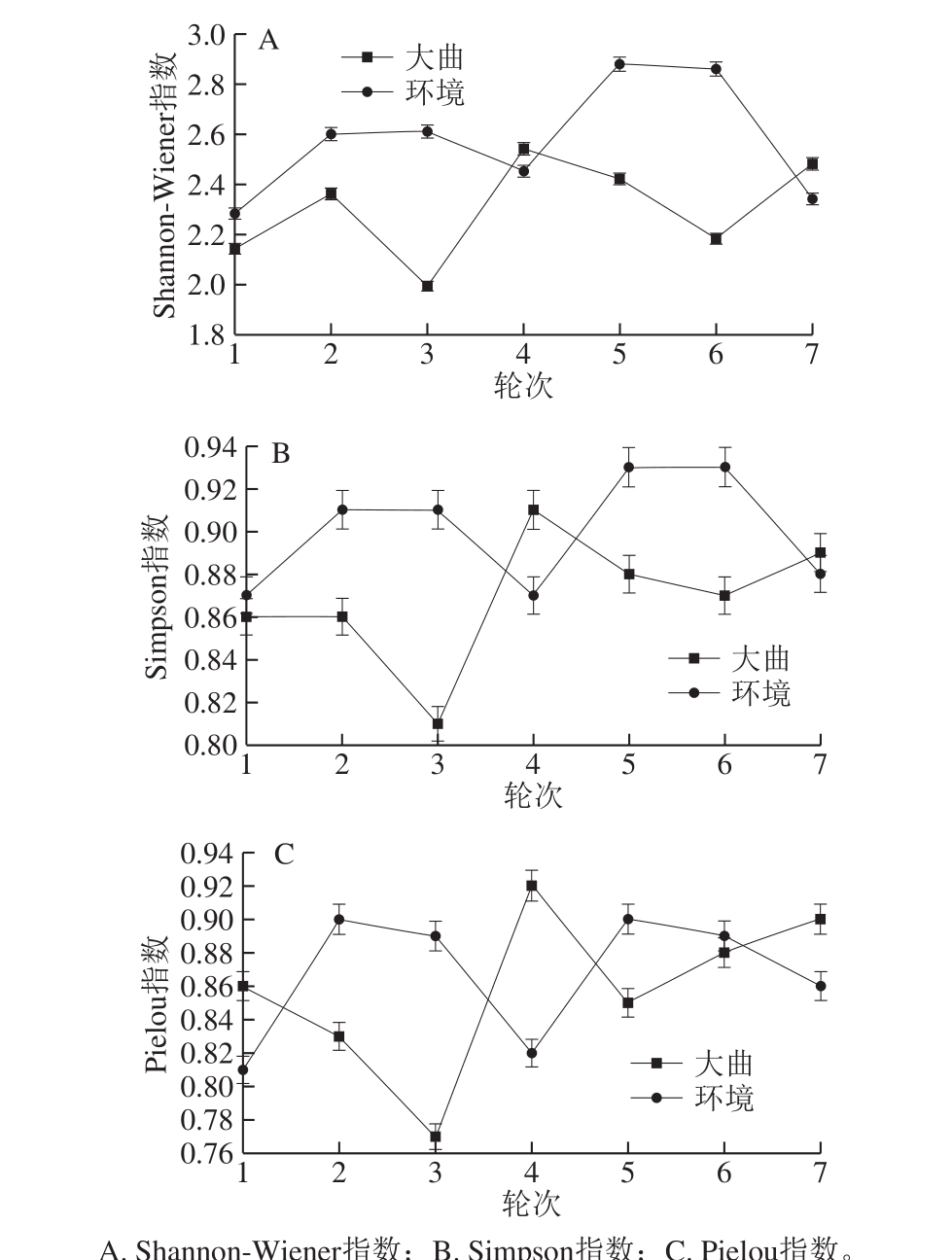
图2 各轮次大曲与环境样品中可培养细菌的多样性指数变化
Fig. 2 Changes in diversity indexes of culturable bacteria in Daqu and environmental samples from each round of fermentation
从图2A、B可看出,大曲样品中的细菌物种多样性变化为:Shannon-Wiener指数在1~2轮次缓慢上升,Simpson指数趋于平稳;在2~7轮次中,Shannon-Wiener指数和Simpson指数变化规律一致,2、3轮次为下降过程,3、4轮次稳定上升,4~6轮次连续缓慢下降,6、7轮次缓慢回升。环境样品中的细菌物种多样性变化为:Shannon-Wiener指数和Simpson指数在1~7轮次过程中变化规律呈现出一致性,1、2轮次呈缓慢上升,2、3轮次趋于稳定,3、4轮次为下降过程,到4、5轮次稳定上升,在5、6轮次保持最高值,7轮次呈大幅下降到1轮次的水平。由图2C可知,4轮次环境样品中的物种分布均匀度(Pielou指数)最低。可见4轮次可能为环境样品细菌多样性的转折点,在此前后2轮次其多样性都稳定保持在较高水平。相反,在大曲样品中,细菌多样性在4轮次达到最高水平。大曲样品中细菌多样性除在4轮次与7轮次略高于环境样品外,其他轮次均小于环境样品。实践生产中3~5轮次的出酒率高且酒质好,但其物种多样性却并非保持一致,而是有高有低,波动极大,这可能与酿造物料形态、酿造参数变化及其整体微生物菌群结构有关,其具体机制正在开展进一步的研究。同时也表明物种多样性反映的是微生态结果,产酒产质量体现的是核心微生物结构问题,即微生物生态结构虽然丰富但不一定协调,同时也说明真正要丰产和高质还得看酿酒核心微生物结构及其丰度。
通过上述分析表明,优势度大的可培养细菌基本都归于几个属,因此,为进一步寻找其可培养细菌中的核心菌群,本研究通过气泡图分析可培养细菌在各轮次样品中的分布及菌群结构演替规律。

图3 属水平上各轮次大曲及环境样品中可培养细菌菌群结构多样性
Fig. 3 Structural diversity of culturable bacteria communities in of Daqu and environmental samples from each round of fermentation
如图3所示,在属水平上各轮次大曲和环境样品中的细菌菌群优势度及多样性分布特征明显。在1~7轮次大曲样品中一共检出18 个属,分别为8、11、8、11、10、5、8 个属。从1~7轮次环境样品中一共检出24 个属,各轮次分别为9、8、9、12、14、16、9 个属。
将在样本中分布频率较大并普遍存在的微生物菌群作为核心微生群,是寻找复杂发酵体系中的核心微生物菌群的方法[11-13]。如图3所示,在属水平上各轮次大曲和环境样品中的细菌菌群优势度及多样性分布特征明显,在大曲样品中Bacillus、Lysinibacillus、Staphylococcus和Micrococcus稳定分布于6 个轮次以上的样品中,其分布频率大且优势度高。结合图1分析,大曲样品中优势可培养细菌均包含在Bacillus、Lysinibacillus、Staphylococcus、Micrococcus、Alcaligenes这5 个属中。Bacillus包括B. subtilis、B. licheniformis、Bacillus sp.、B. subtilis subsp. subtilis、B. velezensis、B. megaterium和B. paralicheniformis,可知Bacillus属内的优势细菌不仅优势度大且种类多;Lysinibacillus下的L. fusiformis优势度大并分布在6 个轮次的大曲样品中;而Staphylococcus下的Staphylococcus sp.和Micrococcus下的Micrococcus sp.也都分布在6 个轮次的大曲样品中。由此表明,Bacillus、Lysinibacillus、Staphylococcus和Micrococcus为大曲样品中可培养核心细菌属;同理,将Bacillus、Staphylococcus、Micrococcus和Alcaligenes以及暂未鉴定明确的未知细菌属列为环境样品中可培养的核心细菌属;Bacillus、Staphylococcus和Micrococcus列为大曲和环境样品共有的可培养核心微生物属。将其结果与其他地区白酒酿造过程中优势细菌属及核心细菌属比较,发现其主要细菌菌群结构差异会伴随地域性差异而发生,如,周瑞平等[14]对四川浓香型白酒厂内可培养细菌多样性的研究发现,其优势细菌属为Bacillus、Lysinibacillus、Staphylococcus、Rummeliibacillus、Brevibacillus和Brachybacterium;王鹏等[11]对江苏某些酒厂的微生物进行研究发现其核心细菌属为Bacillus、Lactobacillus和Lactococcus;以上结论表明,区域性核心微生物的结构差异性是导致各区域酿酒产业发展和酿造酒体征特风味差异的重要原因之一。
另外,从图3还可看出,Firmicutes和Proteobacteria为整个酿造过程中可培养细菌的优势菌门,且Firmicutes在大曲中的优势度比在环境样品中的优势度高,而该门下的Bacillus与Staphylococcus在连续7 个轮次的大曲和环境样品中都处于优势地位,其中Bacillus为绝对优势菌属,该结论与其他文献报道结果一致[2,6],同时也与本课题组对同批样品微生物结构的宏基因组学分析结果一致。Bacillus为传统酿造过程中的优势菌群和功能菌群,是白酒发酵过程中风味演替的主要动力[11]。上述结论表明,酱香白酒酿造过程各轮次大曲与环境的菌群结构具有较好的互动性,在其主要功能细菌菌群结构演替中仍然保持一致性,这也进一步说明环境微生物是酱香型白酒酿造过程中微生物的重要来源之一,因此对其功能进一步分析十分重要。
2.3 可培养细菌产酶及金属离子吸附性功能分析
细菌对白酒酿造过程基础酒体的风格、酒体风味物质起着极大的调控作用,此外,细菌还为白酒酿造过程提供了环境净化的功能作用[15]。为研究可培养优势细菌的功能,基于大曲与环境样品中可培养细菌,在种水平上对可培养核心细菌属下的优势细菌种进行了产酶和金属离子的吸附性能分析,为其下一步精准鉴定其可培养核心细菌菌群及其功能研究提供依据和奠定基础。
表2 大曲样品中优势细菌的功能总结分析
Table 2 Functions of dominant bacteria in Daqu samples

注:—.该菌无此项功能特性,下同。
细菌 产酶特性 金属离子吸附性B. megaterium 纤维素酶、木质素氧化酶、漆酶[16] Au3+[17]B. paralicheniformis 精氨酸水解酶、皂苷水解酶、明胶水解酶[18]、铁脲酶[19] —L. fusiformis 氨基甲酸乙酯水解酶[20]、几丁质酶[21]、蛋白酶、酯酶[22] Cr6+[23]Staphylococcus sp. 脂肪酶[24]、木聚糖酶[25] —
由表2可知,仅存在于大曲样品中的可培养优势细菌可代谢丰富的酶系。B. megaterium可产纤维素酶等酶,其代谢纤维素酶可催化β-1,4-糖苷键水解,可将纤维素降解为纤维二糖和葡萄糖[26]。在酿造过程B. megaterium可降解大曲原料、高粱原料,有利于制曲过程微生物的生长和富集。此外,L. fusiformis具有产蛋白酶和氨基酸酶的功能。而蛋白酶能够水解酱香大曲中的蛋白质,一方面其产物为微生物生长提供营养物质,另一方面形成的氨基酸与葡萄糖发生美拉德反应,为白酒香味提供前体物质[26]。Staphylococcus sp.可代谢产脂肪酶,脂肪酶能水解长链脂肪酸甘油生成游离脂肪酸和甘油,生成的产物构成了白酒中香味物质的本身或者前驱物质[26]。大曲中的优势细菌还有对金属的吸附性,主要有B. megaterium和L. fusiformis,可吸附的金属离子分别为Au3+和Cr6+。以上结果表明,存在于大曲样品中的可培养优势细菌以产酶功能为主,且以富集白酒风味的酶系居多。其菌株具体的代谢酶类和风味成分正在开展进一步的研究工作。
表3 环境样品中优势细菌的功能总结分析
Table 3 Functions of dominant bacteria in environmental samples

细菌 产酶特性 金属离子吸附性B. tequilensis 蛋白酶、漆酶、果胶酶、木聚糖酶[27] —S. saprophyticus 脂肪酶[28] Cr6+、Pb2+、Cu2+[29]A. faecalis D-氨基酰化酶[30]、腈水解酶[31]、纤维素酶[32] —uncultured bacterium— —B. amyloliquefaciens 淀粉酶、蛋白酶[33]、木聚糖酶、纤维素酶、植酸酶[34] Cr6+[35]bacterium strain— —
从表3可知,存在于环境样品中的优势细菌有4 种具有产酶功能,占比为67%,33%的菌株暂未发现其产酶特性。可见,存在于环境样品中的可培养优势细菌也具有丰富的代谢酶类,可代谢产10 种酶类,分别为蛋白酶、淀粉酶、漆酶、果胶酶、木聚糖酶、脂肪酶、D-氨基酰化酶、腈水解酶、纤维素酶和植酸酶,其中以蛋白酶及纤维素酶类为主,不同的代谢酶类共同构成了酿酒环境中繁杂的酶系结构。此外,具有吸附金属特性的菌株分别是B. amyloliquefaciens和S. saprophyticus,可吸附金属离子Cr6+、Pb2+和Cu2+。
表4 大曲和环境样品中共有优势细菌功能总结分析
Table 4 Functions of dominant bacteria common to Daqu and environmental samples

细菌 产酶特性 金属离子吸附性B. licheniformis 蛋白酶、淀粉酶、脂肪酶[32]、木聚糖酶[36] Pb2+[37]Bacillus sp. 酯酶、淀粉酶、酸性蛋白酶[32]、纤维素酶[38]、漆酶[39] Pb2+[40]B. subtilis 蛋白酶、淀粉酶、脂化酶[32]、纤维素酶[41]、植酸酶[42]Mg2+、Fe3+、Cu2+、Na+、K+、Au3+、Ni2+[43]B. subtilis subsp. subtilis 木聚糖酶、纤维素酶[44] —B. velezensis 淀粉酶[45]、 纤维素酶[46] —Micrococcus sp. 蛋白酶、酯酶、淀粉酶、漆酶[47] —
表4为大曲和环境样品中共有的6 种优势细菌,结果表明其全部菌株都具有产酶功能。从所产酶类看,主要为蛋白酶、淀粉酶、脂肪酶和纤维素酶类,而这几大酶类正是白酒酿造的重要酶结构。从原料的降解到酒体风味物质的形成都与这四大酶系息息相关。对金属具有吸附性的菌株有3 种,占比为50%,分别为B. licheniformis、Bacillus sp.和B. subtilis,其中B. subtilis对金属离子吸附能力最强,其吸附金属离子的种类达7 种。由此说明,茅台镇酿造环境之所特殊,一方面是由于环境中富集了大量细菌及其具有代谢酿造酶类的多样性潜质,不但可降解发酵底物,促进发酵和生香,同时也降解了环境中对酿造体系构成污染威胁的一些大分子物质;另外,由于环境中有较多的细菌具有金属离子吸附性,将工业化、水体等所难以避免而带入的重金属离子通过微生物吸附降解方式除去,净化酿造环境,从而为酱香白酒酿造提供了良好的宏观与微观环境,促进了产品品质的提升、产品安全性和微生物生态结构的稳定性。
3 结 论
通过传统可培养和分子生物学鉴定方法,对茅台镇2018—2019酿造年度1~7轮次大曲及环境样品中可培养细菌菌群结构多样性及其功能开展研究。从样品中共分离得1 370 株细菌,鉴定归属于5 个门、28 个属和59 种细菌。所分离获得菌株B. solani、B. gottheilii、B. paralicheniformis、B. agri、P. xanthomarina、L. nimipressuralis、Aureimonas sp.、S. daejeonense、O. indicireducens、C. sakazakii、M. gaviniae和P. fungorum鲜见在酱香白酒酿造过程检出和报道。同时,优势度高的可培养细菌高度集中在Bacillus、Lysinibacillus、Staphylococcus、Micrococcus和Alcaligenes这5 个属里。细菌属分布频率和优势度表明,Bacillus、Lysinibacillus、Staphylococcus和Micrococcus为酿造大曲中的核心可培养细菌属,Bacillus、Staphylococcus、Micrococcus和Alcaligenes为环境中的核心可培养细菌属,Bacillus、Staphylococcus和Micrococcus为大曲和环境样品中共有的可培养核心细菌属;核心细菌属下优势细菌的功能分析表明,各轮次大曲与环境中的细菌菌群结构虽有差异性,但主要功能细菌菌群结构及其演替基本保持一致。大曲和环境样品中的优势细菌都具有产丰富酶系的功能,且具有较强的金属离子吸附降解功能,说明可培养优势细菌一方面为茅台镇酱香型白酒酿造提供了丰富的生物性资源、丰富的酿造酶系结构,调控重要风味形成;另一方面为高品质的酱香白酒酿造提供了净化、安全的基础环境条件。本研究为茅台镇酱香型白酒酿造建立可培养细菌资源库奠定了基础,为后续专项研究提供了参考,同时对茅台镇酱香型白酒的产业发展提供了科学的微生物理论支撑。
[1] 吴徐建. 酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D]. 无锡: 江南大学, 2013.
[2] 张亚丽. 贵州省仁怀地区茅台空气微生物的鉴定与分析[D]. 北京:北京化工大学, 2014.
[3] 戴奕杰, 李宗军, 田志强. 酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学, 2019, 40(4): 152-159. DOI:10.7506/spkx1002-6630-20180228-251.
[4] 闻熙. 茅台酒厂之外无“茅台酒”: 解读国酒茅台核心竞争力之环境篇[J]. 国际人才交流, 2006(12): 52-53.
[5] 王雪山. 不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D]. 无锡: 江南大学, 2018.
[6] 程才璎, 刘晓风, 袁月祥, 等. 酱香型白酒酒曲和连续七轮次堆积酒醅的细菌群落结构[J]. 应用与环境生物学报, 2014, 20(5): 825-831.DOI:10.3724/SP.J.1145.2014.03035.
[7] WANG C L, SHI D J, GONGG G L. Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J]. World Journal of Microbiology & Biotechnology, 2008, 24(10): 2183-2190.DOI:10.1007/s11274-008-9728-0.
[8] 蒋思峡. 传统与机械化酱香大曲的菌群结构分析[D]. 贵阳: 贵州大学, 2017.
[9] 晋方佑, 李治滢, 王永霞, 等. 云南程海湖可培养真菌多样性分析[J].应用与环境生物学报, 2013, 19(6): 1025-1030. DOI:10.3724/SP.J.1145.2013.01025.
[10] 高宝嘉. 雾灵山森林植物与节肢动物群落结构及多样性研究[D].北京: 北京林业大学, 2005.
[11] 王鹏, 吴群, 徐岩. 中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J]. 微生物学报, 2018, 58(1): 142-153. DOI:10.13343/j.cnki.wsxb.20170060.
[12] BOUCHERBA N, GAGAOUA M, BOUANANE-DARENFED A,et al. Biochemical properties of a new thermo- and solventstable xylanase recovered using three phase partitioning from the extract of Bacillus oceanisediminis strain SJ3[J]. Bioresources and Bioprocessing, 2017, 4(1): 29. DOI:10.1186/s40643-017-0161-9.
[13] PERIASAMY A, GURUSAMY A, BYUNG H. Production of alkaline protease from a newly isolated Exiguobacterium profundum BK-P23 evaluated using the response surface methodology[J]. Biologia, 2013,68(2): 186-193. DOI:10.2478/s11756-013-0159-5.
[14] 周瑞平, 陈云宗, 唐代云. 多粮浓香型白酒厂内细菌多样性及分布的研究[J]. 食品科学, 2010, 31(13): 209-213.
[15] 张辉, 李培军, 胡筱敏, 等. 固定化芽孢杆菌修复油污染地表水的研究[J]. 中国给水排水, 2007(7): 28-31. DOI:10.3321/j.issn:1000-4602.2007.07.007.
[16] 苏玉龙, 王倩, 张成省, 等. 降解烤烟秸秆和烟碱菌株的筛选及其产酶特性[J]. 微生物学报, 2015, 55(12): 1543-1550. DOI:10.13343/j.cnki.wsxb.20150157.
[17] 刘月英, 傅锦坤, 陈平, 等. 巨大芽孢杆菌D01吸附金(Au3+)的研究[J]. 微生物学报, 2000(4): 425-429. DOI:10.13343/j.cnki.wsxb.2000.04.015.
[18] KIM S J, DUNLAP C A, KWON S W, et al. Bacillus glycinifermentans sp.nov. isolated from fermented soybean paste[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(10):3586-3590. DOI:10.1099/ijsem.0.000462.
[19] LIU Q, CHEN Y, YUAN M, et al. A Bacillus paralicheniformis ironcontaining urease reduces urea concentrations in rice wine[J]. Applied and Environmental Microbiology, 2017, 83(17): AEM.01258-17.DOI:10.1128/AEM.01258-17.
[20] 王伟高, 陈坚, 周景文. 赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化[J]. 食品与生物技术学报, 2017, 36(3): 259-265.DOI:10.3969/j.issn.1673-1689.2017.03.005.
[21] SINGH R K, KUMAR D P, SOLANKI M K, et al. Optimization of media components for chitinase production by chickpea rhizosphere associated Lysinibacillus fusiformis B-CM18[J]. Journal of Basic Microbiology, 2013, 53(5): 451-460. DOI:10.1002/jobm.201100590.
[22] SURYIA P M, DIVAKAR K, DEEPA A P J, et al. Statistical analysis of production of protease and esterase by a newly isolated Lysinibacillus fusiformis AU01: purification and application of protease in subculturing cell lines[J]. Annals of Microbiology, 2015, 65(1): 33-46.DOI:10.1007/s13213-014-0833-z.
[23] 何敏艳. 高效铬还原菌Bacillus cereus SJ1和Lysinibacillus fusiformis ZC1的铬还原特性和全基因组序列分析[D]. 武汉: 华中农业大学, 2010.
[24] POGAKU P, FAN W, SURESH A, et al. Optimization of lipase production by Staphylococcus sp. Lp12[J]. African Journal of Biotechnology, 2010, 9(6): 882-886.
[25] GUPTA S, BHUSHAN B, HOONDAL G S. Enhanced production of xylanase from Staphylococcus sp. SG-13 using amino acids[J]. World Journal of Microbiology and Biotechnology, 1999, 15(4): 511-512.DOI:10.1023/a:1008932119389.
[26] 肖蓓. 酱香大曲中细菌类群关系研究与功能细菌筛选[D]. 贵阳:贵州大学, 2015.
[27] KHUSRO A, KALIYAN B K, AL-DHABI N A, et al. Statistical optimization of thermo-alkali stable xylanase production from Bacillus tequilensis strain ARMATI[J]. Electronic Journal of Biotechnology,2016, 22: 16-25. DOI:10.1016/j.ejbt.2016.04.002.
[28] FANG Y, LU Z, LV F, et al. A newly isolated organic solvent tolerant Staphylococcus saprophyticus M36 produced organic solvent-stable lipase[J]. Current Microbiology, 2006, 53(6): 510-515. DOI:10.1007/s00284-006-0260-x.
[29] SAI K R Y, DAVID G, RAY V W. Adsorbents for the removal of arsenic,cadmium, and lead from contaminated waters[J]. Journal of Hazardous Materials, 2009, 171(1): 1-15. DOI:10.1016/j.jhazmat.2009.05.103.
[30] 陶金, 倪孟祥. 粪产碱杆菌D-氨基酰化酶的分离纯化及发酵条件优化[J]. 化学与生物工程, 2016, 33(4): 55-58. DOI:10.3969/j.issn.1672-5425.2016.04.014.
[31] 徐建明, 柳志强, 徐建妙, 等. 高产腈水解酶Alcaligenes faecalis UL44菌株的诱变筛选[J]. 微生物学杂志, 2011, 31(5): 45-48.DOI:10.3969/j.issn.1005-7021.2011.05.009.
[32] 杜冰, 郑来久, 魏取福. 响应面法优化粪产碱菌Alcaligenes faecalis DL-08产纤维素酶培养工艺[J]. 工业微生物, 2015, 45(5): 7-12.DOI:10.3969/j.issn.1001-6678.2015.05.002.
[33] 张荣. 产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡: 江南大学, 2009.
[34] BORRISS R, MAKAREWICZ O, IDRISS E E, et al. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect[J]. Microbiology, 2002, 148(7): 2097-2109. DOI:10.1099/00221287-148-7-2097.
[35] BHAGWAT P, SASMITADA S, PRADEEP K D, et al.Optimization of extracellular chromate reductase production by Bacillus amyloliquefaciens (CSB 9) isolated from chromite mine environment[J]. Biocatalysis and Agricultural Biotechnology, 2014,3(3): 35-41. DOI:10.1016/j.bcab.2014.01.004.
[36] ARCHANA A, SATYANARAYANA T. Xylanase production by thermophilic Bacillus licheniformis A99 in solid-state fermentation[J].Enzyme & Microbial Technology, 1997, 21(1): 12-17. DOI:10.1016/S0141-0229(96)00207-4.
[37] 张金帆, 杜春艳, 文晓凤, 等. 固定化地衣芽孢杆菌Pb2+的吸附特性研究[J]. 环境科学与技术, 2018, 41(11): 87-92.
[38] 陈龙. 高产纤维素酶芽孢杆菌157的筛选、特性分析及对玉米秸秆-豆粕混合固态发酵降解功能的研究[D]. 长春: 吉林农业大学, 2018.
[39] 王佳懿. 芽胞杆菌漆酶的定点突变及酶学性质研究[D]. 哈尔滨:东北林业大学, 2018.
[40] 陈兰洲, 赵瑞雪, 武艳芳, 等. 芽孢杆菌Z-y3对Pb(II)吸附特性及机理[J]. 中南民族大学学报(自然科学版), 2018, 37(1): 30-34.DOI:10.12130/znmdzk.20180107.
[41] 聂利波, 李旺, 史敦胜, 等. 产纤维素酶枯草芽孢杆菌Kpg酶学性质研究及对麸皮纤维素含量的影响[J]. 家畜生态学报, 2018, 39(12):25-30. DOI:10.3969/j.issn.1673-1182.2018.12.005.
[42] 王亚茹, 姚斌, 曾虹, 等. 枯草芽孢杆菌中性植酸酶的纯化和酶学性质[J]. 微生物学报, 2001(2): 198-203. DOI:10.3321/j.issn:0001-6209.2001.02.012.
[43] BEVERIDGE T J, MURRAY R G E. Uptake and retention of metals by cell walls of Bacillus subtilis[J]. Journal of Bacteriology, 1976,127(3): 1502-1518. DOI:10.1139/m78-233.
[44] KIM B K, LEE B H, LEE Y J, et al. Purification and characterization of carboxymethylcellulase isolated from a marine bacterium, Bacillus subtilis subsp. subtilis A-53[J]. Enzyme and Microbial Technology,2009, 44(6/7): 411-416. DOI:10.1016/j.enzmictec.2009.02.005.
[45] WANG L T, LEE F L, TAI C J, et al. Bacillus velezensis is a later heterotypic synonym of Bacillus amyloliquefaciens[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(3):671-675. DOI:10.1016/j.diamond.2007.11.010.
[46] 邓先余, 邹谋勇, 黄志坚, 等. 一株产纤维素酶细菌的分离鉴定及其酶学特性研究[J]. 中山大学学报(自然科学版), 2012, 51(5): 93-99.
[47] DU L N, ZHAO M, LI G, et al. Biodegradation of malachite green by Micrococcus sp. strain BD15: biodegradation pathway and enzyme analysis[J]. International Biodeterioration & Biodegradation, 2013,78(2): 108-116. DOI:10.1016/j.ibiod.2012.12.011.