植物内生菌泛指生活在植物组织内,暂时不引起宿主出现明显病害症状的微生物,包括表面生活的腐生微生物和潜伏性病原微生物[1]。现有研究表明,所有植物中均存在丰富的内生菌,但人类仅研究了其中很小的一部分,绝大多数还处于未知状态[2]。对众多瓜果实内生菌的研究表明,其内生菌数量、种群等易受宿主种类、生长阶段及环境的影响[3-5]。同时,随着宿主生长阶段的变化,及其中纤维素酶、蛋白酶和几丁质酶等相关物质的变化,有些在前期无害的内生菌可能会引起宿主的病害[6]。因此,研究植物内生菌不仅对进一步研究微生物的环境适应性、群落演替和微生物资源挖掘有重要研究价值,也对果蔬贮藏保鲜、防病治病有着重要应用价值。
库车小白杏因盛产于新疆阿克苏地区库车县而得名,是新疆的特色水果之一。其鲜果成熟期集中,贮存期短,易腐败变质。目前普遍认为,小白杏的腐败变质除了与其采后理化过程相关外,主要与真菌侵染有关,但国内外对细菌在其中发挥的潜在作用鲜有研究。前期研究发现,随着库车小白杏采后成熟度的增加,其菌群组成结构存在明显的更替。高通量测序结果进一步证明了,小白杏内生细菌中存在一些与植物软腐相关的病原菌,可能与库车小白杏采后的软化腐败有关,如泛菌属类菌群随着成熟的推进,其所占比例增加了近416 倍,葡糖杆菌属类菌群则增加了约17.5 倍[7]。因此,解析库车小白杏内生细菌群落组成并筛选相关内生细菌,为揭示和验证库车小白杏采后腐败变质的内在机理提供了科学依据。
本研究采用高通量测序法结合传统分离培养法,对库车小白杏内生细菌群落结构组成进行分析,并对其产蛋白酶、脂肪酶、纤维素酶、淀粉酶、果胶酶特性进行研究,旨在揭示库车小白杏果实可培养微生物群落多样性,同时,从活性酶产生菌的角度解析其与果实软腐的潜在关系,为进一步开发库车小白杏的贮藏保鲜方法、挖掘相关活性物质等研究提供理论依据。
1 材料与方法
1.1 材料与试剂
库车小白杏于2018年6月采自库车县乌恰镇小白杏果园中,根据成熟等级,选择果实自然成熟,无机械伤痕,无病变,且表皮有光泽,颜色、大小、硬度等表观一致的小白杏(约(2.0~2.5)cm×(2.5~3.0)cm),经发泡网包裹装筐后,12 h内运回实验研究室,于4 ℃贮藏,并在48 h内尽快开展相关表面消毒和分离筛选等工作。
1.2 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):200 g马铃薯去皮切块后煮30 min,过滤后加入葡萄糖20 g,琼脂18 g,pH 7.0左右;察式培养基:硝酸钠3 g、氯化钾0.5 g、磷酸氢二钾1 g、七水硫酸亚铁0.01 g、七水硫酸镁0.5 g、蔗糖30 g、琼脂17 g,pH 6.0左右;种子琼脂培养基:葡萄糖20 g、酵母粉5 g、磷酸氢二钾1g、硫酸镁15 g、乙醇15 mL、琼脂18 g,pH 6.5左右;蛋白酶筛选培养基:营养琼脂(nutrient agar,NA)培养基中加入脱脂牛奶20 g;脂肪酶筛选培养基:NA培养基中加入75 mL三丁酸甘油酯乳化液(15 mL三丁酸甘油酯加入60 mL 2%聚乙烯醇溶液,加热,160 Hz超声10 min,间隔2 s);纤维素酶筛选培养基:NA培养基中加入羧甲基纤维素钠2 g;果胶酶筛选培养基:酵母粉5 g、CaCl2·2H2O 0.5 g、聚果胶酸钠10 g、2% NaOH 9 mL、溴百里酚蓝0.2%溶液12.5 mL,琼脂8 g,121 ℃高压灭菌不超过15 min;胰蛋白胨大豆琼脂培养基(tryptic soy agar,TSA)、高氏一号培养基、R2A培养基、完全培养基、NA培养基、LB培养基 青岛高科园海博生物技术有限公司。
1.3 方法
1.3.1 样品的表面消毒
库车小白杏经自来水流水冲洗10 min,无菌滤纸吸干水分,75%乙醇溶液处理5 min,经无菌水洗涤,3%H2O2溶液浸泡3 min,再用无菌水冲洗3~4 次,最后一次无菌水洗涤液经涂板检测无菌后,备用。
1.3.2 总DNA的提取
经表面消毒的库车小白杏,采用十六烷基三甲基溴化铵(etyltrimethylammonium-ammonium bromide,CTAB)法[8]对样本的基因组DNA进行大量提取,设置3 个重复,经凝胶电泳检测DNA浓度及纯度合格后,作为聚合酶链式反应(polymerase chain reaction,PCR)扩增模板使用。
1.3.3 16S r DNA序列V57可变区的PCR扩增
以前述内生菌D N A为模板,采用引物为799 F(AACMGGATTAGATACCCKG)和1 193 R(ACGTCATCCCCACCTTCC)[9],扩增16S rRNA基因序列的V5-V7可变区。PCR条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃延伸10 min。扩增PCR产物经电泳检测切胶回收,并调节检测浓度一致,样品送至北京诺禾致源生物信息科技有限公司进行高通量测序。
1.3.4 数据预处理
所得的测序数据经去除冗余和无效序列后,对有效序列Tags聚类,以同源性大于97%聚为一个操作分类单元(operational taxonomic units,OTU),作为一个假定的分类单元。选取代表性序列,通过RDP classifier软件进行物种分类,确定OTU之间的分类地位。
1.3.5 菌株的分离及纯化
梯度稀释法:样品经表面消毒后,无菌条件下去核并分别称取200 g果肉,进行匀浆。将组织悬液按10-1、10-2、10-3梯度稀释至10-5,取0.1 mL组织悬液将其分别涂布在实验所需的各类培养基上,每个梯度设置3 个重复,于28 ℃条件下进行培养。每间隔24 h观察一次培养皿的变化情况。
组织切块法:选择10 颗经表面消毒的果实,无菌条件下使用刀片将果实由外向内进行1 cm×1 cm的切块,并将切块平均切成3 段,将靠近杏核的一段放至于实验所需的各类培养基上进行培养,每颗杏果设置3 个重复,于28 ℃条件下进行培养。每间隔24 h观察一次培养皿的变化情况。
待培养基长出菌落,于无菌条件下挑取不同形态的单菌落植于新培养基上再次进行培养。不断重复此操作,直至得到形态单一的菌落为止。
1.3.6 菌株的分子鉴定
采用菌落克隆方法,利用细菌16S rRNA基因通用引物27 F和1 492 R进行PCR扩增[10]。条件为95 ℃预变性5 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,30 个循环;72 ℃延伸10 min。PCR产物经切胶纯化回收后,送往北京鼎国生物技术有限公司进行测序。
所测得的序列与EzTaxon数据库(http://www.ezbiocloud.net/eztaxon/ identify)进行比对,并调取相似性最高模式菌株序列,使用MEGA 5.0进行ClustalX多重比对,使用Neighbor-Joining法构建系统发育树,自举值为1 000,初步确定菌株的生物学分类地位。
1.3.7 菌株产酶特性的测定
将纯化好的菌株接至待测培养基上进行测定,于28 ℃条件下进行培养。果胶酶筛选可通过观察菌落周围的培养基是否有下凹,若存在该现象则为阳性。蛋白酶、脂肪酶筛选可直接通过观察菌落周围是否存在透明圈;纤维素酶筛选需用刚果红染色后观察菌落周围是否有透明圈;淀粉酶筛选需用0.1%的碘液染色,在5 min之内观察菌落周围是否有透明圈。以上培养基若存在透明圈则为阳性,根据透明圈直径与菌落的直径比值的比较各菌株产酶能力的强弱[11]。
1.4 数据处理
群落组成分析、多样性分析、功能酶活性分析及相关的方差分析等工作采用DPS v9.50、Origin 8.0 Excel 2003等软件进行。
2 结果与分析
2.1 高通量测序法分析内生细菌群落组成
通过对各样品内生细菌的16S rDNA V57区测序,总计测得原始序列113 448 条,过滤掉低质量序列后,总数为106 202 条。所得序列经聚类比对,以相似度低于97%聚类为1 个OTU,并去除植物体内的线粒体、叶绿体相关序列后,共获得406 个OTU,涉及9 个门,16 个纲,44 个目,99 个科,94 个属。其中,在门水平上,以变形杆菌门和厚壁菌门为优势菌群。在种群多样性方面,以假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、芽孢杆菌属(Bacillus)、短波单胞菌属(Brevundimonas)种群最为多样(图1)。其中,未分类菌群(unclassified)为绝对优势菌群,约占总菌群OTU数量的17.73%。其次为拟杆菌属(Bacteroides)、芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)、乳杆菌属(Lactobacillus)、鞘脂单胞菌属(Sphingomonas)、马赛菌属(Massilia)、劳特氏菌属(Blautia)、假单胞菌属(Pseudomonas)和蟑螂杆状体科未分类属(unclassified Blattabacteriaceae)。

图1 主要菌属OTU所占比例
Fig. 1 Proportion of OTU in major genera
2.2 小白杏果实内生细菌的分离
经不同分离培养基培养3~15 d后,根据菌落形态观察,共挑取各类菌株235 株。通过共同接种至NA培养基中,观察菌落形态和显微形态去重后,获得实验菌株99 株。其中,采用R2A培养基共分离获得菌株8 株,而常规分离培养基分离到菌株91 株,其占绝大多数。不同培养基来源菌株统计数情况如表1所示。
表1 主要菌属OTU所占比例
Table 1 Proportion of OTU in major genera cultured with different media
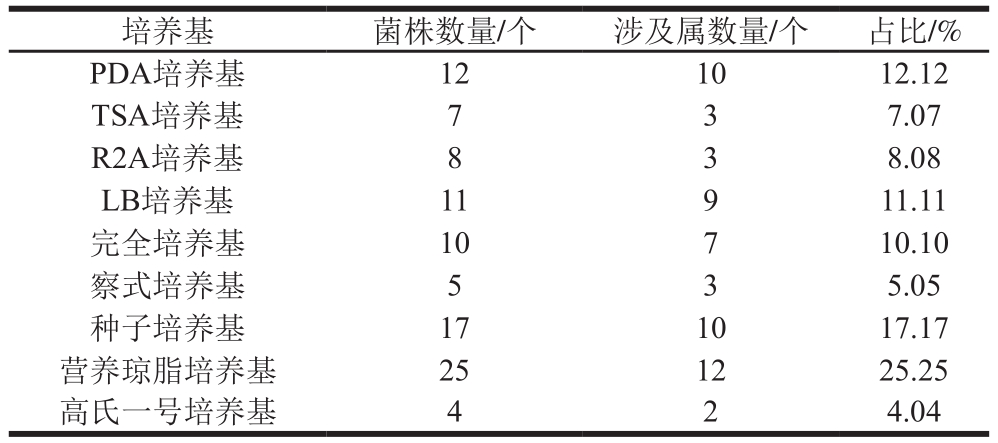
培养基 菌株数量/个 涉及属数量/个 占比/%PDA培养基 12 10 12.12 TSA培养基 7 3 7.07 R2A培养基 8 3 8.08 LB培养基 11 9 11.11完全培养基 10 7 10.10察式培养基 5 3 5.05种子培养基 17 10 17.17营养琼脂培养基 25 12 25.25高氏一号培养基 4 2 4.04
2.3 内生细菌多样性分析
上述99 株菌的16S rRNA基因序列经PCR扩增和测序后,运用EzTaxon数据库(http://www.ezbiocloud.net/identify)进行相似度比较。结果表明,在门水平中(图2),厚壁菌门(Firmicutes)为所得库车小白杏内生细菌的主要菌门,约占总菌数的40%;其次为放线菌门(Actinobacteria),约占总菌数的32%;变形杆菌门(Proteobacteria)约占总菌数的26%,拟杆菌门(Bacteroidetes)仅占总菌数2%。与高通量测序结果相比较,库车小白杏共涉及8 个门,变形杆菌门为库车小白杏可培养细菌的主要菌门,约占总菌群的74%,其次为拟杆菌门和厚壁菌门分别约占总菌群的17%、8%;而放线菌门(Actinobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus)、梭杆菌门(Fusobacteria)、软壁菌门(Tenericutes)和未分类菌群的所占比例均低于2%。
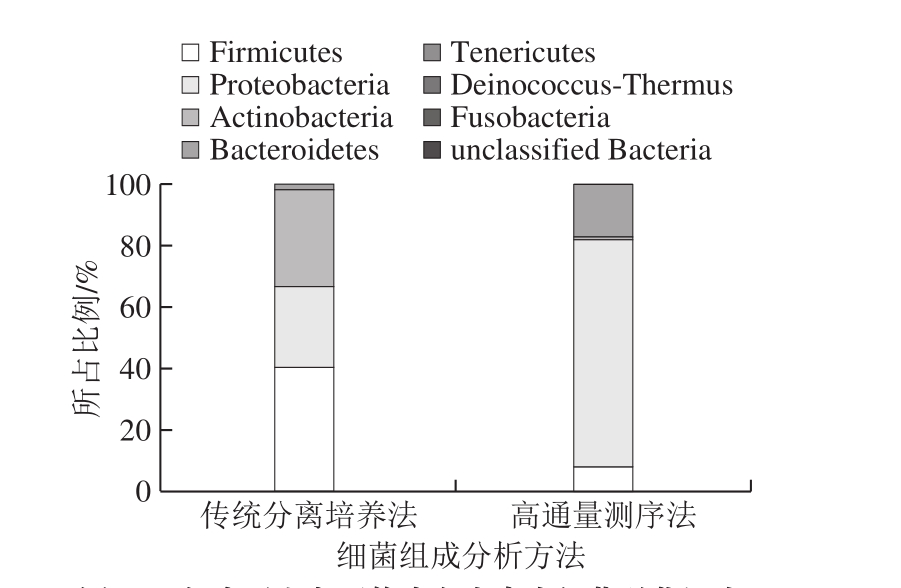
图2 门水平上主要的小白杏内生细菌群落组成
Fig. 2 Composition of endophytic bacterial communities in Kuqa apricots at phylum level
同时,分别调取各菌株相似性最高模式菌株序列构建系统进化发育树(图3~5),确定库车小白杏可培养细菌种类较为丰富,所得99 株菌分别属于4 个门28 个属。其中,变形菌门所含种属最为丰富,共涉及11 个属,如图3所示,分别为产卟啉杆菌属(Porphyrobacter)、欧文氏菌属(Erwinia)、泛菌属(Pantoea)、短波单胞菌属(Brevundimonas)、肠杆菌属(Enterobacter)、鞘氨醇单胞菌属(Sphingomonas)、葡糖杆菌属(Gluconobacter)、不动杆菌属(Acinetobacter)、醋酸杆菌属(Acetobacter)、斯塔普氏菌属(Stappia)和黄杆菌属(Flavobacterium)。而拟杆菌门涉及种属最少,仅包含类香味菌属(Myroides)。
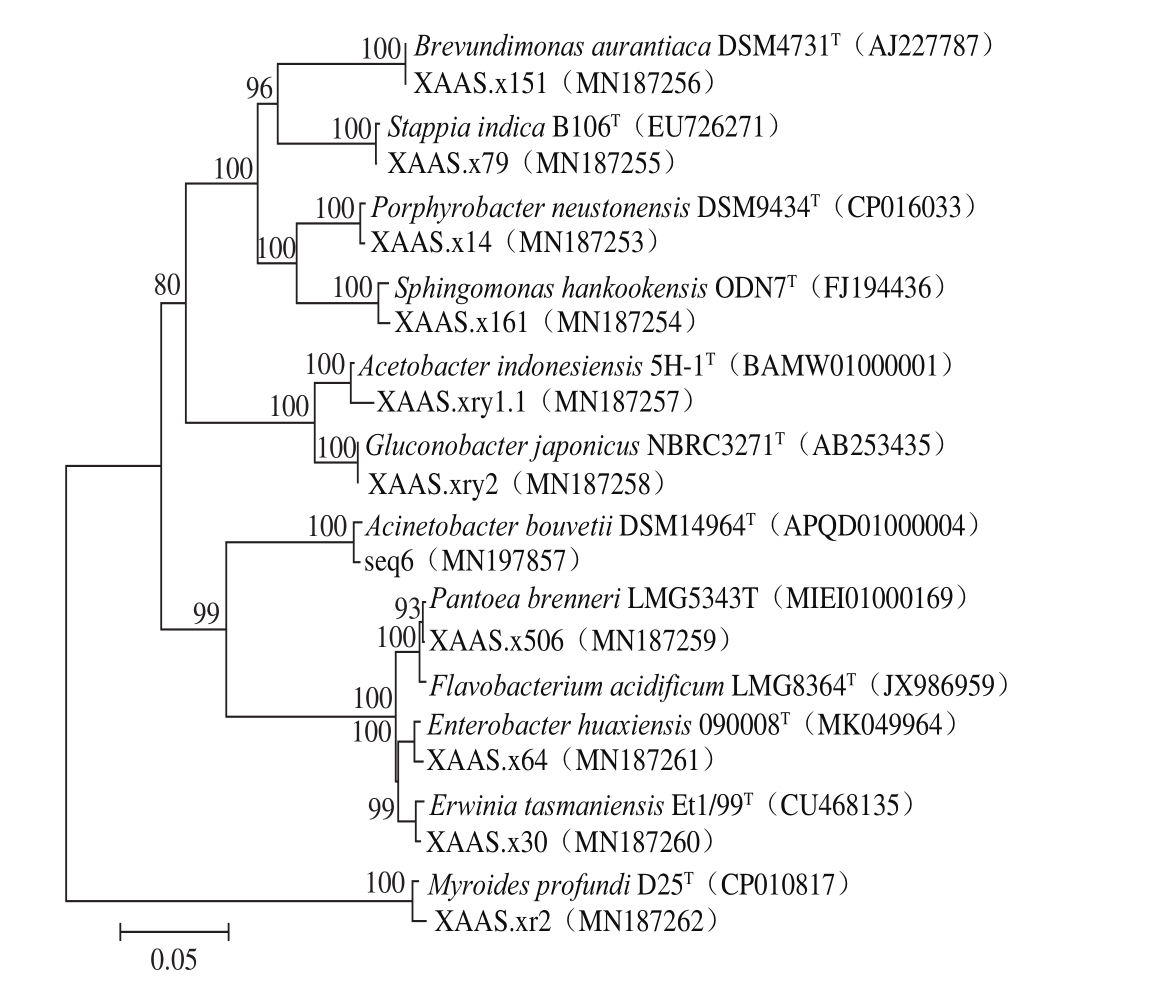
图3 基于变形杆菌门和拟杆菌门代表菌株的16S rRNA基因序列构建的系统进化树
Fig. 3 Phylogenetic tree of isolates in the phyla Proteobacteria and Bacteroides as well as related species based on 16S rRNA gene sequences
厚壁菌门(图4)和放线菌门(图5)各包含8 个属。在厚壁菌门中,分别包括芽孢杆菌属(Bacillus)、赖氨酸芽孢杆菌属(Lysinibacillus)、短杆菌属(Brevibacterium)、动性球菌属(Planococcus)、葡萄球菌属(Staphylococcus)、类芽孢杆菌属(Paenibacillus)、果糖杆菌属(Fructobacillus)、明串珠菌属(Leuconostoc)。放线菌门中,分别为:链霉菌属(Streptomyces)、类诺卡氏属(Nocardioides)、迪茨氏属(Dietzia)、原小单胞菌属(Promicromonospora)、考克氏菌属(Kocuria)、节杆菌属(Arthrobacter)、微球菌属(Micrococcus)、短杆菌属(Brevibacterium)。
此外,研究发现,与高通量V 5 7区间的测序结果相比,通过分离培养法所得的果糖杆菌属(Fructobacillus)、明串珠菌属(Leuconostoc)、节杆菌属(A r t h r o b a c t e r)、原小单胞菌属(Promicromonospora)、欧文氏菌属(Erwinia)、肠杆菌属(Enterobacter)和类香味菌属(Myroides)在本次高通量测序结果中却未检出。

图4 基于厚壁菌门代表菌株的16S rRNA基因序列构建的系统进化树
Fig. 4 Phylogenetic tree of isolates in the phylum Firmicutes as well as related species based on their 16S rRNA gene sequences

图5 基于放线菌门代表菌株的16S rRNA基因序列构建的系统进化树
Fig. 5 Phylogenetic tree of isolates in the phylum Actinobacteria as well as related species based on their 16S rRNA gene sequences
2.4 小白杏果实潜在新种的发现
在完成测序的99 个菌株中,5 株菌与己知模式菌株序列相似性均小于98.5%(表2),初步确定为潜在新种,共涉及节杆菌属(Arthrobacter)、黄杆菌属(Flavobacterium)、类芽孢杆菌属(Paenibacillus)的5 个种。其中,类芽孢杆菌属的潜在新种最多,菌株x506与最近模式菌Flavobacterium acidificum相似性最低,仅为96.98%。该结果初步表明了库车小白杏果实中存在微生物潜在新类群(物种)资源,具体物种有待进一步挖掘。上述菌株的最终分类地位,有待进一步的细菌多相系统分类鉴定结果证明。
表2 基于16S rRNA基因序列比对结果的潜在新种
Table 2 Potential novel species based on 16S rRNA gene sequence analysis

分离株 最近模式菌株 相似性/%XAAS.x375 Arthrobacter humicola KV-653(T) 98.23 XAAS.x506 F. acidificum LMG 8364(T) 96.98 XAAS.x160 Paenibacillus tundrae A10b(T) 98.27 XAAS.x162 P. timonensis 2301032(T) 97.80 XAAS.x234 P. xylanexedens B22a(T) 98.13
2.5 小白杏果实内生细菌产酶特性分析
表3 部分菌株产功能酶特性
Table 3 Some strains with functional enzyme activities

注:++.透明圈直径/菌落直径的值(HC)>10时菌株产酶能力;+.HC>1时菌株产酶能力;-.菌体不生长或没有透明圈出现。
菌株 属名 蛋白酶 脂肪酶 纤维素酶 淀粉酶 果胶酶XAAS.xd1 Promicromonospora ++ - - - ++XAAS.x14 Porphyrobacter - - - ++ -XAAS.x45 Fructobacillus - - - - ++XAAS.x506 Pantoea ++ - - - -XAAS.x64 Enterobacter ++ - - ++ -XAAS.x375 Arthrobacter + - - ++ -XAAS.x146 Lysinibacillus - - - ++ -XAAS.x161 Sphingomonas - - - ++ -XAAS.x30 Erwinia ++ - - ++ -XAAS.x160 Paenibacillus - - ++ ++ -XAAS.x29 Bacillus - - - ++ -XAAS.x135 Bacillus - - ++ ++ -XAAS.x250 Bacillus - - - ++ -XAAS.xj3 Bacillus - ++ ++ ++ -XAAS.xj4 Bacillus - - - ++ -XAAS.xj9 Bacillus - - ++ ++ ++XAAS.x502 Bacillus - ++ ++ ++ -XAAS.x193 Streptomyces - - - ++ +XAAS.x128 Streptomyces - - - - +XAAS.xd4 Streptomyces + - - - ++XAAS.x2.2 Streptomyces ++ - - ++ ++XAAS.x10 Streptomyces - - - ++ -XAAS.x129 Streptomyces - - + ++ ++XAAS.lbx2.1 Streptomyces ++ - - - ++
通过平板透明圈法或显色圈法对所得菌株的蛋白酶、脂肪酶、纤维素酶、淀粉酶、果胶酶产生能力进行了分析(表3)。结果表明,具有淀粉酶活性的代表菌株数量最多,其次为产果胶酶、蛋白酶、纤维素酶类菌株,而具有脂肪酶活性的菌株的数量最少。其中,69 株菌均具有较强的淀粉酶活性;35 株菌具有果胶酶活性,70%的菌株活性较强;31 株菌具有蛋白酶活性,78%的菌株活性较强;23 株菌具有较强的纤维素酶活性,83%的菌株活性较强;具有脂肪酶活性的菌株较少,仅为12 株,67%的菌株活性较强。同时,研究发现,59 株菌具有2 种或以上的功能酶产生能力。
以上结果说明,库车小白杏果实中的内生菌种类多样,且存在大量具有丰富功能酶产生菌。
3 讨 论
内生细菌种类繁多,分布广泛,且能通过多种途径参与植物的代谢、发育和成熟,是宝贵的微生物资源,也是天然活性物质的重要来源,但在现有条件下绝大多数还不能被培养出来[12]。随着高通量测序技术的发展,由于其方便、快捷、高效和低运行成本等突出优势,充分弥补了传统分离培养法的不足,更为全面地展现了环境生态微生物的组成和分布,己成为环境微生物研究的重要手段[13]。然而,2012年法国的Didier Raoult团队首次提出了“微生物培养组学”的概念,并通过“微生物培养组学”获得了大量此前高通量测序结果中未发现的微生物,有效的纠正了相关实验偏差[14-16]。2015年,Forster等[17]利用高通量测序法结合微生物潜在培养表型等多手段,分离获得了大量“不可培养”肠道微生物;此外,相关研究也通过该法获得了40多个潜在新种,20 多个潜在新属,2 个潜在新科,展现了出了微生物培养组学的强大优势[18-19]。因此,开展高通量测序和有效的微生物培养分离,可更为全面地获得样本的群落组成。
本研究以库车小白杏为研究对象,利用高通量测序法结合传统分离培养法,对库车小白杏内生细菌群落结构组成进行分析。高通量测序结果显示,库车小白杏采后内生细菌共包括406 个OTU,涉及9 个门,94 个属。在种群多样性方面,未分类菌群OTU所占比例最高,占总菌群OTU的17.27%,其次为拟杆菌属(Bacteroides)、芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)等类群。通过可培养筛选共获得99 株菌,归类为4 个门28 个属,研究还获得了一批潜在的微生物新种,共涉及节杆菌属(Arthrobacter)、黄杆菌属(Flavobacterium)、类芽孢杆菌属(Paenibacillus)的5 个种,其中类芽孢杆菌属的潜在新种最多。虽然,在实验室条件下培养的微生物仅是其中一小部分,绝大多数内生细菌都难以在现有培养技术和条件下进行繁殖和生长,但本实验通过可培养法获得一批未在高通量测序结果中检出的类群,分别为果糖杆菌属(Fructobacillus)、明串珠菌属(Leuconostoc)、节杆菌属(Arthrobacter)、原小单胞菌属(Promicromonospora)、欧文氏菌属(Erwinia)、肠杆菌属(Enterobacter)和类香味菌属(Myroides)。表明了库车小白杏果实中存在着宝贵的微生物资源,有待进一步分析和挖掘。
研究进一步对所得菌株的产蛋白酶、脂肪酶、纤维素酶、淀粉酶、果胶酶等能力进行研究,为进一步揭示活性酶产生菌与果实软腐的潜在关系提供了科学材料。结果显示,实验获得的菌株中存在着丰富多样的功能酶产生菌。具有淀粉酶活性的代表菌株的数量占绝大多数,其次为果胶酶、蛋白酶、纤维素酶类菌株,而具有脂肪酶活性的菌株的数量最少。其中,69 株菌具有较强的淀粉酶活性,35 株菌具有果胶酶活性,23 株菌具有较强的纤维素酶活性,12 株菌具有脂肪酶活性,且59 株菌具有2 种或以上的功能酶产生能力。一般认为,相关酶系的作用,在果实成熟和软化中起着重要的作用。其中,淀粉在未成熟果实中的含量较多,随着果实的成熟,其在酶的作用下其可转化为糖,以葡萄糖和蔗糖为主。而葡萄糖可被大部分微生物所利用,且与真菌相比,细菌生长繁殖的速度较快[20-22];同时,果胶酶、纤维素酶等活性增强能够引起小白杏果硬度的下降,是小白杏果实软化的重要标志[23-25]。尽管目前仍无法证明,内生细菌在库车小白杏成熟过程中代谢产酶的情况,但大量能产生相关酶的菌株存在,可推断内生细菌可通过利用杏果中的营养物质大量生长和繁殖,同时部分内生细菌可通过产生淀粉酶、果胶酶、蛋白酶、纤维素酶等,推进果实的成熟,加快果实软化的速度,这可能是造成小白杏先出现水渍状病斑,后发生腐烂的重要因素。
同时,前期高通量测序结果显示,青熟期和完熟期的库车小白杏中均存在与植物软腐相关的病原菌,如葡糖杆菌属、泛菌属、欧氏菌属和布伦纳氏属等菌群,且随着小白杏的成熟,其所占比例呈倍数增长,最高可增加416 倍。而本实验通过可培养筛选法,进一步验证了库车小白杏中存在葡糖杆菌属、泛菌属、果糖杆菌属、明串珠菌属、欧文氏菌属等与果实软腐相关的菌株,与前期研究结果一致。相关研究己证实,葡糖杆菌属是引起柑橘、草莓腐烂和霉变的主要细菌[26-28];泛菌属和布伦纳氏属的部分菌株可导致番茄[29-30]、玉米[31]、草莓[32]等的软腐病;欧氏菌属是引发丹尼斯凤梨、大白菜等软腐病的重要因素[33-34]。因此,以上与软腐相关菌群的大量繁殖能否引起其他品种杏的软腐变质,相关验证工作己开展。
本实验结果不仅揭示了库车小白杏内生细菌群落丰富的结构组成及多样性,证实了杏果中存在大量具有丰富功能的微生物资源;也从内生细菌角度,为小白杏采后腐败变质内在机理提供了科学依据,为其贮藏保鲜提供了新思路。
[1] STROBEL G, STIERLE A, STIERLE D, et al. Taxomyces and reanae,a proposed new taxon for a bulbilliferous hyphomycete associated with Pacific yew (Taxes brevifolia)[J]. Mycotaxon, 1993, 47: 71-80.DOI:10.3329/bjb.v43 i1.19739.
[2] 黄敬瑜, 张楚军, 姚瑜龙, 等. 植物内生菌生物抗菌活性物质研究进展[J].生物工程学报, 2017, 33(2): 178-186. DOI:10.13345/j.cjb.160277.
[3] 姜云琴, 罗明, 张祥林, 等. 哈密瓜内生拮抗细菌的筛选及其抑菌物质研究初报[J]. 中国农学通报, 2007, 23(3): 356-359. DOI:10.3969/j.issn.1000-6850.2007.03.079.
[4] 邱思鑫, 温庆放. 10 种蔬菜内生细菌的分离筛选[J]. 武夷科学,2009, 25(1): 69-75. DOI:10.3969/ j.issn.1001-4276.2009.01.014.
[5] 杜晓宁, 徐惠娟, 黄盼盼, 等. 宁夏枸杞内生细菌的多样性及其抑菌活性研究[J]. 微生物学通报, 2015, 42(9): 1779-1787. DOI:10.13344/j.microbiol.china.140913.
[6] 邓振山, 李超, 何园. 南瓜中内生菌筛选及其次级代谢产物的分析[J].食品科学, 2016, 37(23): 224-229. DOI:10.7506/spkx1002-6630-201623036.
[7] 刘晓静, 朱静, 楚敏, 等. 库车小白杏采后内生细菌群落代谢特征及结构组成的变化[J]. 食品科学, 2018, 39(22): 141-146. DOI:10.7506/spkx1002-6630-201822022.
[8] 张志东, 顾美英, 王玮, 等. 基于高通量测序的辐射污染区细菌群落特征分析[J]. 微生物学通报, 2016, 43(6): 1218-1226. DOI:10.13344/j.microbiol.china.150371.
[9] 陈丽莹, 张玉满, 陈晓英, 等. 茶树叶际选择性富集的内生细菌的鉴定[J]. 微生物学报, 2018, 58(10): 92-101. DOI:10.13343/j.cnki.wsxb.20170592.
[10] 曹振华, 朱莉, 娄恺, 等. 乌鲁木齐10号冷泉水中可培养细菌群落结构组成[J]. 新疆农业科学, 2012, 49(4): 723-729. DOI:10.6048/j.issn.1001-4330.2012.04.019.
[11] 陈小敏, 林影, 梁书利. 烟叶表面微生物群落结构鉴定及其产酶分析[J]. 基因组学与应用生物学, 2016(7): 1760-1766.
[12] 邢磊, 赵圣国, 郑楠, 等. 未培养微生物分离培养技术研究进展[J].微生物学通报, 2017, 44(12): 3053-3066. DOI:10.13344/j.microbiol.china.170356.
[13] 林先智, 胡思敏, 刘胜, 等. 传统测序与高通量测序在稚鱼食性分析中的比较[J]. 应用生态学报, 2018, 29(9): 299-307. DOI:10.13287/j.1001-9332.201809.005.
[14] PFLEIDERER A, LAGIER J C, ARMOUGOM F, et al. Culturomics identified 11 new bacterial species from a single anorexia nervosa stool sample[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2013, 32(11): 1471-1481. DOI:10.1007/s10096-013-1900-2.
[15] LAGIER J C, ARMOUGOM F, MILLION M, et al. Microbial culturomics: paradigm shift in the human gut microbiome study[J].Clinical Microbiology and Infection, 2012, 18(12): 1185-1193.DOI:10.1111/1469-0691.12023.
[16] DIOP A, KHELAIFI S, ARMSTRONG N, et al. Microbial culturomics unravels the halophilic microbiota repertoire of table salt: description of Gracilibacillus massiliensis sp. nov.[J]. Microbial Ecology in Health and Disease, 2016, 27: 1. DOI:10.3402/mehd.v27.32049.
[17] FORSTER S C, BROWNE H P, KUMAR N, et al. HPMCD: the database of human microbial communities from metagenomic datasets and microbial reference genomes[J]. Nucleic Acids Research, 2015,44(1): 604-609. DOI:10.1093/nar/gkv1216.
[18] KHELAIFI S, LAGIER J C, BIBI F, et al. Microbial culturomics to map halophilic bacterium in human gut: genome uence and description of Oceanobacillus jeddahense, sp. nov.[J]. OMICS: A Journal of Integrative Biology, 2016, 20(4): 248-258. DOI:10.1089/omi.2016.0004.
[19] LAGIER J C, KHELAIFI S, TIDJANI A M, et al. Culture of previously uncultured members of the human gut microbiota by culturomics[J]. Nature Microbiology, 2016, 1(2): 179. DOI:10.1038/nmicro-biol.2016.203.
[20] VALENCI, GERMAN A, MORAES I C F, et al. Physicochemical,morphological, and functional properties of flour and starch from peach palm (Bactris gasipaes K.) fruit[J]. Starch-Starke, 2015, 67(1/2):163-173. DOI:10.1002/star.201400097.
[21] CARMEN B, SUMALAN R, SORIN V. Research on influence of some post-harvest change of peach genotypes[J]. Bulletin of the University of Agricultural Sciences & Veterinary, 2015, 72(2): 352.DOI:10.15835/buasvmcn-agr:11722.
[22] 齐秀东, 魏建梅, 赵美微, 等. ‘京白梨’果实后熟软化与糖、淀粉代谢及其基因表达的关系[J]. 中国农业科学, 2015, 48(13): 2591-2599.DOI:10.3864/j.issn.0578-1752.2015.13.011.
[23] 李萍. 新疆杏果实发育期及采后生理生化机理研究[D]. 乌鲁木齐:新疆农业大学, 2013: 34-37.
[24] 胡留申, 董晓颖, 李培环, 等. 桃果实成熟前后细胞壁成分和降解酶活性的变化及其与果实硬度的关系[J]. 植物生理学报, 2007, 43(5):837-841.
[25] 阚娟, 刘涛, 金昌海, 等. 硬溶质型桃果实成熟过程中细胞壁多糖降解特性及其相关酶研究[J]. 食品科学, 2011, 32(4): 268-274.
[26] 张大为, 张洁, 李猛. 分离引起柑橘腐烂、霉变的微生物及生物防治[J]. 生物加工过程, 2011, 9(4): 54-57. DOI:10.3969/j.issn.1672-3678.2011.04.012.
[27] 戴宝玲, 肖英平, 戴贤君, 等. 基于Illumina高通量测序技术分析草莓表面微生物结构[J]. 江苏农业科学, 2018, 46(20): 33-36.DOI:10.15889/j.issn.1002-1302.2018.20.006.
[28] 周胜虎, 薛齐佳, 刘传凤, 等. 细菌纤维素高产菌株的筛选和初步鉴定[J]. 湖北农业科学, 2013, 52(15): 3514-3517. DOI:10.3969/j.issn.0439-8114.2013.15.013.
[29] 冯洁. 植物病原细菌分类最新进展[J]. 中国农业科学, 2017, 50(12):2305-2314. DOI:10.3864/j.issn.0578-1752.2017.12.011.
[30] 代晓航, 魏超, 郭灵安. 16S rDNA方法对新鲜番茄中细菌分布的调查[J]. 西南农业学报, 2015, 28(2): 797-800. DOI:10.16213/j.cnki.scjas.2015.02.065.
[31] 曹慧英, 王晓鸣, 肖明纲. 玉米细菌干茎腐病的病原鉴定[C]//中国植物病理学会2008年学术年会论文集. 2008.
[32] 魏超, 郭灵安, 代晓航, 等. 草莓表面典型微生物鉴定、16S rDNA同源性分析及附着能力研究(I)[J]. 西南农业学报, 2016, 29(12): 2939-2943. DOI:10.16213/j.cnki.scjas.2017.3.030.
[33] 吕娟. 丹尼斯凤梨细菌性软腐病病原鉴定及室内药剂筛选[D].海口: 海南大学, 2011: 37-38.
[34] 臧威. 黑龙江省大白菜软腐病菌致病力分化及抗源筛选的研究[D].哈尔滨: 东北农业大学, 2003: 20.