随着人们生活水平的提高,膳食的摄入也更加丰富,但无论是常量元素、微量元素还是有害重金属元素,摄入过多都会对人体健康造成损伤。鳕鱼的食用价值和经济价值很高,富含众多人体所需常量和微量营养元素,年捕捞量巨大[1]。目前,鳕鱼市场需求量在逐年增长,其营养和安全性越来越受到重视,因此,对鳕鱼体内常量和微量营养元素的非定向快速检测十分必要。目前常用的微量元素检测方法有电感耦合等离子体质谱发射光谱法[2-4],该方法结果精确、检出限低、灵敏度高[5],但需要昂贵的化学试剂以及高纯度气体支撑,以进行复杂的样品预处理,且处理过程中排放的有毒废物不利于环境和人体健康。原子吸收光谱法的选择性强、分析范围广、灵敏度和精密度较高,但样品需提前消化,且不能多元素同时检测,分析速度慢[6]。
激光诱导击穿光谱(laser induced breakdown spectroscopy,LIBS)技术是近年发展起来的一种元素分析技术,该技术采用一束高能量脉冲激光经过聚焦后烧蚀样品表面,产生瞬态等离子体,通过对等离子体的发射光谱进行分析实现对待测样品的定性或定量检测[7]。LIBS技术具有无需或少量样品预处理、无环境污染、检测速度快、可以进行多元素同时检测的优势,在食品分析领域如婴儿奶粉、茶叶、水果、蔬菜、食用油、谷物、酒、肉类等方面的应用均有报道[8-14]。例如,Casado-Gavalda等[15]使用LIBS检测添加到牛肝中碎牛肉的铜元素含量;Andersen等[16]使用LIBS定量检测新鲜家禽肉类中的钙元素含量;Velioglu等[17]用LIBS成功测定了牛肉中内脏的含量,有效识别内脏掺假问题。然而,LIBS在定量检测和分析过程中存在一些挑战。样品不均匀、实验条件波动、谱线干扰、基体效应等问题均会对LIBS分析结果产生很大的影响[18],导致定量精度和准确度较差。针对这一问题,采用合适的内标元素进行光谱归一化(内标法)能够有效克服实验条件波动和基体效应的影响[19]。同时,近年来也发展了一系列基于化学计量学的多元分析方法[20-24],如偏最小二乘(partial least square,PLS)法、支持向量机、人工神经网络用于LIBS光谱分析,能够有效改善LIBS的定量分析性能[25]。
本研究将LIBS技术用于鳕鱼中8 种元素P、Fe、Al、Mn、K、Mg、Ca、Na的同时定量分析。制备6 组不同含量的鳕鱼标准样品,采用电感耦合等离子体发射光谱(inductively coupled plasma-optical emission spectrometry,ICP-OES)法提供各元素浓度的参考值。选择5 组样品绘制各元素的定标曲线,1 组样品作为待测样品得到LIBS预测含量。采用单变量定标、内定标与PLS 3 种定量方法,通过比较定标曲线的相关系数(R2)、预测含量的相对误差、相对标准偏差(relative standard deviation,RSD)、交叉验证均方根误差(root mean square error of cross validation,RMSECV)指标,评估LIBS对各元素的定量分析能力,验证该方法用于水产品多种元素的同时、快速、非定向检测的可行性。
1 材料与方法
1.1 材料与试剂
鳕鱼 市购;P、Fe、Al、Mn、K、Mg、Ca、Na标准液 国家有色金属及电子材料分析测试中心;PH-302微晶纤维素 日本旭化成株式会社;其他试剂均为国产分析纯。
1.2 仪器与设备
Dava-200 Nd:YAG调Q脉冲激光器 镭宝光电技术有限公司;AvaSpec-2048-USB2四通道光谱仪 荷兰Avantes公司;5110等离子体发射光谱仪 美国安捷伦公司;FW-4A粉末压片机 天津拓普仪器有限公司。
1.3 方法
1.3.1 样品制备
使用实验室肉类搅拌器分别切碎鳕鱼样品,搅拌器使用前经过抗菌洗涤液和超纯水的仔细清洁,以确保没有污染。使用干净的烧杯将样品置于105 ℃的鼓风干燥箱中烘干,直至恒质量。之后,制备系列含量标准品,如表1所示。将烘干后的样品粉末进行压片处理[26],将样品粉末与微晶纤维素茹合剂按质量比3∶2混合均匀,使用分析天平准确称量每种含量的混合样品粉末0.35 g,转移至压片模具中,用粉末压片机在15 MPa的压力下保持3 min,得到直径为13 mm的片状样品。每个片状样品制作之前都使用无水乙醇将压片模具内外擦拭干净,最后采用LIBS系统对制备的片状样品进行光谱采集。
按照GB 5009.268—2016《食品中多元素的测定》中的ICP-OES法作为标准方法,得到各个样品中P、Fe、Al、Mn、K、Mg、Ca、Na元素的实际含量。将每个含量的样品粉末在105 ℃的鼓风干燥箱中干燥完全,获得尽可能均匀的样品,使用HNO3对样品进行消化。消化后根据样品中不同的元素含量使用超纯水对消化液进行梯度稀释。
仪器参数:泵速100 r/min,雾化器压力0.2 MPa,射频功率1 150 W,样品冲洗时间20 s。对稀释后的消化液进行检测,并根据对应的波长和信号强度制作标准曲线,由各个元素标准曲线计算得到实际含量。ICP-OES获得的各样品中8 种元素的参考含量如表1所示。
表1 样品中各元素的参考含量
Table 1 Concentrations of P, Fe, Al, Mn, K, Mg, Ca, Na in each sample mg/kg
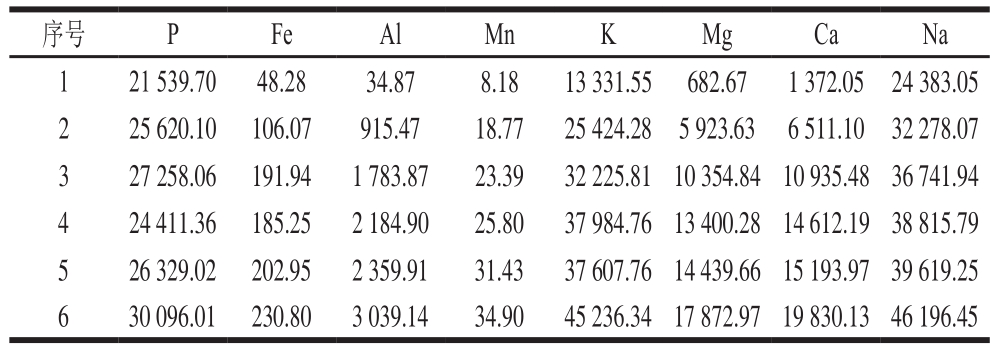
序号 P Fe Al Mn K Mg Ca Na 1 21 539.70 48.28 34.87 8.18 13 331.55 682.67 1 372.05 24 383.05 2 25 620.10 106.07 915.47 18.77 25 424.28 5 923.63 6 511.10 32 278.07 3 27 258.06 191.94 1 783.87 23.39 32 225.8110 354.8410 935.4836 741.94 4 24 411.36 185.25 2 184.90 25.80 37 984.7613 400.2814 612.1938 815.79 5 26 329.02 202.95 2 359.91 31.43 37 607.7614 439.6615 193.9739 619.25 6 30 096.01 230.80 3 039.14 34.90 45 236.3417 872.9719 830.1346 196.45
1.3.2 LIBS光谱检测装置与处理
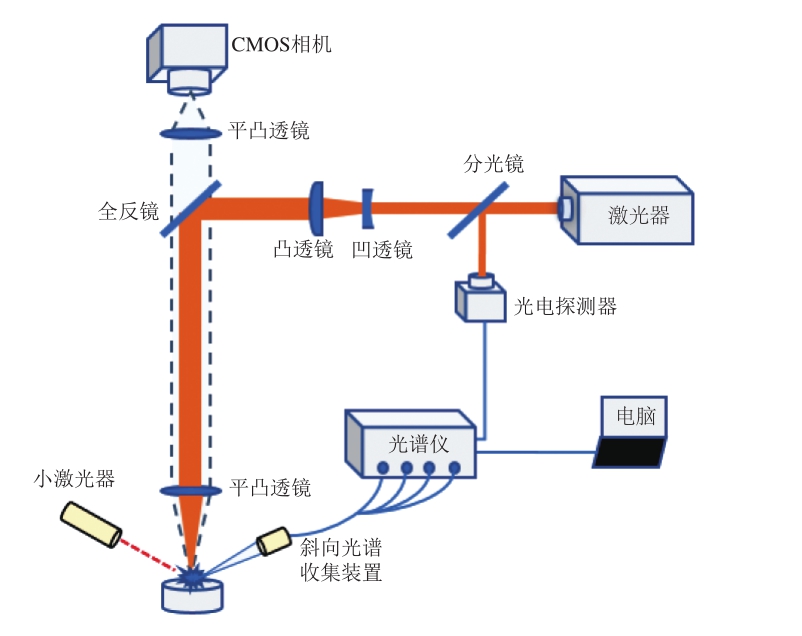
图1 鳕鱼样品多元素分析LIBS实验装置
Fig. 1 Schematic of the LIBS device used for multi-elemental analysis of cod samples
本实验采用的LIBS实验装置如图1所示。激光器输出激光波长1 064 nm,重复频率10 Hz,脉冲宽度10 ns。激光脉冲能量采用75 mJ,经扩束后由平凸透镜(f=50 mm)会聚到样品表面产生等离子体。等离子体辐射通过双透镜收集器耦合到光纤头中,光谱仪波段范围200~850 nm,光谱探测延时设置为1.28 μs,积分时间为1 ms。在实验中调节样品表面水平,并通过十字激光配合CMOS相机对样品表面高度实时监控。通过三维电动位移平台控制样品的移动,选择样品表面边长为7.20 mm的正方形区域进行激光打点,在10×10网格中,每个取样点打10 次激光脉冲,每10 个取样点获得一张光谱,即每张光谱为100 个激光脉冲的平均。每个样品重复测量10 次得到10 张光谱。
在获得原始光谱后首先进行基线去除,之后针对每种元素选择合适的特征波长,采用单变量定标、内定标、PLS 3 种方法分别绘制各元素定标准曲线。对于每种定量方法,统一选用表1中的1、2、3、5、6号样品作为己知样品(共50 张光谱)绘制定标曲线,4 号样品作为待测样品(共10 张光谱)用以验证不同定量方法的预测能力。所有的光谱数据均采用Matlab R2017进行处理(Math Works,United States)。
2 结果与分析
2.1 特征谱线的选择
如图2所示,在200~850 nm波长范围内,能够清晰识别出P、Fe、Al、Mn、K、Mg、Ca、Na 8 种元素的特征谱线。各元素特征谱线的确定根据文献调研结合NIST数据库查询实现。对于每种元素,选择合适的谱线进行定量分析对后续的定量结果至关重要。本实验对于每种元素的特征谱线选取遵循以下3 条原则:1)选择信噪比高,且附近无其他元素谱线干扰的谱线;2)对于含量较高且谱线选择多的元素(如P、Mg、Ca、Na),选择下能级不为基态的谱线,以减少谱线自吸收效应对定量分析的影响;3)对含量较低且谱线选择少的元素(如Fe、Al、Mn、K),选择下能级为基态的谱线,以保证较好的谱线质量。此外,在满足以上原则的基础上,优先选择各元素的原子线,其原因是原子线受实验条件波动、等离子体状态波动等因素的干扰更小,更有利于定量分析。最终本实验所选取的8 种元素的特征谱线如图2和表2所示。
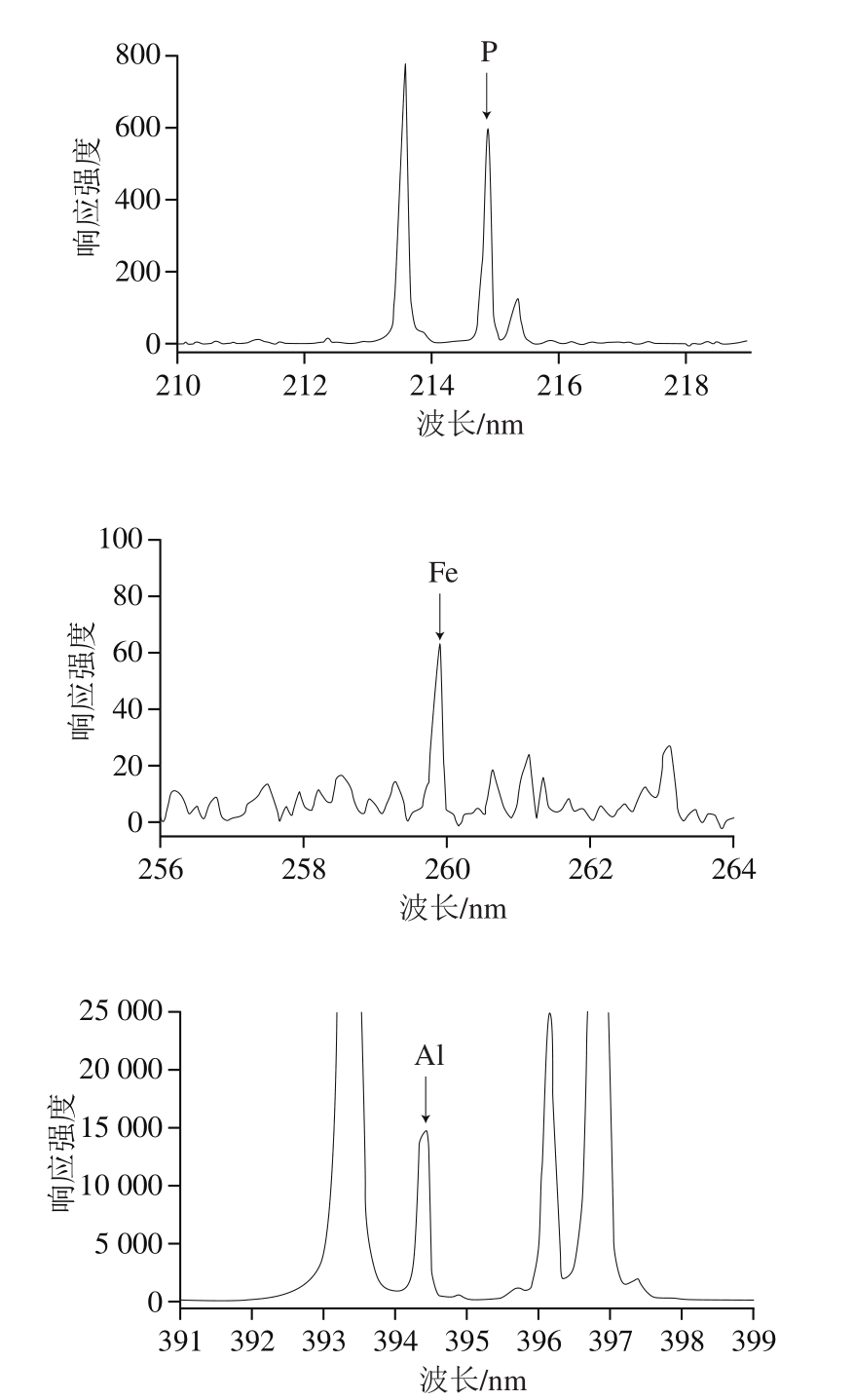
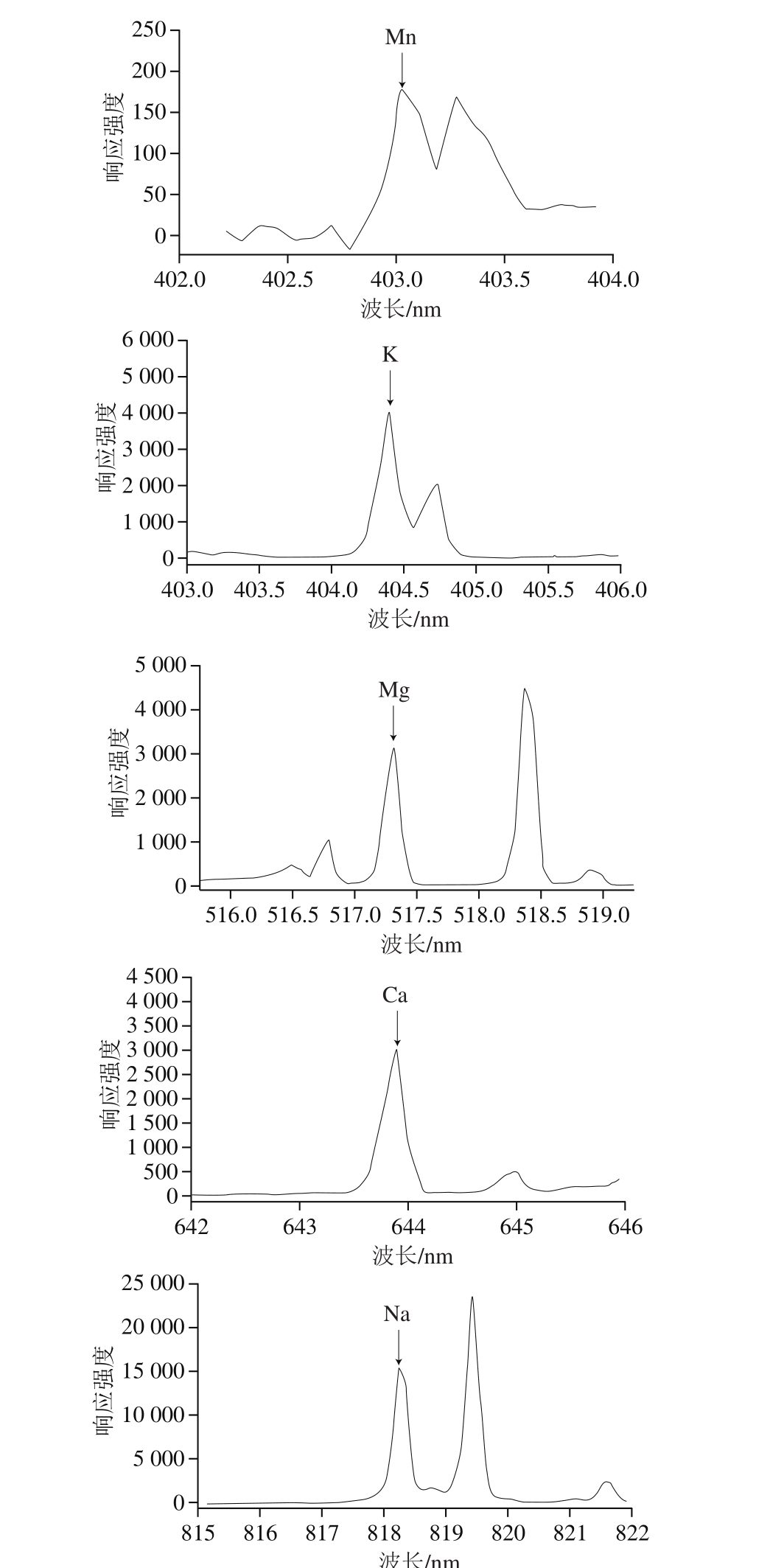
图2 鳕鱼样品8 种元素的典型LIBS光谱
Fig. 2 Typical LIBS spectra of 8 elements in cod samples
表2 鳕鱼样品8 种元素的特征谱线
Table 2 Characteristic lines of 8 elements in cod samples

元素 波长/nm 跃迁几率/s-1能级能量/eV 电子组态 简并度P I 214.915 3.18×108 1.409~7.176 2D°~2P 4~2 Fe II 259.940 2.35×108 0~4.768 a 6D~z 6D° 10~10 Al I 394.401 4.99×107 0~3.143 2P°~2S 2~2 Mn I 403.076 1.70×107 0~3.075 a 6S~z 6P° 6~8 K I 404.414 1.15×106 0~3.065 2S~2P° 2~4 Mg I 517.268 3.37×107 2.712~5.108 3P°~3S 3~3 Ca I 643.907 5.30×107 2.526~4.451 3D~3F° 7~9 Na I 818.326 4.29×107 2.102~3.617 2P°~2D 2~4
2.2 单变量定标法和内定标法
2.2.1 单变量定标法
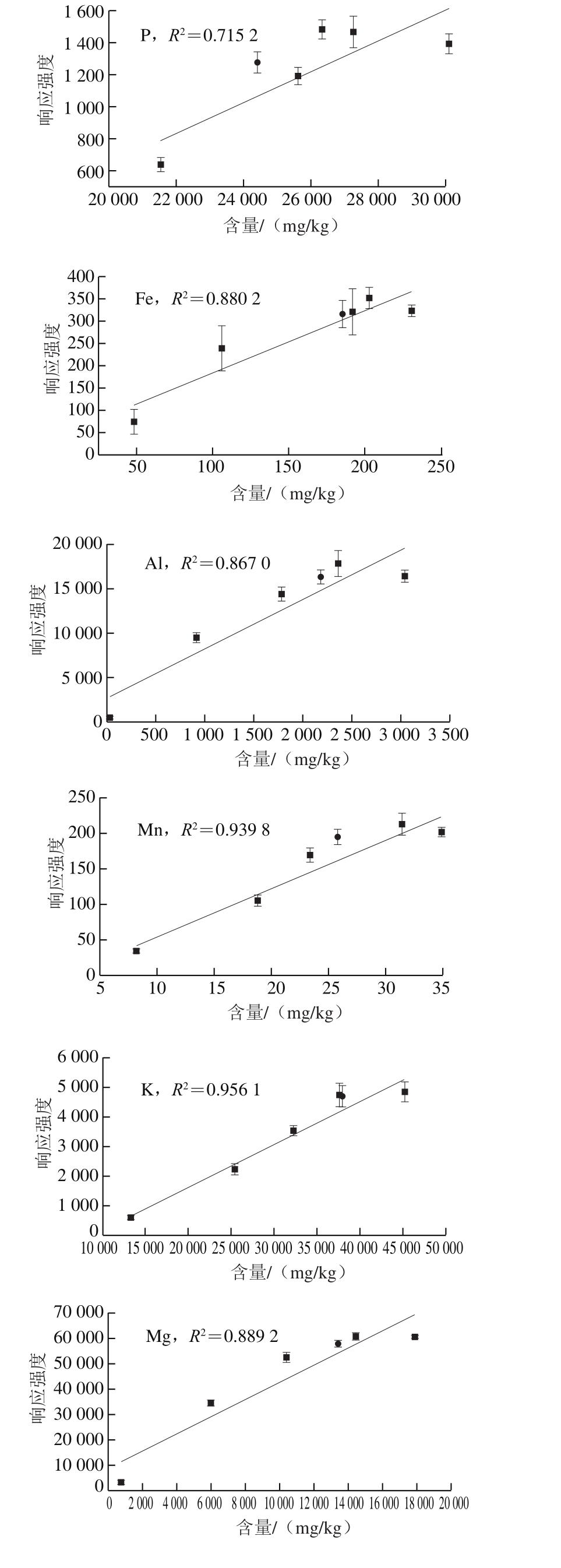
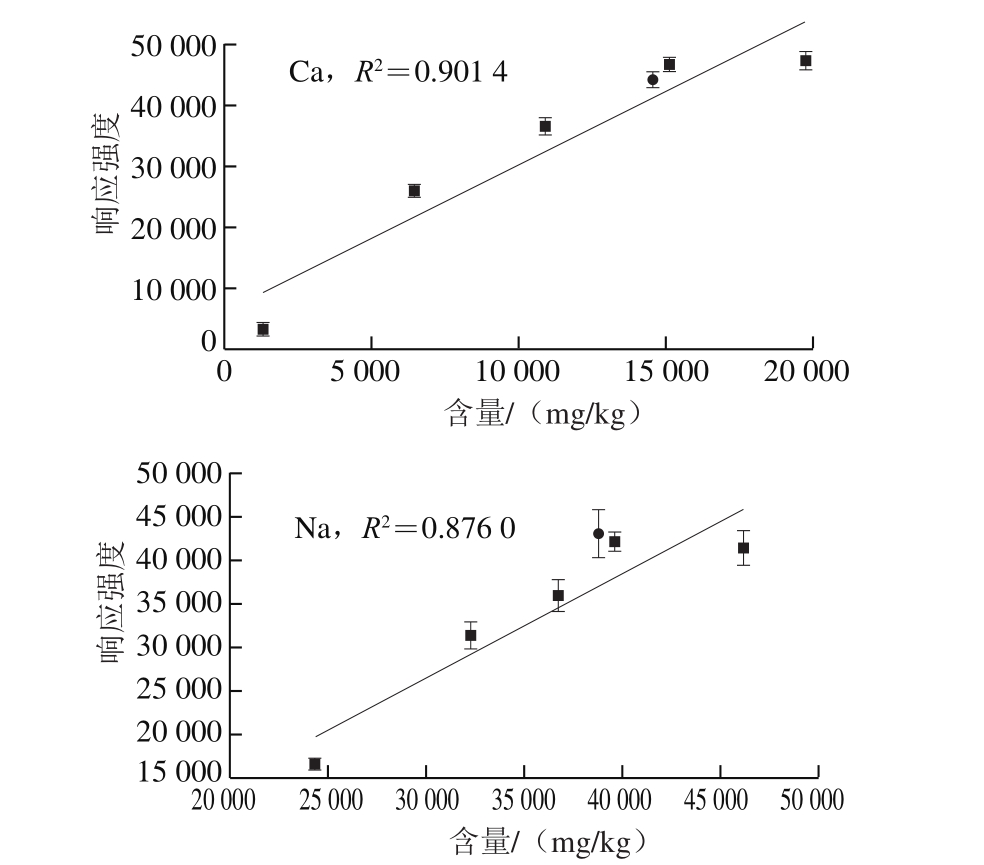
图3 8 种元素单变量定标曲线
Fig. 3 Univariate calibration curves of 8 elements
传统的单变量定标法是以目标元素的谱线强度为因变量,样品中该元素的标准含量为自变量,绘制定标曲线进行定量分析。本实验谱线强度采用峰值强度,以ICP-OES测得的元素含量作为标准含量。8 种元素的单变量定标曲线如图3所示。R2越趋近于1,说明拟合效果越好。误差棒由每组样品的10 次重复测量结果得到。可以发现,采用单变量定标法得到的定标曲线普遍不理想,P、Fe、Al、Mg、Na元素的R2均低于0.9,P元素R2仅为0.715 2,相关性较低。此外,待测样品的各元素偏离定标曲线较远,反映了单变量定标法对未知样品存在较大的预测误差。该结果说明在LIBS用于鳕鱼样品的定量分析时,传统的单变量定标法受样品不均匀、基体效应、实验条件波动等因素影响较大,其检测结果的准确性和可靠性较低,难以满足检测要求。
2.2.2 内定标法
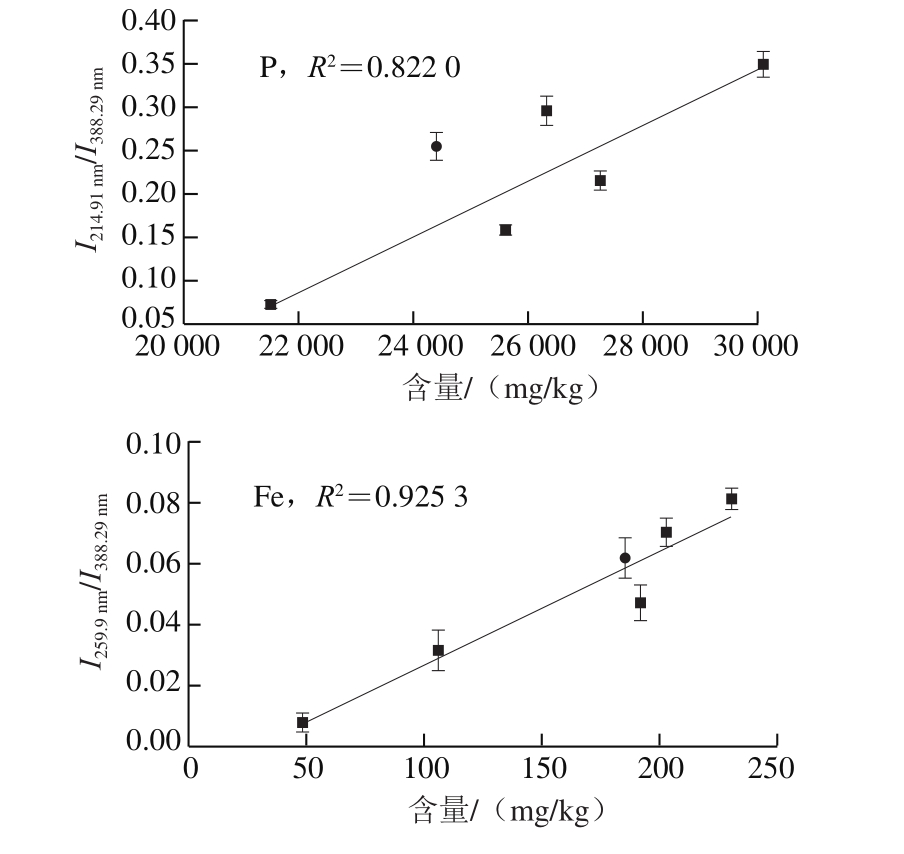

图4 8 种元素的内定标曲线
Fig. 4 Internal calibration curves of 8 elements
内定标法是LIBS技术中普遍采用的定量方法,该方法选择样品中含量固定不变的元素(或含量很高的基体元素)作为内标元素,通过待测元素谱线与内标元素谱线的比值,绘制定标曲线进行定量分析。内标法能够在一定程度上降低实验过程中的波动和样品基体效应所带来的影响,获得较好的定量结果。由于本实验采用的鳕鱼样品为有机样品,其基体元素为C、H、O、N,综合考虑之后选择谱线较强的CN 388.29 nm的分子谱线作为内标谱线。如图4所示,经过内定标处理后,定标曲线的线性相关性显著提高,P元素的R2从0.715 2提升到0.822 0,其他7 种元素的R2均在0.925 3以上。同时各点的误差棒更小,对未知样品的预测误差也普遍降低,反映了采用内定标法比单变量定标法具有更好的预测准确度和精度,定量分析结果得到明显改善。
2.3 PLS法
为了进一步优化LIBS光谱的定量分析结果,本实验进一步采用PLS方法建立多变量回归模型用于鳕鱼中各元素的定量分析。PLS方法是一种基于化学计量学统计分析的多元分析方法,目前在LIBS光谱的定性分类和定量检测中得到广泛应用[27-30]。该方法能够有效简化数据结构,具有较好的分析效果[31]。在建立PLS定量分析模型时,采用全波段光谱数据作为模型的输入变量不仅大大增加了数据运算量,更重要的是会引入噪声和不相关变量的干扰,从而降低模型的预测能力。因此本实验针对鳕鱼中的8 种元素,在确定其特征谱线之后,选择该谱线附近的光谱区间作为输入变量,分别建立PLS回归模型。各元素含量参考值和PLS预测值之间的定标曲线如图5所示。
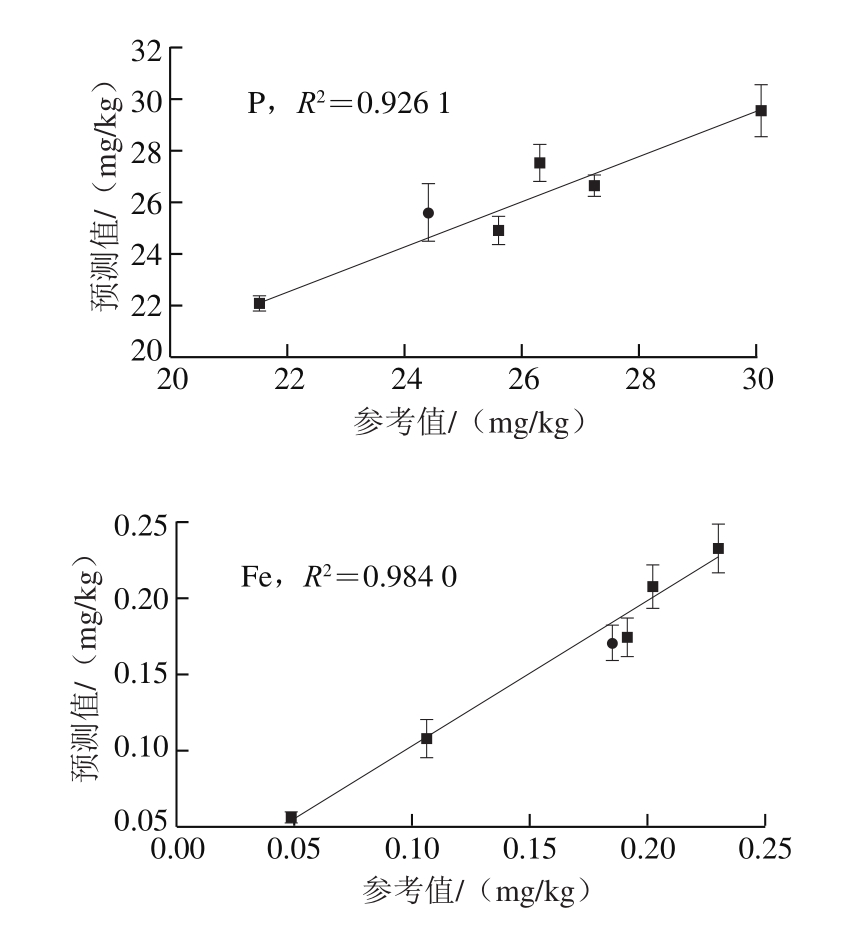

图5 8 种元素含量参考值与预测值的PLS定标曲线
Fig. 5 PLS calibration curves of 8 elements between reference values and predicted values
由图5可以看出,对于5 组训练集样品,采用PLS方法得到的预测值和参考值之间具有很好的相关性,各元素的R2均有明显提升,Al、Mn、K、Mg、Ca、Na 6 种元素的R2均在0.991 2以上,Fe与P元素的R2也分别达到0.984 0和0.926 1。对于测试集样品(圆点),可以发现离定标曲线的偏离程度普遍较小,反映了PLS模型具有较低的预测误差。图6进一步给出了单变量定标、内定标、PLS 3 种方法对测试集样品8 种元素预测的相对误差。值得注意的是,受样品个数的限制,测试集中仅包含一组含量的样品,因此所获得的预测相对误差结果具有一定的偶然性。但从图6仍可发现,采用PLS方法后,P、Al、Mn、Mg、Na 5 种元素具有最低的相对误差。统计8 种元素相对误差的平均值发现,单变量定标、内定标、PLS的平均相对误差分别为8.84%、7.02%和5.01%,反映了PLS方法具有最高的预测准确度。以上结果表明,在LIBS对鳕鱼中多种元素的同时定量分析时,PLS方法优于传统的单变量定标法和内定标法,具有更高的预测准确度。后续工作将进一步增加PLS模型中训练集和测试集样品个数,避免模型过拟合情况,以获得更好的定量分析结果。
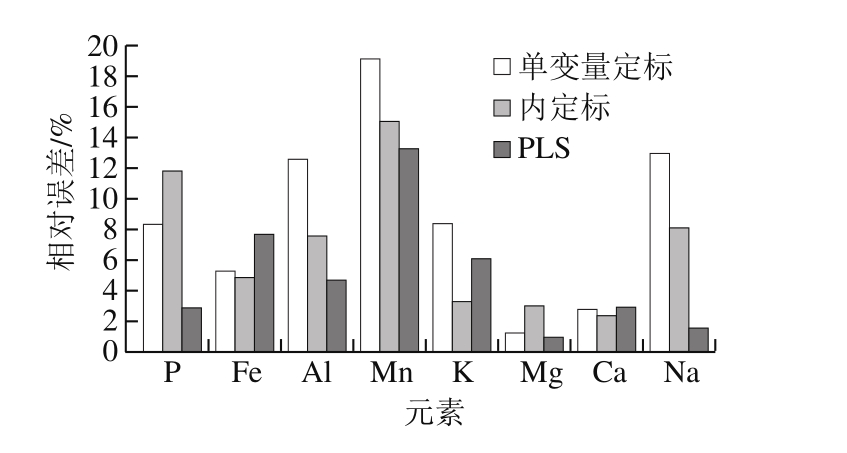
图6 3 种方法对8 种元素的预测相对误差
Fig. 6 Relative prediction errors of 8 elements using the 3 methods
如表3所示,相对误差、RSD、RMSECV值越小,说明模型预测准确性、预测精度和可信度越高。8 种元素的R2和RMSECV的平均值分别为0.986和0.564,相对误差范围为0.96%~13.27%,平均值为5.01%,RSD范围为2.02%~7.55%,平均值为4.65%,体现了PLS模型较好的预测准确度和精度。另一方面,比较不同的元素可以发现,PLS模型对Fe、Al、K、Mg、Ca、Na 6 种元素具有较好的定量结果,而Mn元素的预测相对误差较大(13.27%),P元素的R2较低(0.926 1)。其可能的原因为样品中的Mn元素含量较低(8.18~34.90 mg/kg),谱线质量较差(图2),导致定量分析误差较大;而P为非金属元素,相对其他金属元素检测难度更大,且P元素的含量梯度较小(21 539.70~30 096.01 mg/kg),导致定量的线性相关性较低。总结以上结果可以得出,利用LIBS技术结合PLS方法能够实现对鳕鱼中多种元素的同时定量分析,且具有较高的预测准确度和精度,有效验证了LIBS技术用于鳕鱼多元素检测的可行性。
表3 PLS模型的预测结果指标
Table 3 Calibration and prediction results from PLS model
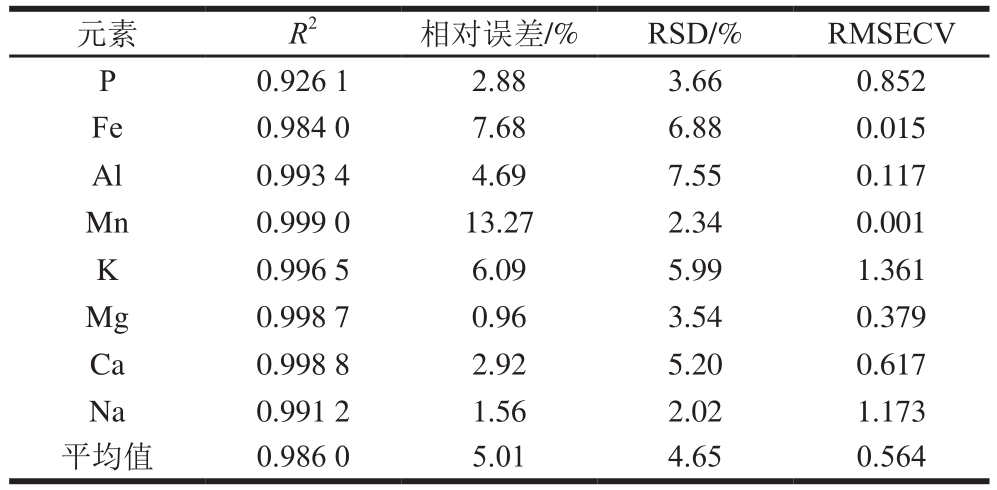
元素 R2 相对误差/% RSD/% RMSECV P 0.926 1 2.88 3.66 0.852 Fe 0.984 0 7.68 6.88 0.015 Al 0.993 4 4.69 7.55 0.117 Mn 0.999 0 13.27 2.34 0.001 K 0.996 5 6.09 5.99 1.361 Mg 0.998 7 0.96 3.54 0.379 Ca 0.998 8 2.92 5.20 0.617 Na 0.991 2 1.56 2.02 1.173平均值 0.986 0 5.01 4.65 0.564
3 结 论
本实验利用LIBS技术对鳕鱼中的P、Fe、Al、Mn、K、Mg、Ca、Na 8 种元素进行同时定量分析,并对单变量定标、内定标、PLS 3 种定量方法进行了比较。结果表明,内定标方法比传统的单变量定标方法具有更好的定量效果,定标曲线的相关系数有明显提升。而进一步的采用PLS方法能够获得最佳的定量分析结果,8 种元素R2和RMSECV的平均值分别为0.986和0.564,相对误差范围在0.96%~13.27%之间,平均值为5.01%,RSD范围在2.02%~7.55%之间,平均值为4.65%,体现了PLS模型较好的预测准确度和精度。结果表明LIBS技术应用于鳕鱼中多种元素的快速、非定向检测方面效果良好,并有很大潜力推广至水产品检测,同时为今后针对水产品的便携式LIBS检测仪器开发提供理论依据。
[1] 孙炜琳, 刘佩. 近10年来我国水产品供求变化及趋势分析[J].农产品市场周刊, 2015, 3(12): 61-64. DOI:10.3969/j.issn.1672-0423.2014.03. 034.
[2] 樊祥, 周瑶, 陈迪, 等. 电感耦合等离子体质谱法分析水产品中12 种元素[J]. 分析试验室, 2013, 32(5): 91-95. DOI:10.13595/j.cnki.issn1000-0720.2013. 0138.
[3] SOUZA S O, SILVANIO S L, BRUM B C T, et al. Determination of nutrients in sugarcane juice using slurry sampling and detection by ICP OES[J]. Food Chemistry, 2018, 273: 57-63. DOI:10.1016/j.foodchem.2018.03.060.
[4] BARBOSA I D S, BRITO G B, SANTOS G L D, et al. Multivariate data analysis of trace elements in bivalve molluscs: characterization and food safety evaluation[J]. Food Chemistry, 2018, 273: 64-70.DOI:10.1016/j.foodchem.2018.02.063.
[5] OHKI A, NAKAJIMA T, HIRAKAWA S, et al. A simple method of the recovery of selenium from food samples for the determination by ICP-MS[J]. Microchemical Journal, 2016, 124: 693-698. DOI:10.1016/j.microc.2015.10.012.
[6] TIAN Y, CHEUNG H C, ZHENG R, et al. Elemental analysis of powders with surface-assisted thin film laser-induced breakdown spectroscopy[J]. Spectrochimica Acta Part B Atomic Spectroscopy,2016, 124: 16-24. DOI:10.1016/j.sab.2016.08.016.
[7] ZHU R S, LIU Y Z, ZHANG Q H, et al. Quantitative analysis of Fe and detection of multiple elements in the coal ash by laser-induced breakdown spectroscopy[J]. Optik, 2018, 169: 77-84. DOI:10.1016/j.ijleo.2018.05.035.
[8] PENG J Y, LIU F, ZHOU F, et al. Challenging applications for multi-element analysis by laser-induced breakdown spectroscopy in agriculture: a review[J]. TrAC Trends in Analytical Chemistry, 2016,85: 260-272. DOI:10.1016/j.trac.2016.08.015.
[9] MARKIEWICZ-KESZYCKAA M, CAMA-MONCUNILLA X,CASADO-GAVALDAA M P, et al. Laser-induced breakdown spectroscopy (LIBS) for food analysis: a review[J]. Trends in Food Science & Technology, 2017, 65: 80-93. DOI:10.1016/j.tifs.2017.05.005.
[10] 温荣欣, 扈莹莹, 于晶, 等. 激光诱导击穿光谱技术及其在食品分析中的应用研究进展[J]. 食品科学, 2019, 40(15): 15-22. DOI:10.7506/spkx1002-6630-20180906-070.
[11] MONCAYO S, MANZOOR S, ROSALES J D, et al. Qualitative and quantitative analysis of milk for the detection of adulteration by laser induced breakdown spectroscopy (LIBS)[J]. Food Chemistry, 2017,232: 322-328. DOI:10.1016/j.foodchem.2017.04.017.
[12] BILGE G, VELIOGLU H M, SEZER B, et al. Identification of meat species by using laser-induced breakdown spectroscopy[J]. Meat Science, 2016, 119: 118-122. 10.1016/j.meatsci.2016.04.035.
[13] SINGH J, KUMAR R, AWASTHI S, et al. Laser Induced breakdown spectroscopy: a rapid tool for the identification and quantification of minerals in cucurbit seeds[J]. Food Chemistry, 2017, 221: 1778-1783.DOI:10.1016/j.foodchem.2016.10.104.
[14] TIAN Y, YAN C H, ZHANG T L, et al. Classification of wines according to their production regions with the contained trace elements using laser-induced breakdown spectroscopy[J]. Spectrochimica Acta Part B Atomic Spectroscopy, 2017, 135(1): 91-101. DOI:10.1016/j.sab.2017.07.003.
[15] CASADO-GAVALDA M P, DIXIT Y, GEULEN D, et al.Quantification of copper content with laser induced breakdown spectroscopy as a potential indicator of offal adulteration in beef[J].Talanta, 2017, 169: 123-129. DOI:10.1016/j.talanta.2017.03.071.
[16] ANDERSENA M S, FRYDENVANG J, HENCKEL P, et al. The potential of laser-induced breakdown spectroscopy for industrial at-line monitoring of calcium content in comminuted poultry meat[J]. Food Control, 2016, 64: 226-233. DOI:10.1016/j.foodcont.2016.01.001.
[17] VELIOGLU H M, SEZER B, BILGE G, et al. Identification of offal adulteration in beef by laser induced breakdown spectroscopy(LIBS)[J]. Meat Science, 2017, 138: 28-33. DOI:10.1016/j.meatsci.2017.12.003.
[18] 王欢欢. 基于LIBS的煤质检测及其软件开发[D]. 南京: 东南大学, 2013.
[19] 余克强, 赵艳茹, 刘飞, 等. 应用激光诱导击穿光谱对土壤中多元素同时定量分析[J]. 光谱学与光谱分析, 2017, 37(9): 2879-2884.DOI:10.3964/j.issn.1000-0593(2017)09-2879-06.
[20] BELDJILALI S, BORIVENT D, MERCADIER L, et al. Evaluation of minor element concentrations in potatoes using laser-induced breakdown spectroscopy[J]. Spectrochimica Acta Part B: Atomic Spectroscopy, 2010, 65(8): 727-733. DOI:10.1016/j.sab.2010.04.015.
[21] DIXIT Y, CASADO-GAVALADA M P, CAMA-MONCUNILL R,et al. Quantification of rubidium as a trace element in beef using laser induced breakdown spectroscopy[J]. Meat Science, 2017, 130: 47-49.DOI:10.1016/j.meatsci.2017.03.013.
[22] CAMA-MONCUNILL X, MARKIEWICZ-KESZYCKA M, DIXIT Y,et al. Feasibility of laser-induced breakdown spectroscopy (LIBS)as an at-line validation tool for calcium determination in infant formula[J]. Food Control, 2017, 78: 304-310. DOI:10.1016/j.foodcont.2017.03.005.
[23] SINGH J, KUMAR R, AWASTHI S, et al. Laser Induced breakdown spectroscopy: a rapid tool for the identification and quantification of minerals in cucurbit seeds[J]. Food Chemistry, 2017, 221: 1778-1783.DOI:10.1016/j.foodchem.2016.10.104.
[24] DE CARVALHO G G A, SANTOS D J, DA SILVA G M, et al.Inf l uence of particle size distribution on the analysis of pellets of plant materials by laser-induced breakdown spectroscopy[J]. Spectrochimica Acta Part B: Atomic Spectroscopy, 2015, 105: 130-135.DOI:10.1016/j.sab.2014.09.001.
[25] ZHANG T L, WU S, TANG H S, et al. Progress of chemometrics in laser-induced breakdown spectroscopy analysis[J]. Chinese Journal of Analytical Chemistry, 2015, 43(6): 939-948. DOI:10.1016/S1872-2040(15)60832-5.
[26] KIM G, KWAK J, CHOI J, et al. Detection of nutrient elements and contamination by pesticides in spinach and rice samples using laserinduced breakdown spectroscopy (LIBS)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(3): 718-724. DOI:10.1021/jf203518f.
[27] SE K W, GHOSHAL S K, WAHAB R A. Laser-induced breakdown spectroscopy unified partial least squares regression:an easy and speedy strategy for predicting Ca, Mg and Na content in honey[J]. Measurement, 2019, 136: 1-10. DOI:10.1016/j.measurement.2018.12.052.
[28] BILGE G, SEZER B, ESELLER K E, et al. Ash analysis of flour sample by using laser-induced breakdown spectroscopy[J].Spectrochimica Acta Part B: Atomic Spectroscopy, 2016, 124: 74-78.DOI:10.1016/j.sab.2016.08.023.
[29] JULL H, KÜNNEMEYER R, SCHAARE P. Nutrient quantification in fresh and dried mixtures of ryegrass and clover leaves using laserinduced breakdown spectroscopy[J]. Precision Agriculture, 2018,19(15): 1-17. DOI:10.1007/s11119-018-9559-4.
[30] TIAN Y, WANG Z N, HAN X S, et al. Comparative investigation of partial least squares discriminant analysis and support vector machines for geological cuttings identification using laser-induced breakdown spectroscopy[J]. Spectrochimica Acta Part B: Atomic Spectroscopy,2014, 102: 52-57. DOI:10.1016/j.sab.2014.10.014.
[31] XAVIER C M, MARIA M K, RAQUEL C M, et al. Sampling effects on the quantification of sodium content in infant formula using laserinduced breakdown spectroscopy (LIBS)[J]. International Dairy Journal, 2018, 85: 49-55. DOI:10.1016/j.idairyj.2018.04.014.