向日葵(Helianthus annuus L.)是重要的油料作物之一,在世界各地均有广泛种植[1-2]。其种子含油量高,富含人体所必需的不饱和脂肪酸、VE、β-胡萝卜素、矿物质等,具有很强的生物活性,经常食用对人体有益,且风味优良,通常被制成葵花籽油或休闲食品[3-4]。目前,国内调味品行业发展潜力巨大,许多酱类产品如芝麻酱、花生酱等深受广大消费者喜爱,但其品种较为单一,所占市场份额也比较小。另外,国内外还存在一部分人由于对花生等食品过敏而限制了花生酱等产品的销售,据研究,葵花籽酱或可以作为花生酱的替代品[2,5]。迄今为止,在国内市场上鲜见有关葵花籽酱产品的生产与销售。因此,研究葵花籽酱对于开发新型酱类食品及作为花生酱等的替代品具有重要意义。
风味是衡量食品品质优劣的重要方面,近年来,国内外研究者越来越重视对于挥发性风味成分的研究[6-7]。炒籽温度显著影响热反应风味物质的产生,另外,有研究报道,初始水分含量可能会影响美拉德反应的程度,进而影响食品的最终风味[8-11]。目前,关于葵花籽酱的研究较少,更鲜见有关挥发性风味成分的报道。本实验通过分析炒籽温度及初始水分含量对葵花籽酱挥发性风味成分的影响,结合气味阈值确定不同挥发性组分的相对气味活度值(relative odor activity value,ROAV),探讨葵花籽酱的特征风味成分,并结合主成分分析(principal component analysis,PCA)进一步明确不同炒籽温度及初始水分含量制备的葵花籽酱的关键风味物质,以期为新型酱类产品的研究与开发提供参考,对企业的生产加工有一定的指导意义。
1 材料与方法
1.1 材料与试剂
葵花籽品种为SH 361,产地为内蒙古巴彦淖尔市;C6~C30正构烷烃标样 西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
7890B/5977B气相色谱-质谱联用仪 美国安捷伦公司;固相微萃取手柄、50/30 μm DVB/CAR/PDMS萃取头 西格玛奥德里奇(上海)贸易有限公司。
1.3 方法
1.3.1 葵花籽酱的制备
称取葵花籽仁每份约350 g,处以3 种不同的处理以得到不同的水分含量:60 ℃烘烤2.5 h,以及分别用水浸泡0 min和10 min(水与葵花籽液料比为2∶1(mL/g))。浸泡后的样品用纱布沥干水分,在恒温恒湿培养箱中平衡24 h。测定3 种处理的水分质量分数分别为2.74%、5.40%、15.08%。
将上述样品分别放入炒籽机中炒籽(炉温分别为140、170、200 ℃),并于胶体磨中磨制成酱,装瓶密封保存。为方便描述,分别将其编号为1-1(140 ℃、2.74%)、1-2(140 ℃、5.40%)、1-3(140 ℃、15.08%)、2-1(170 ℃、2.74%)、2-2(170 ℃、5.40%)、2-3(170 ℃、15.08%)、3-1(200 ℃、2.74%)、3-2(200 ℃、5.40%)、3-3(200 ℃、15.08%)。另外,称取350 g葵花籽,不经过浸泡和炒籽,磨制成酱作为对照组。
1.3.2 挥发性成分的萃取及检测
1.3.2.1 顶空固相微萃取条件
萃取头老化温度270 ℃,老化时间1 h;活化温度250 ℃,活化时间15 min;萃取条件:顶空瓶置于40 ℃恒温水浴中萃取60 min。
1.3.2.2 气相色谱-质谱条件
色谱条件:HP-5色谱柱(30 m×0.25 mm,0.25 μm);程序升温:初始温度35 ℃,保持2 min;然后以5 ℃/min升温到230 ℃,保持8 min。进样口温度250 ℃;载气流速1.8 mL/min;进样方式:不分流;载气为高纯氦气(纯度≥99.99%)。
质谱条件:电子电离源;电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;采集方式:Scan;质量扫描范围m/z 30~550。
挥发性化合物由质谱解析以及NIST11.L谱库进行检索,根据匹配度(≥80%)定性,并通过正构烷烃(C6~C30),按式(1)计算各挥发性化合物的保留指数(retention index,RI),并与文献报道的RI进行比对。
式中:tR(x)、tR(n)和tR(n+1)分别为待测挥发物,以及含n和n+1 个碳原子正构烷烃的保留时间/min。
一般认为,当ROAV≥1时,该组分为所分析样品的特征风味物质,当0.1≤ROAV<1时,则认为该组分对样品的总体风味具有重要的修饰作用[12-15]。
采用峰面积归一化法,并根据不同样品中风味物质的组分峰面积占总的挥发性风味组分峰面积的百分比计算每种风味组分的相对含量。
1.3.3 特征风味成分分析
在衡量挥发性成分对风味的贡献时,单纯用某种物质的相对含量多少是不够全面和准确的,因此,参考刘登勇等[12]的方法,通过计算ROAV的方法明确葵花籽酱的特征风味物质,首先定义对样品总体风味贡献度最大组分的ROAVstan=100[13-15],对其他风味组分则有:
式中:Ci为各个挥发性组分的相对含量/%;Ti为各个挥发性组分的气味阈值/(mg/kg);Cstan和Tstan分别为对样品总体风味贡献最大的组分的相对含量/%和气味阈值/(mg/kg)。
1.4 数据处理
采用Microsoft Excel 2016软件进行数据处理和ROAV的计算,采用SPSS 20.0软件进行特征挥发性物质的PCA,图谱采用Origin 2018软件绘制完成。
2 结果与分析
2.1 不同炒籽温度及初始水分含量制备的葵花籽酱样品的挥发性成分
采用气相色谱-质谱分别对每个样品进行3 次平行测定,如表1所示。10 个葵花籽酱样品中共检测出163 种挥发性物质,其中对照、1-1、1-2、1-3、2-1、2-2、2-3、3-1、3-2和3-3分别检测出27、56、58、50、57、57、73、65、74 种和71 种挥发性物质,再以总挥发性组分为100%,各类挥发性组分占总挥发性组分相对含量见图1。

图1 不同炒籽温度及初始水分含量制备的葵花籽酱中挥发性物质的相对含量
Fig. 1 Relative contents of various classes of volatile compounds in sunf l ower butters produced with different initial moisture contents at different roasting temperatures
表1 不同炒籽温度及初始水分含量制备的葵花籽酱中挥发性成分及相对含量(n=3)
Table 1 Relative contents of volatile components in sun flower butters prepared with different initial moisture contents at different roasting temperatures (n= 3)
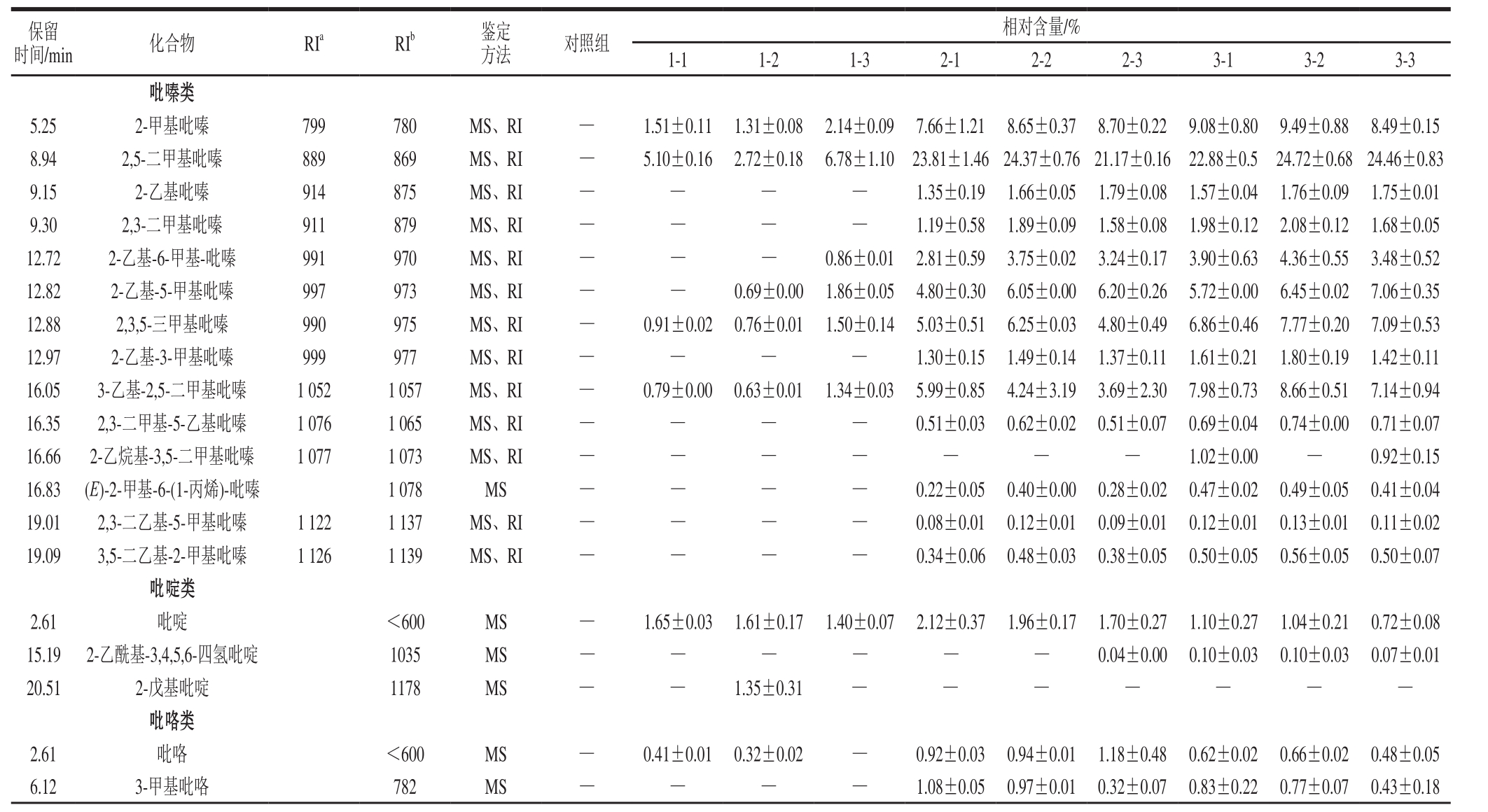
时间/min 化合物 RIa RIb 鉴定方法 对照组保留相对含量/%1-1 1-2 1-3 2-1 2-2 2-3 3-1 3-2 3-3吡嗪类5.25 2-甲基吡嗪 799 780 MS、RI — 1.51±0.11 1.31±0.08 2.14±0.09 7.66±1.21 8.65±0.37 8.70±0.22 9.08±0.80 9.49±0.88 8.49±0.15 8.94 2,5-二甲基吡嗪 889 869 MS、RI — 5.10±0.16 2.72±0.18 6.78±1.10 23.81±1.46 24.37±0.76 21.17±0.16 22.88±0.5 24.72±0.68 24.46±0.83 9.15 2-乙基吡嗪 914 875 MS、RI — — — — 1.35±0.19 1.66±0.05 1.79±0.08 1.57±0.04 1.76±0.09 1.75±0.01 9.30 2,3-二甲基吡嗪 911 879 MS、RI — — — — 1.19±0.58 1.89±0.09 1.58±0.08 1.98±0.12 2.08±0.12 1.68±0.05 12.72 2-乙基-6-甲基-吡嗪 991 970 MS、RI — — — 0.86±0.01 2.81±0.59 3.75±0.02 3.24±0.17 3.90±0.63 4.36±0.55 3.48±0.52 12.82 2-乙基-5-甲基吡嗪 997 973 MS、RI — — 0.69±0.00 1.86±0.05 4.80±0.30 6.05±0.00 6.20±0.26 5.72±0.00 6.45±0.02 7.06±0.35 12.88 2,3,5-三甲基吡嗪 990 975 MS、RI — 0.91±0.02 0.76±0.01 1.50±0.14 5.03±0.51 6.25±0.03 4.80±0.49 6.86±0.46 7.77±0.20 7.09±0.53 12.97 2-乙基-3-甲基吡嗪 999 977 MS、RI — — — — 1.30±0.15 1.49±0.14 1.37±0.11 1.61±0.21 1.80±0.19 1.42±0.11 16.05 3-乙基-2,5-二甲基吡嗪 1 052 1 057 MS、RI — 0.79±0.00 0.63±0.01 1.34±0.03 5.99±0.85 4.24±3.19 3.69±2.30 7.98±0.73 8.66±0.51 7.14±0.94 16.35 2,3-二甲基-5-乙基吡嗪 1 076 1 065 MS、RI — — — — 0.51±0.03 0.62±0.02 0.51±0.07 0.69±0.04 0.74±0.00 0.71±0.07 16.66 2-乙烷基-3,5-二甲基吡嗪 1 077 1 073 MS、RI — — — — — — — 1.02±0.00 — 0.92±0.15 16.83 (E)-2-甲基-6-(1-丙烯)-吡嗪 1 078 MS — — — — 0.22±0.05 0.40±0.00 0.28±0.02 0.47±0.02 0.49±0.05 0.41±0.04 19.01 2,3-二乙基-5-甲基吡嗪 1 122 1 137 MS、RI — — — — 0.08±0.01 0.12±0.01 0.09±0.01 0.12±0.01 0.13±0.01 0.11±0.02 19.09 3,5-二乙基-2-甲基吡嗪 1 126 1 139 MS、RI — — — — 0.34±0.06 0.48±0.03 0.38±0.05 0.50±0.05 0.56±0.05 0.50±0.07吡啶类2.61 吡啶 <600 MS — 1.65±0.03 1.61±0.17 1.40±0.07 2.12±0.37 1.96±0.17 1.70±0.27 1.10±0.27 1.04±0.21 0.72±0.08 15.19 2-乙酰基-3,4,5,6-四氢吡啶 1035 MS — — — — — — 0.04±0.00 0.10±0.03 0.10±0.03 0.07±0.01 20.51 2-戊基吡啶 1178 MS — — 1.35±0.31 — — — — — — —吡咯类2.61 吡咯 <600 MS — 0.41±0.01 0.32±0.02 — 0.92±0.03 0.94±0.01 1.18±0.48 0.62±0.02 0.66±0.02 0.48±0.05 6.12 3-甲基吡咯 782 MS — — — — 1.08±0.05 0.97±0.01 0.32±0.07 0.83±0.22 0.77±0.07 0.43±0.18
续表1
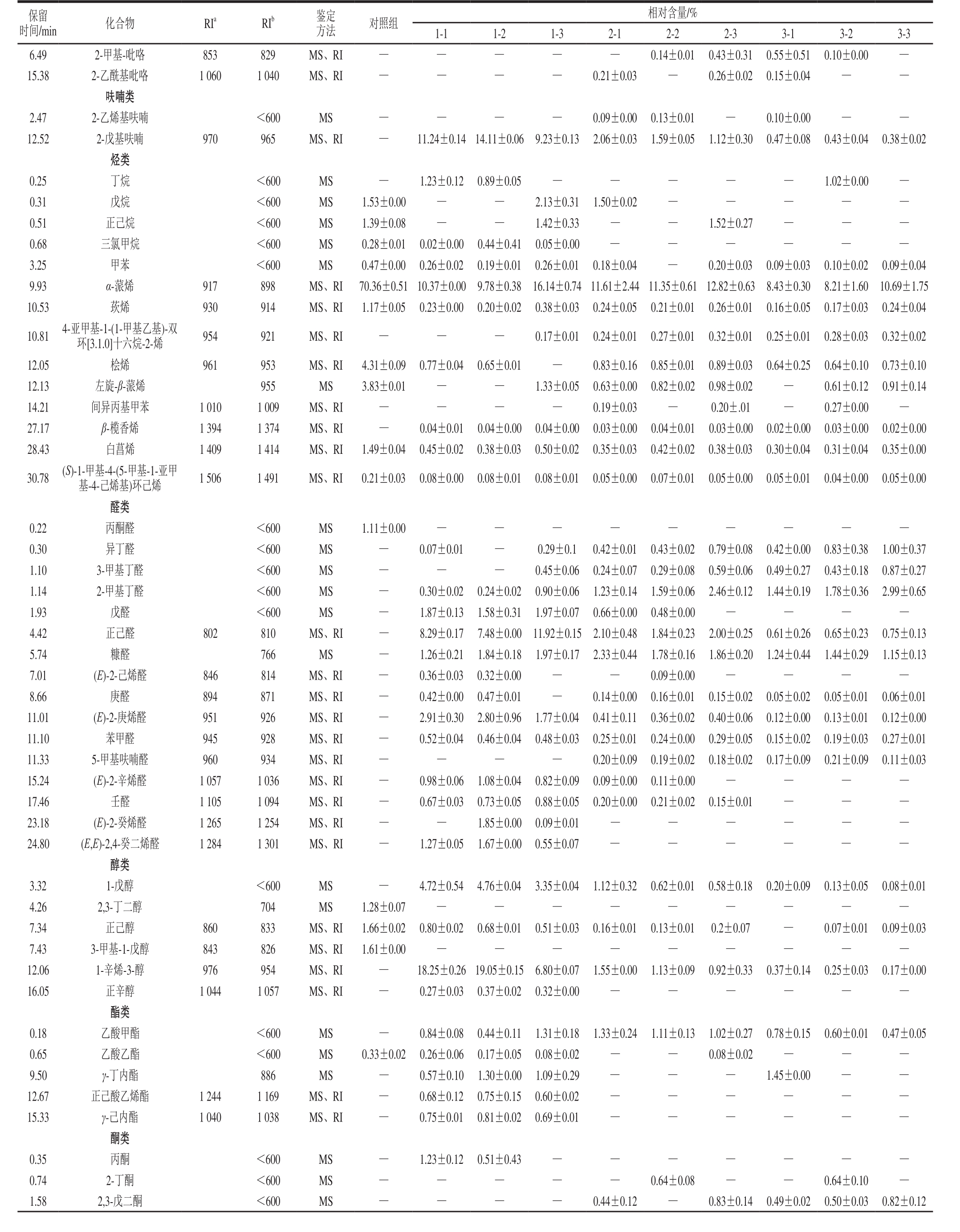
时间/min 化合物 RIa RIb 鉴定方法 对照组相对含量/%1-1 1-2 1-3 2-1 2-2 2-3 3-1 3-2 3-3 6.49 2-甲基-吡咯 853 829 MS、RI — — — — — 0.14±0.01 0.43±0.31 0.55±0.51 0.10±0.00 —15.38 2-乙酰基吡咯 1 060 1 040 MS、RI — — — — 0.21±0.03 — 0.26±0.02 0.15±0.04 — —呋喃类2.47 2-乙烯基呋喃 <600 MS — — — — 0.09±0.00 0.13±0.01 — 0.10±0.00 — —12.52 2-戊基呋喃 970 965 MS、RI — 11.24±0.14 14.11±0.06 9.23±0.13 2.06±0.03 1.59±0.05 1.12±0.30 0.47±0.08 0.43±0.04 0.38±0.02烃类0.25 丁烷 <600 MS — 1.23±0.120.89±0.05 — — — — — 1.02±0.00 —0.31 戊烷 <600 MS 1.53±0.00 — — 2.13±0.31 1.50±0.02 — — — — —0.51 正己烷 <600 MS 1.39±0.08 — — 1.42±0.33 — — 1.52±0.27 — — —0.68 三氯甲烷 <600 MS 0.28±0.01 0.02±0.00 0.44±0.41 0.05±0.00 — — — — — —3.25 甲苯 <600 MS 0.47±0.00 0.26±0.02 0.19±0.01 0.26±0.01 0.18±0.04 — 0.20±0.03 0.09±0.03 0.10±0.02 0.09±0.04 9.93 α-蒎烯 917 898 MS、RI 70.36±0.51 10.37±0.00 9.78±0.38 16.14±0.74 11.61±2.44 11.35±0.61 12.82±0.63 8.43±0.30 8.21±1.60 10.69±1.75 10.53 莰烯 930 914 MS、RI 1.17±0.05 0.23±0.00 0.20±0.02 0.38±0.03 0.24±0.05 0.21±0.01 0.26±0.01 0.16±0.05 0.17±0.03 0.24±0.04 10.81 4-亚甲基-1-(1-甲基乙基)-双环[3.1.0]十六烷-2-烯 954 921 MS、RI — — — 0.17±0.01 0.24±0.01 0.27±0.01 0.32±0.01 0.25±0.01 0.28±0.03 0.32±0.02 12.05 桧烯 961 953 MS、RI 4.31±0.09 0.77±0.04 0.65±0.01 — 0.83±0.16 0.85±0.01 0.89±0.03 0.64±0.25 0.64±0.10 0.73±0.10 12.13 左旋-β-蒎烯 955 MS 3.83±0.01 — — 1.33±0.05 0.63±0.00 0.82±0.02 0.98±0.02 — 0.61±0.12 0.91±0.14 14.21 间异丙基甲苯 1 010 1 009 MS、RI — — — — 0.19±0.03 — 0.20±.01 — 0.27±0.00 —27.17 β-榄香烯 1 394 1 374 MS、RI — 0.04±0.01 0.04±0.00 0.04±0.00 0.03±0.00 0.04±0.01 0.03±0.00 0.02±0.00 0.03±0.00 0.02±0.00 28.43 白菖烯 1 409 1 414 MS、RI 1.49±0.04 0.45±0.02 0.38±0.03 0.50±0.02 0.35±0.03 0.42±0.02 0.38±0.03 0.30±0.04 0.31±0.04 0.35±0.00 30.78 (S)-1-甲基-4-(5-甲基-1-亚甲基-4-己烯基)环己烯 1 506 1 491 MS、RI 0.21±0.03 0.08±0.00 0.08±0.01 0.08±0.01 0.05±0.00 0.07±0.01 0.05±0.00 0.05±0.01 0.04±0.00 0.05±0.00醛类0.22 丙酮醛 <600 MS 1.11±0.00 — — — — — — — — —0.30 异丁醛 <600 MS — 0.07±0.01 — 0.29±0.1 0.42±0.01 0.43±0.02 0.79±0.08 0.42±0.00 0.83±0.38 1.00±0.37 1.10 3-甲基丁醛 <600 MS — — — 0.45±0.06 0.24±0.07 0.29±0.08 0.59±0.06 0.49±0.27 0.43±0.18 0.87±0.27 1.14 2-甲基丁醛 <600 MS — 0.30±0.02 0.24±0.02 0.90±0.06 1.23±0.14 1.59±0.06 2.46±0.12 1.44±0.19 1.78±0.36 2.99±0.65 1.93 戊醛 <600 MS — 1.87±0.13 1.58±0.31 1.97±0.07 0.66±0.00 0.48±0.00 — — — —4.42 正己醛 802 810 MS、RI — 8.29±0.17 7.48±0.00 11.92±0.15 2.10±0.48 1.84±0.23 2.00±0.25 0.61±0.26 0.65±0.23 0.75±0.13 5.74 糠醛 766 MS — 1.26±0.21 1.84±0.18 1.97±0.17 2.33±0.44 1.78±0.16 1.86±0.20 1.24±0.44 1.44±0.29 1.15±0.13 7.01 (E)-2-己烯醛 846 814 MS、RI — 0.36±0.03 0.32±0.00 — — 0.09±0.00 — — — —8.66 庚醛 894 871 MS、RI — 0.42±0.00 0.47±0.01 — 0.14±0.00 0.16±0.01 0.15±0.02 0.05±0.02 0.05±0.01 0.06±0.01 11.01 (E)-2-庚烯醛 951 926 MS、RI — 2.91±0.30 2.80±0.96 1.77±0.04 0.41±0.11 0.36±0.02 0.40±0.06 0.12±0.00 0.13±0.01 0.12±0.00 11.10 苯甲醛 945 928 MS、RI — 0.52±0.04 0.46±0.04 0.48±0.03 0.25±0.01 0.24±0.00 0.29±0.05 0.15±0.02 0.19±0.03 0.27±0.01 11.33 5-甲基呋喃醛 960 934 MS、RI — — — — 0.20±0.09 0.19±0.02 0.18±0.02 0.17±0.09 0.21±0.09 0.11±0.03 15.24 (E)-2-辛烯醛 1 057 1 036 MS、RI — 0.98±0.06 1.08±0.04 0.82±0.09 0.09±0.00 0.11±0.00 — — — —17.46 壬醛 1 105 1 094 MS、RI — 0.67±0.03 0.73±0.05 0.88±0.05 0.20±0.00 0.21±0.02 0.15±0.01 — — —23.18 (E)-2-癸烯醛 1 265 1 254 MS、RI — — 1.85±0.00 0.09±0.01 — — — — — —24.80 (E,E)-2,4-癸二烯醛 1 284 1 301 MS、RI — 1.27±0.05 1.67±0.00 0.55±0.07 — — — — — —醇类3.32 1-戊醇 <600 MS — 4.72±0.54 4.76±0.04 3.35±0.04 1.12±0.32 0.62±0.01 0.58±0.18 0.20±0.09 0.13±0.05 0.08±0.01 4.26 2,3-丁二醇 704 MS 1.28±0.07 — — — — — — — — —7.34 正己醇 860 833 MS、RI 1.66±0.02 0.80±0.02 0.68±0.01 0.51±0.03 0.16±0.01 0.13±0.01 0.2±0.07 — 0.07±0.01 0.09±0.03 7.43 3-甲基-1-戊醇 843 826 MS、RI 1.61±0.00 — — — — — — — — —12.06 1-辛烯-3-醇 976 954 MS、RI — 18.25±0.26 19.05±0.15 6.80±0.07 1.55±0.00 1.13±0.09 0.92±0.33 0.37±0.14 0.25±0.03 0.17±0.00 16.05 正辛醇 1 044 1 057 MS、RI — 0.27±0.03 0.37±0.02 0.32±0.00 — — — — — —酯类0.18 乙酸甲酯 <600 MS — 0.84±0.08 0.44±0.11 1.31±0.18 1.33±0.24 1.11±0.13 1.02±0.27 0.78±0.15 0.60±0.01 0.47±0.05 0.65 乙酸乙酯 <600 MS 0.33±0.02 0.26±0.06 0.17±0.05 0.08±0.02 — — 0.08±0.02 — — —9.50 γ-丁内酯 886 MS — 0.57±0.10 1.30±0.00 1.09±0.29 — — — 1.45±0.00 — —12.67 正己酸乙烯酯 1 244 1 169 MS、RI — 0.68±0.12 0.75±0.15 0.60±0.02 — — — — — —15.33 γ-己内酯 1 040 1 038 MS、RI — 0.75±0.01 0.81±0.02 0.69±0.01 — — — — — —酮类0.35 丙酮 <600 MS — 1.23±0.120.51±0.43 — — — — — — —0.74 2-丁酮 <600 MS — — — — — 0.64±0.08 — — 0.64±0.10 —1.58 2,3-戊二酮 <600 MS — — — — 0.44±0.12 — 0.83±0.14 0.49±0.02 0.50±0.03 0.82±0.12保留
续表1
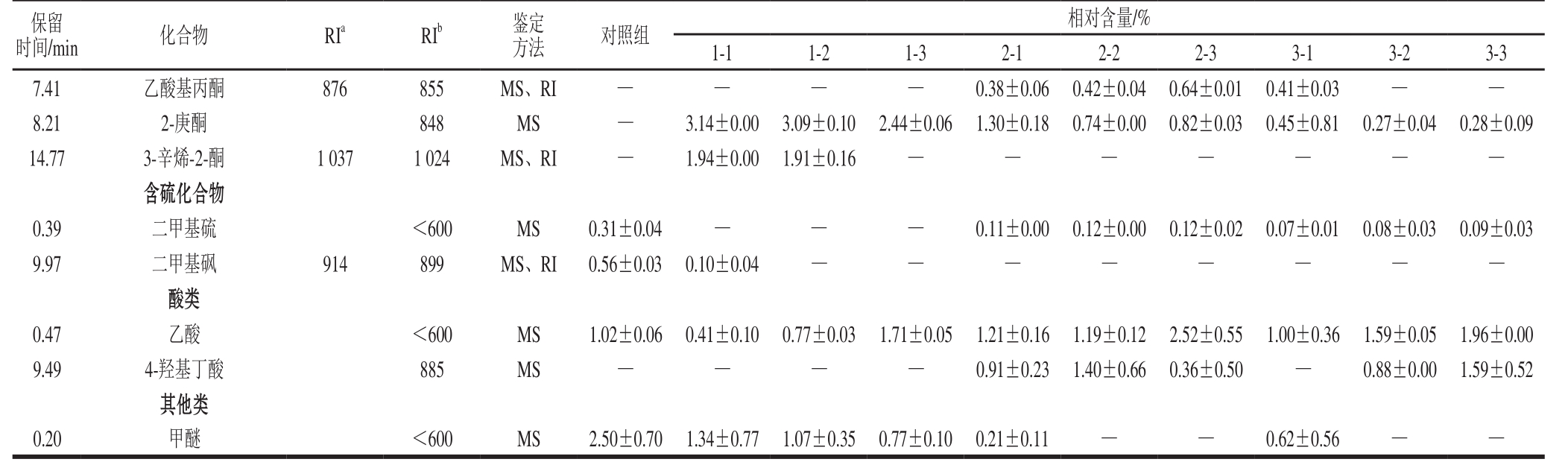
注:只列出部分挥发性化合物,未包括所有己鉴定出的化合物;a.在https://webbook.nist.gov/chemistry/cas-ser/中报道的RI;b.在HP-5色谱柱上针对正构烷烃计算的RI;—.未检出,表3同。
时间/min 化合物 RIa RIb 鉴定方法 对照组相对含量/%1-1 1-2 1-3 2-1 2-2 2-3 3-1 3-2 3-3 7.41 乙酸基丙酮 876 855 MS、RI — — — — 0.38±0.06 0.42±0.04 0.64±0.01 0.41±0.03 — —8.21 2-庚酮 848 MS — 3.14±0.00 3.09±0.10 2.44±0.06 1.30±0.18 0.74±0.00 0.82±0.03 0.45±0.81 0.27±0.04 0.28±0.09 14.77 3-辛烯-2-酮 1 037 1 024 MS、RI — 1.94±0.00 1.91±0.16 — — — — — — —含硫化合物0.39 二甲基硫 <600 MS 0.31±0.04 — — — 0.11±0.00 0.12±0.00 0.12±0.02 0.07±0.01 0.08±0.03 0.09±0.03 9.97 二甲基砜 914 899 MS、RI 0.56±0.03 0.10±0.04 — — — — — — — —酸类0.47 乙酸 <600 MS 1.02±0.06 0.41±0.10 0.77±0.03 1.71±0.05 1.21±0.16 1.19±0.12 2.52±0.55 1.00±0.36 1.59±0.05 1.96±0.00 9.49 4-羟基丁酸 885 MS — — — — 0.91±0.23 1.40±0.66 0.36±0.50 — 0.88±0.00 1.59±0.52其他类0.20 甲醚 <600 MS 2.50±0.70 1.34±0.77 1.07±0.35 0.77±0.10 0.21±0.11 — — 0.62±0.56 — —保留
由表1和图1可知,10 个葵花籽酱样品的香味物质可以分为吡嗪类、吡啶类、吡咯类、呋喃类、烃类、醛类、醇类、酯类、酮类、含硫化合物、酸类和其他类等12 个类别。其中,对照组中烃类物质的相对含量最高,为87.72%,是其主体风味成分;炒籽温度为140 ℃的样品中烃类、醛类和醇类物质的相对含量较高;随着炒籽温度的升高,吡嗪类物质成为葵花籽酱的主体风味物质,炒籽温度为170 ℃和200 ℃的样品中吡嗪类物质相对含量均在54%以上,使得样品具有突出的焙烤香味,另外,烃类和醛类物质的相对含量也较高,炒籽温度为170 ℃时,样品的风味较为丰富。
2.2 不同炒籽温度及初始水分含量制备的葵花籽酱样品的挥发性成分的比较分析
2.2.1 吡嗪类和呋喃类
吡嗪类物质是焙炒油料主要的挥发性物质之一[16-17]。通常认为,吡嗪类化合物是由风味前体物质经美拉德反应产生的,其中烷基吡嗪最可能由Strecker降解反应生成的氨基酮的缩合形成[18]。葵花籽酱样品中吡嗪类物质总的相对含量由0%(对照)增加到69.90%(样品3-2)。其中,2,5-二甲基吡嗪的相对含量最高,2,5-二甲基吡嗪也存在于烘烤的葵花籽、葵花籽油以及芝麻酱中[19-21]。同一温度条件下,水分含量升高时,吡嗪类物质的相对含量先升高后降低,表明水分含量可能影响葵花籽酱中吡嗪类物质的形成。
随着炒籽温度的升高,呋喃类物质的相对含量降低。在炒籽温度为140 ℃的样品中相对含量较高,其余样品中相对含量较低。样品1-2中呋喃类物质相对含量最高,为14.18%,其中,2-戊基呋喃的相对含量最高。2-戊基呋喃一般为碳水化合物降解或不饱和脂肪酸氧化产生,可能对葵花籽酱的整体风味有较大贡献[22]。
2.2.2 烃类
各样品中均有烃类物质检出且相对含量较高,可以分为饱和烃与不饱和烃两类。其中的不饱和烃种类较多,具有较低的阈值,而饱和烃阈值较高,主要来自于脂肪酸烷氧基的均裂,对风味的贡献不大[23]。由表1可知,对照中烃类物质相对含量最高,为87.72%,其中α-蒎烯的相对含量最高,为70.36%,经炒籽后制成的葵花籽酱中烃类物质的相对含量显著降低,可能是因为有些烃类物质作为形成杂环化合物的中间体而发生了转化[24]。烯烃类物质α-蒎烯、β-蒎烯等主要呈现松油味等[25],气味强烈,贡献了葵花籽酱的整体风味。
2.2.3 醛类
醛类物质主要来自于油脂的氧化、降解,以及氨基酸的Strecker降解反应[26]。醛类物质在炒籽温度为140 ℃时的样品中相对含量较高,平均为21.03%。其中,正己醛为亚油酸的一级氧化产物之一,在葵花籽酱中相对含量较高,也是浓香花生油中主要的风味醛[8]。(E,E)-2,4-癸二烯醛为亚油酸的过氧化产物,壬醛和正辛醛被认为是油酸的氧化产物[27-28]。醛类物质相对含量随着水分含量的升高而升高,表明水分含量增加可能会导致油脂氧化从而增加醛类物质的生成[29]。
2.2.4 醇类、酯类
醇类物质在对照和140 ℃炒籽的样品中相对含量较高,而在170 ℃和200 ℃炒籽的样品中相对含量较低。饱和醇阈值较高,只有在高浓度下才会影响食品风味,而不饱和醇阈值相对较低,对葵花籽酱的整体风味有较大贡献[30],如1-辛烯-3-醇表现出青草味[31]。醇类物质的相对含量随着炒籽温度的升高而降低,可能是因为醇类物质在受热过程中部分被氧化为酮类物质,以及部分烯醇异构化形成了饱和醛类物质等[32]。酯类物质的相对含量较低。主要由于酯类化合物挥发性较低,对葵花籽酱的整体气味起到一定的柔和作用[25]。
2.3 不同炒籽温度及初始水分含量制备的葵花籽酱的特征风味成分分析
由表2可知,所有组分的ROAV≤100,对照组中有2 种特征风味成分(ROAV≥1),依次为正己醇和乙酸;140 ℃炒籽制得的样品中共有14 种特征风味成分,主要为2,3,5-三甲基吡嗪、2-戊基呋喃、异丁醛、2-甲基丁醛、正己醛、(E,E)-2,4-癸二烯醛和1-辛烯-3-醇等;170 ℃炒籽制得的样品中共有12 种特征风味成分,主要为2,3,5-三甲基吡嗪、3-乙基-2,5-二甲基吡嗪、2,3-二乙基-5-甲基吡嗪、异丁醛、2-甲基丁醛和1-辛烯-3-醇等;200 ℃炒籽制得的样品中共有8 种特征风味成分,主要为2,3,5-三甲基吡嗪、3-乙基-2,5-二甲基吡嗪、2,3-二乙基-5-甲基吡嗪、异丁醛、2-甲基丁醛和甲硫醇等。可见,葵花籽酱的风味是多种组分协同作用的结果,计算出各个挥发物的ROAV可使葵花籽酱中的特征风味物质更加明确。
表2 不同炒籽温度和初始水分含量制备的葵花籽酱中挥发性物质的ROAV(n=3)
Table 2 ROAV of volatile compounds in sun flower butters produced with different initial moisture contents at different roasting temperatures (n= 3)
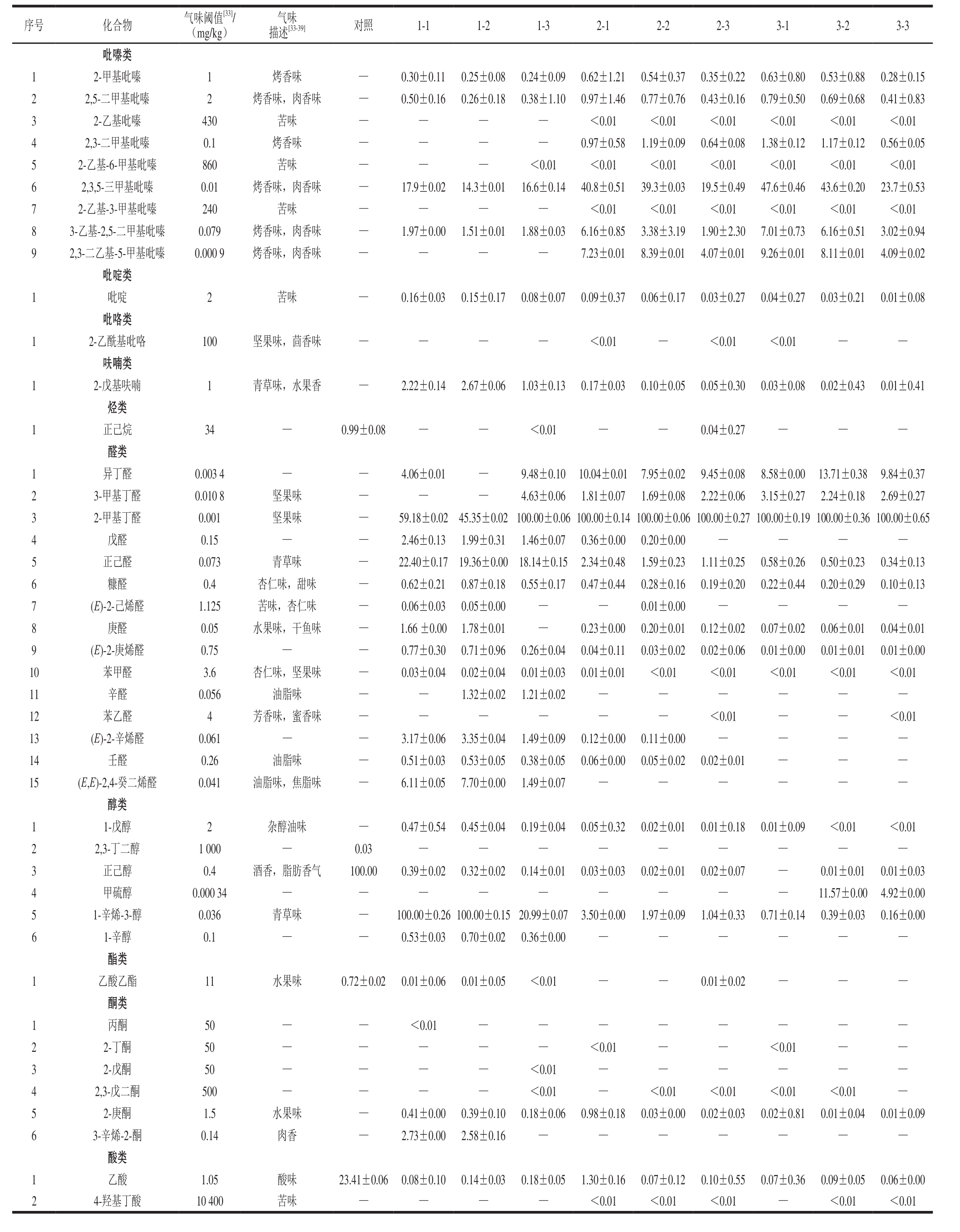
[33]序号 化合物 气味阈值/(mg/kg)气味描述[33-39] 对照 1-1 1-2 1-3 2-1 2-2 2-3 3-1 3-2 3-3 2-甲基吡嗪 1 烤香味 — 0.30±0.11 0.25±0.08 0.24±0.09 0.62±1.21 0.54±0.37 0.35±0.22 0.63±0.80 0.53±0.88 0.28±0.15 2 2,5-二甲基吡嗪 2 烤香味,肉香味 — 0.50±0.16 0.26±0.18 0.38±1.10 0.97±1.46 0.77±0.76 0.43±0.16 0.79±0.50 0.69±0.68 0.41±0.83 3 2-乙基吡嗪 430 苦味 — — — — <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 4 2,3-二甲基吡嗪 0.1 烤香味 — — — — 0.97±0.58 1.19±0.09 0.64±0.08 1.38±0.12 1.17±0.12 0.56±0.05 5 2-乙基-6-甲基吡嗪 860 苦味 — — — <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 6 2,3,5-三甲基吡嗪 0.01 烤香味,肉香味 — 17.9±0.02 14.3±0.01 16.6±0.14 40.8±0.51 39.3±0.03 19.5±0.49 47.6±0.46 43.6±0.20 23.7±0.53 7 2-乙基-3-甲基吡嗪 240 苦味 — — — — <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 8 3-乙基-2,5-二甲基吡嗪 0.079 烤香味,肉香味 — 1.97±0.00 1.51±0.01 1.88±0.03 6.16±0.85 3.38±3.19 1.90±2.30 7.01±0.73 6.16±0.51 3.02±0.94 9 2,3-二乙基-5-甲基吡嗪 0.000 9 烤香味,肉香味 — — — — 7.23±0.01 8.39±0.01 4.07±0.01 9.26±0.01 8.11±0.01 4.09±0.02吡啶类1吡啶 2 苦味 — 0.16±0.03 0.15±0.17 0.08±0.07 0.09±0.37 0.06±0.17 0.03±0.27 0.04±0.27 0.03±0.21 0.01±0.08吡咯类1 2-乙酰基吡咯 100 坚果味,茴香味 — — — — <0.01 — <0.01 <0.01 — —呋喃类1 2-戊基呋喃 1 青草味,水果香 — 2.22±0.14 2.67±0.06 1.03±0.13 0.17±0.03 0.10±0.05 0.05±0.30 0.03±0.08 0.02±0.43 0.01±0.41烃类1正己烷 34 — 0.99±0.08 — — <0.01 — — 0.04±0.27 — — —醛类1异丁醛 0.003 4 — — 4.06±0.01 — 9.48±0.10 10.04±0.01 7.95±0.02 9.45±0.08 8.58±0.00 13.71±0.38 9.84±0.37 2 3-甲基丁醛 0.010 8 坚果味 — — — 4.63±0.06 1.81±0.07 1.69±0.08 2.22±0.06 3.15±0.27 2.24±0.18 2.69±0.27 3 2-甲基丁醛 0.001 坚果味 — 59.18±0.02 45.35±0.02 100.00±0.06 100.00±0.14 100.00±0.06 100.00±0.27 100.00±0.19 100.00±0.36 100.00±0.65 4戊醛 0.15 — — 2.46±0.13 1.99±0.31 1.46±0.07 0.36±0.00 0.20±0.00 — — — —5正己醛 0.073 青草味 — 22.40±0.17 19.36±0.00 18.14±0.15 2.34±0.48 1.59±0.23 1.11±0.25 0.58±0.26 0.50±0.23 0.34±0.13 6糠醛 0.4 杏仁味,甜味 — 0.62±0.21 0.87±0.18 0.55±0.17 0.47±0.44 0.28±0.16 0.19±0.20 0.22±0.44 0.20±0.29 0.10±0.13 7(E)-2-己烯醛 1.125 苦味,杏仁味 — 0.06±0.03 0.05±0.00 — — 0.01±0.00 — — — —8庚醛 0.05 水果味,干鱼味 — 1.66 ±0.00 1.78±0.01 — 0.23±0.00 0.20±0.01 0.12±0.02 0.07±0.02 0.06±0.01 0.04±0.01 9 (E)-2-庚烯醛 0.75 — — 0.77±0.30 0.71±0.96 0.26±0.04 0.04±0.11 0.03±0.02 0.02±0.06 0.01±0.00 0.01±0.01 0.01±0.00 10 苯甲醛 3.6 杏仁味,坚果味 — 0.03±0.04 0.02±0.04 0.01±0.03 0.01±0.01 <0.01 <0.01 <0.01 <0.01 <0.01 11 辛醛 0.056 油脂味 — — 1.32±0.02 1.21±0.02 — — — — — —12 苯乙醛 4 芳香味,蜜香味 — — — — — — <0.01 — — <0.01 13 (E)-2-辛烯醛 0.061 — — 3.17±0.06 3.35±0.04 1.49±0.09 0.12±0.00 0.11±0.00 — — — —14 壬醛 0.26 油脂味 — 0.51±0.03 0.53±0.05 0.38±0.05 0.06±0.00 0.05±0.02 0.02±0.01 — — —15 (E,E)-2,4-癸二烯醛 0.041 油脂味,焦脂味 — 6.11±0.05 7.70±0.00 1.49±0.07 — — — — — —醇类1 1-戊醇 2 杂醇油味 — 0.47±0.54 0.45±0.04 0.19±0.04 0.05±0.32 0.02±0.01 0.01±0.18 0.01±0.09 <0.01 <0.01 2 2,3-丁二醇 1 000 — 0.03 — — — — — — — — —3正己醇 0.4 酒香,脂肪香气 100.00 0.39±0.02 0.32±0.02 0.14±0.01 0.03±0.03 0.02±0.01 0.02±0.07 — 0.01±0.01 0.01±0.03 4甲硫醇 0.000 34 — — — — — — — — — 11.57±0.00 4.92±0.00 5 1-辛烯-3-醇 0.036 青草味 — 100.00±0.26 100.00±0.15 20.99±0.07 3.50±0.00 1.97±0.09 1.04±0.33 0.71±0.14 0.39±0.03 0.16±0.00 6 1-辛醇 0.1 — — 0.53±0.03 0.70±0.02 0.36±0.00 — — — — — —酯类1乙酸乙酯 11 水果味 0.72±0.02 0.01±0.06 0.01±0.05 <0.01 — — 0.01±0.02 — — —酮类1丙酮 50 — — <0.01 — — — — — — — —2 2-丁酮 50 — — — — — <0.01 — — <0.01 — —3 2-戊酮 50 — — — — <0.01— — — — — —4 2,3-戊二酮 500 — — — — <0.01 — <0.01 <0.01 <0.01 <0.01 —5 2-庚酮 1.5 水果味 — 0.41±0.00 0.39±0.10 0.18±0.06 0.98±0.18 0.03±0.00 0.02±0.03 0.02±0.81 0.01±0.04 0.01±0.09 6 3-辛烯-2-酮 0.14 肉香 — 2.73±0.00 2.58±0.16 — — — — — — —酸类1乙酸 1.05 酸味 23.41±0.06 0.08±0.10 0.14±0.03 0.18±0.05 1.30±0.16 0.07±0.12 0.10±0.55 0.07±0.36 0.09±0.05 0.06±0.00 2 4-羟基丁酸 10 400 苦味 — — — — <0.01 <0.01 <0.01 — <0.01 <0.01吡嗪类1
2.4 葵花籽酱特征风味成分的PCA
对表2中ROAV不小于0.1的30 种挥发性物质进行PCA,结果如表3所示。利用这30 种挥发性风味组分在前2 个主成分上的得分图和载荷图如图2所示。
表3 主成分特征值及方差贡献率
Table 3 Eigenvalues of principal components and their contribution rates to total variance

主成分 特征值 方差贡献率/% 累计方差贡献率/%1 16.454 54.847 54.847 2 8.234 27.446 82.293 3 2.226 7.420 89.713 4 1.279 4.265 93.978
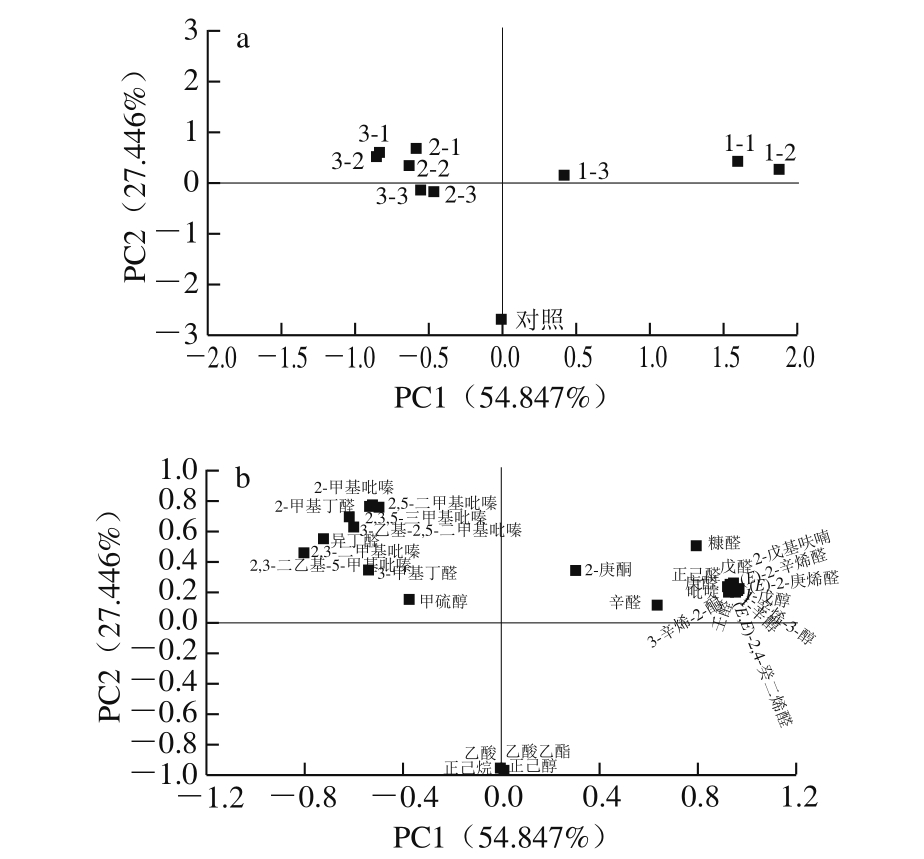
图2 葵花籽酱样品的主成分得分图(a)及其挥发性组分的主成分载荷图(b)
Fig. 2 PCA loading (a) and score (b) plots for volatile compounds of sunf l ower butter samples
由图2a可知,PCA可以很好地区分不同炒籽温度和初始水分含量的样品。样品2-1、2-2、2-3、3-1、3-2、3-3在得分图上距离较近,表明170 ℃和200 ℃的炒籽温度下制得样品的风味组分和相对含量相似度较高,且与140 ℃炒籽制得的样品有明显区分,表明其风味有较大差异。由图2b可知,吡啶、2-戊基呋喃、戊醛、正己醛、(E)-2-庚烯醛、(E)-2-辛烯醛、壬醛、(E,E)-2,4-癸二烯醛、1-戊醇、1-辛烯-3-醇、1-辛醇等与PC1呈较强的正相关,2,3-二甲基吡嗪、2,3-二乙基-5-甲基吡嗪、异丁醛、糠醛等与PC1呈较强的负相关,2-甲基吡嗪、2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2-甲基丁醛等与PC2呈较强的正相关,正己烷、正己醇、乙酸乙酯和乙酸与PC2呈较强的负相关。结合图2可知,表征样品1-1和1-2的关键风味物质(ROAV≥1)主要为2-戊基呋喃、正己醛、(E,E)-2,4-癸二烯醛和1-辛烯-3-醇等,起到重要修饰作用的物质(0.1≤ROAV<1)为吡啶、(E)-2-庚烯醛、壬醛、1-戊醇和1-辛醇等,表征样品1-3的关键风味物质为辛醛,起到重要修饰作用的物质为2-庚酮。由此可知,醛类物质为140 ℃炒籽制得样品的最主要的香气物质,醛类主要呈现脂肪香和青草香等,多表现出油脂氧化味[26],且140 ℃炒籽制得样品的感官评分也较低(表4),与PCA结果一致;表征样品2-1、2-2、2-3、3-1、3-2和3-3的关键风味物质为2,3,5-三甲基吡嗪、3-乙基-2,5-二甲基吡嗪、2,3-二乙基-5-甲基吡嗪、2-甲基丁醛、异丁醛等,起到重要修饰作用的物质为2-甲基吡嗪、2,5-二甲基吡嗪等。由此可知,吡嗪类物质为170 ℃和200 ℃炒籽制得样品的最主要的香气物质,呈现出坚果香、爆米花味等[16-17],赋予葵花籽酱的独特焙烤风味。
表4 葵花籽酱样品感官评价结果
Table 4 Sensory evaluation results of sunf l ower butter samples

注:同列小写字母不同表示差异显著(P<0.05);采用9 分制打分,1 分为最不喜欢,9 分为最喜欢。
样品 外观 气味 味道 组织状态 总体接受度对照 1.00±0.01g1.50±0.01f2.80±0.31ef1.05±0.01f2.60±0.60f 1-1 3.70±1.36e3.20±0.76e2.90±1.28e5.60±1.65e3.80±2.20e 1-2 2.10±0.74f3.80±1.25e3.50±1.27e5.70±1.17e3.40±1.30e 1-3 3.10±0.57e3.60±1.95e2.40±2.17f6.50±1.91cd4.13±1.94d 2-1 8.10±1.52a7.50±1.51a8.10±2.32a8.40±1.23a7.40±1.35a 2-2 7.40±1.01c7.30±0.92ab7.00±0.67b8.25±0.47a6.60±0.70b 2-3 7.90±1.21ab7.20±1.48b7.50±0.28b8.00±0.07a7.25±0.09a 3-1 7.80±1.23b7.60±0.70a7.00±1.15b7.80±1.37b6.63±0.67b 3-2 6.30±2.32d6.40±0.13c5.80±1.37d6.90±1.83c7.20±1.48a 3-3 6.50±1.52d5.60±1.24d6.60±1.07c6.40±1.29d6.60±1.71b
3 结 论
通过分析不同炒籽温度及初始水分含量下制备的10 个葵花籽酱样品中的挥发性物质,共鉴定出163 种风味物质,包括吡嗪类、吡啶类、吡咯类、呋喃类、烃类、醛类、醇类、酯类、酮类、含硫化合物、酸类和其他类共12 类化合物。不同炒籽温度的样品挥发性成分的种类和相对含量有较大差异,葵花籽经炒籽后其吡嗪类、吡啶类等杂环类和醛类、醇类等风味物质的组成和各组分的相对含量增加,而烃类物质的相对含量显著降低。初始水分含量的增加会影响吡嗪类和醛类物质的生成,对葵花籽酱的风味具有负面影响。结合ROAV和PCA结果表明,对照组样品的特征风味物质为正己醇和乙酸;140 ℃炒籽制得样品的特征风味物质以醛类物质为主,包括正己醛、(E,E)-2,4-癸二烯醛、2-戊基呋喃和1-辛烯-3-醇等;170 ℃和200 ℃炒籽制得样品的特征风味物质以吡嗪类物质为主,包括2,3,5-三甲基吡嗪、3-乙基-2,5-二甲基吡嗪、2,3-二乙基-5-甲基吡嗪、2-甲基丁醛和异丁醛等。
[1] 周萍萍. 葵花籽烘烤对葵花籽油风味和品质的影响[D]. 无锡: 江南大学, 2013: 1-25.
[2] LIMA I M, GURAYA H S. Optimization analysis of sunflower butter[J]. Journal of Food Science, 2010, 70(6): 365-370. DOI:10.1111/j.1365-2621.2005.tb11457.x.
[3] 陈洁, 洪振童, 刘国琴, 等. 微波焙炒对葵花籽油品质和挥发性物质的影响[J]. 现代食品科技, 2015, 31(8): 211-218. DOI:10.13982/j.mfst.1673-9078.2015.8.034.
[4] 颜小平. 烘炒葵花籽品质改良及抗氧化研究[D]. 广州: 华南理工大学, 2011: 1-11
[5] THOMAS R, GEBHARDT S E. Sunflower seed butter and almond butter as nutrient-rich alternatives to peanut butter[J]. Journal of the American Dietetic Association, 2010, 110(9): 52-58. DOI:10.1016/j.jada.2010.06.189.
[6] 郝红梅, 张生万, 郭彩霞, 等. 顶空固相微萃取-气相色谱-质谱联用法分析山楂果醋易挥发成分[J]. 食品科学, 2016, 37(2): 138-141.DOI:10.7506/spkx1002-6630-201602024.
[7] 汪立平, 徐岩, 赵光鳌, 等. 顶空固相微萃取法快速测定苹果酒中的香味物质[J]. 无锡轻工大学学报, 2003, 22(1): 1-26. DOI:10.3321/j.issn:1673-1689.2003.01.001.
[8] CHIOU R Y Y, CHANG Y S, TSAI T T, et al. Variation of flavorrelated characteristics of peanuts during roasting as affected by initial moisture contents[J]. Journal of Agricultural and Food Chemistry,1991, 39(6): 1155-1158. DOI:10.1021/jf00006a033.
[9] SOMBOONCHAN S, LUBBERS S, ROUDAUT G. Water and temperature contribution to the structuration of starch matrices in the presence of flavour[J]. Food Chemistry, 2015, 195(4): 79-86.DOI:10.1016/j.foodchem.2015.04.099.
[10] PATTEE H E, YOUNG C T, PEARSON J L, et al. Storage and moisture effects on peanut composition and roasted flavor[J]. Peanut Science, 2010, 9(2): 98-101. DOI:10.3146/i0095-3679-9-2-14.
[11] 乐仁思, 王世平. 美拉德反应对焙烤花生特征风味形成的影响[J].食品科技, 2011, 36(3): 76-80. DOI:10.13684/j.cnki.spkj.2011.03.058.
[12] 刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J]. 食品科学, 2008, 29(7): 370-374. DOI:10.3321/j.issn:1002-6630.2008.07.082.
[13] 王瑞花, 田金虎, 姜万舟, 等. 基于电子鼻和气相质谱联用仪分析葱姜蒜复合物对炖煮猪肉风味物质的影响[J]. 中国食品学报, 2017,17(4): 209-218. DOI:10.16429/j.1009-7848.2017.04.026.
[14] 王丹, 丹彤, 孙天松, 等. SPME-GC-MS结合ROAV分析单菌及复配发酵牛乳中关键性风味物质[J]. 食品科学, 2017, 38(8): 145-152.DOI:10.7506/spkx1002-6630-20170823.
[15] 王大为, 马岩石, 李娜, 等. 陈酿时间对发酵型香菇酒香气成分及酒体风味的影响[J]. 食品科学, 2016, 37(14): 80-85. DOI:10.7506/spkx1002-6630-201614014.
[16] 邓龙. 菜籽油特征香气成分和营养物质组成的研究[D]. 南昌: 南昌大学, 2017: 10-35.
[17] SHIMODA M, NAKADA Y, NAKASHIMA M, et al. Quantitative comparison of volatile flavor compounds in deep-roasted and light-roasted sesame seed oil[J]. Journal of Agricultural and Food Chemistry, 1997, 45(8): 3193-3196. DOI:10.1021/jf970172o.
[18] 刘云花, 胡晖, 刘红芝, 等. 花生饼粕及花生壳烘烤风味分析[J].食品科学, 2017, 38(2): 146-153. DOI:10.7506/spkx1002-6630-201702024.
[19] 贾春晓, 毛多斌, 孙晓丽, 等. 葵花籽烘烤前后化学成分的分析及对比[J]. 食品研究与开发, 2008, 29(7): 111-115. DOI:10.3969/j.issn.1005-6521.2008.07.035.
[20] 洪振童, 陈洁, 范璐, 等. HS-SPME-GC-MS分析冷榨和热榨葵花籽油的挥发性物质[J]. 中国油脂, 2015, 40(2): 90-94.
[21] 张淼, 刘国群, 贾洪锋, 等. 不同热加工方式芝麻酱风味物质的差异研究[J]. 食品工业科技, 2018, 39(10): 268-272; 277. DOI:10.13386/j.issn1002-0306.2018.10.048.
[22] 刘源, 周光宏, 徐幸莲, 等. 南京盐水鸭挥发性风味化合物的研究[J].食品科学, 2 0 0 6, 2 7(1): 1 6 6-1 7 1. D O I:1 0.3 3 2 1/j.issn:1002-6630.2006.01.038.
[23] 任欣, 娄阁, 沈群. 高压热处理对复合芝麻酱品质特性的影响[J].中国食品学报, 2016, 16(8): 140-148. DOI:10.16429/j.1009-7848.2016.08.020.
[24] 王玉涛, 王世锋, 刘孟洲, 等. 应用HS-SPME和GC/MS技术检测舍饲合作猪肌肉中的风味物质[J]. 核农学报, 2008, 22(5): 654-660.
[25] 贡慧, 杨震, 史智佳, 等. 不同熬煮时间对北京酱牛肉挥发性风味成分的影响[J]. 食品科学, 2017, 38(10): 183-190. DOI:10.7506/spkx1002-6630-201710031.
[26] 文志勇, 孙宝国, 梁梦兰, 等. 脂质氧化产生香味物质[J]. 中国油脂,2004, 29(9): 41-44. DOI:10.3321/j.issn:1003-7969.2004.09.012.
[27] RODE H R, FEHRMAN C E, BLAIR A D, et al. Evaluation of the significance of the Maillard browning reaction caramelization, and flavor development in beef steaks[J]. Meat Science, 2016, 112(5): 152-156. DOI:10.1016/j.meatsci.2015.08.114.
[28] HO C W, WAN A W, MASKAT M Y, et al. Changes in volatile compounds of palm sap (Arenga pinnata) during the heating process for production of palm sugar[J]. Food Chemistry, 2007, 102(4): 1156-1162. DOI:10.1016/j.foodchem.2006.07.004.
[29] 王勇, 纪聪利, 黄健花, 等. 玉米胚芽水分含量对其油脂品质的影响[J].中国油脂, 2018, 43(5): 152-155.
[30] 唐春红, 陈旭华, 张春晖, 等. 不同卤制方法对鸡腿肉中挥发性风味化合物的影响[J]. 食品科学, 2014, 35(14): 123-129. DOI:10.7506/spkx1002-6630-201414024.
[31] 顾赛麒, 王锡昌, 陶宁萍, 等. 顶空固相微萃取-气质联用及电子鼻技术检测中华绒螯蟹不同可食部位中的香气成分[J]. 食品科学, 2013,34(18): 239-244. DOI:10.7506/spkx1002-6630-201318049.
[32] BELITZ H D, GROSCH W, SCHIEBERLE P. 食品化学[M]. 石阶平,霍军生, 译. 北京: 中国农业大学出版社, 2008: 297-298.
[33] GEMERT L J. 化合物香味阈值汇编[M]. 刘强, 冒德寿, 汤峨, 译.北京: 科学出版社, 2015.
[34] GIRIA, OSAKO K, OHSHIMA T. Identification and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fish species and meat washing[J]. Food Chemistry, 2010, 120(2): 621-631.DOI:10.1016/j.foodchem.2009.10.036.
[35] 孙宝国. 食用调香术[M]. 2版. 北京: 化学工业出版社, 2010.
[36] SCHIFFMAN S S, BENNETT J L, RAYMER J H. Quantification of odors and odorants from swine operations in North Carolina[J].Agricultural and Forest Meteorology, 2001, 108(3): 213-240.DOI:10.1016/s0168-1923(01)00239-8.
[37] WEI C Q, LIU W Y, XI W P, et al. Comparison of volatile compounds of hot-pressed, cold-pressed and solvent-extracted flaxseed oils analyzed by SPME-GC/MS combined with electronic nose: major volatiles can be used as markers to distinguish differently processed oils[J]. European Journal of Lipid Science and Technology, 2015,117(3): 320-330. DOI:10.1002/ejlt.201400244.
[38] 刘登勇, 王逍, 吴金城, 等. 肉制品烟熏风味物质研究进展[J]. 肉类研究, 2018, 32(10): 53-60. DOI:10.7506/rlyj1001-8123-201810010.
[39] 马建荣, 潘腾, 王振宇, 等. 传统炭烤羊腿特征挥发性风味物质分析[J]. 肉类研究, 2019, 33(1): 50-54. DOI:10.7506/rlyj1001-8123-20181211-228.