带鱼(Trichiurus japonicus)广泛分布于大西洋、西太平洋、印度洋以及我国渤海至南海海域,是一种重要的海洋经济鱼类[1]。带鱼鱼肉富含蛋白质、脂肪、维生素以及多种矿物质,为高脂鱼类,其中二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的含量明显高于淡水鱼类,具有较高的营养价值。且带鱼肉质绵软细腻,味道鲜美,鱼身无细刺,同样也适用于小孩和老人食用,因此深受广大消费者欢迎[2]。在我国,油炸是带鱼的一种常用烹饪方式,油炸带鱼口感香脆不茹连,鱼肉外焦里嫩,常出现在中国老百姓的餐桌上。但是传统油炸方式使带鱼中植物油含量高,不利于心血管健康。
空气油炸作为一种新型油炸技术,将样品置于热空气中而不是浸泡在油中,只需极少量由空气循环带起来的小油滴与样品直接接触,从而实现快速加热和脆化,就能获得与传统油炸方式类似的外观、质地、风味和口感[3-5]。此技术相较于传统方式更方便安全且降低了接近80%的含油量,大幅度减少了油炸食品中的热量,在一定程度上有助于解决油炸食品引起的肥胖问题[6]。温度是空气油炸技术的一个重要参数,温度的高低对食品的品质,尤其是食品的营养成分有较大的影响,因此对于不同油炸温度条件下的样品组成成分进行实时监测尤为重要。
快速蒸发离子化质谱(rapid evaporative ionization mass spectrometry,REIMS)是一种新兴技术,使用iKnife装置切入样品组织中,形成气溶胶,再由运输管道进入质谱仪的电离源,在激烈的碰撞表面发生离子化过程[7]。该技术无需任何样品处理,仅需几秒就能完成数据采集和分析,规避了传统质谱技术用时较长的问题,能对样品进行高通量实时监测[8]。在国外,REIMS技术主要用于医疗干预期间组织的鉴定,但最近发现其可应用于食品分析鉴别方面[9-11]。Verplanken等[12]采用REIMS对公猪膻味进行鉴别分析,发现其在母猪、有膻味公猪和无膻味公猪之间具有极强的鉴别能力,从而实现在公猪屠宰期间对胴体的实时鉴定。Song Gongshuai等[13]利用REIMS技术能明显地实时区分三文鱼和虹鳟鱼,为确保三文鱼产品的真实性提供了前线的检测方式。由此可见,REIMS在国内食品领域将具有可观的应用前景。
本研究首先将iKnife的切割输出功率进行优化,然后采用空气油炸方法对带鱼进行处理,基于REIMS技术,对不同油炸温度条件下的带鱼样品进行实时鉴别分析,探究油炸温度对于带鱼脂肪酸和磷脂组成成分的影响。REIMS在国内鲜有报道,本实验旨在介绍一种新型的质谱技术,将其应用于食品领域。
1 材料与方法
1.1 材料与试剂
带鱼 市购;甲醇、乙腈、丙二醇(均为色谱纯)美国Merck公司;亮氨酸脑啡肽 美国Sigma公司;超纯水由Millipore超纯水仪制备。
1.2 仪器与设备
REIMS系统、Xevo G2-XS四极杆飞行时间质谱仪(配有快速蒸发离子源)、REIMS质谱进样接口 美国Waters公司;WSD151 iKnife智能刀 德国Weller公司;Pump11 elite针泵注射进样器 美国Harvard公司;Milliplus 2150超纯水处理系统 美国Millipore公司;KL-J63A空气炸锅 杭州九阳公司。
1.3 方法
1.3.1 样品制备
将带鱼进行内脏清理,并洗净切断备用。置于空气油炸锅中,分别于160、170、180 ℃油炸10 min,经自然冷却后进行检测。
1.3.2 质谱条件
使用iKnife智能刀切割带鱼,形成含有大量离子的气溶胶,经泵驱动,通过PTEE管引入质谱仪中;以丙二醇-亮氨酸脑啡肽混合物为辅助溶剂,经注射泵以0.1 mL/min的流量引入端口,用于清洗杂质、提高信号强度、锁定质量校正;质谱接口内设Kanthal A1灯丝(1.1 Ω,3 V,500 ℃)用作辅助碰撞电离,离子碰撞后进入质谱仪StepWave装置;质谱仪扫描时间为1 s;质量扫描范围m/z 50~1 200;每个样品切割5 次,以作平行;所有数据均以负电离模式收集。
1.4 数据分析
将质谱图经MassLynx 4.1进行峰匹配、滤噪、中心化和标准物质校准处理,结果保存为Excel格式。根据质谱数据得到主要离子峰的质荷比和峰面积信息,结合Lipid MS Predictor脂质分子数据库比对确定或推测脂质的结构信息。采用峰面积归一化方法计算所得脂质的相对含量。平均值、标准差和显著性水平均采用SPSS 21.0软件计算,显著性分析的置信区间为95%。采用SIMCA 14.1软件将磷脂数据进一步处理,得到主成分分析(principal component analysis,PCA)散点图。
2 结果与分析
2.1 iKnife切割输出功率的优化
REIMS技术的原理是基于电刀在鱼肉表面切割产生气溶胶泵入质谱仪进行鉴定分析,因此电刀的切割输出功率对于组织表面脂质离子化的效率有重要影响。本研究中以特征脂质离子峰m/z 255.230 0、281.247 5、327.237 5、744.554 9、790.539 2的信噪比为指标优化输出功率,结果见图1。
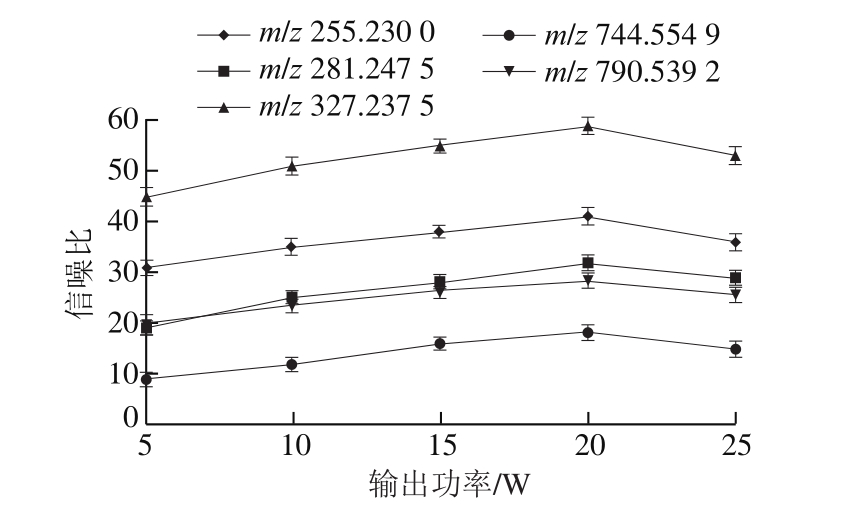
图1 输出功率对特征脂质离子信噪比的影响
Fig. 1 Effect of output power on the signal-to-noise ratio of representative lipid ions
一般来说,当功率较低时,信噪比较小,可能是由于能量偏低,带鱼鱼肉表面化合物离子化不充分;当功率过高时,信噪比减小,主要是能量过高导致较多的基质化合物产生,从而干扰目标离子。本研究中分别以5、10、15、20、25 W的输出功率切割未经油炸的带鱼原料,由图1可知,在5~20 W的范围内,信噪比随输出功率的增加而增大,在20 W时,达到最大值,随后则呈下降趋势。因此,本研究中设置电刀的切割输出功率为20 W。
2.2 不同油炸温度下脂肪酸组成分析
REIMS技术通过手持的iKnife对样品表面离子化,无需任何样品前处理,能够实时获得质谱轮廓图。经MassLynx 4.1去背景、中心化、校准等得到质荷比和相应的峰面积,并结合Lipid MS Predictor比对获得脂质的结构。Yu Xina等[14]采用亲水性相互作用液相色谱-质谱联用分析甲鱼的脂质组学,总耗时大于1 h,包括大于40 min的样品前处理和18 min的液相色谱梯度洗脱时间,整体步骤较为复杂。而REIMS技术数据采集时间为3 s左右,扫描时间大约为1 s,整个测定时间大致4 s,体现了快速、实时、高效的优点。
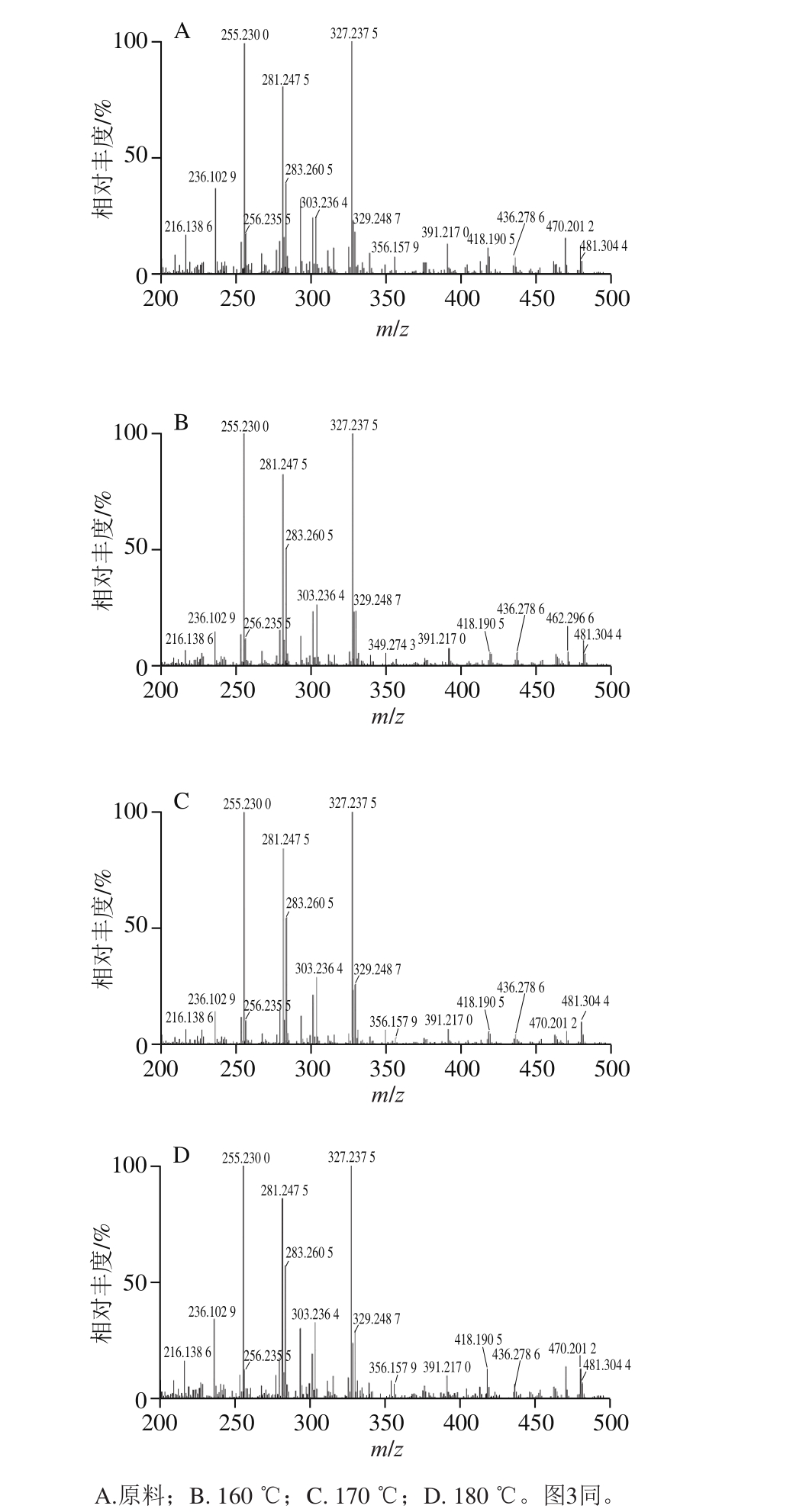
图2 iKnife-REIMS联用技术实时获取带鱼脂肪酸质谱图
Fig. 2 Mass spectra of fatty acids in lipids from hairtail using iKnife-REIMS
表1 未经油炸和不同空气油炸温度下带鱼脂肪酸组成和相对含量
Table 1 Composition and relative contents of fatty acids in lipids from hairtail air fried and not air fried at different temperatures

注:同行肩标小写字母不同表示差异显著(P<0.05);—.未检出。下表同。
相对含量/%原料 160 ℃ 170 ℃ 180 ℃1 227.209 2 C14:0 0.42±0.02c0.58±0.07b0.74±0.04a0.80±0.04a 2 253.218 3 C16:1 2.06±0.09a1.79±0.09b1.74±0.02b1.61±0.04c 3 255.230 0 C16:0 18.40±0.38d19.26±0.26c19.97±0.19b20.51±0.15a 4 279.238 2 C18:2 1.13±0.05d1.26±0.02c1.34±0.05b1.43±0.05a 5 281.247 5 C18:1 16.72±0.15c17.48±0.12b17.51±0.11b17.72±0.18a 6 283.260 5 C18:0 5.60±0.10d8.18±0.09c8.50±0.15b 8.9±0.09a 7 301.217 4 C20:5 5.81±0.13a5.68±0.12ab5.57±0.18b5.09±0.06c 8 303.236 4 C20:4 5.83±0.07c6.32±0.07b6.43±0.09b6.70±0.10a 9 305.247 8 C20:3 0.49±0.06a0.48±0.03a0.27±0.02b —10 307.269 4 C20:2 0.14±0.02a0.07±0.01b — —11 327.237 5 C22:6 38.91±0.76a33.43±0.08b31.80±0.58c30.74±0.30d 12 329.248 7 C22:5 4.21±0.09c4.71±0.09b4.88±0.13a4.99±0.09a 13 331.266 2 C22:4 0.09±0.01d0.32±0.02c0.51±0.03b0.56±0.03a 14 349.279 5 C22:2(Ep) 0.19±0.02d0.44±0.03c0.74±0.03b0.95±0.04a SFA 24.42±0.14d28.02±0.17c29.21±0.20b30.21±0.15a MUFA 18.78±0.21b19.27±0.12a19.25±0.18a19.33±0.14a EPA+DHA 44.72±0.23a39.11±0.12b37.37±0.15c35.83±0.17d PUFA 56.80±0.21a52.71±0.20b51.54±0.18c50.46±0.16d编号 m/z 结构解析
如图2所示,质荷比范围为m/z 200~500,各个峰分离度较好,信噪比较高几乎看不到基质峰。通过对该范围内的脂肪酸鉴定和积分,得到不同油炸温度下和原料带鱼的脂肪酸组成及其相对含量,见表1。在4 种带鱼样品共检测出14 种脂肪酸,包括饱和脂肪酸(saturated fatty acids,SFA)3 种,单不饱和脂肪酸(monounsaturated fatty acids,MUFA)2 种,其余均为多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)。其中相对含量最高的为DHA,原料、160、170 ℃和180 ℃油炸带鱼中的DHA相对含量分别为38.91%、33.43%、31.80%、30.74%;可以明显看到,原料的DHA相对含量最高,随着油炸温度的升高,其相对含量逐渐降低,4 组样品的DHA相对含量呈显著差异(P<0.05);主要由于高温使PUFA氧化或者裂解[15]。EPA具有同样趋势,相对含量从原来的5.81%最低降至5.09%(180 ℃油炸)。这2 种PUFA是人体的必需脂肪酸,DHA俗称“脑黄金”,EPA则被称为“血管清道夫”,分别对大脑发育和心血管健康具有重要生理作用[16-17]。李楠楠等[18]提出以EPA和DHA的保存率为指标研究油炸对鱼类营养价值的影响。经180 ℃空气油炸后,带鱼中EPA和DHA的保存率为80.12%;Gladyshav等[19-20]在相同温度下对大马哈鱼进行普通油炸处理后,EPA和DHA的保存率为74.94%,相同条件下鳟鱼的EPA和DHA平均保存率为78.77%;由此可见,空气油炸下EPA和DHA的保存率略大于普通油炸,说明空气油炸对于PUFA的氧化影响稍小于普通油炸。棕榈酸(C16:0)是4 种样品中含量第2高的脂肪酸,经过180 ℃油炸的带鱼中棕榈酸相对含量最高(20.51%),与原料(18.40%)呈显著性差异(P<0.05);可能是油炸温度越高,棕榈油酸(C16:1)转成棕榈酸越多。总的来说,SFA含量随油炸温度的升高呈现上升趋势,PUFA与之相反;由于PUFA更易氧化,其转化成MUFA的速率较快,而MUFA转化成SFA的速率较慢,因此会产生MUFA含量增加现象,该结果与宋恭帅等[21]研究的不同贮藏温度下鱼油MUFA含量的变化趋势一致。
2.3 空气油炸温度对磷脂组成成分的影响

图3 iKnife-REIMS联用技术实时获取带鱼磷脂质谱图
Fig. 3 Mass spectra of phospholipids from hairtail using iKnife-REIMS
如图3所示,各个峰的分离度较好。对该范围内的磷脂离子进行降噪和峰提取等处理,经比对共鉴定出32 种磷脂分子,m/z范围为673.481 4~957.549 9,结果见表2。磷脂是生物体内重要的活性物质,不仅是细胞膜的主要成分,而且在改善血液循环、降血脂、细胞识别和提高人体免疫力等方面发挥重要的生理作用[22-23]。磷脂根据极性头部基团的不同分为磷脂酰乙醇胺(phosphatidyl ethanolamines,PE)、磷脂酰胆碱(phosphatidyl cholines,PC)、磷脂酰肌醇(phosphatidyl inositols,PI)、甘油磷脂酸(phosphatidic acid,PA)和磷脂酰丝氨酸(phosphatidyl serines,PS)等[24]。由表2可知,4 种带鱼样品中相对含量最多的磷脂分子形式为PE和PC,这与邹舟等[25]研究鲢鱼各部位磷脂组分的结果一致。带鱼中信号最强的离子峰为m/z 790.539 2,经鉴定为[PE C40:6-H]-,原料、160、170 ℃和180 ℃中相对含量依次为24.71%、24.31%、23.67%、23.06%,随着油炸温度的升高,相对含量不断降低,不同样品间呈显著性差异(P<0.05);其次为m/z 744.554 9([PE C36:1-H]-),相对含量分别为13.50%、13.70%、14.06%、14.58%,相对含量随油炸温度的升高而提高,最高增加了1.08%。总体来说,升高油炸温度,会使磷脂分子的不饱和度下降,主要是由于高温油炸破坏了一部分的不饱和脂肪酸,使其发生氧化或加氢,从而饱和度提高[26-27]。
表2 未经油炸和不同空气油炸温度下带鱼磷脂组成和相对含量
Table 2 Composition and relative contents of phospholipids in hairtail air fried and not air fried at different temperatures
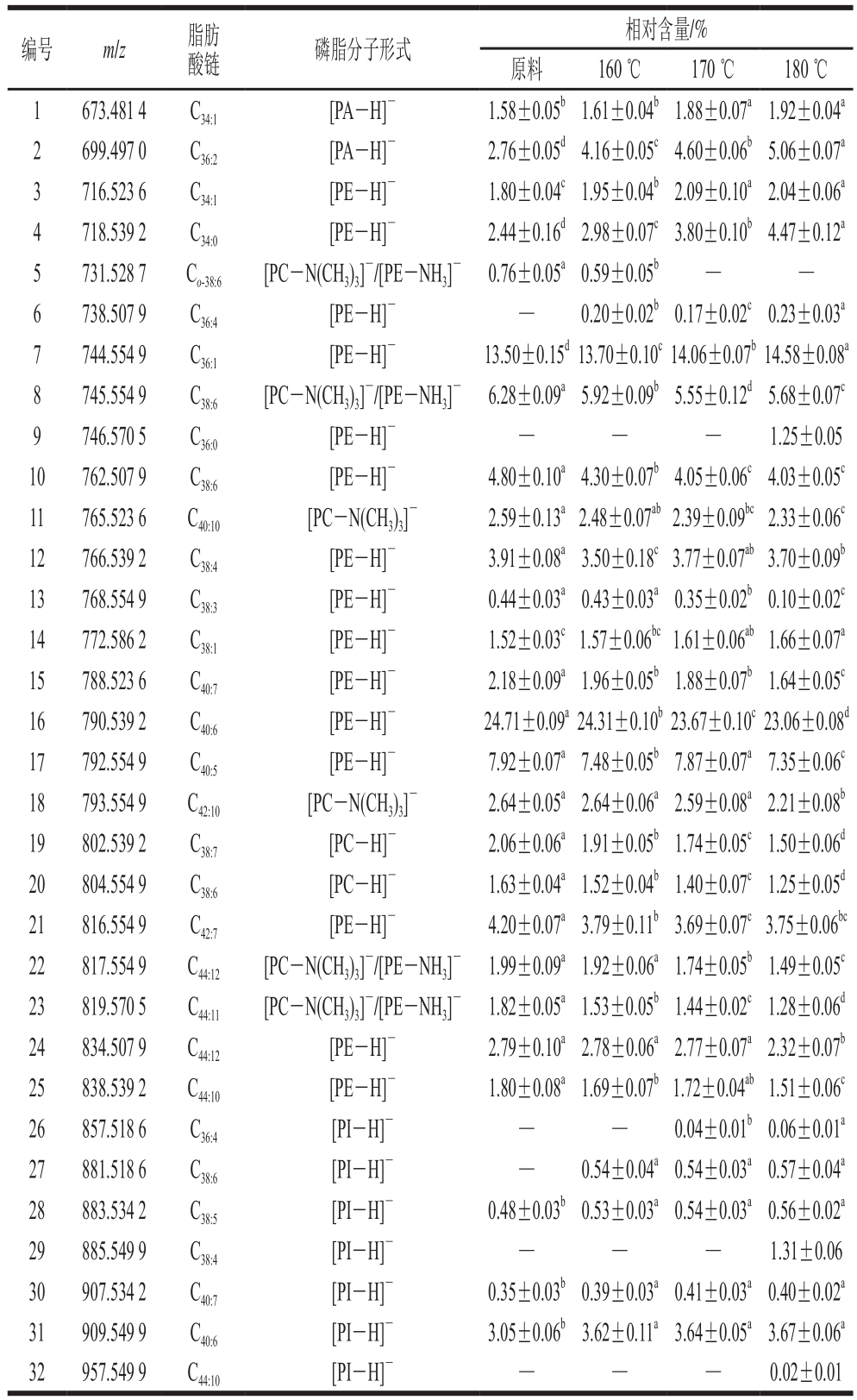
编号 m/z 脂肪酸链 磷脂分子形式 相对含量/%原料 160 ℃ 170 ℃ 180 ℃1 673.481 4 C34:1 [PA-H]- 1.58±0.05b1.61±0.04b1.88±0.07a1.92±0.04a 2 699.497 0 C36:2 [PA-H]- 2.76±0.05d4.16±0.05c4.60±0.06b5.06±0.07a 3 716.523 6 C34:1 [PE-H]- 1.80±0.04c1.95±0.04b2.09±0.10a2.04±0.06a 4 718.539 2 C34:0 [PE-H]- 2.44±0.16d2.98±0.07c3.80±0.10b4.47±0.12a 5 731.528 7 Co-38:6 [PC-N(CH3)3]-/[PE-NH3]- 0.76±0.05a0.59±0.05b — —6 738.507 9 C36:4 [PE-H]- — 0.20±0.02b0.17±0.02c0.23±0.03a 7 744.554 9 C36:1 [PE-H]- 13.50±0.15d13.70±0.10c14.06±0.07b14.58±0.08a 8 745.554 9 C38:6 [PC-N(CH3)3]-/[PE-NH3]- 6.28±0.09a5.92±0.09b5.55±0.12d5.68±0.07c 9 746.570 5 C36:0 [PE-H]- — — — 1.25±0.05 10 762.507 9 C38:6 [PE-H]- 4.80±0.10a4.30±0.07b4.05±0.06c4.03±0.05c 11 765.523 6 C40:10 [PC-N(CH3)3]- 2.59±0.13a2.48±0.07ab2.39±0.09bc2.33±0.06c 12 766.539 2 C38:4 [PE-H]- 3.91±0.08a3.50±0.18c3.77±0.07ab3.70±0.09b 13 768.554 9 C38:3 [PE-H]- 0.44±0.03a0.43±0.03a0.35±0.02b0.10±0.02c 14 772.586 2 C38:1 [PE-H]- 1.52±0.03c1.57±0.06bc1.61±0.06ab1.66±0.07a 15 788.523 6 C40:7 [PE-H]- 2.18±0.09a1.96±0.05b1.88±0.07b1.64±0.05c 16 790.539 2 C40:6 [PE-H]- 24.71±0.09a24.31±0.10b23.67±0.10c23.06±0.08d 17 792.554 9 C40:5 [PE-H]- 7.92±0.07a7.48±0.05b7.87±0.07a7.35±0.06c 18 793.554 9 C42:10 [PC-N(CH3)3]- 2.64±0.05a2.64±0.06a2.59±0.08a2.21±0.08b 19 802.539 2 C38:7 [PC-H]- 2.06±0.06a1.91±0.05b1.74±0.05c1.50±0.06d 20 804.554 9 C38:6 [PC-H]- 1.63±0.04a1.52±0.04b1.40±0.07c1.25±0.05d 21 816.554 9 C42:7 [PE-H]- 4.20±0.07a3.79±0.11b3.69±0.07c3.75±0.06bc 22 817.554 9 C44:12 [PC-N(CH3)3]-/[PE-NH3]- 1.99±0.09a1.92±0.06a1.74±0.05b1.49±0.05c 23 819.570 5 C44:11 [PC-N(CH3)3]-/[PE-NH3]- 1.82±0.05a1.53±0.05b1.44±0.02c1.28±0.06d 24 834.507 9 C44:12 [PE-H]- 2.79±0.10a2.78±0.06a2.77±0.07a2.32±0.07b 25 838.539 2 C44:10 [PE-H]- 1.80±0.08a1.69±0.07b1.72±0.04ab1.51±0.06c 26 857.518 6 C36:4 [PI-H]- — — 0.04±0.01b0.06±0.01a 27 881.518 6 C38:6 [PI-H]- — 0.54±0.04a0.54±0.03a0.57±0.04a 28 883.534 2 C38:5 [PI-H]- 0.48±0.03b0.53±0.03a0.54±0.03a0.56±0.02a 29 885.549 9 C38:4 [PI-H]- — — — 1.31±0.06 30 907.534 2 C40:7 [PI-H]- 0.35±0.03b0.39±0.03a0.41±0.03a0.40±0.02a 31 909.549 9 C40:6 [PI-H]- 3.05±0.06b3.62±0.11a3.64±0.05a3.67±0.06a 32 957.549 9 C44:10 [PI-H]- — — — 0.02±0.01
2.4 PCA结果
PCA是将n维特征映射到k维上,从而实现多个指标的数据转换和降维,并对k维的特征向量进行线性变换,转换后的变量则称为主成分[28-29]。本研究采用SIMCA 14.1软件对原料和不同空气油炸温度下的样品中磷脂组成成分(32 种),共计20 个观察组进行PCA,结果如图4所示。PC1贡献率较高,为64.3%,说明PC1能解释64.3%的原有变量;PC2的贡献率为14.3%;2 个主成分的累计贡献率为78.6%,说明这2 个主成分能较好地反映原料和不同空气油炸温度下磷脂组成的特征信号[30-31]。由图4可知,20 个带鱼样品信息被分成4 个集群,分别为原料、160 、170、180 ℃油炸。未油炸的带鱼能和其他3 个油炸样品明显地区分,其中和180 ℃油炸样品区别最大。经REIMS技术测得的磷脂分子数据经显著性分析后,也可明显地看到4 组样品间一些特征离子峰具有显著性差异(P<0.05),通过PCA更好地验证了之前的分析结果。由图5可知,在置信区间为95%的情况下,PC1中m/z 718.539 2、699.497 0、744.554 9三个离子所占的比重最大,说明这3 个变量对于形成PC1的贡献最大,结合表2显著性分析表明这3 个离子在区分样品中起到重要作用。
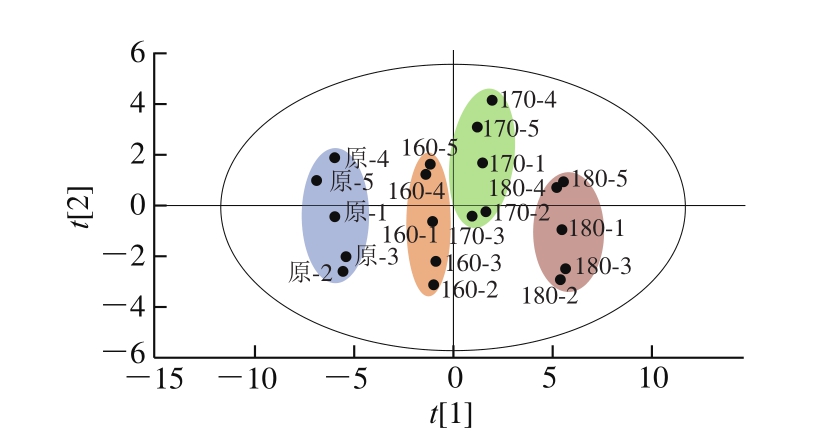
图4 未经油炸和不同空气油炸温度下带鱼样品PCA散点图
Fig. 4 PCA scatter plot for hairtail air fried and not air fried at different temperatures
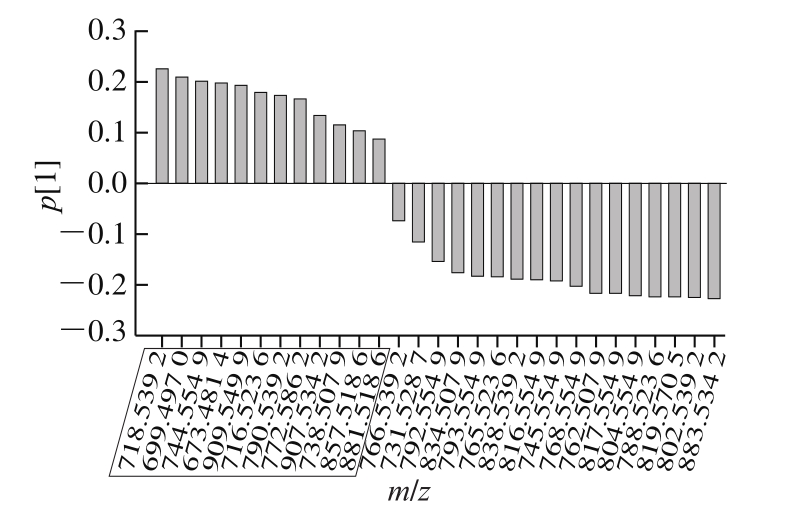
图5 PC1的载荷柱状图
Fig. 5 Loadings bar plot of PC1
2.5 方法验证
本研究选取m/z 255.230 0、281.247 5、327.237 5、744.554 9、790.539 2为特征离子,以未经油炸的带鱼作为代表样品对REIMS检测方法进行验证,结果如表3所示。该方法的精密度通过日内和日间精密度衡量,使用电刀在相同的输出功率下平行切割带鱼鱼肉表面5 次,分别计算特征离子相对含量,并得到平均值和日内精密度;在相同条件下连续平行测试3 d,获得特征离子相对含量的平均值和日间精密度。由表3可知,该方法日内精密度为2.23%~4.06%,日间精密度为3.04%~6.18%,结果显示此方法精密度和重复性较高。
表3 iKnife-REIMS联用技术检测方法验证
Table 3Validation of iKnife-REIMS
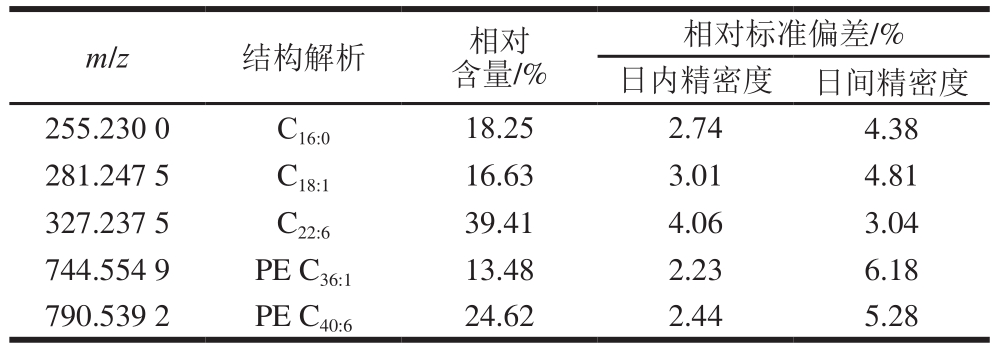
相对标准偏差/%日内精密度 日间精密度255.230 0 C16:0 18.25 2.74 4.38 281.247 5 C18:1 16.63 3.01 4.81 327.237 5 C22:6 39.41 4.06 3.04 744.554 9 PE C36:1 13.48 2.23 6.18 790.539 2 PE C40:6 24.62 2.44 5.28 m/z 结构解析 相对含量/%
3 结 论
本研究基于iKnife-REIMS技术获得未经油炸和不同空气油炸温度下带鱼样品的实时脂质组成。在获得最佳电刀输出功率20 W的基础上,探究空气油炸温度对脂肪酸和磷脂含量的影响,成功检测出14 种脂肪酸和32 种磷脂分子形式。其中相对含量最高的脂肪酸为DHA,相对含量最多的磷脂分子形式为PE和PC,信号最强的磷脂离子峰为m/z 790.539 2。总体来说,脂质分子的饱和度随着油炸温度的升高而提高。将20 组样品进行PCA,得到PC1和PC2的累计贡献率为78.6%,并获得4 个明显的集群。选取特征离子对iKnife-REIMS检测方法进行验证,结果显示此方法精密度和重复性较好。本研究采用的新型质谱检测技术具有快速、高效和实时等优点,在海洋食品等领域具有广泛前景。
[1] 胡翠林, 张洪亮, 张亚洲, 等. 带鱼保护区春秋季鱼类群落特征及与环境因子的关系[J]. 水产学报, 2018, 42(5): 73-82. DOI:10.11964/jfc.20170410787.
[2] 吴燕燕, 陈玉峰, 李来好, 等. 带鱼腌制加工过程理化指标、微生物和生物胺的动态变化及相关性[J]. 水产学报, 2015, 39(10): 1577-1586. DOI:10.11964/jfc.20150309782.
[3] TERUEL M D R, GORDON M, LINARES M B, et al. A comparative study of the characteristics of French fries produced by deep fat frying and air frying[J]. Journal of Food Science, 2015, 80(2): E349-E358.DOI:10.1111/1750-3841.12753.
[4] SANSANO M, JUAN-BORRÁS M, ESCRICHE I, et al. Effect of pretreatments and air-frying, a novel technology, on acrylamide generation in fried potatoes[J]. Journal of Food Science, 2015, 80(5):T1120-T1128. DOI:10.1111/1750-3841.12843.
[5] SHAKER M A. Comparison between traditional deep-fat frying and air-frying for production of healthy fried potato strips[J]. International Food Research Journal, 2015, 22(4): 1557-1563.
[6] HEREDIA A, CASTELLÓ M L, ARGÜELLES A, et al. Evolution of mechanical and optical properties of French fries obtained by hot airfrying[J]. LWT-Food Science and Technology, 2014, 57(2): 755-760.DOI:10.1016/j.lwt.2014.02.038.
[7] BLACK C, CHEVALLIER O P, HAUGHEY S A, et al. A real time metabolomic profiling approach to detecting fish fraud using rapid evaporative ionisation mass spectrometry[J]. Metabolomics, 2017,13(12): 153-165. DOI:10.1007/s11306-017-1291-y.
[8] GOLF O, STRITTMATTER N, KARANCSI T, et al. Rapid evaporative ionization mass spectrometry imaging platform for direct mapping from bulk tissue and bacterial growth media[J]. Analytical Chemistry, 2015, 87(5): 2527-2534. DOI:10.1021/ac5046752.
[9] BALOG J, PERENYI D, GUALLARHOYAS C, et al. Identification of the species of origin for meat products by rapid evaporative ionization mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2016, 64(23): 4793-4800. DOI:10.1021/acs.jafc.6b01041.
[10] LIN Y, WANG H, RAO W, et al. Structural characteristics of dietary fiber (Vigna radiata L. hull) and its inhibitory effect on phospholipid digestion revealed by novel rapid evaporative ionization mass spectrometry based lipidomics[J]. Food Control, 2019, 98(4): 74-81.DOI:10.1016/j.foodcont.2018.11.016.
[11] LIN Y, WANG H, RAO W, et al. Rapid evaporative ionization mass spectrometry-based lipidomics tracking of grass carp(Ctenopharyngodon idellus) during in vitro multiple-stage digestion[J].Journal of Agricultural and Food Chemistry, 2018, 66(24): 6246-6253.DOI:10.1021/acs.jafc.8b01644.
[12] VERPLANKEN K, STEAD S, JANDOVA R, et al. Rapid evaporative ionization mass spectrometry for high-throughput screening in food analysis: the case of boar taint[J]. Talanta, 2017, 169: 30-36.DOI:10.1016/j.talanta.2017.03.056.
[13] SONG G S, ZHANG M N, ZHANG Y Q, et al. In situ method for real-time discriminating salmons and rainbow trout without sample preparation using iKnife and rapid evaporative ionization mass spectrometry based lipidomics[J]. Journal of Agricultural and Food Chemistry, 2019, 67(16): 4679-4688. DOI:10.1021/acs.jafc.9b00751.
[14] YU X N, CHEN K, LI S, et al. Lipidomics differentiation of soft-shelled turtle strains using hydrophilic interaction liquid chromatography and mass spectrometry[J]. Journal of Chromatography B, 2019, 1112: 11-15. DOI:10.1016/j.jchromb.2019.02.025.
[15] 杨铭铎, 邓云, 石长波, 等. 油炸过程与油炸食品品质的动态关系研究[J]. 中国粮油学报, 2006, 21(5): 93-97. DOI:10.3321/j.issn:1003-0174.2006.05.023.
[16] 张蒙娜, 宋恭帅, 彭茜, 等. 精制沙丁鱼油品质及挥发性风味成分分析[J]. 中国油脂, 2018, 43(4): 55-59. DOI:10.3969/j.issn.1003-7969.2018.04.011.
[17] SKIBA G, POLAWSKA E, SOBOL M, et al. Omega-6 and omega-3 fatty acids metabolism pathways in the body of pigs fed diets with different sources of fatty acids[J]. Archives of Animal Nutrition, 2015,69(1): 1-16. DOI:10.1080/1745039x.2014.992173.
[18] 李楠楠, 范志红. 烹调加工对鱼类营养价值的影响[J]. 中国食物与营养, 2011, 17(2): 82-85. DOI:10.3969/j.issn.1006-9577.2011.02.021.
[19] GLADYSHEV M I, SUSHCHIK N N, GUBANENKO G A, et al.Effect of way of cooking on content of essential polyunsaturated fatty acids in muscle tissue of humpback salmon (Oncorhynchus gorbuscha)[J]. Food Chemistry, 2006, 96(3): 446-451. DOI:10.1016/j.foodchem.2005.02.034.
[20] GLADYSHEV M I, SUSHCHIK N N, GUBANENKO G A, et al.Effect of boiling and frying on the content of essential polyunsaturated fatty acids in muscle tissue of four fish species[J]. Food Chemistry,2007, 101(4): 1694-1700. DOI:10.1016/j.foodchem.2006.04.029.
[21] 宋恭帅, 张蒙娜, 彭茜, 等. 不同贮藏温度下鱼油品质的变化[J].食品科学, 2018, 39(21): 244-251. DOI:10.7506/spkx1002-6630-201821036.
[22] 韩迎雪, 林婉玲, 杨少玲, 等. 5 种鲈形目淡水鱼肌肉脂肪酸及磷脂组成的研究[J]. 南方水产科学, 2019, 15(1): 85-92.DOI:10.12131/20180184.
[23] SHEN Q, DAI Z, HUANG Y W, et al. Lipidomic profiling of dried seahorses by hydrophilic interaction chromatography coupled to mass spectrometry[J]. Food Chemistry, 2016, 205: 89-96. DOI:10.1016/j.foodchem.2016.02.151.
[24] 张静. 秋刀鱼内脏甘油三酯、磷脂定性定量分析及磷脂神经保护作用研究[D]. 上海: 上海海洋大学, 2017.
[25] 邹舟, 王琦, 于刚, 等. 鲢鱼各部位磷脂组分及脂肪酸组成分析[J].食品科学, 2014, 35(24): 105-109. DOI:10.7506/spkx1002-6630-201424020.
[26] 季敏, 张剑, 谢凤, 等. 以棕榈油为基础的鱼制品煎炸用油及其氧化稳定性研究[J]. 粮食与油脂, 2016(2): 65-67. DOI:10.3969/j.issn.1008-9578.2016.02.016.
[27] 吕曼丽, 赵新淮. 即食油炸泥鳅的主要化学组成以及质地分析[J]. 食品工业科技, 2015, 36(9): 247-250. DOI:10.13386/j.issn1002-0306.2015.09.045.
[28] SAERENS M, FOUSS F, YEN L, et al. The principal components analysis of a graph, and its relationships to spectral clustering[J].European Conference on Machine Learning, 2004, 32(1): 371-383.
[29] LIU Q, WU J, LIM Z Y, et al. Metabolite profiling of, listeria innocua, for unravelling the inactivation mechanism of electrolysed water by nuclear magnetic resonance spectroscopy[J]. International Journal of Food Microbiology, 2018, 271: 24-32. DOI:10.1016/j.ijfoodmicro.2018.02.014.
[30] WILDE A S, HAUGHEY S A, GALVIN-KING P, et al. The feasibility of applying NIR and FT-IR fingerprinting to detect adulteration in black pepper[J]. Food Control, 2019, 100(6): 1-7.DOI:10.1016/j.foodcont.2018.12.039.
[31] CHEN L, WU J E, LI Z, et al. Metabolomic analysis of energy regulated germination and sprouting of organic mung bean (Vigna radiata) using NMR spectroscopy[J]. Food Chemistry, 2019, 286:87-97. DOI:10.1016/j.foodchem.2019.01.183.