近年来,稀奶油作为食品工业重要的原料,需求量增加迅猛,但国内市场上的稀奶油产品很大程度上依赖于进口。据统计,2005年奶油进口量为0.31万 t,至2016年进口量增至8.19万 t,增加了约26 倍[1],巨大的市场空间及不充分的基础研究促使稀奶油成为近年来乳品工业研究的热点之一。传统的稀奶油生产方式是从新鲜牛乳中分离得到稀奶油,对原料产地有很大的依赖性,这在一定程度上限制了稀奶油工业的发展。再制稀奶油是将乳脂(或氢化植物油脂)、蛋白及乳化剂等配料按一定比例复配后制备得到的水包油乳液,其优势在于可根据应用需求对配方及工艺进行调整,同时也极大地降低了原料的产地依赖性[2]。
乳蛋白因同时具有亲水基团和疏水基团,常作为乳化剂用于再制稀奶油的制备。蛋白分子可吸附在油-水界面上降低界面张力,促进稀奶油体系的形成,随之在界面上形成黏弹性的界面膜阻止脂肪球的聚集和聚结,稳定稀奶油体系[3]。研究发现蛋白的乳化作用受蛋白种类及浓度等多种因素的影响。Gülseren等报道β-乳球蛋白在油-水界面吸附平衡时界面张力较酪蛋白酸钠高,说明其乳化能力较酪蛋白酸钠差[4]。不同蛋白在油-水界面上的吸附也存在一定竞争关系,且竞争关系受蛋白浓度的影响。在酪蛋白酸钠与乳清蛋白共同制备的稀奶油体系中,当蛋白质量分数小于3%时,油-水界面乳清蛋白吸附量较高;而蛋白质量分数大于3%时,界面上酪蛋白吸附量较高[5]。有研究发现蛋白浓度低于形成单层油-水界面膜的临界浓度时,无法形成稳定的水包油乳液;蛋白浓度增加,乳液粒径下降,乳液稳定性改善[6-7]。此外,工艺条件也会对稀奶油的品质产生不同程度的影响。Long Zhao等研究发现较强的灭菌强度(高压蒸汽灭菌)使稀奶油粒径增加,体系网络结构更为致密,稀奶油样品更接近固体[8],增加均质次数稀奶油粒径明显下降,且分布范围变窄[9]。Kováčová等研究发现超高温灭菌可降低稀奶油粒径[10],均质也可降低稀奶油粒径,并可增加稀奶油贮藏稳定性。这些研究表明蛋白和工艺对稀奶油的影响因稀奶油组成及工艺条件的不同而有所不同。
酪蛋白作为牛乳中含量最高的一类蛋白,其功能特性在很大程度上会影响全乳蛋白的应用特性。因此本实验选择胶束酪蛋白浓缩(micelle casein concentrate,MCC)粉及酪蛋白酸钙(calcium caseinate,CaC)粉两种商业酪蛋白产品为研究对象,分析二者对油-水界面张力的影响,比较二者的乳化活性。此后,以无水黄油为乳相,分别以MCC和CaC为蛋白原料制备再制稀奶油,分析两种酪蛋白对再制稀奶油理化性质(粒径、界面蛋白含量、黏度及微流变特性)及稳定性的影响,同时考察灭菌及二次均质后稀奶油理化性质及稳定性的变化情况,分析两种再制稀奶油对工艺的敏感程度。本研究旨在为再制稀奶油的工业化生产提供更多的技术借鉴。
1 材料与方法
1.1 材料与试剂
无水黄油(脂肪质量分数99.9%) 新西兰安佳公司;MCC(蛋白质量分数80.0%) 美国Leprino公司;CaC(蛋白质量分数88.1%) 丹麦Arla公司;单甘酯广州美晨公司。
1.2 仪器与设备
K100界面张力仪 德国Kruss公司;APV-1000均质机 丹麦APV公司;LX-B35L灭菌锅 合肥华泰公司;LS230粒径分析仪 美国Beckman公司;K9860凯氏定氮仪 济南海能公司仪器;DV3T黏度计美国Brookfield公司;Rheolaser Master微流变仪 法国Formulaction公司;LUMiFuge稳定性分析仪 德国LUM公司。
1.3 方法
1.3.1 再制稀奶油的制备流程
将无水黄油加热至70 ℃以上,称取单甘酯溶于无水黄油,使其熔化彻底。称取酪蛋白,在65 ℃左右水浴中搅拌60 min,作为水相。将油相与水相混合,搅拌均匀后定容。样品经一次均质后,于121 ℃、7 min进行灭菌,再于4 MPa进行二次均质。再制稀奶油中脂肪的质量分数为35.5%,单甘酯质量分数为0.4%,酪蛋白质量分数为1.0%或2.0%。
分别取一次均质后、灭菌后及二次均质后的样品进行分析,测定再制稀奶油的理化性质及稳定性。
1.3.2 界面张力测定
利用Wilhelmy吊板法测定蛋白溶液与无水黄油的界面张力,在O'sullivan等报道方法[11]的基础上略作调整。将测量杯中加入15 mL质量分数1.5%蛋白溶液,将铂金吊板部分浸入该液体,加入约50 mL无水黄油后,立即开始界面张力测定,实验在42 ℃下进行,每次测量持续5 000 s。
1.3.3 粒径测定
利用LS230粒径分析仪测定样品的粒径分布以及大小(以表面积平均粒径D3,2表示)。将样品用去离子水稀释10 倍后缓缓滴入样品池,使遮光度处于8%~12%之间。样品折射率和吸收率分别设定为1.460与0.001,分散相折射率设定为1.333。
1.3.4 界面蛋白含量的测定
采用离心分离法测定界面蛋白含量,在Long Zhao等方法[9]的基础上略作调整。称取8.5~10.0 g(精确至0.000 1 g)再制稀奶油样品于50 mL离心管中,4 ℃下离心1 h,转速为10 000 r/min。离心结束后取出下层清液及沉淀,用凯氏定氮法测量其中蛋白含量。按下式计算界面蛋白含量,其中比表面积(specific surface area,SSA)由LS230粒径分析仪测定。

1.3.5 黏度的测定
使用Brookfield DV3T黏度计测定样品黏度,转子型号为SC4-18,测试时间180 s,测量温度25 ℃。
1.3.6 微流变性质的测定
利用Rheolaser Master微流变仪分析样品的微流变性质,在平底瓶中装入约20 mL的样品,旋紧盖子后立即置于测量池中进行测定,在室温条件下测定120 min。用均方根位移(mean square displacement,MSD)(单位时间内粒子运动的面积)表示体系的微流变性质。
1.3.7 稳定性的测定
利用LUMiFuge稳定分析仪测定样品的失稳系数,在Li Xin等方法[12]的基础上略作调整。测试温度25 ℃,离心转速4 000 r/min,光因子1.0,30 s取值一次,测定120 min。
1.4 数据处理与分析
利用Excel 2013软件绘制数据图;利用SPSS 20.0软件中的单因素方差分析方法和T-检验进行显著性分析,当P<0.05时认为在统计学上差异显著。
2 结果与分析
2.1 界面张力分析结果

图1 胶束酪蛋白与酪蛋白酸钙对油-水界面张力的影响
Fig.1 Influence of micelle casein and calcium caseinate on the interfacial tension between oil and water phases
蛋白可吸附在油-水界面上降低界面张力促进稀奶油体系的形成,动态界面张力的变化可反应蛋白的乳化活性[11,13]。如图1所示,MCC和CaC对界面张力的影响无明显差异。MCC与CaC的界面张力分别由(7.95±1.07)、(7.08±0.11)mN/m下降至1.10 mN/m左右(5 000 s),此时酪蛋白在油-水界面的吸附接近平衡状态。MCC中酪蛋白分子多以天然的胶束状态存在[14],CaC制备过程中酪蛋白胶束解离,但因为Ca2+的存在,解离的酪蛋白分子会发生一定程度的聚集[15]。虽然两种酪蛋白的聚集状态不同,但其乳化活性相似,蛋白浓度更高或更低时,两种蛋白对界面张力的影响也无明显差别(数据未给出)。Lazzaro等也报道过相似的结果,不同解离程度的酪蛋白对油-水界面张力的影响类似[16]。研究认为有多种因素可影响油-水界面张力,如油相种类及乳化剂种类等[3],因此实验条件下可能有其他因素对油-水界面张力的影响较酪蛋白的更大。
2.2 粒径分析结果


图2 酪蛋白和工艺对再制稀奶油粒径分布和D3,2的影响
Fig.2 Influence of caseins as well as sterilization and homogenization on the particle size distribution and D3,2 of recombined dairy cream
稀奶油粒径的分布及大小可一定程度上反映蛋白的乳化能力,也可反映稀奶油的稳定性[16]。由图2A可知,一次均质后1.0% MCC再制稀奶油中可见两个分离的分布峰,粒径范围分别约为0.4~1.6、1.6~7.5 μm;2.0%MCC再制稀奶油脂肪球的粒径呈单峰分布,粒径范围约为0.5~7.5 μm。1.0%、2.0% CaC再制稀奶油脂肪球的粒径呈单峰分布,粒径范围约为0.4~9.8 μm,两种添加量下CaC再制稀奶油中脂肪球分散均匀。对比图2A与图2B可看出,1.0% MCC再制稀奶油灭菌后小粒径脂肪球分布峰消失,大粒径分布峰范围变宽,约为1.3~44.0 μm,微观图像上可见较大的脂肪球聚集体;2.0% MCC再制稀奶油粒径分布范围也明显变宽,为0.8~44.0 μm。1.0%、2.0% CaC再制稀奶油脂肪球的粒径分布与灭菌前几乎无差异。二次均质后1.0%、2.0% MCC再制稀奶油粒径分布变窄,粒径范围分别约为0.4~8.9 μm和0.4~10.0 μm,CaC稀奶油粒径范围几乎无明显变化(图2C)。
由图2D可知,一次均质后,MCC再制稀奶油粒径较同添加量的CaC再制稀奶油大,如添加量为1.0%时,MCC再制稀奶油粒径为(2.92±0.09)μm,CaC再制稀奶油粒径为(2.66±0.13)μm,差异明显。灭菌后1.0%、2.0% MCC再制稀奶油D3,2显著增加(P<0.05);而CaC再制稀奶油D3,2无显著变化。MCC再制稀奶油脂肪球粒径的增大与热处理引起的脂肪球聚集有关(图2B),Dickinson等也报道了类似的结果,乳清蛋白制备的乳液热处理后存在脂肪球聚集现象[17]。二次均质后再制MCC稀奶油D3,2显著下降,CaC再制稀奶油D3,2有不同程度的下降,表明此时小粒径脂肪球占比增多,这与Kováčová等报道的结果类似,其研究发现脱脂乳制备的稀奶油经超高温灭菌后再均质脂肪球的粒径也呈现下降趋势[10]。
2.3 界面蛋白含量分析结果

图3 酪蛋白和工艺对再制稀奶油界面蛋白含量的影响
Fig.3 Influence of caseins as well as sterilization and homogenization on the adsorbed protein amount of recombined dairy cream
由图3可知,一次均质后,界面蛋白含量随蛋白添加量的增加而明显增加。添加量由1.0%增至2.0%时,MCC再制稀奶油界面蛋白含量由(6.91±0.30)mg/m2增加至(9.59±1.71)mg/m2;CaC再制稀奶油界面蛋白含量由(3.91±0.84)mg/m2增加至(5.49±0.70)mg/m2。添加量相同时,MCC再制稀奶油界面蛋白含量明显高于CaC再制稀奶油,这可能与两种酪蛋白分子的聚集状态不同有关。Ye Aiqian研究也发现蛋白添加量相同时,胶束酪蛋白制备的乳液界面蛋白含量最高,随着蛋白解离程度的增加,界面蛋白含量会逐渐降低[18],这与本实验结果相似。MCC再制稀奶油灭菌后界面蛋白含量有较大程度增加,与灭菌前样品差异显著(P<0.05)。CaC再制稀奶油界面蛋白含量略有增加。二次均质后,1.0%、2.0% MCC再制稀奶油界面蛋白含量下降,分别为(7.89±0.47)、(17.65±0.86)mg/m2。1.0%、2.0% CaC再制稀奶油界面蛋白含量分别为(3.55±0.35)、(7.22±0.96)mg/m2,1.0% CaC界面蛋白含量略有下降,而2.0% CaC界面蛋白含量无明显变化。界面蛋白含量与蛋白吸附总量及脂肪球的比表面积有关[9],实验条件下两种再制稀奶油灭菌后界面蛋白吸附总量均显著增加(数据未给出),MCC再制稀奶油灭菌后粒径增加,比表面积下降,因而界面蛋白含量有较大程度的增加;而CaC再制稀奶油灭菌后粒径和比表面积变化程度较小,因此CaC界面蛋白含量增加程度较小。二次均质后,脂肪球粒径有不同程度的下降(图2D),界面比表面积增加,界面蛋白吸附总量无显著变化(数据未给出),因而界面蛋白含量有不同程度的下降(2.0% CaC除外)。
2.4 黏度分析结果
由图4可知,一次均质后,2.0% MCC再制稀奶油黏度较1.0% MCC再制稀奶油高,CaC再制稀奶油黏度随添加量的变化趋势与MCC相同。蛋白添加量增加,液相中未吸附蛋白的含量也逐渐增加,有研究报道未吸附蛋白含量的增加可引起稀奶油黏度的增加[19]。灭菌后MCC再制稀奶油黏度显著增加(P<0.05),而CaC再制稀奶油黏度灭菌后无明显变化。MCC再制稀奶油二次均质后黏度显著下降(P<0.05),CaC再制稀奶油黏度在二次均质后无显著变化。Kováčová[10]和Martin-González[20]等发现均质工艺可显著增加乳液的黏度,这与本研究不一致。在一定的压力范围内乳液黏度随均质压力的增加而增加[20],本实验中所采用的均质压力远小于Martin-González等[20]报道所采用的压力,因而可能是均质强度不同引起此差异。
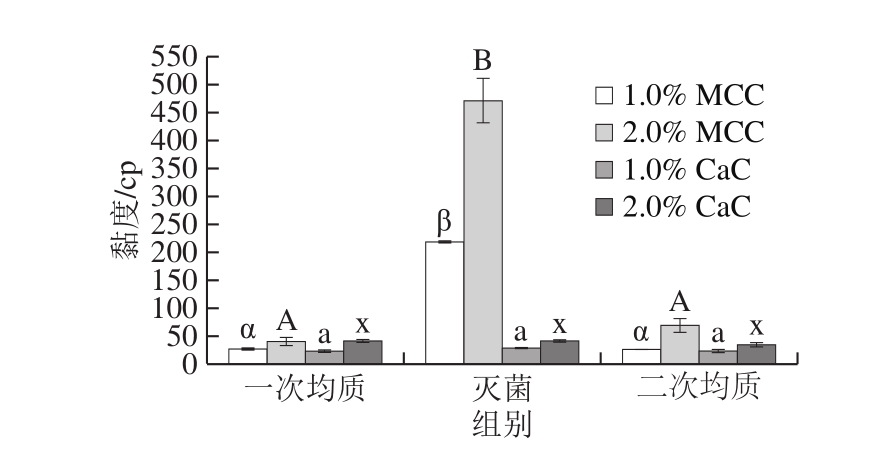
图4 酪蛋白和工艺对再制稀奶油黏度的影响
Fig.4 Influence of caseins as well as sterilization and homogenization on the viscosity of recombined dairy cream
2.5 微流变特性分析结果
微流变技术利用光学技术监控样品中颗粒的布朗运动,从而可对样品的体系结构进行分析。相较于剪切及振荡的测量方式,其优势是测量过程中不会破坏样品的结构[21]。由图5可知,所有再制稀奶油样品的MSD随去相关时间的变化趋势呈非线性,表明样品有一定的黏弹性。此时体系中存在网络结构,颗粒的运动会受到一定的限制[22]。由图5A可知,去相关时间1.0 s时,1.0%、2.0% MCC再制稀奶油MSD分别为(1 193.8±53.5)、(1 343.6±47.0)nm2;1.0%、2.0% CaC的MSD分别为(422.1±19.9)、(456.4±67.7)nm2。由图5B可知,去相关时间1.0 s时,1.0%、2.0% MCC再制稀奶油灭菌后MSD分别为(688.3±62.3)、(538.3±35.4)nm2,较灭菌前明显降低,表明形成了较强的网络结构,CaC再制稀奶油灭菌后MSD变化程度较小。二次均质后,MCC再制稀奶油MSD增加(图5C),添加量为1.0%及2.0%时,MSD分别为(1 236.3±92.9)、(1 053.1±93.7)nm2,CaC再制稀奶油MSD的变化程度仍较小。
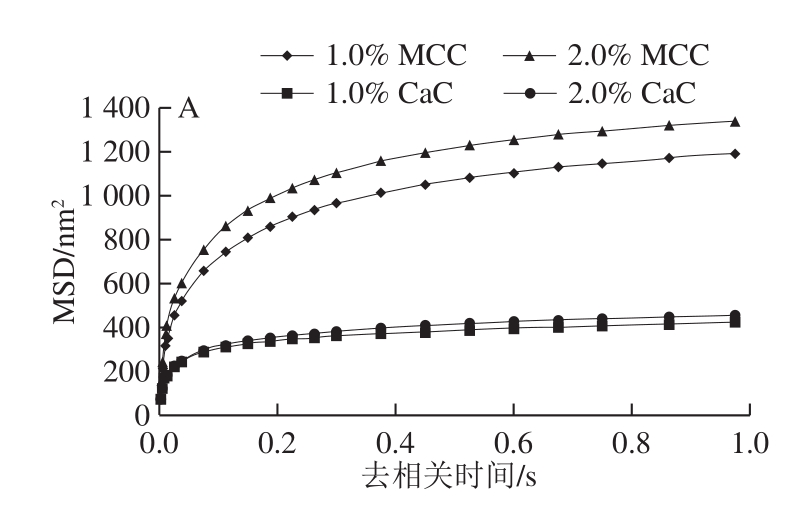
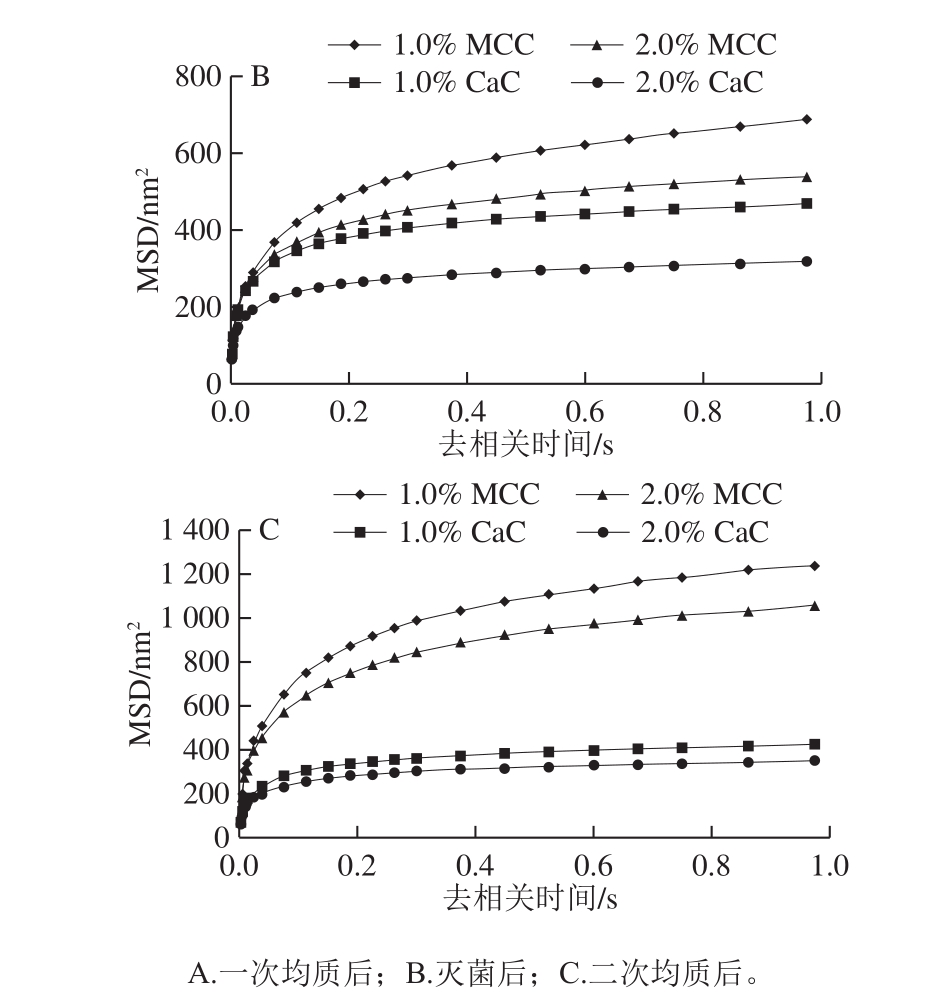
图5 酪蛋白和工艺对再制稀奶油MSD的影响
Fig.5 Influence of caseins as well as sterilization and homogenization on the MSD value of recombined dairy cream
2.6 稳定性分析结果

图6 酪蛋白和工艺对再制稀奶油失稳系数的影响
Fig.6 Influence of caseins as well as sterilization and homogenization on the instability index of recombined dairy cream
稳定性是稀奶油最重要的性质,可直接影响稀奶油产品货架期的长短。本研究利用LUMiFuge稳定性分析仪对再制稀奶油样品的稳定性进行评估,失稳系数越小,体系稳定性越高[12,23]。由图6可以看出,酪蛋白和工艺对再制稀奶油稳定性有较大的影响。一次均质后1.0%、2.0% MCC再制稀奶油失稳系数分别为0.396±0.011、0.032±0.001,表明MCC再制稀奶油稳定性随添加量的增加而明显增加。1.0%、2.0% CaC再制稀奶油失稳系数分别为0.313±0.031、0.375±0.008,表明CaC添加量增加,再制稀奶油稳定性明显下降。1.0%、2.0% MCC再制稀奶油灭菌后失稳系数分别为0.337±0.024、0.198±0.011,与灭菌前的样品相比,分别呈现显著下降和上升趋势(P<0.05)。1.0%与2.0% CaC再制稀奶油灭菌后的失稳系数分别为0.383±0.007、0.329±0.012,与灭菌前相比分别呈现显著上升和下降趋势。二次均质后,1.0% MCC再制稀奶油失稳系数为0.385±0.016,较灭菌后样品相比略有增加;2.0% MCC再制稀奶油的失稳系数显著下降(P<0.05),为0.077±0.030。CaC再制稀奶油二次均质后稳定性变化规律MCC再制稀奶油类似。
3 讨 论
MCC与CaC乳化活性相同,但乳化能力却明显不同,MCC乳化能力较CaC低。在较高的添加量(2.0%)时,MCC再制稀奶油体系中脂肪球才可呈单峰分布,分散均匀。MCC添加量增加,一方面界面蛋白含量增加,界面吸附的蛋白分子排列更为紧密,可能会形成多层的界面膜结构增加脂肪球间的空间位阻[24],增加稳定性;另一方面,再制稀奶油的粒径下降,黏度增加,体系乳析速率也相应下降,因此2.0% MCC再制稀奶油稳定性较好。CaC乳化能力较高,添加量为1.0%时即可形成脂肪球均匀分散的乳液结构,添加量为2.0%时,再制稀奶油稳定性下降,此时液相中有过量的未吸附蛋白(数据未给出),这些蛋白发生聚集并形成沉淀,导致体系稳定性下降。此外,当体系中未吸附酪蛋白颗粒粒径与脂肪球颗粒粒径在特定范围内时,也可引起排斥絮凝使体系稳定性下降[25]。
稀奶油体系的稳定性与乳液粒径、界面蛋白含量及体系结构(黏度及微流变特性)等理化性质有关[26]。工艺过程会导致再制稀奶油这些理化性质不同程度的改变,因而体系稳定性也会随之变化。灭菌过程中可能存在界面蛋白分子间、界面与非吸附蛋白分子间以及非吸附蛋白分子间的交互作用[27]。MCC和CaC再制稀奶油灭菌后界面蛋白吸附总量增加,未吸附蛋白含量下降,表明存在界面蛋白分子与未吸附蛋白分子间的交互作用。此外,MCC再制稀奶油灭菌后粒径显著增加,且存在大颗粒的脂肪球聚集体,表明可能还存在界面蛋白分子间的相互作用。胶束酪蛋白的热稳定性较差[14],非胶束酪蛋白有较好的热稳定性[25],MCC和CaC热稳定性的差异可能是引起两种再制稀奶油灭菌后结构变化不一致的原因。本研究发现,添加量为1.0%和2.0%时,同种蛋白制备的再制稀奶油灭菌后粒径、界面蛋白含量、体系结构变化趋势一致,但稳定性的变化却不同,如灭菌后1.0%、2.0% MCC再制稀奶油的脂肪球粒径增加,界面蛋白含量增加,体系网络结构增强,而二者的稳定性却分别呈现上升和下降的趋势。类似的,二次均质后,添加量为1.0%和2.0%时,同种酪蛋白制备的再制稀奶油理化性质的变化趋势相似,但稳定性的变化却不同。1.0% MCC和1.0% CaC再制稀奶油二次均质后稳定性略有下降,而2.0% MCC与2.0% CaC再制稀奶油稳定性则明显增加。2.0% CaC再制稀奶油在灭菌后及二次均质后稳定性的增加可能与液相未吸附蛋白含量的下降有关,此时沉淀量减少,排斥絮凝程度下降,Srinivasan等也报道过类似结果[28]。1.0%、2.0% MCC再制稀奶油及1.0% CaC再制稀奶油在工艺过程中稳定性的变化与单一理化性质的变化无明显的相关性。
本研究发现,两种不同形式酪蛋白产品的乳化能力不同,MCC乳化能力较CaC低,在低添加量时(1.0%)无法形成脂肪球均匀分散的乳液结构;较高添加量(2.0%)时,MCC再制稀奶油的乳析稳定性最好。MCC和CaC再制稀奶油对灭菌工艺敏感性不同,MCC再制稀奶油对灭菌工艺较敏感,灭菌后2.0% MCC再制稀奶油的乳析稳定性有较大程度的下降,因此以MCC为原料制备再制稀奶油时,可采用较低强度的灭菌工艺。
[1]豆明.中国奶业统计资料2017[M].北京: 荷斯坦杂志社, 2017: 32.
[2]ZHOU X, CHEN L, HAN J, et al.Stability and physical properties of recombined dairy cream: effects of soybean lecithin[J].International Journal of Food Properties, 2016, 20(10): 2223-2233.DOI:10.1080/10942912.2016.1233434.
[3]GOMES A, COSTA A L R, CUNHA R L.Impact of oil type and WPI/Tween 80 ratio at the oil-water interface: adsorption,interfacial rheology and emulsion features[J].Colloids and Surfaces B-Biointerfaces, 2018, 164: 272-280.DOI:10.1016/j.colsurfb.2018.01.032.
[4]GÜLSEREN İ, CORREDIG M.Interactions at the interface between hydrophobic and hydrophilic emulsifiers: polyglycerol polyricinoleate(PGPR) and milk proteins, studied by drop shape tensiometry[J].Food Hydrocolloids, 2012, 29(1): 193-198.DOI:10.1016/j.foodhyd.2012.03.010.
[5]YE A.Interfacial composition and stability of emulsions made with mixtures of commercial sodium caseinate and whey protein concentrate[J].Food Chemistry, 2008, 110(4): 946-952.DOI:10.1016/j.foodchem.2008.02.091.
[6]DICKINSON E.Caseins in emulsions interfacial properties and interactions[J].International Dairy Journal, 1999, 9(3/4/5/6): 305-312.DOI:10.1016/S0958-6946(99)00079-5.
[7]AMINE C, DREHER J, HELGASON T, et al.Investigation of emulsifying properties and emulsion stability of plant and milk proteins using interfacial tension and interfacial elasticity[J].Food Hydrocolloids,2014, 39: 180-186.DOI:10.1016/j.foodhyd.2014.01.001.
[8]LONG Zhao, ZHAO Mouming, SUN-WATERHOUSE D, et al.Effects of sterilization conditions and milk protein composition on the rheological and whipping properties of whipping cream[J].Food Hydrocolloids, 2016, 52: 11-18.DOI:10.1016/j.foodhyd.2015.06.015.
[9]LONG Zhao, ZHAO Mouming, ZHAO Qiangzhong, et al.Effect of homogenisation and storage time on surface and rheology properties of whipping cream[J].Food Chemistry, 2012, 131(3): 748-753.DOI:10.1016/j.foodchem.2011.09.028.
[10]KOVÁČOVÁ R, ŠTĚTINA J, ČURDA L.Influence of processing and κ-carrageenan on properties of whipping cream[J].Journal of Food Engineering, 2010, 99(4): 471-478.DOI:10.1016/j.jfoodeng.2010.02.010.
[11]O'SULLIVAN J, ARELLANO M, PICHOT R, et al.The effect of ultrasound treatment on the structural, physical and emulsifying properties of dairy proteins[J].Food Hydrocolloids, 2014, 42: 386-396.DOI:10.1016/j.foodhyd.2014.05.011.
[12]LI Xin, WANG Xu, XU Duoxia, et al.Enhancing physicochemical properties of emulsions by heteroaggregation of oppositely charged lactoferrin coated lutein droplets and whey protein isolate coated DHA droplets[J].Food Chemistry, 2018, 239: 75-85.DOI:10.1016/j.foodchem.2017.06.078.
[13]JIANG J, JIN Y, LIANG X, et al.Synergetic interfacial adsorption of protein and low-molecular-weight emulsifiers in aerated emulsions[J].Food Hydrocolloids, 2018, 81: 15-22.DOI:10.1016/j.foodhyd.2018.02.038.
[14]SAUER A, MORARU C I.Heat stability of micellar casein concentrates as affected by temperature and pH[J].Journal of Dairy Science, 2012, 95(11): 6339-6350.DOI:10.3168/jds.2012-5706.
[15]SRINIVASAN M, HARJINDER S, MUNRO P A.Adsorption behaviour of sodium and calcium caseinates in oil-in-water emulsions[J].International Dairy Journal, 1999, 9(3): 337-341.DOI:10.1016/S0958-6946(99)00084-9.
[16]LAZZARO F, SAINT-JALMES A, VIOLLEAU F, et al.Gradual disaggregation of the casein micelle improves its emulsifying capacity and decreases the stability of dairy emulsions[J].Food Hydrocolloids,2017, 63: 189-200.DOI:10.1016/j.foodhyd.2016.08.037.
[17]DICKINSON E, PARKINSON E L.Heat-induced aggregation of milk protein-stabilized emulsions: sensitivity to processing and composition[J].International Dairy Journal, 2004, 14(7): 635-645.DOI:10.1016/j.idairyj.2003.12.005.
[18]YE Aiqian.Functional properties of milk protein concentrates:emulsifying properties, adsorption and stability of emulsions[J].International Dairy Journal, 2011, 21(1): 14-20.DOI:10.1016/j.idairyj.2010.07.005.
[19]DAW E, HARTEL R W.Fat destabilization and melt-down of ice creams with increased protein content[J].International Dairy Journal,2015, 43: 33-41.DOI:10.1016/j.idairyj.2014.12.001.
[20]MARTIN-GONZÁLEZ M F, ROACH A, HARTE F.Rheological properties of corn oil emulsions stabilized by commercial micellar casein and high pressure homogenization[J].LWT-Food Science and Technology, 2009, 42(1): 307-311.DOI:10.1016/j.lwt.2008.04.005.
[21]XU D, ZHANG J, CAO Y, et al.Influence of microcrystalline cellulose on the microrheological property and freeze-thaw stability of soybean protein hydrolysate stabilized curcumin emulsion[J].LWT-Food Science and Technology, 2016, 66: 590-597.DOI:10.1016/j.lwt.2015.11.002.
[22]XU D, QI Y, WANG X, et al.The influence of flaxseed gum on the microrheological properties and physicochemical stability of whey protein stabilized β-carotene emulsions[J].Food & Function, 2017,8(1): 415-423.DOI:10.1039/c6fo01357k.
[23]O'SULLIVAN J J, DRAPALA K P, KELLY A L, et al.The use of inline high-shear rotor-stator mixing for preparation of high-solids milk protein-stabilised oil-in-water emulsions with different protein:fat ratios[J].Journal of Food Engineering, 2018, 222: 218-225.DOI:10.1016/j.jfoodeng.2017.10.015.
[24]STEPHEN R E, HIRST R L.Comparison of the concentrationdependent emulsifying properties of protein products containing aggregated and non-aggregated milk protein[J].International Dairy Journal, 1999, 9(10): 693-701.DOI:10.1016/S0958-6946(99)00138-7.
[25]LIANG Y, PATEL H, MATIA-MERINO L, et al.Structure and stability of heat-treated concentrated dairy-protein-stabilised oilin-water emulsions: a stability map characterisation approach[J].Food Hydrocolloids, 2013, 33(2): 297-308.DOI:10.1016/j.foodhyd.2013.03.012.
[26]SRINIVASAN M, SINGH H, MUNRO P A.Creaming stability of oilin-water emulsions formed with sodium and calcium caseinates[J].Journal of Food Science, 2001, 66(3): 441-446.DOI:10.1111/j.1365-2621.2001.tb16126.x.
[27]LIANG Y, MATIA-MERINO L, GILLIES G, et al.The heat stability of milk protein-stabilized oil-in-water emulsions: a review[J].Current Opinion in Colloid & Interface Science, 2017, 28: 63-73.DOI:10.1016/j.cocis.2017.03.007.
[28]SRINIVASAN M, SINGH H, MUNRO P A.Formation and stability of sodium caseinate emulsions: influence of retorting (121 ℃ for 15 min)before or after emulsification[J].Food Hydrocolloids, 2002, 16(2):153-160.DOI:10.1016/S0268-005X(01)00072-8.