百里香精油是百里香经过水蒸气蒸馏所得的油状产品[1-2],主要含有醇、酯、酚、单萜等挥发性成分[3-5]。百里香精油在防腐、提高免疫力、抗癌、抗病毒、止痛、抗氧化、延缓衰老等方面具有极高的药用价值[6-7]。但其自身稳定性较差,极易挥发,且提取的高浓度百里香精油带有一定的刺激性气味,使得百里香精油在食品中的应用受到极大限制[8-11]。对百里香精油进行包埋并控制其释放,是目前解决该问题的主要途径。目前主要的包埋材料有环糊精或食品胶[12-13]。近年来也有新的包埋材料出现,比如以啤酒废酵母为包埋材料制备百里香精油微胶囊,精油与酵母质量比为2∶1,60 ℃下包埋10 h,包埋率为86.71%,该微胶囊可以有效抑制百里香精油的挥发[14]。海藻酸钠复合壳聚糖也被作为百里香精油的包埋材料,该方法可有效缩短包埋时间,精油和包材质量比为1∶2时,pH 3、40 ℃下包埋20 min,包埋率可达到85.17%[15]。虽然这些方法都具有较高的包埋率(85%以上),有一定的抑制百里香精油挥发或者缓慢释放精油的效果,但是大多制备工艺复杂且不能有效控制百里香精油在不同环境中的释放。
多肽水凝胶是以多肽分子为凝胶因子来束缚水分子,从而形成的半固体透明状凝胶[16]。相比于其他传统的包埋材料,具有生物相容性好、易于合成及pH值响应等优点[17-18]。目前多肽水凝胶多用于药物的控制释放。Briuglia等[19]利用可在生理条件下自组装成水凝胶的RADA16多肽包裹亲脂性的药物吲哚洛尔、奎宁和马来酸噻吗洛尔,具有良好的缓释效果。Baral等[20]利用化学改性三肽Boc-AUDA-PhePhe-COOH为包埋材料实现对VB12和万古霉素的缓释作用。Raza等[21]用具有高pH值敏感性的FER-8肽自组装成纳米水凝胶,利用肿瘤部位的pH值敏感性实现对肿瘤药物紫杉醇在小鼠体内的靶向释放,达到抑制肿瘤生长的作用。但是目前利用多肽水凝胶实现对精油类物质进行控释的研究还鲜有报道。
本课题组前期利用N-芴甲氧羰基-L-苯丙氨酸(N-FMoc-L-phenylalanine,Fmoc-F)水凝胶包埋大蒜精油和丁香精油,包埋率都可达90%以上,并且Fmoc-F水凝胶对包埋的精油具有控制释放的作用,但其成胶机制与结构还鲜有研究[22-23]。因此,本实验利用Fmoc-F为水凝胶因子,将具有抑菌效果的百里香精油作为包埋物,利用流变仪、圆二色谱、近红外光谱等技术研究其成胶机制及凝胶特性,通过多肽水凝胶的分解实验、抑菌实验、抗氧化实验研究多肽水凝胶的pH值响应性及其对丁香精油的包埋控释作用、抑菌和抗氧化效果的延长作用,为精油类物质提供新型、廉价、生物相容性好的有效控释包埋材料。
1 材料与方法
1.1 材料与试剂
百里香精油 江西鑫森天然植物油有限公司;大肠杆菌(Escherichia coli) 南京便诊生物科技有限公司;Fmoc-F(纯度>99%) 吉尔生化(上海)有限公司;葡萄糖酸内酯(纯度>99%) 美国Sigma-Aldrich公司;香豆素-3-羧酸(coumarin-3-carboxylic acid,CCA)(纯度>99%) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
FA1004B电子分析天平(精度0.000 1 g) 上海佑科仪器仪表有限公司;SW-CJ-1FD超净工作台 苏净集团宿州安泰空气技术有限公司;UV-1800紫外-可见分光光度计、SM-7800F型扫描电子显微镜、IRTracer-100型傅里叶变换红外光谱仪 日本岛津公司;SHZ-D(III)循环水真空泵 上海精密科学仪器有限公司;G154DWS高压灭菌锅 致微(厦门)仪器有限公司;XMTE-8112水浴锅 北京中兴伟业仪器有限公司;WH-3微型漩涡混合仪 上海沪西分析仪器厂有限公司;DH4000BII电热恒温培养箱 天津市泰斯特仪器有限公司;IS-RDD3恒温振荡器 郑州南北仪器有限公司;PHS-3C型pH计 上海仪电科学仪器有限责任公司;J-815圆二色谱仪 日本Jasco公司;DHR-2型流变仪 美国TA公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;F4600荧光色谱仪 日本日立高新技术公司。
1.3 方法
1.3.1 Fmoc-F水凝胶的制备
在1.5 mL超纯水中加入15 mg Fmoc-F粉末,混匀后加入0.5 mL 0.1 mol/L的NaOH溶液,于40 ℃的恒温水浴锅中加热15 min使固体物质完全溶解,再将3 mg葡糖酸内酯加入混合液中,于超声波清洗机中振荡1 min,静置30 min待其形成水凝胶。
1.3.2 Fmoc-F/百里香精油水凝胶的制备
与1.3.1节方法一致,但加入NaOH溶液后,再加入40 μL的百里香精油。
1.3.3 Fmoc-F水凝胶包埋精油前后的流变学表征
实验选用平行板流变仪测量,平板夹具直径40 mm。按照1.3.1节和1.3.2节方法制备包埋百里香精油前后的Fmoc-F水凝胶,成胶前取适量液体快速滴于流变仪夹具上,夹具边缘加一圈硅油,防止在测试中样品水分蒸发。设置好参数测定样品储能模量(G')和耗能模量(G'')。其中,成胶流变学测定参数:平行板间隙1 mm、应变0.2%、频率1 Hz、温度37 ℃、时间0~10 000 s。动态黏弹性测定参数:测量间隙1 mm、应变0.2%、温度37 ℃、扫描频率0.1~10 Hz。
1.3.4 Fmoc-F水凝胶包埋精油前后的结构表征
1.3.4.1 圆二色光谱测定
用纯水将样品稀释至约0.05 mg/mL。取少量溶液于1 mm石英比色皿并测定。参数:扫描波长190~350 nm,频带宽度2.5 nm,扫描速率50 nm/min,分辨率0.1 nm。
1.3.4.2 傅里叶变换红外光谱测定
将水凝胶干燥粉碎,按样品和KBr质量比1∶100在玛瑙研钵中磨成粉末,其少量粉末压片,采用傅里叶变换红外光谱仪测定,分辨率为4 cm-1,扫描波数400~4 000 cm-1。以KBr压片为背景校零。
1.3.5 扫描电子显微镜观察
将水凝胶样品滴加在硅片上,成胶后用液氮极速冷冻,迅速放入冷冻干燥机中冻干。将干燥的水凝胶样品安放在金属台上,喷金、干燥后用扫描电子显微镜观察样品。
1.3.6 不同pH值环境下Fmoc-F的分解率测定
利用KH2PO4与Na2HPO4配制pH值分别为4.5、5.0、5.5、6.0、6.5、7.0的0.1 mol/L的磷酸盐缓冲液,配制6 份1 mL的Fmoc-F水凝胶,分别加于1.5 mL不同pH值的磷酸盐缓冲液中,置于37 ℃的恒温水浴锅中,并分别在20、40、60、100、140、180 min时取300 μL样品溶液,将其稀释10 倍后于264 nm波长处测定吸光度,实验平行测定3 次后取平均值,再根据公式(1)计算Fmoc-F水凝胶的分解率。
式中:A0为Fmoc-F水凝胶完全溶解于水中,溶液在264 nm波长处的吸光度;A1为Fmoc-F水凝胶在不同pH值溶液中水浴后在264 nm波长处的吸光度。
1.3.7 百里香精油标准曲线的绘制
将100 μL的百里香精油用体积分数95%乙醇溶液稀释1 000 倍后,继续稀释成质量浓度为0.02、0.04、0.06、0.08、0.10 μL/mL的标准液。以体积分数95%的乙醇溶液为背景,测定各标准溶液在274 nm波长处的吸光度,每个质量浓度平行测定3 次后取平均值。以274 nm波长处的吸光度为纵坐标,百里香精油体积分数为横坐标,绘制百里香精油标准曲线,得到线性方程:y=46.256x-0.048 9(R2=0.998 7)。
1.3.8 Fmoc-F水凝胶包埋百里香精油的包埋率测定
用体积分数95%乙醇溶液冲洗包埋40 μL百里香精油的Fmoc-F水凝胶的表面,并将冲洗所得的液体稀释定容到100 mL,再吸取2 mL溶液稀释5 倍后,于276 nm波长处测定吸光度。将吸光度代入线性方程得到Fmoc-F水凝胶表面含油量,再根据公式(2)计算百里香精油的包埋率[22]。
1.3.9 Fmoc-F/百里香精油多肽水凝胶的抑菌实验
将4 个250 mL的锥形瓶编号A、B、C、D,同时制备LB液体培养基和大肠杆菌菌悬液,灭菌备用。在无菌条件下分别向4 个锥形瓶中加入40 mL LB液体培养基和100 μL菌悬液[23]。其中,向A中加入6.12 mL无菌水,作为空白组;向B中加入6 mL Fmoc-F水凝胶和120 μL无菌水;向C中加入6 mL Fmoc-F水凝胶和120 μL百里香精油;向D中加入包埋120 μL百里香精油的6 mL Fmoc-F水凝胶。
将以上4 组锥形瓶用一次性封口皮和牛皮纸包扎,于37 ℃、150 r/min的恒温振荡箱中培养,并分别在0、1、2、4、6、8、10、24 h时测定其在600 nm波长处的吸光度,实验平行3 次,取平均值。
1.3.10 自由基清除率实验
取4 支试管,分别标记A、B、C、D,按照1.3.1节和1.3.2节的方法分别配制1 mL水凝胶备用。试管A、C中都加入1 mL Fmoc-F水凝胶和20 μL百里香精油;B、D试管分别加入1 mL包埋20 μL百里香精油的Fmoc-F水凝胶。
1.3.10.1 DPPH自由基清除实验
称量3 mg 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),用无水乙醇定容至100 mL,配制为75 μmol/L的DPPH溶液备用,在517 nm波长处测得吸光度A0。在装有水凝胶的4 组试管中分别加入1 mL pH 3的盐酸溶液。待A、B两组试管中的胶完全溶解,C、D两组于室温下放置20 h后,将4 组离心(12 000 r/min、30 min)取1 mL上清液加入3 mL DPPH溶液中,充分混匀并避光静置30 min后于517 nm波长处测得吸光度A1。每组实验平行3 次,取平均值。根据公式(3)计算各组的DPPH自由基清除率。
式中:A0为517 nm波长处不加样品的吸光度;A1为517 nm波长处加入样品后的吸光度。
1.3.10.2 ABTS阳离子自由基清除实验
取0.2 mL 2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)储备液(ABTS二铵盐3 mg,超纯水0.735 mL)和0.2 mL K2S2O8储备液(K2S2O8 1 mg,超纯水1.430 mL)混合,黑暗环境下室温放置12 h,用pH 7.4磷酸盐缓冲液将混合液稀释10~20 倍至吸光度为(0.70±0.02),即为ABTS工作液。
取ABTS工作液800 μL于比色皿中,加200 μL无水乙醇稀释混合,于734 nm波长处测得吸光度A0(A0宜在0.70±0.02)。在装有水凝胶的4 组试管中分别加入1 mL无水乙醇,待A、B试管中的胶完全溶解,C、D于室温下放置20 h后,将4 组离心(12 000 r/min、30 min)取200 μL上清液加入800 μL的ABTS溶液中,于734 nm波长处测得吸光度A1。每组实验平行3 次,取平均值。根据公式(4)计算各组的ABTS阳离子自由基清除率。
式中:A0为734 nm波长处不加样品的吸光度;A1为734 nm波长处加入样品后的吸光度。
1.3.10.3 CCA荧光标记法测定羟自由基清除实验
在装有水凝胶的4 组试管中分别加入1 mL超纯水,待A、B两组试管中的胶完全溶解,C、D两组于室温下放置20 h后,将4 组离心(12 000 r/min、30 min),稀释至合适浓度后,分别取20 μL并加入终浓度为6 μmol/L Cu2+、40 μmol/L H2O2的溶液、100 μmol/L pH 7.4的CCA溶液以及pH 7.4的磷酸盐缓冲液制成150 μL混合液,外覆锡箔纸避光7 h。设置激发波长为390 nm,将上述测定液加入到微量比色皿中,测定其在450 nm波长处的荧光值F。每组实验平行3 次,取平均值。根据公式(5)计算各组的羟自由基清除率。
式中:F0为450 nm波长处不加样品的荧光值;F1为450 nm波长处加入样品后的荧光值;F2为450 nm波长处加入样品但不加Cu2+和H2O2时的荧光值(背景)。
1.4 数据处理与分析
所有实验均进行3 次平行,数据以平均值±标准差表示;采用Origin 93软件进行作图。
2 结果与分析
2.1 Fmoc-F水凝胶及Fmoc-F/百里香精油水凝胶的流变学特征
G'和G''是流变性中重要的两个参数,其中G'代表了样品的弹性形变,G''反映样品的黏性形变[24]。当G'大于G''时,弹性形变大于黏性形变,样品呈现一定的刚性;当G'小于G''时,样品呈现流体特性;当G'等于G''时,为凝胶转化点,也就是凝胶点。
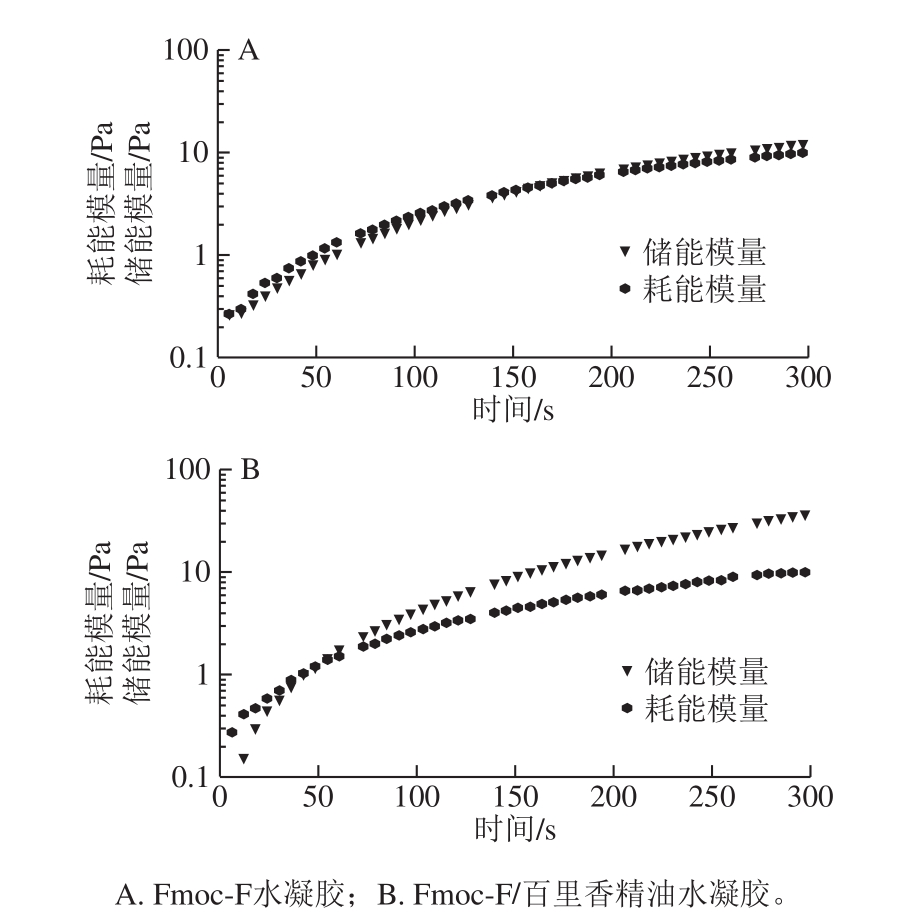
图1 储能模量和耗能模量随时间变化曲线
Fig.1 Time-dependent storage and loss moduli of hydrogels
如图1所示,Fmoc-F和Fmoc-F/百里香精油样品的G'和G''都随时间延长而上升。在160 s之前,Fmoc-F样品的G'小于G'',说明样品呈现流体性质;160 s后,G'大于G'',样品呈现一定的刚性,即成胶[24](图1A)。利用Fmoc-F包埋百里香精油的样品的凝胶点在50 s(图1B)。证明Fmoc-F包埋百里香可以形成凝胶,且百里香精油可以缩短Fmoc-F的成胶时间。这可能是因为百里香精油的强疏水性加速了Fmoc-F分子间的有序聚合,从而加速了胶体的形成。
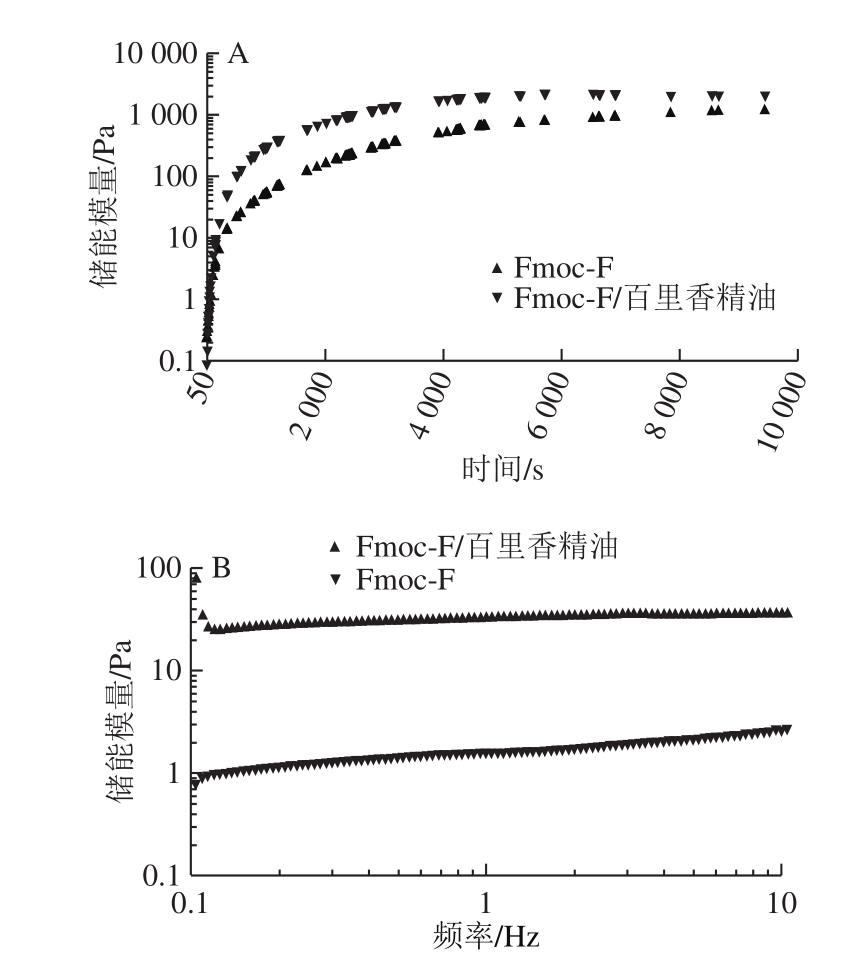
图2 包埋精油前后的Fmoc-F水凝胶成胶过程中储能模量随时间(A)和频率(B)的变化曲线
Fig.2 Comparison of storage modulus during gelation of Fmoc-F hydrogel with and without essential oil encapsulation varied with time (A)and frequency (B)
如图2A所示,Fmoc-F和Fmoc-F/百里香精油样品的G'在4 000 s之前都随时间延长而上升,4 000 s后基本保持不变。在样品成胶以后,Fmoc-F/百里香精油胶体的G'始终大于Fmoc-F胶体,证明Fmoc-F/百里香精油胶体的强度更优于Fmoc-F胶体。
在频率10 Hz以内,Fmoc-F胶体的G'随着频率的变化有缓慢上升,而Fmoc-F/百里香精油的G'在该频率范围内基本不变(图2B)。说明Fmoc-F胶体是一种较为松弛的凝胶[25],而百里香精油的加入填补了Fmoc-F分子间的空隙,使凝胶的结构更为紧密,胶体的强度也更强(图2A)。
2.2 Fmoc-F和Fmoc-F/百里香精油的二级结构分析

图3 Fmoc-F与Fmoc-F/百里香精油水凝胶的圆二色谱
Fig.3 Comparison of circular dichroism spectra of Fmoc-F hydrogels with and without encapsulated essential oil
为研究Fmoc-F和Fmoc-F/百里香精油的二级结构,利用圆二色谱进行检测。结果如图3所示,Fmoc-F在217 nm波长处有一个明显的负峰,证明Fmoc-F很可能是呈β-折叠结构[26],同样,在Fmoc-F/百里香精油的样品中在同一位置有明显的负峰,此外并没有明显的其他峰的出现。因此Fmoc-F和Fmoc-F/百里香精油水凝胶主要的二级结构极可能都是β-折叠结构,并且百里香精油的加入,并不影响Fmoc-F的二级结构。
2.3 傅里叶变换红外光谱研究胶体的分子间作用
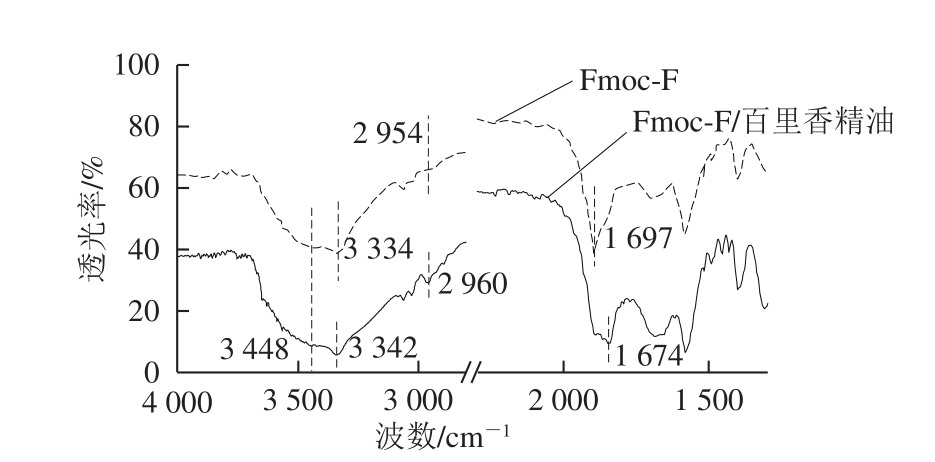
图4 Fmoc-F和Fmoc-F/百里香精油水凝胶的傅里叶变换红外光谱
Fig.4 Intermolecular interactions evaluated by Fourier transform infrared spectroscopy
采用傅里叶变换红外光谱分析水凝胶的特殊基团,结果见图4。Fmoc-F水凝胶在3 448 cm-1处出现酰胺A带的N—H或O—H伸缩振动吸收峰;3 334 cm-1是—NH的伸缩振动峰[27],2 954 cm-1是酰胺B带的N—H或O—H伸缩振动吸收峰,1 697 cm-1是C=O的伸缩振动峰,与文献[28]报道的结果一致。与Fmoc-F水凝胶相比,在Fmoc-F/百里香精油的谱线中,3 448 cm-1处的伸缩振动吸收峰变宽,3 334 cm-1处的伸缩振动吸收峰移动至3 342 cm-1处,2 954 cm-1处的伸缩振动吸收峰移动至2 960 cm-1处,1 697 cm-1处的伸缩振动峰增宽且移动至1 674 cm-1处,这些变化证明分子间氢键的存在[29]。因此推断百里香精油是通过疏水作用力推动,与Fmoc-F分子形成分子间氢键从而形成水凝胶。
2.4 Fmoc-F和Fmoc-F/百里香精油多肽水凝胶的形貌
Fmoc-F水凝胶与包埋百里香精油的Fmoc-F水凝胶,经液氮处理、冷冻干燥后用扫描电子显微镜观察胶体的形貌,结果如图5所示。

Fmoc-F水凝胶为纳米纤维结构(图5A),纤维分布不太均匀。Fmoc-F/百里香精油也具有长的、纤维状的三维空间结构(图5B),纤维分布更均匀。正是因为这种更均匀的纤维网络结构,导致Fmoc-F/百里香精油凝胶比Fmoc-F水凝胶具有更高的G'(图2)。
2.5 Fmoc-F水凝胶在不同pH值下的分解率
Fmoc-F水凝胶具有pH值响应性[23],为研究其在不同pH值下的分解率,将Fmoc-F水凝胶分别放在不同pH值的磷酸盐缓冲液中,在不同的时间测定溶液中Fmoc-F的特征吸收峰(264 nm波长处的吸光度),从而计算其分解率,结果如图6所示。

图6 不同pH值下Fmoc-F水凝胶的分解率
Fig.6 Decomposition rates of Fmoc-F hydrogel at different pH
由图6可知,在pH 7.0的磷酸盐缓冲液中,前20 min内凝胶的分解率仅有3.5%,40~180 min内,其分解率稳定在5.0%左右。在pH 6.5的磷酸盐缓冲液中,前20 min内凝胶分解率为7.8%,之后也稳定在10.0%左右。在pH 6.0的磷酸盐缓冲液中,前100 min内Fmoc-F水凝胶的分解率逐渐提高,由12.7%增长到38.6%。但100 min后凝胶的分解率未出现明显的上升。在pH 5.5的磷酸盐缓冲液中,前20~100 min内,Fmoc-F水凝胶的分解率从21.6%提高到50.9%,100 min后分解率上升不明显。在pH 5.0与pH 4.5的磷酸盐缓冲液中,到100 min时分解率分别达到89.5%和93.6%,在140 min时,完全分解。
结果表明,Fmoc-F水凝胶具有明显的pH值响应特性,其在酸性条件下会分解,在中性条件下可以形成稳定凝胶。这是由于当pH≥6.5时,Fmoc-F分子间通过疏水作用力和氢键结合在一起,其结构稳定,不易分解[30];当pH<6.5时,溶液呈现酸性,且随着pH值的逐渐降低,溶液中正电荷不断增加,Fmoc-F分子带正电荷而使分子间的斥力逐渐增大,当分子间斥力大于分子间的疏水作用力时,凝胶结构被破坏,Fmoc-F分子发生分解[30]。当利用Fmoc-F包埋百里香精油时,凝胶也会因为环境pH值的变化发生分解,从而释放其中包埋的精油。
2.6 Fmoc-F水凝胶对百里香精油的包埋和控释作用研究
2.6.1 Fmoc-F水凝胶对百里香精油的包埋率
用1.3.8节的方法计算Fmoc-F对百里香精油的包埋率,实验结果表明Fmoc-F多肽水凝胶对百里香精油的包埋率高达93.13%,具有很好的包埋效果,而王娣等[14]利用啤酒废酵母为包埋材料制备百里香精油微胶囊,包埋率为86.71%;申莉莉[15]采用壳聚糖和海藻酸钠为壁材包埋百里香精油的包埋率只有85.17%;张珊珊等[31]采用乳液模板——层层自组装法制备的百里香精油微胶囊的包埋率也仅有71.13%,均小于采用Fmoc-F水凝胶对百里香精油的包埋率。
2.6.2 Fmoc-F水凝胶对百里香精油的控释作用和对抑菌效果的延长作用
为了研究Fmoc-F水凝胶对百里香精油的控释作用及Fmoc-F/百里香精油水凝胶的抑菌效果,利用百里香精油、Fmoc-F水凝胶、包埋百里香精油的Fmoc-F水凝胶作液体抑菌实验,结果如表1所示。A组在培养24 h的过程中,菌液OD值呈现出典型的大肠杆菌的生长周期[32];B组OD值变化与A组一致,证明单独的Fmoc-F水凝胶对大肠杆菌的生长并没有抑制效果;C组因为加入百里香精油,在0~24 h,其OD值明显小于A、B组,证明百里香精油的加入可以较好地抑制大肠杆菌的生长;D组在0~1 h内,菌液pH>6.5,Fmoc-F水凝胶基本没有分解,被包埋的百里香精油无法发挥抑菌作用,在1~4 h内,菌液pH>5.5,Fmoc-F水凝胶少量分解,百里香精油开始缓慢释放到菌液中,发挥抑菌作用。随着培养时间的延长(10 h后),菌液中微生物数量增多,溶液pH值下降到5左右,Fmoc-F水凝胶分解增多,百里香精油释放出来,完全发挥抑菌效果。此外,10 h后,对比C、D组,发现D组的抑菌效果好于C组,这是因为C组中,由于百里香精油加在溶液中,导致培养后期有部分精油挥发;而D组由于百里香精油被包埋在Fmoc-F水凝胶中,大肠杆菌数量增多,导致溶液pH值下降后才释放出来,因此有效抑制了百里香精油的挥发,从而延长百里香精油的抑菌效果。
从上述实验可以看出Fmoc-F水凝胶能抑制培养液中百里香精油的挥发,提高其稳定性,并且由于Fmoc-F水凝胶的pH值响应特性,可以对百里香精油进行有效的控制释放,根据菌液的生长情况缓慢释放被包埋的精油,从而达到长效抑菌效果。
表1 添加包埋和未包埋的百里香精油的大肠杆菌液体培养液的OD值和pH值
Table 1 OD and pH of Escherichia coli culture in the presence of Fmoc-F hydrogels with free and encapsulated thyme essential oil
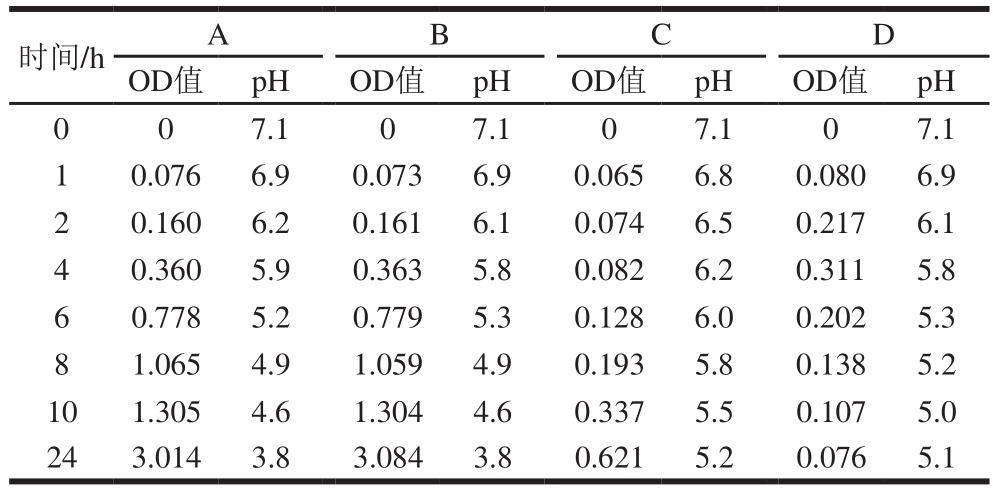
时间/h A B C D OD值 pH OD值 pH OD值 pH OD值 pH 0 0 7.1 0 7.1 0 7.1 0 7.1 1 0.076 6.9 0.073 6.9 0.065 6.8 0.080 6.9 2 0.160 6.2 0.161 6.1 0.074 6.5 0.217 6.1 4 0.360 5.9 0.363 5.8 0.082 6.2 0.311 5.8 6 0.778 5.2 0.779 5.3 0.128 6.0 0.202 5.3 8 1.065 4.9 1.059 4.9 0.193 5.8 0.138 5.2 10 1.305 4.6 1.304 4.6 0.337 5.5 0.107 5.0 24 3.014 3.8 3.084 3.8 0.621 5.2 0.076 5.1
2.7 Fmoc-F水凝胶对百里香精油抗氧化作用的影响
除了抑菌作用,百里香精油还有抗氧化作用,为研究Fmoc-F水凝胶对百里香精油抗氧化效果的影响,测定了百里香精油、Fmoc-F水凝胶包埋百里香精油的DPPH自由基、ABTS阳离子自由基及羟自由基清除率。
表2 各样品的自由基清除率
Table 2 Free radical scavenging rates of free and encapsulated essential oil
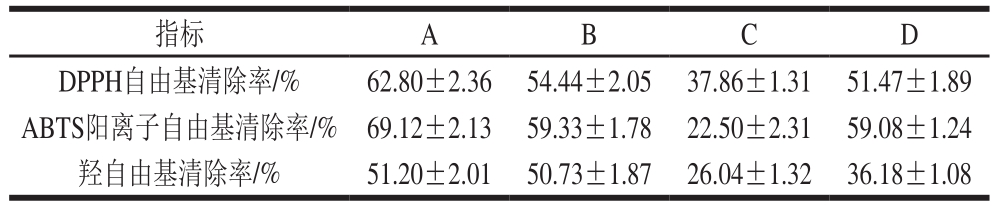
指标 A B C D DPPH自由基清除率/% 62.80±2.36 54.44±2.05 37.86±1.31 51.47±1.89 ABTS阳离子自由基清除率/% 69.12±2.13 59.33±1.78 22.50±2.31 59.08±1.24羟自由基清除率/% 51.20±2.01 50.73±1.87 26.04±1.32 36.18±1.08
如表2所示,对比A、B两组发现,A组样品的自由基清除率略大于B组,这是由于B组百里香精油是包埋在Fmoc-F水凝胶内的,实验过程中有少量精油在胶体内没有完全起到抗氧化作用;对比A、C两组发现,A组样品的自由基清除率远大于C组样品,这是由于C组经20 h放置后,百里香精油大量挥发,使其抗氧化效果减弱,自由基清除率大大降低;对比C、D两组发现,D组样品的自由基清除率大于C组,这是由于Fmoc-F水凝胶的包埋作用,使得百里香精油缓慢释放,减少其挥发作用,延长百里香精油的抗氧化作用。D组羟自由基清除率相比B组略有下降,可能是因为精油并不溶于水,在水相体系中,精油更倾向于附着在Fmoc-F胶体上,因此放置20 h后溶液中精油的有效浓度减少,从而导致对羟自由基清除率的轻微下降。上述结果说明Fmoc-F水凝胶对百里香精油有较好的控释作用,可以减少百里香精油的挥发,延长其抗氧化效果。
3 结 论
本实验利用Fmoc-F水凝胶包埋百里香精油,通过流变仪、圆二色光谱、傅里叶变换红外光谱、扫描电子显微镜研究其成胶机制及微观结构;通过紫外吸收、抑菌和抗氧化研究Fmoc-F水凝胶的pH值响应性及其对百里香精油的控释作用和长效抑菌、抗氧化作用。通过流变学实验发现,百里香精油可以加速水凝胶的形成,并提高其刚性;圆二色谱表明Fmoc-F水凝胶和Fmoc-F/百里香精油水凝胶的二级结构都可能是β-折叠结构;傅里叶变换红外光谱和扫描电子显微镜结果说明百里香精油与Fmoc-F分子形成水凝胶主要是通过分子间氢键形成均匀纤维状三维网络结构;紫外吸收实验说明Fmoc-F具有pH值响应性;抑菌实验和抗氧化实验说明当溶液pH≥6.5时,Fmoc-F水凝胶可有效包埋百里香精油,并且抑制百里香精油的挥发,其包埋率可达93.13%,当溶液pH<6.5时,Fmoc-F水凝胶开始分解,释放百里香精油,从而起到缓释精油、发挥其长效抑菌和抗氧化的效果。
[1]贺红宇, 朱永清, 王自鹏, 等.10 种植物精油对圣女果中三种致病菌抑制效果的研究[J].食品工业科技, 2016, 37(18): 153-157.DOI:10.13386/j.issn1002-0306.2016.18.021.
[2]邱倩, 陈虎虎, 李虹静, 等.百里香植物资源应用价值研究进展[J].陇东学院学报, 2018, 29(1): 77-81.DOI:10.3969/j.issn.1674-1730.2018.01.019.
[3]裴海闰, 韩笑, 曹学丽.百里香精油的成分分析及其抗氧化和抑菌活性评价[J].中国食品学报, 2011, 11(5): 182-188.DOI:10.3969/j.issn.1009-7848.2011.05.029.
[4]张有林, 张润光, 钟玉.百里香精油的化学成分、抑菌作用、抗氧化活性及毒理学特征[J].中国农业科学, 2011, 44(9): 1888-1897.DOI:10.3864/j.issn.0578-1752.2011.09.016.
[5]李文茹.植物精油化学成分及其抗菌活性的研究进展[J].微生物学通报, 2016, 43(6): 1339-1344.DOI:10.13344/j.microbiol.china.150522.
[6]刘光发, 宋海燕, 罗婉如, 等.百里香-丁香罗勒精油抗菌纸对草莓的防腐保鲜效果[J].包装工程, 2018, 39(19): 91-97.DOI:10.19554/j.cnki.1001-3563.2018.19.017.
[7]LAGOURI V, GULDAS M, GURBUZ O. In vitro, antioxidant/free radical scavenging and antibacterial properties of endemic oregano and thyme extracts from Greece[J].Food Science and Biotechnology,2011, 20(6): 1487-1493.DOI:10.1007/s10068-011-0206-3.
[8]邓雯瑾, 蒋汶龙, 陈安均, 等.百里香精油抗菌涂层包装对鲜切生菜货架期内理化品质及微生物的影响[J].食品与发酵工业, 2016,42(7): 247-253.DOI:10.13995/j.cnki.11-1802/ts.201607041.
[9]SARENGAOWA, HU W Z, JIANG A, et al.Effect of thyme oil-alginate-based coating on quality and microbial safety of fresh-cut apples[J].Journal of the Science of Food and Agriculture, 2017, 98(6):2302-2311.DOI:10.1002/jsfa.8720.
[10]ALMELA C, CASTELLO M L, TARRAZO J, et al.Washing of cut persimmon with thyme or lemon essential oils[J].Food Science and Technology International, 2013, 20(8): 557-565.DOI:10.1177/1082013213495865.
[11]SANTORO K, MAGHENZANI M, CHIABRANDO V, et al.Thyme and savory essential oil vapor treatments control brown rot and improve the storage quality of peaches and nectarines, but could favor gray mold[J].Foods, 2018, 7(1): 7-23.DOI:10.3390/foods7010007.
[12]姚茂君, 刘飞.猕猴桃籽油的超临界萃取与微胶囊化研究[J].食品科学, 2007, 28(7): 162-164.DOI:10.3321/j.issn:1002-6630.2007.07.034.
[13]郭元新, 贾洪涛.微胶囊化技术生产粉状芝麻油的研究[J].中国油脂, 2005, 30(4): 24-26.DOI:10.3321/j.issn:1003-7969.2005.04.006.
[14]王娣, 许晖, 汪张贵, 等.百里香精油的微胶囊制备及其缓释性能[J].食品科学, 2013, 34(6): 60-63.DOI:10.7506/spkx1002-6630-201306013.
[15]申莉莉.百里香微胶囊制备及抑菌效果和机理研究[D].武汉:华中农业大学, 2015: 19-24.DOI:10.7666/d.Y2803345.
[16]王凤凤, 郑根建, 周岚.生物水凝胶的现状与展望[J].海南医学, 2015,26(17): 2575-2578.DOI:10.3969/j.issn.1003-6350.2015.17.0931.
[17]朱钦麟, 李英.水凝胶在药物缓释中的应用[J].比较化学, 2018,2(3): 109-113.DOI:10.12677/cc.2018.23013.
[18]PONNUMALLAYAN P, FEE C J.Reversible and rapid pH-regulated self-assembly of a poly(ethylene glycol)-peptide bioconjugate[J].Langmuir, 2014, 30(47): 14250-14256.DOI:10.1021/la502360k.
[19]BRIUGLIA M L, URQUHART A J, LAMPROU D A.Sustained and controlled release of lipophilic drugs from a self-assembling amphiphilic peptide hydrogel[J].International Journal of Pharmaceutics, 2014, 474(1/2): 103-111.DOI:10.1016/j.ijpharm.2014.08.025.
[20]BARAL A, ROY S, DEHSORKHI A, et al.Assembly of an injectable noncytotoxic peptide-based hydrogelator for sustained release of drugs[J].Langmuir, 2014, 30(3): 929-936.DOI:10.1021/la4043638.
[21]RAZA F, ZHU Y, CHEN L, et al.Paclitaxel-loaded pH responsive hydrogel based on self-assembled peptides for tumor targeting[J].Biomaterials Science, 2019, 7(5): 2023-2036.DOI:10.1039/C9BM00139E.
[22]周天啸, 刘馥歌, 杨涛, 等.自组装多肽水凝胶包埋大蒜精油的控释研究[J].粮食与油脂, 2016, 29(7): 14-18.DOI:10.3969/j.issn.1008-9578.2016.07.004.
[23]张琳, 周天啸, 王奔, 等.Fmoc-F多肽水凝胶对丁香精油的控释作用研究[J].食品与机械, 2016, 32(9): 8-11.DOI:10.13652/j.issn.1003-5788.2016.09.002.
[24]IKEDA S, NISHINARI K.“Weak gel”-type rheological properties of aqueous dispersions of nonaggregated kappa-carrageenan helices[J].Journal of Agricultural and Food Chemistry, 2001, 49(9): 4436-4441.DOI:10.1021/jf0103065.
[25]MCKENNA B M.食品质构学: 半固态食品[M].李云飞, 译.北京:化学工业出版社, 2007: 33.
[26]SMITH A, WILLIAMS R, TANG C, et al.Fmoc-diphenylalanine self assembles to a hydrogel via a novel architecture based on π-π interlocked beta-sheets[J].Advanced Materials, 2010, 20(1): 37-41.DOI:10.1002/adma.200701221.
[27]BAIRI P, ROY B, ROUTH P, et al.Self-sustaining, fluorescent and semi-conducting co-assembled organogel of Fmoc protected phenylalanine with aromatic amines[J].Soft Matter, 2012, 8(28):7436-7445.DOI:10.1039/C2SM25673H.
[28]LI D, MU C, CAI S, et al.Ultrasonic irradiation in the enzymatic extraction of collagen[J].Ultrasonics Sonochemistry, 2009, 16(5):605-609.DOI:10.1016/j.ultsonch.2009.02.004.
[29]CHAKRABORTY P, BAIRI P, MONDAL S, et al.Co-assembled conductive hydrogel of N-fluorenylmethoxycarbonyl phenylalanine with polyaniline[J].Journal of Physical Chemistry B, 2014, 118(48):13969-13980.DOI:10.1021/jp5086137.
[30]SINGH V, SNIGDHA K, SINGH C, et al.Understanding the self-assembly of Fmoc-phenylalanine to hydrogel formation[J].Soft Matter, 2015, 11(26): 5353-5364.DOI:10.1039/C5SM00843C.
[31]张珊珊, 冯武, 熊芸, 等.乳液模板-层层自组装法制备百里香精油微胶囊[J].食品工业, 2018, 39(8): 87-92.
[32]何岚, 王柳懿, 朱琪, 等.两种绘制枯草芽孢杆菌和大肠杆菌生长曲线方法的比较[J].天津农业科学, 2017, 23(5): 14-18.DOI:10.3969/j.issn.1006-6500.2017.05.004.