近年来,食品安全面临的主要问题包括由腐败菌和致病菌引起的食源性疾病,它们对公众健康构成严重威胁[1]。随着消费模式的改变,冷鲜肉成为肉类消费的主流,冷鲜肉的质量安全也成为不容忽视的问题。微生物对肉类的污染不仅对生产者和消费者造成经济损失,而且对人体健康构成严重的影响。冷鲜肉中常发现的腐败性嗜冷菌有假单胞菌属、莫拉氏菌属、不动杆菌属、气单胞菌属、肠肝菌属、乳杆菌属、热杀索丝菌(Brochothrix thermosphacta)等[2]。腐败变质的食品对人体有很大危害,微生物代谢的产物不仅能导致人的过敏、中毒,还可通过消化道或呼吸道进入人体,诱发某些病变[3]。
热杀索丝菌是一种革兰氏阳性好氧和兼性厌氧型长杆菌,生长的温度一般在0~30 ℃,可在冷冻肉类和海产品中产生异味并导致变质。Jiang Yun等[4]的研究表明热杀索丝菌是导致真空包装冷却猪肉4 ℃贮藏末期中腐败的优势菌之一。Reid等[5]研究发现热杀索丝菌是真空包装牛肉中主要的嗜冷菌之一。Silbande等[6]研究认为热杀索丝菌是金枪鱼冰贮过程中的主要腐败菌,因其兼性厌氧和嗜冷的特点,即便在真空低温的条件下,也能利用食品中的营养成分产生腐败物质,导致肉品腐败和变质[7]。几十年来,人们制定各种策略来防止食品中致病菌和腐败细菌的生长,以达到保藏食品的目的,在食品工业中最常用、简便和高效的方法是向食品中加入化学防腐剂。但化学防腐剂的潜在毒性、微生物耐药性、安全、残留等问题日益突出。天然防腐剂由于其抗菌性强、水溶性好、安全无毒、抑菌谱广等优点使得人们越发关注其开发与研究[8]。
植物精油是一种有效的天然防腐剂,通常从香料和草药中提取,具有良好的感官和防腐性能,可以抑制微生物生长,延长货架期[9]。单萜化合物是植物精油的主要成分,具有抗菌等多种生物活性。百里酚、薄荷醇、亚麻酸乙酯是3 种单萜化合物,通过破坏细胞壁和细胞膜,导致细胞内物质渗漏,对金黄色葡萄球菌和大肠杆菌具有有效的抗菌活性[10]。β-石竹烯,又称β-丁香油精,一种双环倍半萜型的天然产物,其性状为无色至微黄油状液体,具有淡的丁香似香味[11]。国家标准化管理委员会规定石竹烯可用作食用香料(GB 2760—2014《食品安全国家标准 食品添加剂使用标准》)。石竹烯广泛存在于一些天然植物中,如作为海南黑、白胡椒的主要香气成分,石竹烯的相对含量分别为44.41%和12.98%[12]。牡荆挥发油的主要成分为石竹烯(43.12%),对大肠杆菌、枯草杆菌、四联球菌均表现出较强的抑菌效果[13]。但是,目前还鲜有石竹烯对B.thermosphacta的抑菌性能和抑制机制的相关报道。
本实验通过测定最小抑菌浓度(minimum inhibition concentration,MIC)和生长曲线等指标确定石竹烯对B.thermosphacta的抑菌活性,并通过扫描电子显微镜(scanning electron microscopy,SEM)观察、碱性磷酸酶(alkaline phosphatase,AKP)活力测定、二乙酸荧光素(fluorescein diacetate,FDA)染色实验、胞外钾离子浓度、细胞内外蛋白质含量、丙酮酸激酶(pyruvate kinase,PK)、苹果酸脱氢酶(malic dehydrogenase,MDH)活力和基因组DNA相对含量的测定等进一步探究石竹烯对B.thermosphacta的抑菌机理,为石竹烯作为天然抑菌剂提供理论依据。
1 材料与方法
1.1 材料与试剂
B.thermosphacta 广东微生物菌种保藏中心;β-石竹烯(纯度>90%) 日本TCL公司;营养肉汤、琼脂、无水乙醇、无菌磷酸盐缓冲液(phosphate buffered saline,PBS)、FDA、G250考马斯亮蓝 北京索莱宝科技有限公司;AKP活性测定试剂盒、MDH活性测定试剂盒、PK活性测定试剂盒 南京建成生物工程研究所;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
GI54DS型高压灭菌锅 厦门致微仪器有限公司;SW-CJ-1FD型无菌超净工作台 苏州佳宝净化工程设备有限公司;SPX-288型生化培养箱 宁波江南仪器厂;SHA-2型恒温振荡器 常州澳华仪器有限公司;CR22N型落地式高速冷冻离心机、S-3000型扫描电子显微镜日本日立公司;TU1810型紫外-可见分光光度计、TAS-990 Super AFG型原子吸收分光光度计 北京普析通用仪器有限责任公司;Alpha1型冷冻干燥机 德国Marin Christ公司;JYD-650L型超声波细胞粉碎机 上海五相仪器仪表有限公司;WGY-10型荧光分光光度计 天津港东科技发展股份有限公司;NanoPhotometer-N50型超微量分光光度计 德国Implen公司;SP-Max3500FL型多功能酶标仪 上海闪谱生物科技公司。
1.3 方法
1.3.1 菌株活化
将B.thermosphacta接种于营养琼脂培养基中,置于26 ℃培养箱中培养18~24 h进行传代以恢复活性。活化后的B.thermosphacta接种到灭菌的营养琼脂培养基中,26 ℃培养18~24 h,使用麦氏比浊法用生理盐水将菌液浓度稀释至106~107 CFU/mL备用。
1.3.2 MIC的测定
采用琼脂稀释法[14]测定MIC。将溶于20%(体积分数,下同)乙醇溶液的石竹烯2 倍梯度稀释,得到不同质量浓度石竹烯溶液,并与营养琼脂培养基均匀混合,使琼脂培养基中石竹烯终质量浓度分别为18.04、9.02、4.51、2.26、1.13、0.56 mg/mL,以加入等量无菌水和20%乙醇溶液的培养基分别为空白、阴性对照组。将200 μL稀释至106~107 CFU/mL的菌悬液均匀地涂布于平板上,26 ℃倒置培养24 h。观察各平板菌落生长情况,以肉眼看不见细菌生长的最小稀释浓度为MIC。
1.3.3 生长曲线的测定
通过紫外-可见分光光度法测定B.thermosphacta的生长曲线[15]。取对数生长期的B.thermosphacta浓度梯度稀释为106~107 CFU/mL,并按体积分数5%的接种量接种至营养肉汤培养基中,以加入1 倍和2 倍最小抑菌浓度(1×MIC、2×MIC)的石竹烯的组为实验组,以加入等量无菌水和20%乙醇溶液的培养基分别为空白、阴性对照组,在摇床中培养,每隔1 h用紫外-可见分光光度计在600 nm处测定样品OD值。
1.3.4 细胞形态的观察
根据Diao Wenrui等[16]的方法,采用扫描电子显微镜观察B.thermosphacta细胞外部形态的变化。向培养至对数生长期的菌悬液中加入1×MIC、2×MIC石竹烯的组为实验组,加入等量无菌水和20%乙醇溶液的组分别为空白、阴性对照组,分别取培养4、8 h的菌悬液,低温离心收集菌体。用PBS(pH 7.2)洗涤3 次,再用乙醇逐级脱水,将脱水后的菌体置于-20 ℃预冷冻2 h,冷冻干燥12 h后取样镀金,在扫描电子显微镜上观察细胞形态。
1.3.5 AKP活力的测定
通过测定AKP活力来评价石竹烯对B.thermosphacta细胞壁的破坏程度。实验组和对照组的配制如1.3.4节,将培养至0、3、6、9、12 h的菌液离心后取上清液,按照AKP试剂盒说明书测定上清液AKP活力。
1.3.6 FDA染色实验
通过FDA荧光强度的测定来反映细菌细胞膜的完整性和通透性。根据曾哲灵等[17]的方法做适当调整。将培养至对数生长期的B.thermosphacta 6 000 r/min低温离心收集菌体并重悬于无菌生理盐水中,实验组和对照组的配制如1.3.4节。在培养至6、9、12 h分别取样离心收集菌体,用PBS洗涤2 次后与250 μL FDA-丙酮溶液(2 mg/mL)在常温下共同孵育20 min,加入PBS洗涤,低温离心,弃去上清液,重复3 次后,再将菌体重悬于PBS中,用荧光分光光度计测定样品的平均荧光强度。
1.3.7 细胞外钾离子质量浓度的测定
测定细菌细胞中钾离子的外流是研究抗菌药物对细胞膜损伤的经典方法。通过钾离子释放实验进一步探讨石竹烯对B.thermosphacta细胞壁和膜的影响。参考Miao Jianyin等[18]的方法并做适当调整。低温离心培养至对数期的菌体,用生理盐水(0.9%光谱纯NaCl、超纯水稀释)将收集到的菌体洗涤3 次并重悬于等量生理盐水中,对照组和实验组的配制如1.3.4节,在0、0.5、1、2、3、4 h分别取样,10 000 r/min离心取上清液,并用超纯水稀释至适当浓度,使用原子吸收分光光度计测定。
1.3.8 细胞外蛋白质量浓度的测定
通过测定细胞外蛋白质量浓度来判断石竹烯对B.thermosphacta蛋白质泄漏情况的影响。实验组和对照组的配制如1.3.4节。分别取培养0、2、4、6、8、10、12 h的菌悬液低温离心,取上清液,采用考马斯亮蓝法,用紫外-可见分光光度计于595 nm波长处测定吸光度。
1.3.9 细胞内蛋白质量浓度的测定
通过测定细胞内蛋白质量浓度来研究石竹烯对B.thermosphacta蛋白质合成的影响以及为后续MDH活力的测定提供计算基础。参考He Mengying等[19]的方法。实验组和对照组的配制如1.3.4节,用PBS将低温离心收集到的培养至0、3、6、9、12、24 h的菌体洗涤3 次并重悬。上机破碎细胞5 min,10 000 r/min离心10 min,取上清液冷藏于4 ℃。采用考马斯亮蓝法,用紫外-可见分光光度计于595 nm波长处测定吸光度。
1.3.10 MDH活力的测定
通过MDH活力的变化来研究石竹烯对B.thermosphacta糖代谢和三羧酸循环等的影响。采用MDH试剂盒测定的方法,将工作液37 ℃预温,取100 μL 1.3.9节中超声破碎后的样液,再加入1 mL工作液,混合均匀后,开始计时,在20、80 s时记录吸光度分别为A1、A2。计算2 次吸光度差(ΔA=A1-A2),按公式(1)计算MDH活力。
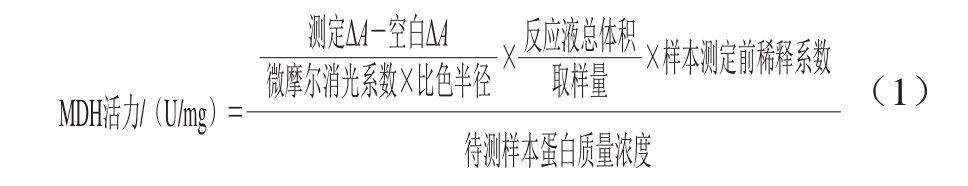
式中:微摩尔消光系数为6.2 L/(μmol·cm);测定ΔA为20 s时测定管的吸光度与80 s时的测定管吸光度的差值;空白ΔA为20 s时空白管的吸光度与80 s时的空白管吸光度的差值;比色皿半径为0.5 cm;反应液总体积为1.1 mL;取样量为0.1 mL;待测样本蛋白质量浓度单位为mg/mL。
1.3.11 PK活力的测定
通过PK活力的变化研究石竹烯对B.thermosphacta糖酵解等代谢途径的影响。采用PK试剂盒测定的方法。将在37 ℃预温的试剂与100 μL 1.3.9节中超声破碎后的样液混合均匀,计时、进行比色,在0.5、15.5 min时记录吸光度分别为A1、A2,第一次记录后要将反应液倒入原试管中,将试管水浴15 min,再上机记录第二次,计算2 次吸光度差(ΔA=A1-A2),按公式(2)计算PK活力。
式中:ΔA为30 s时测定管的吸光度与15 min 30 s时测定管吸光度的差值;毫摩尔消光系数为6.22 L/(mmol·cm);反应时间为15 min;比色皿半径为0.5 cm;反应液总体积为1.195 mL;取样量为0.02 mL。
1.3.12 细菌基因组DNA相对含量的测定
用荧光光谱法研究石竹烯与B.thermosphacta DNA的相互作用。按照试剂盒说明书的方法提取B.thermosphacta细菌基因DNA。提取的DNA的纯度和浓度用超微量分光光度计分别通过260 nm和280 nm波长处的光密度值比(OD260 nm/OD280 nm=1.8)和OD260 nm确定[20]。用0.01 mol/L Tris-HCl(pH 7.2)缓冲液将细菌基因组DNA稀释至60 μg/mL。将不同质量浓度的石竹烯溶液(0、1×MIC、2×MIC、4×MIC)加入到相同体积的DNA溶液中,并在37 ℃在黑暗中温育10 min。采用多功能酶标仪在激发波长280 nm处,测量混合物从300 nm到500 nm的荧光光谱,狭缝宽度为10 nm。
1.4 数据处理与分析
实验数据采用DPS数据处理系统进行方差分析,P<0.05表示存在显著性差异,使用Origin 2018软件制图。
2 结果与分析
2.1 石竹烯对B.thermosphacta的MIC
表1 B.thermosphacta生长情况
Table 1 Growth of B.thermosphacta
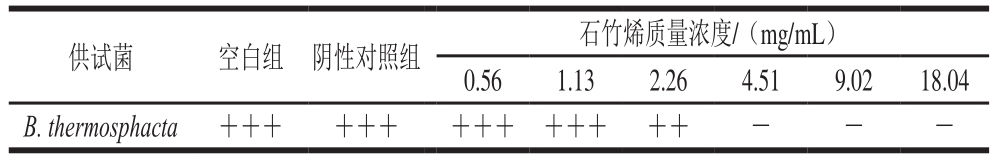
注:-.无菌落;++.较多菌落;+++.大量菌落。
供试菌 空白组 阴性对照组 石竹烯质量浓度/(mg/mL)0.56 1.13 2.26 4.51 9.02 18.04 B.thermosphacta +++ +++ +++ +++ ++ - - -
由表1可知,石竹烯对B.thermosphacta有较好的抑菌效果,且抑菌能力随着其质量浓度的增加而增加,当石竹烯质量浓度为4.51 mg/mL时细菌不能生长,即石竹烯对B.thermosphacta的MIC为4.51 mg/mL,且20%乙醇溶液对B.thermosphacta的生长没有影响。
2.2 石竹烯对B.thermosphacta生长的影响
在一定的波长范围内,菌悬液浓度与吸光度成正比[21],可通过OD值变化来评判石竹烯对B.thermosphacta的抑制和杀灭作用。如图1所示,空白对照组和阴性对照组呈现典型细菌生长特点的S型生长曲线。在10~18 h期间,两组的细菌迅速生长,乙醇组相较于空白组略缓慢,但最终几乎同时达到稳定期,这表示20%乙醇溶液对细菌的生长影响甚微。在加入终质量浓度为1×MIC和2×MIC石竹烯的菌液中,菌液OD600 nm显著低于对照组(P<0.05),细菌几乎停止生长。结果表明在接种体积分数5%的106~107 CFU/mL B.thermosphacta后加入终质量浓度为1×MIC和2×MIC的石竹烯能够有效抑制B.thermosphacta的生长。
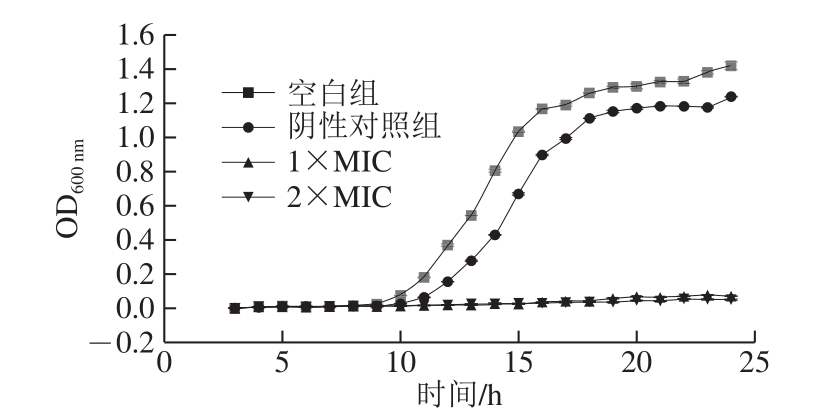
图1 石竹烯对B.thermosphacta生长的影响
Fig.1 Effect of caryophyllene on the growth of B.thermosphacta
2.3 石竹烯对B.thermosphacta细胞形态的影响

图2 B.thermosphacta扫描电子显微镜图(8 000×)
Fig.2 Scanning electron microphotographs of B.thermosphacta (8 000 ×)
如图2所示,空白组(图2A1、A2)中的菌体呈正常短杆状,圆润饱满、表面光滑、边缘整齐、形状规则、粗细均匀一致,未出现细胞破裂、内容物溢出等现象。阴性对照组(图2B1、B2)中B.thermosphacta经乙醇处理4、8 h后细胞表面有轻微的褶皱,受到的破坏很小,大部分菌体完好,可见20%乙醇溶液对B.thermosphacta的影响甚微。经石竹烯作用4 h的B.thermosphacta(图2C1、D1),能观察到菌体表面粗糙,出现褶皱,在细胞周围观察到许多细胞碎片,部分菌体分裂,从而引起细胞内容物的外泄。经石竹烯处理8 h的B.thermosphacta(图2C2、D2)形态受到破坏,菌体萎陷,边缘模糊,细胞表面粗糙不平并出现孔洞,细胞内容物外泄。由此可见,石竹烯能破坏B.thermosphacta的完整性,使细胞内容物泄漏。
2.4 石竹烯对B.thermosphacta细胞壁通透性的影响
在细胞正常情况下,不能在胞外检测到AKP活力,当细胞壁受到一定破坏时,其通透性增加,存在于细胞壁和细胞膜之间的AKP容易泄漏到细胞外,因此通过检测胞外AKP活力的变化,可反映细菌细胞壁受损坏的情况[22]。由图3可知,在1×MIC、2×MIC石竹烯作用的菌液中AKP活力极显著大于对照组中AKP活力(P<0.01)。随着时间的延长,检测到空白对照组和阴性对照组细胞外AKP含量变化很小,而实验组在经石竹烯处理2 h后开始出现AKP的大量渗出,而且添加2×MIC石竹烯的菌液中检测到的AKP泄漏量明显高于1×MIC。0~8 h内,1×MIC石竹烯作用的菌液中AKP活力稳定上升,2×MIC石竹烯作用的菌液中AKP活力波动较大,但仍呈上升的趋势。结果表明石竹烯能通过诱导细胞壁损伤而作用于细胞壁,增加细胞壁的通透性,导致大量AKP外泄到胞外。
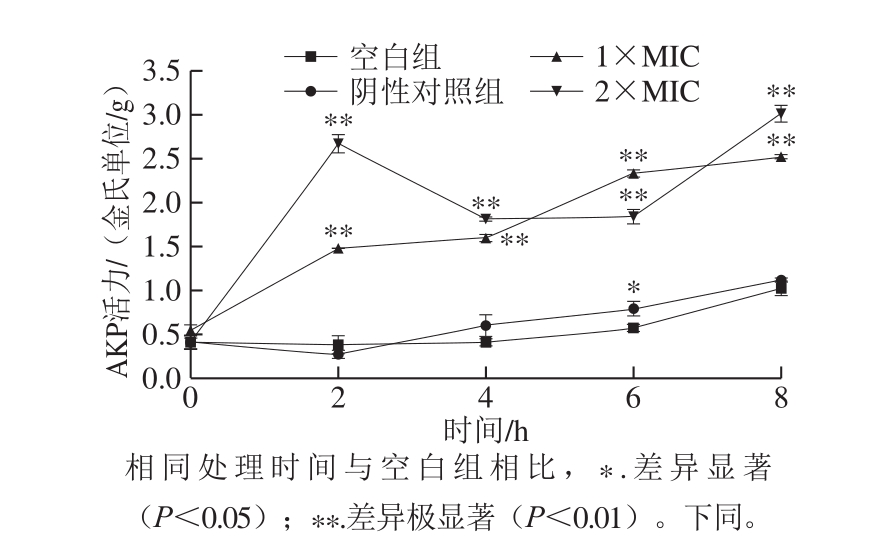
图3 石竹烯对B.thermosphacta细胞外AKP活力的影响
Fig.3 Effect of caryophyllene on the activity of extracellular AKP in B.thermosphacta
2.5 石竹烯对B.thermosphacta细胞膜通透性的影响
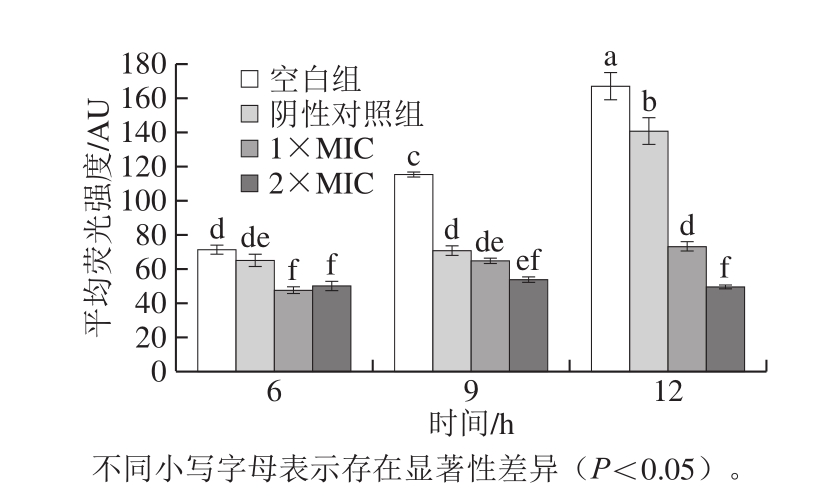
图4 石竹烯对B.thermosphacta 细胞膜通透性的影响
Fig.4 Effect of caryophyllene on cell membrane permeability of B.thermosphacta
研究表明大多数抑菌物质都作用于细胞膜,细胞膜能够维持细胞内物质和能量的平衡,使细胞维持正常的生命活动[23]。FDA进入细胞后可被酶水解为在细胞中发出黄绿色荧光的荧光素,若细胞膜受到破坏,荧光素分子会流到细胞外,导致FDA荧光强度降低[24]。FDA荧光强度低表明细胞内细胞膜完整性被破坏,荧光从胞浆中外漏。由图4可知,由于细菌增长繁殖,随着时间的延长细胞内滞留的荧光素分子含量增加,空白组和阴性对照组的荧光强度显著增加,显著高于1×MIC组和2×MIC组(P<0.05)。经1×MIC石竹烯处理的菌液荧光强度在6~12 h内增长缓慢,经2×MIC石竹烯作用的菌液荧光强度在6~9 h期间缓慢增长,直至12 h略有下降。说明石竹烯能破坏细胞膜结构、增强细胞膜通透性、导致FDA外泄,并随着石竹烯质量浓度从1×MIC增加至2×MIC,随着作用时间的延长,破坏程度更为明显。
2.6 石竹烯对B.thermosphacta细胞外钾离子质量浓度的影响
当微生物细胞膜被破坏,其通透性变化,则会导致一些电解质泄漏,如钾离子[25]。由图5可知,空白组和阴性对照组中,胞外钾离子的质量浓度几乎没有增长,且在各个时间段内极显著低于用石竹烯处理的菌液中的钾离子质量浓度(P<0.01)。1×MIC、2×MIC石竹烯作用的菌液中,胞外钾离子浓度显著增大(P<0.05),在0~0.5 h,钾离子质量浓度迅速增加。细胞外钾离子的存在表明钾离子从细菌细胞中泄漏,且在处理0.5 h内钾离子出现大量泄漏,这是由于石竹烯破坏B.thermosphacta的细胞膜结构,细胞膜通透性增加,从而导致钾离子等细胞原生质内容物的泄漏。经石竹烯处理后细胞内钾离子流出量的增加为石竹烯对细菌膜损伤机制提供了更多的依据。

图5 石竹烯对B.thermosphacta细胞外钾离子质量浓度的影响
Fig.5 Effect of caryophyllene on extracellular potassium ion concentration in B.thermosphacta
2.7 石竹烯对B.thermosphacta细胞外蛋白质量浓度的影响
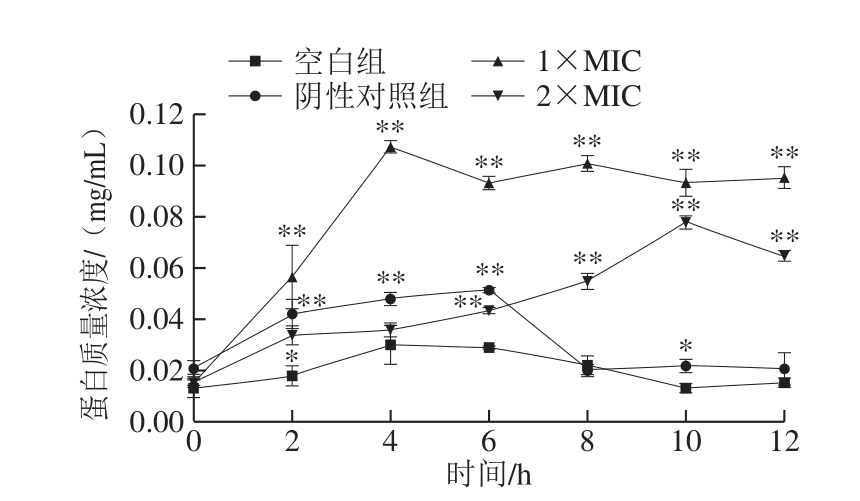
图6 石竹烯对B.thermosphacta细胞外蛋白质量浓度的影响
Fig.6 Effect of caryophyllene on extracellular protein concentration in B.thermosphacta
由图6可知,空白组和阴性对照组中胞外蛋白质量浓度虽有一定程度的波动但最终趋于平稳,且低于用石竹烯处理后的B.thermosphacta悬液中的胞外蛋白质量浓度,说明石竹烯损伤细胞,破坏细胞的完整性,导致胞内蛋白质大量外泄。1×MIC石竹烯溶液作用的菌液中胞外蛋白质量浓度显著增加(P<0.05),在0~4 h内,迅速增加,4 h后有轻微波动。2×MIC石竹烯溶液作用的菌液中胞外蛋白质量浓度低于1×MIC石竹烯溶液作用后的菌液且渗出速率缓慢,可能是因为菌体受到高质量浓度石竹烯的作用,其自我修复功能受到激发[26],少数菌体恢复活力,继续生存繁殖,菌液中的蛋白质被正在生长的菌体所消耗,蛋白质渗出胞外的速率也相对小于1×MIC石竹烯作用的菌液中的渗出速率。
2.8 石竹烯对B.thermosphacta细胞内蛋白质量浓度的影响
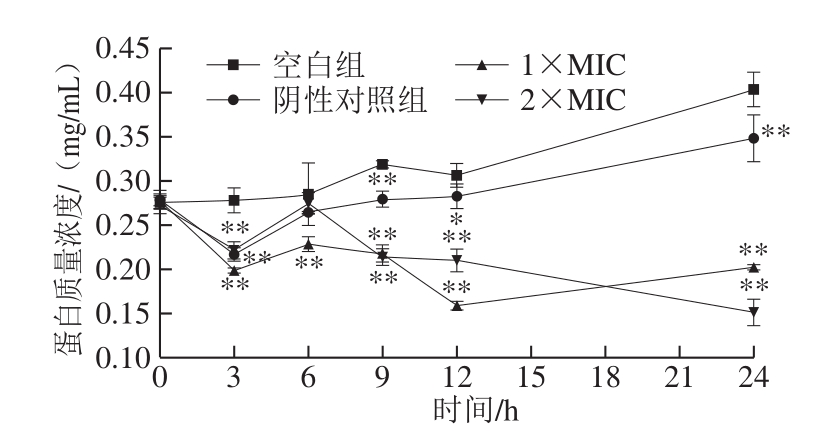
图7 石竹烯对B.thermosphacta细胞内蛋白质量浓度的影响
Fig.7 Effect of caryophyllene on intracellular protein concentration in B.thermosphacta
由图7可知,空白组和阴性对照组中,随着生长时间的延长,B.thermosphacta大量繁殖,代谢旺盛,细胞内蛋白质量浓度呈增加的趋势,经石竹烯作用的菌液中蛋白质量浓度小于对照组。1×MIC石竹烯作用的菌液中胞内蛋白质量浓度波动较大,但总体呈下降趋势,2×MIC石竹烯作用的菌液中胞内蛋白质量浓度呈下降趋势,波动小于1×MIC组。由此可知,石竹烯的质量浓度越大,越能使胞内蛋白质量浓度稳定下降。结合2.7节结果可知,胞内蛋白质量浓度下降可能是因为细胞膜通透性增加,胞内蛋白外泄。也可以推测石竹烯能够引起细菌蛋白合成途径受阻,破坏蛋白质合成,导致代谢功能障碍,甚至细胞死亡。
2.9 石竹烯对B.thermosphacta MDH活力的影响
MDH是生物体进行糖代谢的关键酶之一[27]。在线粒体中MDH可调节作为生物细胞中重要氧分解代谢途径的三羧酸循环的运转速率,作为NADP阳离子自由基的辅酶,在生物合成过程中从代谢产物中接受H+形成NADPH,因此MDH活性能反映细胞代谢是否正常[28]。由图8可知,空白组和阴性对照组MDH活力在一定时间的波动后极显著高于1×MIC、2×MIC石竹烯作用的菌液中的MDH活力(P<0.01)。1×MIC组中MDH活力在12 h前总体呈上升趋势,12 h后显著下降,2×MIC组在处理3 h后MDH活力出现显著下降后在6 h时呈上升趋势,6 h后MDH活力急速下降并始终低于1×MIC组中MDH活力,这种变化与Hu Yichen等[29]的研究结果一致。表明石竹烯对MDH活力有一定抑制作用,并且石竹烯的质量浓度越大,对MDH活力抑制程度越高,抑制作用也越早显现出来。MDH活力下降可能是因为石竹烯与MDH相结合,导致酶分子结构发生了变化,使其活性降低[23]。
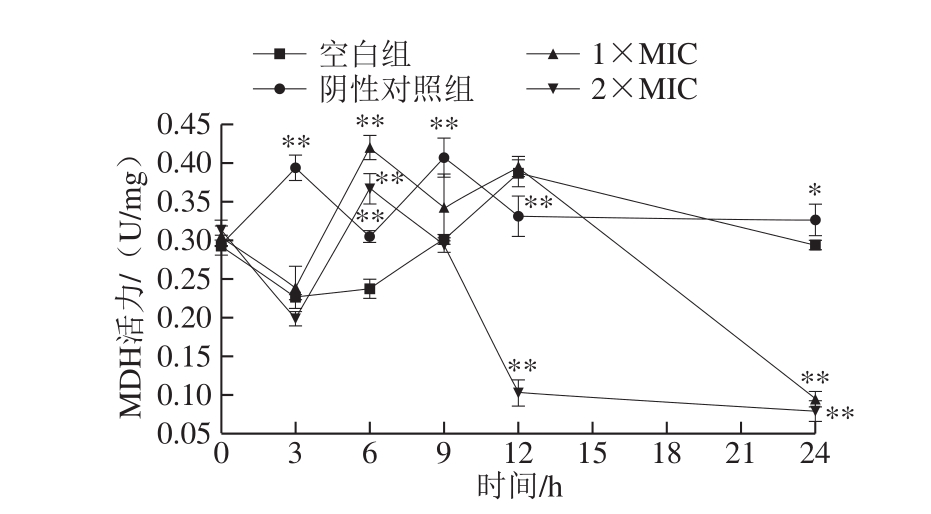
图8 石竹烯对B.thermosphacta细胞中MDH活力的影响
Fig.8 Effect of caryophyllene on MDH activity in B.thermosphacta
2.10 石竹烯对B.thermosphacta细胞中PK活力的影响
在糖酵解途径中,PK是关键限速酶之一[30],能促进糖酵解产生丙酮酸,对能量代谢有一定促进作用。丙酮酸在细胞代谢过程中,联系着糖酵解途径和三羧酸循环[31]。
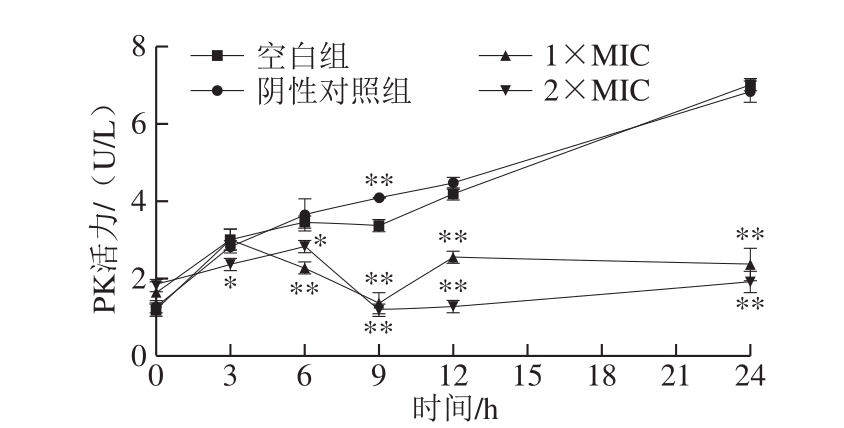
图9 石竹烯对B.thermosphacta细胞中PK活力的影响
Fig.9 Effect of caryophyllene on PK activity in B.thermosphacta
由图9可知,空白组和阴性对照组的PK活力显著增加(P<0.05),随着时间延长,细菌大量繁殖,糖酵解反应活跃,PK活力增强。经1×MIC、2×MIC石竹烯作用的菌液中PK活力虽有轻微波动,但在处理6~24 h内PK活力显著低于空白对照组和阴性对照组(P<0.05),表明PK活力受到抑制,则丙酮酸的产生也受到抑制,丙酮酸是生产乙酰辅酶A的原料,乙酰辅酶A是三羧酸循环中的初始反应物[32],结合2.9节结果,MDH活性也受到了抑制,而MDH是三羧酸循环中重要的酶,说明三羧酸循环受到抑制,即影响细胞正常代谢。经过石竹烯处理后酶活力的降低可能是由于其与酶侧链发生反应并引起结构变化,进而导致酶构象的改变。此外,细菌的呼吸链位于细胞膜上,细胞膜参与了细菌各种重要的生命活动,如细胞能量转换、高分子结构的合成和酶分泌等[33]。因此,石竹烯的处理会干扰细菌的呼吸和能量代谢,破坏细胞膜的结构和呼吸链上酶系统的功能,从而干扰细菌的正常生命活动。
2.11 石竹烯对细菌基因组DNA的影响
DNA的破坏会阻碍基因的表达,从而阻碍正常酶和受体的合成,甚至导致细菌死亡[34]。因此,采用DNA研究中最敏感的技术之一——荧光光谱技术研究石竹烯与DNA的相互作用[35]。
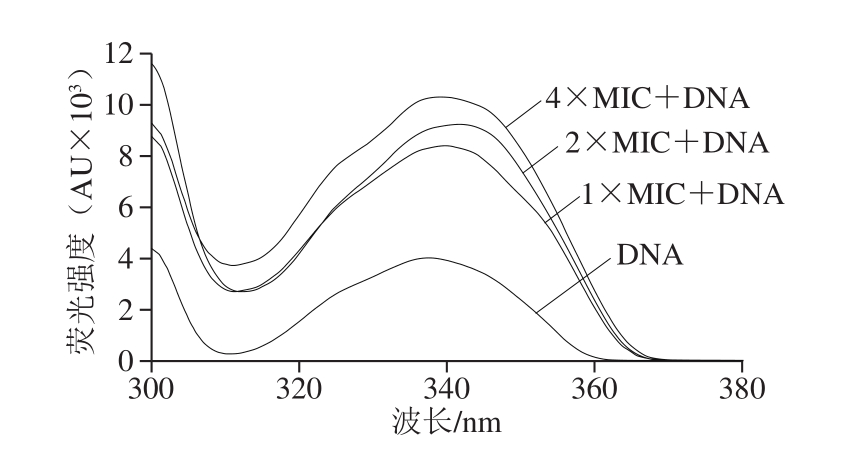
图10 B.thermosphacta基因组DNA在不同质量浓度石竹烯作用下的荧光光谱
Fig.10 Fluorescence spectra of genomic DNA of B.thermosphacta in the presence of different concentrations of caryophyllene
如图10所示,将不同质量浓度的石竹烯加入到含有DNA的溶液中后,荧光强度显著增强且随着石竹烯质量浓度增加而增加。这可能是由于相邻碱基对之间的平面石竹烯堆叠引起的DNA分子平面性的增加,碰撞频率溶剂分子以及DNA的减少[36]。结果表明,石竹烯可能插入DNA螺旋中的碱基对或位于DNA的疏水环境中,通过与DNA碱基的堆积相互作用可以稳定复合物,从而增加DNA的荧光强度。
3 结 论
石竹烯存在于许多具有抗炎、抑菌、抑制哮喘功能的植物提取物中。较多学者对石竹烯研究局限于含有石竹烯的精油对微生物的抑制作用,但陈奕鹏等[37]简要说明石竹烯对尖孢镰刀菌、胶胞炭疽菌和多主棒孢菌具良好的抑制作用,即说明石竹烯具有一定的抑菌作用。本实验从细胞水平揭示究石竹烯对B.thermosphacta的抑菌机理。结果表明:石竹烯能够抑制B.thermosphacta的生长,使其细胞壁和细胞膜的完整性受到破坏,通透性增加,细胞内容物如蛋白质、钾离子外渗,MDH、PK活力降低,影响细胞正常生长代谢。而且石竹烯可以与基因组DNA结合,破坏其结构与构象,抑制细菌生长。
绿色、健康、无化学防腐剂添加的天然食品越来越受人喜爱。本实验探索石竹烯对于在真空包装和冷藏条件下能生长繁殖的B.thermosphacta的抑菌机理,表明石竹烯在食品中的应用具有良好的潜力。为更有针对性的利用石竹烯作为天然防腐剂抑制食品腐败菌,将继续这一研究方向并探究石竹烯对不同菌种的抑菌机理。
[1]ARQUÉS J L, RODRÍGUEZ E, NUÑEZ M, et al.Inactivation of gram-negative pathogens in refrigerated milk by reuterin in combination with nisin or the lactoperoxidase system[J].European Food Research and Technology, 2008, 227(1): 77-82.DOI:10.1007/s00217-007-0695-8.
[2]张玉芬, 张森, 刘准.食品保藏剂N-1081的抗菌作用[J].食品与发酵工业, 1986(5): 61-63.DOI:10.13995/j.cnki.11-1802/ts.1986.05.011.
[3]孔凡真.冷却肉的腐败变质与保鲜包装技术[J].肉类工业,2006(11): 3-4.DOI:10.3969/j.issn.1008-5467.2006.11.002.
[4]JIANG Yun, GAO Feng, XU Xinglian, et al.Microfloral change of vacuum-packaged pork during chilled storage[J].Food Science, 2011,32(4): 241-245.DOI:10.1631/jzus.B1000185.
[5]REID R, FANNING S, WHYTE P, et al.The microbiology of beef carcasses and primals during chilling and commercial storage[J].Food Microbiology, 2017, 61: 50-57.DOI:10.1016/j.fm.2016.08.003.
[6]SILBANDE A, ADENET S, SMITH-RAVIN J, et al.Quality assessment of ice-stored tropical yellowfin tuna (Thunnus albacares)and influence of vacuum and modified atmosphere packaging[J].Food Microbiology, 2016, 60: 62-72.DOI:10.1016/j.fm.2016.06.016.
[7]艾有伟, 王宏勋, 熊丹萍.热杀索丝菌降解猪肉蛋白机制研究[J].食品科技, 2015, 40(5): 166-170.
[8]杜芸.天然食品防腐剂的研究进展[J].食品研究与开发, 2006,27(3): 67-71.DOI:10.3969/j.issn.1005-6521.2006.03.063.
[9]VALLVERDÚ-QUERALT A, REGUEIRO J, MARTÍNEZ-HUÉLAMO M, et al.A comprehensive study on the phenolic profile of widely used culinary herbs and spices: rosemary, thyme, oregano, cinnamon,cumin and bay[J].Food Chemistry, 2014, 154: 299-307.DOI:10.1016/j.foodchem.2013.12.106.
[10]TROMBETTA D, CASTELLI F, SARPIETRO M G, et al.Mechanisms of antibacterial action of three monoterpenes[J].Antimicrobial Agents and Chemotherapy, 2005, 49: 2474-2478.DOI:10.1128/aac.49.6.2474-2478.2005.
[11]刘晓宇, 陈旭冰, 陈光勇.β-石竹烯及其衍生物的生物活性与合成研究进展[J].林产化学与工业, 2012, 32(1): 104-110.
[12]陈晓龙, 陈光静, 柳中, 等.海南黑、白胡椒有效成分的检测及其分析[J].中国调味品, 2017, 42(11): 102-106.DOI:10.3969/j.issn.1000-9973.2017.11.022.
[13]凌玮玮.牡荆化学成分及其抑菌活性研究[D].合肥: 安徽农业大学,2010: 51-53.DOI:10.7666/d.y1735093.
[14]贺松, 龚芳红, 张德纯, 等.乳酸链球菌素对乳酸菌抑菌作用的研究[J].食品科学, 2009, 30(23): 352-355.DOI:10.3321/j.issn:1002-6630.2009.23.080.
[15]BABII C, BAHRIN L G, NEAGU A N, et al.Antibacterial activity and proposed action mechanism of a new class of synthetic tricyclic flavonoids[J].Journal of Applied Microbiology, 2016, 120(3):630-637.DOI:10.1111/jam.13048.
[16]DIAO Wenrui, HU Qingping, ZHANG Hong, et al.Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill.)[J].Food Control, 2014, 35(1): 109-116.DOI:10.1016/j.foodcont.2013.06.056.
[17]曾哲灵, 赵存洋, 罗春燕, 等.单癸月桂酸甘油酯的抑菌作用及机理研究[J].食品科学, 2013, 34(3): 70-74.
[18]MIAO Jianyin, LIU Guo, KE Chang, et al.Inhibitory effects of a novel antimicrobial peptide from kefir against Escherichia coli[J].Food Control, 2016, 65: 63-72.DOI:10.1016/j.foodcont.2016.01.023.
[19]HE Mengying, WU Ting, PAN Siyi, et al.Antimicrobial mechanism of flavonoids against Escherichia coli ATCC 25922 by model membranestudy[J].Applied Surface Science, 2014, 305: 515-521.DOI:10.1016/j.apsusc.2014.03.125.
[20]AMAGLIANI G, GIAMMARINI C, OMICCIOLI E, et al.Detection of Listeria monocytogenes using a commercial PCR kit and different DNA extraction methods[J].Food Control, 2007, 18(9): 1137-1142.DOI:10.1016/j.foodcont.2006.06.012.
[21]李婷婷, 张慧芳, 姜杨, 等.鲶鱼体表粘液粗提物对铜绿假单胞菌的抑菌机理初探[J].现代食品科技, 2015, 31(7): 67-73.DOI:10.13982/j.mfst.1673-9078.2015.7.012.
[22]SÁNCHEZ E, GARCÍA S, HEREDIA N.Extracts of edible and medicinal plants damage membranes of Vibrio cholerae[J].Applied and Environmental Microbiology, 2010, 76(20): 6888-6894.DOI:10.1674/0003-0031(2007)158[147:SATVIT]2.0.CO;2.
[23]YAO X L, ZHU X R, PAN S Y, et al.Antimicrobial activity of nobiletin and tangeretin against Pseudomonas[J].Food Chemistry,2012, 132(4): 1883-1890.DOI:10.1016/j.foodchem.2011.12.021.
[24]YAMAKAWA, MORICIN M.A novel type of antibacterial peptide isolated from the silkworm, bombyx mori[J].Journal of Biological Chemistry, 1995, 270(50): 29923-29927.DOI:10.1074/jbc.270.50.29923.
[25]黄巍, 王建清, 张倩.香旱芹精油对金黄色葡萄球菌抑菌机理的研究[J].中国调味品, 2017, 42(12): 7-11.DOI:10.3969/j.issn.1000-9973.2017.12.002.
[26]朱力, 王恒樑, 黄培堂.蛋白质组学在细菌应激反应研究中的应用[J].生物技术通讯, 2007, 18(3): 511-514.DOI:10.3969/j.issn.1009-0002.2007.03.043.
[27]FLORES, MARÍA E.Function, kinetic properties, crystallization, and regulation of microbial malate dehydrogenase[J].Journal of Zhejiang University-SCIENCE B, 2016, 17(4): 247-261.DOI:10.1631/jzus.B1500219.
[28]陈玉环, 万春鹏, 彭旋, 等.桂枝主要抑菌活性成分对柑橘青霉病菌的作用机制研究[J].现代食品科技, 2016, 32(10): 45-51.DOI:10.13982/j.mfst.1673-9078.2016.10.008.
[29]HU Yichen, ZHANG Jinming, KONG Weijun, et al.Mechanisms of antifungal and anti-aflatoxigenic properties of essential oil derived from turmeric (Curcuma longa L.) on Aspergillus flavus[J].Food Chemistry, 2017, 220: 1-8.DOI:10.1016/j.foodchem.2016.09.179.
[30]叶陈毅, 陈炜平, 赵翔, 等.丙酮酸激酶M2在肿瘤及骨关节炎发病中的作用[J].浙江医学, 2017, 39(22): 2053-2057.DOI:10.12056/j.is sn.1006-2785.2017.39.22.2017-2144.
[31]王志坤.酿酒酵母BY5419生产丙酮酸的定向进化及辅酶工程改造[D].济南: 山东大学, 2010: 23-24.DOI:10.7666/d.y1790924.
[32]PILANE M C, BAGLA V P, MOKGOTHO M P, et al.Free radical scavenging activity: antiproliferative and proteomics analyses of the differential expression of apoptotic proteins in MCF-7 cells treated with acetone leaf extract of Diospyros lycioides (Ebenaceae)[J].Evidence-Based Complementray and Alternative Medicine, 2015(12):534808.DOI:10.1155/2015/534808.
[33]ULTEE A, KETS E P, SMID E J.Mechanisms of action of carvacrol on the food-borne pathogen Bacillus cereus[J].Applied and Environmental Microbiology, 1999, 65(10): 4606-4610.DOI:10.1089/oli.1.1999.9.487.
[34]NING Y W, YAN A H, YANG K, et al.Antibacterial activity of phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J].Food Chemistry, 2017, 228: 533-540.DOI:10.1016/j.foodchem.2017.01.112.
[35]TANG Y L, SHI Y H, ZHAO W, et al.Interaction of MDpep9, a novel antimicrobial peptide from Chinese traditional edible larvae of housefly, with Escherichia coli genomic DNA[J].Food Chemistry,2009, 115(3): 867-872.DOI:10.1016/j.foodchem.2008.12.102.
[36]NYARKO E, HANADA N, HABIB A, et al.Fluorescence and phosphorescence spectra of Au(III), Pt(II) and Pd(II) porphyrins with DNA at room temperature[J].Inorganica Chimica Acta, 2004, 357(3):739-745.DOI:10.1016/j.ica.2003.08.023.
[37]陈奕鹏, 杨扬, 时涛, 等.内生真菌HND5挥发性物质组分分析及其抑菌作用测定[J].热带作物学报, 2017, 38(4): 689-694.DOI:10.3969/j.issn.1000-2561.2017.04.016.