姜黄素(curcumin,CCM)具有多种生理和药理活性,如抗氧化、抗肿瘤、抗人类免疫缺陷病毒作用、抗纤维化作用等,同时也是国内外广泛使用的天然食用色素[1]。CCM的耐热性好、安全性高[2],但CCM的水溶性很低(11 ng/mL、25 ℃)[3],紫外稳定性差[4],中性及碱性条件下易降解[5],跨膜转运率低[6]。这些缺陷不仅影响CCM生物活性的充分发挥,而且极大程度上限制了其在食品、保健品等领域的应用。
植物糖原(phytoglycogen,PG)是由α-1,4和α-1,6-糖苷键连接的、高度支化的可溶性α-D-葡聚糖,是一种具有“外紧内松”球型结构的天然纳米粒[7-8]。PG分子表面和内部存在大量的葡萄糖残基,可参与形成氢键,因此PG易溶于冷水或与其他物质相互作用。PG球型纳米粒的分子分散密度沿半径方向呈梯度变化,即由外至内的分子分散密度由大到小,这使得PG分子内部形成相对疏水的环境,有利于PG与极性较小的物质发生相互作用。
本课题组采用PG负载CCM,制备PG-CCM复合物,使CCM的表观溶解度提高了约2 700 倍;PG-CCM中CCM以无定形非晶体结构存在,氢键和疏水相互作用是二者结合的主要作用力[9]。基于上述成果,本实验着重考查了PG负载后CCM的紫外稳定性以及在不同pH值条件下的稳定性;同时,采用总还原力测定等方法研究了PG-CCM的抗氧化活性,采用噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测了PG-CCM对MCF-7和A549癌细胞的抑制活性。结合PG-CCM复合物中CCM的存在状态、PG与CCM相互作用力以及CCM的分布特征,探讨了负载前后以及不同复合物样品中CCM稳定性和生物活性变化的可能机制,PG负载对于改善CCM的稳定性和提高生物利用率具有重要意义。
1 材料与方法
1.1 材料与试剂
加强型甜玉米‘中甜8号’ 北京金农科种子科技有限公司。
C1386 CCM 美国Sigma公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 上海蓝季生物科技有限公司;DMEM培养基 美国HyClone公司;胎牛血清 江苏恩莫阿赛科技有限公司;胰消化酶 合肥Biosharp科技有限公司;A549细胞 国家实验细胞资源共享服务平台(北京总部);MCF-7细胞ATCC细胞库;其他试剂均为分析纯,购自天津市德恩化学试剂有限公司。
1.2 仪器与设备
L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;H2050高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Nano-ZS90型动态光散射激光粒度仪 英国马尔文仪器有限公司;紫外灯(253.7 nm) 江阴市飞扬器械有限公司;E191IR恒温培养箱 美国西蒙公司;CKX41SF倒置电子显微镜 日本OLYMPUS公司;SWCJ-2FD双人单面净化工作台 苏州净化设备有限公司;RS-232C酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 PG提取
提取方法参照Bi Lin等[10]报道并作适当修改。取‘中甜8号’玉米样品,经粉碎、冷水浸提后,调节pH值至4.8沉淀蛋白;离心收集上清液,4 ℃冰箱中静置沉淀淀粉;离心收集上清液,调节pH值至7,高温(121 ℃、20 min)处理。离心取上清液,加入3 倍体积乙醇沉淀PG,抽滤得到PG固体粉末。采用3,5-二硝基水杨酸法[11]测得PG中的还原糖质量分数为0.71%,采用考马斯亮蓝法[12]测得PG中的蛋白质量分数为0.12%。
1.3.2 PG负载CCM和负载特征分析
负载方法:分别配制质量分数1%、3%和5%的PG水溶液和4 mg/mL CCM乙醇溶液。取4.95 mL各质量分数的PG溶液,加入0.05 mL的CCM溶液,于摇床中振荡平衡(200 r/min、30 min);离心(10 000×g、15 min),弃去未溶的CCM沉淀,上清液即为PG-CCM复合物溶液。将部分上述溶液冻干成粉,于4 ℃冰箱中保存、备用。复合物因PG质量分数不同,分别记为1% PG-CCM、3% PG-CCM和5% PG-CCM。
负载能力分析:取PG-CCM复合物溶液1 mL,加入4 mL无水乙醇,离心(10 000×g、15 min)。收集上清液,采用分光光度法测定并计算CCM质量,检测波长为425 nm。按式(1)计算负载能力。
CCM分布特征分析:参照Ofokansi等[13]的方法并作适当修改。精确称取一定量不同种类的PG-CCM复合物,分别溶于去离子水中,使CCM质量浓度为20 μg/mL。每种样品取1 mL于离心管中,各两支。摇床振荡20 min(37 ℃、200 r/min);一个样品采用分光光度法测定样液中CCM质量浓度,记为ρA/(μg/mL);另一个经离心(10 000×g、15 min)后用来测定上清液中CCM质量浓度,记为ρB/(μg/mL)。按式(2)计算CCM负载于PG-CCM纳米粒表面的比例。
1.3.3 PG-CCM复合物纳米粒的粒径及表面电位测定
取1.3.2节中所得的PG-CCM复合物溶液,分别用蒸馏水稀释,使PG终质量浓度均为2 mg/mL;漩涡振荡混匀,采用Nano-ZS90型动态光散射激光粒度仪测定平均粒径、聚合物分散性指数(polymer dispersity index,PDI)和表面电位[8]。
1.3.4 PG-CCM复合物的稳定性分析
稳定性实验中,以PG/CCM物理混合物和CCM作为对照,PG/CCM物理混合物制备:将一定量的PG粉末和CCM混合均匀,使二者的质量比分别与1% PG-CCM、5% PG-CCM复合物相等,即得PG/CCM物理混合物。取一定量4 mg/mL CCM乙醇溶液加入去离子水,充分振荡,即得CCM在水中的分散液。实验期间每间隔一定时间取出一组样品,测定CCM质量浓度,计算保留率。
1.3.4.1 紫外稳定性测定
1)加速光解条件下的紫外稳定性:精确称取样品,平铺于25 mL烧杯底面,将烧杯置于紫外灯(30 W)下25 cm处照射。各复合物和相应物理混合物样品中CCM初始质量均为20 μg,CCM样品取5 µL 4 mg/mL CCM乙醇溶液于烧杯中,置于通风橱将乙醇挥干。分别在1、3、5、7、9、12 h各取一组测定CCM保留率,同时比较复合物和相应物理混合物在5 h时的紫外稳定性。2)贮藏条件下的紫外稳定性:精确称取样品,分别置于4 ℃避光、室温避光和室温不避光的环境中贮藏。PG-CCM复合物样品中CCM初始质量均为20 μg。120 d后测定CCM保留率。
1.3.4.2 酸碱稳定性测定
1)贮藏条件下的酸碱稳定性:5% PG-CCM复合物分别溶于pH 3.0~6.6的磷酸盐缓冲液中,置于4 ℃冰箱中。CCM初始质量浓度均为20 μg/mL。第10天和第20天各取一组样品测定CCM保留率。2)在体外模拟胃、肠液条件下的稳定性:按照Maltais等[14]所述方法分别配制不含消化酶的模拟胃液(pH 1.2)和肠液(pH 6.9、7.2)。将5% PG-CCM复合物分别溶于模拟胃、肠液中,同时将CCM和不同质量分数的PG-CCM复合物分别溶于肠液(pH 7.2)中,CCM初始质量浓度均为20 μg/mL,37 ℃水浴。第1、2、4、6、8、10、12小时各取一组样品测定CCM保留率。
1.3.4.3 CCM质量浓度及保留率的测定
1)CCM质量浓度的测定:标准曲线绘制:采用紫外分光光度法绘制CCM标准曲线,CCM质量浓度在0~7 μg/mL的范围内,CCM质量浓度与吸光度呈良好的线性关系,线性回归方程为y=0.172 1x+0.013 7(R2=0.999 7)。固体PG-CCM复合物和PG/CCM物理混合物样品CCM质量浓度测定:加入1 mL去离子水使之充分溶解,加无水乙醇4 mL混匀后离心(10 000×g、15 min),取上清液,测其在425 nm波长处的吸光度,计算CCM质量浓度。液体PG-CCM复合物样品CCM质量浓度测定:1 mL液体样品,加入4 mL无水乙醇,按同样方法测定吸光度并计算CCM质量浓度。固体CCM质量浓度测定:加入5 mL 80%乙醇,测定其吸光度并计算CCM质量浓度。液体CCM质量浓度测定:1 mL液体样品,加入4 mL无水乙醇,测定其吸光度并计算CCM质量浓度。
2)CCM保留率的测定及计算:不同时间点分别取出一组样品,测定该时刻CCM质量浓度,按式(3)计算CCM保留率。
1.3.5 PG-CCM复合物中CCM的释放分析
参照Xie Xiaoxia等[15]的方法并略作修改。按1.3.4.2节配制模拟胃、肠液。称取1%、5% PG-CCM冻干粉分别加入至模拟胃、肠液中,使CCM质量浓度为20 μg/mL。取1 mL于离心管中37 ℃水浴,每隔一定时间取出一组样品,离心(10 000×g、15 min)后,按1.3.4.3节所述方法测定上清液中CCM的质量浓度;按式(4)计算CCM在模拟胃、肠液中的释放率。
式中:ρA为0时刻样液中CCM的质量浓度/(μg/mL);ρB为t时刻经离心处理后上清液中CCM的质量浓度/(μg/mL)。
1.3.6 PG-CCM复合物的抗氧化活性分析
样品准备:分别配制CCM水分散液(按1.3.4节所述方法)、CCM乙醇溶液和PG-CCM水溶液3 组样品,并分别以去离子水、乙醇和相应质量分数的PG溶液为对照。
1.3.6.1 总还原力测定
总还原力检测参考Fan Jinling等[16]的方法并作适当修改:取0.5 mL样液,CCM质量浓度为0~70 μg/mL,加入1.5 mL的质量分数1%铁氰化钾溶液,水浴(50 ℃、20 min),取出冷却后,加入质量分数10%三氯乙酸溶液2.5 mL。取混合液2.5 mL,依次加入去离子水2.5 mL和质量分数0.1%三氯化铁溶液0.5 mL,充分混匀,静置10 min后,在700 nm波长处测定其吸光度。总还原力以样品吸光度与相应对照吸光度的差值表示。
1.3.6.2 ABTS阳离子自由基的清除活性测定
ABTS阳离子自由基的清除活性测定参考Li Gao等[17]的方法并作适当修改:将ABTS(7 mmol/L)和高硫酸钾(2.45 mmol/L)等体积混合均匀,室温避光静置14 h,生成ABTS工作液;用磷酸缓冲液(0.05 mol/L,pH 7.4)稀释至吸光度为0.70±0.02(734 nm)。取0.2 mL样品溶液于试管中,CCM质量浓度为0~30 μg/mL,加入3.8 mL ABTS工作液,漩涡混匀后,室温反应30 min,于734 nm波长处检测吸光度A样品。CCM水分散液和CCM乙醇溶液样品的空白对照分别为水和乙醇,PG-CCM样品的空白对照为对应质量浓度的PG溶液,测得吸光度为A空白。ABTS阳离子自由基的清除率按式(5)计算。
1.3.7 PG-CCM复合物对癌细胞抑制作用率测定
样品准备:将CCM分散至DMEM培养基中配制CCM悬浊液,记为CCM/H2O组;将CCM溶于二甲基亚砜(dimethylsulfoxide,DMSO)中配制1 mg/mL母液,用DMEM培养基稀释得到不同质量浓度样品(DMSO质量分数控制在1%),记为CCM/DMSO组;将PG-CCM复合物冻干粉复溶于DMEM培养基中配制不同质量浓度PG-CCM样品液,记为PG-CCM组;上述3 组样品浓度以CCM计,均为0~150 μmol/L。同时,将PG溶于DMEM培养基配制与PG-CCM组相同PG质量浓度的样品,记为PG组。
MCF-7细胞和A549细胞增殖的抑制作用:采用MTT法研究样品对MCF-7细胞和A549细胞增殖的抑制作用。MCF-7和A549细胞用含10%胎牛血清、100 U/mL双抗的DMEM培养基培养,在37 ℃、含5% CO2气体的恒温培养箱中培养至细胞铺满瓶底面积的80%;用胰酶消化后,以1×105 个/mL浓度接种至96 孔板,每孔200 μL,培养6 h。弃去旧培养基,加入200 μL新鲜培养基或样品液,继续培养24 h。弃去旧培养基,磷酸盐缓冲液清洗两次,每孔加入200 μL新鲜培养基和10 μL MTT(5 mg/mL),继续培养4 h。倒掉培养基中液体,吸掉泡沫,加150 μL DMSO反应10 min,酶标仪测定550 nm波长处样品孔吸光度,加MTT的样品孔吸光度记为A2,加等体积培养基的孔吸光度记为A1,不加MTT的孔为记A0,根据式(6)计算抑制率。PG-CCM组抑制率为扣除PG组抑制率之后的数据。
1.4 数据统计与分析
1.3.7 节实验重复6 次,其余所有实验重复3 次,结果以平均值±标准差表示;通过DPS软件采用单因素方差分析法比较各组结果间的差异显著性;用Origin 8.5软件作图。
2 结果与分析
2.1 PG-CCM复合物纳米粒的粒径、表面电位、负载能力和负载分布
PG的平均粒径约为71 nm,PDI小于0.2,呈电中性。以不同质量分数的PG负载CCM,得到1% PG-CCM、3% PG-CCM和5% PG-CCM 3 种复合物。3 种复合物的平均粒径、PDI及表面电位与PG相比无显著变化,彼此之间也无显著差异。但是,伴随载体PG质量分数的增大,负载能力及负载于纳米粒表面的CCM比例均显著下降,当PG质量分数由1%提高到5%时,负载能力由1.887 μg/mg下降为原来的32%,而纳米粒表面的负载比例则由37.5%减小到17.3%(表1)。
PG是一种天然存在的纳米粒[18],具有“外紧内松”的球型结构,即由内至外,分子分散密度由小至大,这使得其分子内部形成相对疏水的环境[7]。将CCM分散于PG的水溶液时,CCM由极性较大的微环境向PG的疏水区域转移[9],优先分布在PG的疏水内核中。载体PG质量分数较大,意味着提供了较多的内核空间,分布在内核的CCM比例高于PG质量分数较小载体。
上述研究结果表明,PG-CCM复合物是一种粒径分布均匀、呈电中性的纳米粒,CCM在纳米粒中的分布因载体质量分数而异。CCM在球形纳米粒载体PG中的分布特征会影响其稳定性、释放特性及生物活性。
表1 PG-CCM复合物的粒径、表面电位、负载能力和负载分布
Table 1 Average particle size, surface potential, loading capacity and loading distribution of PG-CCM complex

注:同列肩标小写字母不同表示差异显著(P<0.05)。表3同。
样品 平均粒径/nm PDI 表面电位/mV负载能力/(μg/mg)负载于纳米粒表面CCM比例/%PG 70.72±0.47a 0.131±0.020a -0.037±0.070a 1% PG-CCM 70.20±0.51a 0.131±0.002a -0.116±0.600a 1.887±0.063a 37.50±3.45a 3% PG-CCM 73.26±0.45a 0.138±0.017a -0.001±0.130a0.867±0.031b 30.20±2.04b 5% PG-CCM 75.32±0.26a 0.139±0.020a -0.037±1.220a 0.595±0.009c 17.30±3.08c
2.2 PG-CCM复合物的稳定性
2.2.1 PG-CCM复合物的紫外稳定性
CCM光敏性很强,主要降解产物为香草醛、香草酸和阿魏酸[19]等。Li等[1]报道了CCM暴露于紫外灯光下12 h后的损失率为50%。紫外线照射是一种最常见、有效且简单的灭菌方法;而贮藏过程中自然光条件下样品的稳定性则直接影响其货架期。紫外稳定性是CCM应用于食品等领域时需考虑的问题之一。
2.2.1.1 加速光解条件下的紫外稳定性

图1 紫外光照射条件下PG-CCM复合物中CCM的稳定性
Fig.1 Stability of encapsulated CCM in PG-CCM complex under UV irradiation
如图1所示,CCM表现出显著的光解不稳定性;与CCM相比,3 种PG-CCM复合物中CCM的降解速率均显著降低,保留率依次为:5% PG-CCM>3% PG-CCM>1% PG-CCM。为了探究复合物对CCM保护作用可能机制,实验进一步比较了PG-CCM复合物和相应物理混合物(PG/CCM)的紫外稳定性,从表2可看出,PG/CCM物理混合物中CCM保留率均显著高于相应的PG-CCM复合物。5 h时,CCM的保留率为24.90%,5% PG-CCM、1% PG-CCM复合物中CCM的保留率分别提高至79.42%和59.39%,而两种PG/CCM物理混合物CCM几乎不损失。
表2 紫外光照射条件下PG-CCM复合物、PG/CCM物理混合物中
CCM稳定性的比较
Table 2 Comparison of CCM stability in PG-CCM and PG/CCM physical mixtures under UV irradiation

注:大写字母不同表示各样品与CCM相比差异显著(P<0.05);小写字母不同表示相同质量分数的复合物与物理混合物之间差异显著(P<0.05)。
样品 CCM保留率/%CCM 24.90±0.92B 1% PG-CCM 59.39±0.11Ab 1% PG/CCM 100.26±0.69Aa 3% PG-CCM 71.27±0.98Ab 3% PG/CCM 99.08±0.68Aa 5% PG-CCM 79.42±0.84Ab 5% PG/CCM 98.46±1.44Aa
2.2.1.2 贮藏期间的紫外稳定性
贮藏温度和避光处理对不同PG-CCM复合物样品中CCM保留率的影响见表3。贮藏温度对所有PG-CCM复合物中CCM的保留率均无显著影响,但避光处理显著提高了所有PG-CCM复合物中CCM的保留率。在避光条件下,不同PG-CCM复合物的稳定性均较高,彼此无显著差异;在不避光条件下,不同PG-CCM复合物的稳定性差异显著,其保留率依次为5% PG-CCM(65.53%)>3% PG-CCM(48.79%)>1% PG-CCM(29.28%),与加速光解条件下的紫外稳定性研究结果相吻合。
表3 PG-CCM复合物在不同贮藏条件下的保留率(120 d)
Table 3 Retention rates of PG-CCM complex under different storage conditions (after 120 d)
%

注:同行肩标大写字母不同表示差异显著(P<0.05)。
样品 室温 4 ℃、避光避光 不避光1% PG-CCM 86.47±4.01abA 29.28±4.39cB 86.70±2.96abA 3% PG-CCM 95.16±2.13aA 48.79±2.36bB 93.70±3.25aA 5% PG-CCM 95.35±1.35aA 65.53±1.35aB 95.13±4.01aA
CCM被负载或包埋后,其紫外稳定性的变化屡有报道,但结果不一,其原因也未得到很好的解释。Li Jinglei等[2]用将CCM分散在Eudragit EPO聚合物中,制备得到Cur@EPO,CCM的紫外稳定性得到显著提高。Onoue等[20]利用乙酸琥珀酸羟丙基甲基纤维素制备了非晶固体分散体(ASD-Cur),其紫外稳定性显著下降。通常情况下,晶体状态下物质的稳定性优于无定形状态[20]。另一方面,CCM酚羟基氧原子的未成键电子,如果作为电子供体提供给自身分子的苯环,则CCM分子较稳定;相反,如果参与分子间氢键形成,CCM分子的稳定性就会被破坏[21]。本课题组前期研究表明:PG-CCM复合物中,CCM与PG通过分子间氢键相互作用,且由晶体状态转变为无定形状态[9]。本研究中,CCM的紫外稳定性可因载体PG的物理覆盖效应得到显著提高。但是,由于复合物中CCM的无定形状态以及CCM与PG之间的氢键作用,使得PG对CCM的保护作用在一定程度上被削弱。
不同PG-CCM复合物的紫外稳定性存在较大差异,这可能与CCM在载体PG中的分布不同有关。如上所述,载体质量分数越大,CCM分布于载体表面的比例越小,更多的CCM分布在纳米粒的内核中,从而提高了对CCM的保护作用。因此,本研究中5% PG-CCM的紫外稳定性优于1%~3% PG-CCM。
2.2.2 PG-CCM复合物的酸碱稳定性
CCM在pH 6.8及以上条件快速降解[5,22],Wang等[5]报道了当CCM在0.1 mol/L磷酸盐缓冲液和无血清培养基(pH值均为7.2)中37 ℃孵育30 min时,降解率约90%。CCM在食品加工过程以及在经人体胃、肠道消化时,均可能经历较宽范围内的pH值变化。本实验采用体外模型考察了不同种类PG-CCM复合物在模拟胃、肠液条件下的稳定性,同时研究了5% PG-CCM复合物在不同pH值环境条件下的贮藏稳定性。
2.2.2.1 PG-CCM复合物在体外模拟胃、肠液条件下的稳定性

图2 PG-CCM复合物在体外模拟胃、肠液条件下的稳定性
Fig.2 Stability of PG-CCM complex in SGF and SIF
如图2A所示,体外模拟胃液(pH 1.2)条件下,5% PG-CCM复合物中的CCM具有良好的稳定性,12 h的保留率高达97%;在模拟肠液条件下(pH 6.9和pH 7.2),CCM的降解速率明显提高,在pH 7.2模拟肠液中尤为明显;2 h和12 h时分别损失了18%和47%。在此基础上,进一步考查了不同质量分数PG-CCM复合物中CCM在pH 7.2模拟肠液条件下的稳定性,并与分散于模拟肠液中CCM的稳定性相比较,结果见图2B。在模拟肠液条件下,3 种PG-CCM复合物中CCM的降解模式与CCM存在明显差异,CCM在2 h内迅速降解,损失率约42%,之后几乎不再降解。3 种PG-CCM复合物均在监测的12 h内发生持续降解,前期降解速率及最终降解程度由低到高依次为5% PG-CCM<3% PG-CCM<1% PGCCM;其中,5% PG-CCM降解速率在整个实验期间均低于CCM,明显提高了CCM的酸碱稳定性。
PG-CCM和CCM在肠液条件下表现出不同的降解趋势,这一现象可能是CCM的存在状态不同造成的。在CCM的固体分散液(20 μg/mL)中,由于CCM水中的溶解度远低于1 μg/mL[4,23];因此,CCM除以极少量游离态分子存在外,大部分分子因相互作用彼此聚集,形成纳米粒或生成结晶沉淀[2,24-25]。不同存在状态的CCM分子稳定性有极大差异,Li Bin等[22]报道了结晶态CCM分子的降解速率远低于溶液中游离的CCM分子。本实验中,在最初的2 h内,溶解状态的游离分子或聚集较少分子纳米粒中的CCM分子发生快速降解;随后体系中的CCM主要以结晶或沉淀形式存在,不容易发生降解。因此,CCM总体降解规律表现为前期快速降解,后期维持稳定。在PG-CCM体系中,CCM由于与PG相互作用,主要以分子状态存在,不发生结晶或沉淀;因此,其降解规律表现为降解速率持续下降。5% PG-CCM降解速率在12 h监测时间内均低于CCM,而3% PG-CCM在监测前4 h内降解速率也低于CCM,对CCM起到较好的保护作用,有利于CCM在肠道的吸收。
2.2.2.2 5% PG-CCM复合物贮藏期间的酸碱稳定性
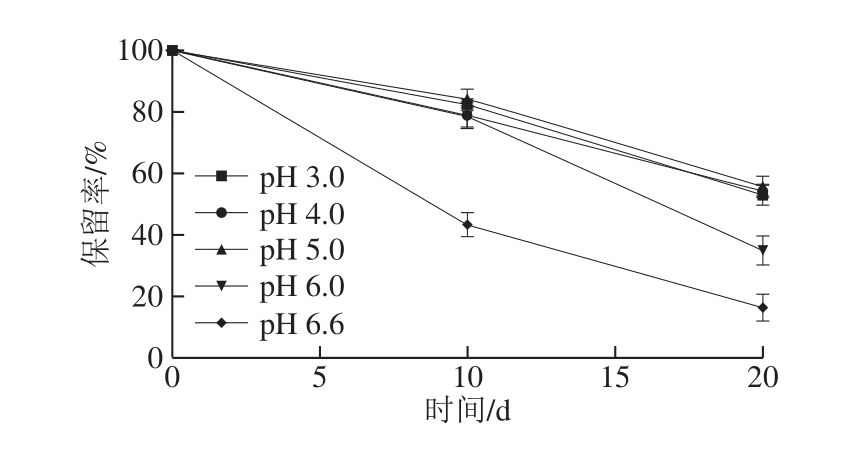
图3 5%PG-CCM复合物在不同pH值条件下的贮藏稳定性
Fig.3 Stability of 5% PG-CCM complex under different pH conditions during storage
由图3可知,随贮藏时间延长,不同pH值条件下5% PG-CCM复合物中CCM的保留率均呈显著下降趋势;20 d时,pH 3.0~5.0之间,CCM保留率差异不明显,约为52%~55%;而pH 6.0和pH 6.6时的保留率明显降低,仅分别为34.91%和16.30%。表明PG-CCM适宜保存在较低pH值的环境中。
2.3 PG-CCM复合物中CCM在胃、肠液环境下的释放率
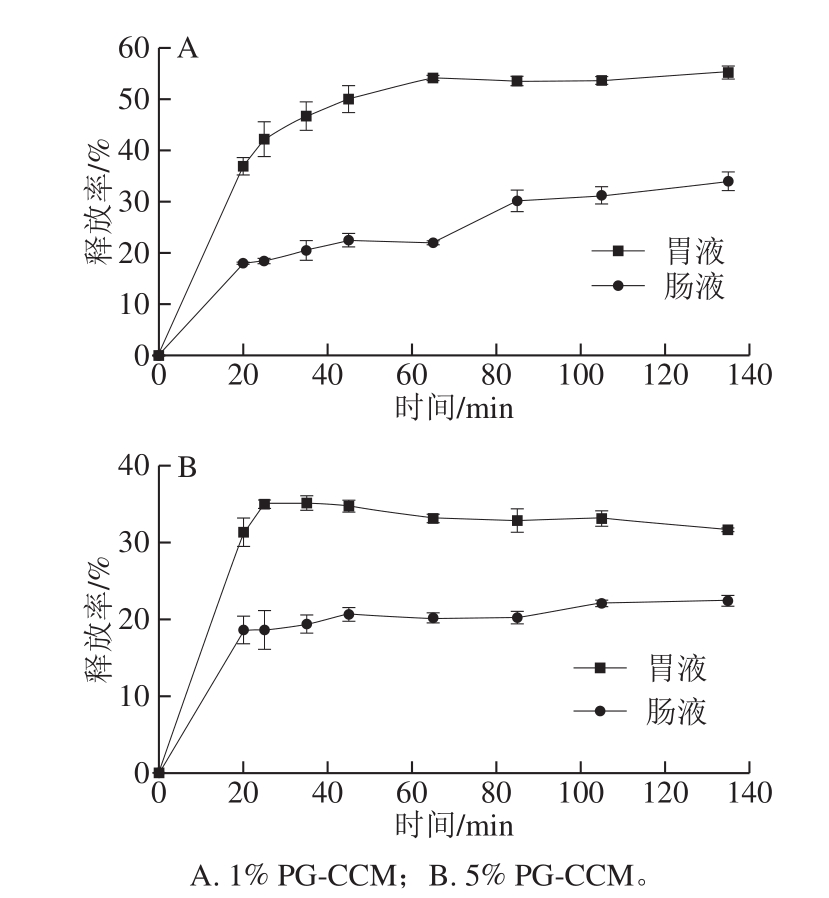
图4 PG-CCM复合物在体外模拟胃、肠液中的释放
Fig.4 Kinetic release profiles of encapsulated CCM from PG-CCM complex in SGF and SIF
1% PG-CCM、5% PG-CCM在体外模拟胃、肠液环境中的释放动力学结果如图4所示,两种复合物中CCM的释放特征明显不同:1% PG-CCM复合物中CCM在胃、肠液环境下的释放均表现出“前期突释(0~20 min)、随后持续释放(20 min以后)”的两相特征,且在胃液中的释放率明显高于肠液。20 min时,在胃、肠液的释放率分别达到36.8%和17.8%,而后释放率逐渐增长,至135 min时分别为55.1%和33.9%。5% PG-CCM复合物中CCM在胃、肠液中的释放也存在“前期突释”(0~20 min)现象,但随后释放率在整个实验期间不再增长,保持在15%~20%左右。两种复合物相比,1% PG-CCM复合物中CCM在胃液和肠液中的释放率均显著高于5% PG-CCM。
“突释”部分的CCM通常被认为负载在载体表面,随后持续释放的CCM则代表结合在载体内核中[13,26]。1% PG-CCM复合物中负载于纳米粒表面的比例远高于5% PG-CCM,因此“突释量”更高;随后释放的CCM可认为是从纳米粒内核逐渐向表面转移并释放到介质中。氢键是PG和CCM相互作用的主要作用力之一[9],而pH值影响分子间的氢键作用[2,4,27];因此,本研究中模拟胃、肠液pH值的差异是影响PG-CCM中CCM释放量不同的主要原因。Gangurde等[4]报道了与本研究相类似的CCM释放现象。
2.4 PG-CCM复合物的生物活性
2.4.1 抗氧化活性
分散于水中的CCM总还原力较小,且对ABTS阳离子自由基几乎无清除活性。溶于乙醇的CCM总还原力提高,且表现出较强的ABTS阳离子自由基清除活性。3 种PG-CCM复合物的总还原力和ABTS阳离子自由基清除活性均高于CCM(无论是分散在水中或溶解于乙醇中)。不同的PG-CCM复合物相比,总还原力和ABTS阳离子自由基清除活性差异均明显,但规律相反:总还原力为1% PG-CCM>3%PG-CCM>5%PG-CCM(图5A),而对ABTS阳离子自由基清除能力依次为5% PG-CCM>3% PG-CCM>1% PG-CCM(图5B)。
CCM分子结构中的酚羟基和共轭双键使其具有很强的抗氧化活性。但是,CCM的水溶性低,其在水基质中的抗氧化活性较差,在有机溶剂中的抗氧化活性往往高于分散于水的情况[28-29]。本实验的研究结果也证实了这一点。本研究同时表明经PG负载后,CCM的抗氧化活性得到进一步提高。这可能与下面两个因素有关:1)PG-CCM在水中具有良好的分散性;2)PG的纳米粒结构提供了极大的外表面积。以上两方面因素均有利于在水相发生的反应。类似的现象已见文献[28-30]报道,如Chang Chao等[28]报道了果胶包被的酪蛋白酸钠/玉米醇溶蛋白复合物负载的CCM对ABTS阳离子自由基的清活性显著高于溶于乙醇或分散于水中的CCM。
值得注意的是,不同的PG-CCM复合物对ABTS阳离子自由基的清除活性表现出的规律与稳定性相吻合,即载体质量分数越高,CCM的活性越强。但是,总还原力表现出的规律则正好相反。还原力测定中所用的氧化剂铁氰化物无法透过疏水区域,因此广泛用于测定暴露在水介质中的还原性基团[30-31]。本研究中,载体PG质量分数越大,CCM分布在PG疏水内核中的比例越高,分布于表面的CCM越少。铁氰化物无法透过PG表面进入到疏水的内核中与之反应,因此表现出较低的还原力。
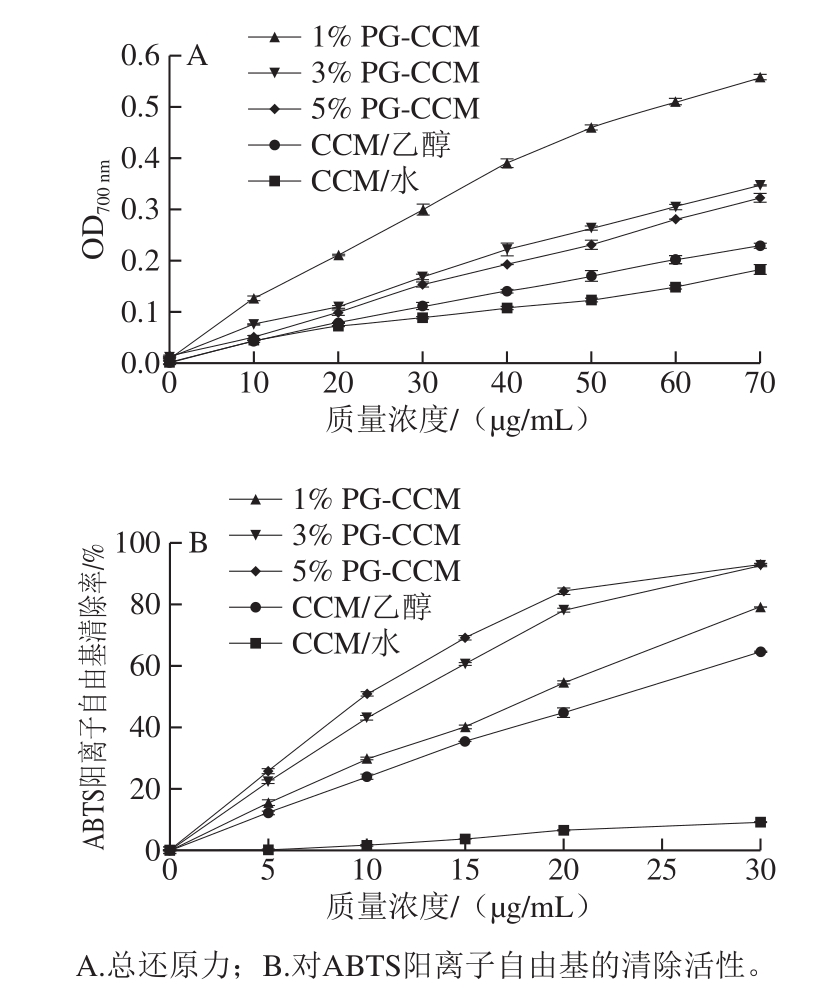
图5 PG-CCM复合物的抗氧化活性
Fig.5 Antioxidant activity of PG-CCM complex
2.4.2 对癌细胞抑制作用
CCM具有抑制结肠癌细胞、口腔鳞癌细胞、肺癌细胞、人胰腺癌、肾癌细胞[32]等多种癌细胞增殖的作用。本实验研究比较了CCM/H2O组、CCM/DMSO组和1% PG-CCM、5% PG-CCM组对A549 和MCF-7细胞增殖的抑制作用,结果如图6所示。

图6 PG和CCM对A549和MCF-7细胞的抑制作用
Fig.6 Cytotoxicity of PG on A549 and MCF-7 and cytotoxicity of PGCCM on A549 and MCF-7
PG对两种细胞的抑制率均小于15%,表明其对癌细胞生长的影响可忽略不计(图6A)。如图6B、C所示,CCM/H2O对上述两种癌细胞的抑制作用较小,并且仅在很低的浓度范围呈现剂量依赖关系;当浓度超过某一值后(A549为40 μmol/L,MCF-7为20 μmol/L),抑制率不再发生明显变化,维持在较低水平。CCM/DMSO组对两种细胞均表现出很强的抑制作用,且具有良好的剂量依赖性;其中,对MCF-7的抑制作用更显著。两种PG-CCM复合物对癌细胞的抑制率在多数浓度条件下都明显高于CCM/H2O。1% PG-CCM对两种癌细胞的抑制作用均优于5% PG-CCM,其中对A549的抑制作用在浓度大于60 μmol/L时,与CCM/DMSO无明显差异。
如上所述,CCM水溶性低,达到饱和浓度后,继续增大CCM在水中的量,溶解于水中的CCM分子数量并不会因此增加,故对癌细胞的抑制作用也就不再增强。DMSO和PG负载对CCM均起到增加溶解度的作用,可以提供更多的游离CCM分子与癌细胞接触,因此提高了对癌细胞的抑制作用。与5% PG-CCM复合物相比,更大比例的CCM分布于1% PG-CCM复合物纳米粒的表层;一方面有利于与癌细胞直接接触,另一方面有利于释放,因此对癌细胞的抑制作用也更突出。
3 结 论
CCM负载于PG后的紫外稳定性、抗氧化活性及癌细胞抑制活性均显著增强。PG-CCM制备时使用的PG浓度极大影响CCM的负载特征、释放曲线、CCM的稳定性以及生物活性。5% PG-CCM复合物的紫外稳定性和酸碱稳定性均显著优于1% PG-CCM,其中5% PG-CCM与CCM相比,显著提高了CCM的酸碱稳定性。1% PG-CCM在胃液和肠液中的释放率和对两种癌细胞的抑制作用均高于5% PG-CCM。两种复合物稳定性、释放特性及生物活性的差异与CCM在PG中的分布状态有关。
[1]LI J L, SHIN G H, LEE I W, et al.Soluble starch formulated nanocomposite increases water solubility and stability of curcumin[J].Food Hydrocolloids, 2016, 56: 41-49.DOI:10.1016/j.foodhyd.2015.11.024.
[2]LI Jinglei, LEE I W, SHIN G H, et al.Curcumin-Eudragit® E PO solid dispersion: a simple and potent method to solve the problems of curcumin[J].European Journal of Pharmaceutics and Biopharmaceutics, 2015, 94: 322-332.DOI:10.1016/j.ejpb.2015.06.002.
[3]KAMINAGA Y, NAGATSU A, AKIYAMA T, et al.Production of unnatural glucosides of curcumin with drastically enhanced water solubility by cell suspension cultures of Catharanthus roseus[J].FEBS Letters, 2003, 555(2): 311-316.DOI:10.1016/S0014-5793(03)01265-1.
[4]GANGURDE A B, KUNDAIKAR H S, JAVEER S D, et al.Enhanced solubility and dissolution of curcumin by a hydrophilic polymer solid dispersion and its in silico molecular modeling studies[J].Journal of Drug Delivery Science and Technology, 2015, 29: 226-237.DOI:10.1016/j.jddst.2015.08.005.
[5]WANG Y J, PAN M H, CHENG A L, et al.Stability of curcumin in buffer solutions and characterization of its degradation products[J].Journal of Pharmaceutical & Biomedical Analysis, 1997, 15(12):1867-1876.DOI:10.1016/S0731-7085(96)02024-9.
[6]FARALLI A S E A.In vitro permeability enhancement of curcumin across Caco-2 cells monolayers using electrospun xanthanchitosan nanofibers[J].Carbohydrate Polymers, 2018, 206: 38-47.DOI:10.1016/j.carbpol.2018.10.073.
[7]HUANG L, YAO Y.Particulate structure of phytoglycogen nanoparticles probed using amyloglucosidase[J].Carbohydrate Polymers, 2011, 83(4):1665-1671.DOI:10.1016/j.carbpol.2010.10.030.
[8]SCHEFFLER S L, WANG X, HUANG L, et al.Phytoglycogen octenyl succinate, an amphiphilic carbohydrate nanoparticle, and ε-polylysine to improve lipid oxidative stability of emulsions[J].Journal of Agricultural and Food Chemistry, 2010, 58(1): 660-667.DOI:10.1021/jf903170b.
[9]王攀, 樊金玲, 杨亚培, 等.植物糖原负载提高姜黄素溶解度[J].食品科学, 2019, 40(12): 30-36.DOI:10.7506/spkx1002-6630-20180614-254.
[10]BI Lin, YANG Lei, BHUNIA A K, et al.Carbohydrate nanoparticlemediated colloidal assembly for prolonged efficacy of bacteriocin against food pathogen[J].Biotechnology & Bioengineering, 2011,108(7): 1529-1536.DOI:10.1002/bit.23099.
[11]赵凯, 许鹏举, 谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学, 2008, 29(8): 534-536.DOI:10.3321/j.issn:1002-6630.2008.08.127.
[12]李娟, 张耀庭, 曾伟, 等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志, 2000, 13(2): 118-120.DOI:10.3969/j.issn.1004-5503.2000.02.018.
[13]OFOKANSI K, WINTER G, FRICKER G, et al.Matrix-loaded biodegradable gelatin nanoparticles as new approach to improve drug loading and delivery[J].European Journal of Pharmaceutics and Biopharmaceutics, 2010, 76(1): 1-9.DOI:10.1016/j.ejpb.2010.04.008.
[14]MALTAIS A, REMONDETTO G E, SUBIRADE M.Soy protein cold-set hydrogels as controlled delivery devices for nutraceutical compounds[J].Food Hydrocolloids, 2009, 23(7): 1647-1653.DOI:10.1016/j.foodhyd.2008.12.006.
[15]XIE Xiaoxia, TAO Qing, ZOU Yina, et al.PLGA nanoparticles improve the oral bioavailability of curcumin in rats: characterizations and mechanisms[J].Journal of Agricultural and Food Chemistry, 2011,59(17): 9280-9289.DOI:10.1021/jf202135j.
[16]FAN Jinling, ZHU Wenxue, KANG Huaibin, et al.Flavonoid constituents and antioxidant capacity in flowers of different Zhongyuan tree penoy cultivars[J].Journal of Functional Foods, 2012,4(1): 147-157.DOI:10.1016/j.jff.2011.09.006.
[17]LI Gao, MIN B S, ZHENG Changji, et al.Neuroprotective and free radical scavenging activities of phenolic compounds from Hovenia dulcis[J].Archives of Pharmacal Research, 2005, 28(7): 804-809.DOI:10.1007/BF02977346.
[18]POWELL P O, SULLIVAN M A, SWEEDMAN M C, et al.Extraction,isolation and characterisation of phytoglycogen from su-1 maize leaves and grain[J].Carbohydrate Polymers, 2014, 101: 423-431.DOI:10.1016/j.carbpol.2013.09.061.
[19]MOHANTY C, DAS M, SAHOO S K.Emerging role of nanocarriers to increase the solubility and bioavailability of curcumin[J].Expert Opinion on Drug Delivery, 2012, 9(11): 1347-1364.DOI:10.1517/17425247.2012.724676.
[20]ONOUE S, TAKAHASHI H, KAWABATA Y, et al.Formulation design and photochemical studies on nanocrystal solid dispersion of curcumin with improved oral bioavailability[J].Journal of Pharmaceutical Sciences,2010, 99(4): 1871-1881.DOI:10.1002/jps.21964.
[21]TONNESEN H H, MASSON M, LOFTSSON T.Studies of curcumin and curcuminoids.XXVII.cyclodextrin complexation: solubility,chemical and photochemical stability[J].International Journal of Pharmaceutics, 2002, 244(1/2): 127-135.
[22]LI Bin, KONECKE S, WEGIEL L A, et al.Both solubility and chemical stability of curcumin are enhanced by solid dispersion in cellulose derivative matrices[J].Carbohydrate Polymers, 2013, 98(1):1108-1116.DOI:10.1016/j.carbpol.2013.07.017.
[23]ADITYA N P, YANG H, KIM S, et al.Fabrication of amorphous curcumin nanosuspensions using β-lactoglobulin to enhance solubility,stability, and bioavailability[J].Colloids and Surfaces B: Biointerfaces,2015, 127: 114-121.DOI:10.1016/j.colsurfb.2015.01.027.
[24]HE Y, HUANG Y B, WANG W T, et al.Integrating micromixer precipitation and electrospray drying toward continuous production of drug nanoparticles[J].Chemical Engineering Journal, 2011, 168(2):931-937.DOI:10.1016/j.cej.2011.01.092.
[25]ZHENG Z, ZHANG X, CARBO D, et al.Sonication-assisted synthesis of polyelectrolyte-coated curcumin nanoparticles[J].Langmuir, 2010,26(11): 7679-7681.DOI:10.1021/la101246a.
[26]THONG P Q, NGUYEN H N, PHUC N X, et al.Impact of PLA/PEG ratios on curcumin solubility and encapsulation efficiency, size and release behavior of curcumin loaded poly(lactide)-poly(ethylenglycol)polymeric micelles[J].International Journal of Drug and Deliverly,2014, 6(3): 279-285.
[27]JIN S P, LIU M Z, ZHANG F, et al.Synthesis and characterization of pH-sensitivity semi-IPN hydrogel based on hydrogen bond between poly(N-vinylpyrrolidone) and poly(acrylic acid)[J].Polymer, 2006,47(5): 1526-1532.DOI:10.1016/j.polymer.2006.01.009.
[28]CHANG Chao, WANG Taoran, HU Qiaobin, et al.Pectin coating improves physicochemical properties of caseinate/zein nanoparticles as oral delivery vehicles for curcumin[J].Food Hydrocolloids, 2017,70: 143-151.DOI:10.1016/j.foodhyd.2017.03.033.
[29]PAN K, ZHONG Q, BAEK S J.Enhanced dispersibility and bioactivity of curcumin by encapsulation in casein nanocapsules[J].Journal of Agricultural and Food Chemistry, 2013, 61(25): 6036-6043.DOI:10.1021/jf400752a.
[30]TAN C, XIE J, ZHANG X, et al.Polysaccharide-based nanoparticles by chitosan and gum arabic polyelectrolyte complexation as carriers for curcumin[J].Food Hydrocolloids, 2016, 57: 236-245.DOI:10.1016/j.foodhyd.2016.01.021.
[31]XIA S, XU S, ZHANG X, et al.Effect of coenzyme Q10 incorporation on the characteristics of nanoliposomes[J].The Journal of Physical Chemistry B, 2007, 111(9): 2200-2207.DOI:10.1021/jp066130x.
[32]DOELLO K, QUESADA R Q, ALVAREZ P, et al.Latest in vitro and in vivo assay, clinical trials and patents in cancer treatment using curcumin: a literature review[J].Nutrition & Cancer, 2018, 70(4): 1-10.DOI:10.1080/01635581.2018.1464347.