病原微生物是新世纪以来食品安全中面临的重大威胁[1-3],尤其是生鲜食品文化的兴起,为保证食品安全同时满足人们对于食品健康的追求,现有研究已证明天然产物具有优异的抑菌性能[4-5],天然抑菌剂的开发越来越受人们重视[6-8]。二氢杨梅素(dihydromyricetin,DMY)是一种多酚羟基双氢黄酮醇,是黄酮类物质。广泛存在于藤茶中,具有抗菌[9-10]、抗氧化[11-12]、防腐[13]等多种活性,可替代成为新型的天然抗菌剂、抗氧化剂和防腐剂,在食品行业中的应用有很好的前景,但其稳定性差和水难溶性限制了其应用推广。Ag+是典型的广谱金属离子抑菌剂,主要原因是它极易被还原(氧化还原电位低、离子化倾向高),而且与有机物官能团反应力强,但是过量的Ag+对于机体的正常细胞也会产生破坏和影响,所以GB 5749—2006《生活饮用水卫生标准》中规定其质量浓度不能超过50 μg/L[14-15],而此限量并不能完全抑制食品中的细菌,无法起到食品保质的作用。基于此,本实验提出构建DMY-Ag+纳米乳液体系,以期解决DMY水难溶性不稳定的问题,并通过协同作用提高体系的抑菌性能,弥补Ag+添加量限制的缺陷,为天然抑菌剂的开发提供新思路和新方法。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌ATCC6538 广东省微生物菌种保存中心;DMY(纯度≥98%) 贵州苗药生物有限公司;硝酸银(分析纯、纯度≥99.8%)、3,5-二硝基水杨酸(纯度≥98%)、酒石酸钾钠(分析纯、纯度≥99%)、苯酚(分析纯)、无水亚硫酸钠(分析纯、纯度≥98%) 上海麦克林生化科技有限公司;营养琼脂、LB肉汤 广东环凯微生物科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 天津大茂化学试剂公司;硝基氯化碘(iodonitrotetrazolium chloride,INT)(分析纯、纯度≥98%) 上海源叶生物科技有限公司。
1.2 仪器与设备
FP-1100-C全自动生长曲线仪 芬兰Bioscreen公司;HT 7700透射电子显微镜 日本日立仪器设备有限公司;UV-1800PC紫外-可见分光光度计 上海美谱达仪器有限公司;Bante 901电导率仪 上海邦特仪器有限公司。
1.3 方法
1.3.1 菌种活化和菌悬液的制备
金黄色葡萄球菌保存在4 ℃的营养琼脂(含质量分数2% NaCl,下同)斜面上,实验前在37 ℃下培养24 h进行活化。活化后的菌体接种于营养琼脂培养基中,取3~5接种环接入LB肉汤培养基(含2% NaCl)在37 ℃下气浴摇床(100 r/min)中培养24 h。菌悬液的菌体浓度调整至104~108 CFU/mL用于各项实验。
1.3.2 DMY梯度浓度溶液的制备
0.1 g DMY溶解于5 mL体积分数为20%的乙醇溶液中,然后用蒸馏水将DMY的醇溶液2 倍稀释至10、5、2.5、1.25、0.625、0.313、0.156、0.078、0 mg/mL系列梯度。
1.3.3 DMY对金黄色葡萄球菌最低抑菌浓度的确定
使用3 种方法(生长曲线、抑菌圈直径与平板计数)确定DMY对金黄色葡萄球菌的最低抑菌浓度(minimum inhibitory concentration,MIC)。全自动生长曲线能够准确记录活菌数随着时间变化的变化,在600 nm波长处的吸收强度代表活菌数量,因此可使用全自动生长曲线仪记录DMY对于金黄色葡萄球菌体的生长抑制[16]。将0.1 mL的菌悬液(106 CFU/mL)与0.9 mL的DMY处理液在试管中混合后置于37 ℃下气浴摇床(150 r/min)中处理5 min,然后取300 μL处理后的混合液与100 μL LB肉汤培养基滴加于孔板的测试小孔中,用全自动生长曲线仪每1 h记录1 次小孔的生长情况,直至20 h停止。与空白组对比可以得出各个质量浓度的DMY对于金黄色葡萄球菌的抑制能力。
抑菌圈直径是检测DMY对于金黄色葡萄球菌的MIC比较直观的方法[17]。将菌悬液(104 CFU/mL)与营养琼脂(冷却至45 ℃)以1∶50的比例混合均匀,然后倒15 mL至培养皿中使其在室温下凝固。凝固后用牛津杯在每个培养基中打出3 个6 mm直径的小孔,然后向每个小孔分别注入浓度梯度的DMY处理液与培养基表面持平。培养基在5~10 ℃下存放1 h使处理液充分扩散至培养基中,接着培养基在37 ℃下培养24 h后测量抑菌圈直径。
平板计数是用来确定DMY对于金黄色葡萄球菌的MIC重要的传统方法[18]。将0.1 mL菌悬液(106 CFU/mL)与0.9 mL的DMY处理液在试管中混合后置于37 ℃下气浴摇床(150 r/min)中处理5 min,然后取0.1 mL处理后的混合液滴加在灭菌的琼脂培养基表面并涂布均匀,进行3 次平行,在37 ℃下孵育10 h,然后进行计数。
此3 种方法同样用于确定DMY-Ag+纳米乳液的抑菌效果。
1.3.4 DMY-Ag+纳米乳液的制备及表征
因为DMY的水难溶性限制了其在食品工业中的应用,所以一个稳定的纳米乳液系统能够提高其在水溶液体系中的含量。首先将15 mL DMY的醇溶液(体积分数20%)与10 mL吐温-80(体积分数10%)水溶液在磁力搅拌器中均匀搅拌5 min,然后缓慢滴加25 mL AgNO3(50 μg/L)水溶液,继续搅拌10 min。最后得到纳米乳液组成为1.25 mg/mL DMY+50 μg/L Ag+。使用紫外-可见分光光度计进行全波长扫描研究纳米乳液的组装方式,用HT 7700透射电子显微镜观测乳液的形态和尺寸。将一滴纳米乳液滴在铜网上在37 ℃下隔夜干燥后进行观察。
1.3.5 电导率的测定
菌悬液中电导率变化可以反映菌体胞壁和胞膜的破损和通透性变化。1 mL菌悬液(106 CFU/mL)与5 mL处理液在37 ℃下气浴摇床(150 r/min)中培养12 h,以蒸馏水作为空白对照,测定处理前后的菌悬液中电导率。
1.3.6 核酸与蛋白质泄漏的测定
将2 mL菌悬液(106 CFU/mL)与10 mL处理液混合在37 ℃下气浴摇床(150 r/min)中培养10 h,以蒸馏水作为空白对照,每隔2 h取样1 mL,5 478.2×g离心5 min后用紫外-可见分光光度计测定上清液在260 nm[19]和280 nm[20]波长处的OD值。
1.3.7 还原糖释放的测定
将1 mL菌悬液(106 CFU/mL)加入到5 mL处理液中,然后混合8 h并且每隔2 h测试一次。每次测试前,将菌悬液5 478.2×g离心5 min后收集0.5 mL上清液在一根试管中,向试管加入0.5 mL 3,5-二硝基水杨酸后沸水浴5 min。沸水浴后待其冷却,向试管中加入4 mL蒸馏水,用紫外-可见分光光度计测定其在540 nm波长处的OD值[21]。
1.3.8 呼吸链脱氢酶活性的测定
用20 mL蒸馏水将斜面培养的菌体刮下,每根试管分装2 mL后2 795×g离心10 min,去掉上清液后用生理盐水清洗,然后与1 mL处理液混合培养1 h。阳性对照组(空白组用无菌水处理)和阴性对照组(用沸水加热处理20 min杀死菌体)按同样的操作条件。培养结束后,菌悬液11 180×g离心15 min并丢弃上清液,沉淀用生理盐水清洗。然后向每根试管中加入0.9 mL PBS和0.1 mL INT混合后在室温中避光暗处理1 h。暗处理后用紫外-可见分光光度计测定其在490 nm波长处的OD值[22]。
1.3.9 细胞形态观察
使用透射电子显微镜观察金黄色葡萄球菌细胞形态的变化。处理液处理后,菌悬液11 180×g离心10 min丢弃上清液,接着将戊二醛(体积分数2.5%)加入到试管中固定细胞6 h,固定结束后用PBS洗涤并11 180×g离心3 min,然后用乙醇溶液梯度洗脱,洗脱完毕后重悬并滴在铜网上,在37 ℃下隔夜干燥后进行观察。
1.4 数据统计与分析
使用OriginPro 9.1软件对所收集数据进行统计和方差分析,并根据数据结果进行绘图。
2 结果与分析
2.1 DMY对金黄色葡萄球菌MIC的确定
由图1可知,加入DMY处理后的金黄色葡萄球菌生长曲线在前5 h都表现出不同程度的生长迟滞,20 h的生长结束后对比于经DMY处理的其他各组,菌体在600 nm波长处的OD值都有所降低,说明不同质量浓度的DMY均对金黄色葡萄球菌表现出了一定的抑制,并且抑制效果随着DMY质量浓度的增加而增强。当所处理的DMY质量浓度高于0.625 mg/mL时,600 nm波长处的OD值跳跃式下降并接近于0.2,所以判断1.25 mg/mL为DMY对于金黄色葡萄球菌的MIC。

图1 DMY处理后金黄色葡萄球菌600 nm波长处的生长曲线
Fig.1 Growth curves of Staphylococcus aureus at 600 nm after DMY treatment
为进一步确定DMY对于金黄色葡萄球菌的MIC,使用传统的抑菌圈和平板计数法。抑菌圈实验结果显示,当DMY的质量浓度低于1.25 mg/mL时在培养基中没有出现明显的抑菌圈或不可测量;而从平板的结果中也可以看出当DMY的质量浓度低于1.25 mg/mL时培养基上的菌落数较大,所以结合生长曲线的结果确认1.25 mg/mL为DMY对金黄色葡萄球菌的MIC,研究发现DMY对于副溶血性弧菌的MIC为0.625 mg/mL[23],结合对其他菌的抑制效果研究[24-26],可以看出DMY的抑菌性较强并且为广谱抑菌。
2.2 DMY-Ag+纳米乳液的表征结果
经测定,DMY-Ag+纳米乳液表观性质为:pH 6.6、吐温-80体积分数2%、4 500 r/min离心15 min后无分层或浑浊、粒径200 nm。纳米乳液的pH值偏中性,这对于市面上常见的酸性防腐剂是一个比较好的补充。
DMY-Ag+乳液是稳定分散的圆球形液滴(图2a)、并无团聚,表观性质测定结果也说明乳液具有很好的离心稳定性,这对于解决DMY在水溶液体系中的难溶性问题有很好的启示作用。可以看到每一个乳液球滴都是由一个外圈加内核的形态构成,推测Ag+在外形成了一层亲水层,通过表面活性剂将DMY包埋在内层,使DMY稳定在水相体系中。乳液微观形态模拟图(图2b),与王嘉军[27]制备的蜂胶-银离子复合纳米乳剂理论相似。

图2 纳米乳液的透射电子显微镜图与模拟图
Fig.2 Transmittance electron microscopic observation and simulation of nanoemulsion
制备的DMY-Ag+乳液呈乳黄色,经过光照或长时间存放后颜色稳定(图3),而直接螯合的DMY-Ag+配合物则因被氧化由黄色转变成红棕色,这与Ameen等[28]所制得的DMY介导Ag+配合物现象一致;全波长扫描发现乳液与DMY、Ag+纯物质对比并没有出现新的峰,说明本实验制备所得乳液并非直接化学键螯合,并且乳液的性质要比螯合物稳定。

图3 DMY-Ag  乳液与DMY-Ag
乳液与DMY-Ag  螯合对比
螯合对比
Fig.3 Comparison of DMY-Ag+ emulsion with DMY-Ag+ chelate
2.3 DMY-Ag+乳液对金黄色葡萄球菌生长曲线的影响
各处理液对于金黄色葡萄球菌的生长情况影响如图4所示,相对于空白组,各组处理液都表现出比较强的抑制生长情况,前4 h出现了生长迟滞,并且可以看出DMY-Ag+乳液几乎完全抑制了金黄色葡萄球菌的生长,实验结果表明乳液相对于单种抑菌处理液达到了较好的协同抑制效果。

图4 不同处理液处理后金黄色葡萄球菌在600 nm波长处生长曲线
Fig.4 Growth curves of Staphylococcus aureus at 600 nm after treatment with different agents
为了进一步确定纳米乳液的协同效果,使用传统的抑菌圈直径和平板计数的方法分析抑菌效果。从抑菌圈直径可以看出,纳米乳液抑菌圈直径达到5.25 mm,DMY抑菌圈直径为4.05 mm,而Ag+处理组与空白组有较多的菌落生长并无清晰可见的抑菌圈。平板计数结果的规律与前面2 种方法所测得的结果也比较符合,并且纳米乳液相对于空白组菌落总数减少了4.385(lg(CFU/mL)),所以纳米乳液达到很好的协同作用。
2.4 DMY-Ag+乳液对金黄色葡萄球菌细胞壁膜通透性的影响
菌悬液在260 nm以及280 nm波长处的吸收峰在加入处理液后2~6 h增加并在之后保持稳定(图5a、b),核酸和蛋白质释放的时间关联过程表明有可能是因为细胞膜的损伤增加导致细胞内容物的向外泄漏。图5c、d则进一步确认细胞中的离子与还原糖也在扩散到菌悬液中,因此认为这些处理液改变了部分或全部的细胞壁膜的渗透性质,使得其失去生物选择透过的功能,同时根据内容物外泄的程度可以看出DMY-Ag+乳液对于金黄色葡萄球菌的细胞壁膜破坏最大。熊伟等[29]研究认为DMY对于金黄色葡萄球菌细胞壁的通透性只有一定的影响,可导致细胞中的离子等电解质小分子泄漏,而不足以导致蛋白质等大分子外泄。图5b也可以印证这一点,DMY处理下的280 nm处的OD值并不高,同时可以看到DMY-Ag+纳米乳液处理下的280 nm波长处的OD值较高,即认为DMY-Ag+纳米乳液对于细胞壁膜的破坏程度足以导致蛋白质等大分子也出现外泄的现象。
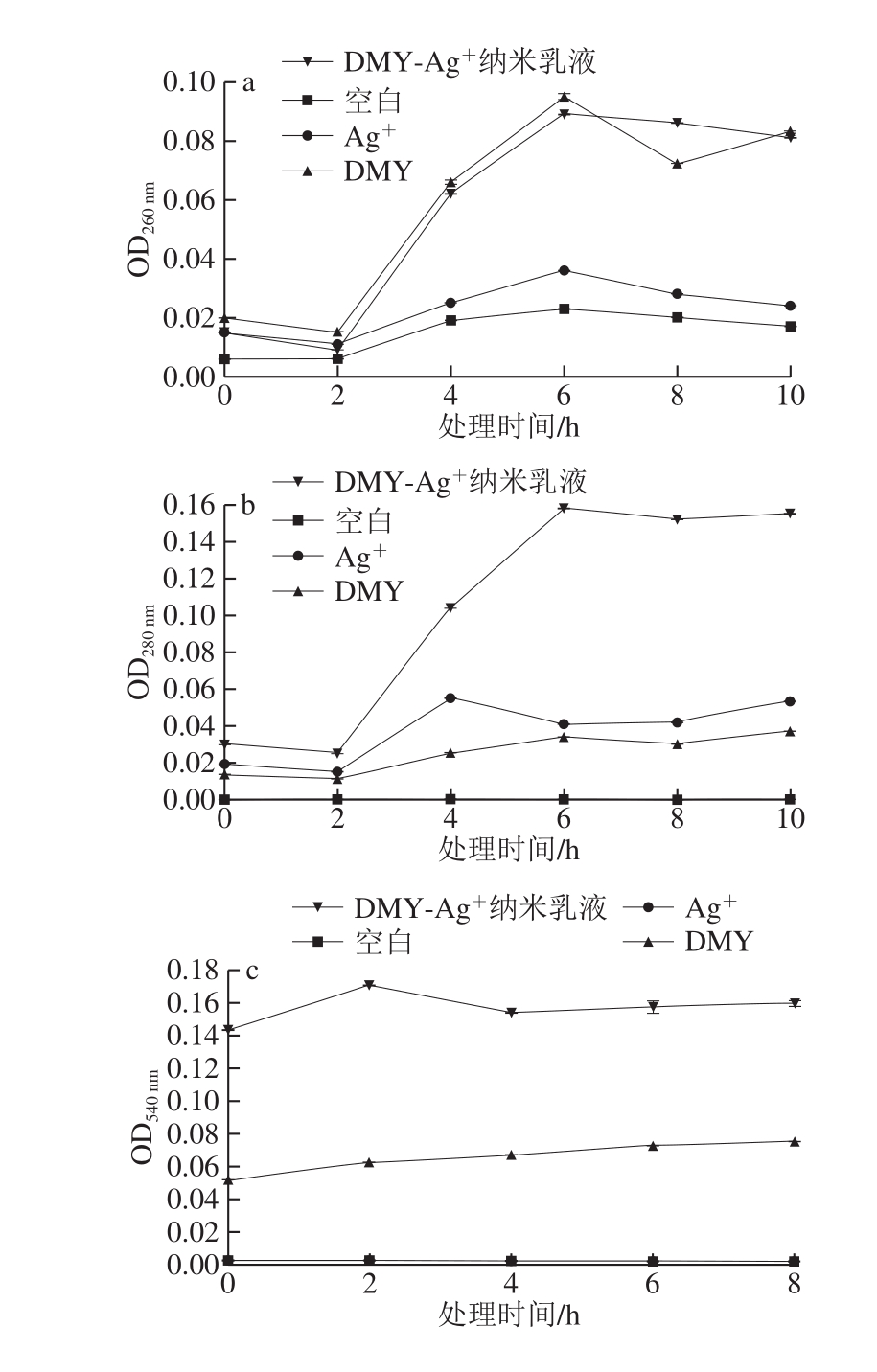

图5 处理液对金黄色葡萄球菌细胞壁膜通透性的影响
Fig.5 Effects of bacteriostatic agents on cell membrane permeability of Staphylococcus aureus
2.5 DMY-Ag+纳米乳液对金黄色葡萄球菌呼吸链脱氢酶活性的影响

图6 不同处理液对金黄色葡萄球菌呼吸链脱氢酶活性的影响
Fig.6 Effects of bacteriostatic agents on respiratory chain dehydrogenase activity in Staphylococcus aureus
如图6所示,与阳性对照组相比,各组酶活力都有不同程度的降低。熊伟等[30]研究DMY主要是通过三羧酸循环途径来影响菌体的呼吸代谢,而呼吸链脱氢酶是三羧酸循环中的关键酶,如果酶活降低则乙酰辅酶A在第三阶段则无法被彻底氧化或者氧化速率降低,即会影响葡萄糖的完全转化,无法完成呼吸代谢和对菌体正常生命活动所需的供能。图6中DMY-Ag+纳米乳液对于脱氢酶活的影响程度比DMY稍强,因此可以看出其对于菌体有氧呼吸的代谢过程也产生了抑制作用。
2.6 DMY-Ag+乳液对金黄色葡萄球菌细胞壁膜形态的影响


图7 不同抑菌处理液处理后的金黄色葡萄球菌细胞形态
Fig.7 Cell morphology of Staphylococcus aureus before and after treatment by bacteriostatic agents
由图7a、b可知,经过DMY处理后的金黄色葡萄球菌保持了与空白处理的菌体一样的外观形态,而从前面的实验结果中,可以看出经过DMY处理后菌悬液中的离子浓度、核酸、蛋白质含量都有增加,说明细胞中的这些物质在向溶液中扩散,造成这一现象是因为细胞壁和细胞膜在与DMY接触后遭到破坏,导致其丧失了部分或者全部的选择透过性,使得内容物外泄。这可能是因为金黄色葡萄球菌是革兰氏阳性菌,它的细胞壁厚且致密,而DMY分子粒径相对比较大,所以不能直接裂解细胞壁进入细胞,只能附着在金黄色葡萄球菌的表面,由于其极强的疏水性引起细胞膜表面疏水性增加,而改变细胞壁膜的通透性,使得细胞内容物外泄。由图7c可知,经过Ag+处理的金黄色葡萄球菌菌体形态破裂,而造成细胞中物质向溶液扩散这一现象是因为带正电的Ag+可以与细胞膜上带负电的成分产生库仑力,而牢固吸附在细胞上,大量的Ag+穿透细胞壁进入胞内,破坏了细胞壁膜的完整性,导致内容物外泄,并且Ag+可以与—SH反应,使蛋白质凝固,破坏细胞一些成分或产生功能障碍。另外有研究表明微量的Ag+在细胞表面也能起到催化活性中心的作用,激活空气或者水中的氧,产生羟基自由基及活性氧离子抑制或杀灭细菌[31-32]。由图7d可知,经过DMY-Ag+纳米乳液处理的菌体被改变了原有的形态,而结合前面的实验结果,说明了其也引起了菌体细胞壁膜通透性的改变,而且要比单独使用DMY或Ag+处理的效果更强,这可能是因为DMY和Ag+形成了相互协同作用,加快了对于菌体壁膜的黏附速率以及破坏强度。这些抑菌剂除通过改变菌体细胞壁膜的结构和功能来实现抑菌以外,另一个非常重要的途径就是影响细菌菌体的呼吸代谢。
3 结 论
DMY是一种来源于天然植物的黄酮类物质,其本身具有抗氧化、抗菌等生理活性作用,实验证明DMY对金黄色葡萄球菌的MIC为1.25 mg/mL,说明其具有很好的食品行业开发价值,特别是对于海产品、生鲜食品的贮存等,但水难溶性限制了其推广应用。实验通过制备DMY-Ag+纳米乳液使其能够稳定存在于水溶液体系,并且Ag+本身具有广谱抑菌的性能,因此可以在达到较好协同抑菌效果的同时大大降低抑菌剂在食品中的添加量,保证食品的质感和安全。通过进一步研究DMY-Ag+纳米乳液的抑菌机理,发现其改变了细胞壁膜的通透性,并且由于DMY和Ag+的相互协同作用,加快了对菌体壁膜的黏附速率以及破坏强度。另一方面,乳液也破坏了菌体呼吸代谢中的关键酶活力。关于乳液抑菌机理的完全阐释需要更进一步的实验研究,包括乳液尺寸对于抑菌的影响、作用的具体靶点、对遗传物质的影响等。进一步完善乳液的开发对于食品的抑菌具有重要意义。
[1]马冉, 雷柳冰, 田国梁, 等.东莞市区肉菜市场熟肉制品中金黄色葡萄球菌污染溯源分析[J].食品安全质量检测学报, 2019, 10(12):3873-3877.DOI:10.3969/j.issn.2095-0381.2019.12.040.
[2]郦娟, 杨永, 董华夏, 等.鲜湿米粉中金黄色葡萄球菌污染状况研究[J].粮食与油脂, 2019, 32(6): 75-77.DOI:10.3969/j.issn.1008-9578.2019.06.019.
[3]高璇.市售鲜牛奶中金黄色葡萄球菌的分离鉴定及耐药性分析[J].安徽农业科学, 2018, 46(27): 173-175.DOI:10.3969/j.issn.0517-6611.2018.27.050.
[4]黎海梅.三类天然产物的抗氧化性及抑菌特性研究[D].广州: 暨南大学, 2018: 1-88.
[5]李光辉, 孙思胜, 高雪丽, 等.天然产物对食源性致病菌的抑菌机制研究进展[J].食品安全质量检测学报, 2018, 9(4): 694-698.DOI:10.3969/j.issn.2095-0381.2018.04.002.
[6]朱昌玲, 张锋伦.几种天然产物的抑菌性能研究[J].中国野生植物资源, 2017, 36(5): 21-23.DOI:10.3969/j.issn.1006-9690.2017.05.005.
[7]赵艳敏, 李平, 田莉莉.天然产物Longistylines A的全合成与抑菌活性研究[J].华中师范大学学报(自然科学版), 2016, 50(1): 74-77.DOI:10.19603/j.cnki.1000-1190.2016.01.015.
[8]郭艳华, 许国权, 李艾华, 等.天然黄酮芦丁的化学改性及抑菌作用[J].江汉大学学报(自然科学版), 2013, 41(2): 31-35.DOI:10.16389/j.cnki.cn42-1737/n.2013.02.009.
[9]王亚男, 吴春.二氢杨梅素固体脂质颗粒抗氧化及抑菌性研究[J].哈尔滨商业大学学报(自然科学版), 2017, 33(1): 48-51; 65.DOI:10.19492/j.cnki.1672-0946.2017.01.012.
[10]黄郁梅, 洪正善, 杨柯, 等.二氢杨梅素稳定性影响因素及抑菌活性研究进展[J].药学研究, 2017, 36(9): 531-533; 537.DOI:10.13506/j.cnki.jpr.2017.09.010.
[11]孔琪.显齿蛇葡萄提取物与主要黄酮类化合物及衍生物的抗菌抗氧化活性研究[D].贵阳: 贵州师范大学, 2015: 1-62.
[12]王恩花, 杨礼寿, 逯凤肖, 等.二氢杨梅素对菜籽油和花生油氧化作用的影响研究[J].山地农业生物学报, 2016, 35(5): 89-94.DOI:10.15958/j.cnki.sdnyswxb.2016.05.016.
[13]王晓云, 姜子涛.天然抗氧剂二氢杨梅素研究进展[J].食品研究与开发, 2007, 28(2): 185-188.DOI:10.3969/j.issn.1005-6521.2007.02.056.
[14]彭宏熙, 李聪.中国和美国、日本饮用水水质标准的比较探究[J].中国给水排水, 2018, 34(10): 26-31.
[15]马骉, 李梦洁, 陈志平.国内外饮用水标准比较及对我国未来水质标准的思考[J].中国给水排水, 2016, 32(10): 11-14.
[16]陈日荣, 李惠冰, 周美容.不同种类微生物在全自动血培养仪中的生长曲线及其意义[J].中国感染控制杂志, 2006, 5(3): 206-208; 213.DOI:10.3969/j.issn.1671-9638.2006.03.004.
[17]BARNARD R T.The zone of inhibition[J].Clinical Chemistry, 2019,65(6): 819.DOI:10.1373/clinchem.2018.299800.
[18]陈美莲, 章慧, 王仕英.Soleris微生物实时光电法与平板计数法测定生乳中菌落总数的比较研究[J].乳业科学与技术, 2018, 41(5):24-27.DOI:10.15922/j.cnki.jdst.2018.05.006.
[19]顾颖娟, 秦宇, 潘思奕, 等.高效液相色谱法测定婴幼儿奶粉中5 种核苷酸的含量[J].食品工业, 2017, 38(9): 271-275.
[20]路阳, 王贤舜, 丁丽俐, 等.用考马斯亮兰G-250迅速、灵敏地测定蛋白质浓度[J].生物学杂志, 1992(1): 24-25; 32.
[21]管斌, 丁友昉, 谢来苏, 等.还原糖测定方法的规范[J].无锡轻工大学学报, 1999(3): 74-79.
[22]郑志永, 姚善泾.比色法测定大肠杆菌呼吸链脱氢酶活性[J].浙江大学学报(工学版), 2005, 39(3): 119-122.DOI:10.3785/j.issn.1008-973X.2005.03.025.
[23]LIU D, PANG W C, DING L J, et al.An insight into the inhibitory activity of dihydromyricetin against Vibrio parahaemolyticus[J].Food Control, 2016, 67: 25-30.DOI:10.1016/j.foodcont.2016.02.030.
[24]肖小年, 王江南, 谭潇啸, 等.二氢杨梅素的抑菌活性及其影响因素[J].中国食品学报, 2016, 16(10): 124-129.DOI:10.16429/j.1009-7848.2016.10.017.
[25]熊伟, 李雄辉, 王慧宾, 等.二氢杨梅素的抑菌性能研究及其与苯甲酸钠的比较[J].生物化工, 2016, 2(1): 12-14.
[26]王江南.二氢杨梅素的抑菌作用研究[D].南昌: 南昌大学, 2014: 1-61.
[27]王嘉军.蜂胶-银离子复合纳米乳剂的研制及其生物活性的检测[D].北京: 中国人民解放军军事医学科学院, 2006: 1-87.
[28]AMEEN F, AIYAHYA S A, BAKHREBAH M, et al.Flavonoid dihydromyricetin-mediated silver nanoparticles as potential nanomedicine for biomedical treatment of infections caused by opportunistic fungal pathogens[J].Research on Chemical Intermediates, 2018, 44(9): 5063-5073.DOI:10.1007/s11164-018-3409-x.
[29]熊伟, 王慧宾, 谭潇啸, 等.二氢杨梅素对金黄色葡萄球菌细胞渗透性的影响研究[J].食品工业, 2016, 37(1): 214-216.
[30]熊伟, 王慧宾, 谭潇啸, 等.二氢杨梅素对细菌形态及呼吸代谢的影响研究[J].食品工业, 2015, 36(11): 12-14.
[31]XU H Y, QU F, XU H, et al.Role of reactive oxygen species in the antibacterial mechanism of silver nanoparticles on Escherichia coli O157:H7[J].Biometals, 2012, 25(1): 45-53.DOI:10.1007/s10534-011-9482-x.
[32]LI W R, XIE X B, SHI Q S, et al.Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli[J].Applied Microbiology and Biotechnology, 2010, 85(4): 1115-1122.DOI:10.1007/s00253-009-2159-5.