牦牛是中国青藏高原地区特有的畜种,也是该地区优势畜种之一[1-2],对于高寒、低氧及牧草匮乏的环境具有良好的适应性。随着人们生活水平的提高,牛肉的消费量不断提高,牛肉的品质及安全就显得尤为重要,而以天然放牧为主的牦牛肉质鲜美,蛋白含量高,具有独特的风味,以其“绿色食品”的独特优势引起市场的广泛关注,具有很大的开发潜力[3-4]。
青藏高原地区的植物受寒冷天气的影响,生长周期非常短且枯萎期很长,加之草场缺乏管理,鼠害蔓延,导致草场退化严重,牧草质量急剧下降[5-7]。青藏高原地区牦牛饲养方式仍以放牧为主,因此与其他优质牛品种相比,牦牛的出栏率和生产性能较低,肉品质较差,使得牦牛肉制品在市场的占有量不高[8]。近年来为了改变这种状况,在牧区开始不断推广由传统放牧向舍饲饲养转变。目前针对舍饲育肥牦牛肉品质相关研究还较少,尤其是有关肌肉微观结构的差异研究更为鲜见,大部分的研究集中于通过补饲改变牦牛肉品质。王莉[9]、孔祥颖[10]等的研究表明,补饲能够提高牦牛肉肌内脂肪含量,同时改善牦牛肉的剪切力,使其肉质更嫩。Mamani-Linares等[11]研究发现,补饲3 个月后的美洲驼,肌内脂肪含量显著提高,肌纤维密度明显增大。补饲或者舍饲育肥之所以能提高动物肌内脂肪含量,可能是由于日粮组成的改变影响了瘤胃微生物组成,提高了饲料消化率,Carberry等[12]提出,瘤胃中普雷沃氏菌可以作为进一步研究瘤胃微生物的候选菌,并阐明了它们与饲料消化率的关系,同时也指出瘤胃微生物区系对宿主的饲粮利用率有影响,据此可以进一步研究是否可以通过调节瘤胃微生物来提高肉牛对饲料的消化率。而肌肉脂肪酸组成与肌内脂肪含量息息相关,同时肌肉脂肪酸组成又对挥发性风味物质产生影响,例如己醛就是亚油酸氧化后的基本产物[13]。但目前还鲜有对不同饲养条件下牦牛肌肉挥发性风味物质的研究。
因此,本实验对舍饲与放牧条件下牦牛的瘤胃微生物多样性、肉品质及肌纤维微观特性及挥发性风味物质进行比较研究,以探究不同饲养方式影响牦牛肌肉品质、营养成分及挥发性风味物质的可能机制,以期在牦牛快速育肥的基础上,改善牦牛肉品质,保留其特有风味,为进一步提高牦牛肉品质的研究提供基础数据。
1 材料与方法
1.1 材料与试剂
牦牛:2017年6~8月分别在四川省阿坝羌族藏族自治州金川县(海拔2 156 m)牦牛养殖场和小金县选择年龄4 岁左右、体质量257 kg左右的舍饲育肥与放牧饲养条件下的公牦牛各8 头。
浓缩料购自成都新通达公司。
E.Z.N.A.DNA试剂盒 美国Omega Biotek公司;AxyPrep DNA凝胶提取试剂盒 美国Axygen Biosciences公司。
1.2 仪器与设备
2200 凯氏定氮仪 丹麦FOSS公司;BSA124SCW分析天平 德国赛多利斯公司;7890A气相色谱仪美国安捷伦公司;Trace DSQ气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪(配置Triplus自动进样器) 美国Thermo公司;50/30 μm DVB/CAR/PDMS萃取头 美国Supelco公司;L-8900全自动氨基酸分析仪 日本日立公司;HP-C210色差仪中国汉谱科仪有限公司;pH-Star胴体肉质pH计 德国Matthaus公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;定量流变仪 美国Promega公司。
1.3 方法
1.3.1 实验设计
对牦牛采用放牧和舍饲育肥两种饲养方式。对放牧牦牛组进行全放牧饲养,自由采食;对舍饲育肥牦牛组,其日粮参考NY/T 815—2004《肉牛饲养标准》中牛体质量为225 kg时所需的营养量,平均日增质量为0.8 kg/d,精料组成为玉米24%(质量分数,下同)、豆粕4.23%、发酵酒糟10.56%、食盐0.48%、碳酸钙0.32%、小苏打0.32%、氯化胆碱0.08%、预混料0.01%(可为每千克日粮提供铁20 mg、碘0.5 mg、钴0.2 mg、锰40 mg、硒0.3 mg、锌30 mg、VA 1 500 IU、VD 550 IU、VE 10 IU);粗料组成为鲜玉米酒糟16%、燕麦干草13%和青贮玉米秸秆31%,日粮中精料与粗料质量之比为4∶6,正饲期100 d,喂料时间分别为每天早上8∶00与下午17∶00,自由采食,自由饮水。舍饲牦牛日粮营养成分含量(以干质量计)为干物质58.5 g/100 g、粗蛋白14.67 g/100 g、酸性洗涤纤维21.6 g/100 g、中性洗涤纤维40.15 g/100 g、钙0.53 g/100 g、磷0.45 g/100 g、增重净能4.28 mJ/kg,除增重净能为计算值外,其余均为实测值。
1.3.2 样品采集与处理
饲养期结束后禁食禁水12 h,屠宰后每头牛取瘤胃内容物用4 层纱布过滤出瘤胃液,分别装入2 支5 mL冻存管中;同时每头牛取倒数第一与第二肋骨之间背最长肌2 份(去除筋膜、血污及表面脂肪),每份约500 g,其中一份沿肌纤维方向进行分割处理,平均修整为大小2 cm×5 cm×2 cm肉块6 块,每块质量约为20 g,用于肉品质测定,同时取1 cm2肉样2 块,放置于体积分数4%多聚甲醛固定液中进行固定备用,进行肌纤维特性的测定。另一份肉样低温运送回实验室后立即-20 ℃保藏,用于后续脂肪酸、挥发性风味物质测定。
1.3.3 指标测定
1.3.3.1 瘤胃微生物区系测定
分别采集每头牦牛瘤胃液5 mL,置于冻存管中冷冻保存,随后委托广州基迪奥生物科技有限公司,利用16S rRNA技术测定瘤胃微生物区系多样性。使用E.Z.N.A.DNA试剂盒从瘤胃液中提取微生物DNA,利用引物341F:5'-CCTACGGGNGGCWGCAG-3';806R:5'-GGACTACHVGGGTATCTAAT-3',聚合酶链反应(polymerase chain reaction,PCR)16S rRNA V3~V4区(95 ℃保持2 min,随后98 ℃保持10 s,62 ℃保持30 s,68 ℃保持30 s,最后68 ℃保持10 min),PCR反应在含有5 μL 10×KOD缓冲液、5 μL 2.5 mmol/L dNTPs、1.5 μL引物、1 μL KOD聚合酶和100 ng模板DNA的3 份50 μL混合物中进行。从质量分数2%琼脂糖凝胶中提取扩增子,并用AxyPrep DNA凝胶提取试剂盒纯化,根据使用说明书用定量流变仪进行定量检测,根据标准方案,在Illumina平台上以等摩尔和成对末端测序(2×250)合并纯化的扩增子。
用Uparse软件对所有样品的全部有效序列(effective tags)进行聚类分析,默认提供以97%的一致性(identity)将序列聚类成为操作分类单元(operational taxonomic units,OTUs)结果;使用QIIME软件计算Alpha多样性指数;UPARSE软件在构建OTUs的过程中会选取代表性序列(OTUs中丰度最高的Tag序列),将这些代表性序列集合用RDP Classifier的Naïve Bayesian assignment算法,与Silva数据库进行物种注释(设定置信度的阈值为0.8~1.0),统计各个层级分类水平上的各样品物种组成情况,然后用堆叠图的形式,直观展示不同样品在各个分类层级水平上的物种丰度的变化情况,只展示至少在一个样本中的表达丰度达到2%的前10 个物种,其余物种统一归类到其他(Other)类别,无法注释到该水平的序列则被归类到未分类(Unclassified)的类别。
1.3.3.2 肌肉常规营养成分、肌内脂肪含量测定
取肉样约200 g,在65 ℃烘箱中烘干,回潮后粉碎,制成风干样,进行常规营养成分的测定。水分含量的测定参考GB 5009.3—2010《食品安全国家标准 食品中水分的测定》中的直接干燥法;粗蛋白含量的测定参考GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法;粗灰分含量的测定参考GB 5009.4—2010《食品安全国家标准 食品中灰分的测定》中的灼烧法;肌内脂肪含量的测定采用GB 5009.6—2003《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法方法。所有指标平行测定3 次。
1.3.3.3 肉色及pH值测定
采用HP-C210色差仪测定肉样的L*值(亮度)、a*值(红度)、b*值(黄度)。测定前对仪器进行校正,将肉样放置于平面,置于现场自然光线充足处,垂直将色差仪镜头置于肌肉横断面,镜口紧扣肉面(不漏光),平行测定3 次,测定位置均匀分布于肌肉横切面,计算平均数作为色差读数。
胴体肉质pH计经pH 4和pH 7的校准液校准后,分别在宰后45 min和24 h,插入胴体背最长肌进行测定,每块样品重复测定3 次,计算平均值作为pH值读数。
1.3.3.4 滴水损失率及蒸煮损失率的测定
滴水损失率及蒸煮损失率的测定参考牛克兰等[14]的方法并稍作修改。首先将修整好的待测肉样称质量(m1/g),再用铁丝钩住肉样一端,使肌纤维垂直向下,装入塑料袋中,用洗耳球向塑料袋吹气,使之处于膨胀状态,并使肉样不与塑料袋壁接触,封口后,吊挂在4 ℃的冰箱中,24 h后再称肉块质量(m2/g),并按公式(1)计算滴水损失率。
取修整好的肉样,称质量,记为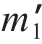 '/g,用自封袋真空密封,于80 ℃水浴于中加热30 min,当肉的中心温度达到75 ℃时,恒温5 min后取出,冷却至室温后再次称质量,记为
'/g,用自封袋真空密封,于80 ℃水浴于中加热30 min,当肉的中心温度达到75 ℃时,恒温5 min后取出,冷却至室温后再次称质量,记为 /g,并按公式(2)计算蒸煮损失率。
/g,并按公式(2)计算蒸煮损失率。
1.3.3.5 剪切力测定
取修整好的生肉样及熟肉样(85 ℃恒温水浴锅中加热30 min),采用TA-XT Plus质构仪按照NY/T 1180—2006《肉嫩度的测定 剪切力测定法》进行测定。沿肌纤维垂直方向测量每个肉柱的剪切力,每个样品测定3 次。测试速率为1 mm/s。
1.3.3.6 脂肪酸含量测定
取肉样约150 g,参照GB/T 9695.2—2008《肉与肉品质 脂肪酸测定》的方法采用7890A气相色谱仪测定脂肪酸含量,每个处理组做8 个平行(8 头牛),每个平行取两个样测定。脂肪酸含量结果以干质量计。
1.3.3.7 肌纤维特性测定
肌纤维特性参考文献[15]中的石蜡切片法进行测定。将样品从体积分数4%多聚甲醛中取出,经全自动脱水机脱水,包埋、切片后,经伊红-苏木精染色后进行封片,进行镜检。用数码三目摄像显微镜观察切片,利用Motic Images Advanced 3.2软件,选择切片中较好的区域照相,调整物镜的倍数(20×)及测量数据的单位(μm),将采集到的图片导入Motic Images Advanced软件进行肌纤维直径、面积及密度测量,每个样本采集3 张图片。
1.3.3.8 挥发性风味物质测定
采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)-GC-MS法测定,取肉样5 g用组织匀浆机捣碎成肉糜,置于20 mL顶空瓶中,将盖子盖紧后,放置于4 ℃冷藏备用。萃取头使用前在GC进样口220 ℃老化30 min,将完成老化的萃取头插入顶空瓶中于60 ℃萃取10 min后,再于GC进样口解吸5 min。
GC条件:TR-FFAP色谱柱(30 m×0.25 mm,0.25 μm);载气为高纯度He,流速1 mL/min;采用程序升温:初温40 ℃,保持5 min,以4 ℃/min升温至120 ℃,保持10 min,再以13 ℃/min升温至220 ℃,保持5 min;进样口温度220 ℃,分流进样,分流比为20∶1。
MS条件:传输线温度220 ℃;离子源温度200 ℃;电离方式:电子轰击离子,电离电压70 eV;扫描方式为全扫描,扫描范围m/z 35~500。
1.4 数据处理与分析
数据采用Excel 2010软件进行整理,用SPSS 18.0软件中GLM模型进行单因素方差分析,Duncan氏法进行多重比较,结果以平均值±标准差表示,P<0.05表示差异显著。挥发性风味物质仅选择正相似指数与反相似指数均不小于750的物质进行分析。
2 结果与分析
2.1 不同饲养方式对牦牛瘤胃微生物区系的影响
2.1.1 不同饲养方式对牦牛瘤胃微生物OTUs数目和Alpha多样性的影响
舍饲牦牛与放牧牦牛OTUs数目和Alpha多样性指数见表1,放牧牦牛瘤胃微生物中表示微生物丰富度的OTUs数目显著高于舍饲牦牛瘤胃微生物(P<0.05),分别为2 543.40和1 742.00;同时放牧牦牛组中与样本的物种丰富度信息相关指标ACE、Chao1指数以及体现物种的丰富度和均匀度的Shannon指数和Simpson指数分别为2 925.87、3 002.86、9.56、0.99,前3 项均显著高于舍饲牦牛组(P<0.05)。舍饲牦牛与放牧牦牛样品的覆盖率(coverage)均为0.99,表明本实验低丰度OTUs覆盖率及测序深度合理。本实验结果表明,放牧牦牛的瘤胃微生物多样性高于舍饲牦牛,而曹连宾等[16]选择了青海全放牧和舍饲牦牛各3 头进行研究,结果表明舍饲牦牛的瘤胃微生物多样性高于放牧牦牛,与本研究结果相反。出现上述结果可能是动物品种不同、饲粮精粗比及成分不同等原因所造成。有大量的研究结果表明,日粮的组成不同,瘤胃微生物的组成会发生改变,许多瘤胃微生物菌群能够被扩大,或成为优势菌群[12,17-18]。
表1 饲养方式对牦牛瘤胃微生物OTUs数量和Alpha多样性的影响
Table 1 Effect of feeding systems on number of OTUs and alpha diversity of rumen microbial floral in yaks
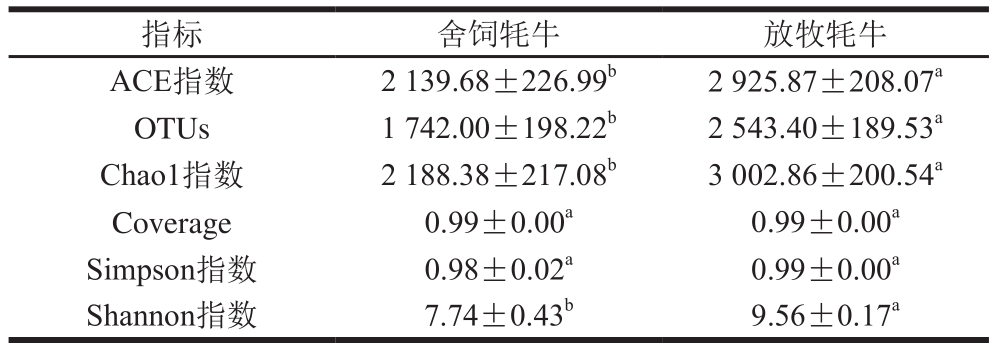
注:同行肩标小写字母不同表示差异显著(P <0.05)。下同。
指标 舍饲牦牛 放牧牦牛ACE指数 2 139.68±226.99b 2 925.87±208.07a OTUs 1 742.00±198.22b 2 543.40±189.53a Chao1指数 2 188.38±217.08b 3 002.86±200.54a Coverage 0.99±0.00a 0.99±0.00a Simpson指数 0.98±0.02a 0.99±0.00a Shannon指数 7.74±0.43b 9.56±0.17a
2.1.2 不同饲养方式对牦牛瘤胃微生物组成的影响
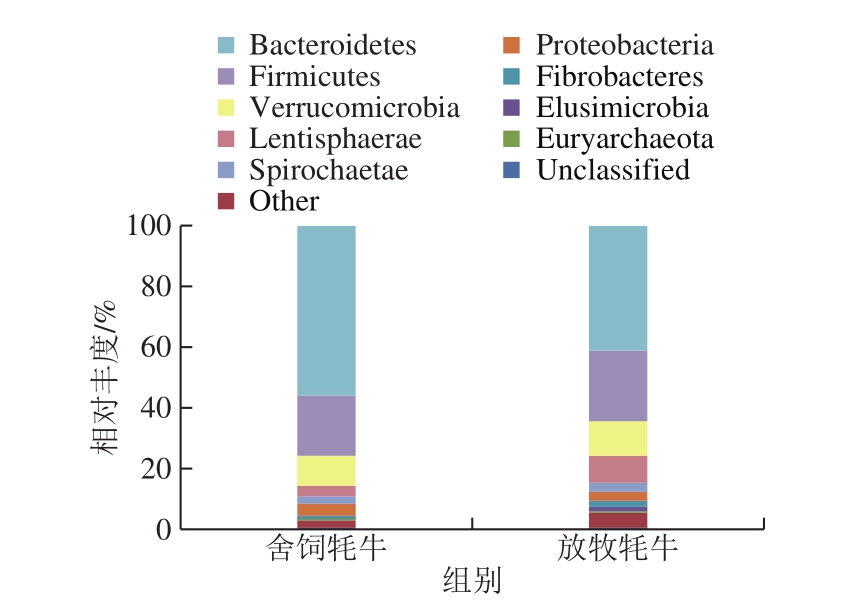
图1 饲养方式对牦牛瘤胃微生物组成在门水平上的影响
Fig.1 Effect of feeding systems on rumen microbial floral composition of yaks at the phylum level
由图1可知,舍饲牦牛与放牧牦牛瘤胃微生物均由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和黏胶球形菌门(Lentisphaerae)4 个优势菌门主导。各优势菌门在两处理组样品丰度也有所不同,拟杆菌门作为第一优势菌门在舍饲牦牛样本中的相对丰度为55.75%,明显高于放牧牦牛组中41.20%;而作为第二优势菌门的厚壁菌门在舍饲牦牛样本中为19.76%,明显低于放牧牦牛组。上述结果与曹连宾[16]、de Oliverira[19]等的研究结果一致,健康牛瘤胃微生物菌群在门水平上大部分都属于拟杆菌门和厚壁菌门。放牧牦牛瘤胃液中的黏胶球形菌门含量明显高于舍饲牦牛,高出5.77%。
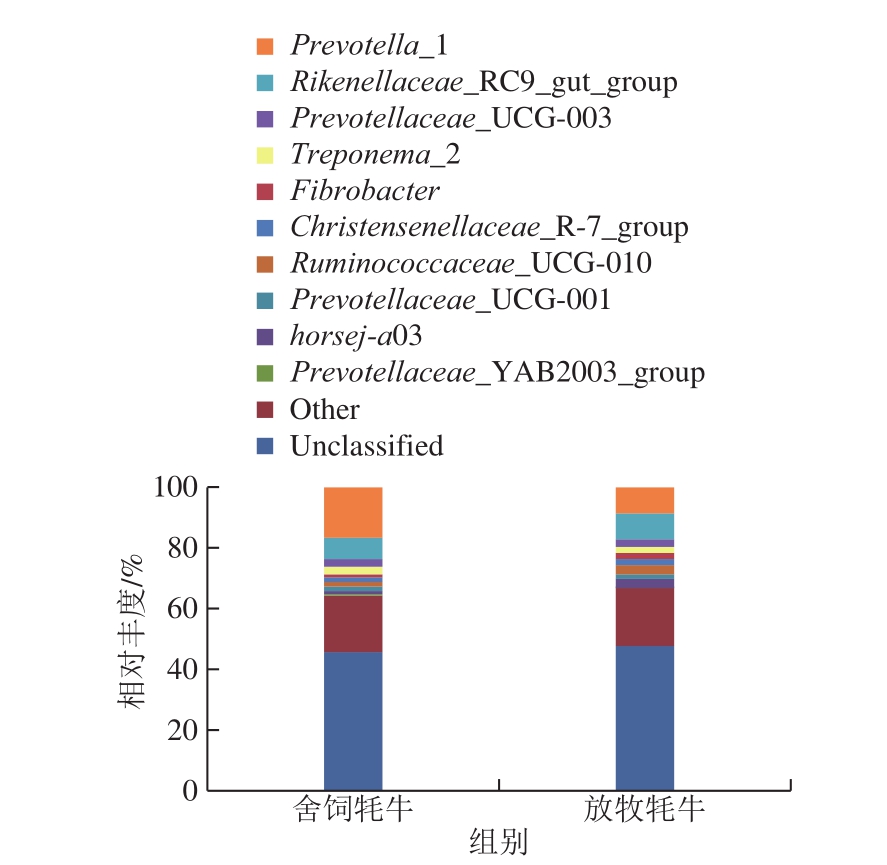
图2 饲养方式对牦牛瘤胃微生物组成在属水平上的影响
Fig.2 Effect of feeding systems on rumen microbial floral composition at the genus level
由图2可知,舍饲牦牛和放牧牦牛样本中,丰度最高的前3 个属均源于拟杆菌门,分别为普雷沃氏菌_1(Prevotella 1)、拟杆菌门理研菌科RC9肠道菌体属(Rikenellaceae RC9 gut group)、普雷沃氏菌科UCG-003(Prevotellaceae UCG-003),其中舍饲牦牛样本中普雷沃氏菌_1占比达到16.49%,而在放牧牦牛样本中仅占8.84%。Fernando等[20]对肉牛研究发现,与饲喂干草的相比,高精料饲喂的牛瘤胃内拟杆菌门的数量更多,并且在拟杆菌门中检测到的大部分细菌属都是普雷沃氏菌,该结果与本实验结果一致。
产生上述结果的原因可能是由于舍饲牦牛日粮中添加了精料,而精料中的蛋白质和淀粉的含量高于放牧牦牛的粗料,从而导致瘤胃内的蛋白降解菌和淀粉降解菌的含量增加[21],有研究表明可分离培养的普雷沃氏菌中,一部分具有降解蛋白质和淀粉等营养物质的功能;另一部分具有发酵纤维二糖、果糖、葡萄糖等的能力[22-23]。因此可以进一步研究是否可以通过调节瘤胃微生物来提高肉牛对饲料的消化率。肌肉中脂肪酸和风味物质变化与瘤胃微生物区系的改变密不可分,杨蕾等[24]指出瘤胃微生物菌群丰度对其储存能量及沉积脂肪的能力有重要影响,尤其是厚壁菌门与拟杆菌门的相对丰度对肌内脂肪沉积的影响较大。肌内脂肪的沉积与肌肉中脂肪酸组成有着密切的联系,本研究结果中舍饲牦牛瘤胃中拟杆菌门与厚壁菌门丰度均增加。
2.2 不同饲养方式对牦牛肉品质的影响
不同饲养条件下牦牛肌肉品质分析结果见表2,本实验条件下,舍饲牦牛与放牧牦牛肌肉肉色、pH值及水分、粗蛋白、粗灰分含量无显著差异(P>0.05),舍饲与放牧牦牛肌肉中粗蛋白含量均高于牛肉的平均蛋白质含量(20 g/100 g),该结果与王莉等[9]的研究结果一致,说明牦牛肉蛋白含量高。有研究表明,放牧饲养的动物肌肉比谷物饲养的动物肌肉具有更深的颜色[25-26],但是本实验结果中,两种饲养方式对牦牛肌肉的肉色及pH值并无显著影响,可能是饲养时间不够的原因造成。
滴水损失率是反映肌肉持水力的重要指标之一,蒸煮损失率是衡量肌肉在加工过程中失去水分的量的重要指标,关系到产品的加工成本[27-28],水分流失率低能使肌肉保持较好的嫩度和营养。舍饲牦牛肉的滴水损失率与蒸煮损失率分别为1.35%和21.28%,均显著低于放牧牦牛肉(P<0.05),说明舍饲牦牛肉在宰后及加工过程中,能表现出比放牧牦牛肉更高的系水力,其嫩度可能也会因此得到改善。
肌内脂肪通常称为大理石花纹脂肪,有研究表明消费者在购买牛肉时,更青睐肌内脂肪含量高的牛肉。肌内脂肪含量与熟肉的嫩度和多汁性有关,肌内脂肪含量的增加对肌肉的多汁性有明显的改善作用,使得肌肉在烹饪过程中保留更多的水分[29]。肌内脂肪对于嫩度的改善可能是因为肌内脂肪位于肌纤维束之间的肌束膜结缔组织中,能够使肌纤维的密度变小,在咀嚼时更容易破碎[30]。舍饲牦牛的肌内脂肪含量(1.14 g/100 g)显著高于放牧牦牛(0.73 g/100 g)(P<0.05);舍饲牦牛肉与放牧牦牛肉生肉剪切力差异不显著(P>0.05),但煮熟后,舍饲牦牛熟肉剪切力为69.74 N,显著低于放牧牦牛熟肉(P<0.05),可能正是由于舍饲牦牛肌内脂肪含量更高,使牦牛肌肉在烹煮过程中保留了更多的水分。因此,舍饲牦牛肉品质在嫩度与多汁性方面的表现优于放牧牦牛。
表2 不同饲养方式对牦牛肉品质的影响
Table 2 Effects of different feeding systems on meat quality of yaks
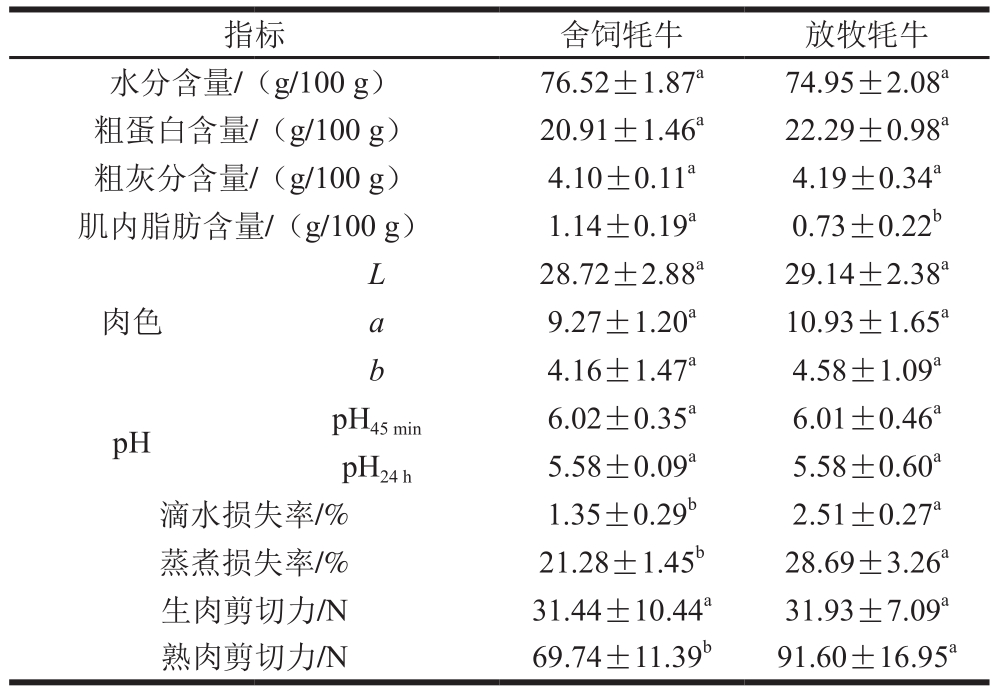
指标 舍饲牦牛 放牧牦牛水分含量/(g/100 g) 76.52±1.87a 74.95±2.08a粗蛋白含量/(g/100 g) 20.91±1.46a 22.29±0.98a粗灰分含量/(g/100 g) 4.10±0.11a 4.19±0.34a肌内脂肪含量/(g/100 g) 1.14±0.19a 0.73±0.22b肉色L 28.72±2.88a 29.14±2.38a a 9.27±1.20a 10.93±1.65a b 4.16±1.47a 4.58±1.09a pH pH45 min 6.02±0.35a 6.01±0.46a pH24 h 5.58±0.09a 5.58±0.60a滴水损失率/% 1.35±0.29b 2.51±0.27a蒸煮损失率/% 21.28±1.45b 28.69±3.26a生肉剪切力/N 31.44±10.44a 31.93±7.09a熟肉剪切力/N 69.74±11.39b 91.60±16.95a
2.3 不同饲养方式对牦牛肌肉脂肪酸组成的影响
有研究报道,牛肉中较高的饱和脂肪酸和单不饱和脂肪酸含量与其较高的肌内脂肪含量相关[25],且猪、牛、羊的肌肉和肌肉组织中的脂肪酸组成取决于该动物胴体和肌肉中的脂肪含量[29],由表3可知,舍饲牦牛肌肉中饱和脂肪酸、单不饱和脂肪酸相对含量显著高于放牧牦牛(P<0.05),可能是由于舍饲牦牛肌内脂肪相对含量更高,导致脂肪细胞中甘油三酯的沉积更多[31]。Enser等[32]的研究结果也表明,脂肪组织中的脂肪酸含量远高于肌肉中的含量,但是其组成大致相似。饱和脂肪酸中,舍饲牦牛肌肉中棕榈酸及硬脂酸相对含量分别为25.11%、18.98%,均显著高于放牧牦牛肌肉(P<0.05),而更高的饱和脂肪酸相对含量并不能够说明舍饲牦牛肉的脂肪酸组成不及放牧牦牛的好,不同的饱和脂肪酸具有不同的功能,例如硬脂酸在降低部分胆固醇溶解速率的同时,还可以对胆酸进行调节,从而达到降低血清和肝脏中胆固醇含量的目的[33];膳食中棕榈酸可以降低血清中胆固醇的含量[34]。虽然舍饲牦牛肌肉中饱和脂肪酸相对含量显著高于放牧牦牛,但从饱和脂肪酸种类来看,舍饲牦牛肌肉的中功能性脂肪酸相对含量更高。
不饱和脂肪酸中,舍饲牦牛肌肉中油酸相对含量为40.21%,显著高于放牧牦牛(P<0.05),放牧牦牛肌肉中亚油酸、亚麻酸、二十碳五烯酸相对含量分别为9.61%、2.79%、1.80%,均显著高于舍饲牦牛肌肉(P<0.05);其他脂肪酸相对含量差异均不显著(P>0.05)。放牧牦牛肌肉中多不饱和脂肪酸相对含量显著高于舍饲牦牛(P<0.05),也高于马聘等[35]的研究结果中2~3 岁的牦牛肌肉中多不饱和脂肪酸的相对含量(7.15%),Raes等[25]的研究发现不同种类、不同饲养方式的牛肉之间多不饱和脂肪酸含量差异均不显著。与上述文献结果不一致的原因:一方面是因为放牧牦牛长期以植物为食,可能是由于其中往往含有较高的植物源性抗氧化剂等活性成分,能够有效保护多不饱和脂肪酸[36];另一方面可能是动物的品种、年龄、日粮组成等不同造成的。
舍饲牦牛肉和放牧牦牛肉中多不饱和脂肪酸与饱和脂肪酸含量的比值(P∶S)均未达到世界卫生组织推荐的0.4,并且放牧牦牛肌肉P∶S为0.33,显著高于舍饲牦牛肌肉(0.15)(P<0.05),这主要是由于反刍动物的瘤胃具有氢化作用,所以P∶S通常在0.1左右[37-39]。舍饲牦牛肌肉与放牧牦牛肌肉中n-6/n-3脂肪酸的比值分别为4.55和1.86,舍饲牦牛肌肉显著高于放牧牦牛肉(P<0.05),可能是由于舍饲饲粮中谷物相对含量更高,而谷物饲料具有更多的n-6脂肪酸,放牧牦牛的饲粮仅为草料,含有更多的C18:3n-3[25]。
Moloney等[40]发现富含不饱和脂肪酸的饮食会影响与肉类色泽稳定性密切相关的牛肉中的脂肪酸组成,如青贮饲料。由此,可推测舍饲牦牛日粮组成的改变使得肌内脂肪相对含量增加,改变了其脂肪酸相对含量。已有研究表明,瘤胃微生物具有氢化作用,通过对日粮的调控可以改变肌肉中脂肪酸的组成[37]。因此在进一步研究中,可以考虑通过在饲粮中加入微生态制剂调节瘤胃微生物的多样性,从而改变牦牛对饲料的消化吸收,在提高肌内脂肪相对含量的同时,使脂肪酸维持稳定。
表3 不同饲养方式对牦牛肌肉脂肪酸组成的影响
Table 3 Effects of different feeding systems on fatty acid composition of muscle lipids in yaks
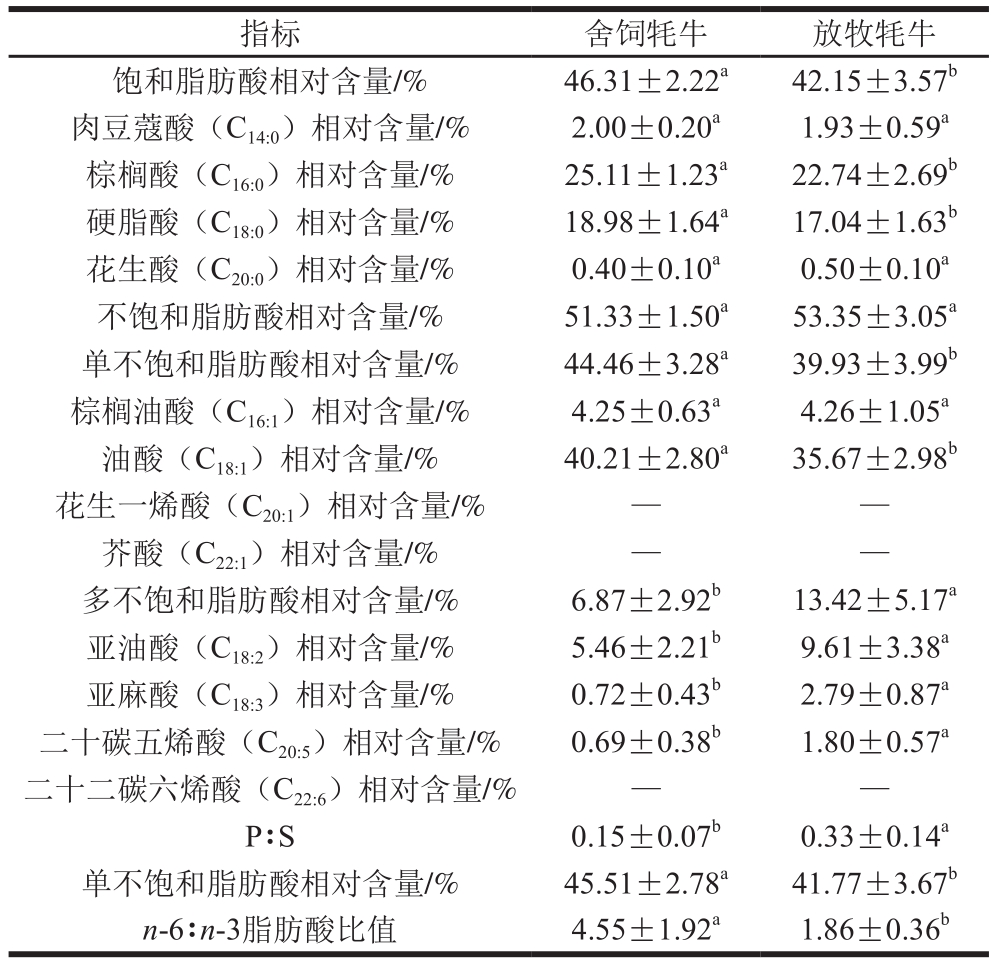
注:—.未检测到。表5同。
指标 舍饲牦牛 放牧牦牛饱和脂肪酸相对含量/% 46.31±2.22a 42.15±3.57b肉豆蔻酸(C14:0)相对含量/% 2.00±0.20a 1.93±0.59a棕榈酸(C16:0)相对含量/% 25.11±1.23a 22.74±2.69b硬脂酸(C18:0)相对含量/% 18.98±1.64a 17.04±1.63b花生酸(C20:0)相对含量/% 0.40±0.10a 0.50±0.10a不饱和脂肪酸相对含量/% 51.33±1.50a 53.35±3.05a单不饱和脂肪酸相对含量/% 44.46±3.28a 39.93±3.99b棕榈油酸(C16:1)相对含量/% 4.25±0.63a 4.26±1.05a油酸(C18:1)相对含量/% 40.21±2.80a 35.67±2.98b花生一烯酸(C20:1)相对含量/% — —芥酸(C22:1)相对含量/% — —多不饱和脂肪酸相对含量/% 6.87±2.92b 13.42±5.17a亚油酸(C18:2)相对含量/% 5.46±2.21b 9.61±3.38a亚麻酸(C18:3)相对含量/% 0.72±0.43b 2.79±0.87a二十碳五烯酸(C20:5)相对含量/% 0.69±0.38b 1.80±0.57a二十二碳六烯酸(C22:6)相对含量/% — —P∶S 0.15±0.07b 0.33±0.14a单不饱和脂肪酸相对含量/% 45.51±2.78a 41.77±3.67b n-6∶n-3脂肪酸比值 4.55±1.92a 1.86±0.36b
2.4 不同饲养方式对牦牛肌纤维特性的影响
表4 不同饲养方式对牦牛肌纤维特性的影响
Table 4 Effects of different feeding systems on yak muscle fiber characteristics

指标 舍饲牦牛 放牧牦牛肌纤维面积/μm2 1 401.37±246.74a 1 432.73±281.95a肌纤维直径/μm 37.64±6.17a 38.86±3.79a肌纤维密度/(N/mm2) 6.67±2.35b 10.64±2.69a
动物出生后,肌纤维的数量不再变化,但随着时间的推移,肌纤维类型可能会发生转化。由表4可知,舍饲牦牛肉与放牧牦牛肉的肌纤维面积、肌纤维直径差异均不显著(P>0.05),但舍饲牦牛肉的肌纤维密度(6.67 N/mm2)显著低于放牧牦牛肉(10.64 N/mm2)(P<0.05),可能是由于舍饲牦牛肌内脂肪含量更高,使得肌纤维之间结缔组织的联结作用降低。有研究表明,肌纤维横截面积与嫩度呈负相关(-0.11<r<-0.53)[41-42]。Ishii等[43]对体质量200~600 kg肉牛(日本黑牛×荷斯坦牛)肌肉的肌纤维横截面积进行研究,发现它们的肌纤维横截面积均未超过1 200 μm2,低于本实验两种牛肉结果,可见牦牛肉的嫩度不及肉牛高;因此在进一步的研究中,可以通过不断改善饲养管理方式来改善牦牛肉的嫩度。
2.5 不同饲养方式对牦牛肌肉挥发性风味物质的影响
两种饲养方式对牦牛肌肉挥发性风味物质的影响结果见表5,舍饲与放牧饲养条件下的牦牛肉中分别检测出27 种和34 种挥发性风味物质,其中包括醛类11 种、酮类5 种、醇类9 种、酯类2 种、烷烃类3 种、烯烃类2 种及杂环化合物7 种。
表5 不同饲养方式对牦牛肌肉挥发性风味物质的影响
Table 5 Effects of different feeding systems on volatile flavor compounds in yak meat
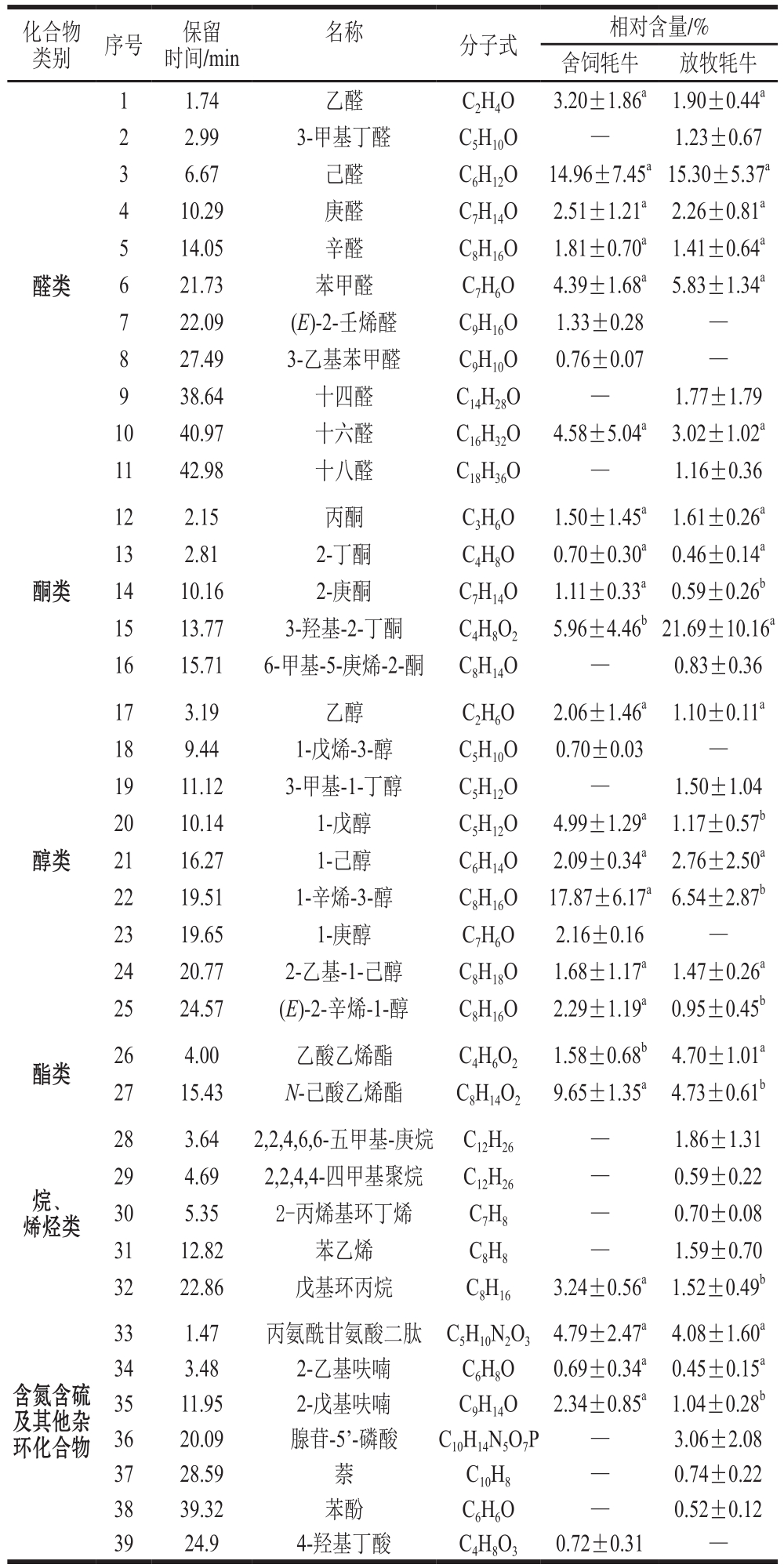
化合物类别序号保留时间/min名称 分子式 相对含量/%舍饲牦牛 放牧牦牛醛类1 1.74 乙醛 C2H4O 3.20±1.86a 1.90±0.44a 2 2.99 3-甲基丁醛 C5H10O — 1.23±0.67 3 6.67 己醛 C6H12O 14.96±7.45a15.30±5.37a 4 10.29 庚醛 C7H14O 2.51±1.21a 2.26±0.81a 5 14.05 辛醛 C8H16O 1.81±0.70a 1.41±0.64a 6 21.73 苯甲醛 C7H6O 4.39±1.68a 5.83±1.34a 7 22.09 (E)-2-壬烯醛 C9H16O 1.33±0.28 —8 27.49 3-乙基苯甲醛 C9H10O 0.76±0.07 —9 38.64 十四醛 C14H28O — 1.77±1.79 10 40.97 十六醛 C16H32O 4.58±5.04a 3.02±1.02a 11 42.98 十八醛 C18H36O — 1.16±0.36酮类12 2.15 丙酮 C3H6O 1.50±1.45a 1.61±0.26a 13 2.81 2-丁酮 C4H8O 0.70±0.30a 0.46±0.14a 14 10.16 2-庚酮 C7H14O 1.11±0.33a 0.59±0.26b 15 13.77 3-羟基-2-丁酮 C4H8O2 5.96±4.46b21.69±10.16a 16 15.71 6-甲基-5-庚烯-2-酮 C8H14O — 0.83±0.36醇类17 3.19 乙醇 C2H6O 2.06±1.46a 1.10±0.11a 18 9.44 1-戊烯-3-醇 C5H10O 0.70±0.03 —19 11.12 3-甲基-1-丁醇 C5H12O — 1.50±1.04 20 10.14 1-戊醇 C5H12O 4.99±1.29a 1.17±0.57b 21 16.27 1-己醇 C6H14O 2.09±0.34a 2.76±2.50a 22 19.51 1-辛烯-3-醇 C8H16O 17.87±6.17a6.54±2.87b 23 19.65 1-庚醇 C7H6O 2.16±0.16 —24 20.77 2-乙基-1-己醇 C8H18O 1.68±1.17a 1.47±0.26a 25 24.57 (E)-2-辛烯-1-醇 C8H16O 2.29±1.19a 0.95±0.45b酯类 26 4.00 乙酸乙烯酯 C4H6O2 1.58±0.68b 4.70±1.01a 27 15.43 N-己酸乙烯酯 C8H14O2 9.65±1.35a 4.73±0.61b烷、烯烃类28 3.64 2,2,4,6,6-五甲基-庚烷 C12H26 — 1.86±1.31 29 4.69 2,2,4,4-四甲基聚烷 C12H26 — 0.59±0.22 30 5.35 2-丙烯基环丁烯 C7H8 — 0.70±0.08 31 12.82 苯乙烯 C8H8 — 1.59±0.70 32 22.86 戊基环丙烷 C8H16 3.24±0.56a 1.52±0.49b含氮含硫及其他杂环化合物33 1.47 丙氨酰甘氨酸二肽 C5H10N2O3 4.79±2.47a 4.08±1.60a 34 3.48 2-乙基呋喃 C6H8O 0.69±0.34a 0.45±0.15a 35 11.95 2-戊基呋喃 C9H14O 2.34±0.85a 1.04±0.28b 36 20.09 腺苷-5'-磷酸 C10H14N5O7P — 3.06±2.08 37 28.59 萘 C10H8 — 0.74±0.22 38 39.32 苯酚 C6H6O — 0.52±0.12 39 24.9 4-羟基丁酸 C4H8O3 0.72±0.31 —
舍饲与放牧牦牛肌肉中各共有的醛类化合物相对含量差异均不显著(P>0.05),醛类化合物总相对含量较高,是牦牛肉中主要的挥发性风味物质,这与原琦等[44]的研究结果相同,说明醛类化合物是牛肉风味物质的主要构成部分,对牛肉香味的贡献不可替代。舍饲牦牛与放牧牦牛中的醛类化合物均以己醛相对含量最高,分别为14.96%和15.30%,己醛具有青草味,是亚油酸氧化后的基本产物[13],放牧牦牛肌肉中己醛相对含量稍高于舍饲牦牛,可能与其肌肉中亚油酸相对含量显著高于舍饲牦牛有关;庚醛和辛醛具有油脂氧化的气味[45],在舍饲牦牛肌肉中庚醛和辛醛相对含量分别为2.51%和1.81%,稍高于放牧牦牛,这可能是由于舍饲牦牛肌内脂肪含量高于放牧牦牛,牛肉风味与这些高相对含量低分子质量的醛类物质有很大关系[46]。
酮类化合物是脂质氧化后产生的另一种产物,具有特殊香气,肉中酮类化合物的存在可使腥味增强或改变[47]。放牧牦牛肌肉中酮类化合物含量高于舍饲牦牛,可能是由于放牧牦牛肌肉中多不饱和脂肪酸含量更高。放牧牦牛肌肉中3-羟基-2-丁酮相对含量为21.69%,显著高于舍饲牦牛肉的5.96%,这可能导致放牧牦牛肉中的腥味高于舍饲牦牛。舍饲牦牛肌肉种2-庚酮相对含量为1.11%,显著高于放牧牦牛中的相对含量(P<0.05);6-甲基-5-庚烯-2-酮只在放牧牦牛肌肉中检出,相对含量为0.83%,上述两种酮类化合物对肌肉风味影响极小。
醇类化合物的来源也是脂肪的氧化降解,舍饲牦牛肌肉中醇类化合物含量高于放牧牦牛,舍饲牦牛肌肉中1-戊醇、1-辛烯-3-醇、(E)-2-辛烯-1-醇的相对含量均显著高于放牧牦牛肌肉(P<0.05),尤其是1-辛烯-3-醇的相对含量达到17.87%,在放牧牦牛肌肉中仅为6.54%,徐永霞等[47]的研究表明,1-辛烯-3-醇是重要的香味活性物质。Lorenz等[48]研究了饲养方式对牛肉的脂肪酸组成及熟制后牛肉的风味成分影响,结果发现舍饲组中的1-辛烯-3-醇含量高于放牧组,与本研究结果一致。1-戊烯-3-醇与1-庚醇均只在舍饲牦牛肌肉中检出,相对含量分别为0.70%和2.16%;3-甲基-1-丁醇仅在放牧牦牛肌肉中检出,相对含量为1.50%,这两种物质均因为相对含量极低,对牦牛肌肉风味总体影响极小。
Mottram等[49]的研究表明,脂质是肉品风味物质的重要前体物,尤其是磷脂,其富含不饱和脂肪酸,例如花生四烯酸、亚油酸等的产物可能直接影响挥发性风味物质的组成,从而改变肉品风味。酯类化合物的形成通常是通过一个复杂的反应链,有可能是通过微生物作用后,醇类与羧酸类的酯化反应而形成[50],舍饲和放牧牦牛肌肉中N-己酸乙烯酯检出的相对含量分别为9.65%和4.73%,二者差异显著(P<0.05)。
在舍饲牦牛肌肉中并未检测到烯烃类化合物,在放牧牦牛肌肉中检测出2-丙烯基环丁烯和苯乙烯2 种烯烃类化合物。含氮含硫及杂环化合物中,舍饲牦牛肌肉中2-戊基呋喃的相对含量为2.34%,显著高于放牧牦牛肌肉中的相对含量,但放牧牦牛肌肉中杂环化合物种类多于舍饲牦牛。某些烷烃类化合物有可能是某些杂化化合物形成过程中的中间体,对形成肉香也有一定作用[45];因此,可能正是由于放牧牦牛肌肉中烷烃类化合物种类较多,所以产生的杂环化合物种类也较多。仅在舍饲牦牛肌肉中检出4-羟基丁酸,其相对含量仅为0.72%,因此对牦牛肉香气贡献并不大。
3 结 论
在牦牛瘤胃微生物方面,放牧牦牛瘤胃微生物多样性显著高于舍饲牦牛,与放牧牦牛相比,舍饲牦牛瘤胃中的拟杆菌门相对丰度明显提高,而厚壁菌门相对丰度明显降低。在牦牛肉品质方面,与放牧牦牛肉相比,舍饲牦牛肌肉中肌内脂肪含量显著提高,滴水损失率、蒸煮损失率、熟肉剪切力、肌纤维密度均显著降低,饱和脂肪酸、单不饱和脂肪酸相对含量显著提高,多不饱和脂肪酸相对显著降低;而放牧饲牦牛肌肉中检测出更多种类的挥发性风味物质。
综上所述,舍饲育肥对牦牛肉品质具有改善作用,但日粮组成改变对其瘤胃微生物区系、肌肉脂肪酸组成及肌肉中挥发性风味物质种类产生影响;因此在进一步研究中,可以通过调整牦牛日粮组成,改善瘤胃微生物区系组成,进而达到既提高牦牛肉品质,又保证牦牛肉营养成分和风味物质组成的目的。
[1]王莉.牦牛肉肌纤维类型组成及其代谢酶活力差异对宰后肉嫩度的影响[D].兰州: 甘肃农业大学, 2016: 1-45.
[2]周立业.不同饲养方式对放牧犊牦牛生长发育及肉品品质的影响[D].兰州: 甘肃农业大学, 2007: 1-43.
[3]WANG Q, ZHAO X, REN Y R, et al.Effects of high pressure treatment and temperature on lipid oxidation and fatty acid composition of yak (Poephagus grunniens) body fat[J].Meat Science,2013, 94(4): 489-494.DOI:10.1016/j.meatsci.2013.03.006.
[4]YIN R H, BAI W L, WANG J M, et al.Development of an assay for rapid identification of meat from yak and cattle using polymerase chain reaction technique[J].Meat Science, 2009, 83(1): 38-44.DOI:10.1016/j.meatsci.2009.03.008.
[5]董全民, 赵新全, 马玉寿, 等.高寒地区暖季草场放牧牦牛的生产性能及其土壤养分变化[J].草地学报, 2009, 17(5): 629-635.DOI:10.3969/j.issn.1007-0435.2009.05.015.
[6]杨宗荣.红原高寒草地生态系统初探[J].四川草原, 1984(3): 54-60.
[7]泽柏.红原县草场类型及其利用的探讨[J].四川草原, 1983(3): 30-36.
[8]方雷.饲养方式对夏季牦牛生长性能、屠宰性能、牛肉品质和瘤胃细菌多样性的影响[D].北京: 中国农业大学, 2015: 1-53.
[9]王莉, 孙宝忠, 保善科, 等.补饲和放养牦牛肉品质及肌肉微观结构差异[J].肉类研究, 2015, 29(6): 5-10.DOI:10.7506/rlyj1001-8123-201506002.
[10]孔祥颖, 张丽, 保善科, 等.放养过程中补饲对青海高原牦牛产肉能力及肉品质的影响[J].中国畜牧兽医, 2015, 42(1): 104-108.DOI:10.16431/j.cnki.1671-7236.2015.01.016.
[11]MAMANI-LINARES L W, GALLO C.Effects of supplementary feeding on carcass and meat quality traits of young llamas (Lama glama)[J].Small Ruminant Research, 2013, 114(2/3): 233-239.
[12]CARBERRY C A, KENNY D A, HAN S, et al.Effect of phenotypic residual feed intake and dietary forage content on the rumen microbial community of beef cattle[J].Applied and Environmental Microbiology,2012, 78(14): 4949-4958.DOI:10.1128/AEM.07759-11.
[13]ELMORE J S, MOTTRAM D S, ENSER M, et al.Effect of the polyunsaturated fatty acid composition of beef muscle on the profile of aroma volatiles[J].Journal of Agricultural and Food Chemistry, 1999,47(4): 1619-1625.DOI:10.1021/jf980718m.
[14]牛克兰, 左惠心, 余群力, 等.不同保水性牦牛肉品质比较及肌原纤维蛋白凝胶特性分析[J].食品工业科技, 2016, 37(23): 81-85.DOI:10.13386/j.issn1002-0306.2016.23.007.
[15]艾鷖, 文勇立, 傅昌秀, 等.金川多胸椎牦牛宰后肌肉色差(ΔE*)、滴水损失率及肌纤维特性分析[J].畜牧兽医学报, 2013, 44(4):649-656.
[16]曹连宾, 崔占鸿, 孙红梅, 等.全放牧牦牛与舍饲牦牛瘤胃细菌多样性比较[J].江苏农业科学, 2016, 44(3): 242-248.DOI:10.15889/j.issn.1002-1302.2016.03.068.
[17]KONG Y H, HE M L, MCALISTER T, et al.Quantitative fluorescence in situ hybridization of microbial communities in the rumens of cattle fed different diets[J].Applied and Environmental Microbiology, 2010,76(20): 6933-6938.DOI:10.1128/AEM.00217-10.
[18]BEKELE A Z, KOIKE S, KOBAYASHI Y.Genetic diversity and diet specificity of ruminal Prevotella revealed by 16S rRNA gene-based analysis[J].FEMS Microbiology Letters, 2010, 305(1): 49-57.DOI:10.1111/j.1574-6968.2010.01911.x.
[19]DE OLIVEIRA M N V, JEWELL K A, FREITAS F S, et al.Characterizing the microbiota across the gastrointestinal tract of a Brazilian Nelore steer[J].Veterinary Microbiology, 2013, 164(3/4):307-314.DOI:10.1016/j.vetmic.2013.02.013.
[20]FERNANDO S C, PURVIS H T, NAJAR F Z, et al.Rumen microbial population dynamics during adaptation to a high-grain diet[J].Applied and Environmental Microbiology, 2010, 76(22): 7482-7490.DOI:10.1128/AEM.00388-10.
[21]COE M L, NAGARAJA T G, SUN Y D, et al.Effect of virginiamycin on ruminal fermentation in cattle during adaptation to a high concentrate diet and during an induced acidosis[J].Journal of Animal Science, 1999, 77(8): 2259-2268.DOI:10.2527/1999.7782259x.
[22]AVGUSTIN G, WALLACE R J, FLINT H J.Phenotypic diversity among ruminal isolates of Prevotella ruminicola: proposal of Prevotella brevis sp.nov., Prevotella bryantii sp.nov., and Prevotella albensis sp.nov.and redefinition of Prevotella ruminicola[J].International Journal of Systematic Bacteriology, 1997, 47(2): 284-288.DOI:10.1099/00207713-47-2-284.
[23]PURUSHE J, FOUTS D E, MORRISON M, et al.Comparative genome analysis of Prevotella ruminicola and Prevotella bryantii:insights into their environmental niche[J].Microbial Ecology, 2010,60(4): 721-729.DOI:10.1007/s00248-010-9692-8.
[24]杨蕾, 王柏辉, 靳烨.反刍动物瘤胃菌群与机体营养沉积研究进展[J].黑龙江畜牧兽医, 2017(15): 85-87; 90.DOI:10.13881/j.cnki.hljxmsy.2017.1327.
[25]RAES K, BALCAEN A, DIRINCK P, et al.Meat quality, fatty acid composition and flavour analysis in Belgian retail beef[J].Meat Science,2003, 65(4): 1237-1246.DOI:10.1016/s0309-1740(03)00031-7.
[26]VESTERGAARD M, OKSBJERG N, HENCKEL P.Influence of feeding intensity, grazing and finishing feeding on muscle fibre characteristics and meat colour of semitendinosus, longissimus dorsi and supraspinatus muscles of young bulls[J].Meat Science, 2000,54(2): 177-185.DOI:10.1016/S0309-1740(99)00097-2.
[27]胡猛, 张文举, 尹君亮, 等.育成荷斯坦奶公牛与其他3 个品种牛的肉品质比较研究[J].中国畜牧兽医, 2013, 40(3): 95-99.DOI:10.3969/j.issn.1671-7236.2013.03.021.
[28]HERNÁNDEZ A J, PASTOR J.Relationship between plant biodiversity and heavy metal bioavailability in grasslands overlying an abandoned mine[J].Environmental Geochemistry and Health, 2008,30(2): 127-133.DOI:10.1007/s10653-008-9150-4.
[29]WOOD J D, ENSER M, FISHER A V, et al.Fat deposition, fatty acid composition and meat quality: a review[J].Meat Science, 2008, 78(4):343-358.DOI:10.1016/j.meatsci.2007.07.019.
[30]WOOD J D.Consequences for meat quality of reducing carcass fatness[M]// WOOD J D, FISHER A V.Reducing fatness in meat animal.Londong: Elsevier Applied Science, 1990: 344-397.
[31]VERNON R G, FLINT D J.Lipid metabolism in farm animals[J].Proceedings of the Nutrition Society, 1988, 47(3): 287-293.DOI:10.1079/pns19880046.
[32]ENSER M, HALLETT K, HEWITT B, et al.Fatty acid content and composition of English beef, lamb and pork at retail[J].Meat Science,1996, 42(4): 443-456.DOI:10.1016/0309-1740(95)00037-2.
[33]HASSIG C A.Fiber-derived butyrate and the preventation of colon cancer[J].Chemistry and Biology, 1997, 4(11): 783-789.DOI:10.1016/S1074-5521(97)90111-3.
[34]DÍAZ M T, ÁLVAREZ I, DE LA FUENTE J, et al.Fatty acid composition of meat from typical lamb production systems of Spain,United Kingdom, Germany and Uruguay[J].Meat Science, 2005,71(2): 256-263.DOI:10.1016/j.meatsci.2005.03.020.
[35]马骋, 梁琪, 文鹏程, 等.岁龄对甘南牦牛肉中脂肪酸与氨基酸含量的影响[J].食品工业科技, 2015, 36(19): 361-365.DOI:10.13386/j.issn1002-0306.2015.19.065.
[36]YOUNG O A, BERDAGUÉ J L, VIALLON C, et al.Fat-borne volatiles and sheepmeat odour[J].Meat Science, 1997, 45(2): 183-200.DOI:10.1016/s0309-1740(96)00100-3.
[37]WOOD J D, RICHARDSON R I, NUTE G R, et al.Effects of fatty acids on meat quality: a review[J].Meat Science, 2004, 66(1): 21-32.DOI:10.1016/s0309-1740(03)00022-6.
[38]SIMOPOULOS A P.The importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases[J].Experimental Biology and Medicine, 2008, 233(6): 674-688.DOI:10.3181/0711-mr-311.
[39]冯晓群, 韩玲.马鹿亚种间杂交后代背最长肌脂肪酸的分析研究[J].肉类工业, 2012(3): 20-25.DOI:10.3969/j.issn.1008-5467.2012.03.011.
[40]MOLONEY A P, MOONEY M T, KERRY J P, et al.Colour of fat,and colour, fatty acid composition and sensory characteristics of muscle from heifers offered alternative forages to grass silage in a finishing ration[J].Meat Science, 2013, 95(3): 608-615.DOI:10.1016/j.meatsci.2013.05.030.
[41]RENAND G, PICARD B, TOURAILLE C, et al.Relationships between muscle characteristics and meat quality traits of young Charolais bulls[J].Meat Science, 2001, 59(1): 49-60.DOI:10.1016/s0309-1740(01)00051-1.
[42]DRANSFIELD E, MARTIN J F, BAUCHART D, et al.Meat quality and composition of three muscles from French cull cows and young bulls[J].Animal Science, 2003, 76(3): 387-399.DOI:10.1017/S1357729800058616.
[43]ISHII T, ISHIBASHI T, MITANI K.Variation in cross-sectional areas of muscle fibers of three body weight groups in skeletal muscles of cattle[J].Japanese Journal of Zoo Technical Science, 1990, 61(8): 695-700.DOI:10.2508/chikusan.61.695.
[44]原琦, 罗爱平, 何光中, 等.不同部位奶公犊小白牛肉挥发性风味物质分析[J].食品与机械, 2015, 31(5): 39-42.DOI:10.13652/j.Issn.1003-5788.2015.05.009.
[45]MOTTRAM D S.Flavour formation in meat and meat products: a review[J].Food Chemistry, 1998, 62(4): 415-424.DOI:10.1016/S0308-8146(98)00076-4.
[46]魏晋梅, 罗玉柱, 王继卿, 等.固相微萃取-气相色谱-质谱联用法检测小白牛肉的挥发性成分[J].食品工业科技, 2011, 32(9): 73-75.DOI:10.13386/j.issn1002-0306.2011.09.096.
[47]徐永霞, 陈清婵, 吴鹏, 等.气相色谱-嗅闻技术鉴定清炖猪肉汤中的挥发性香气物质[J].食品科学, 2011, 32(18): 274-277.DOI:1002-6630(2011)18-0274-04.
[48]LORENZ S, BUETTNER A, ENDER K, et al.Influence of keeping system on the fatty acid composition in the longissimus muscle of bulls and odorants formed after pressure-cooking[J].European Food Research and Technology, 2002, 214(2): 112-118.DOI:10.1007/s00217-001-0427-4.
[49]MOTTRAM D S, EDWARDS R A.The role of triglycerides and phospholipids in the aroma of cooked beef[J].Journal of the Science of Food and Agriculture, 2010, 34(5): 517-522.DOI:10.1002/jsfa.2740340513.
[50]SPANIER A M, SHAHIDI F, PARLIMENT T H, et al.Food flavors and chemistry[M].Cambridge: Royal Society of Chemistry, 2001:280-288.DOI:10.1039/9781847550859.