目前糖尿病已成为一个全球性的严重公共卫生问题,中国糖尿病流行形势尤为严峻。中国糖尿病不仅患者数量巨大,且患病率也高于全球水平,2017年中国糖尿病患病率高达10.9%[1],并呈现明显上升趋势,因此开发有关预防和治疗高血糖的产品很有必要。糖尿病的主要特征是高血糖症,葡萄糖(glucose,Glu)可以通过非酶方法糖化与血浆蛋白生成相应的共价加合物,蛋白质糖化和晚期糖基化终产物(advanced glycation end products,AGEs)的形成在糖尿病及其并发症的发生中起着关键的作用[2]。AGEs是由还原糖羰基与蛋白质的自由氨基之间的非酶反应或褐变反应生成的不可逆的复杂化合物,也称为Maillard反应产物[3]。目前AGEs抑制剂可用于治疗糖尿病及其并发症,因此越来越多关于有效抗糖化剂的研究正在进行,以用于治疗AGEs导致的相关疾病。
AGEs的形成可以由Glu自氧化以及脂质过氧化引起[4],即与抗氧化之间存在一定关系,表明抗糖化剂和抗氧化剂也存在一定的关系。硒(Se)参与许多硒依赖的抗氧化酶的结构和功能,参与细胞免受氧化应激的保护,是生物学中至关重要的元素。硒是谷胱甘肽过氧化物酶等多种酶在细胞中的活性位点,对清除细胞内自由基有直接或间接作用[5-6]。此外,硒和硒蛋白复合物在抑制自由基和活性氧的传播方面具有潜在的抗氧化作用。虎乳灵芝菌核提取物主要是一种构型为β-(1→3)-D-葡聚糖的大分子多糖[7],虎乳灵芝多糖(Lignosus rhinocerotis polysaccharides,LRP)具有独特的多分支结构,由于超声处理产生的空化效应[8-9],其结构会随之发生某种程度上的变化,从而影响其生物活性。研究发现LRP具有抗肿瘤、抗炎症、抗氧化等活性,同时还能促进免疫细胞的增殖[10-12]。
多糖具有抗肿瘤、抗氧化和增强免疫调节的功效,同时硒能有效清除生物体内的自由基,具有较好的保健作用;本实验以LRP为模板,对其进行硒化改性,在超声处理下合成虎乳灵芝多糖-硒纳米粒子(ultrasound treated LRP-selenium nanoparticles,U-LRP-SeNPs),探究SeNPs对非酶糖基化反应的抑制作用,从而为LRP-SeNPs的进一步开发和利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
LRP为采用0.5 mol/L NaOH溶液从虎乳灵芝菌核中提取得到的碱溶性多糖[13];牛血清白蛋白(bovine serum albumin,BSA)、氯化硝基四氮唑兰(nitroblue tetrazolium,NBT)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、氨基胍(aminoguanidine,AG)、溴酚蓝、Glu 国药集团化学试剂公司;其他试剂均为分析纯。实验用水均为2 次去离子水。
1.2 仪器与设备
JY92-IIN型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;UV-1800紫外-可见分光光度计 日本Shimadzu公司;FP-6500型荧光光谱仪 日本Jasco公司;DYY-10C型电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 LRP-SeNPs的制备
按照Cai Wenfei等[14]研究方法,配制3 份1 mg/mL的LRP溶液70 mL,分别依次加入0、1.167、1.750 mL的Na2SeO3溶液(4 mg/mL),30 min后依次逐滴加入与Na2SeO3同等体积的抗坏血酸溶液(18 mg/mL),室温避光搅拌反应24 h。反应后的混合溶液经自来水和蒸馏水分别透析3 d,冷冻干燥后所得样品按照Se/LRP质量比分别标记为Na2SeO3/LRP=1∶15、1∶10。然后取25 mg不同比例的LRP-SeNPs样品复溶于10 mL去离子水中,使用超声波细胞粉碎机以20 kHz、300 W功率进行超声处理10 min。所得样品按照Se/LRP质量比分别标记为U-LRP-SeNPs=1∶15、U-LRP-SeNPs=1∶10。
1.3.2 非酶糖基化体系构建
参考Zhang Liangshuan等[15]研究方法,无菌条件下向培养瓶中加入4 mL 40 mg/mL BSA溶液和3 mL 2 mol/L Glu溶液,加入含0.02%叠氮钠的200 mmol/L的磷酸盐缓冲液(pH 7.4)定容至10 mL,建立完全糖基化体系对照组Fa;如表1所示,同时设立不加样品不含Glu的对照组Fb;加样品不含BSA的对照组Fc;配制3 mg/mL的U-LRP、U-LRP-SeNPs溶液,设置终质量浓度分别为0.6 mg/mL的抑制组F,以AG为阳性对照。在25 ℃恒温培养箱中培养15 d,分别于0、3、6、9、12、15 d进行如下实验。
表1 非酶糖基化体系构成
Table 1 Composition of glucose-BSA non-enzymatic glycosylation systems
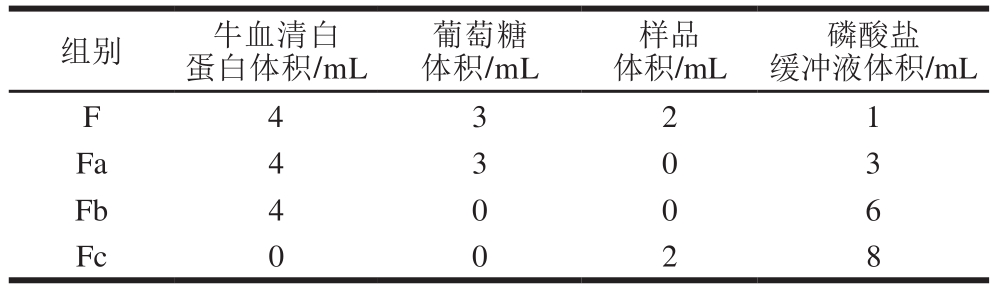
组别 牛血清白蛋白体积/mL葡萄糖体积/mL样品体积/mL磷酸盐缓冲液体积/mL F 4 3 2 1 Fa 4 3 0 3 Fb 4 0 0 6 Fc 0 0 2 8
1.3.3 NBT还原能力的测定
取0.25 mL糖基化产物和1.0 mL 0.3 mmol/L NBT(NBT溶于100 mmol/L pH 10.35碳酸钠缓冲溶液中),两者在室温下混合孵化1 h。在530 nm波长处用紫外-可见分光光度计测定吸光度[16],用碳酸钠缓冲溶液代替糖基化物质作为空白。
1.3.4 二羰基化合物含量的测定
取0.2 mL糖基化产物,0.1 mL 500 mmol/L吉拉德-T储备液和1.7 mL 500 mmol/L pH 2.9甲酸钠溶液在室温下混合孵化1 h。在294 nm波长处测定吸光度[17],以甲酸钠溶液代替糖基化物质作为空白。
1.3.5 非酶糖基化抑制率的测定
取0.75 mL糖基化产物,测定糖基化终产物在激发波长370 nm、发射波长440 nm处的荧光强度F[18],按式(1)计算样品对非酶糖基化的抑制率。
式中:F为样品+BSA+Glu的荧光强度;Fa为BSA+Glu的荧光强度;Fb为只含BSA的荧光强度;Fc为只含样品的荧光强度。
1.3.6 糖基化蛋白生成率的测定
在25 ℃培养15 d后,取出孵化后蛋白;按照Ma Jun等[19]的研究方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)实验;经考马斯亮蓝染色脱色后,用凝胶成像系统拍照,Image Lab 3.0软件分析原BSA和糖基化BSA的光密度值,按式(2)计算糖基化蛋白的生成率。
1.4 数据处理
实验进行3 组平行,3 次重复,所有数据以Origin Pro 2015软件进行处理,结果以平均值±标准差表示。
2 结果与分析
2.1 非酶糖基化体系条件的确定
Glu通过非酶方法糖化与血浆蛋白反应形成共价加合物,最终生成的AGEs在糖尿病及其并发症的发生中起着关键作用。非酶糖基化和氧化反应之间具有密切联系,氧化反应参与非酶糖基化反应,糖基化反应同时又促进氧化反应[20]。AGEs主要通过破坏与其交联的蛋白质,促进机体的氧化应激反应。在非酶糖基化的第一阶段,还原糖与游离氨基反应生成席夫碱,进一步反应生成稳定的酮胺,即Amadori产物;Amadori产物在碱性溶液还原NBT,在530 nm波长处产生最大吸收波长,因此可用果糖胺比色法测定蛋白质初期糖化的程度。在第二阶段,通过氧化脱水,Amadori产物随后降解成多种α-二羰基化合物,这些化合物反应能力更强。在第三阶段,α-二羰基化合物再次与游离氨基反应,通过氧化、脱水和环合反应,形成具有荧光的、不可逆的终产物,通常称为AGEs[21-22]。AGEs会引起不同类型的蛋白质修饰,导致机体结构和功能的损害。因此,本实验在25 ℃恒温培养箱中构建非酶糖基化体系,使用AG作为阳性对照,反应15 d来评价U-LRP-SeNPs对AGEs形成的抑制作用。
2.2 NBT还原实验结果
研究可知U-LRP-SeNPs具备较好的稳定性,U-LRP-SeNPs溶液能够保持均相体系(均匀分散、不会发生明显的相分离和分层现象)16 d,没有任何明显的沉淀产生,粒径略有增加但基本都保持在200 nm内[14]。而非酶糖基化体系反应时间较长,为保证实验结果的准确性,本实验研究超声处理后的U-LRP-SeNPs体系对非酶糖基化的抑制作用,其中BSA+Glu为完全糖基化组,AG+BSA+Glu为阳性对照组,U-LRP-SeNPs+BSA+Glu为抑制组。
在蛋白质非酶糖基化反应发生的早期阶段,还原糖与存在于蛋白质中的自由氨基反应生成席夫碱,然后产生稳定的酮胺,也称为Amadori产物[22-23]。Amadori产物可以还原NBT,然后在530 nm波长处产生最大吸收峰的有色反应物[24],因此可以通过NBT还原实验来研究非酶糖基化反应初期的情况。

图1 NBT还原能力随反应时间的变化
Fig.1 Determination of NBT reducing power as affected by U-LRP and U-LRP-SeNPs
图1为不同Se/LRP质量比的U-LRP-SeNPs对NBT还原实验的产物抑制效果。可以发现,终质量浓度为0.6 mg/mL时,U-LRP和U-LRP-SeNPs对Amadori产物的形成具有一定的抑制活性,但抑制效果较差,存在时间的依赖性。在反应初期(0~4 d),Amadori产物增加最为迅速,其后增长速率有所下降。在15 d的培养时间内,U-LRP-SeNPs=1∶15对Amadori产物的抑制作用相对较好,抑制NBT还原能力依次为U-LRP-SeNPs=1∶15>U-LRP-SeNPs=1∶10。整体结果表明,U-LRP-SeNPs对糖基化反应初期的抑制作用不明显。这主要是因为LRP自身含有部分还原糖,反应初期糖类参与自由氨基反应,因此抑制效果不明显。
2.3 二羰基化合物的含量变化
在中间反应阶段,氧化和脱水后,Amadori产物随后降解产生具有高反应性的二羰基化合物。研究表明,二羰基化合物可以诱导蛋白质的快速交联并产生稳定的AGEs[25],大约45%~50%的AGEs来源于二羰基化合物[26]。如图2所示,二羰基化合物的含量在反应初期增长速率较慢,存在一定的时间依赖性,随着时间的延长而逐渐增加。与完全糖基化组相比,加入U-LRP和U-LRP-SeNPs可以明显降低二羰基化合物的含量,表明终质量浓度为0.6 mg/mL的U-LRP和U-LRP-SeNPs对二羰基化合物的生成有较好的抑制效果。在第15天时,U-LRP-SeNPs=1∶15和U-LRP-SeNPs=1∶10表现出较好的抑制能力,抑制率分别为50%和46%,且U-LRP-SeNPs抑制效果明显强于U-LRP,这与SeNPs的存在有一定关系。研究表明硒可以阻断自由基链反应[27],其次,具有较大比表面积的SeNPs可以提供许多与自由基结合的相关位点,屏蔽或终止了自由基反应,从而有效抑制自由基引发的氧化反应。通常,SeNPs的比表面积与SeNPs尺寸密切相关,其中,粒径越小,比表面积相应越大[14]。此外,SeNPs的稳定性对清除自由基有积极作用[14],因为SeNPs的稳定性较差会导致更多的SeNPs聚集,活性表面减少,与自由基结合的位点减少,从而导致游离的高能态自由基增多,继而引发氧化反应,而超声处理有效提高了U-LRP-SeNPs的分散稳定性,使SeNPs与自由基结合的位点增多,从而屏蔽甚至清除自由基。
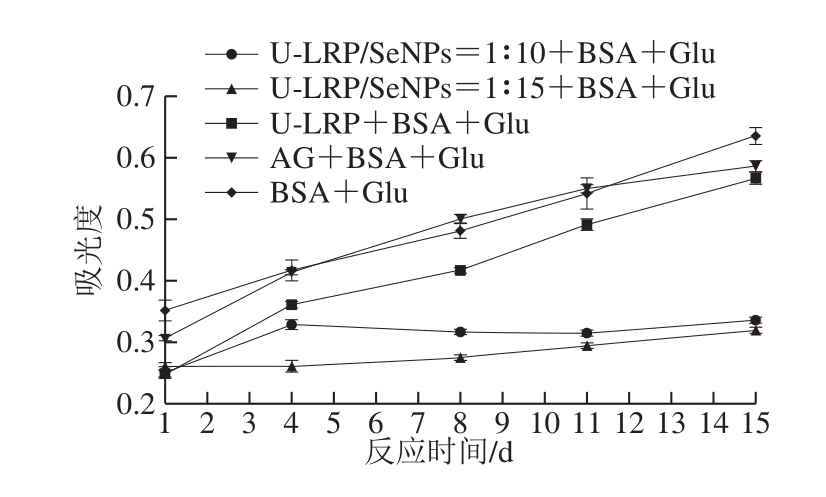
图2 二羰基化合物含量随反应时间的变化
Fig.2 Determination of dicarbonyl compounds as affected by U-LRP and U-LRP-SeNPs
2.4 终产物荧光强度分析结果
在反应末期,α-二羰基化合物再次与自由基反应,通过氧化、脱水和环化等一系列相关反应,形成产生荧光的终产物[22]。如图3所示,到反应末期时,与完全糖基化组相比,加入终质量浓度为0.6 mg/mL的U-LRP-SeNPs可以有效降低荧光强度;其中阳性对照AG组荧光强度明显降低,表明U-LRP-SeNPs和AG能有效抑制AGEs的形成,其中U-LRP-SeNPs=1∶10和U-LRP-SeNPs=1∶15整体的抑制效果较好,处于相对稳定的状态。表2所示为U-LRP和U-LRP-SeNPs对糖基化过程中AGEs的具体抑制率变化。其中U-LRP-SeNPs组对糖基化具有较好的抑制作用,从第8天开始,U-LRP-SeNPs=1∶15抑制率基本保持在20%左右;U-LRP-SeNPs=1∶10抑制率随着时间的延长略有下降但基本保持在30%,前期抑制效果较好,高达37%,后期因抑制剂部分消耗因此有所下降。此外U-LRP抑制效果不理想,直到反应末期才达到10%左右。研究发现,某些物质抗糖基化活性与抗氧化活性密切相关[28],氧化反应和非酶糖基化反应两者相互作用,参与并促进对方体系的反应。氧化应激能激活蛋白激酶C,促进细胞外基质的代谢和相关因子的表达,造成糖尿病及其并发症的发生。AGEs主要通过破坏与其交联的蛋白质,促进机体的氧化应激反应[20]。在之前的抗氧化研究中,U-LRP-SeNPs被证实是具有较好的抗氧化的能力[14],SeNPs的存在是增强体系抗氧化活性的关键因素。而本实验中U-LRP-SeNPs对AGEs的抑制作用明显强于U-LRP,证实了氧化反应和非酶糖基化反应两者之间存在一定关系,同时也说明SeNPs是抑制两者反应发生的重要因素。

图3 终产物荧光强度随反应时间的变化
Fig.3 Determination of fluorescence intensity of AGEs as affected by U-LRP and U-LRP-SeNPs
表2 终产物抑制率
Table 2 Inhibitory ratios of U-LRP-SeNPs on the formation of AGEs

组别 反应时间/d 8 11 15 U-LRP 1.03% 1.00% 10.09%U-LRP-SeNPs=1∶10 37.04% 31.67% 28.96%U-LRP-SeNPs=1∶15 21.75% 19.05% 20.17%
2.5 糖基化蛋白条带图谱及生成率的分析结果
由图4a可知,在分子质量97 kDa处,可见明显的糖基化蛋白条带,表明在AGEs形成期间发生蛋白质与多糖之间的交联结合;加入不同抑制剂以后,可以发现97 kDa处条带的灰度发生不同程度的变化,表明抑制剂U-LRP-SeNPs起到了一定的抑制作用。使用图像分析软件Image Lab 3.0计算每个条带的强度,糖基化BSA与原始BSA的强度比显示在图4b中。U-LRP-SeNPs抑制了糖基化BSA条带的形成,抑制作用U-LRP-SeNPs=1∶15大于U-LRP-SeNPs=1∶10,由条带分析可知抑制率分别为45.8%和40.2%,SDS-PAGE与终产物荧光强度实验结果趋势一致。SDS-PAGE结果表明,U-LRP没有表现出明显的抑制效果;作为抑制剂,U-LRP抗糖基化主要抑制糖基化反应的第二阶段,而在糖基化过程的第一、三阶段抑制效果不明显。AGEs的特征是氧化反应参与了荧光分子交联的形成,Amadori重排产物的形成涉及的是非氧化反应。而U-LRP抗氧化活性较差[14],因此,其非酶糖基化抑制作用也较差[22,29]。综上所述,两种不同比例的U-LRP-SeNPs能够抑制AGEs的形成,可以有效预防由高血糖引起的机体损害,这为其在治疗糖尿病及其并发症和相关功能食品开发方面提供了良好的应用前景和一定的理论依据。

图4 SDS-PAGE糖基化蛋白条带图谱及分析
Fig.4 SDS-PAGE profile of glycosylat protein bands and analysis
2.6 超声作用下SeNPs对AGEs作用机制
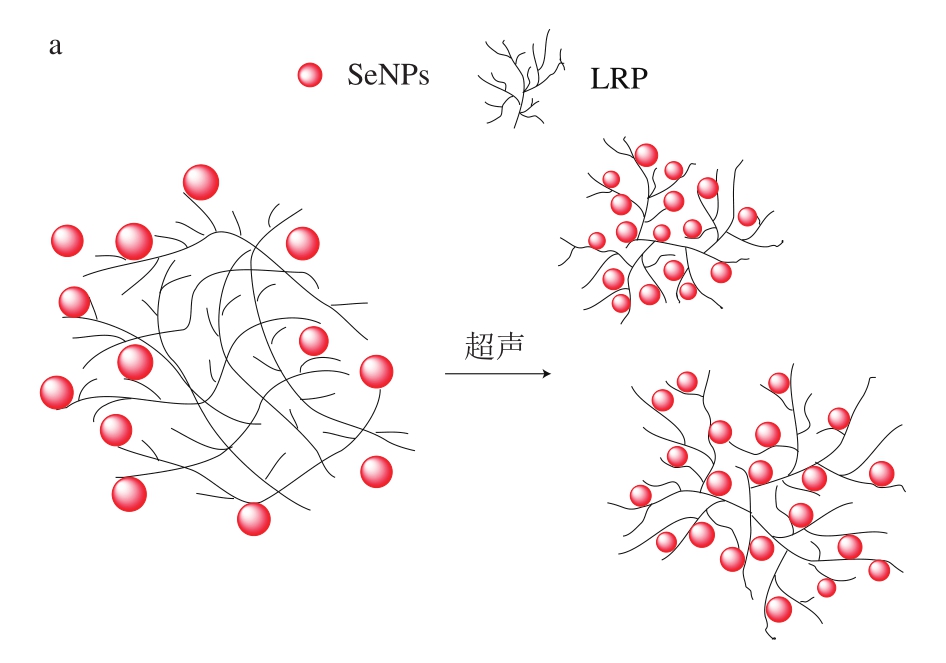
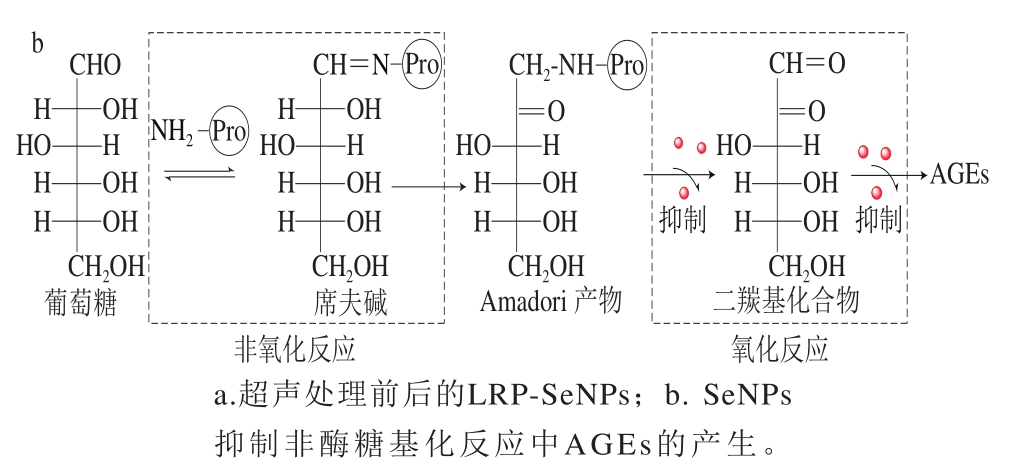
图5 超声作用下SeNPs抑制AGEs产生的机制
Fig.5 Mechanism of the inhibitory effect of ultrasound treated SeNPs on the generation of AGEs
由先前研究可知,由于超声空化效应,支化LRP的缠结链被部分解开,其致密的线团结构变得松散,使得SeNPs容易扩散到LRP内部分支并稳定于分支链中,其中U-LRP-SeNPs=1∶10、1∶15时具有最佳的稳定性和较小的粒径[14]。硒可以中断自由基链反应,小尺寸的SeNPs具有大的比表面积以提供大量的结合位点来屏蔽或终止自由基,从而抑制自由基引发的氧化反应。超声空化效应可以破坏聚集物,使SeNPs能够以尽可能小的尺寸分散并稳定在LRP基质中,这些具有较大比表面积的SeNPs可以提供许多与自由基结合的相关位点,屏蔽或终止自由基,最终抑制自由基引发的氧化反应。由图5糖基化反应过程可以发现,糖基化反应第二、三阶段主要涉及自由基的氧化,第一阶段属于非氧化反应。因此,在第一阶段,即使有SeNPs的存在,其抑制作用也并不明显;当席夫碱环化、异构化重排生成Amadori产物并进一步氧化生成二羰基化合物以及最终生成晚期糖基化产物时,SeNPs存在使得反应进程受到抑制,且U-LRP-SeNPs具有更好的稳定性和比表面积,这使得SeNPs更加充分地参与并抑制自由基引发的非酶糖基化反应的中后期氧化反应,将非酶糖基化反应阻止于氧化阶段,从而大大提高了非酶糖基化反应的抑制效果。而LRP在整个过程中并没有良好的抑制效果,表明SeNPs对非酶糖基化抑制作用的重要性,也从侧面反映出糖基化抑制作用与抗氧化活性密切相关。
3 结 论
非酶糖基化和氧化反应之间具有密切联系,氧化反应是非酶糖基化反应的中后阶段,糖基化反应同时又促进氧化反应。超声处理后具有较好抗氧化活性的U-LRP-SeNPs能有效抑制非酶糖基化反应,且存在一定的剂量依赖效应;其中U-LRP-SeNPs=1∶10、1∶15具有较好的非酶糖基化抑制活性,抑制率分别达到30%和20%。超声处理有效提高了U-LRP-SeNPs稳定性,SeNPs的稳定性对清除自由基有积极作用;具有较大比表面积的SeNPs可以提供许多与自由基结合的位点,屏蔽或终止自由基,有效抑制了自由基引发的氧化反应,最终提高非酶糖基化抑制效果。
[1]杨文英.中国糖尿病的流行特点及变化趋势[J].中国科学(生命科学),2018, 48(8): 812-819.DOI:10.1360/N052018-00005.
[2]WANG X, ZHANG L S, DONG L L.Inhibitory effect of polysaccharides from pumpkin on advanced glycation end-products formation and aldose reductase activity[J].Food Chemistry, 2012,130(4): 821-825.DOI:10.1016/j.foodchem.2011.07.064.
[3]ZHANG L, ZHANG C J, TU Z C, et al.Nelumbo nucifera, leaf extracts inhibit the formation of advanced glycation end-products and mechanism revealed by nano LC-orbitrap-MS/MS[J].Journal of Functional Foods, 2018, 42: 254-261.DOI:10.1016/j.jff.2018.01.012.
[4]LEE A Y W, CHUNG S S M.Contributions of polyol pathway to oxidative stress in diabetic cataract[J].The FASEB Journal, 1999,13(1): 23-30.DOI:10.0000/PMID9872926.
[5]LI Y, LI X, WONG Y S, et al.The reversal of cisplatin-induced nephrotoxicity by selenium nanoparticles functionalized with 11-mercapto-1-undecanol by inhibition of ROS-mediated apoptosis[J].Biomaterials, 2011, 32(34): 9068-9076.DOI:10.1016/j.biomaterials.2011.08.001.
[6]PAN D, LIU J, ZENG X, et al.Immunomodulatory activity of selenium exopolysaccharide produced by Lactococcus lactis subsp.Lactis[J].Food and Agricultural Immunology, 2015, 26(2): 248-259.DOI:10.1080/09540105.2014.894000.
[7]胡婷.虎乳灵芝多糖的多级结构及溶液行为研究[D].武汉: 华中农业大学, 2017: 38-59.
[8]MALLAKPOUR S, RASHIDIMOGHADAM S.Application of ultrasonic irradiation as a benign method for production of glycerol plasticized-starch/ascorbic acid functionalized MWCNTs nanocomposites: investigation of methylene blue adsorption and electrical properties[J].Ultrasonics Sonochemistry, 2018, 40: 419-432.DOI:10.1016/j.ultsonch.2017.07.032.
[9]YAN J K, PEI J J, MA H L, et al.Effects of ultrasound on molecular properties, structure, chain conformation and degradation kinetics of carboxylic curdlan[J].Carbohydrate Polymers, 2015, 121: 64-70.DOI:10.1016/j.carbpol.2014.11.066.
[10]BI H, GAO T, LI Z, et al.Structural elucidation and antioxidant activity of a water-soluble polysaccharide from the fruit bodies of Bulgaria inquinans (Fries)[J].Food Chemistry, 2013, 138(2/3):1470-1475.DOI:10.1016/j.foodchem.2012.11.039.
[11]LIU M, MENG G, ZHANG J, et al.Antioxidant and hepatoprotective activities of mycelia selenium polysaccharide by Hypsizigus marmoreus SK-02[J].Biological Trace Element Research, 2016,172(2): 437-448.DOI:10.1007/s12011-015-0613-z.
[12]LEE S, TAN N, FUNG S, et al.Anti-inflammatory effect of the sclerotium of Lignosus rhinocerotis (Cooke) Ryvarden, the tiger milk mushroom[J].BMC Complementary and Alternative Medicine, 2014,14(1): 359.DOI:10.1186/1472-6882-14-359.
[13]HU T, HUANG Q, WONG K, et al.A hyperbranched β-d-glucan with compact coil conformation from Lignosus rhinocerotis sclerotia[J].Food Chemistry, 2017, 225: 267-275.DOI:10.1016/j.foodchem.2017.01.034.
[14]CAI Wenfei, HU Ting, BAKRY A M, et al.Effect of ultrasound on size, morphology, stability and antioxidant activity of selenium nanoparticles dispersed by a hyperbranched polysaccharide from Lignosus rhinocerotis[J].Ultrasonics Sonochemistry, 2018, 42:823-831.DOI:10.1016/j.ultsonch.2017.12.022.
[15]ZHANG Liangshuan, WANG Xuan, DONG Lulu.Antioxidation and antiglycation of polysaccharides from Misgurnus anguillicaudatus[J].Food Chemistry, 2011, 124(1): 183-187.DOI:10.1016/j.foodchem.2010.06.006.
[16]BAKER J R, ZYZAK D V, THORPE S R, et al.Chemistry of the fructosamine assay: D-glucosone is the product of oxidation of Amadori compounds[J].Clinical Chemistry, 1994, 40(10): 1950-1955.DOI:10.1016/0009-9120(94)00046-8.
[17]WELLS-KNECHT K J, ZYZAK D V, LITCHFIELD J E, et al.Mechanism of autooxidative glycosylation: identification of glyoxal and arabinose as intermediates in the autoxidative modification of proteins by glucose[J].Biochemistry, 1995, 34(11): 3702-3709.DOI:10.1021/bi00011a027.
[18]WANG Z B, CHEN B B, LUO L, et al.Fractionation, physicochemical characteristics and biological activities of polysaccharides from Pueraria lobata roots[J].Journal of the Taiwan Institute of Chemical Engineers, 2016, 67: 54-60.DOI:10.1016/j.jtice.2016.07.029.
[19]MA Jun, LIANG Shujun, WANG Zhigang, et al.ROCK pathway participates in the processes that 15-hydroxyeicosatetraenoic acid(15-HETE) mediated the pulmonary vascular remodeling induced by hypoxia in rat[J].Journal of Cellular Physiology, 2010, 222(1): 82-94.DOI:10.1002/jcp.21923.
[20]汤剑明, 洪莉.氧化应激调控细胞外基质代谢的研究进展[J].中国医药导报, 2016, 13(4): 36-40.
[21]张良栓.泥鳅多糖抗氧化及抗蛋白质非酶糖基化活性研究[D].哈尔滨: 哈尔滨医科大学, 2010: 8-16.
[22]WU J W, HSIEH C L, WANG H Y, et al.Inhibitory effects of guava(Psidium guajava L.) leaf extracts and its active compounds on the glycation process of protein[J].Food Chemistry, 2009, 113(1): 78-84.DOI:10.1016/j.foodchem.2008.07.025.
[23]WANG X, ZHANG L S, DONG L L.Inhibitory effect of polysaccharides from pumpkin on advanced glycation end-products formation and aldose reductase activity[J].Food Chemistry, 2012,130(4): 821-825.DOI:10.1016/j.foodchem.2011.07.064.
[24]JOHNSON R N, METCALF P A, BAKER J R.Fructosamine: a new approach to the estimation of serum glycosylprotein.An index of diabetic control[J].Clinica Chimica Acta, 1983, 127(1): 87-95.DOI:10.1016/0009-8981(83)90078-5.
[25]MEADE S J, GERRARD J A.The structure-activity relationships of dicarbonyl compounds and their role in the Maillard reaction[C]//International Congress Series, Kumamoto, Japan, 2001: 455-456.
[26]RUGGIERO-LOPEZ D, LECOMTE M, MOINET G, et al.Reaction of metformin with dicarbonyl compounds.Possible implication in the inhibition of advanced glycation end product formation[J].Biochemical Pharmacology, 1999, 58(11): 1765-1773.DOI:10.1016/S0006-2952(99)00263-4.
[27]NAVARRO-ALARCON M, CABRERA-VIQUE C.Selenium in food and the human body: a review[J].Science of the Total Environment,2008, 400(1/2/3): 115-141.DOI:10.1016/j.scitotenv.2008.06.024.
[28]ZHA X Q, LI X L, ZHANG H L, et al.Pectinase hydrolysis of Dendrobium huoshanense polysaccharide and its effect on protein nonenzymatic glycation[J].International Journal of Biological Macromolecules, 2013, 61: 439-447.DOI:10.1016/j.ijbiomac.2013.08.008.
[29]FU M X, WELLS-KNECHT K J, BLACKLEDGE J A, et al.Glycation, glycoxidation, and cross-linking of collagen by glucose:kinetics, mechanisms, and inhibition of late stages of the Maillard reaction[J].Diabetes, 1994, 43(5): 676-683.DOI:10.2337/diabetes.43.5.676.