酸枣(Ziziphus jujube Mill.var.spinosa (Bunge) Hu ex H.F.Chou)属于鼠李科(Rhammaceae)枣属(Ziziphus Mill.),别名野枣、山枣等。酸枣作为药物,始载于《神农本草经》,被列为上品。酸枣广泛分布于我国华北、西北广大低山丘陵地区,资源酸枣蕴藏量巨大。现代研究表明,酸枣中含有大量的糖类[1]、生物碱类[2]、黄酮类[3]、三萜及其皂苷类[4]等化学成分,具有镇静催眠[5]、抗氧化[6]、增强免疫力[7]、保肝[1]以及预防动脉硬化[8]等多种保健功效。酸枣可被加工成酸枣酒[9]、酸枣醋[10]、酸枣面[11]、酸枣汁[12]等多种食品,但每年仍有大量酸枣果肉资源作为酸枣药用植物的废弃组织被丢弃,造成巨大的资源浪费。
干燥是食品传统的保存方法,能够抑制微生物的繁殖,减少营养物质的损失,有利于食品的保藏。目前食品干燥多采用自然晒干(sun drying,SD)、热风干燥(hot-air drying,HAD)和冷冻干燥(freeze drying,FD)等技术。Peinado等[13]研究了葡萄在SD过程中酚类物质变化,黄酮类成分含量在SD过程中一直呈现上升趋势。闫旭等[14]研究了干燥方式对番石榴活性物质及抗氧化活性的影响,发现60 ℃和75 ℃干燥的番石榴中总酚和抗坏血酸含量较高,且番石榴能够保持较强的抗氧化能力。许晴晴等[15]研究了FD和HAD对蓝莓品质的影响,发现FD在保持蓝莓复水性、感官品质和活性成分等方面比HAD具有明显优势。尽管酸枣在众多领域有着丰富的应用,但目前关于干燥方式对酸枣果肉品质影响的研究鲜见报道。
基于氢核磁共振(1H nuclear magnetic resonance,1H NMR)的分析技术重现性好、分析时间短、备样方法简单,可以获得几乎全部含氢化合物的信息,相对于液相色谱,NMR的优势体现在可以检测大部分的有机化合物。代谢组学技术与多元统计分析手段结合不仅可以确定样本之间的相似性或均一性,而且可以确定引起组间差异的化学成分。目前已广泛应用于食品的组分分析[16]、中药化学成分鉴定和质量评价[17]研究等方面。Mediani等[18]研究不同采收期对两种叶下珠属植物化学成分和生物活性的影响,通过1H NMR技术结合多元统计分析能够准确得到不同采收期与化学成分的关系,进而与生物活性关联,全面分析三者之间的相关性;Pariyani等[19]研究不同干燥技术对猫须草叶化学成分及生物活性的影响,采用1H NMR技术结合多元统计综合分析干燥方式、代谢化合物和活性三者的关系,从而快速选择能够保留影响活性较高的代谢化合物的干燥方式。本课题组前期已将NMR技术应用于葛根芩连汤[20]、酸枣仁[21]活性成分研究。
本实验选取实际生产中较为成熟的SD、FD和HAD 3 种干燥方式,以酸枣果肉中多糖、总酚和总黄酮等活性物质含量以及体外抗氧化活性为指标,整合1H NMR技术与多元统计分析方法,考察不同干燥方式对酸枣果肉代谢产物及抗氧化活性的影响,以期优选合理的干燥方式,为酸枣的产地加工提供合理的科学依据。
1 材料与方法
1.1 材料与试剂
2018年9 月于山西省晋中市榆次区乌金山镇(东经112°44'52”,北纬37°46'2”)采集成熟酸枣果实,经山西中医药大学裴香萍副教授鉴定为鼠李科植物酸枣(Ziziphus jujube Mill.var.spinosa (Bunge) Hu ex H.F.Chou)的果实。
2,2 '-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、2,4,6-三(2-吡啶基)三嗪(2,4,6-tri(2-pyridyl)-1,3,5-triazine,TPTZ)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、没食子酸、福林-酚试剂 北京索莱宝科技有限公司;重水(D2O)美国Norell公司;氘代甲醇和3-(三甲基硅基)氘代丙酸钠(sodium-3-(trimethylsilyl)propionate-2,2,3,3-d4,TSP)青岛腾龙微波科技有限公司;氘代氢氧化钠 瑞士Armar公司;芦丁 阿拉丁试剂(上海)有限公司;硝酸铝、氢氧化钠、亚硝酸钠、三氯化铁、过硫酸钾、无水乙酸钠、葡萄糖、氯仿、苯酚均为国产分析纯。
1.2 仪器与设备
LGJ-10C型冷冻干燥机 北京四环科学仪器厂有限公司;BGZ-76型电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;UV-6100S紫外-可见分光光度计 上海元析仪器有限公司;DL-5-B低速离心机 上海安亭科学仪器厂;KQ5200E型超声波清洗器 昆山市超声仪器有限公司;FA3204B电子天平 上海精科天美科学仪器有限公司;600-MHz AVANCE III NMR Spectrometer(600.13 MHz质子频率) 德国布鲁克公司。
1.3 方法
1.3.1 样品干燥方法
分别取18 份新鲜酸枣,洗净晾干,每份30 g均匀放入搪瓷托盘中待进一步干燥处理。HAD:酸枣使用鼓风干燥箱干燥26 h,温度为60 ℃,干燥结束后称质量;FD:酸枣放于冷冻干燥机中干燥48 h,真空压力为20 Pa,冷凝温度-50 ℃,干燥结束后称质量;SD:酸枣白天以太阳光直射,温度为23~28 ℃,晚上控制温度在20~25 ℃,干燥6 d,干燥结束后取出称质量。所有酸枣干燥完成后剔除果核,将果肉用粉碎机粉碎后过60 目筛,密封保存于干燥器中。
1.3.2 水分质量分数的测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[22]直接干燥法进行干燥。干燥结束后失水率按照公式(1)计算。
1.3.3 基本化学成分测定
1.3.3.1 多糖含量测定
多糖含量测定采用苯酚-硫酸法[23]。精密称取干燥后的酸枣粉末0.50 g于50 mL三角锥瓶中,加入25 mL去离子水超声提取30 min,滤渣加入50 mL去离子水,90 ℃回流提取1 h,离心合并两次上清液,旋转蒸发浓缩至10 mL,加无水乙醇至溶液乙醇体积分数70%,4 ℃静置过夜,离心取沉淀,去离子水定容至25 mL,得到酸枣果肉多糖水提取液。取上述水提取液测定多糖含量,结果以每克干质量酸枣果肉中葡萄糖质量表示,单位为mg/g。标准曲线以葡萄糖溶液为标准溶液绘制,得到回归方程y=0.012 8x+0.046(x的线性范围15.81~50.84 µg/mL,R2=0.997 3)。
1.3.3.2 总酚含量测定
总酚含量测定采用福林-酚比色法[24]。精密称取干燥后的酸枣粉末0.50 g于50 mL三角锥瓶中,精密加入体积分数60%乙醇溶液25 mL,称量质量,超声处理30 min,用体积分数60%乙醇溶液补足损失的质量,得到酸枣果肉醇提取液(质量浓度为20 mg/mL)。取上述乙醇提取液测定总酚含量,结果以每克干质量酸枣果肉中没食子酸质量表示,单位为mg/g。标准曲线以没食子酸标准品溶液绘制,得到回归方程y=0.063 9x-0.005 6(x的线性范围3.89~12.01 µg/mL,R2=0.999 5)。
1.3.3.3 总黄酮含量测定
总黄酮含量测定采用NaNO2-Al(NO3)3比色法[25]。取醇提取液测定总黄酮含量,结果以每克干质量酸枣果肉中芦丁质量表示,单位为mg/g。标准曲线以芦丁标准溶液绘制,得到回归方程y=0.112 1x-0.033 1(x的线性范围2.43~6.03 µg/mL,R2=0.999 3)。
1.3.4 抗氧化活性测定
1.3.4.1 ABTS阳离子自由基清除能力测定
ABTS阳离子自由基清除实验参考Zheng Meiyu等[26]的方法。取140 mmol/L过硫酸钾溶液88 μL和10 mmol/L ABTS储备液5.0 mL混合,避光37 ℃静置过夜制备ABTS储备液,使用时以无水乙醇将ABTS储备液稀释至734 nm波长处吸光度为0.70±0.02,得ABTS工作液。取4.0 mL ABTS工作液加入逐级稀释的酸枣果肉乙醇提取液(0.3、0.4、0.5、0.6、0.7、0.8 mg/mL)1.0 mL,暗处放置30 min后在734 nm波长处测得样品溶液的吸光度A2。用同体积的无水乙醇作空白对照,操作同前,测得对照溶液吸光度A1。ABTS阳离子自由基清除率按公式(2)计算,以每克干质量酸枣果肉中VC质量表示,单位为µg/g。标准曲线以VC标准液绘制,得到回归方程y=0.061x+0.012 5(x的线性范围6.58~12.50 µg/mL,R2=0.997 9)。
1.3.4.2 DPPH自由基清除能力测定
DPPH自由基清除实验参考Xiong Shuangli等[27]的方法并略作修改。精密称取10.0 mg DPPH于2.0 mL的容量瓶中,用无水乙醇定容,使用时加无水乙醇稀释至吸光度在0.7~0.8范围内。吸取逐级稀释的酸枣果肉乙醇提取液(0.2、0.4、0.6、0.8、1.0、1.2 mg/mL)1.0 mL,分别加入3.0 mL稀释后的DPPH溶液,暗处静置30 min后在517 nm波长处测得样品溶液的吸光度A2,用同体积的无水乙醇做空白对照,操作同前,测得对照溶液吸光度A1。DPPH自由基清除率按公式(3)计算,以每克干质量酸枣果肉中VC质量表示,单位为µg/g。标准曲线以VC标准液绘制,得到回归方程y=0.105x+0.112 2(x的线性范围2.59~7.80 µg/mL,R2=0.998 8)。
1.3.4.3 总还原能力测定
总还原能力(ferric ion reducing antioxidant power,FRAP)的测定参考Pulido等[28]的方法并略作修改。将300 mmol/L醋酸盐缓冲液(pH 3.6)、20 mmol/L氯化铁、10 mmol/L TPTZ(40 mmol/L盐酸配制)按体积比10∶1∶1混合,37 ℃反应10 min得FRAP工作液。精密吸取逐级稀释的酸枣果肉乙醇提取溶液(0.4、0.5、0.6、0.7、0.8、0.9 mg/mL)0.1 mL,加去离子水2.0 mL,FRAP工作液3.0 mL,摇匀,避光放置30 min,以去离子水为空白对照,于596 nm波长处测定吸光度。以每克干质量酸枣果肉中VC质量表示,单位为mg/g。标准曲线以VC标准液绘制,得到回归方程y=0.004x-0.006 7(y为596 nm波长处的吸光度;x为VC标准液质量浓度,线性范围71.93~190.68 µg/mL,R2=0.998 1)。
1.3.5 基于1H NMR技术的化学成分鉴定
1.3.5.1 样品制备
样品制备参照赵晓喆等[29]的方法。精密称取干燥后的酸枣粉末约0.2 g,置于10 mL离心管中,加氯仿-甲醇-水混合溶液(2∶1∶1,V/V)6 mL,漩涡混匀1 min,超声提取25 min,室温下离心(3 500 r/min)25 min得到甲醇-水和氯仿层,保留甲醇-水层,并减压浓缩蒸干。甲醇-水层用400 μL氘代甲醇与400 μL缓冲重水(缓冲液:KH2PO4溶于D2O中,以1 mol/L氘代氢氧化钠溶液调节pH值至6.0,含0.1% TSP)超声溶解,移至1.5 mL离心管中,13 000 r/min离心10 min,取上清液600 μL于5 mm核磁管中待测。
1.3.5.2 1H NMR测定
样品在25 ℃下于600 MHz NMR仪中测定(频率600.13 MHz),扫描次数为64,谱宽12 345.7 Hz,傅里叶变换频率0.188 Hz,脉冲时间为14 µs,采样时间2.654 s,延迟时间为1.0 s。甲醇-水相提取物核磁测定采用Noesygppr1D序列压制水峰,用氘代甲醇进行锁场,内标为3-(三甲基硅基)氘代丙酸钠。
1.4 数据处理与分析
实验样品平行测定3 次,结果以平均值±标准差表示,用SPSS Statistics 20软件进行方差分析,并用Duncan's法进行多重比较,以P<0.05表示差异或相关性显著。NMR图谱采用Mest ReNova软件进行处理,NMR图谱经过定标、相位、基线校准后,以δ 0.01积分段对化学位移区间δ 0.0~10.0进行分段积分,其中δ 4.70~5.02(残余水峰)和δ 3.30~3.38(残余甲醇峰)不进行积分。将积分数据导入SIMCA-P 13.0软件中进行主成分分析(principal component analysis,PCA),再用偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal PLS-DA,OPLS-DA)找出差异代谢物。使用SIMCA-P软件对差异代谢物、基本化学成分和抗氧化活性进行PLS回归分析。
2 结果与分析
2.1 干燥方式对酸枣失水率的影响
不同干燥样品的失水率依次为HAD(84.53%)>SD(79.78%)>FD(78.83%),相对标准偏差均在5%以内,结果见表1。其中HAD样品失水率最大,达到84.53%,可能是HAD热效率较高,有利于水分的快速散失。
2.2 干燥方式对酸枣多糖、总酚、总黄酮含量及抗氧化活性的影响
如表1所示,多糖含量依次为SD>HAD>FD。FD样品的多糖含量相对较低,可能因为冷冻对植物细胞壁的增强作用,阻碍了多糖等物质的释放[19]。
如表1所示,不同干燥样品的总酚含量依次为HAD>FD>SD。HAD样品中总酚含量最高,可能是由于加热过程导致细胞结构破坏,有利于总酚的释放和提取[30];也可能由于高温抑制了多酚氧化酶的活性,从而减少其多酚类成分的分解[31]。SD样品中总酚含量最低,可能是由于样品长时间与氧气接触,导致多酚类物质因氧化而损失。
黄酮类化合物是广泛存在于植物果皮中的一类酚类化合物,主要包括黄酮醇、黄烷酮、查耳酮、花色素等[32]。本研究中不同干燥方式下的黄酮含量无显著性差异(表1),已有研究亦表明不同干燥方式对黄酮含量的影响无显著性差异[33-34]。但长时间高温加热可能会对黄酮类成分有明显破坏作用[35],这与本研究结果基本一致。
本实验比较了HAD、FD、SD 3 种不同干燥方式对酸枣果肉60%体积分数乙醇提取物抗氧化能力的影响。由表1可以看出,3 种干燥方式下的ABTS阳离子自由基清除能力大小依次为SD≈FD>HAD;DPPH自由基清除能力大小依次为FD>SD>HAD;总还原能力依次为SD>FD>HAD。3 种抗氧化活性的测定结果不完全一致,可能是由于不同干燥方式样品中代谢产物种类和含量存在差异。
表1 不同干燥方式酸枣果肉的基本化学成分含量及抗氧化活性(n= 6)
Table 1 Contents of chemical constituents and antioxidant activity of ziziphi spinosae sarcocarp dried by different drying methods (n= 6)

注:同行肩标小写字母不同表示差异显著(P<0.05)。
指标 HAD FD SD失水率/% 84.53±2.62 78.83±4.91 79.78±3.05多糖含量/(mg/g) 36.78±1.92b31.42±2.67a39.47±0.83b总酚含量/(mg/g) 37.23±5.16a34.31±5.99a32.13±1.53a总黄酮含量/(mg/g) 2.24±0.24a 2.46±0.46a 2.49±0.15a ABTS阳离子自由基清除率/(µg/g) 28.05±0.56a36.02±1.38b37.56±2.74b DPPH自由基清除率/(µg/g) 3.41±0.13a 5.60±1.12c 3.99±0.14b FRAP/(mg/g) 0.17±0.00a 0.19±0.03a 0.20±0.04a
2.3 基于1H NMR技术数据分析结果
2.3.1 基于1H NMR技术的代谢产物指认结果
如图1所示,通过分析每个化合物的化学位移、偶合常数及峰形等信息,结合文献并参照HMDB和BMRB数据库对本实验图谱进行指认,共指认出32 种代谢产物,如表2所示。1H NMR图谱大致可以分为3 个区域:有机酸和氨基酸区(δ 3.10~0.00)主要包括丙氨酸、脯氨酸、蛋氨酸等;糖区(δ 5.50~3.10)鉴定的成分包括α-葡萄糖、β-葡萄糖、木糖等;芳香区(δ 9.50~5.50)鉴定的成分包括没食子酸、腺苷、腺嘌呤等。本节主要针对1H NMR图谱中峰相对较为明显的化合物进行分析描述。氨基酸的特征峰主要在δ 3.10~1.20,脯氨酸分别在δ 1.99(m)、δ 2.08(m)、δ 2.34(m)处有特征峰,苏氨酸的特征峰位于δ 1.33(d,J=6.6 Hz);在δ 3.70~3.35的糖区也包含了一些氨基酸的α-H信号,δ 3.35(s)、δ 3.73(t,J=5.4,6.6 Hz)的特征峰鉴定为精氨酸,δ 3.54(s)为甘氨酸的特征峰。δ 5.50~3.20的糖区信号相对较强,具有明显的糖类化合物的信号特征,如δ 5.39(d,J=4.2 Hz)处的特征峰证实了蔗糖的存在,β-葡萄糖明显的双峰位于δ 4.58(d,J=7.8 Hz)处,δ 3.20(t,J=7.8,9.0 Hz)、δ 5.18(d,J=3.6 Hz)的特征峰则归属于木糖。δ 8.32~7.00的芳香区中如没食子酸的特征峰位于δ 7.03(s),在δ 8.32(s)处的单峰归属于腺嘌呤。

图1 不同干燥方式的酸枣果肉1H NMR图谱
Fig.1 1H NMR spectra of ziziphi spinosae sarcocarp dried by different drying methods
表2 酸枣果肉中主要化学成分的1H-NMR图谱数据归属
Table 2 1H NMR assignments of major metabolites in ziziphi spinosae sarcocarp

编号 代谢物 化学位移(δ) 编号 代谢物 化学位移(δ)1 3-羟基丁酸 1.20(d,6.6 Hz)、4.17(s) 17 果糖 3.55(s)、4.34(t,4.8 Hz,4.2 Hz)2 苏氨酸 1.33(d,6.6 Hz) 18 二甲基甘氨酸 3.70(s)3 丙氨酸 1.48(d,7.2 Hz) 19 α-葡萄糖 3.87(d,1.8 Hz)4 N-乙酰谷氨酸 1.85(m) 20 甜菜碱 3.89(s)5 脯氨酸 1.99(m)、2.08(m)、2.34(m) 21 肌酸酐 3.90(s)6 蛋氨酸 2.12(s)、2.76(t, 15.6 Hz,7.2 Hz) 22 β-葡萄糖 4.58(d,7.8 Hz)7 α-氨基丁酸 2.24(s) 23 半乳糖 4.74(s)、5.45(d, 4.2 Hz)8 谷氨酸 2.45(m) 24 大枣皂苷II 5.11(s)9 二甲胺 2.63(s) 25 蔗糖 5.39(d,4.2 Hz)10 天冬氨酸 2.83(d,3.6 Hz) 26 棉籽糖 5.41(d,3.6 Hz)11 肌酸 3.04(s) 27 尿囊素 5.38(s)12 胆碱 3.16(s) 28 二甲基甲酰胺 7.00(s)13 木糖 3.20(t,7.8 Hz,9.0 Hz)、5.18(d,3.6 Hz) 29 没食子酸 7.03(s)14 芦丁 7.66(d,2.4 Hz) 30 尿苷 7.92(d,7.8 Hz)15 精氨酸 3.35(s)、3.73(t,5.4 Hz,6.6 Hz) 31 腺苷 8.06(s)、8.14(s)、8.26(s)16 甘氨酸 3.54(s) 32 腺嘌呤 8.32(s)
2.3.2 多元统计分析结果
2.3.2.1 PCA分析结果
PCA分析的得分散点图能直观地显示不同样品之间的整体差异,且在得分图中,投影在某主成分上的绝对值越大,表明该主成分对该类的区分影响越大[36]。图2为3 种不同干燥方式的PCA得分散点图,由主成分1(贡献率29.3%)和主成分2(贡献率15.2%)为坐标构建。FD样品位于散点图的左侧,HAD样品位于散点图右下部,SD样品位于散点图右上部,具有一定的分离趋势,说明经3 种干燥方式处理后酸枣果肉所含化学成分存在一定差异。
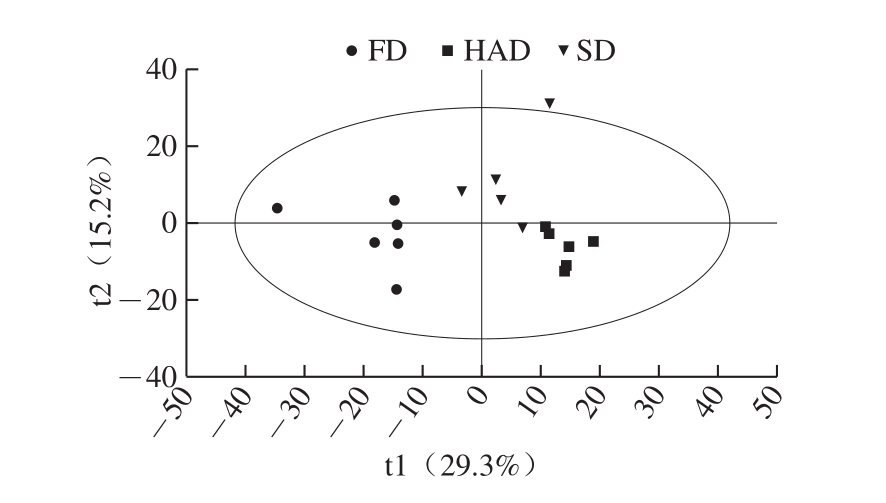
图2 不同干燥方式的酸枣果肉化学成分PCA得分图
Fig.2 PCA score plots of ziziphi spinosae sarcocarp dried by different drying methods
2.3.2.2 PLS-DA及OPLS-DA分析结果
PCA为无监督的分析方法,在确定差异成分时不能忽略组内误差,也不能消除与研究目的无关的随机误差。因此,需要采用有监督的OPLS-DA,以确定不同干燥方式之间的化学差异成分。通过HAD和SD的OPLS-DA得分图(图3A)、FD和HAD的OPLS-DA得分图(图4A)可以看出,分类效果优于PCA分析,组内差异明显降低,更有利于准确地确定组间差异。但是OPLS-DA的使用必须以PLS模型通过验证为基础,排列模型用于验证PLS-DA模型的拟合程度。HAD和SD的PLS-DA 200 个排列模型(图3B)的参数为R2=0.939 9、Q2=0.712 6;FD和HAD的PLS-DA 200 个排列模型(图4B)的参数为R2=0.987 5、Q2=0.919 2,图3B与图4B中Q2回归线与左边纵轴均相交于零点以下,且左边Q2实验值低于右边的原始值,说明模型有效,可以继续鉴定差异性化学成分。
由HAD和SD的OPLS-DA柱状载荷图(图3C)可以看出,HAD样品中大部分糖区化合物以及芳香区化合物含量高于SD样品;而SD样品中有机酸及氨基酸区中化合物以及少部分糖区的化合物含量高于HAD样品。S-plot图中变量对分类的重要程度由变量投影重要度(variable importance in the projection,VIP)值来衡量,变量离原点越远,VIP值越大。将VIP>1作为筛选差异化合物的判定标准,对差异化合物进行初步鉴定,共找出14 个差异化合物。其中,HAD样品中3-羟基丁酸(1)、蛋氨酸(6)、肌酸(11)、木糖(13)、甘氨酸(16)、果糖(17)、肌酸酐(21)、大枣皂苷II(24)8 个差异代谢物相对含量高于SD样品;而SD样品中丙氨酸(3)、N-乙酰谷氨酸(4)、脯氨酸(5)、二甲胺(9)、二甲基甘氨酸(18)、β-葡萄糖(22)6 个差异代谢物相对含量高于HAD样品(图3D)。
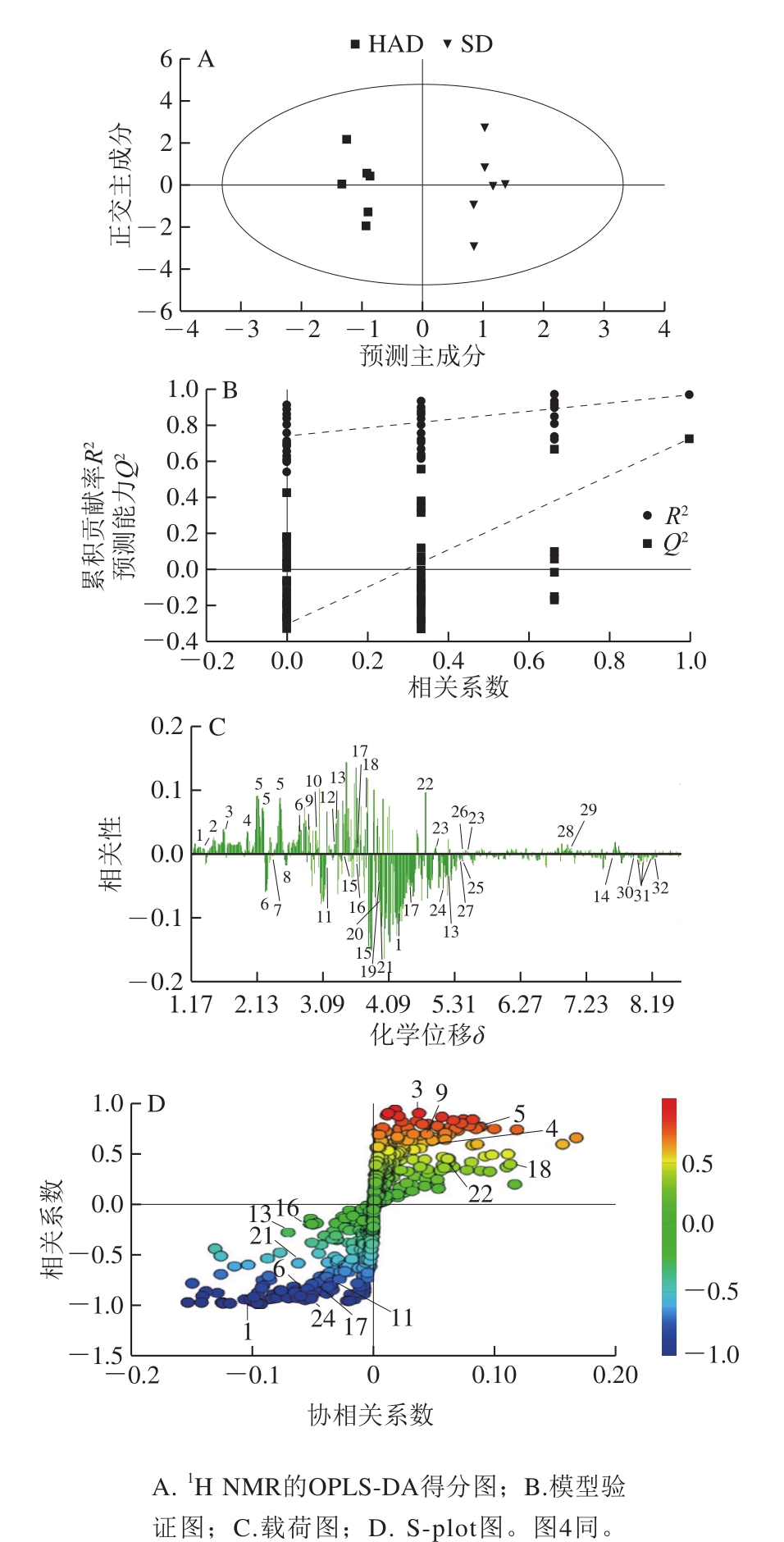
图3 HAD和SD酸枣果肉1H NMR多元统计分析
Fig.3 1H NMR multiple statistical analysis of hot-air dried and sun dried ziziphi spinosae sarcocarp
由FD和HAD的OPLS-DA柱状载荷图(图4C)可以看出。HAD样品中大部分有机酸、氨基酸区化合物以及糖区化合物含量高于FD样品;FD样品中芳香区化合物、少部分有机酸及氨基酸区化合物含量高于HAD样品。将VIP值大于1和S-plot图结合寻找差异化合物,共找出13 个差异性化合物。其中,FD样品中天冬氨酸(10)、胆碱(12)、木糖(13)、精氨酸(15)、甘氨酸(16)、β-葡萄糖(22)6 个差异代谢物相对含量高于HAD样品;HAD样品中蛋氨酸(6)、果糖(17)、二甲基甘氨酸(18)、α-葡萄糖(19)、甜菜碱(20)、肌酸酐(21)和大枣皂苷II(24)7 个差异代谢物相对含量高于FD样品(图4D)。
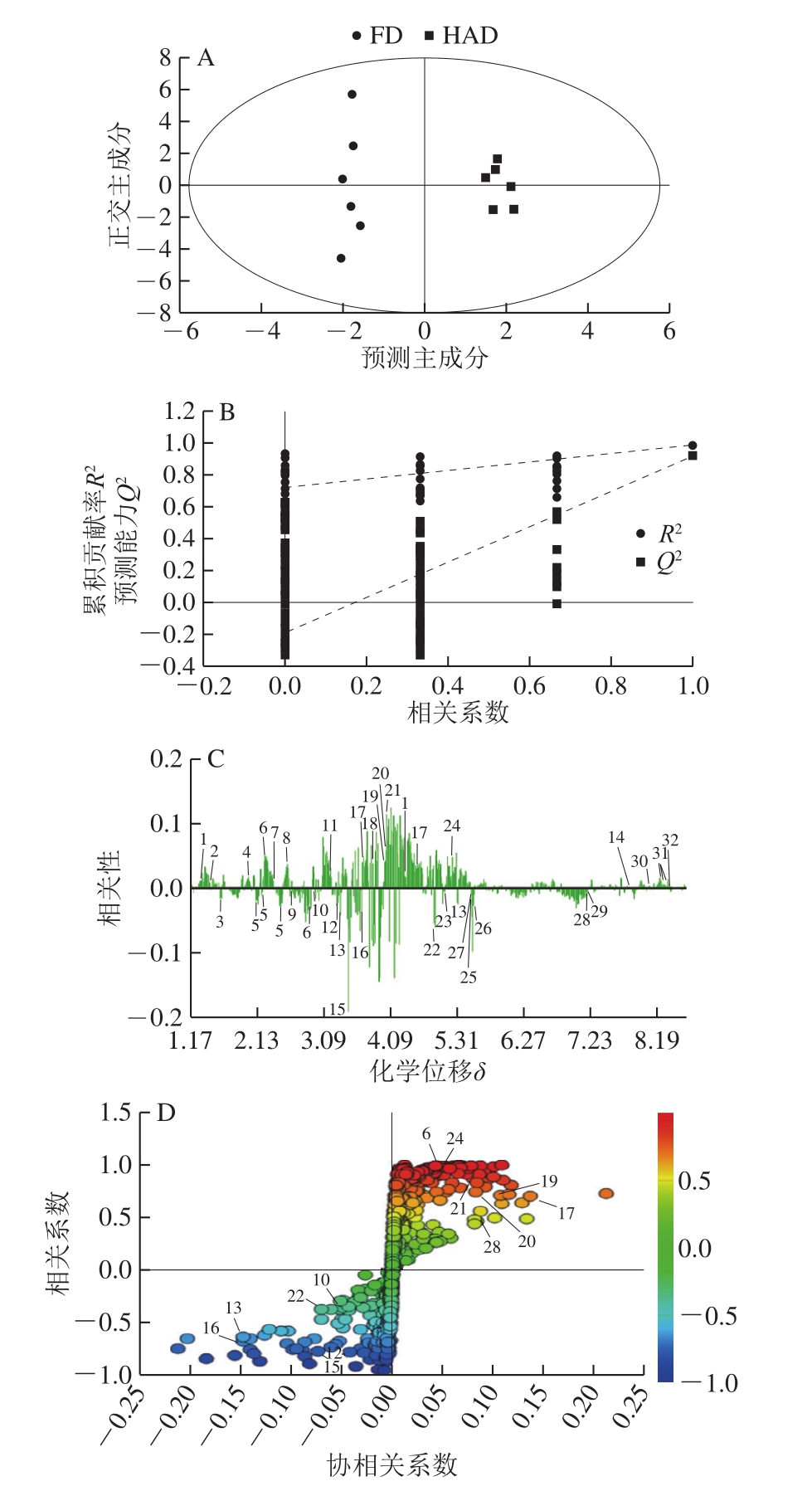
图4 FD和HAD酸枣果肉1H NMR多元统计分析
Fig.4 1H NMR multiple statistical analysis of freeze-dried and hot-air dried ziziphi spinosae sarcocarp
2.4 不同干燥方式的酸枣果肉化学成分与抗氧化活性的相关性分析结果
采用PLS法模型,对3 种干燥方式(HAD、FD、SD)制备酸枣果肉的抗氧化活性(ABTS阳离子自由基清除率、DPPH自由基清除率、FRAP)、基本化学成分(多糖含量、总酚含量和总黄酮含量)与差异代谢化合物的相关性进行了分析。主成分1和主成分2分别解释了47.7%和9.1%的变量信息。主成分1能较好地将FD和SD、HAD分开,主成分2能较好地将SD和HAD分开,如图5所示。从活性与样品的相关性角度分析,ABTS阳离子自由基清除率、DPPH自由基清除率等抗氧化活性与FD样品距离相对较近,说明与其相关性较高;FRAP与3 种干燥方式的距离均较远,说明其与干燥方式的相关性较低。从化合物与活性的相关性角度分析,总黄酮含量、总酚含量和丙氨酸(3)、脯氨酸(5)、谷氨酸(8)、木糖(13)、芦丁(14)、蔗糖(25)、棉籽糖(26)等化合物含量与ABTS阳离子自由基清除率、DPPH自由基清除率距离较近,说明这些化合物对抗氧化活性的贡献度较高;多糖含量和α-氨基丁酸(7)、肌酸酐(21)、半乳糖(23)含量与SD样品相关性较高;总酚含量和尿苷(30)、腺苷(31)含量与HAD样品相关性较高。

图5 不同干燥方式的酸枣果肉成分与抗氧化活性的相关分析
Fig.5 Biplot obtained from PLSR model describing the correlation between phytoconstituents and antioxidant activity of ziziphi spinosae sarcocarp dried by different drying methods
上述分析表明总黄酮和部分氨基酸如丙氨酸(3)、脯氨酸(5)、谷氨酸(8)等与抗氧化活性相关性较高。黄酮是公认的一种天然抗氧化剂[37],黄酮类物质在抗氧化反应中不仅能清除链引发阶段的自由基,而且可以直接捕获反应链中的自由基,阻断自由基链反应,起到预防和断链的双重作用[38]。现有研究表明氨基酸类成分亦具有显著的抗氧化活性,其抗氧化机制可能是由于这些氨基酸可以为自由基供氢所致。葛晓鸣等[39]认为丙氨酸、脯氨酸等疏水氨基酸对抗氧化活性起到决定性的作用,同时极性氨基酸和非极性氨基酸可通过协同作用来增强多肽清除自由基的有效浓度。因此,黄酮和氨基酸可能是FD样品发挥抗氧化活性的物质基础。
3 结 论
干燥是食品生产加工的一个重要环节,在干燥过程中能够使产品的功效物质和营养成分得到最大的保留,也可使各化学成分间发生相互转化等物理化学变化[40]等,使最终产品集有效和安全于一体。本研究采用1H NMR技术结合多元统计分析和PLS回归分析,研究FD、SD、HAD对酸枣果肉代谢产物和抗氧化活性的影响。从NMR图谱中共指认32 个代谢物,结果显示FD样品中总黄酮、糖类(如木糖、β-葡萄糖)、氨基酸类(如精氨酸、甘氨酸和天冬氨酸)以及胆碱等含量保留较高,并且其DPPH自由基清除能力最强;SD样品中能够最大程度保留多糖以及脯氨酸、二甲胺等化合物的含量,并且ABTS阳离子自由基清除能力较强,但干燥时间较长;HAD样品中总酚含量以及蛋氨酸、3-羟基丁酸、大枣皂苷II、α-葡萄糖、果糖和甜菜碱等化合物含量保留较高。
综上所述,在酸枣干燥过程中,FD样品能够保留较强的ABTS阳离子自由基和DPPH自由基清除能力;SD能够一定程度上减少抗氧化活性的损失;HAD表现相对较差的抗氧化活性。鉴于此,FD可较好地保留酸枣的抗氧化活性,极大地缩短干燥时间,是一种酸枣较适宜的干燥方式。但在实际生产中,可以根据干燥产品的品质,综合选择适宜的干燥方式。如HAD在节约能源和时间上都有较大优势,可以进一步优化HAD的干燥条件,如采用HAD与微波干燥相结合的方式,在保留活性成分的前提下缩短干燥时间。本研究结果全面展示了干燥方式对于酸枣抗氧化活性的重要影响,为酸枣的综合开发与利用提供了科学参考。
[1]YUE Yuan, WU Shuangchan, ZHANG Huifang, et al.Characterization and hepatoprotective effect of polysaccharides from Ziziphus jujuba Mill.var.spinosa (Bunge) Hu ex H.F.Chou sarcocarp[J].Food and Chemical Toxicology, 2014, 74: 76-84.DOI:10.1016/j.fct.2014.09.006.
[2]LIAO L J, WON T H, KANG S S, et al.Simultaneous analysis of bioactive metabolites from Ziziphus jujube by HPLC-DAD-ELSDMS/MS[J].Journal of Pharmaceutical Investigation, 2012, 42(1): 21-31.DOI:10.1007/s40005-012-0004-9.
[3]田秀红, 黎梅, 张慧姣, 等.河北酸枣总黄酮提取工艺研究[J].食品研究与开发, 2015, 36(13): 76-78.DOI:10.3969/j.issn.1005-6521.2015.13.021.
[4]WU Yi, CHEN Ming, DU Maobo, et al.Chemical constituents from the fruit of Zizyphus jujuba Mill.var.spinosa[J].Biochemical Systematics and Ecology, 2014, 57: 6-10.DOI:10.1016/j.bse.2014.07.009.
[5]吴巧敏, 赵艺初, 韩艺凡, 等.生酸枣仁、炒酸枣仁、酸枣果肉对PCPA失眠模型大鼠学习记忆能力影响的对比研究[J].中医药导报,2016, 22(5): 72-75.DOI:10.13862/j.cnki.cn43-1446/r.2016.05.022.
[6]SUN Yanfang, LIANG Zongsuo, SHAN Changjuan, et al.Comprehensive evaluation of natural antioxidants and antioxidant potentials in Ziziphus jujuba Mill.var.spinosa (Bunge) Hu ex H.F.Chou fruits based on geographical origin by TOPSIS method[J].Food Chemistry, 2011, 124(4):1612-1619.DOI:10.1016/j.foodchem.2010.08.026.
[7]郎杰, 崔娜, 张立斌.酸枣果肉多糖保健功能的初步研究[J].西北农林科技大学学报(自然科学版), 2014, 42(2): 162-166.DOI:10.13207/j.cnki.jnwafu.2014.02.059.
[8]吴树勋, 郎杏彩, 贾秉义, 等.酸枣果肉对家兔实验性动脉粥样硬化的影响[J].中国中药杂志, 1989, 14(7): 50-51.
[9]张祝君.一种酸味果酒的生产方法: CN109022216A[P].(2018-07-28)[2019-07-01].http://kns.cnki.net/kns/detail/detail.aspx?FileName=CN109022216A&DbName=SCPD2018.
[10]赵旭升, 刘红霞.一种酸枣醋及其制备方法与应用:CN108865635A[P].(2018-08-01) [2019-07-01].http://kns.cnki.net/kns/detail/detail.aspx?FileName=CN108865635A&DbName=SCPD2018.
[11]林飞武, 尹志刚, 李红梅, 等.野生酸枣原粉片的制备方法:CN107259427A[P].(2017-05-24) [2019-07-01].http://kns.cnki.net/kns/detail/detail.aspx?FileName=CN107259427A&DbName=SCPD2017.
[12]张井印, 徐伟峰, 张海龙.一种野生酸枣干果低温蒸汽浸提方法、装置及其酸枣汁: CN108813239A[P].(2018-06-08) [2019-07-01].http://kns.cnki.net/kns/detail/detail.aspx?FileName=CN108813239A&DbName=SCPD2018.
[13]PEINADO J, LERMA N, LOPEZ D, et al.Antioxidant activity of different phenolics fractions isolated in must from Pedro Ximenez grapes at different stages of the off-vine drying process[J].Food Chemistry, 2009, 114(3): 1050-1055.DOI:10.1016/j.foodchem.2008.10.068.
[14]闫旭, 刘璇, 毕金峰, 等.干燥方法对番石榴活性物质含量及抗氧化能力的影响[J].食品科学, 2016, 37(17): 57-64.DOI:10.7506/spkx1002-6630-201617010.
[15]许晴晴, 陈杭君, 郜海燕, 等.真空冷冻和热风干燥对蓝莓品质的影响[J].食品科学, 2014, 35(5): 64-68.DOI:10.7506/spkx1002-6630-201405013.
[16]DU Yuanyuan, BAI Guoyun, ZHANG Xu, et al.Classification of wines based on combination of H NMR spectroscopy and principal component analysis[J].Chinese Journal of Chemistry, 2010, 25(7):930-936.DOI:10.1002/cjoc.200790181.
[17]WANG Pei, RONG Zeming, MA Cuixia, et al.Distribution of metabolites in root barks of seven tree peony cultivars for quality assessment using NMR-based metabolomics[J].Chinese Herbal Medicines, 2017, 9(1): 31-41.DOI:10.1016/S1674-6384(17)60073-X.
[18]MEDIANI A, ABAS F, KHATIB A, et al.Phytochemical and biological features of Phyllanthus niruri and Phyllanthus urinaria harvested at different growth stages revealed by 1H NMR-based metabolomics[J].Industrial Crops and Products, 2015, 77: 602-613.DOI:10.1016/j.indcrop.2015.09.036.
[19]PARIYANI R, ISMAIL I S, AZAM A A, et al.Identification of the compositional changes in Orthosiphon stamineus leaves triggered by different drying techniques using 1H NMR metabolomics[J].Journal of the Science of Food and Agriculture, 2017, 97(12): 4169-4179.DOI:10.1002/jsfa.8288.
[20]杜晨晖, 李津, 闫艳, 等.葛根芩连汤及其发酵产物干预2型糖尿病大鼠的1H-NMR代谢组学研究[J].中草药, 2018, 49(10): 2302-2311.DOI:10.7501/j.issn.0253-2670.2018.10.010.
[21]杜晨晖, 裴香萍, 张敏, 等.基于1H-NMR代谢组学的酸枣仁改善失眠大鼠睡眠作用机制研究[J].中草药, 2019, 50(10): 2405-2412.DOI:10.7501/j.issn.0253-2670.2019.10.022.
[22]卫生部.食品安全国家标准 食品中水分的测定: GB 5009.3—2016[S].北京: 中国标准出版社, 2016: 12.
[23]HE Minjing, ZENG Jianyuan, ZHAI Lu, et al.Effect of in vitro simulated gastrointestinal digestion on polyphenol and polysaccharide content and their biological activities among 22 fruit juices[J].Food Research International, 2017, 102: 156-162.DOI:10.1016/j.foodres.2017.10.001.
[24]DERAKHSHAN Z, FERRANTE M, TADI M, et al.Antioxidant activity and total phenolic content of ethanolic extract of pomegranate peels, juice and seeds[J].Food and Chemical Toxicology, 2018, 114:108-111.DOI:10.1016/j.fct.2018.02.023.
[25]AN Kejing, ZHAO Dandan, WANG Zhengfu, et al.Comparison of different drying methods on Chinese ginger (Zingiber officinale Roscoe): changes in volatiles, chemical profile, antioxidant properties,and microstructure[J].Food Chemistry, 2016, 197: 1292-1300.DOI:10.1016/j.foodchem.2015.11.033.
[26]ZHENG Meiyu, XIA Qile, LU Shengmin.Study on drying methods and their influences on effective components of loquat flower tea[J].LWT-Food Science and Technology, 2015, 63(1): 14-20.DOI:10.1016/j.lwt.2015.03.090.
[27]XIONG Shuangli, LI Anlin, HUANG Ni, et al.Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicus[J].Carbohydrate Polymers, 2011,86(3): 1273-1280.DOI:10.1016/j.carbpol.2011.06.025.
[28]PULIDO R, BRAVO L, SAURA-CALIXTO F.Antioxidant activity of dietary polyphenols as determined by a modified ferric reducing/antioxidant power assay[J].Journal of Agricultural and Food Chemistry, 2000, 48(8): 3396-3402.DOI:10.1021/jf9913458.
[29]赵晓喆, 赵思俊, 田俊生, 等.基于1H-NMR代谢组学比较不同品种海马化学成分差异性[J].中草药, 2018, 49(3): 536-543.DOI:10.7501/j.issn.0253-2670.2018.03.005.
[30]ANETA W, ADAM F, JAN O.Effect of drying methods with the application of vacuum microwaves on the bioactive compounds, color,and antioxidant activity of strawberry fruits[J].Journal Agricultural Food Chemistry, 2009, 57(4): 1337-1343.DOI:10.1021/jf802507j.
[31]JANG J, MA Y, SHIN J, et al.Characterization of polyphenoloxidase extracted from Solanum tuberosum Jasim[J].Food Science & Biotechnology,2005, 14(1): 117-122.DOI:10.1016/j.foodpol.2005.01.001.
[32]陈玮琦, 郭玉蓉, 张娟, 等.干燥方式对苹果幼果干酚类物质及其抗氧化性的影响[J].食品科学, 2015, 36(5): 33-37.DOI:10.7506/spkx1002-6630-201505007.
[33]韩姝葶, 王婉馨, 袁国强, 等.干燥方式对铁皮石斛品质的影响[J].食品科学, 2019, 40(3): 142-148.DOI:10.7506/spkx1002-6630-20180712-167.
[34]张耀雷, 黄立新, 张彩虹, 等.不同干燥方式对壶瓶枣粉品质的影响[J].食品工业科技, 2016, 37(1): 76-79; 85.DOI:10.13386/j.issn1002-0306.2016.01.007.
[35]田文翰, 张晓伟, 杨小露, 等.不同干燥方式对十香菜根多酚和黄酮含量及其抗氧化活性的影响[J].保鲜与加工, 2019, 19(2): 103-107.DOI:10.3969/j.issn.1009-6221.2019.02.017.
[36]范玛莉, 邢婕, 李震宇, 等.基于NMR代谢组学技术的白芍与赤芍化学成分比较研究[J].中草药, 2014, 45(22): 3230-3237.DOI:10.7501/j.issn.0253-2670.2014.22.004.
[37]孟庆焕.牡丹种皮黄酮提取分离与抗氧化及抗疲劳作用研究[D].哈尔滨: 东北林业大学, 2013: 11.
[38]YOKOZAWA T, DONG E, LIU Z W, et al.Antioxidative activity of flavones and flavonols in vitro[J].Phytotherapy Research, 2015, 11(6):446-449.DOI:10.1002/(SICI)1099-1573(199709)11:6<446::AIDPTR128>3.0.CO;2-8.
[39]葛晓鸣, 顾伟, 徐永健.海马水解蛋白的氨基酸组成与抗氧化能力的关系[J].核农学报, 2019, 33(2): 322-329.DOI:10.11869/j.issn.100-8551.019.02.0322.
[40]郭盛, 段金廒, 吴达维, 等.干燥方法对何首乌块根中多元功效物质转化的影响[J].中草药, 2014, 45(4): 498-503.DOI:10.7501/j.issn.0253-2670.2014.04.009.