米糠是糙米的外层,为碾米工业的副产品,主要由果皮、种皮、外胚乳、糊粉层和胚组成。新鲜米糠呈黄色,具有浓郁米香味,形状多样且不规则。我国年产米糠近1 000万 t,是一种量大、价廉、营养丰富的谷物加工副产品[1]。稻谷中近64%的营养素集中在米糠中[2],除蛋白质、脂肪、糖类和维生素等营养物质外,还含有大量的脂多糖、谷维素和角鲨烯等天然抗氧化剂和功能物质,对人类健康及疾病的控制具有重要意义。
近年来,大量研究表明米糠是蛋白质、脂肪、碳水化合物和其他活性物质(如功能性油脂、肌醇、酚类)等的优质来源[3]。其中,米糠多糖作为一种结构复杂的杂聚糖,含有木糖、甘露糖、鼠李糖、半乳糖和葡萄糖等糖类物质[4],具有显著的保健功能和生物活性。除了具有与一般多糖一样的生理功能外,从米糠中提取的生物活性多糖能够增强免疫功能、促进外周血淋巴细胞增殖、抗氧化、降胆固醇、降血脂、降血糖[5]。
传统的热水浸提多糖方法存在得率低、周期长、耗能高等缺点[6],不利于保留米糠的营养成分。研究表明,采用超声波、微波、酶解等处理方法可以有效提高样品的多糖提取率,并能在一定程度上保持样品的生理生化特性[7-11]。红外辐射作为一种高效的热处理工艺,具有加热快、能耗低、营养物质破坏少等优点,能在无介质条件下实现能量的传递,是米糠及其油脂加工的热门研究方向。当红外辐射处理样品时,组分分子快速吸收的辐射能量,并转换成自身分子振动和转动能量,致使分子、晶格和键团的振动及碰撞频率加快。这种效应有利于活性成分从样品基质中溶出,提高提取效率[12-14]。但现有的红外辐射研究主要集中于干燥和钝酶[15-16]等方面,对活性成分的辅助提取有待进一步研究。
综上,本实验采用红外辐射辅助提取米糠多糖,分析不同红外处理工艺对米糠单一糖组分影响程度,并探讨处理后米糠多糖的天然活性,旨在为米糠的进一步开发利用和稻谷产业链的延伸提供一定理论依据。
1 材料与方法
1.1 材料与试剂
‘京优1号’稻谷产自江苏宿迁。
正已烷、乙醇 广东光华科技股份有限公司;浓硫酸 南京化学试剂股份有限公司;水杨酸、硫酸亚铁 国药集团化学试剂有限公司;α-淀粉酶、木瓜蛋白酶、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、葡萄糖、鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖 上海源叶生物科技有限公司;羟甲基氨基甲烷(Tris) 北京Biotopped公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
砻谷碾米一体机 广州市邦民机械设备厂;陶瓷红外-热风联合干燥箱 镇江美博红外科技有限公司;数显恒温水浴锅 常州国华电器有限公司;ZHWY-1102双层恒温摇床 上海智城分析仪器制造有限公司;TG16WS高速离心机 长沙湘智离心机仪器有限公司;真空冷冻干燥机 美国Labconco公司;U-3900紫外-可见分光光度计 日本日立高新技术公司;NV-8G氮吹干仪天津博纳艾杰尔科技有限公司;6890N气相色谱仪美国安捷伦科技有限公司。
1.3 方法
1.3.1 米糠预处理
取适量稻谷,碾米后收集新鲜米糠,立即进行实验。将电偶测温仪的温度感受器贴在器皿表面的5 个点,取5 个温度读数的平均值作为处理最终稻谷温度。取适量米糠,在21 cm×9 cm的不锈钢器皿中均匀平铺,直至米糠单层完全覆盖器皿表面,称量此时米糠的质量作为每次米糠处理量的标准,约为50 g。取50 g米糠,在不锈钢器皿中均匀平铺,并确保温度感受器被米糠均匀覆盖,待陶瓷红外-热风联合干燥箱的红外辐射面板温度达到300 ℃(对应红外辐射强度为2 780 W/m2)[15]并保持稳定时将平铺的米糠放入面板下照射,当各测温点平均温度分别到达70、75、80、85、90 ℃时取出,冷却备用。未经处理米糠设为对照组(CK)。将经不同红外辐射处理后的米糠过80 目筛,取90 g样品于锥形瓶中,加100 mL己烷,置于摇床中,调节温度为20 ℃,转速为100 r/min,振荡时间为30 min。振荡结束后,取米糠,重复两次脱脂,将米糠放置于通风橱内室温下风干,自封袋封装备用。
1.3.2 红外辐射辅助热水法提取米糠多糖
米糠粗多糖的提取参考张维杰[17]的方法并作部分修改。分别称取处理组与对照组未处理的米糠样品各5.0 g置于锥形瓶中,加入100 mL蒸馏水,搅拌均匀,于85 ℃水浴锅内浸提3.5 h,室温下冷却后离心(2 500 r/min、10 min)。取上清液,加入1.0 g α-淀粉酶,80 ℃保温1.5 h,离心(2 500 r/min、10 min),保留上清液。加0.03 g木瓜蛋白酶,60 ℃保温1.5 h,沸水灭酶30 min,离心(2 500 r/min、10 min),保留取上清液。再向上清液中加入200 mL的体积分数70%乙醇溶液,将混合物在4 ℃下保存12 h,离心(6 000 r/min、20 min),得白色沉淀,并定容至50 mL。进行多糖测定后,将剩余含有水溶性粗多糖的上清液冷冻干燥备用。
1.3.3 米糠多糖提取率分析
1.3.3.1 试剂的配制
准确称取干燥至恒质量的葡萄糖0.025 0 g(精确至0.000 1 g),加适量蒸馏水溶解,转移至250 mL容量瓶定容,配成100 μg/mL的葡萄糖标准液。准确称取重蒸苯酚15.000 2 g(精确至0.000 1 g),加适量蒸馏水溶解,转移至250 mL容量瓶定容,配成6 g/100 mL苯酚试剂。
1.3.3.2 葡萄糖标准曲线的绘制
分别准确量取葡萄糖标准溶液0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL置于比色管中,分别加水至2.0 mL,再分别加入6 g/100 mL苯酚溶液1.0 mL,摇匀,然后加入浓硫酸5.0 mL,摇匀,以2.0 mL水作为空白对照液,在沸水浴中恒温30 min,取出并用冷水冷却15 min后,在490 nm波长处测其吸光度,以吸光度为纵坐标,葡萄糖质量为横坐标绘制标准曲线。得到标准曲线方程为Y=7.425X+0.0077,R2=0.999 6。结果表明葡萄糖标准溶液在0.02~0.16 mg的质量范围内与吸光度有良好的线性关系。
1.3.3.3 米糠多糖提取率的测定
参考罗凯等[18]的方法测定米糠多糖提取率。取5.0 mL多糖提取液,于100 mL容量瓶中定容,取稀释液1.0 mL于比色管中,再加入1.0 mL蒸馏水,加入6 g/100 mL苯酚溶液1.0 mL,摇匀,然后加入浓硫酸5.0 mL,摇匀,以2.0 mL水作为空白对照液,在沸水浴中恒温30 min,取出冷水浴冷却15 min后,在490 nm波长处测其吸光度,根据葡萄糖标准曲线,按照公式(1)计算多糖提取率。
式中:0.9为葡萄糖转化为多糖的转化因子;n为稀释倍数;ρ为提取液中多糖的质量浓度/(mg/mL);V为提取液总体积/mL;m为原料的质量/g。
1.3.4 米糠多糖单糖组分测定
1.3.4.1 标准曲线的制作
精确称取各标准单糖(葡萄糖、鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖)20 mg,用无水吡啶溶解并定容至5 mL。分别吸取各标准单糖0.2、0.4、0.6、0.8、1.0 mL于具塞试管中,分别加入2 mg内标肌醇与10 mg盐酸羟胺,用无水吡啶补充至1 mL,溶解后在90 ℃反应30 min,冷却至室温,加入0.5 mL无水醋酸酐,在90 ℃下反应30 min,冷却后进行气相色谱分析。以每种单糖的浓度为横坐标,单糖与内标的峰面积比为纵坐标,作标准曲线。
1.3.4.2 米糠多糖的水解
取10 mg米糠多糖至于安培管中,加入2 mL 2 mol/L三氟乙酸,封管,120 ℃下水解2 h,冷却后使用氮吹仪蒸干。
1.3.4.3 米糠多糖衍生物的制备
参考姚丹等[19]的方法,向水解的米糠多糖中加入2 mg内标和10 mg盐酸羟胺,再加入1 mL吡啶,放入90 ℃水浴中振荡加热30 min。取出后冷却至室温,加入0.5 mL醋酸酐,在90 ℃下继续反应30 min进行乙酰化,反应产物可直接进行气相色谱分析。
1.3.4.4 气相色谱条件
色谱柱:HP-INNOWax毛细管色谱柱(30 m×0.32 mm,0.25 µm);升温程序:140 ℃保持3 min,以10 ℃/min升至240 ℃,保持11 min;检测器:氢火焰离子化检测器;检测器温度260 ℃;进样口温度260 ℃;载气(He)流速1.2 mL/min,进样量1 μL;分流比20∶1。
1.3.4.5 米糠多糖中单糖物质的量的计算
计算米糠多糖中各单糖与内标物的峰面积比,代入各单糖标准品的回归方程,按照公式(2)得到米糠多糖中各单糖物质的量。
式中:ci为单糖浓度/(mol/L);V为多糖溶液的体积/mL;Mi为单糖的相对分子质量。
1.3.5 DPPH自由基清除能力的测定
参考Ma等[20]的方法,准确称取DPPH试剂3.94 mg,用无水乙醇溶解,并定容至100 mL容量瓶中,得到浓度为0.01 mmol/L DPPH储备液,冷藏备用。取一定质量浓度待测样品(1 mg/mL)溶液2 mL,加入2 mL 0.1 mmol/L的DPPH储备液,混匀,避光30 min后用溶剂作参比,在517 nm波长处测吸光度A样品;同时测定相同条件下2 mL DPPH与2 mL蒸馏水混合后的吸光度A对照;以及2 mL待测样品与2 mL无水乙醇混合后的吸光度A空白。按照公式(3)计算DPPH自由基清除率。
1.3.6 羟自由基清除能力的测定
采用Fenton反应法[21],称取1.243 g水杨酸,乙醇溶解并定容至100 mL,然后稀释10 倍,得9 mmol/L乙醇-水杨酸;称2.502 g FeSO4·7H2O,去离子水溶解,定容至100 mL,稀释10 倍,得9 mmol/L硫酸亚铁;取2.696 mL体积分数30% H2O2溶液,去离子水定容至100 mL,得8.8 mmol/L H2O2。按表1加入各试剂。37 ℃水浴加热30 min,测510 nm波长处的吸光度。测定A0时,参比溶液为不加双氧水的体系;测定Ax、Ax0时,参比溶液为去离子水。按公式(4)计算羟自由基清除率。
表1 羟自由基清除实验反应体系
Table 1 Preparation of reaction systems used for hydroxyl radical scavenging experiments
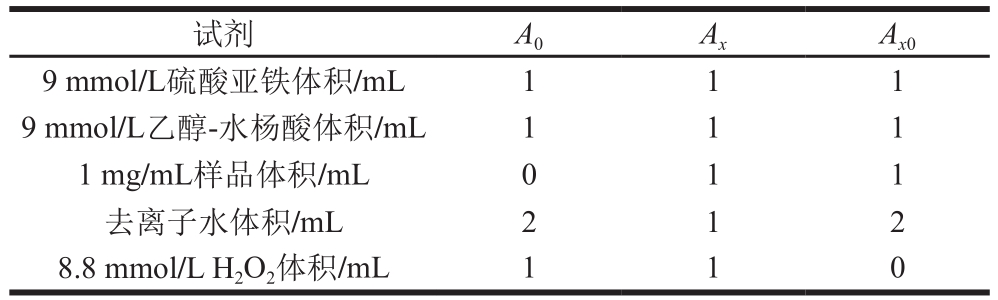
试剂 A0 Ax Ax0 9 mmol/L硫酸亚铁体积/mL 1 1 1 9 mmol/L乙醇-水杨酸体积/mL 1 1 1 1 mg/mL样品体积/mL 0 1 1去离子水体积/mL 2 1 2 8.8 mmol/L H2O2体积/mL 1 1 0
1.3.7 超氧阴离子自由基清除能力的测定
参考宋佳敏等[22]的方法,取4.5 mL 50 mmol Tris-HCl缓冲溶液(pH 8.2)、4 mL蒸馏水在试管中混匀后在37 ℃水浴中保温20 min,取出后立即加入在37 ℃预热过的3 mmol/L邻苯三酚0.5 mL,迅速摇匀后倒入比色皿,325 nm波长处每隔30 s测定吸光度,记为A1,计算线性范围内每分钟吸光度的增加值,以10 mmol/L HCl溶液配制空白管作为对照。按照上述步骤在加入邻苯三酚前先分别加入1 mL的各样品液,蒸馏水3 mL。同样以10 mmol/L HCl溶液配制空白管作为对照。测定吸光度,记为A2,每个样品均重复3 次,取其平均值。按公式(5)计算超氧阴离子自由基清除率。

式中:![]() 为邻苯三酚自氧化时反应速率/s-1;
为邻苯三酚自氧化时反应速率/s-1;![]() 为加入样品液后邻苯三酚自氧化时反应速率/s-1。
为加入样品液后邻苯三酚自氧化时反应速率/s-1。
1.4 数据分析及处理
实验数据取3 次重复的平均值,数据统计采用GraphPad Prism 7软件进行方差分析,使用Origin 9软件作图。
2 结果与分析
2.1 红外辐射对米糠多糖提取率的影响
对不同处理组及对照组样品的米糠多糖提取率的测定结果如图1所示。相对于对照组,处理组的米糠多糖提取率均得到提高,其中红外辐射处理米糠终止温度由70 ℃上升至75 ℃时,多糖的提取率随着温度的增加而增加,在处理终止温度为75 ℃时,多糖提取率最高,为(0.72±0.02)%,相对于未处理米糠,多糖提取率提高了18.33%。在处理终止温度高于80 ℃时,米糠多糖含量略微下降,但与80 ℃时无显著性差异,这可能是随着处理终止温度的升高,米糠多糖中存在着热敏性物质,在红外辅助提取的条件下温度升高会使得这些成分易变性降解[23-25]。
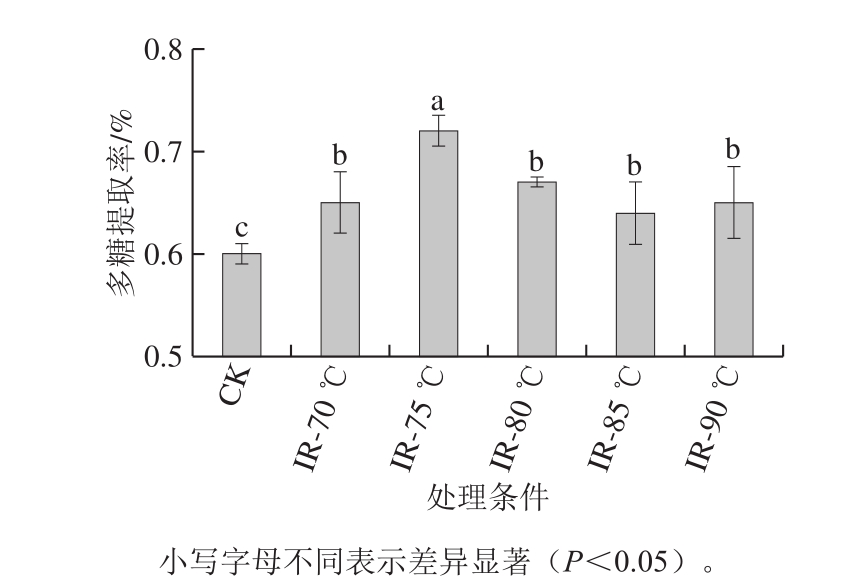
图1 不同处理条件对米糠多糖提取率的影响
Fig.1 Yield of rice bran polysaccharides under different treatment conditions
2.2 红外辐射对米糠多糖单糖组分含量的影响
通过比对混合标准单糖衍生物与每个标准单糖的保留时间,确定了混合标准单糖中各个单糖的出峰时间。如图2所示,鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、内标肌醇出峰时间分别为11.771、12.805、13.073、15.033、15.415、16.034、16.306 min。混合标准单糖衍生物气相色谱分析结果表明,采用硅烷化衍生化,各单糖与内标物能完全分开。而且,在实验所采用的气相色谱条件下,混合单糖中各种单糖衍生物均可以得到较好的分离。
对6 种单糖标准品作回归方程及相关系数分析,如表2所示。将样品衍生物的色谱峰与标准单糖衍生物色谱峰在保留时间进行比对,实现样品内部单糖组分的定性判别。进一步采用内标品标准曲线法对米糠中的单糖组分进行定量分析[26],分析结果如表3所示。结果表明,米糠多糖中含有阿拉伯糖、木糖、葡萄糖和半乳糖等几种单糖,对照组的米糠多糖的单糖组成及各单糖的物质的量比为n(鼠李糖)∶n(阿拉伯糖)∶n(木糖)∶n(甘露糖)∶n(葡萄糖)∶n(半乳糖)=1.34∶26.42:28.56∶15.99∶56.76∶6.88,其中葡萄糖含量最高,鼠李糖含量最低。经红外辐射处理后,米糠多糖中鼠李糖、甘露糖、葡萄糖的含量相比原样都提高,其中在80 ℃时米糠多糖中鼠李糖的含量达到最高,相比原样中鼠李糖的含量提高了66.42%;在85 ℃时米糠多糖中甘露糖的含量达到最高;在70 ℃时米糠多糖中葡萄糖含量达到最高。米糠多糖中半乳糖的含量除了在90 ℃时低于对照组,其余都高于对照组。米糠多糖中阿拉伯糖的含量经红外辐射处理后都有所下降,除加热至85 ℃米糠多糖中阿拉伯糖含量高于对照组。经红外辐射处理后,米糠多糖中木糖的含量都比对照组少,其中90 ℃时米糠多糖中木糖含量最少。
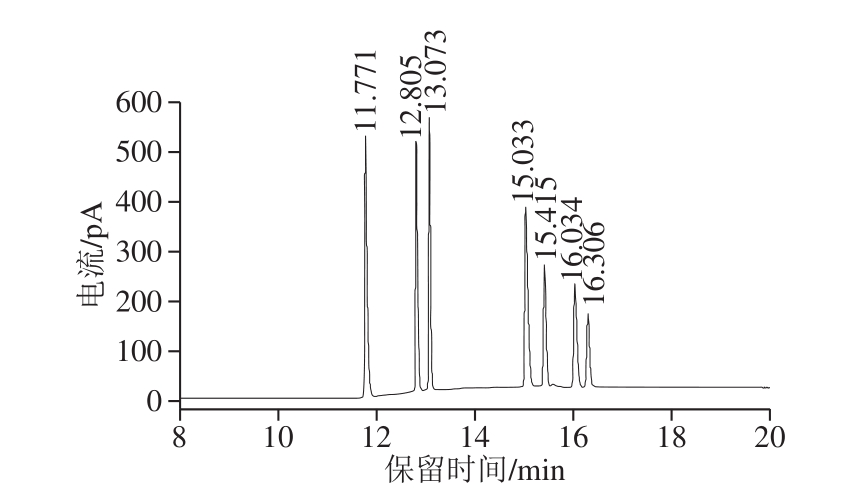
图2 单糖标准品混合样的气相色谱图
Fig.2 GC chromatogram of mixture of monosaccharide standards
表2 6 种单糖标准品的回归方程及相关系数
Table 2 Regression equations with correlation coefficients for six monosaccharide standards
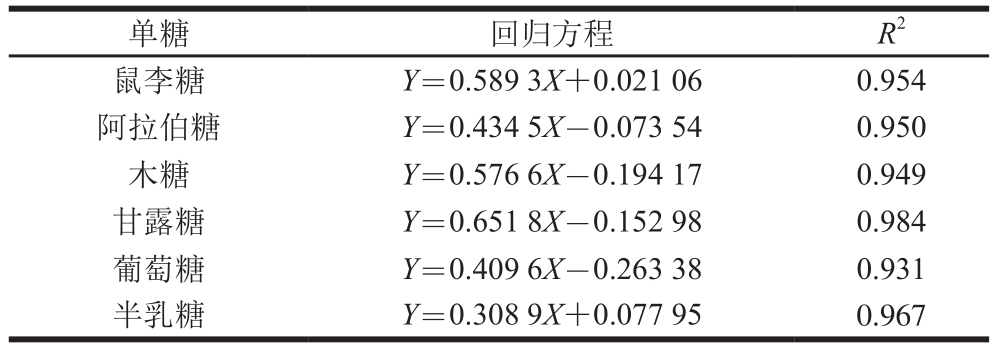
单糖 回归方程 R2鼠李糖 Y=0.589 3X+0.021 06 0.954阿拉伯糖 Y=0.434 5X-0.073 54 0.950木糖 Y=0.576 6X-0.194 17 0.949甘露糖 Y=0.651 8X-0.152 98 0.984葡萄糖 Y=0.409 6X-0.263 38 0.931半乳糖 Y=0.308 9X+0.077 95 0.967
表3 不同处理方法下米糠多糖的单糖组成
Table 3 Monosaccharide composition of rice bran polysaccharides obtained under different treatment conditions
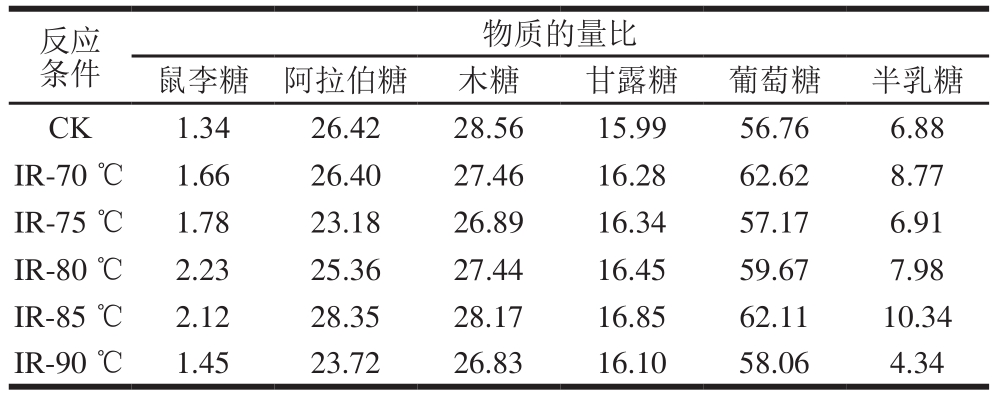
反应条件物质的量比鼠李糖 阿拉伯糖 木糖 甘露糖 葡萄糖 半乳糖CK 1.34 26.42 28.56 15.99 56.76 6.88 IR-70 ℃ 1.66 26.40 27.46 16.28 62.62 8.77 IR-75 ℃ 1.78 23.18 26.89 16.34 57.17 6.91 IR-80 ℃ 2.23 25.36 27.44 16.45 59.67 7.98 IR-85 ℃ 2.12 28.35 28.17 16.85 62.11 10.34 IR-90 ℃ 1.45 23.72 26.83 16.10 58.06 4.34
2.3 红外辐射对米糠多糖抗氧化活性的影响
DPPH自由基是一种较为稳定的自由基,在517 nm波长处有特征吸收峰,广泛应用于评价抗氧化成分的自由基清除能力[27-28]。羟自由基是极其活泼的分子,它们能够很容易地穿过细胞膜并与各种生物分子反应,包括碳水化合物、蛋白质、脂质和DNA。羟自由基和生物分子之间的反应可能导致严重的组织损伤或细胞死亡[29]。它在510 nm波长处有特殊吸收,如果加入具有羟自由基清除能力的物质,羟自由基的生成就会减少,同时也会减少有色化合物的生成。而超氧阴离子自由基在大多数生物体中是弱氧化剂,但它可以通过歧化和其他类型的反应产生过氧化氢和羟自由基,是体内形成的自由基的来源。此外,超氧化物自由基及其衍生物通过破坏DNA和细胞膜而破坏细胞[30]。
表4 不同处理方法下米糠多糖清除DPPH自由基、超氧阴离子自由基与羟自由基的能力
Table 4 DPPH, superoxide anion and hydroxyl radical scavenging capacity of polysaccharides from rice bran subjected to different infrared irradiation treatments

注:同行肩标小写字母不同表示差异显著(P<0.05)。
指标 CK IR-70 ℃ IR-75 ℃ IR-80 ℃ IR-85 ℃ IR-90 ℃DPPH自由基清除率/% 21.21±0.76c23.27±0.36b21.94±0.75b24.00±0.85a25.21±0.88a23.39±0.24b超氧阴离子自由基清除率/% 31.44±0.33d34.40±0.29b35.93±0.24a34.13±0.56b33.11±0.37c33.50±0.49c羟自由基清除率/% 47.07±1.68c48.12±1.05c59.56±0.75a61.24±1.08a57.34±1.41b56.71±1.81b
由表4可知,经过红外辐射处理后,米糠多糖具有清除DPPH自由基的能力,并且经过红外辐射处理的米糠多糖的DPPH自由基清除率普遍高于对照组。红外辐射加热至70 ℃的米糠多糖的DPPH自由基清除率为(23.27±0.36)%,加热至75 ℃的米糠多糖的DPPH自由基清除活性略有下降,为(21.94±0.75)%,之后的DPPH自由基清除率都呈上升趋势,直至在85 ℃时达到最高,为(25.21±0.88)%。而对照组的超氧阴离子清除活性为(31.44±0.33)%,处理组的米糠多糖超氧阴离子清除活性明显高于对照组米糠多糖。超氧阴离子清除活性在红外辐射处理至75 ℃时达到最高值(35.93±0.24)%,之后开始下降,但在红外辐射处理至90 ℃时又有小幅度的上升。米糠多糖的羟自由基清除活性也得到了提高,红外辐射处理至80 ℃的米糠多糖的羟自由基清除率最高,达到了(61.24±1.08)%。之后红外处理至85、90 ℃的米糠多糖的羟自由基清除率都逐渐降低,但是仍高于对照组米糠多糖的羟自由基清除率((47.07±1.68)%)。
Meng Lei等[31]采用皮尔逊相关分析法和线性回归分析法,分析了多糖的抗氧化活性与单糖组成的关系。抗氧化活性与甘露糖含量(P<0.01)、葡萄糖含量(P<0.05)有显著相关性,半乳糖含量与抗氧化特性无显著相关性(P>0.05)。抗氧化活性与单糖组成(甘露糖含量,r=0.942;葡萄糖含量,r=-0.905)之间存在很高的相关系数,表明甘露糖和葡萄糖对自由基清除率有显著影响。可以看出,甘露糖含量较高的多糖往往有较好的抗氧化特性,85 ℃时米糠多糖的DPPH自由基清除活性最好,这可能与甘露糖的含量有关。Lo等[32]采用4 种常规测定抗氧化活性的方法(针对不同的抗氧化反应机理)进行多元线性回归,研究多糖的抗氧化活性与多糖结构特征之间的关系。对于4 种不同的多元线性回归方程,鼠李糖和甘露糖通常表现为正系数,因而鼠李糖和甘露糖是多糖各组分中利于提高抗氧化活性的因素。在80 ℃时米糠多糖中鼠李糖的含量达到最高,80 ℃的米糠多糖的羟自由基清除率最高可能与此有关。
3 结 论
采用红外辐射辅助热水法提取米糠多糖,得到不同红外辐射温度下多糖得率。当红外辐射处理米糠表层终止温度达到75 ℃时,多糖得率相对最高,较对照样(CK)多糖得率提高了18.33%。当处理终止温度大于75 ℃时,米糠多糖含量呈现下降趋势。
通过测定米糠单糖组分以及DPPH自由基、羟自由基、超氧阴离子自由基清除能力等多项指标评价米糠多糖抗氧化特性,结果显示相对于对照样,处理组样品中鼠李糖、甘露糖的含量都明显提高,在85 ℃时米糠多糖中甘露糖的含量达到最高,80 ℃时米糠多糖中鼠李糖的含量达到最高,75 ℃时米糠多糖中木糖含量最少。DPPH自由基、羟自由基和超氧阴离子自由基最高清除率明显提高,这说明米糠单糖组分与抗氧化特性有相关性,且红外辐射处理可辅助提高米糠多糖提取效率及抗氧化特性。
[1]吴伟, 蔡勇建, 吴晓娟.不同贮藏期米糠制备的米糠蛋白酶解产物抗氧化性分析[J].食品科学, 2017, 38(3): 245-249.DOI:10.7506/spkx1002-6630-201703037.
[2]张敏.米糠深加工技术[M].北京: 科学出版社, 2016: 1.
[3]吴妙鸿, 黄薇, 刘兰英, 等.米糠营养成分分析及其在鲍鱼饲料中的应用价值研究[J].粮食与饲料工业, 2018(3): 34-37.DOI:10.7633/j.issn.1003-6202.2018.03.009.
[4]毕晋明, 王永军.米糠多糖的生物学活性研究及应用前景[J].饲料博览, 2006(4): 16-17.DOI:10.3969/j.issn.1001-0084.2006.04.006.
[5]MORRIS J N, MARR J W, CLAYTON D G.Diet and heart: a postscript[J].British Medical Journal, 1977, 2: 1307-1314.DOI:10.1136/bmj.2.6101.1550.
[6]LIU H M, WANG F Y, LIU Y L.Hot-compressed water extraction of polysaccharides from soy hulls[J].Food Chemistry, 2016, 202:104-109.DOI:10.1016/j.foodchem.2016.01.129.
[7]GUO H H, KONGF S, YAN C Y.Optimization of polysaccharide ultrasonic extraction conditions using purple sweet potato tubers based on free radical scavenging and glycosylation inhibitory bioactivities[J].Pharmacognosy Magazine, 2017, 13(51): 504-511.DOI:10.4103/0973-1296.211044.
[8]CHEN C, ZHANG B, HUANG Q, et al.Microwave-assisted extraction of polysaccharides from Moringa oleifera Lam.leaves:characterization and hypoglycemic activity[J].Industrial Crops and Products, 2017, 100: 1-11.DOI:10.1016/j.indcrop.2017.01.042.
[9]YOU Q H, YIN X L, ZHAO Y P.Enzyme assisted extraction of polysaccharides from the fruit of Cornus officinalis[J].Carbohydrate Polymers, 2013, 98(1): 607-610.DOI:10.1016/j.carbpol.2013.06.036.
[10]FADEL A, PLUNKETT A, ASHWORTH J, et al.The effect of extrusion screw-speed on the water extractability and molecular weight distribution of arabinoxylans from defatted rice bran[J].Journal of Food Science & Technology, 2018, 55(3): 1201-1206.DOI:10.1007/s13197-017-3010-0.
[11]ZHA X Q, WANG J H, YANG X F, et al.Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J].Carbohydrate Polymers, 2009, 78(3):570-575.DOI:10.1016/j.carbpol.2009.05.020.
[12]DING C, KHIR R, PAN Z L, et al.Effect of infrared and conventional drying methods on physicochemical characteristics of stored white rice[J].Cereal Chemistry, 2015, 92(5): 441-448.DOI:10.1094/CCHEM-11-14-0232-R.
[13]DING C, KHIR R, PAN Z L, et al.Improvement in shelf life of rough and brown rice using infrared radiation heating[J].Food and Bioprocess Technology, 2015, 8(5): 1149-1159.DOI:10.1007/s11947-015-1480-5.
[14]PAN Z L, ATUNGULU G.Infrared heating for food and agricultural processing[M]// SUN D W.Contemporary food engineering.Boca Raton: CRC Press, 2010: 8-11.DOI:10.1007/s11947-015-1480-5.
[15]PEI Y S, TAO T T, YANG G F, et al.Lethal effects and mechanism of infrared radiation on Sitophilus zeamais and Tribolium castaneum in rough rice[J].Food Control, 2018, 88: 149-158.DOI:10.1016/j.foodcont.2018.01.012.
[16]丁超.稻谷红外干燥的动力学特性及对稻米储藏品质的影响研究[D].南京: 南京农业大学, 2015: 3-6.
[17]张惟杰.糖复合物生化研究技术[M].杭州: 浙江大学出版社, 1999:38-40.
[18]罗凯, 黄秀芳, 周毅峰, 等.响应面试验优化复合酶法提取碎米荠多糖工艺及其抗氧化活性[J].食品科学, 2017, 38(4): 243-248.DOI:10.7506/spkx1002-6630-201704038.
[19]姚丹, 王宏军.黄芪多糖单糖组分的气相色谱分析[J].安徽农业科学,2012, 40(9): 5128-5129.DOI:10.13989/j.cnki.0517-6611.2012.09.189.
[20]MA C W, FENG M Y, ZHAI X F, et al.Optimization for the extraction of polysaccharides from Ganoderma lucidum and their antioxidant and antiproliferative activities[J].Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(6): 886-894.DOI:10.1016/j.jtice.2013.01.032.
[21]MAO G H, ZOU Y, FENG W W, et al.Extraction, preliminary characterization and antioxidant activity of Se-enriched maitake polysaccharide[J].Carbohydrate Polymers, 2014, 101: 213-219.DOI:10.1016/ j.carbpol.2013.09.034.
[22]宋佳敏, 王鸿飞, 孙朦, 等.响应面法优化金蝉花多糖提取工艺及抗氧化活性分析[J].食品科学, 2018, 39(4): 275-281.DOI:10.7506/spkx1002-6630-201804041.
[23]邱现创, 赵宁, 李晨, 等.铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响[J].食品科学, 2018, 39(2): 273-280.DOI:10.7506/spkx1002-6630-201802043.
[24]杨娜, 王鸿飞, 宋佳敏, 等.超声波辅助提取裂褶菌多糖及分离纯化的研究[J].核农学报, 2014, 28(11): 2015-2024.DOI:10.11869/j.issn.100-8551.2014.11.2015.
[25]杨文雅, 李长征, 张海晖, 等.蛹虫草多糖的亚临界水萃取及其抗氧化活性研究[J].食品工业科技, 2016, 37(5): 252-253.DOI:10.13386/j.issn1002-0306.2016.05.041.
[26]邢丽, 耿越.气相色谱法分析豌豆粉渣中多糖的单糖组分[J].食品科学, 2014, 35(22): 252-254.DOI:10.7506/spkx1002-6630-201422049.
[27]BRACA A, DE-TOMMASI N, DI-BARI L, et al.Antioxidant principles from Bauhinia tarapotensis[J].Journal of Natural Products,2001, 64(7): 892-895.DOI:10.1021/np0100845.
[28]YUAN J F, ZHANG Z Q, FAN Z C, et al.Antioxidant effects and cytotoxicity of three purified polysaccharides from Ligusticum chuanxiong Hort.[J].Carbohydrate Polymers, 2008, 74(4): 822-827.DOI:10.1016/j.carbpol.2008.04.040.
[29]ZHA X Q, WANG J H, YANG X F, et al.Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J].Carbohydrate Polymers, 2009, 78: 570-575.DOI:10.1016/j.carbpol.2009.05.020.
[30]WANG J J, KAN L J, NIE S P, et al.A comparison of chemical composition, bioactive components and antioxidant activity of natural and cultured Cordyceps sinensis[J].LWT-Food Science and Technology, 2015, 63(1): 2-7.DOI:10.1016/j.lwt.2015.03.109.
[31]MENG Lei, SUN Sasa, LI Rong, et al.Antioxidant activity of polysaccharides produced by Hirsutella sp.and relation with their chemical characteristics[J].Carbohydrate Polymers, 2015, 117: 452-457.DOI:10.1016/j.carbpol.2014.09.076.
[32]LO C T, CHANG C A, CHUI K H, et al.Correlation evaluation of antioxidant properties on the monosaccharide components and glycosyl linkages of polysaccharide with different measuring methods[J].Carbohydrate Polymers, 2011, 86(1): 320-327.DOI:10.1016/j.carbpol.2011.04.056.