大豆蛋白是一种所含氨基酸种类丰富、营养价值全面的优质植物蛋白质,因其具有较好的功能特性,故在食品工业方面有着较广泛的应用[1]。但其功能性质易受许多外界因素的影响,因此需要用改性的方法进一步改善其功能特性。目前,大豆蛋白的改性方法主要有物理法、化学法、酶法等[2]。糖基化改性属于化学改性范畴,加热条件下,糖基化反应可在蛋白和糖分子间自发进行,无需催化剂,且反应得到的蛋白质多糖复合物具有较好的溶解性、乳化性、稳定性、凝胶性等,是一种理想的蛋白改性方法[3-4]。但传统糖基化方法中,干法反应所需时间长,湿法反应不易控制、接枝产物颜色深,这些问题都限制了蛋白质接枝改性方法的广泛应用。
目前较多使用外场辅助技术辅助糖基化反应,以弥补传统糖基化反应的不足,空化射流属于外场辅助手段的一种,可以产生空化效应。空化效应是液流系统中的局部压力低于相应温度下该液体的饱和蒸气压时,液体迅速气化形成许多空泡,这些空泡随液体流入高压区后,发生收缩、渍灭的现象。空泡渍灭瞬间能形成强烈的冲击力和速率高达100 m/s的微射流。并伴随高压等极端物理现象,这种极端条件可使在一般条件下难以实现的物理、化学反应得以进行[5-6]。
空化射流强大的冲击力使其已在促进化学反应方面有许多应用,但大都是生物医学方面,目前在食品行业中应用较少。本实验将空化射流用于辅助糖基化反应,对不同空化射流时间对糖基化产物的结构与功能性进行研究,从而探究空化射流对糖基化改性的影响,为改善大豆蛋白功能性与空化射流在食品加工行业方面的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 山东禹王集团;葡萄糖 中国医药集团上海化学试剂有限公司;大豆油 九三粮油工业集团有限公司;1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司;考马斯亮蓝G-250 天津市科密欧化学试剂厂;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)配制试剂盒、Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平 梅特勒-托利多仪器(上海)有限公司;THZ-80水浴恒温振荡器 江苏金坛亿通电子有限公司;空化射流机 北京中森汇嘉科技发展有限责任公司;5430小型高速离心机 德国Eppendorf公司;FD5-3型冷冻干燥机 美国Sim公司;722型紫外-可见分光光度计 上海光谱仪器有限公司;SDS-PAGE仪北京君意东方电泳设备有限公司;HYP-308消化炉上海纤检仪器有限公司;LNK-871型凯氏定氮快速自动蒸馏器 江苏省宜兴市科教仪器研究所;F-4500荧光分光光度计 日本Hitachi公司;VECTOR33傅里叶变换红外分析仪 德国Bruker公司。
1.3 方法
1.3.1 糖基化大豆分离蛋白制备
将大豆分离蛋白与葡萄糖以质量比4∶1溶于pH 7.5、0.2 mol/L磷酸盐缓冲溶液,室温下搅拌2 h至完全溶解,配制成蛋白质量浓度为0.05 g/mL的样品溶液。将样品置于80 ℃恒温水浴锅预热后,分别倒入空化射流机中空化20、40、60、80、100、120 min,空化过程中保持温度80 ℃恒定。空化射流处理后,取出样品在80 ℃水浴条件下继续加热,控制样品进行糖基化反应总时长均为6 h。待反应结束后,立即将样品放入冰水浴中冷却至室温,离心除去不溶物,取上清液透析24 h(4 ℃),冷冻干燥后置于4 ℃备用。
1.3.2 接枝度测定
采用邻苯二甲醛(o-phthalaldehyde,OPA)法[7]测接枝度。准确称取40.0 mg的OPA溶解于1.0 mL甲醇中,再加入25.0 mL 0.1 mol/L硼砂溶液、2.5 mL质量分数20%的SDS、100 μL β-巯基乙醇,最后用蒸馏水定容到50 mL,制得OPA试剂。测定时,取200 μL样品溶液(蛋白质量浓度2 mg/mL)溶于4.0 mL OPA试剂中,混合均匀,放入35 ℃水浴中反应2 min,之后在340 nm波长处测吸光度At。空白对照组为在4.0 mL OPA试剂加入200 μL水。接枝度按式(1)计算。
式中:A0为反应前样品的吸光度;At为反应t时间后的吸光度。
1.3.3 褐变程度测定
将样品用质量分数0.1% SDS溶液稀释,使样品液蛋白质量浓度为2 mg/mL,以稀释液作空白对照,在420 nm波长处测定吸光度A420 nm[8]。褐变程度与A420 nm成正比。
1.3.4 溶解性测定
称取一定量未处理的样品与糖基化的样品,分别溶解配制成蛋白质量浓度为2 mg/mL的溶液,并在室温下均匀搅拌30 min使其充分溶解。然后在4 ℃、12 000×g条件下离心10 min。采用Lowry法[9]测定上清液中的蛋白质量分数,使用牛血清白蛋白作为标准物绘制标准曲线(y=1.302 9x+0.001 6,R2=0.998 1),测定500 nm波长处的吸光度,用凯氏定氮法测定蛋白样品中总蛋白质量分数。溶解度按式(2)计算。
1.3.5 乳化活性及乳化稳定性测定
根据Pearce等[10]的方法进行,首先取样品溶于0.1 mol/L、pH 7.0磷酸盐缓冲溶液中使其质量浓度为2 mg/mL,取5 mL样品溶液加入15 mL大豆油,在10 000 r/min分散1 min,立即从溶液底部吸取50 mL乳浊液,加入5 mL质量分数0.1% SDS溶液进行稀释,在500 mm波长处测吸光度A0。20 min后,测吸光度A20。乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)分别由公式(3)、(4)计算。
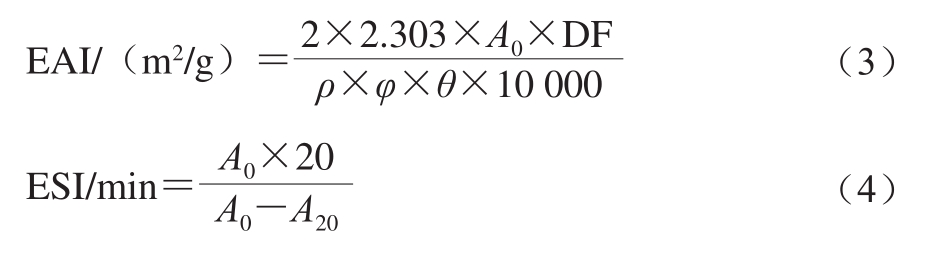
式中:DF为稀释倍数(100);ρ为蛋白质量浓度/(g/mL);φ为比色皿光程(1 cm);θ为乳液中油相所占比例(0.25);A0和A20分别为0 min和20 min时的吸光度。
1.3.6 SDS-PAGE分析大豆蛋白分子质量
根据Leammli[11]的方法稍作修改,先分别配制12%分离胶与5%浓缩胶。将蛋白质量浓度为4 mg/mL样品溶液与4×上样缓冲液以体积比3∶1混合,然后在95 ℃下加热3 min做变性处理,冷却至室温上样,上样量为10 mL。电泳时保持恒压,其中浓缩胶电压保持为80 V,分离胶电压保持为120 V。用染色液(含质量分数0.1%考马斯亮蓝G-250)染色30 min,之后用脱色液脱色,成像,采用彩虹Marker作为标准蛋白。
1.3.7 表面疏水性测定
根据Kato[12]、Shen Lan[13]等的方法稍作修改。将未处理的样品与糖基化的样品分别用0.1 mol/L、pH 7.0的磷酸盐缓冲溶液稀释成蛋白质量浓度为1.0、0.5、0.25、0.1、0.02 mg/mL的溶液,并用此磷酸盐缓冲溶液配制ANS溶液(8 mmol/L)。取2 mL稀释后的样品溶液,加入20 μL ANS溶液后混合均匀,设定激发波长为390 nm,发射波长为470 nm,测定其荧光强度。以蛋白质量浓度为横坐标,荧光强度为纵坐标作图,采用线性回归分析进行曲线拟合,曲线的初始斜率即为样品的表面疏水性H0。
1.3.8 傅里叶变换红外光谱分析
准确称量2 mg的样品,加入一定量的溴化钾至200 mg,用研钵研磨成均匀粉末,压制成薄片,再用傅里叶变换红外光谱仪做全波段扫描(400~4 000 cm-1),扫描次数64 次。
1.3.9 荧光光谱分析
根据Bonomi等[14]方法进行一定修改。用0.01 mol/L、pH 7.0的磷酸盐缓冲液配制样品溶液,使蛋白质量浓度为0.05 mg/mL。选择激发波长为290 nm、激发狭缝5 nm,发射波长范围为300~400 nm,扫描速率为240 nm/min。
1.4 数据统计分析
所有实验均平行3 次,采用SPSS 19软件进行数据分析,多重比较采用Duncan分析方法,P<0.05表示差异显著,数据采用Origin 8.0软件作图。
2 结果与分析
2.1 糖基化产物接枝度与褐变程度分析结果
接枝度是衡量糖基化反应程度的一个重要指标[15]。由图1可知,大豆蛋白接枝物的接枝度随空化射流时间的延长呈增长趋势,说明空化射流可以促进蛋白与糖的接枝反应。空化射流辅助120 min得到的糖基化产物的接枝度从29.1%增加到43.2%。这是由于空化射流过程中,空泡渍灭瞬间所产生的空穴效应、超高压等可以使蛋白的分子结构展开,变得更加松散,使可发生接枝反应的游离氨基更多地暴露在蛋白分子表面,从而使更多的游离氨基酸与糖的还原性羰基末端发生糖基化反应,接枝物的接枝度增加。同时空化射流产生的高速水射流,可以使蛋白的游离氨基与糖的羰基碰撞几率增大,这也可以加快接枝反应速率。
糖基化棕褐色产物的特征波长是420 nm[16]。如图1所示,随着空化射流时长的增加,蛋白接枝物的A420 nm显著增大(P<0.05),大豆分离蛋白-葡萄糖褐变程度增加。这是由于空化射流使蛋白结构展开,同时空化射流的射流效应使蛋白与糖结合几率增大,从而使蛋白自由氨基基团能更多的与葡萄糖分子的羧基末端反应,使糖基化反应程度增加,生成更多的深棕色物质使褐变程度不断增加。
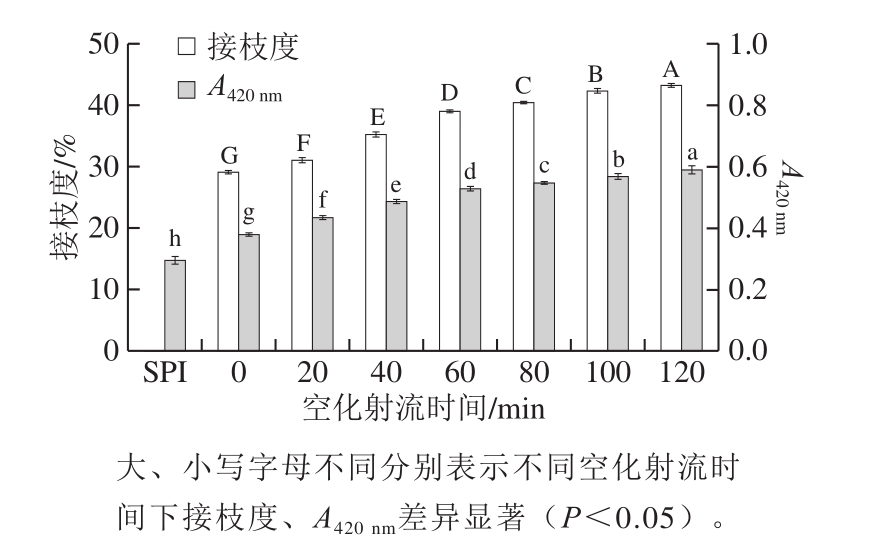
图1 空化射流处理时间对糖基化产物接枝度与褐变程度变化的影响
Fig.1 Effects of cavitation jet treatment duration on the degree of grafting and browning
2.2 糖基化产物溶解性分析结果
由图2可知,空化射流辅助糖基化反应比单纯糖基化反应对大豆蛋白的溶解度改善效果更好。在空化射流60 min内,接枝物的溶解度随着空化射流时间延长而显著增加(P<0.05),空化射流处理60 min时的糖基化产物的溶解度最高,达到89.27%,与未处理蛋白相比提高43.3%,与单独加热糖基化产物相比提高约37%。这可能是因为空化射流会加快糖基化反应速率,而引入更多的糖链中的多羟基官能团[17],改善了蛋白质和水分子之间亲和力[18]。同时空化射流所产生的空化效应和机械效应会破坏蛋白质分子的高级结构,释放出小分子的亚基和肽,使其溶解度增加[19]。继续延长空化射流时间,溶解度变化趋于平缓并有小幅度下降,这是因为到达一定程度后继续增加亲水性羟基对蛋白亲水性影响不大。同时可能因为空化过度使蛋白质发生一定程度的聚集,生成大分子质量物质,故溶解性有小幅度下降[20]。
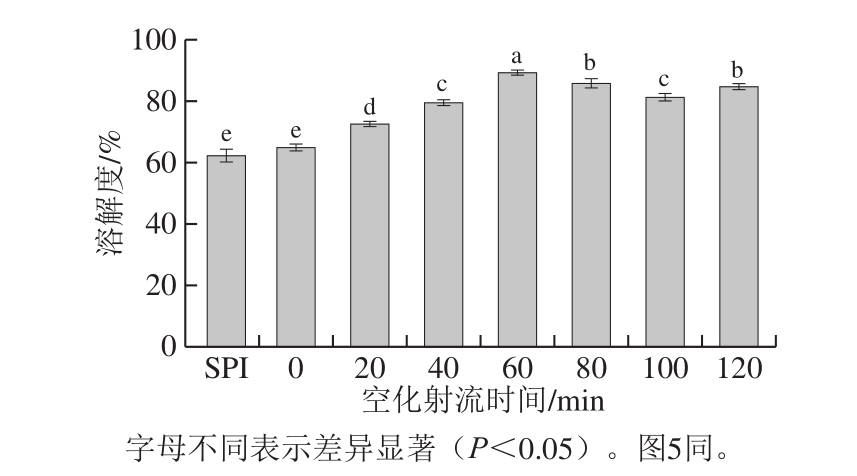
图2 空化射流处理时间对糖基化产物溶解性变化的影响
Fig.2 Effect of cavitation jet treatment duration on solubility of glycosylated products
2.3 糖基化产物乳化活性与乳化稳定性分析结果
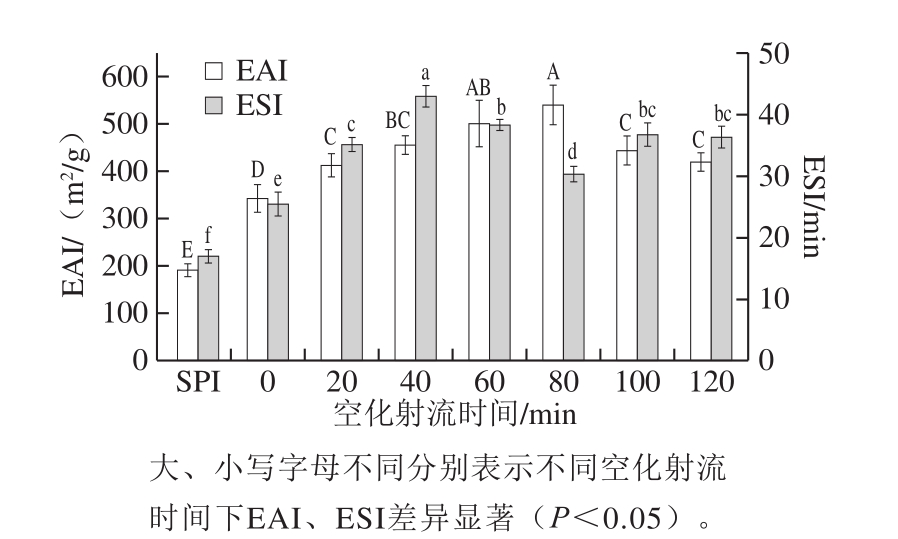
图3 空化射流处理时间对糖基化产物乳化活性与乳化稳定性变化的影响
Fig.3 Effect of cavitation jet treatment duration on emulsifying activity and emulsion stability of glycosylated products
由图3可知,与大豆蛋白相比,糖基化反应可以显著提高其乳化活性与乳化稳定性(P<0.05)。乳化活性随空化射流处理时间的延长呈先增后减的趋势,在空化射流处理80 min时,乳化活性改善效果最好,与未处理蛋白相比提升183.17%,与单独加热糖基化产物相比提高57.83%。蛋白乳化性与蛋白的溶解性、疏水基团暴露程度均存在一定联系[21]。空化射流促进了蛋白糖基化反应,使蛋白质空间结构变的松散,蛋白分子内部更多的疏水基团暴露[22]。在蛋白乳化的过程中,更多疏水基团与油相结合,利于蛋白吸附在油-水界面上,阻碍油滴间的聚合,从而提高蛋白的乳化活性。继续延长空化射流时间,乳化活性开始降低,接枝度不断增大,更多的亲水基团的引入会对油-水界面的平衡造成破坏,复合物界面活性降低,从而造成乳化活性降低[23]。
乳化稳定性也随空化射流处理时间的延长呈先增后减的趋势,处理40 min时达到最高值。这是因为随着糖基化反应的进行,糖的引入增加了油-水乳化体系中水相的黏度,降低了其表面张力使乳化体系的稳定性得到提高。空化射流处理40 min时达到最高值,与未处理蛋白相比提高220.21%,与单独加热糖基化产物相比提高153.72%。40 min后乳化稳定性小幅度下降,这可能是由于空化射流会破坏蛋白质分子的结构,使蛋白发生聚集。蛋白聚集后,疏水基团被埋在分子内部,无法与油相接触而发挥乳化作用,导致乳化稳定性不继续增加[24]。
2.4 糖基化产物SDS-PAGE分析结果
SDS-PAGE可被用来分析蛋白质的亚基及分子质量的变化情况。图4反映不同空化射流处理时间辅助糖基化改性的大豆蛋白各亚基条带的变化,可以看出,在空化射流辅助下,大豆蛋白与葡萄糖发生共价反应。交联的蛋白随着空化射流时间的延长生成异肽链或二硫键,从而生成了一些大分子物质,这些大分子物质不能通过浓缩胶和分离胶,留在分离胶顶部,使分离胶顶部颜色逐渐加深。
随着空化射流时间的延长,大豆蛋白的亚基组成发生明显变化,多个亚基因为与葡萄糖之间发生接枝作用,生成了大分子聚集体,表现为对应谱带的缺失。另外一种可能是一个葡萄糖连接了一个亚基,但是亚基之间逐渐聚合,表现为谱带的缺失。
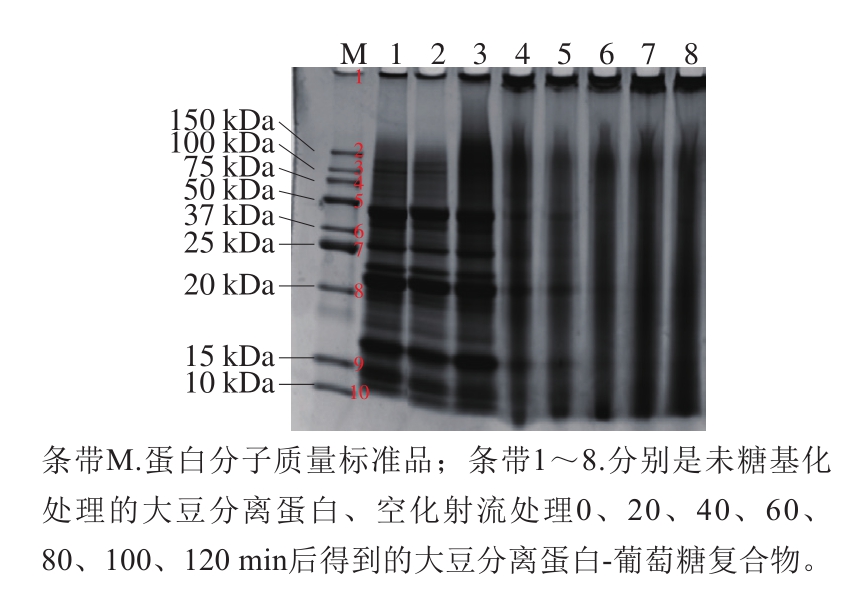
图4 不同空化射流时间下糖基化产物的SDS-PAGE图
Fig.4 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis of glycosylated products at different cavitation jet times
2.5 糖基化产物表面疏水性分析结果
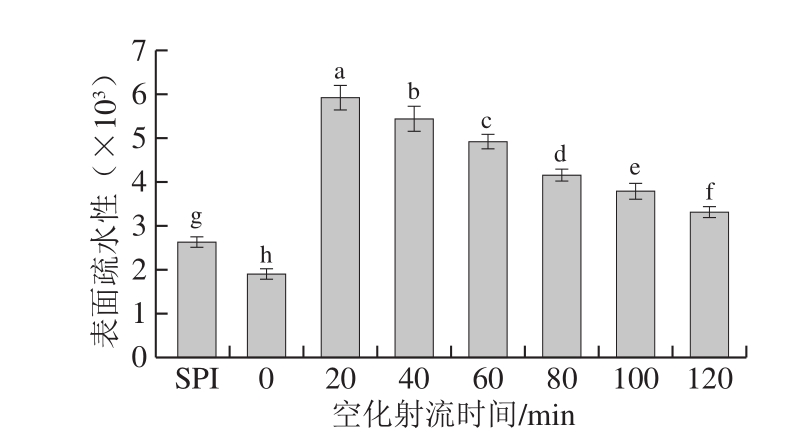
图5 空化射流处理时间对糖基化产物表面疏水性变化的影响
Fig.5 Surface hydrophobicity of glycosylated products as a function of cavitation jet treatment duration
由图5可知,对比未糖基化处理的蛋白与普通糖基化(即空化射流0 min)产物,可以发现糖基化反应可以降低蛋白表面疏水性。这是由于大豆蛋白经糖基化反应后,产物中引入了较多的亲水性羟基,从而导致表面疏水性降低。短时间空化射流处理可以显著提高接枝物的表面疏水性(P<0.05),处理20 min时表面疏水性达到最高,之后不断降低。这可能是因为空化效应使折叠的肽链展开,更多藏在蛋白质分子内部的疏水性基团暴露,从而使表面疏水性增加。有研究表明,空化作用会增加蛋白表面疏水性[25]。继续延长空化射流时间,糖基化反应程度加剧,更多葡萄糖与蛋白质共价结合,产物中引入了更多的亲水性羟基,使蛋白质分子亲水性增加[26-27]。另外可能是由于空化射流处理使疏水基团相互作用导致了蛋白质的聚集,从而降低了接枝物的表面疏水性[28]。
2.6 糖基化产物红外光谱分析结果

图6 不同空化射流处理时间糖基化产物傅里叶变换红外光谱分析
Fig.6 Fourier transform infrared spectra of glycosylated products at different cavitation jet treatment times
红外光谱(图6)测定的酰胺I带可以计算二级结构相对含量,对酰胺I带的谱带进行了如下归属:1 650~1 660 cm-1为α-螺旋,1 610~1 640 cm-1和1 670~1 690 cm-1为β-折叠,1 660~1 670 cm-1和1 690~1 700 cm-1为β-转角,1 640~1 650 cm-1为无规卷曲结构。对酰胺I带进行处理后进行二阶导数拟合。各峰面积占总面积的比例即为各二级结构的相对含量。不同空化射流处理时间糖基化产物的二级结构相对含量如表1所示。
表1 空化射流处理时间对糖基化产物二级结构变化的影响
Table 1 Effect of cavitation jet treatment duration on secondary structures of glycosylated products
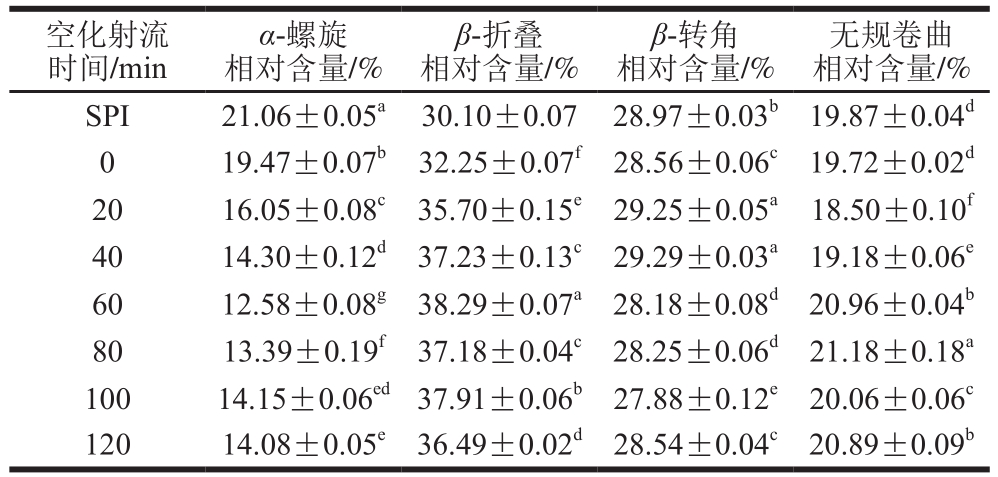
注:同列之间字母不同表示存在显著性差异(P<0.05)。
空化射流时间/min α-螺旋相对含量/%β-折叠相对含量/%β-转角相对含量/%无规卷曲相对含量/%SPI 21.06±0.05a 30.10±0.07 28.97±0.03b 19.87±0.04d 0 19.47±0.07b 32.25±0.07f28.56±0.06c19.72±0.02d 20 16.05±0.08c35.70±0.15e29.25±0.05a 18.50±0.10f 40 14.30±0.12d 37.23±0.13c 29.29±0.03a 19.18±0.06e 60 12.58±0.08g 38.29±0.07a 28.18±0.08d 20.96±0.04b 80 13.39±0.19f37.18±0.04c 28.25±0.06d 21.18±0.18a 100 14.15±0.06ed37.91±0.06b 27.88±0.12e 20.06±0.06c 120 14.08±0.05e 36.49±0.02d 28.54±0.04c 20.89±0.09b
由表1可知,与未糖基化蛋白相比,糖基化反应可以使葡萄糖与大豆蛋白共价结合,从而使蛋白二级结构发生变化。空化射流辅助可以使接枝物二级结构相对含量发生显著变化(P<0.05),接枝物α-螺旋相对含量显著降低,β-折叠与无规卷曲相对含量增加。空化射流处理60 min时,变化最为明显,接枝物的α-螺旋相对含量由19.47%下降到12.58%,β-折叠和无规卷曲的相对含量则分别从32.25%和19.72%增加到38.29%和20.96%。说明空化射流辅助条件下,糖基化大豆蛋白的二级结构主要是由α-螺旋结构解螺旋形成β-折叠和无规卷曲结构,由有序变为无序。这是由于参与糖基化反应的ε-氨基位于α-螺旋结构中,ε-氨基与葡萄糖中的还原性羰基反应造成了α-螺旋结构相对含量的降低[29]。空化射流可以促进糖基化反应,使更多ε-氨基参与糖基化反应,从而降低α-螺旋相对含量。蛋白二级结构中α-螺旋呈紧密无空腔结构,较稳定,不利于蛋白功能性的发挥。α-螺旋相对含量降低可以使蛋白结构稳定性变差,从而有利于蛋白功能性的改善[30-31]。
2.7 糖基化产物荧光光谱分析结果
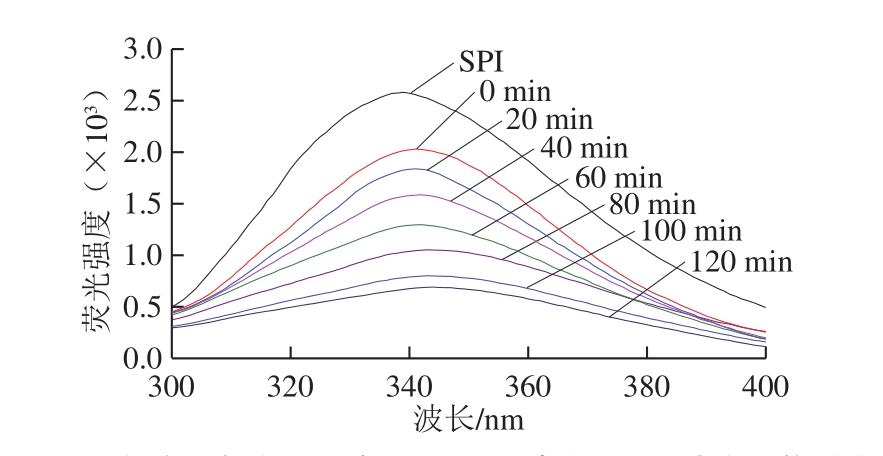
图7 不同空化射流处理时间对糖基化产物荧光强度变化的影响
Fig.7 Effect of cavitation jet treatment time on fluorescence intensity of glycosylated products
由图7可以看出,对比未经糖基化反应蛋白,糖基化反应可以显著降低蛋白的荧光强度。空化射流处理可以使蛋白接枝物的荧光强度显著降低,处理80 min时,荧光强度达到最小值,继续增加空化射流时间,荧光强度有所上升。这可能是由于空化射流破坏了大豆蛋白的结构,导致更多的发色团暴露在溶剂中。另外,空化射流促进了糖基化反应的发生,使更多蛋白与葡萄糖共价结合,导致对色氨酸的荧光猝灭作用的发生,这与Sun Yuanxia等[32]的研究结果类似。同时空化射流处理使蛋白质的λmax发生不同程度红移,λmax发生红移代表蛋白具有更松散的三级结构,有利于蛋白功能特性的发挥[33-34],证明空化射流处理可以改变接枝物的三级结构,从而改善接枝物的功能性。
3 结 论
大豆分离蛋白与葡萄糖糖基化产物的接枝度随空化射流时间延长而逐渐增大,说明空化射流可以促进糖基化反应。经空化射流辅助处理后,接枝物功能性均有不同程度改善。但达到最优所需的处理时间不同。溶解度在处理60 min时改善最为明显,达到峰值89.27%,与未处理蛋白相比提高43.3%,与单独加热糖基化产物相比提高约37%。乳化活性在处理80 min时最高,比未处理蛋白提高183.17%。乳化稳定性在40 min时改善效果最明显,与未处理蛋白相比提高220.21%。短时间空化射流可以使蛋白质分子内部疏水氨基酸暴露,提高其表面疏水性。SDS-PAGE显示空化射流促进了蛋白质亚基与葡萄糖发生接枝反应。傅里叶变换红外光谱分析证明了空化射流可以使蛋白二级结构变得疏松,柔韧性增加,从而利于蛋白功能性的发挥。荧光光谱分析表明,空化射流处理可以使接枝物发生荧光猝灭作用且使最大荧光强度红移,说明空化射流处理可以使蛋白三级结构变得更加松散。
[1]YUAN Y J, VELEV O D, CHEN K, et al.Effect of pH and Ca2+-induced associations of soybean proteins[J].Journal of Agricultural and Food Chemistry, 2002, 50(17): 4953-4958.DOI:10.1021/jf025582d.
[2]XUE F, LI C, ZHU X W, et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J].Food Research International, 2013, 51(2): 490-495.DOI:10.1016/j.foodres.2013.01.012.
[3]宋永令, 秦瑞旗, 王若兰.外场辅助蛋白质糖基化改性技术研究[J].食品科技, 2018, 43(3): 60-63.DOI:10.13684/j.cnki.spkj.2018.03.012.
[4]ZHANG B, CHI Y J, LI B.Effect of ultrasound treatment on the wet heating Maillard reaction between β-conglycinin and maltodextrin and on the emulsifying properties of conjugates[J].European Food Research and Technology, 2014, 238(1): 129-138.DOI:10.1007/s00217-013-2082-y.
[5]管金发, 邓松圣, 雷飞东, 等.空化水射流理论和应用研究[J].石油化工应用, 2010, 29(12): 15-19.DOI:10.3969/j.issn.1673-5285.2010.12.005.
[6]古颖龙, 王海燕, 吴羽, 等.空化微流体在生物医学方面的应用[J].激光生物学报, 2014, 23(4): 290-293.DOI:10.3969/j.issn.1007-7146.2014.04.001.
[7]CHURCH F C, SWAISGOOD H E, PORTER D H, et al.Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins1[J].Journal of Dairy Science, 1983, 66(6): 1219-1227.DOI:10.3168/jds.S0022-0302(83)81926-2.
[8]DIFTIS N, KIOSSEOGLOU V.Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry, 2003, 81(1): 1-6.DOI:10.1016/s0308-8146(02)00236-4.
[9]LOWRY O H, ROSEBROUGH N J, FARR A L, et al.Protein measurement with the Folin phenol reagent[J].Journal of Biological Chemistry, 1951, 193(1): 265-275.DOI:10.1515/bchm2.1951.286.1-6.270.
[10]PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.DOI:10.1021/jf60217a041.
[11]LEAMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227: 680-685.DOI:10.1016/0005-2795(80)90220-2.
[12]KATO A, NAKAI S.Hydrophobicity determination by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[13]SHEN Lan, TANG Chuanhe.Microfluidization as a potential technique to modify surface properties of soy protein isolate[J].Food Research International, 2012, 48(1): 108-118.DOI:10.1016/j.foodres.2012.03.006.
[14]BONOMI F, MORA G, PAGANI M A, et al.Probing structural features of water-insoluble proteins by front-face fluorescence[J].Analytical Biochemistry, 2004, 329(1): 104-111.DOI:10.1016/j.ab.2004.02.016.
[15]LAROQUE D, INISAN C, BERGER C, et al.Kinetic study on the Maillard reaction.Consideration of sugar reactivity[J].Food Chemistry, 2008, 111(4): 1032-1042.DOI:10.1016/j.foodchem.2008.05.033.
[16]ASHOOR S H, ZENT J B.Maillard browning of common amino acids and sugars[J].Journal of Food Science, 1984, 49(4): 1206-1207.DOI:10.1111/j.1365-2621.1984.tb10432.x.
[17]张瑶.不同糖化方法对提高大豆分离蛋白功能性质的对比研究[D].哈尔滨: 东北农业大学, 2017: 43-45.
[18]XUE F, LI C, ZHU X, et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J].Food Research International, 2013, 51(2): 490-495.DOI:10.1016/j.foodres.2013.01.012.
[19]LIU C C, TELLEZ-GARAY A M, CASTELL-PEREZ M E.Physical and mechanical properties of peanut protein films[J].LWT-Food Science and Technology, 2004, 37(7): 731-738.DOI:10.1016/j.lwt.2004.02.012.
[20]李晨.基于糖基化反应的花生蛋白成膜性及其风味缓释效应的研究[D].无锡: 江南大学, 2015: 41-43.
[21]ZHANG Y, TAN C, ZHANG X, et al.Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J].European Food Research and Technology, 2014, 238(6): 957-968.DOI:10.1007/s00217-014-2164-5.
[22]MARIA J S, MARIA J M, PILOSOF A M R, et al.Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J].Food Hydrocolloids,2014, 39: 223-230.DOI:10.1016/j.foodhyd.2014.01.014.
[23]COIA K A, STAUFFER K R.Shelf life study of oil/water emulsions using various commercial hydrocolloids[J].Journal of Food Science,1987, 52(1): 166-172.DOI:10.1111/j.1365-2621.1987.tb13997.x.
[24]EINHORN-STOLL U, ULBRICH M, SEVER S, et al.Formation of milk protein-pectin conjugates with improved emulsifying properties by controlled dry heating[J].Food Hydrocolloids, 2005, 19(2):329-340.DOI:10.1016/j.foodhyd.2004.07.005.
[25]毕爽, 马文君, 李杨, 等.脉冲电场-超声波作用对黑豆球蛋白功能性质的影响[J].食品科学, 2016, 37(9): 7-12.DOI:10.7506/spkx1002-6630-201609002.
[26]程熙茜.超声辅助湿热法制备大豆分离蛋白糖接枝物[D].无锡: 江南大学, 2012: 10-21.
[27]臧艳妮, 赵妍嫣, 罗水忠, 等.超声波和糖基化复合改性对小麦面筋蛋白性质和结构的影响[J].食品科学, 2017(5): 132-138.DOI:10.7506/spkx1002-6630-201705020.
[28]ZHANG H H, LI Q, CLAVER I P, et al.Effect of cysteine on structural, rheological properties and solubility of wheat gluten by enzymatic hydrolysis[J].International Journal of Food Science and Technology, 2010, 45(10): 2155-2161.DOI:10.1111/j.1365-2621.2010.02384.x.
[29]HATTORI M, MIYAKAWA S, OBAMA Y, et al.Reduced immunogenicity of β-lactoglobulin by conjugation with acidic oligosaccharides[J].Journal of Agricultural and Food Chemistry, 2004,52(14): 4546-4553.DOI:10.1021/jf0353887.
[30]CHEN X, RU Y, CHEN F, et al.FTIR spectroscopic characterization of soy proteins obtained through AOT reverse micelles[J].Food Hydrocolloids, 2013, 31(2): 435-437.DOI:10.1016/j.foodhyd.2012.11.017.
[31]穆利霞.大豆蛋白-糖接枝改性及其结构与功能特性研究[D].广州:华南理工大学, 2010: 87-98.
[32]SUN Yuanxia, HAYAKAWA S, IZUMORI K.Modification of ovalbumin with a rare keto-hexose through the Maillard reaction,effect on protein structure and gel properties[J].Journal of Agricultural and Food Chemistry, 2004, 52(5): 1293-1299.DOI:10.1021/jf030428s.
[33]LIU Y, ZHAO G, REN J, et al.Effect of denaturation during extraction on the conformational and functional properties of peanut protein isolate[J].Innovative Food Science and Emerging Technologies, 2011,12(3): 375-380.DOI:10.1016/j.ifset.2011.01.012.
[34]LI C, XUE H, CHEN Z, et al.Comparative studies on the physicochemical properties of peanut protein isolatepolysaccharide conjugates prepared by ultrasonic treatment or classical heating[J].Food Research International,2014, 57: 1-7.DOI:10.1016/j.foodres.2013.12.038.