桃(Amygdalus persica Linn)原产于我国,属蔷薇科李属桃亚属,是我国第三大落叶果树[1],其面积和产量均居世界首位,种质资源丰富,目前我国已有上千个桃的商业品种[2]。桃果实鲜美,深受消费者青睐,但是桃柔软多汁,不耐贮运,采后损失严重,采后2~3 d果肉会很快软化、褐变,失去食用价值和经济价值[3]。
因此,将桃进一步加工处理,对延长供应期、提高附加值具有重要意义。果蔬干制作为一种重要的加工途径,发展迅速,市场前景良好,是延伸桃加工产业链的重要趋势[4]。目前,果蔬产品干制的方法主要有热风干燥(hot air drying,AD)、真空冷冻干燥(vacuum freeze drying,FD)、压差闪蒸干燥、微波干燥、红外辐射干燥等[5]。其中真空冷冻干燥作为一种新兴果蔬干燥技术,能够保持食品原有的形状,产品口感酥脆,营养价值高,但能耗相对较高。与真空冷冻干燥相比,热风干燥作为一种传统的干燥方式,能耗低,操作简单,但产品在干燥过程中容易因氧化造成褐变和营养物质的损失,使产品品质降低[6-8]。
黄桃由于口感偏酸,生产上在干燥前需对其进行渗糖预处理,生产上常用糖液主要有蔗糖、麦芽糖、麦芽糖醇(maltitol,MAI)等。然而,单一的糖液渗透处理时间长,一般需要180 min以上,效率低。因而很多研究采用超声辅助糖液渗透(ultrasound assisted osmosis,USOD)处理,可有效缩短渗透时间,而且可以提高物料的干燥速率、缩短干燥时间以及减少能量消耗,该技术已成功应用于草莓、胡萝卜、苹果和蘑菇等果蔬干燥中[9-10]。但目前国内外关于超声辅助渗透脱水在果蔬中的应用研究还比较少。传统的糖液虽然可以达到改善产品风味的效果,但甜度相对较高,不适合糖尿病人等特殊人群食用,因此如何在改善黄桃脆片产品风味的前提下使其能被特殊人群所食用值得探究。
功能性低聚糖由3~10 个单糖聚合而成,且具有不易被人体消化酶利用的特殊结构[11]。低聚异麦芽糖(isomalto-oligosaccharides,IMO)作为常见的功能性低聚糖的一种,因其具有的高保湿、甜味温和、低黏度、低水分活度和不能被酵母消化等特点[12],常被韩国和日本等国家应用于发酵食品中[13]。因此对于稳定性要求较高的产品如烘焙食品、糖果、软饮料、清酒和调味料等,IMO都是最佳选择。而且有研究表明对于老年人,长期摄入IMO可改善其结肠微生物形态、肠道功能和血液胆固醇[14]。Park等[15]的研究发现将IMO添加到制作面包的面团中,可以有效改善面包的质量。目前国内外关于功能性低聚糖的研究多集中于功能性研究,关于低聚糖尤其是IMO在食品中的应用研究较少,所以本实验拟展开关于IMO的基础应用研究,探究其添加到黄桃脆片中的可行性。
本实验选用功能性IMO与传统的糖液进行比较,设计3 种不同的超声辅助渗透处理以及单一的超声(ultrasound,US)处理,探究不同预处理对黄桃脆片综合品质的影响,进而明确IMO代替传统的糖液应用于黄桃脆片的渗透处理中的可行性,以期为实际生产提供技术依据,提升黄桃脆片的商业价值。
1 材料与方法
1.1 材料与试剂
黄桃(‘金童5号’品种)购于北京市平谷桃产业基地,平均水分质量分数(89.66±1.22)%。选取果实大小一致,表面黄色均匀一致,八成熟的黄桃,存放于实验室4 ℃冷库。
IMO(纯度90%) 山东保龄宝生物股份有限公司;MAI(质量分数75%) 山东绿健生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-amino-bis(2-ethylbenzothiazoline-6-sulfonic acid)ammonium salt,ABTS)、2,4,6-三吡啶基均三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、6-羟基-2,5,7,8-四甲基-苯并二氢吡喃-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、抗坏血酸标品(纯度≥99%)、福林-酚试剂、九水合硝酸铝 美国西格玛奥德里奇贸易有限公司;葡萄糖标准品、无水碳酸钠、氯化钠、硫酸、苯酚、丙酮、无水乙醇 国药集团化学试剂有限公司;甲醇、正己烷、甲基叔丁基醚(色谱级、纯度为99.9%) 美国赛默飞世尔科技公司。
1.2 仪器与设备
CPA-12电子天平 德国Sartorius公司;FA-200切片机 广东省南海市德丰电热设备厂;KQ-500Z超声波发生器(工作频率40 kHz、功率500 W) 昆山市超声仪器有限公司;DHG-9123A电热恒温鼓风箱、DK-S26电热恒温水浴锅 上海精宏实验设备有限公司;ALPHA1-4Lplus真空冷冻干燥设备 德国Christ公司;UV-1800紫外-可见分光光度计 日本岛津公司;MesoMR23-060H-I型核磁共振分析与成像系统 上海纽迈电子科技有限公司;Asrree II/LS16电子舌 法国Alpha MOS公司;3K15离心机 艾本德中国有限公司;SCCWE61万能蒸烤箱德国乐信有限公司;MASTER-2α手持阿贝折光仪、S-570扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 超声及超声辅助渗透处理
原料去皮去核后,切成厚度8 mm的圆片备用。选用超纯水、25 °Brix(阿贝折光仪校准)的IMO、MAI、MAI和IMO质量比1∶1的复配溶液分别作为渗透液,其对应的预处理分别为超声(US)、超声辅助+低聚异麦芽糖(US+IMO)、超声辅助+麦芽糖醇(US+MAI)、超声辅助+复配糖液(US+(combined sugar solution,CSL)),将等量桃片分别放入盛有不同渗透液的烧杯中,渗透温度设定为40 ℃,料液比设定为1∶10(m/V),以防渗透过程中出现稀释现象,超声渗透时间设定为90 min,超声频率为40 kHz。渗透结束后,将桃片迅速取出,用流动的水简单清洗表面附着的糖液,并用吸水纸吸除表面水分。采用水分损失率(water loss,WL)、固形物增加率(solids gain,SG)评价预处理效率,分别按式(1)、(2)[16]计算。实验平行3 次,取平均值。
式中:m'0为原料初始鲜质量/g;m'为原料某时刻鲜质量/g;m0为原料初始干质量/g;m为原料某时刻干质量/g。
1.3.2 热风干燥和真空冷冻干燥
1.3.2.1 热风干燥
物料经以上预处理后单层平铺于托盘放入已工作稳定的电热鼓风干燥箱。固定温度75 ℃、出口风速1.5 m/s,每次实验用量为(100±1)g,前6 h每30 min记录1 次样品质量变化,之后每60 min记录1 次样品质量变化,直至水分质量分数(湿基)低于5%,停止实验。
1.3.2.2 真空冷冻干燥
物料经以上预处理后在-80 ℃条件下进行预冻,预冻12 h后随即放入干燥仓,冷阱温度为-49 ℃,真空度约为0.37 mbar,每次实验用量为(100±1)g,直至水分质量分数(湿基)低于5%,停止实验。
1.3.3 水分弛豫时间的测定
实验中应用MesoMR型核磁共振分析与成像系统,主频为23 MHz,磁体温度为32 ℃,线圈直径为60 mm磁场强度为0.5 T。采用核磁共振软件中的CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定不同预处理后的桃片中水分的自旋-自旋弛豫时间T2。将桃片放入永磁场中心位置的射频线圈中心,进行T2采集,将得到信号值通过核磁共振T2反演软件进行反演得到T2反演谱。CPMG脉冲序列参数为:重复时间6 500 ms,累加次数16 次,回波数16 000,回波时间0.4 ms。
1.3.4 微观结构分析
将经过超声处理和未超声处理的鲜桃片切成3~5 mm厚的薄片,并在体积分数3%戊二醛的等渗溶液中(0.2 mol、pH 7.0的椰油酸缓冲液,添加质量分数14%的蔗糖)固定过夜。然后将样品浸入一系列浓度梯度的丙酮水溶液中(50%、70%、90%和100%)进行脱水,使用临界点干燥技术去除丙酮,喷金,扫描电子显微镜在10 kV的加速电压下采用100 倍放大倍数观察并采集图谱。
1.3.5 色泽的测定
采用色彩色差仪测定,依CIELAB表色系统测量桃片的明度指数L*、α*、β*并计算总色差值,即ΔE值,表示所测物体的L、α、β值与标准白板之间色差值,ΔE值越小说明产品色泽越鲜亮、越好[17],每个处理3 次平行。ΔE值按式(3)计算。
1.3.6 硬度及脆度的测定
硬度及脆度测定采用质构仪。探头型号为HDP/BSW,测定条件为:探头模式为阻力测试,选择方式为运行方式,前期测试速率2 mm/s,检测速率1 m/s,后期检测速率1 mm/s,触发力和穿透距离分别为10 mm和20 mm。硬度测试结果用测试产生峰的最高值表示,单位为N,值越高代表硬度越大;脆度测试结果用断裂距离表示,单位为mm[18],值越大代表脆度越低,每个处理至少取8 次平行。
1.3.7 总酚含量的测定
采用福林-酚比色法[19]进行总酚含量测定,称取2 g样品于带盖离心管中,加入10 mL 80%(体积分数,下同)甲醇溶液,室温避光超声提取30 min(40 kHz、25 ℃),经10 000 r/min离心10 min后,取上清液,重复上述提取3 次,合并上清液。使用没食子酸作为标准品,以80%甲醇溶液为空白对照,绘制标准曲线,曲线方程为y=0.007 6x+0.643 8,相关系数R2=0.998 7。取1 mL提取液,80%甲醇溶液定容至2 mL,加1 mL 10%福林-酚显色剂,充分摇匀,6 min之后,加入2 mL 7.5 g/L Na2CO3溶液,混匀定容至10 mL,75 ℃放置10 min,冷却至常温后于765 nm波长处测定其吸光度,总酚含量以没食子酸当量表示。
1.3.8 总类胡萝卜素含量的测定
根据Knockaert[20]的方法测定总类胡萝卜素含量。取2 g样品加40 mL提取液(含50%正己烷,25%丙酮,25%乙醇和0.1%BHT,0.5 g NaCl)在常温下搅拌30 min。之后加入15 mL蒸馏水,常温下搅拌10 min,搅拌结束将混合物倒入分液漏斗,振荡3 次,静置,待液体分为清晰的两层后,收集上层有机相。该实验空白为加入BHT(0.10 g/100 mL)并充分溶解后的正己烷,450 nm波长处测定吸光度,按照公式(4)计算样品总类胡萝卜素含量,以干基表示。
式中:A为样品在450 nm波长处的吸光度;m为称取的原料质量/g;V为收集的有机相体积/mL; (2 560)为β-胡萝卜素在正己烷中的消光系数。
(2 560)为β-胡萝卜素在正己烷中的消光系数。
1.3.9 抗氧化能力的测定
1.3.9.1 提取液制备
如Istrati等[21]所述进行总酚提取,方法稍作修改。精密称取粉碎后的样品2 g于具塞试管中,加入10 mL体积分数80%甲醇溶液,超声提取30 min(40 kHz、25 ℃),经10 000 r/min离心10 min 后,取上清液,重复上述提取3 次,合并上清液,于-20 ℃下保存备用,该提取液用于总酚抗氧化能力测定。
1.3.9.2 DPPH自由基清除能力的测定
参照Wang Yongtao等[22]的方法并略作修改。取2 mL不同浓度的Trolox溶液(0、20、40、60、80、100 μmol/L,80%甲醇溶解)于10 mL试管中,加入4 mL 0.1 mol/L DPPH溶液(80%甲醇溶解),避光静置30 min,于517 nm波长处测定吸光度,以Trolox浓度(mol/L)为横坐标,吸光度为纵坐标绘制标准曲线。取1 mL提取液,80%甲醇溶液稀释至2 mL,按上述步骤操作并测定吸光度,代入标准曲线,曲线方程为y=0.006 8x+0.653 7,相关系数R2=0.994 5,样品总酚DPPH自由基清除能力以μmol/g干物质表示。
1.3.9.3 FRAP的测定
Fe2+还原能力(ferric ion reducing antioxidant power,FRAP)的测定参照Tabart等[23]的方法并略作修改。取0.2 mL不同浓度的Trolox溶液(0、100、200、300、400、500、600、700、800 μmol/L、80%甲醇溶解)于10 mL试管中,加入6 mL FRAP试剂,混匀,37 ℃水浴30 min,冷却至常温后于593 nm波长处测定吸光度,以Trolox浓度(μmol/L)为横坐标,吸光度为纵坐标绘制标准曲线。取0.1 mL提取液,80%甲醇溶液稀释至0.2 mL,按上述步骤操作并测定吸光度,代入标准曲线,曲线方程为y=0.001 2x-0.089 4,相关系数R2=0.994 3,测定结果以μmol/g干物质表示。
1.3.9.4 ABTS自由基清除能力的测定
参照Jeong等[24]的方法并略作修改。将7 mmol/L ABTS溶液加入到2.45 mmol/L过硫酸钾溶液中(体积比1∶1),室温避光静置12~14 h后,用80%甲醇溶液将溶液稀释至734 nm波长处吸光度为(0.70±0.02)。取0.40 mL不同浓度的Trolox溶液(0、25、50、75、100、125、150 μmol/L,80%甲醇溶解)于10 mL试管中,加入3.6 mL ABTS溶液,混匀,静置1 min(室温),于734 nm波长处测定吸光度,以Trolox浓度(μmol/L)为横坐标,吸光度为纵坐标绘制标准曲线,曲线方程为y=-0.001x+0.362 1,相关系数R2=0.998 9。吸取0.1 mL提取液,80%甲醇溶液稀释至0.4 mL,按上述步骤操作并测定吸光度,代入标准曲线,结果以μmol/g干物质表示。
1.3.10 VC含量的测定
参照Liu Changjin等[25]的方法并略作修改。取5 g干样,加入50 mL的草酸-EDTA溶液于100 mL烧杯中,摇匀后取一定体积提取液于50 mL刻度离心管中,20 ℃、5 000 r/min离心10 min,上清液即为待测液。取1 mL不同质量浓度的VC标准液(200、400、600、800、1 000 mg/L)于50 mL试管中,依次加入4 mL草酸-EDTA溶液、1.5 mL 3%偏磷酸-醋酸溶液、2 mL 5%硫酸溶液和2 mL 5%钼酸铵溶液,整个反应体系最终用超纯水定容至25 mL,30 ℃水浴显色20 min,取出自然冷却至室温,再放置1 h后于700 nm波长处测定吸光度,以VC浓度(mol/L)为横坐标,吸光度为纵坐标绘制标准曲线。吸取1 mL待测液,按上述步骤操作并测定吸光度,代入标准曲线,曲线方程为y=0.984 6x-0.034 6,相关系数R2=0.999 9,结果以mg/100 g干物质表示。
1.3.11 黄桃脆片口感的测定
参照杨阳等[26]的方法提取样品并略作修改。准确称取(5.00±0.01)g待测样品,加入100 mL超纯水,磁力搅拌30 min后于12 000 r/min下4 ℃离心15 min,吸取上层清液,沉淀,再次用100 mL超纯水溶解,重复上述步骤,合并上清液,过0.45 μm水膜后用于测定。采用AstreeII传感器,包括ZZ、AB、BA、BB、CA、DA、TE,共7 根传感器,选择Ag/AgCl作为参比电极。检测每1 个样品时传感器共采集120 s,1 s采集1 个数据,选取各根传感器上第100~120 s的响应值的平均值作为实验数据(此时传感器趋于稳定)。
1.4 数据处理与分析
采用SPSS 19.0软件进行数据分析,运用方差分析和Duncan多重比较,显著性差异水平P<0.05。采用Origin 8.0软件进行模型拟合、回归分析及绘图。
2 结果与分析
2.1 不同预处理对黄桃鲜样WL、SG、微观结构和水分状态的影响
如表1所示,US处理组的黄桃鲜样WL为8.58%,与之相比US+IMO、US+MAI、US+CSL处理组更易造成水分损失,损失率分别为23.36%、20.13%、21.47%。US及USOD处理均会造成黄桃鲜样可溶性固形物的流失,但在USOD处理过程中由于有糖液的渗入,总固形物质量分数增加,这一结果与张鹏飞等[10]的研究结果一致。相比于US+MAI处理,US+IMO和US+CSL处理组的WL较高,但SG略低。从生产角度上是有利的,因为IMO作为一种功能性低聚糖,其在食品中的添加量有一定的限度。Sorndech等[12]在研究中提到美国食品药品管理局关于IMO在休闲果蔬食品中的推荐添加量为≤6.67%。本实验中US+IMO和US+CSL处理后样品的SG分别为(25.00±0.27)%和(13.00±0.38)%,符合上述提到的IMO在食品中的添加要求,这也表明IMO或者CSL可以考虑代替MAI进行糖液渗透。从经济角度考虑,CSL成本较低。US以及USOD处理对黄桃鲜样微观结构的影响如图1所示。经US处理后的桃片孔隙度明显增大,并且存在细胞破裂的现象,细胞边界处观察到明显的裂痕[27]。USOD处理后的黄桃鲜样微观结构与US处理存在差异,由于糖液的渗入和较多的水分损失,其主要表现为细胞收缩,细胞壁发生扭曲以及细胞坍塌现象[28],这主要是由于上述提到的USOD处理造成较多的水分损失和糖液的渗入。如图1b~e中箭头所示,不同USOD处理组的孔隙中均可以观察到糖液大分子物质,这也验证了上述实验结果。此外,不同预处理后黄桃鲜样微观结构的变化进而会造成其水分状态的变化。
图2为不同预处理组的黄桃鲜样水分T2反演图谱和弛豫时间及峰面积比例的变化。根据水在细胞内外的分布及结合程度,将其分为结合水、不易流动水和自由水。如图2a所示,根据横向弛豫时间,T21(0.01~10 ms)表示结合水;T22(10~100 ms)表示不易流动水,流动性介于结合水和自由水之间;T23(100~1 000 ms)表示自由水,其对应的峰面积分别为A21、A22、A23[29]。未经处理的鲜样其T23和T22值分别为357.07 ms和38.72 ms。经过USOD处理后,T23和T22值均减小,其中US+IMO处理组的T23和T22值最小,分别为310.78 ms和33.70 ms。经USOD处理后T23和T22值的降低一方面是由于糖液的渗入增加了桃片的内部黏度,并与质子发生化学交换,从而导致弛豫时间减小[30],另一方面是US处理使得桃片的微观结构发生变化(图1),细胞收缩,进而形成微孔通道,有利于水分从细胞壁扩散,进而导致T23和T22均有所降低[31]。从图2b可以看出,经过US及USOD处理后,A23呈现先增加后降低的趋势,而A22变化趋势与之相反,这主要是由于渗透过程水分损失较多且主要为自由水,进而使得A22的相对比例增加[10]。综合以上实验结果,与US+MAI处理组相比,US+IMO和US+CSL处理组的渗透效果也较好,USOD处理造成黄桃鲜样较多的水分损失、细胞的坍塌以及T23和T22弛豫时间的减小,这虽然有利于后期干燥过程水分的去除,但也容易造成营养成分如总酚、VC等的流失。
表1 不同预处理后黄桃鲜样的WL和SG
Table 1 WL and SG of yellow peach slices subjected to different pretreatments

注:-.未检测。同列肩标字母不同表示差异显著(P<0.05)。下同。
组别 WL/% SG/%对照组 - -US 8.58±1.58c -5.91±0.20a US+IMO 23.36±2.38a 2.25±0.27c US+MAI 20.13±1.24b 3.68±0.16b US+CSL 21.47±0.95b 2.13±0.38c

图1 不同预处理对黄桃鲜样微观结构的影响
Fig.1 Effect of different pretreatments on the microstructure of yellow peach slices
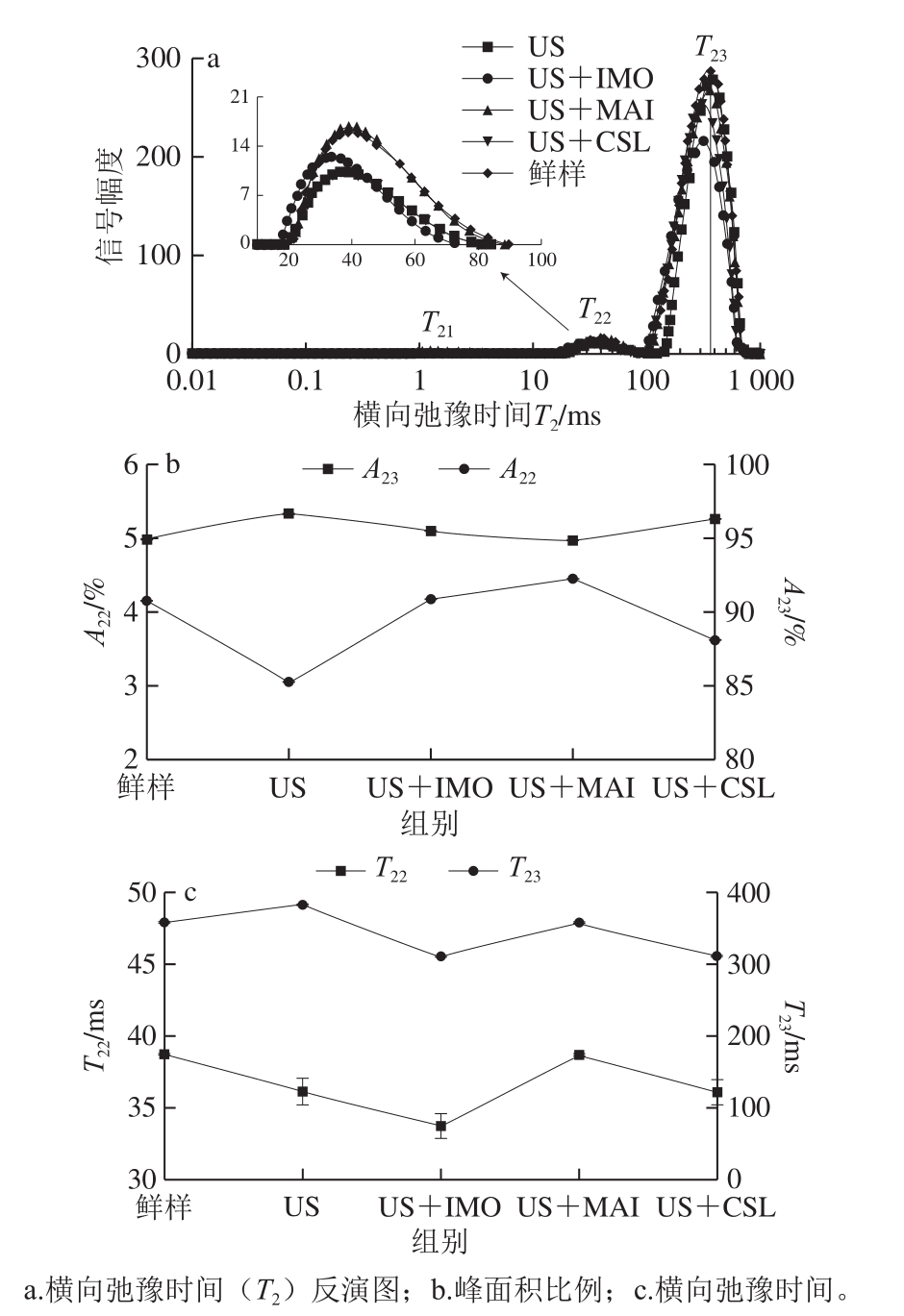
图2 不同预处理后黄桃鲜样内部水分横向弛豫时间(T2)及信号幅度(峰面积比例)的变化
Fig.2 Transverse relaxation time (T2) and signal amplitude (peak area proportion) of water in yellow peach slices with different pretreatments
2.2 不同预处理对热风干燥及真空冷冻干燥的黄桃片感官品质的影响
2.2.1 不同预处理对热风干燥及真空冷冻干燥的黄桃片硬度及脆度的影响
硬度是描述果蔬干制品质地品质的典型参数,反映了果蔬脆片的食用口感[32]。从表2可以看出,热风干燥桃片硬度较大,脆性较差,而真空冷冻干燥黄桃片硬度较低,脆性相对较好。US处理组的热风干燥及真空冷冻干燥黄桃片硬度与对照组不存在显著性差异(P>0.05)。经过USOD处理后,热风干燥及真空冷冻干燥黄桃片硬度均有所增加,这主要是由于溶质(IMO及MAI)大量进入黄桃片内部后,与水分子发生交互作用,造成孔隙度降低、组织结构变硬。其次随着干燥的进行,黄桃片的水分质量分数逐渐降低,糖质量分数逐渐增加,直至结晶析出,最后在黄桃片表面形成致密的晶体结构,这也可能造成硬度的增加[33]。对比不同USOD处理组,US+IMO处理组热风干燥及真空冷冻干燥黄桃片硬度最适中,3 个USOD处理组间脆性差异不显著(P>0.05)。经过US及USOD处理后,黄桃片的脆度均显著增加(P<0.05)。但经过USOD处理后的热风干燥黄桃片脆度略低于US处理组,这可能是由于增加的固形物导致热风干燥样品结构变坚固以及弹性降低,使得US及USOD处理后黄桃片脆度增加[34],经过USOD处理后的冻干黄桃片脆度大于US处理组,这可能是由于固形物的增加导致真空冷冻干燥样品结构变坚固以及弹性损失,脆度增加[33]。综合以上结果,从质构角度看,IMO可以代替MAI进行糖液渗透。
表2 不同预处理对热风干燥及真空冷冻干燥黄桃片硬度及脆度的影响
Table 2 Hardness and crispness of AD- and FD- dried yellow peach chips with different pretreatments
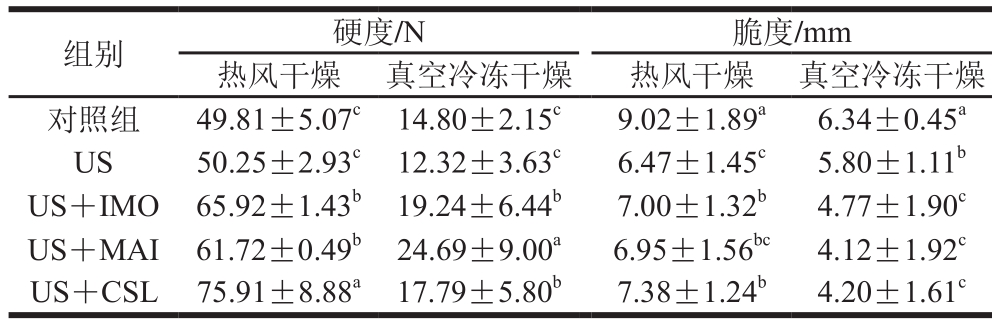
组别 硬度/N 脆度/mm热风干燥 真空冷冻干燥 热风干燥 真空冷冻干燥对照组 49.81±5.07c 14.80±2.15c 9.02±1.89a 6.34±0.45a US 50.25±2.93c 12.32±3.63c 6.47±1.45c 5.80±1.11b US+IMO 65.92±1.43b 19.24±6.44b 7.00±1.32b 4.77±1.90c US+MAI 61.72±0.49b 24.69±9.00a 6.95±1.56bc 4.12±1.92c US+CSL 75.91±8.88a 17.79±5.80b 7.38±1.24b 4.20±1.61c
2.2.2 不同预处理对热风干燥及真空冷冻干燥黄桃片色泽的影响
由表3可知,US及USOD处理后的热风干燥黄桃片由于红度值和黄度值(a、b值)的降低,导致ΔE值显著增加(P<0.05),这说明与对照组相比,经过预处理后的热风干燥黄桃片发生了褐变,颜色偏深。这可能是由于预处理导致黄桃细胞结构的破坏,从而造成多酚氧化酶的释放以及活性的提高[27],加剧热风干燥过程中的褐变反应。US及USOD处理组的真空冷冻干燥黄桃片ΔE值也显著高于对照组(P<0.05),这主要是由亮度值和黄度值(L、b值)的降低导致。但与热风干燥不同,真空冷冻干燥黄桃片经预处理后ΔE值的增加并非在真空冷冻干燥过程中发生了褐变,其主要表现为亮度下降,色泽发白,黄色变浅[35]。这可能是由于经过US及USOD处理后,黄桃片细胞遭受破坏,孔隙变大,使其颜色变浅,其次在真空冷冻干燥过程中可能发生相关色素物质的降解,但具体降解机制及降解物质需要进一步的研究。与US+MAI处理组相比,US+IMO及US+CSL处理组的热风干燥及真空冷冻干燥黄桃片色泽效果也较好。因而,从色泽角度考虑,IMO可以代替MAI进行糖液渗透。
表3 不同预处理对热风干燥和真空冷冻干燥黄桃片色泽的影响
Table 3 Effect of different pretreatments on the color of AD- and FD-dried yellow peach chips
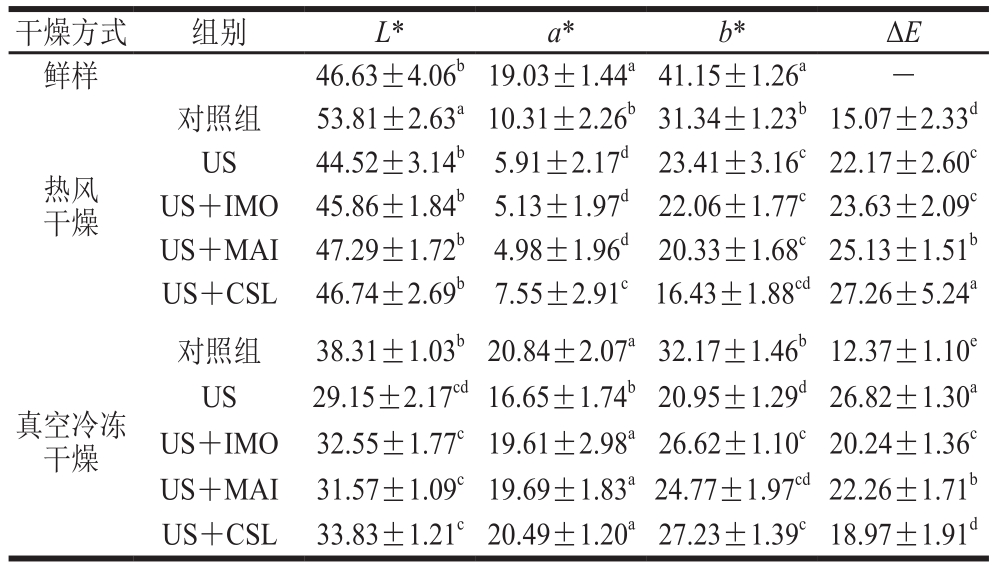
干燥方式 组别 L* a* b* ΔE鲜样 46.63±4.06b19.03±1.44a41.15±1.26a -热风干燥对照组 53.81±2.63a10.31±2.26b31.34±1.23b15.07±2.33d US 44.52±3.14b 5.91±2.17d 23.41±3.16c22.17±2.60c US+IMO 45.86±1.84b5.13±1.97d22.06±1.77c23.63±2.09c US+MAI 47.29±1.72b4.98±1.96d20.33±1.68c25.13±1.51b US+CSL 46.74±2.69b7.55±2.91c16.43±1.88cd27.26±5.24a真空冷冻干燥对照组 38.31±1.03b20.84±2.07a32.17±1.46b12.37±1.10e US 29.15±2.17cd16.65±1.74b20.95±1.29d26.82±1.30a US+IMO 32.55±1.77c19.61±2.98a26.62±1.10c20.24±1.36c US+MAI 31.57±1.09c19.69±1.83a24.77±1.97cd22.26±1.71b US+CSL 33.83±1.21c20.49±1.20a27.23±1.39c18.97±1.91d
2.2.3 黄桃鲜样及不同预处理后的热风干燥和真空冷冻干燥黄桃片滋味的差异性分析

图3 黄桃鲜样及预处理后的热风干燥及真空冷冻干燥黄桃片DFA图
Fig.3 Discrimination function analysis plots of yellow peach slices and AD- and FD-dried yellow peach chips with different pretreatments
图3为黄桃鲜样及经不同预处理的黄桃干制品电子舌检测判别分析(discrimination function analysis,DFA)图。总贡献率超过85%表明实验方法的可行性。图3中主成分1和主成分2的总贡献率达到92.11%,表明提取的信息能够反映原始数据的大部分信息。电子舌分析结果表明,未经处理的热风和真空冷冻干燥黄桃片滋味最接近鲜样,经预处理的黄桃片滋味与对照组存在明显差异,这说明US以及USOD处理对黄桃脆片口感影响较大。US处理组的热风干燥黄桃片与USOD处理组的滋味差异显著,但USOD处理组间热风干燥黄桃片差异不显著。综合来看,3 个USOD处理组的热风干燥及真空冷冻干燥黄桃片相互有重叠,而且热风干燥及真空冷冻干燥黄桃片不同USOD处理组间也相互有重叠,说明其口感较为接近,也间接说明IMO可以考虑代替MAI进行渗透。
2.3 不同预处理对热风干燥及真空冷冻干燥的黄桃片营养品质的影响
2.3.1 不同预处理对热风干燥及真空冷冻干燥的黄桃片总酚含量及其抗氧化能力的影响
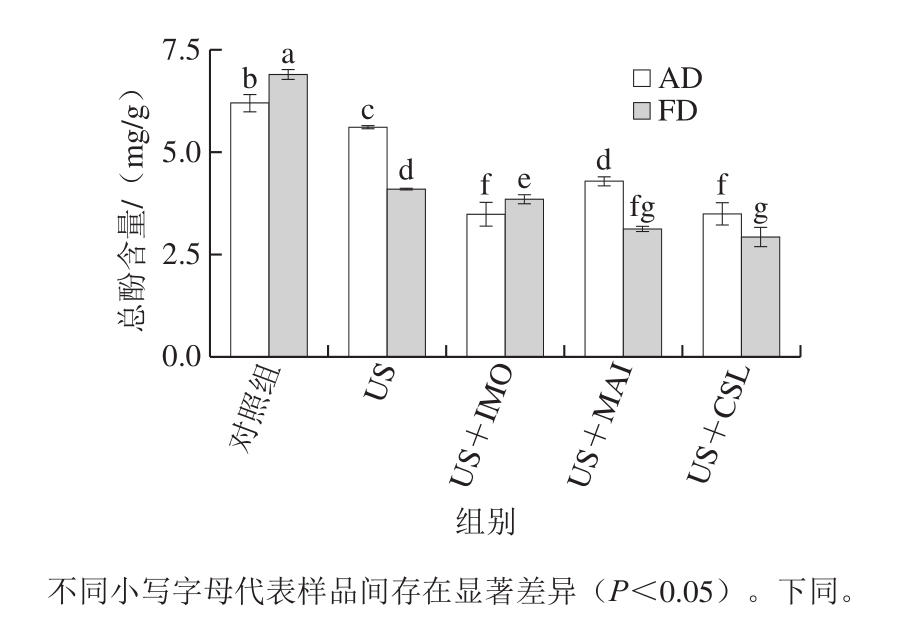
图4 不同预处理对热风干燥及真空冷冻干燥黄桃片总酚含量的影响
Fig.4 Effect of different pretreatments on the polyphenol content of AD- and FD-dried yellow peach chips
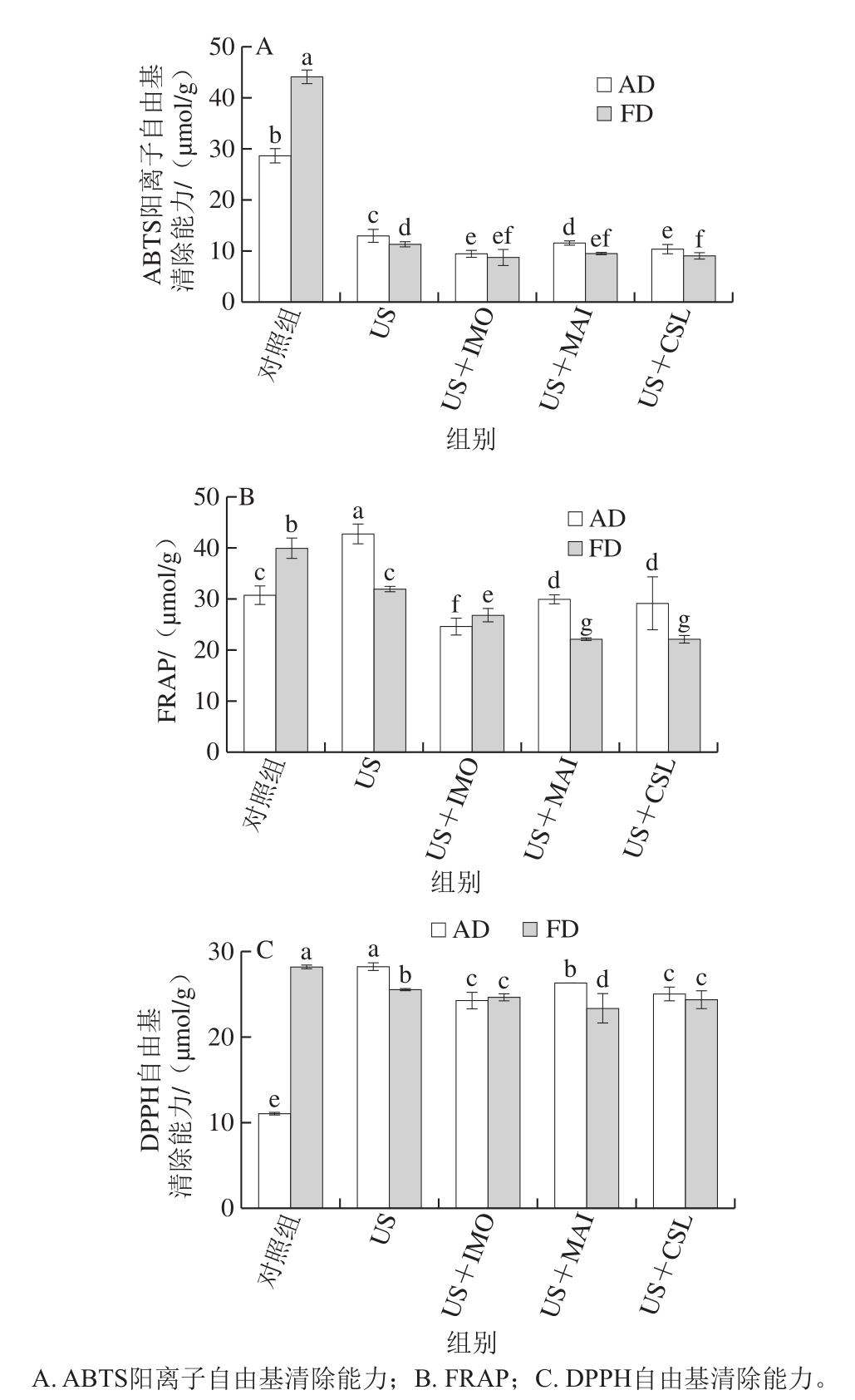
图5 不同预处理对热风干燥及真空冷冻干燥黄桃片抗氧化能力的影响
Fig.5 Effect of different pretreatments on the antioxidant capacity of AD- and FD-dried yellow peach chips
图4和图5分别为不同预处理的热风干燥及真空冷冻干燥黄桃脆片的总酚含量及其抗氧化能力的变化。对照组热风干燥及真空冷冻干燥黄桃片总酚含量分别为6.20、6.90 mg/g。US处理后热风干燥及真空冷冻干燥黄桃片总酚含量下降,分别为5.61、4.09 mg/g。US处理造成总酚含量的降低主要是由于US处理过程中发生的溶质迁移和水分流失,进一步造成部分水溶性营养物质的损失[36]。USOD处理组的热风干燥及真空冷冻干燥黄桃片总酚含量均低于US处理组,这可能是由于USOD处理组WL高于US处理组,进而使得USOD处理组的总酚随着水分的流失而损失较多;此外,对比3 种USOD处理,US+MAI处理组的热风干燥黄桃片总酚含量相对较高,而US+IMO处理组的真空冷冻干燥黄桃片总酚含量相对较高。从图5可以看出,经过US及USOD处理后热风干燥及真空冷冻干燥黄桃片ABTS自由基清除能力及Fe2+还原能力(FRAP值)都显著下降(P<0.05),这主要是由于经过预处理后热风干燥及真空冷冻干燥黄桃片总酚有所损失。然而,与US处理相比,不同预处理后热风干燥黄桃片DPPH自由基清除能力增加,这可能是由于预处理不仅造成黄桃片总酚的损失,也造成其单酚含量和种类的变化。相关研究表明,不同单酚的含量和结构对DPPH、ABTS自由基清除能力以及Fe2+还原能力的贡献率不同,从而导致经过预处理后黄桃脆片DPPH与ABTS、FRAP抗氧化能力的变化呈现差异性[37]。
2.3.2 不同预处理对热风干燥及真空冷冻干燥的黄桃片VC含量的影响
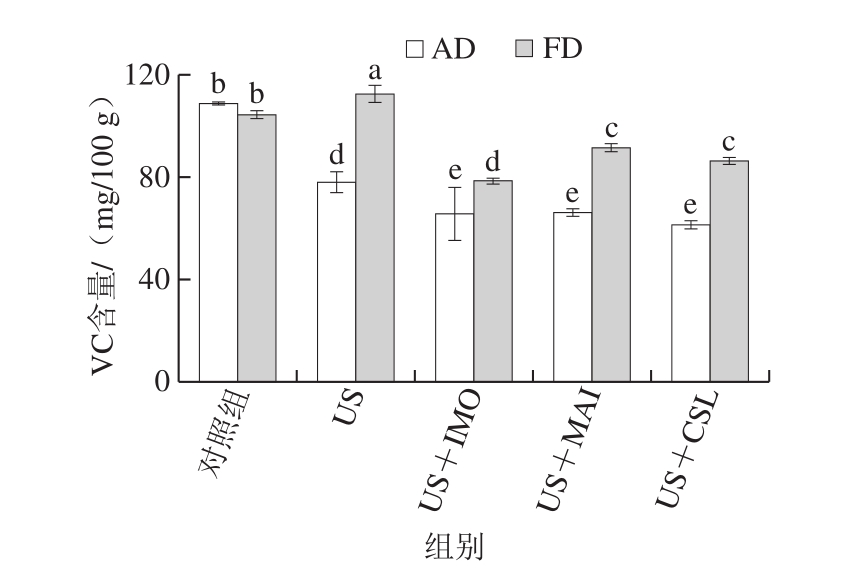
图6 不同预处理对热风干燥及真空冷冻干燥黄桃片VC含量的影响
Fig.6 Effect of different pretreatments on the ascorbic acid content of AD- and FD-dried yellow peach chips
从图6可以看出,对照组的热风和真空冷冻干燥黄桃片的VC含量分别为109.01 mg/100 g和104.42 mg/100 g,差异不显著(P>0.05)。US处理后的真空冷冻干燥黄桃片VC含量增加,然而经过USOD处理后,热风干燥及真空冷冻干燥黄桃片VC均有不同程度的损失,这说明USOD处理后黄桃片VC含量的损失可能是由于渗透处理造成黄桃鲜样较多的水分损失,进而造成了VC的流失[36]。与对照组相比,不同预处理后的真空冷冻干燥黄桃片VC含量均高于热风干燥的桃片,这可能是由于预处理造成黄桃鲜样结构的破坏,促进VC在长时间的热风干燥高温过程中与氧气的接触,进而造成VC的损失[38]。US+IMO、US+MAI、US+CSL处理的热风黄桃片VC含量不存在显著性差异(P>0.05),US+IMO处理组的真空冷冻干燥黄桃片VC含量达78.50 mg/100 g,略低于US+MAI和US+CSL处理组,这可能与US+IMO处理后的黄桃鲜样WL最高有关。
2.3.3 不同预处理对热风干燥及真空冷冻干燥的黄桃片总类胡萝卜素含量的影响
由图7可知,未经处理组的真空冷冻干燥桃片总类胡萝卜素含量低于热风干燥的黄桃片,这是由于真空冷冻干燥黄桃片质地膨松,表面积大等,易造成其在真空冷冻干燥过程中类胡萝卜素发生降解[39]。US+IMO处理组的热风干燥黄桃片总类胡萝卜素含量达47.87 mg/100 g,显著高于对照组及US+CSL和US+MAI处理组(P<0.05),这说明在热风干燥过程中,IMO对类胡萝卜素具有较好的保护作用。经过US及USOD处理的真空冷冻干燥黄桃片总类胡萝卜素含量显著高于对照组(P<0.05),其中US处理组的总类胡萝卜素含量最高,达73.58 mg/100 g,这可能是由于US处理后黄桃鲜样微观结构遭到破坏,导致细胞壁中纤维素的溶解,进而使得细胞中的类胡萝卜素得到释放[40]。对比不同USOD处理组的总类胡萝卜素含量,US+IMO处理组效果最佳。
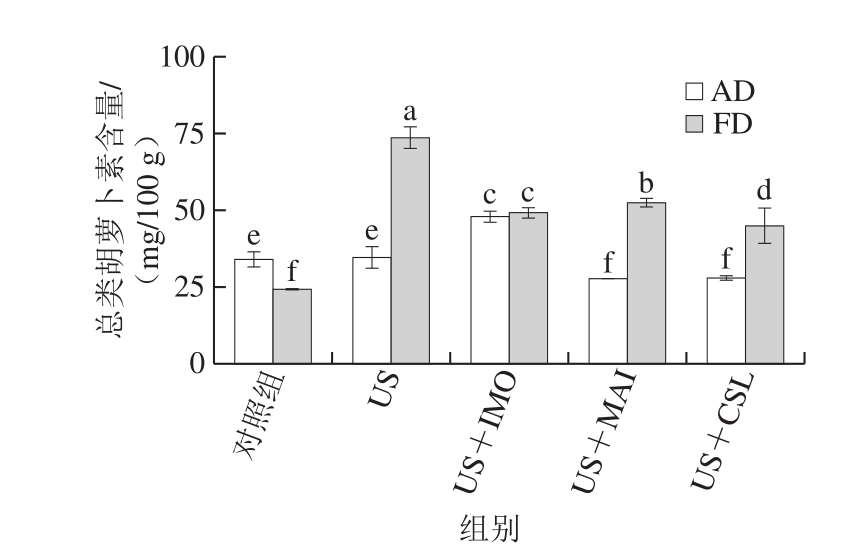
图7 不同预处理对热风干燥及真空冷冻干燥黄桃片总类胡萝卜素含量的影响
Fig.7 Effect of different pretreatments on the carotenoid content of AD- and FD-dried yellow peach chips
3 结 论
本实验研究不同预处理对热风干燥及真空冷冻干燥黄桃片感官品质和营养品质的影响,进而明确IMO是否可以代替传统的MAI对黄桃片进行糖液渗透。结果表明,IMO渗透效果略低于MAI,但满足其在食品中的添加要求。US+IMO处理组的干燥桃片色泽、硬度及脆度效果等都略优于US+MAI处理组。US+IMO处理组的热风干燥及真空冷冻干燥黄桃片口感与US+MAI处理组的差异不明显。经过USOD处理后热风干燥及真空冷冻干燥黄桃片的总酚含量及其抗氧化能力有所降低,VC含量也有损失。然而USOD处理后黄桃脆片总类胡萝卜素含量增加,且其中US+IMO处理组的黄桃片总类胡萝卜素含量最高。因而综合考虑,IMO可以代替MAI进行糖液渗透,在改善黄桃脆片口感的前提下降低甜度,增加消费人群,满足现代人对天然、营养、健康的休闲食品的追求。
[1]苏明申, 叶正文, 李胜源, 等.桃的栽培价值和发展概况[J].现代农业科学, 2008, 15(3): 16-18.
[2]雷培, 尹泽超, 桑利群, 等.桃种质资源收集利用及进化研究进展[J].现代农业科技, 2019(1): 94-95.DOI:10.3969/j.issn.10075-39.2019.01.056.
[3]丁丽玲, 卢建兰, 林佩霞.桃的贮藏保鲜与加工[J].新农村, 2017(8):35-36.DOI:10.3969/j.issn.1674-8409.2017.08.020.
[4]吕健, 刘璇, 毕金峰, 等.桃变温压差膨化脆片品质评价研究[J].中国农业科学, 2016, 49(4): 802-812.DOI:10.3864/j.i-ssn.0578-1752.2016.04.019.
[5]孙芳, 江水泉.我国果蔬干燥加工技术现状及发展前景[J].粮食与食品工业, 2016, 23(4): 11-15.DOI:10.3969/j.issn.1672-5026.2016.04.003.
[6]许晴晴, 陈杭君, 郜海燕, 等.真空冷冻和热风干燥对蓝莓品质的影响[J].食品科学, 2014, 35(5): 64-68.DOI:10.7506/spkx100-2630201405013.
[7]江家伍, 徐伟君.提高真空冷冻干燥速率的研究[J].包装与食品机械, 2002, 20(2): 4-8.DOI:10.3969/j.issn.1005-1295.2002.02.002.
[8]孟岳成, 王君, 房升, 等.熟化红薯热风干燥特性及数学模型适用性[J].农业工程学报, 2011, 27(7): 387-392.DOI:10.3969/j.issn.-1002-6819.2011.07.068.
[9]李晓丽.果蔬预处理现状分析及未来发展趋势[J].北京农业,2016(2): 165-166.DOI:10.3969/j.issn.1000-6966.2016.02.101.
[10]张鹏飞, 吕健, 毕金峰, 等.超声及超声渗透预处理对红外辐射干燥特性研究[J].现代食品科技, 2016, 32(11): 197-202.DOI:10.13982/j.mfst.1673-9078.2016.11.030.
[11]肖敏.功能性低聚糖及其生产应用[J].生物产业技术, 2018(6):29-34.DOI:10.3969/j.issn.1674-0319.2018.06.005.
[12]SORNDECH W, NAKOM N, TONGTA S, et al.Isomalto-oligosaccharides:recent insights in production technology and their use for food and medical applications[J].LWT-Food Science and Technology, 2018, 95:135-142.DOI:10.1016/j.lwt.2018.04.098.
[13]NAKAKUKI T.Present status and future of functional oligosaccharide development in Japan[J].Pure and Applied Chemistry, 2005, 74(7):1245-1251.DOI:10.1351/pac200274071245.
[14]YEN C H, TSENG Y H, KUO Y W, et al.Long-term supplementation of isomalto oligisaccharides improved colonic microflora profile,bowel function, and blood cholesterol levels in constipated elderly people: a placebolled, diet-controlled trial[J].Nutrition, 2011, 27(4):445-450.DOI:10.1016/j.nut.2010.05.012.
[15]PARK E Y, JANG S B, LIM S T.Effect of fructo-oligosaccharide and isomalto-oligosaccharide addition on baking quality of frozen dough[J].Food Chemistry, 2016, 213: 157-162.DOI:10.1016/j.foodchem.2016.06.067.
[16]YADAY B S, YADAV R B, JATAIN M.Optimization of osmotic dehydration conditions of peach slices in sucrose solution using response surface methodology[J].Journal of Food Science and Technology, 2011, 49(5): 547-555.DOI:10.1007/s13197-011-0298-z.
[17]LYU J, ZHOU L Y, BI J F, et al.Quality evaluation of yellow peach chips prepared by explosion puffing drying[J].Journal of Food Science and Technology, 2015, 52(12): 8204-8211.DOI:10.1007/s13197-015-1906-0.
[18]PENG J, BI J F, YI J Y, et al.Engineering texture properties of instant controlled pressure drop (DIC) dried carrot chips via modulating osmotic conditions[J].Food and Bioprocess Technology, 2018, 11(9):1674-1685.DOI:10.1007/s11947-018-2133-2.
[19]CHAN E W C, LIM Y Y, WONG S K, et al.Effects of different drying methods on the antioxidant properties of leaves and tea of ginger species[J].Food Chemistry, 2009, 113(1): 166-172.DOI:10.1016/j.foodchem.2008.07.090.
[20]KNOCKAERT G, LEMMENS L, VAN B S, et al.Changes in β-carotene bioaccessibility and concentration during processing of carrot puree[J].Food Chemistry, 2012, 133(1): 60-67.DOI:10.1016/j.foodchem.2011.12.066.
[21]ISTRATI D, VIZIREANU C, IORDACHESCU G, et al.Physico-chemical characteristics and antioxidant activity of goji fruits jam and jelly during storage[J].Annals of the University Dunarea de Jos of Galati Fascicle VI, 2013, 37(2): 100-110.
[22]WANG Yongtao, LIU Fengxia, CAO Xiamin, et al.Comparison of high hydrostatic pressure and high temperature short time processing on quality of purple sweet potato nectar[J].Innovative Food Science and Emerging Technologies, 2012, 16: 326-334.DOI:10.1016/j.ifset.2012.07.006.
[23]TABART J, KEVERS C, EVERS Z D.Ascorbic acid, phenolic acid,flavonoid, and carotenoid profiles of selected extracts from Ribes nigrum[J].Journal of Agricutural and Food Chemistry, 2011, 59(9):4763-4770.DOI:10.1021/jf104445c.
[24]JEONG J H, JUNG H, LEE S R, et al.Anti-oxidant, anti-proliferative and anti-inflammatory activities of the extracts from black raspberry fruits and wine[J].Food Chemistry, 2010, 123(2): 338-344.DOI:10.1016/j.foodchem.2010.04.040.
[25]LIU Changjin, ZHAO Yanli, LI Xiaojing, et al.Antioxidant capacities and main reducing substance contents in 110 fruits and vegetables eaten in China[J].Food and Nutrition Science, 2014, 5(4): 293-307.DOI:10.4236/fns.2014.54036.
[26]杨阳, 沈诚, 桑跃, 等.电子舌在甜菊糖甜味特性评价中的应用[J].农业机械学报, 2015, 46(6): 239-243.DOI:10.6041/j.issn.1000-1298.2015.06.034.
[27]MIANO A C, ROJAS M L, AUGUSTO P E D.Structural changes caused by ultrasound pretreatment: direct and indirect demon-stration in potato cylinders[J].Ultrasonics Sonochemistry, 2018, 52(2):176-183.DOI:10.1016/j.ultsonch.2018.11.015.
[28]ALLAHDAD Z, NASIRI M, VARIDI M, et al.Effect of sonication on osmotic dehydration and subsequent air-drying of pomegranate arils[J].Journal of Food Engineering, 2019, 244: 202-211.DOI:10.1016/j.jfoodeng.2018.09.017.
[29]XU F F, JIN X, ZHANG L, et al.Investigation on water status and distribution in broccoli and the effects of drying on water status using NMR and MRI methods[J].Food Research International, 2017, 96:191-197.DOI:10.1016/j.foodres.2017.03.041.
[30]XIN Y, ZHANG M, ADHIKARI B.Effect of trehalose and ultrasoundassisted osmotic dehydration on the state of water and glass transition temperature of broccoli (Brassica oleracea L.var. botrytis L.)[J].Journal of Food Engineering, 2013, 119(3): 640-647.DOI:10.1016/j.jfoodeng.2013.06.035.
[31]PEI P, CHEN L F, YANG W J, et al.Comparison of osmotic dehydration and ultrasound-assisted osmotic dehydration on the state of water, texture, and nutrition of Agaricus bisporus[J].CyTA-Journal of Food, 2017, 16(1): 181-189.DOI:10.1080/19476337.2017.1365774.
[32]张莉会, 廖李, 汪超, 等.超声和渗透预处理对干燥草莓片品质及抗氧化活性影响[J].现代食品科技, 2018, 34(12): 196-203.DOI:10.13982/j.mfst.1673-9078.2018.12.029.
[33]陈立夫, 裴斐, 张里明, 等.超声辅助渗透处理对冷冻干燥双孢蘑菇冻干效率和品质的影响[J].食品科学, 2017, 38(23): 8-13.DOI:10.7506/spkx1002-6630-201723002.
[34]AN K J, HUI L, ZHAO D D, et al.Effect of osmotic dehydration with pulsed vacuum on hot-air drying kinetics and quality attributes of cherry tomatoes[J].Drying Technology, 2013, 31(6): 698-706.DOI:10.1080/07373937.2012.755192.
[35]潘清方, 周国燕.真空冷冻干燥芒果片的工艺研究[J].安徽农业科学, 2011, 39(19): 11925-11927.DOI:10.3969/j.issn.0517-6611.2011.19.215.
[36]BOZKIR H, RAYMAN E A, SERDAR E, et al.Influence of ultrasound and osmotic dehydration pretreatments on drying and quality properties of persimmon fruit[J].Ultrasonics Sonochemistry,2019, 54: 135-141.DOI:10.1016/j.ultsonch.2019.02.006.
[37]王俏, 邹阳, 钟耕, 等.多酚类单体物质抗氧化活性的研究[J].食品工业科技, 2011, 32(1): 137-140.
[38]VIEIRA D S J E, LINS D M, BATISTA D M.Influence of ultrasound and vacuum assisted drying on papaya quality parameters[J].LWT-Food Science and Technology, 2018, 97: 317-322.DOI:10.1016/j.lwt.2018.07.017.
[39]GOULA A M, ADAMOPOULOS K G.Kinetic models of β-carotene degradation during air drying of carrots[J].Drying Technology, 2010,28(6): 752-761.DOI:10.1080/07373937.2010.482690.
[40]DA SILVA G D, BARROS Z M P, DE MEDEIROS C B O, et al.Pretreatments for melon drying implementing ultrasound and vacuum[J].LWT-Food Science and Technology, 2016, 74: 114-119.DOI:10.1016/j.lwt.2016.07.039.