近年来,糖尿病已逐渐成为威胁人类健康三大慢性疾病之一,据国际糖尿病联合会统计,2017年我国糖尿病患者达到1.144 亿,也就是每11 个成年人中就有1 个糖尿病患者[1]。而临床的各种治疗药物易引起低血糖、低血压、肝损伤等各种副作用[2],因此开发新的用于辅助治疗糖尿病的食源性活性物质具有十分重要的应用前景。食源性二肽基肽酶IV(dipeptidyl peptidase IV,DPP-IV)抑制肽已逐渐成为用于辅助治疗II型糖尿病的重要靶点,并且无其他副作用[3]。DPP-IV抑制肽指的是蛋白水解物中某些特定肽段可以抑制体内肠道酶DPP-IV对胰高血糖素样肽(glucagonlike peptide-1,GLP-1)的降解,促进胰岛β细胞分泌胰岛素及抑制胰岛α细胞分泌胰高血糖素从而降低血糖[4],还不易诱发低血糖症。这类食源性小分子肽主要来源于酪蛋白、乳清蛋白、胶原蛋白、小麦及大米蛋白等[5-9],通常是由2~10 个氨基酸组成的寡肽序列。截止2019年已报道的抑制肽大约共有400 多条[10],而学者们通过对这些肽的构效关系进行分析发现,DPP-IV抑制肽在结构组成上存在一定的规律,即通常N末端具有Trp或第二位置为Pro或Ala[11-14],而N端第二位置具有Pro或Ala的肽段符合DPP-IV特异酶切位点,因而发挥竞争性抑制作用。因此,食源性DPP-IV抑制肽已成为今后辅助治疗糖尿病的重要手段,而利用构效关系鉴定活性潜力肽段辅助开发新的强活性DPP-IV抑制肽具有指导意义。
酪蛋白作为牛奶中含量最多的一类蛋白质,约占80%左右。近50年来,酪蛋白水解产物中很多种生物活性已陆续被发现,如免疫调节、阿片样活性、降血压、降血糖、抗焦虑等活性[15-19]。大量研究表明,酪蛋白是DPP-IV抑制肽的重要来源,其各种亚基序列中含有许多DPP-IV抑制活性潜在序列[7],而目前关于酪蛋白DPP-IV抑制肽的研究主要集中在商业酶水解释放,如张颖等[20-21]对牛及山羊乳通过5 种商业酶制备DPP-IV抑制肽及其机理研究,发现牛乳酪蛋白水解物对β-细胞促胰岛分泌作用更强,由体内体外实验中证明牛乳酪蛋白经商业酶水解确能释放较多DPP-IV抑制肽。Tagliazucchi等[22]研究几种物种乳源蛋白模拟消化的生物活性,4 种乳源蛋白共鉴定19 种DPP-IV抑制肽,牛奶被发现为DPP-IV抑制肽和抗氧化肽的最佳来源。综上,目前对于牛乳酪蛋白直接消化过程中DPP-IV抑制活性变化规律仍不清晰,从DPP-IV抑制典型结构特征肽分析DPP-IV抑制活性变化机制的研究鲜少、较新颖。
因此,本实验通过模拟人体胃肠消化(胃蛋白酶-胰酶体外消化)水解酪蛋白,研究酪蛋白消化产物DPP-IV抑制活性变化规律,并通过液相色谱串联质谱法(liquid chromatographic-tandem mass spectrometry,LC-MS/MS)分析酪蛋白消化产物中具有典型DPP-IV抑制肽结构特征肽段序列变化,试图阐明抑制活性、消化特性、特征肽组成及含量变化之间的关系。
1 材料与方法
1.1 材料与试剂
酪蛋白(分析纯)、胃蛋白酶(分析纯)、胰酶(分析纯)、二肽基肽酶IV、甘氨酰-脯氨酰-对硝基苯胺对甲苯磺酸盐(Gly-Pro-pNA)、二硫苏糖醇、邻苯二甲醛(o-phthalaldehyde,OPA)、5 种分子质量标准品(牛血清白蛋白(66 430 Da)、细胞色素c(12 384 Da)、抑肽酶(6 521 Da)、杆菌肽(1 423 Da)、VB12(1 355 Da)) 美国Sigma公司;合成肽IPI和LVF(纯度>95%)吉尔生化(上海)有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
ME 204电子天平 瑞士Mettler Toledo公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;KND-2C型定氮仪 上海纤检仪器有限公司;Varioskan Flash全波长扫描多功能读数仪、HPLC高效液相色谱美国Thermo Fisher Scientific公司;Impact II高分辨四极杆飞行时间串联质谱(electrospray ionization-qudropole timeof-flight-tandem mass spectrometry,ESI-Q-TOF-MS/MS)美国Bruker公司;ACQUITY超高效液相色谱(ultra performance liquid chromatography,UPLC)美国Waters公司。
1.3 方法
1.3.1 体外胃蛋白酶-胰酶模拟胃肠道消化制备酪蛋白消化液
根据You Lijun等[23]的方法,加以修改。取5 g酪蛋白分散于50 mL蒸馏水中,放置于磁力搅拌器中使之充分搅拌溶解,再使用1 mol/L HCl溶液将酪蛋白溶解调整pH值至2.0左右,在37 ℃振荡水浴摇床中温育15 min后,向酪蛋白溶液中添加质量分数2%(基于酪蛋白原料)的胃蛋白酶,随后混合物在37 ℃摇床中温育水解持续2 h。2 h后取出,用2 mol/L NaOH溶液调pH值至7.5,往溶液中添加质量分数2%的胰酶进行第二步消化,同样在37 ℃摇床中温育水解持续2 h,分别在相应时间点0、30、60、90、120、150、180、210、240 min时取出消化液,立即于100 ℃沸水下灭酶10 min终止消化,冷却后均于10 000×g、4 ℃下离心15 min,取上清液,部分保留消化液储存至-20 ℃备用,部分冻干后于-20 ℃保存供MS分析。
1.3.2 酪蛋白消化特性的测定
1.3.2.1 酪蛋白体外消化率的测定
依照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》用凯氏定氮法对9 个不同消化时间的消化样品定氮,根据公式(1)计算蛋白质量分数,然后根据公式(2)计算出酪蛋白体外消化率。

1.3.2.2 酪蛋白体外消化水解度的测定
水解度指水解蛋白质断裂游离N-末端氨基的百分比,使用OPA测定法定量测定,参考Nielsen等[24]的方法,加以改进。根据1.3.2.1节测得的蛋白质量分数使用去离子水分别稀释胃消化及肠消化样品,稀释样品质量浓度分别为1 mg/mL及0.5 mg/mL;使用紫外96 孔板,每孔中加32 μL样品、去离子水、丝氨酸标准溶液和240 μL OPA溶液,分别作为样品组、空白组、标准组,并且每个样平行3 次,在37 ℃下反应2 min,于多功能酶标仪中测定340 nm波长处吸光度,按照下列公式(3)计算水解度。
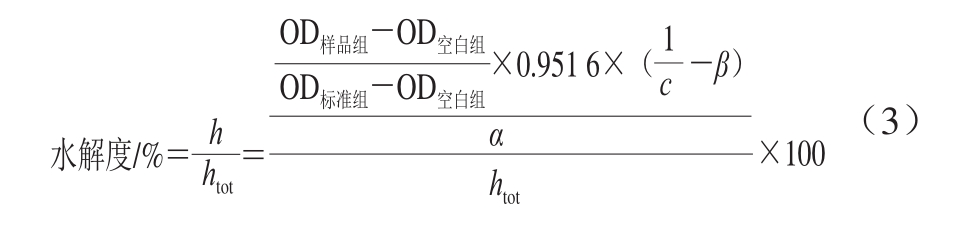
式中:h为水解肽键数;OD样品组、OD空白组、OD标准组分别为样品、去离子水、丝氨酸标准溶液在340 nm波长处测定的吸光度;c为样品浓度/(mol/L);β、α为计算蛋白原料水解肽键数固有系数;htot为总肽键数,取决于原料的类型;其中酪蛋白的β=0.383、α=1.039、htot=8.2。
1.3.3 酪蛋白消化液DPP-IV抑制活性测定
DPP-IV抑制活性是指样品对内源性肠道酶DPP-IV的抑制作用,抑制活性的测定参照Silveira等[25]的方法,加以改进。分别先后在96 孔板中加入40 μL 0.5 mol/L底物(Gly-Pro-pNA溶液)和80 μL蛋白质量浓度4 mg/mL样品(样品组)或Tris溶液(对照组)同时37 ℃温育10 min,再加入40 μL 12.5 mU/mL DPP-IV酶(预先在37 ℃保温5 min),混匀后于多功能酶标仪在37 ℃下孵育,每隔2 min在405 nm波长处测吸光度,共孵育2 h。根据公式(4)计算抑制率。
式中:Slope对照组为利用Slope函数求空白组吸光度在线性范围内变化的时间点的斜率;Slope样品组为使用Slope函数求样品组吸光度在线性范围内变化的时间点的斜率。
1.3.4 分子质量分布的测定
分子质量的分布可以用来表示蛋白质水解的效率,以及辅助分析肽段降解的序列长短范围,参照Zheng Lin等[26]的方法加以修改,采用G2000 SWXL TSK凝胶色谱柱(7.8 mm×300 mm,5 μm),流动相为含0.1%三氟乙酸的磷酸钠缓冲液,流速1 mL/min,进样量20 μL,在220 nm波长处测吸光度,使用6 种分子质量标准品参照物,包括牛血清白蛋白(66 430 Da)、细胞色素c(12 384 Da)、抑肽酶(6 521 Da)、杆菌肽(1 423 Da)、VB12(1 355 Da)和合成三肽LVF(377 Da),得到标准曲线y=-0.351 4x+7.359 2,R2=0.998 2,计算分析消化产物1、2、3、4 h的分子质量分布。
1.3.5 UPLC-ESI-Q-TOF-MS/MS鉴定活性肽段
通过UPLC-ESI-Q-TOF-MS/MS来鉴定酪蛋白模拟胃肠消化过程中释放的肽段序列。色谱柱为HSS T3柱(2.1 mm×100 mm,1.8 μm),洗脱速率为0.2 mL/min,进样量为2 μL。流动相A为0.1%甲酸水,B为乙腈(色谱纯),洗脱程序为:0~10 min,5%~40% B;10~12 min,40%~90% B;12~14 min,90% B;14~15 min,90%~5% B;15~18 min,5% B平衡至初始状态。质谱参数:电子轰击离子源能量7 eV,毛细管电压4 500 V,离子源温度200 ℃,干燥气体流量8 L/min,雾化器压力1.5 bar,质量扫描范围m/z 50~1 500。
数据解谱及检索:采用Mascot搜库鉴定6 肽以上的长肽序列;而具有2~6 个氨基酸残基的短肽则采用Target Analysis 1.2软件筛选匹配符合DPP-IV抑制肽结构特征,再结合Data Analysis 4.3软件手动解谱测序确认序列。
1.4 数据处理与分析
本实验中所有数据分析、作图,均采用Excel 2013、Origin Pro 8软件及SPSS 22软件处理完成,结果均以平均值±标准差表示,采用Duncan多重比较对数据进行显著性差异分析。以P<0.05时表示差异显著。
2 结果与分析
2.1 酪蛋白体外消化特性分析结果
利用胃蛋白酶-胰酶两步体外消化水解酪蛋白,从而模拟其人体胃肠消化过程,并以水解度和消化率来分析其消化过程中肽键断裂程度及消化程度,结果如图1所示。在0~120 min胃蛋白酶消化阶段,水解度均较低,仅为5%左右,且无显著性差异(P>0.05),消化率也较低,在50%~80%左右。这主要是由于胃蛋白酶为内切型蛋白酶,其酶解位点较特异,主要水解肽键的氨基端或羧基端为芳香族氨基酸,因此通常水解肽键程度较低,蛋白消化程度低。而经胰酶消化30 min后,水解度快速增加,由5.29%增加到26.71%,之后趋于平缓;消化率也快速增加至92.24%,之后趋于平缓稳定且无显著性差异(P>0.05)。胰酶中含有胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶以及羧肽酶A和B等多种内切型蛋白酶和外切型蛋白酶,因此能够快速地降解酪蛋白形成小分子肽和游离氨基酸,从而使其水解度和消化率快速增加。Goodman[27]研究也发现相同结论,胰酶相较于胃蛋白酶更有利于蛋白水解,降解成小分子肽,水解度显著增加。以上表明酪蛋白经胃肠消化释放许多有潜力的生物活性肽。
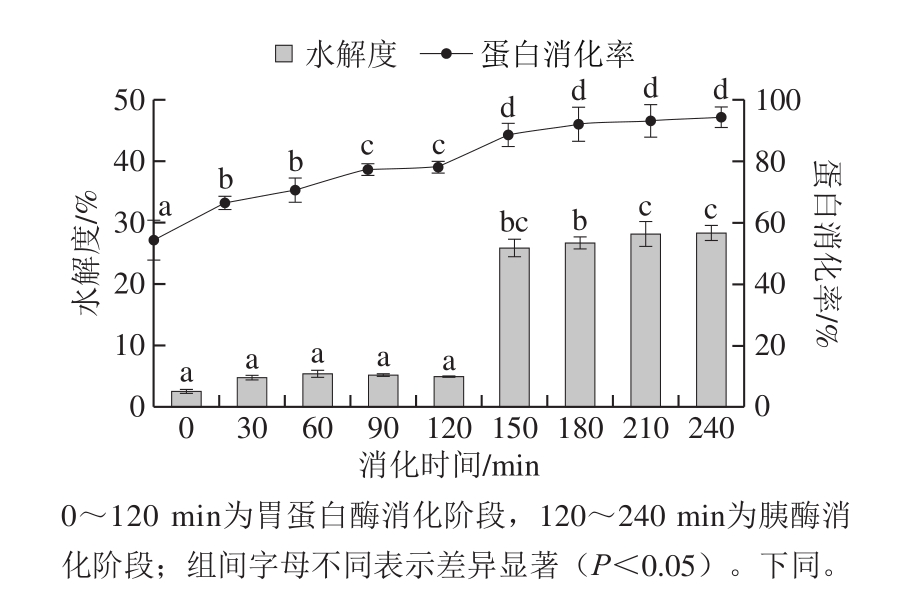
图1 酪蛋白体外消化过程中的水解度和消化率变化
Fig.1 Change in degree of hydrolysis and digestibility of casein during in vitro digestion
2.2 酪蛋白消化产物的DPP-IV抑制率
DPP-IV是一种肠道酶,能降解肠促激素GLP-1及葡萄糖依赖性促胰岛素多肽[4],从而减少胰岛素的释放。根据Pratley等[28]研究表明DPP-IV酶是一种高特异性丝氨酸蛋白酶,具有酶解特异性,主要酶切N端第二位为Pro或Ala的肽链。因此,本实验考察了酪蛋白经体外消化水解后DPP-IV抑制活性的变化,结果如图2所示,样品组进样蛋白含量均维持0.32 mg一致,在0~30 min胃蛋白酶消化阶段,其产物的DPP-IV抑制率由0.61%显著增加至19.51%(P<0.05)。由此可以看出,酪蛋白本身不具备DPP-IV抑制活性,但经一步消化,胃蛋白酶酶切位点为典型疏水性氨基酸,酪蛋白可能释放出部分符合DPP-IV抑制特征结构肽,使活性增加[29]。而在进一步的30~120 min胃蛋白酶消化过程中,DPP-IV抑制率无显著变化(P>0.05),表明在30 min内胃蛋白酶酶切释放特征肽基本作用完全,因此随着消化时间延长,活性无较大变化。在第二步胰酶消化阶段中,在120~150 min内酪蛋白消化产物DPP-IV抑制率显著提高(P<0.05),抑制率由23.22%骤提至50.91%。而在150~240 min内抑制率增加速率减缓,于240 min时抑制率达到最大值58.04%,约是胃蛋白酶消化产物活性的2 倍,表明胰酶消化能显著提高DPP-IV抑制活性(P<0.05),这可能与胰酶中多种消化酶的酶切位点有关,释放出更多DPP-IV抑制肽,从而活性显著提高[30],而后用MS进行分析验证。
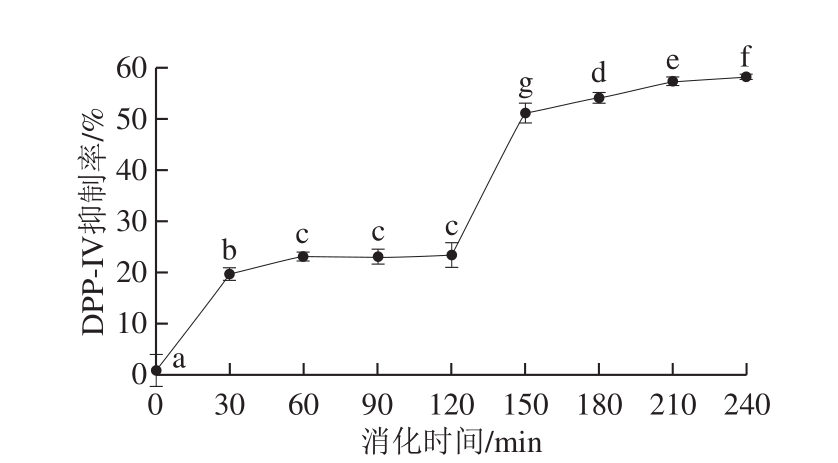
图2 酪蛋白体外消化过程不同时间点DPP-IV抑制率
Fig.2 DPP-IV inhibitory activity of casein hydrolysates during in vitro digestion
2.3 酪蛋白不同消化时间消化产物分子质量分析结果
分子质量分布能够体现蛋白水解、肽键断裂的程度,分子质量与消化产物的生物活性及消化吸收生物可利用度密切相关,小分子质量的肽段通常更易于胃肠道吸收[31]。基于凝胶色谱法结果,本实验将酪蛋白消化产物的分子质量分为4 个部分,分别是分子质量大于5、3~5、1~3 kDa和小于1 kDa。表1呈现出酪蛋白消化过程中随消化时间延长分子质量分布的变化情况。结果表明:在胃蛋白酶消化阶段即水解1、2 h内主要是大于5 kDa的组分占比最大,将近一半(分别为43.84%和41.75%),而1~3 kDa和小于1 kDa的小分子片段较少(消化2 h后分别为20.55%和24.11%),表明胃蛋白酶消化仅降解一小部分大分子蛋白及大分子肽。且这两个组分在1 h和2 h之间无显著性差异(P>0.05),变化趋势基本平稳,此时主要为胃蛋白酶的内切型酶切作用,符合Nongonierma等[32]酪蛋白消化肽释放动力学研究,胃蛋白酶酶解产物大多产生较长的肽,大分子质量产物(分子质量大于3 kDa占比57.20%)占比仍然较大。而在胰酶消化阶段即水解3、4 h内,大于3 kDa组分显著减少(P<0.05),由57.20%下降至33.16%,分子质量在1~3 kDa内达33.55%,小于1 kDa的2~10 肽占比达33.29%,说明胰酶消化酪蛋白后能产生大多为小分子的肽段,而Iwona等[33]研究表明,DPP-IV抑制肽含有2~5 个氨基酸残基通常具有较高生物活性及生物可及性,此时可以初步解释酪蛋白在胰酶消化阶段的DPP-IV抑制活性高于胃蛋白酶阶段。
表1 酪蛋白消化产物分子质量分布
Table 1 Molecular mass distribution of casein digests

注:同行不同上标大写字母表示差异显著(P<0.05),同列不同上标小写字母表示差异显著(P<0.05)。
消化时间/h酪蛋白消化产物比例/%>5 kDa 3~5 kDa 1~3 kDa <1 kDa 1 43.84±0.21Dd 13.36±0.01Ab 20.23±0.04Bb 22.57±0.17Cb 2 41.75±0.04Dc 13.59±0.01Ab 20.55±0.03Bb 24.11±0.06Cc 3 19.78±0.01Bb 13.38±0.05Ab 33.55±0.19Dd 33.29±0.13Cd 4 18.68±0.01Ba 14.33±0.06Ac 32.45±0.20Cc 34.54±0.14De
2.4 UPLC-ESI-Q-TOF-MS/MS分析特征结构肽段组成及其含量变化
图3 酪蛋白体外模拟消化产物总离子流图
Fig.3 Total ion current chromatograms of casein digests in vitro
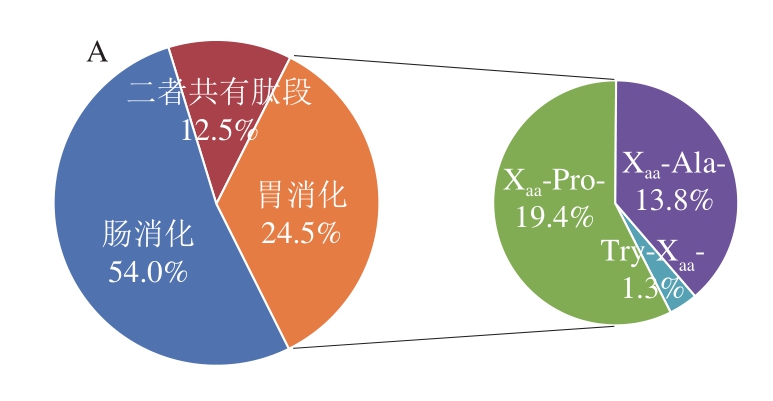
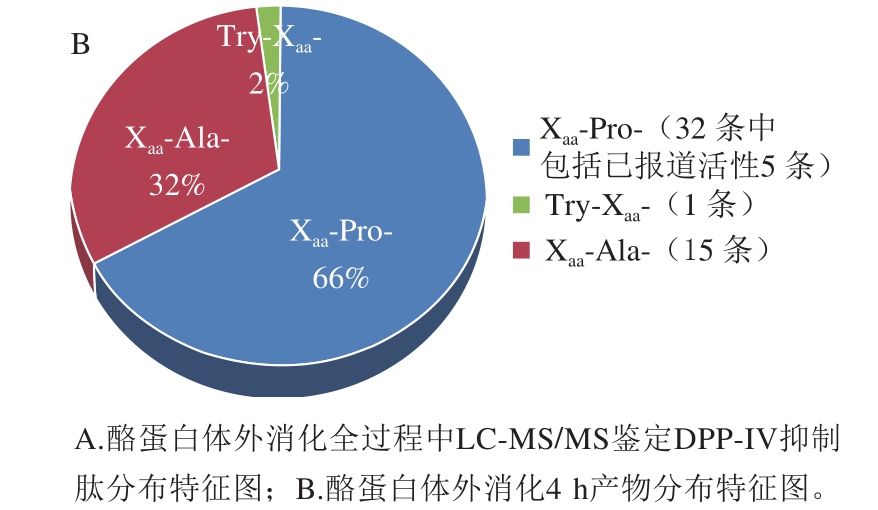
图4 酪蛋白体外消化LC-MS/MS鉴定DPP-IV抑制肽分布
Fig.4 Distribution of DPP-IV inhibitory peptides during in vitro casein digestion examined by LC-MS/MS
表2 通过电喷雾四极杆联用二级质谱鉴定酪蛋白消化产物中肽组分
Table 2 Peptide profile of casein digests identified by UPLC-ESI-Q-TOF-MS/MS
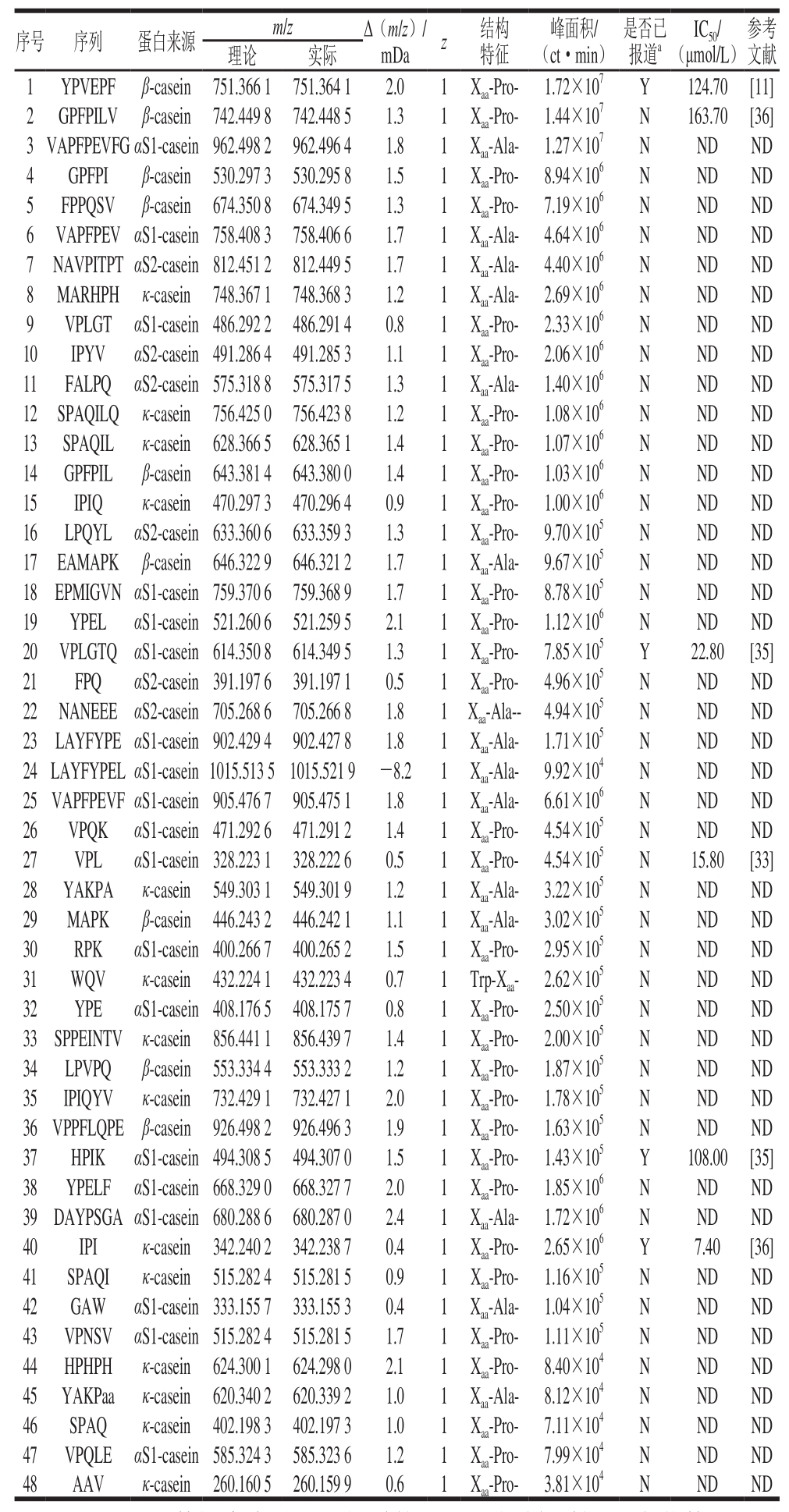
注:a.BIOPEP数据库中是否已报道的DPP-IV抑制活性;z.电荷数;Y.已报道,N.未报道;ND.无。
序号 序列 蛋白来源 m/z Δ(m/z)/mDa z 结构 参考文献理论 实际1 YPVEPF β-casein 751.366 1 751.364 1 2.0 1 Xaa-Pro- 1.72×107 Y 124.70 [11]2 GPFPILV β-casein 742.449 8 742.448 5 1.3 1 Xaa-Pro- 1.44×107 N 163.70 [36]3VAPFPEVFG αS1-casein962.498 2 962.496 4 1.8 1 Xaa-Ala- 1.27×107 N ND ND 4 GPFPI β-casein 530.297 3 530.295 8 1.5 1 Xaa-Pro- 8.94×106 N ND ND 5 FPPQSV β-casein 674.350 8 674.349 5 1.3 1 Xaa-Pro- 7.19×106 N ND ND 6 VAPFPEV αS1-casein758.408 3 758.406 6 1.7 1 Xaa-Ala- 4.64×106 N ND ND 7 NAVPITPT αS2-casein812.451 2 812.449 5 1.7 1 Xaa-Ala- 4.40×106 N ND ND 8 MARHPH κ-casein 748.367 1 748.368 3 1.2 1 Xaa-Ala- 2.69×106 N ND ND 9 VPLGT αS1-casein486.292 2 486.291 4 0.8 1 Xaa-Pro- 2.33×106 N ND ND 10 IPYV αS2-casein491.286 4 491.285 3 1.1 1 Xaa-Pro- 2.06×106 N ND ND 11 FALPQ αS2-casein575.318 8 575.317 5 1.3 1 Xaa-Ala- 1.40×106 N ND ND 12 SPAQILQ κ-casein 756.425 0 756.423 8 1.2 1 Xaa-Pro- 1.08×106 N ND ND 13 SPAQIL κ-casein 628.366 5 628.365 1 1.4 1 Xaa-Pro- 1.07×106 N ND ND 14 GPFPIL β-casein 643.381 4 643.380 0 1.4 1 Xaa-Pro- 1.03×106 N ND ND 15 IPIQ κ-casein 470.297 3 470.296 4 0.9 1 Xaa-Pro- 1.00×106 N ND ND 16 LPQYL αS2-casein633.360 6 633.359 3 1.3 1 Xaa-Pro- 9.70×105 N ND ND 17 EAMAPK β-casein 646.322 9 646.321 2 1.7 1 Xaa-Ala- 9.67×105 N ND ND 18 EPMIGVN αS1-casein759.370 6 759.368 9 1.7 1 Xaa-Pro- 8.78×105 N ND ND 19 YPEL αS1-casein521.260 6 521.259 5 2.1 1 Xaa-Pro- 1.12×106 N ND ND 20 VPLGTQ αS1-casein614.350 8 614.349 5 1.3 1 Xaa-Pro- 7.85×105 Y 22.80 [35]21 FPQ αS2-casein391.197 6 391.197 1 0.5 1 Xaa-Pro- 4.96×105 N ND ND 22 NANEEE αS2-casein705.268 6 705.266 8 1.8 1 Xaa-Ala-- 4.94×105 N ND ND 23 LAYFYPE αS1-casein902.429 4 902.427 8 1.8 1 Xaa-Ala- 1.71×105 N ND ND 24LAYFYPEL αS1-casein1015.513 51015.521 9 -8.2 1 Xaa-Ala- 9.92×104 N ND ND 25VAPFPEVF αS1-casein905.476 7 905.475 1 1.8 1 Xaa-Ala- 6.61×106 N ND ND 26 VPQK αS1-casein471.292 6 471.291 2 1.4 1 Xaa-Pro- 4.54×105 N ND ND 27 VPL αS1-casein328.223 1 328.222 6 0.5 1 Xaa-Pro- 4.54×105 N 15.80 [33]28 YAKPA κ-casein 549.303 1 549.301 9 1.2 1 Xaa-Ala- 3.22×105 N ND ND 29 MAPK β-casein 446.243 2 446.242 1 1.1 1 Xaa-Ala- 3.02×105 N ND ND 30 RPK αS1-casein400.266 7 400.265 2 1.5 1 Xaa-Pro- 2.95×105 N ND ND 31 WQV κ-casein 432.224 1 432.223 4 0.7 1 Trp-Xaa- 2.62×105 N ND ND 32 YPE αS1-casein408.176 5 408.175 7 0.8 1 Xaa-Pro- 2.50×105 N ND ND 33 SPPEINTV κ-casein 856.441 1 856.439 7 1.4 1 Xaa-Pro- 2.00×105 N ND ND 34 LPVPQ β-casein 553.334 4 553.333 2 1.2 1 Xaa-Pro- 1.87×105 N ND ND 35 IPIQYV κ-casein 732.429 1 732.427 1 2.0 1 Xaa-Pro- 1.78×105 N ND ND 36VPPFLQPE β-casein 926.498 2 926.496 3 1.9 1 Xaa-Pro- 1.63×105 N ND ND 37 HPIK αS1-casein494.308 5 494.307 0 1.5 1 Xaa-Pro- 1.43×105 Y 108.00 [35]38 YPELF αS1-casein668.329 0 668.327 7 2.0 1 Xaa-Pro- 1.85×106 N ND ND 39 DAYPSGA αS1-casein680.288 6 680.287 0 2.4 1 Xaa-Ala- 1.72×106 N ND ND 40 IPI κ-casein 342.240 2 342.238 7 0.4 1 Xaa-Pro- 2.65×106 Y 7.40 [36]41 SPAQI κ-casein 515.282 4 515.281 5 0.9 1 Xaa-Pro- 1.16×105 N ND ND 42 GAW αS1-casein333.155 7 333.155 3 0.4 1 Xaa-Ala- 1.04×105 N ND ND 43 VPNSV αS1-casein515.282 4 515.281 5 1.7 1 Xaa-Pro- 1.11×105 N ND ND 44 HPHPH κ-casein 624.300 1 624.298 0 2.1 1 Xaa-Pro- 8.40×104 N ND ND 45 YAKPaa κ-casein 620.340 2 620.339 2 1.0 1 Xaa-Ala- 8.12×104 N ND ND 46 SPAQ κ-casein 402.198 3 402.197 3 1.0 1 Xaa-Pro- 7.11×104 N ND ND 47 VPQLE αS1-casein585.324 3 585.323 6 1.2 1 Xaa-Pro- 7.99×104 N ND ND 48 AAV κ-casein 260.160 5 260.159 9 0.6 1 Xaa-Pro- 3.81×104 N ND ND特征峰面积/(ct·min)是否已报道a IC50/(μmol/L)
为了进一步阐述酪蛋白在消化过程中DPP-IV抑制活性变化的内在机制,采用UPLC-ESI-Q-TOF-MS/MS对酪蛋白消化后释放的肽段进行序列解析,并分析具有DPP-IV抑制肽典型结构特征的肽段变化规律,主要包括Xaa-Pro-、Xaa-Ala-及Trp-Xaa-等结构特征。本实验仅对鉴定结果中48 条满足具有3~10 个氨基酸残基的寡肽序列进行分析,除去25 条二肽(已很多研究)及8 条10 肽以上序列(潜力低),结果如图3及图4A所示。酪蛋白在胃蛋白酶消化阶段共释放出25 条具有DPP-IV抑制肽典型结构特征的肽段,胰酶消化阶段释放48 条特征肽段,数量上将近达到胃消化的2 倍,与其消化产物DPP-IV抑制活性变化规律一致,进一步说明其DPP-IV抑制活性可能与其特征肽的释放有关。LC-MS/MS鉴定消化4 h产物分类结果如图4B所示,对DPP-IV抑制肽典型结构特征分类分析,Xaa-Pro-占66%、Xaa-Ala-占32%、Trp-Xaa-仅占2%,即推测酪蛋白消化产物中DPP-IV抑制肽主要是结构特征为Xaa-Pro-的序列。Nongonierma等[11]研究乳分离蛋白消化产物中DPP-IV抑制肽的定量构效关系,而探索结果表明乳分离蛋白消化产物中DPP-IV抑制肽大多也为Xaa-Pro-样肽。表2呈现了这48 条具有DPP-IV抑制肽典型结构特征的序列及其相关蛋白来源信息。这些肽来源于αS1-酪蛋白、αS2-酪蛋白、β-酪蛋白及κ-酪蛋白4 种亚基,其中包括19 条目标肽来源于αS1-酪蛋白,14 条目标肽来自κ-酪蛋白,基本各占总数的1/3左右,表明这两种亚基序列可以释放更多符合DPP-IV抑制肽典型特征结构。Iwona等[33]利用计算机分析预测得出κ-酪蛋白是良好的DPP-IV抑制肽食物来源,其中目前效力最高的IPI亦来自于κ-酪蛋白,进一步验证本实验结果,但αS1-酪蛋白作为DPP-IV抑制肽的潜在来源还未受到相关具体研究。对这些鉴定得出的肽采用BIOPEP[34](http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)检索已报道DPP-IV抑制肽对比发现,有6 条已被报道,分别是IPI(半抑制浓度(half maximal inhibitory concentration,IC50)为7.40 μmol/L)、YPVEPF(IC50为124.70 μmol/L)、GPFPILV(IC50为163.70 μmol/L)、VPLGTQ(IC50为22.80 μmol/L)、VPL(IC50为15.80 μmol/L)、HPIK(IC50为108.00 μmol/L),主要来源于αS1-酪蛋白、β-酪蛋白及κ-酪蛋白,表明酪蛋白经体外消化可产生很多较强DPP-IV抑制活性潜力肽段。此外,消化产物中还含有很多文献中尚未报道,但含量较高且具有DPP-IV抑制活性潜力肽段,如VAPFPEVFG、GPFPI、YPELF、SPAQI、NAVPITPT,有待进一步合成验证活性强弱,为开发新的有效降糖物质提供参考。结合图5热图分析消化过程中特征肽含量(由色谱峰面积表示)变化规律发现,胃蛋白酶消化肽段特征大多为含有3~9 个氨基酸残基的较长肽,且1~2 h期间,5 肽以下短肽释放含量逐渐增加,胃蛋白酶进一步酶切过程导致,但体外抑制活性变化不大,推断这些增加的短肽可能并非完全为竞争性抑制作用[35]。而反观胰酶消化阶段,特征肽结构特征基本为2~7 肽较短肽,且胰酶与胃蛋白酶阶段相比较,能释放更多特征肽,且包含6 条已报道具有高活性的抑制肽。因此无论从前期直观的特征肽数量上还是各潜在高活性特征肽含量上胰酶消化产物与胃蛋白酶消化产物相较呈增加趋势,能很好地解释前期体外活性评价结果。

图5 酪蛋白体外模拟消化不同时间DPP-IV抑制样肽分布热力图
Fig.5 Heat map of DPP-IV inhibition-like peptide distribution of casein hydrolysates during in vitro simulated gastrointestinal digestion
3 结 论
本实验利用体外模拟胃蛋白酶-胰酶消化模型水解酪蛋白,研究其消化过程DPP-IV抑制活性变化规律及其机制。酪蛋白经两步消化水解产物具有较强DPP-IV抑制活性,并具有一定的规律,胰酶消化后较胃蛋白酶消化产物抑制活性高2 倍左右,并发现两阶段均产生大量潜在的DPP-IV抑制肽,且其数目和含量有所不同。本实验发现酪蛋白消化过程中能释放许多DPP-IV抑制肽,其中抑制活性变化推测可能主要由释放肽中的3~10 肽典型Xaa-Pro-序列相关。但酪蛋白消化产物在生物体内DPP-IV抑制活性发挥作用机制的量效关系仍有待研究,以及鉴定的48 条(除6 条已报道)3~10 肽的典型特征肽,可以为今后开发DPP-IV抑制肽及辅助降糖产品提供理论依据。
[1]International Diabetes Federation.IDF diabetes atlas 8th edition[R/OL].Brussels: IDF, 2017.http://www.diabetesatlas.org.
[2]GOOBEN K, GRABER S.Longer term safety of dipeptidyl peptidase-4 inhibitors in patients with type 2 diabetes mellitus:systematic review and meta-analysis[J].Diabetes, Obesity and Metabolism, 2012, 14(12): 1061-1072.DOI:10.1111/j.1463-1326.2012.01610.x.
[3]ZIMMET P, ALBERTI K G, MAGLIANO D J, et al.Diabetes mellitus statistics on prevalence and mortality: facts and fallacies[J].Nature Reviews Endocrinology, 2016, 12(10): 616-622.DOI:10.1038/nrendo.2016.105.
[4]DRUMMOND E, FLYNN S, WHELAN H, et al.Casein hydrolysate with glycemic control properties: evidence from cells, animal models,and humans[J].Journal of Agricultural and Food Chemistry, 2018,66(17): 4352-4363.DOI:10.1021/acs.jafc.7b05550.
[5]NONGONIERMA A B, HENNEMMANN M, PAOLELLA S, et al.Generation of wheat gluten hydrolysates with dipeptidyl peptidase IV (DPP-IV) inhibitory properties[J].Food and Function, 2017, 8(6):2249-2257.DOI:10.1039/C7FO00165G.
[6]SONG J J, WANG Q, DU M, et al.Identification of dipeptidyl peptidase-IV inhibitory peptides from mare whey protein hydrolysates[J].Journal of Dairy Science, 2017, 100(9): 6885-6894.DOI:10.3168/jds.2016-11828.
[7]HSIEH C, WANG T, HUNG C, et al.In silico, in vitro and in vivo analyses of dipeptidyl peptidase IV inhibitory activity and the antidiabetic effect of sodium caseinate hydrolysate[J].Food and Function, 2016, 7(2): 1122-1128.DOI:10.1039/c5fo01324k.
[8]NONGONIERMA A B, FITZGERALD R J.Investigation of the potential of hemp, pea, rice and soy protein hydrolysates as a source of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides[J].Food Digestion: Research and Current Opinion, 2015, 6(1/2/3): 19-29.DOI:10.1007/s13228-015-0039-2.
[9]HATANAKA T, KAWAKAMI K, URAJI M.Inhibitory effect of collagen-derived tripeptides on dipeptidyl peptidase-IV activity[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2014, 29(6):823-828.DOI:10.3109/14756366.2013.858143.
[10]LIR R, CHENG J, WU H.Discovery of food-derived dipeptidyl peptidase IV inhibitory peptides: a review[J].International Journal of Molecular Sciences, 2019, 20(3): 463.DOI:10.3390/ijms20030463.
[11]NONGONIERMA A B, FITZGERALD R J.Structure activity relationship modelling of milk protein-derived peptides with dipeptidyl peptidase IV (DPP-IV) inhibitory activity[J].Peptides, 2016, 79: 1-7.DOI:10.1016/j.peptides.2016.03.005.
[12]NONGONIERMA A B, RICHARD J.Learnings from quantitative structure-activity relationship (QSAR) studies with respect to food protein-derived bioactive peptides: a review[J].RSC Advances, 2016,6(79): 75400-75413.DOI:10.1039/c6ra12738j.
[13]NONGONIERMA A B, RICHARD J.Inhibition of dipeptidyl peptidase IV (DPP-IV) by proline containing casein-derived peptides[J].Journal of Functional Foods, 2013, 5(4): 1909-1917.DOI:10.1016/j.jff.2013.09.012.
[14]NONGONIERMA A B, RICHARD J.Inhibition of dipeptidyl peptidase IV (DPP-IV) by tryptophan containing dipeptides[J].Food and Function, 2013, 4(12): 1843-1849.DOI:10.1039/c3fo60262a.
[15]TESCHEMACHER H, KOCH G, BRANTL V.Milk protein-derived opioid receptor ligands[J].Biopolymers, 1997, 43(2): 99-117.DOI:10.1002/(SICI)1097-0282(1997)43:2<99::AIDBIP3>3.0.CO;2-V.
[16]MEISEL H.Biochemical Properties of peptides encrypted in bovine milk proteins[J].Current Medicinal Chemistry, 2005, 12(16): 1905-1919.DOI:10.2174/0929867054546618.
[17]YAYEH T, LEEM Y, KIM K, et al.Administration of alphas1-casein hydrolysate increases sleep and modulates GABAA receptor subunit expression[J].Biomolecules and Therapeutics, 2018, 26(3): 268-273.DOI:10.4062/biomolther.2017.083.
[18]TAGLIAZUCCHI D, SHAMSIA S, HELAL A, et al.Angiotensin-converting enzyme inhibitory peptides from goats' milk released by in vitro gastro-intestinal digestion[J].International Dairy Journal, 2017, 71:6-16.DOI:10.1016/j.idairyj.2017.03.001.
[19]HIDAYAT K, DU X, SHI B M.Milk in the prevention and management of type 2 diabetes mellitus: the potential role of milk proteins[J].Diabetes/Metabolism Research and Reviews, 2019, 35(8):e3187.DOI:10.1002/dmrr.3187.
[20]张颖.牛、羊乳酪蛋白源DPP-IV抑制肽的制备、鉴定及抑制机理研究[D].北京: 中国农业大学, 2016.
[21]ZHANG Ying, CHEN Ran, ZUO Fanglei, et al.Comparison of dipeptidyl peptidase IV-inhibitory activity of peptides from bovine and caprine milk casein by in silico and in vitro analyses[J].International Dairy Journal, 2016, 53: 37-44.DOI:10.1016/j.idairyj.2015.10.001.
[22]TAGLIAZUCCHI D, MARTINIS, SHAMSIA S, et al.Biological activities and peptidomic profile of in vitro-digested cow, camel,goat and sheep milk[J].International Dairy Journal, 2018, 81: 19-27.DOI:10.1016/j.idairyj.2018.01.014.
[23]YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al.Changes in the antioxidant activity of loach (Misgurnus anguillicaudatus)protein hydrolysates during a simulated gastrointestinal digestion[J].Food Chemistry, 2010, 120(3): 810-816.DOI:10.1016/j.foodchem.2009.11.018.
[24]NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science, 2001, 66(5): 642-646.DOI:10.1111/j.1365-2621.2001.tb04614.x.
[25]SILVEIRA S T, MARTINEZ-MAQUEDA D, RECIO I, et al.Dipeptidyl peptidase-IV inhibitory peptides generated by tryptic hydrolysis of a whey protein concentrate rich in β-lactoglobulin[J].Food Chemistry, 2013, 141(2): 1072-1077.DOI:10.1016/j.foodchem.2013.03.056.
[26]ZHENG Lin, REN Jiaoyan, SU Guowan, et al.Comparison of in vitro digestion characteristics and antioxidant activity of hot- and cold-pressed peanut meals[J].Food Chemistry, 2013, 141(4):4246-4252.DOI:10.1016/j.foodchem.2013.06.081.
[27]GOODMAN B E.Insights into digestion and absorption of major nutrients in humans[J].Advances in Physiology Education, 2010,34(2): 44-53.DOI:10.1152/advan.00094.2009.
[28]PRATLEY R E, SALSALI A.Inhibition of DPP-4: a new therapeutic approach for the treatment of type 2 diabetes[J].Current Medical Research and Opinion, 2007, 23(4): 919-931.DOI:10.1185/030079906X162746.
[29]LACROIX I M E, LI-CHAN E C Y.Isolation and characterization of peptides with dipeptidyl peptidase-IV inhibitory activity from pepsin-treated bovine whey proteins[J].Peptides, 2014, 54: 39-48.DOI:10.1016/j.peptides.2014.01.002.
[30]MAUX S L, NONGONIERMA A B, MURRAY B, et al.Identification of short peptide sequences in the nanofiltration permeate of a bioactive whey protein hydrolysate[J].Food Research International, 2015, 77:534-539.DOI:10.1016/j.foodres.2015.09.012.
[31]AGUDELO R A, GAUTHIER S F, POULIOT Y, et al.Kinetics of peptide fraction release during in vitro digestion of casein[J].Journal of the Science of Food and Agriculture, 2004, 84(4): 325-332.DOI:10.1002/jsfa.1662.
[32]NONGONIERMA A B, RICHARD J.An in silico model to predict the potential of dietary proteins as sources of dipeptidyl peptidase IV(DPP-IV) inhibitory peptides[J].Food Chemistry, 2014, 165: 489-498.DOI:10.1016/j.foodchem.2014.05.090.
[33]IWONA S, DOROTA N.The use of UniProtKB/BIOPEP for the analysis of oat globulin physicochemical parameters and bioactivity[J].Czech Journal of Food Sciences, 2018, 36(2): 119-125.DOI:10.17221/455/2016-CJFS.
[34]MINKIEWICZ P, IWANIAK A, DAREWICZ M, et al.BIOPEP-UWM database of bioactive peptides: current opportunities[J].International Journal of Molecular Sciences, 2019, 20(23): 5978.DOI:10.3390/ijms20235978.
[35]ZHANG Y, CHEN R, CHEN X, et al.Dipeptidyl peptidase-IV inhibitory peptides derived from silver carp (Hypophthalmichthys molitrix Val.) proteins[J].Journal of Agricultural and Food Chemistry,2016, 64(4): 831-839.DOI:10.1016/j.idairyj.2015.10.001.
[36]MARUYAMA S, OHMORI T, NAKAGAMI T.Prolylendopeptidase inhibitory activity of a glial fibrillary acidic protein fragment and other proline-rich peptides[J].Bioscience, Biotechnology, and Biochemistry,1996, 60(2): 358-359.DOI:10.1271/bbb.60.358.