维持氧化还原稳态是机体正常运行的必要条件,这个过程受体内还原性分子、抗氧化酶、二相解毒酶和其他分子的严格调控。随着年龄、遗传和环境风险因素的变化,体内氧化还原系统会失衡,活性氧自由基(reactive oxygen species,ROS)的大量产生超过了机体本身的清除能力,导致氧化损伤的产生,并最终影响细胞中蛋白质表达和DNA/RNA的翻译后修饰,造成细胞损伤或凋亡[1]。越来越多的研究表明,许多疾病都与氧化应激损伤相关,如糖尿病、心血管疾病、阻塞性肺病、白内障、关节炎、神经退行性疾病和癌症等[2-9]。因此,研究天然产物活性成分的抗氧化作用,对于预防和治疗多种疾病具有重要意义。
姜黄素是从姜黄中提取的一种多酚类化合物,具有多种生物活性。研究表明,姜黄素通过调节炎症相关转录因子和细胞因子可以起到免疫调节和抗炎作用[10-12]。此外,它还具有抗肿瘤、抗氧化作用,是一种较强的体内和体外抗氧化剂[13-14]。然而,姜黄素在氧、光照以及中性和碱性环境下是不稳定的,易被降解为阿魏酸和阿魏酰甲烷[15-16]。此外,与其他多酚类物质类似,姜黄素在体内需经过一系列的生物转化过程才能被人体吸收[17]。研究发现,在小鼠体内注射的姜黄素大部分是由内源性还原酶系统逐步还原成二氢姜黄素、四氢姜黄素和六氢姜黄素,然后再利用尿苷-5'-二磷酸葡萄糖醛酸转移酶进行葡糖醛酸化[18]。有研究证明,四氢姜黄素可减轻高脂高果糖饮食小鼠通过I相代谢酶诱导的氧化应激[19]。它还能够通过下调核因子κB(nuclear factor kappa-B,NF-κB)来降低脂多糖诱导的诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)在巨噬细胞中的表达,但抑制活性弱于姜黄素[20],这可能与它们在细胞中的吸收和代谢不同有关[21]。但四氢姜黄素比姜黄素表现出更强的体外抗氧化活性[22]。Somparn等[23]研究证明,四氢姜黄素比姜黄素具有更强的清除2,2-二(4-叔辛基苯基)-1-苦肼基自由基的能力和抑制脂质过氧化活性,并且其也可以显著抑制2,2'-偶氮二异丁基脒二盐酸盐引起的红细胞溶血。Pal等[24]合成了两种姜黄素葡糖糖醛酸化合物,并评估了其对4 种人类癌细胞株(KBM-5、Jurkat、U266和A549)的增殖抑制活性,发现姜黄素能通过抑制NF-κB的活化表现出较强的抗增殖作用,而姜黄素葡萄糖醛酸化合物则没有上述活性。这些研究结果表明姜黄素代谢产物可能表现出与母体化合物不同的生物活性。而且,不同的抗氧化评价体系(体外化学评价方法和体内抗氧化评价方法)对抗氧化活性结果也有影响。然而,目前关于葡萄糖醛酸修饰对姜黄素抗氧化活性的影响还鲜见报道。因此,为了揭示膳食多酚对多种疾病的预防和治疗作用机制,研究其代谢产物的生物活性具有重要意义。
本实验通过测定细胞存活率、ROS含量和丙二醛(malondialdehyde,MDA)含量,以及超氧化物歧化酶(superoxide dismutase,SOD)活力和细胞内抗氧化相关蛋白的表达水平等指标,比较了姜黄素及其两种主要代谢修饰产物(四氢姜黄素和姜黄素-β-D-葡糖苷酸)对H2O2诱导的大鼠肾上腺嗜铬瘤PC12细胞氧化损伤的保护作用,以期为揭示姜黄素的健康功效机制提供依据。
1 材料与方法
1.1 材料与试剂
姜黄素(纯度≥98%)、四氢姜黄素(纯度≥98%)上海源叶生物科技有限公司;姜黄素-β-D-葡萄糖醛酸盐(纯度≥95%) 加拿大TRC公司。
PC12细胞 上海盖宁生物科技有限公司;RPMI 1640培养基、25%(质量分数,下同)胰蛋白酶乙二胺四乙酸消化液 美国Gibco公司;青霉素-链霉素、二甲基亚砜、30% H2O2溶液 北京索莱宝试剂有限公司;胎牛血清 以色列Bioind公司;噻唑蓝(thiazolyl blue tetrazolium bromide,MTT) 美国Sigma公司;SOD、MDA测定试剂盒、BCA蛋白浓度测定试剂盒、RIPA细胞裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)蛋白酶抑制剂、细胞核细胞浆蛋白提取试剂盒、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)印迹膜 上海碧云天生物科技有限公司;血红素氧合酶-1(hemeoxygenase-1,HO-1)、腺嘌呤二核苷酸醌氧化还原酶(NADPH quinineoxidoreductase-1,NQO-1)、Nrf2单克隆抗体 美国Abcam公司。
1.2 仪器与设备
FA2104A分析天平 上海精天电子仪器有限公司;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;HF90 CO2培养箱 上海力申科学仪器有限公司;ChemiDoc MP凝胶成像系统、Mini-PROTEN Tetra垂直电泳仪 美国Bio-Rad公司;5810R高速冷冻离心机Eppendorf(中国)有限公司;MK3酶标仪 Thermo(上海)仪器有限公司。
1.3 方法
1.3.1 细胞培养
将PC12细胞培养于含体积分数10%的胎牛血清、体积分数1%的青霉素-链霉素混合液的RPMI 1640培养基中,置于37 ℃、体积分数为5%CO2的细胞培养箱中培养,每2~3 d传代一次。取对数生长期的细胞(细胞贴壁80%)用于后续实验,96 孔板种板密度为2.0×105 个/mL,6 孔板种板密度为1×106 个/mL。
1.3.2 细胞存活率的测定
将PC12细胞接种于96 孔板,培养24 h后倒掉培养基,加入含有药物的培养基培养48 h后,倒掉培养基,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)冲洗2~3 遍,每孔加入0.5 mg/mL的MTT溶液100 μL,37 ℃培养箱中孵育4 h后倒掉MTT,每孔加入100 μL二甲基亚砜溶液,振荡10 min,然后于570 nm波长处测定吸光度。在H2O2损伤组中,药物处理后,加入含有H2O2的培养基处理1 h,再加入MTT溶液进行后续实验。细胞存活率按下式计算。
式中:A0为空白对照孔的吸光度;A1为药物处理孔的吸光度;A2为未加药物处理孔的吸光度。
1.3.3 ROS水平的测定
将PC12细胞接种于96 孔板,于37 ℃、体积分数为5% CO2培养箱中培养24 h,倒掉培养基,PBS冲洗2~3 遍,经含有药物的无血清培养基处理48 h后,加入含25 μmol/L 2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)的基本培养基200 μL,于培养箱避光孵育30 min[25]。在氧化损伤模型中,药物处理48 h后,倒掉培养基,用0.5 mmol/L的H2O2溶液处理1 h,再装载探针,后面步骤同上。用多功能酶标仪检测荧光信号强度(吸收波长488 nm、激发波长525 nm)。
1.3.4 MDA含量的测定
将PC12细胞接种到6 孔板中,分为对照组、H2O2损伤组和不同浓度药物处理组,培养48 h后,H2O2处理1 h。吸出培养基,PBS冲洗2~3 遍,加入150 μL含1 mmol/L PMSF的RIPA细胞裂解液,用细胞刮收集细胞后冰浴20 min,于4 ℃、14 000×g离心10 min,取上清液即为提取的细胞总蛋白。按照试剂盒的步骤测定细胞总蛋白中MDA含量[25]。用BCA蛋白浓度测定试剂盒测定样品蛋白浓度。
1.3.5 SOD活力的测定
按照1.3.4节中的方法处理PC12细胞并提取细胞总蛋白,用BCA蛋白浓度测定试剂盒测定样品蛋白浓度,按照SOD活力测定试剂盒步骤测定细胞总蛋白中SOD活力[25]。
1.3.6 Western Blot检测氧化应激相关蛋白的表达
采用Western Blot实验测定细胞内Nrf2及其下游抗氧化酶HO-1和NQO-1蛋白的表达量。按照1.3.4节中的方法提取细胞总蛋白,按照细胞浆和细胞核蛋白提取试剂盒说明书上的步骤提取细胞浆和细胞核蛋白。用BCA蛋白浓度测定试剂盒测定样品浓度,并以V(蛋白样品)∶V(上样缓冲液)=1∶4的比例计算上样量。将样品混匀后于65 ℃变性10 min,随后上样。在电压90 V条件下电泳30 min,然后调节电压至110 V电泳约1.5 h。90 V条件下转膜2 h。将膜在溶于含吐温20的Tris缓冲液(Tris buffered saline with Tween 20,TBST)的脱脂奶粉中封闭2 h。TBST清洗5 次,每次5 min,加入稀释好的一抗,4 ℃孵育过夜。取出PVDF膜,TBST清洗5 次,每次5 min,加入稀释好的二抗,室温孵育2 h。将配好的化学发光液滴于膜上,通过凝胶成像仪成像,并通过Image Lab软件定量分析[26]。
1.4 数据处理与分析
应用SPSS 18.0软件进行实验数据分析,以3 次独立实验结果的平均值±标准差表示,并采用独立样本t检验、单因素方差分析,P<0.05表示存在显著性差异。
2 结果与分析
2.1 姜黄素及其代谢产物对H2O2损伤的PC12细胞存活率的影响
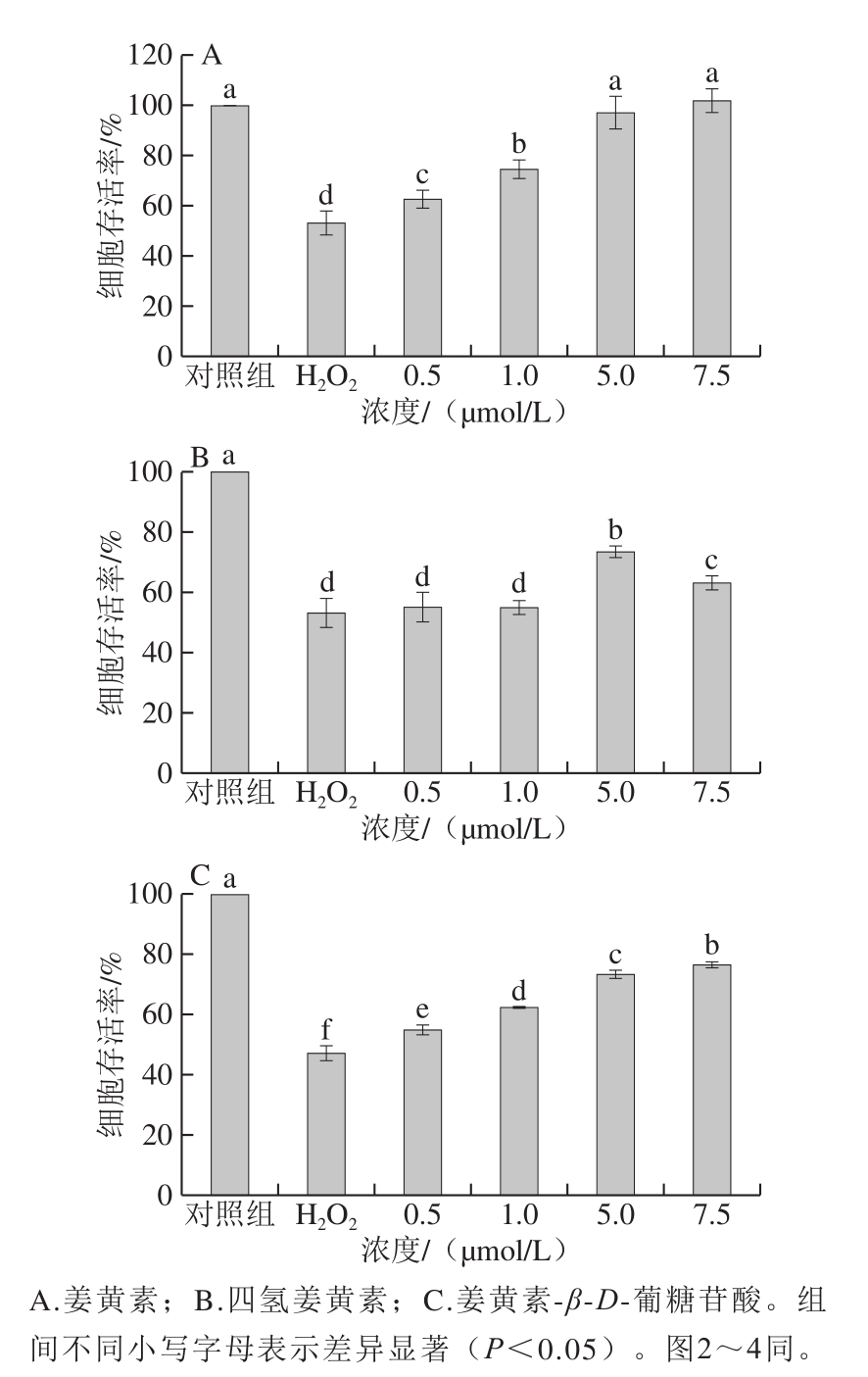
图1 姜黄素及其代谢产物对H2O2损伤的PC12细胞存活率的影响
Fig.1 Effects of curcumin and its metabolites on cell viability in H2O2-treated PC12 cells
如图1所示,与对照组相比,0.5 mmol/L的H2O2处理导致细胞的存活率显著下降了约40%(P<0.05)。姜黄素、四氢姜黄素及姜黄素-β-D-葡糖苷酸处理对H2O2损伤的PC12细胞均有一定的保护作用。其中,与H2O2损伤组相比,姜黄素处理组和姜黄素-β-D-葡糖苷酸处理组对细胞的保护作用均呈现出明显的剂量依赖性,随着药物处理剂量的增加,细胞存活率显著增加(P<0.05)。在最高处理浓度为7.5 μmol/L,姜黄素处理组的细胞存活率最高(101.88%),其次为姜黄素-β-D-葡糖苷酸处理组(76.66%)。四氢姜黄素处理组仅在高浓度(5 μmol/L和7.5 μmol/L)时表现出一定的细胞保护作用,但细胞存活率均低于相同浓度条件下的姜黄素处理组和姜黄素-β-D-葡糖苷酸处理组。在用7.5 μmol/L四氢姜黄素处理时,细胞存活率低于5 μmol/L处理组,这可能是由于过氧化氢损伤导致细胞抵抗能力减弱,较高浓度的四氢姜黄素(7.5 μmol/L)处理对细胞产生了一定的毒性作用。Yang Bobo等[25]也发现了类似的研究结果。
2.2 姜黄素及其代谢产物对H2O2损伤的PC12细胞ROS产生的影响
ROS是细胞氧化损伤的一个重要标志,采用DCFH-DA荧光探针法检测了姜黄素及其代谢产物对细胞内ROS水平的影响。如图2所示,在对照组细胞中,ROS产生较少;经H2O2损伤刺激后,细胞内ROS的水平显著增加(P<0.05),约为对照组的141%。与H2O2损伤组相比,姜黄素及其代谢产物处理均能显著降低H2O2导致的细胞ROS的升高(P<0.05),其中姜黄素和姜黄素-β-D-葡糖苷酸处理组均呈现出较好的剂量依赖性。在浓度为7.5 μmol/L时,细胞中的ROS含量分别为对照组的60.90%、85.23%。四氢姜黄素处理的细胞在处理浓度为5 μmol/L时ROS含量最低,为对照组的76.53%。以上实验结果表明,姜黄素及其代谢产物能够显著降低PC12细胞ROS的产生(P<0.05),从而保护细胞免受氧化损伤,其中姜黄素的保护效果要优于姜黄素-β-D-葡糖苷酸和四氢姜黄素。


图2 姜黄素及其代谢产物对H2O2损伤的PC12细胞ROS产生的影响
Fig.2 Effects of curcumin and its metabolites on ROS generation in H2O2-treated PC12 cells
2.3 姜黄素及其代谢产物对H2O2损伤的PC12细胞MDA含量的影响
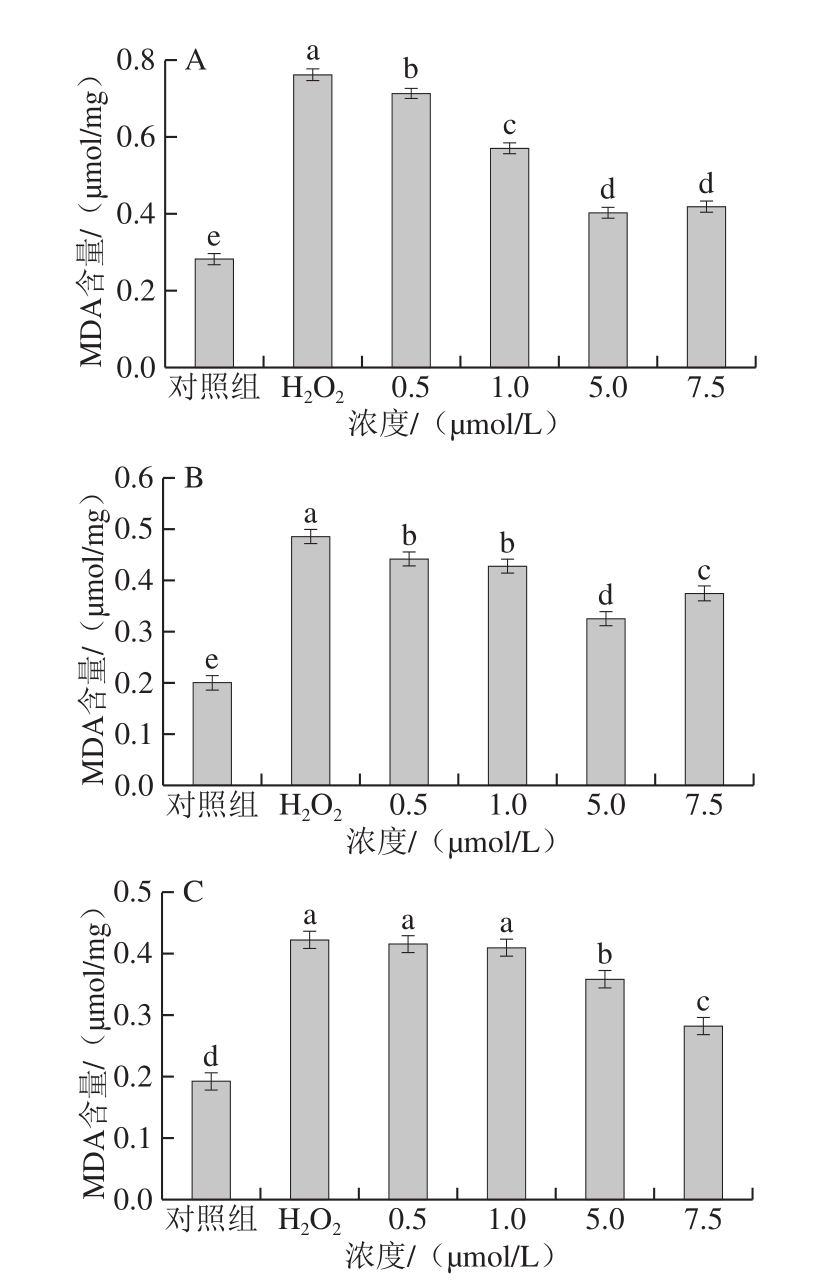
图3 姜黄素及其代谢产物对H2O2损伤的PC12细胞MDA含量的影响
Fig.3 Effects of curcumin and its metabolites on MDA level in H2O2-treated PC12 cells
MDA是评估氧化应激的另一种标志物。在氧化应激状态下,机体中ROS的过量积累会导致细胞膜脂质过氧化,从而造成脂质过氧化产物MDA的积累,并最终引起细胞损伤甚至凋亡[27]。姜黄素及其代谢产物对H2O2损伤的PC12细胞MDA含量的影响结果见图3。正常PC12细胞中,MDA的含量较低,约为0.20 μmol/mg。过氧化氢损伤显著增加了PC12细胞中MDA含量(P<0.05),经姜黄素及其代谢产物处理后,PC12细胞中MDA的含量均呈现不同程度的减少(P<0.05)。在药物处理浓度为7.5 μmol/L时,姜黄素、四氢姜黄素及姜黄素-β-D-葡糖苷酸处理组的MDA含量较H2O2损伤组分别降低了45.12%、33.05%和33.13%。
2.4 姜黄素及其代谢产物对H2O2损伤的PC12细胞SOD活力的影响
细胞内抗氧化酶的存在可以有效地抑制氧化并减少脂质过氧化物的产生,它们在维持氧化和抗氧化防御系统之间的平衡中起关键作用。SOD是维持生物体中活性氧水平所必需的酶,是指示活性氧产生的生物标志物[28],SOD的失活将使机体产生过量的活性氧,进而引起氧化应激[29]。

图4 姜黄素及其代谢产物对H2O2损伤的PC12细胞SOD活力的影响
Fig.4 Effects of curcumin and its metabolites on SOD activity in H2O2-treated PC12 cells
从图4可知,与对照组相比,加入H2O2诱发氧化应激状态后,总SOD活力显著降低了45.57%(P<0.05)。加入不同浓度的姜黄素及其代谢产物处理后,细胞中SOD的活力均得到不同程度的提高。其中,姜黄素处理组呈现出较好的剂量依赖性,浓度为7.5 μmol/L时SOD活力提高至对照组的91.60%。与H2O2损伤组相比,四氢姜黄素和姜黄素-β-D-葡糖苷酸处理组在低浓度时对SOD活力无显著影响(P>0.05),在高浓度(5 μmol/L和7.5 μmol/L)时具有显著影响(P<0.05)。浓度为7.5 μmol/L时,四氢姜黄素和姜黄素-β-D-葡糖苷酸处理组细胞SOD的活力分别提升至对照组的59.21%和77.71%。
2.5 姜黄素及其代谢产物对H2O2损伤的PC12细胞氧化应激相关蛋白表达的影响
2.5.1 对HO-1蛋白表达的影响
HO-1是血红素降解过程中的限速酶,它将血红素转化为胆绿素,促进一氧化碳和铁的释放,在细胞保护中起着至关重要的作用,发挥抗氧化、抗炎和抗凋亡等生物学功能。姜黄素及其代谢产物对氧化损伤的PC12细胞HO-1蛋白表达的影响如图5所示。
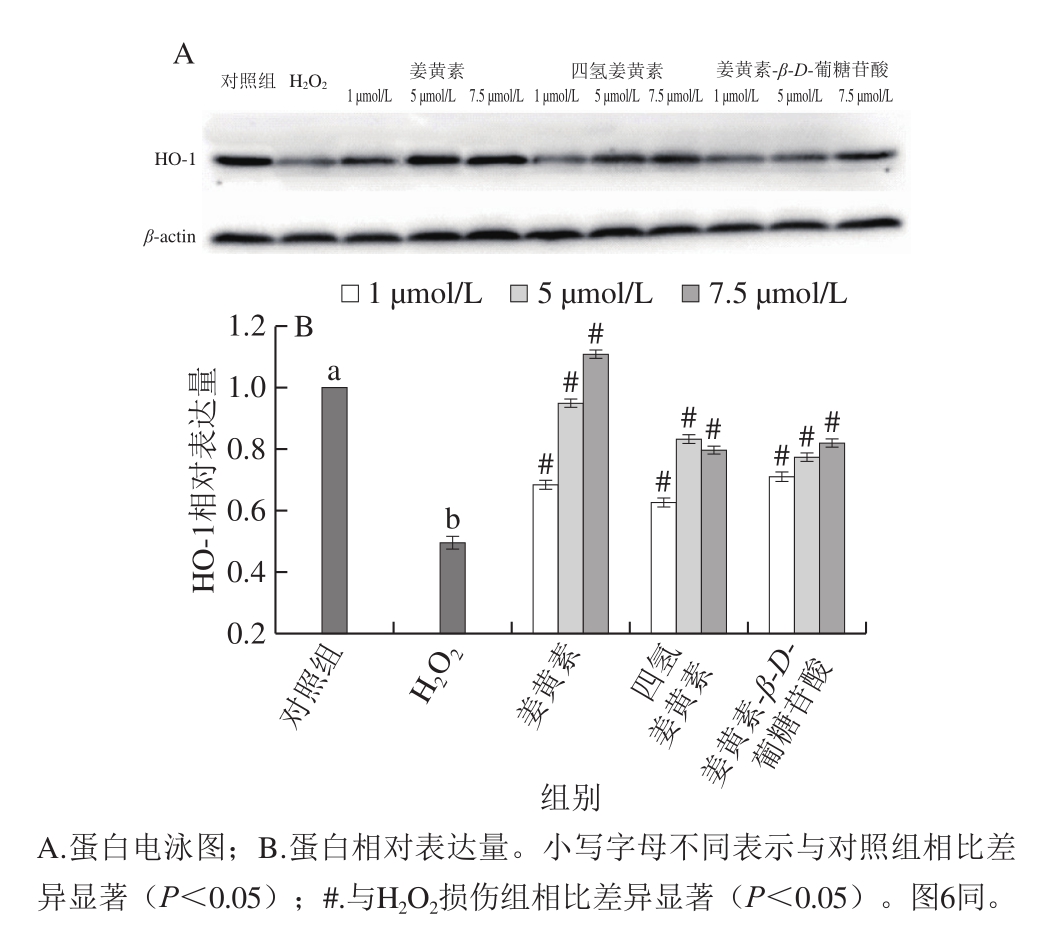
图5 姜黄素及其代谢产物对H2O2损伤的PC12细胞HO-1表达的影响
Fig.5 Effects of curcumin and its metabolites on hemeoxygenase-1 expression in H2O2-treated PC12 cells
与对照组相比,H2O2损伤显著降低了PC12细胞中HO-1蛋白的表达(P<0.05),而姜黄素及其代谢产物处理显著抑制了H2O2损伤导致的HO-1蛋白的下降(P<0.05)。姜黄素处理组和姜黄素-β-D-葡糖苷酸处理组呈现出明显的剂量效应。在浓度为7.5 μmol/L时,姜黄素、四氢姜黄素和姜黄素-β-D-葡糖苷酸处理组与H2O2损伤组相比,HO-1蛋白表达分别增加了123.70%、65.20%和68.10%。这些结果表明姜黄素及其代谢产物能够促进H2O2损伤的PC12细胞HO-1蛋白的表达,进而抵御细胞氧化损伤,其中以姜黄素的作用效果最为显著。
2.5.2 对NQO-1蛋白表达的影响
NQO-1是一种II相解毒酶,它专一性催化细胞内双电子还原反应,解除醌类物质对细胞的毒害,从而起到保护细胞的作用。如图6所示,H2O2处理能够显著降低PC12细胞NQO-1蛋白的表达量(P<0.05),为对照组的88.19%。与H2O2损伤组相比,姜黄素及其代谢产物处理显著增加了NQO-1蛋白的表达量(P<0.05),并具有剂量依赖性。浓度为7.5 μmol/L时,3 种物质对NQO-1的诱导作用均达到最大。与损伤组相比,姜黄素处理组提高了43.60%,四氢姜黄素处理组提高了30.10%,姜黄素-β-D-葡糖苷酸处理组提高了27.30%。

图6 姜黄素及其代谢产物对H2O2损伤的PC12细胞NQO-1表达的影响
Fig.6 Effects of curcumin and its metabolites on NADPH quinineoxidoreductase-1 expression in H2O2-treated PC12 cells
2.6 姜黄素及其代谢产物对PC12细胞Nrf2蛋白表达的影响
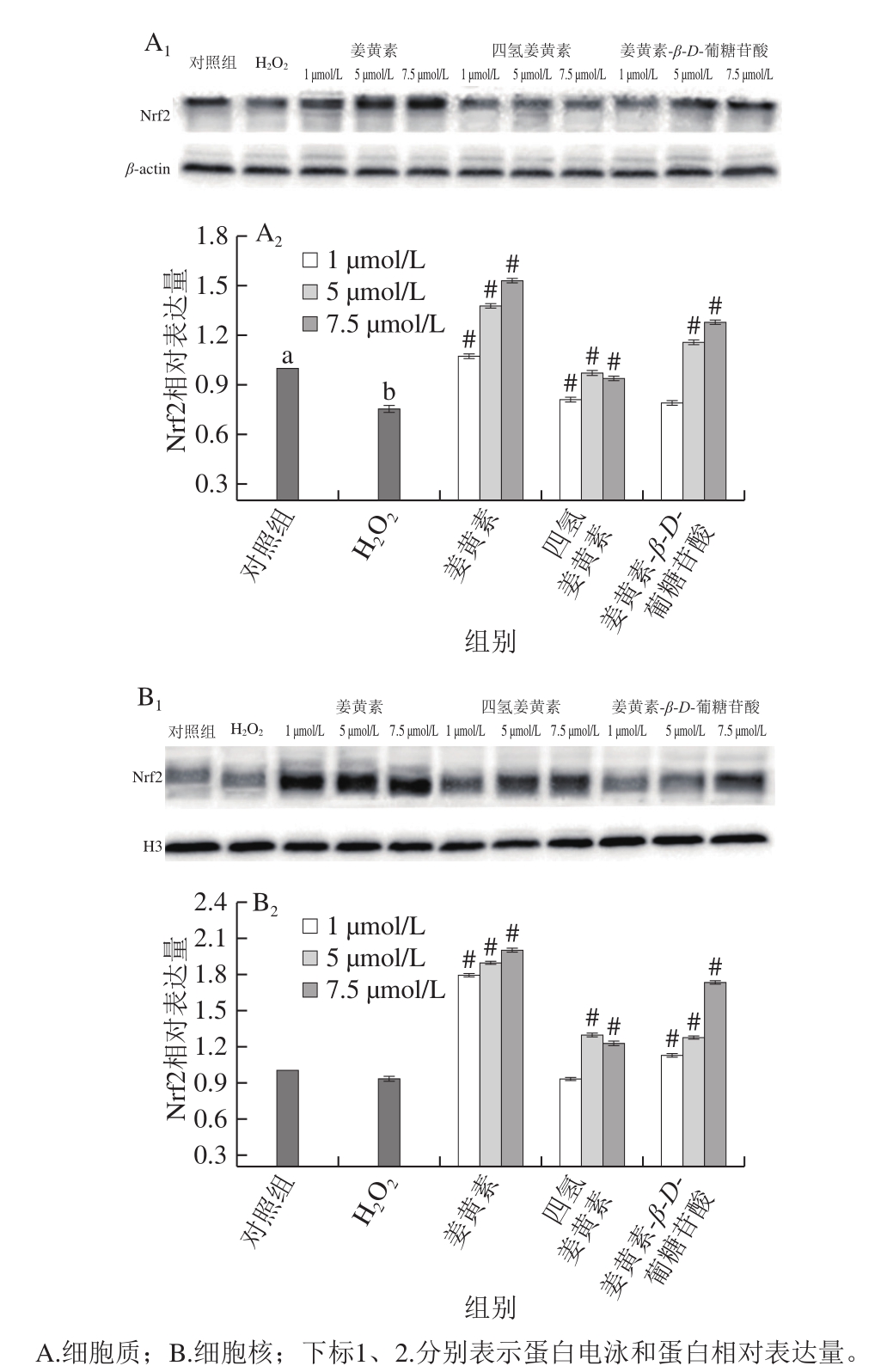
图7 姜黄素及其代谢产物对H2O2损伤的PC12细胞Nrf2表达的影响
Fig.7 Effects of curcumin and its metabolites on Nrf2 expression in H2O2-treated PC12 cells
Nrf2是机体氧化应激反应的主要调节因子,氧化应激的产生可以导致Nrf2从keap1蛋白上解离并移位至细胞核,从而使Nrf2被激活,活化的Nrf2可以通过调节II相解毒酶、抗氧化酶系统的转录和翻译,从而抵御机体由于ROS造成的损伤[30-31],因此,进一步检测姜黄素及其代谢产物对PC12细胞Nrf2蛋白表达的影响,结果如图7所示。
与对照组相比,H2O2损伤组细胞质中Nrf2蛋白的表达量显著下降(P<0.05),但细胞核中的Nrf2蛋白表达量无显著变化(P>0.05),说明H2O2损伤降低了PC12细胞总Nrf2蛋白的表达量,但是由于H2O2处理导致细胞过度氧化损伤,Nrf2表达量降低,可能使Nrf2不足以由细胞质向细胞核转移。与H2O2损伤组相比,姜黄素及其代谢产物处理显著增加了细胞质和细胞核内Nrf2蛋白的表达量(P<0.05),其中姜黄素、四氢姜黄素和姜黄素-β-D-葡糖苷酸在浓度为7.5 μmol/L时,细胞质中Nrf2表达量分别提高了102.80%、24.48%、69.54%,细胞核内Nrf2表达量分别提高了115.10%、32.09%、86.20%。Gao Shuang等[32]研究表明,姜黄素不仅可显著增加氧化损伤的小鼠肝脏内总Nrf2蛋白水平,还可使Nrf2蛋白易位进入细胞核,从而激活Nrf2蛋白。这与本实验结果一致。姜黄素及其代谢产物不仅能够激活氧化损伤的PC12细胞中Nrf2蛋白的表达量,而且还能促进Nrf2向细胞核内转移,从而激活下游抗氧化酶活性,抵御细胞氧化损伤。
3 讨 论
近年来,食物中的酚类物质因其广泛的生物学活性受到关注。其在体内往往需经过复杂的生物转化才能被机体利用,在体内的代谢主要分为两相,第I相主要是官能团化反应,在酶的催化下对药物分子进行的氧化、还原、水解和羟化等反应,在化合物中引入或使其暴露出极性基团;第II相又称结合反应,将第I相中化合物产生的极性基团与体内的内源性成分,如葡萄糖醛酸、硫酸等,经共价键结合,生成极性大、易溶于水和易排出体外的结合物[33]。市面上的大多数药物通常会在高剂量下精准释放,从而避免了代谢过程,这确保了足够数量的活性药物以未代谢、未结合的形式被运送到适当的组织。相反,通过饮食传递的多酚类物质往往含量较低,绝大部分都要经历代谢转化过程。因此,为揭示膳食多酚对多种疾病的预防和治疗作用机制,研究其代谢产物的生物活性或许具有重要意义[34]。Holder等[35]对姜黄素在大鼠体内的代谢研究发现,姜黄素的I相代谢产物主要为四氢姜黄素(质量分数约50%)、六氢姜黄素(质量分数约42%),以及少量的阿魏酸。而姜黄素的I相代谢产物一部分会进行II相代谢,代谢产物主要以葡萄糖醛酸类化合物存在[36]。
本实验比较了姜黄素及其两种主要代谢产物对H2O2损伤的PC12细胞的保护作用。结果表明,姜黄素及其代谢产物能够清除细胞内ROS,提高SOD活力,激活Nrf2信号通路,上调HO-1、NQO-1的表达,从而降低细胞氧化损伤,提高细胞存活率。然而,姜黄素及其代谢产物对PC12细胞的保护作用效果具有一定差异。总体来看,经代谢修饰后的产物——四氢姜黄素和姜黄素-β-D-葡糖苷酸的抗氧化损伤作用弱于姜黄素,这与前人研究的结果类似。Pan等[20]证明姜黄素比四氢姜黄素具有更好的抗炎活性,姜黄素可显著降低脂多糖诱导的巨噬细胞中iNOS基因水平,促进IκB的降解,激活NF-κB转录因子,而四氢姜黄素、六氢姜黄素和八氢姜黄素的活性较低。此外,Shoji等[37]也证明姜黄素葡糖苷酸对HepG2细胞存活率及mRNA的影响弱于姜黄素,这可能与姜黄素和黄素葡糖苷酸在HepG2细胞中的相对吸收速率有关。在将来的研究中,进一步通过细胞或动物实验来揭示姜黄素修饰前后产物的构效关系和吸收速率是必要的。
[1]PHANIENDRA A, JESTADI D B, PERIYASAMY L.Free radicals: properties, sources, targets, and their implication in various diseases[J].Indian Journal of Clinical Biochemistry, 2015, 30(1):11-26.DOI:10.1007/s12291-014-0446-0.
[2]GERBER P A, RUTTER G A.The role of oxidative stress and hypoxia in pancreatic beta cell dysfunction in diabetes mellitus[J].Antioxidants &Redox Signaling, 2016, 26(10): 501-518.DOI:10.1089/ars.2016.6755.
[3]KIYUNA L A, ALBUQUERQUE R P E, CHEN C H, et al.Targeting mitochondrial dysfunction and oxidative stress in heart failure:challenges and opportunities[J].Free Radical Biology and Medicine,2018, 129: 155-168.DOI:10.1016/j.freeradbiomed.2018.09.019.
[4]JHA J C, BANAL C, CHOW B S, et al.Diabetes and kidney disease:role of oxidative stress[J].Antioxidants & Redox Signaling, 2016,25(12): 657-684.DOI:10.1089/ars.2016.6664.
[5]SINGH S, VERMA S K, KUMAR S, et al.Evaluation of oxidative stress and antioxidant status in chronic obstructive pulmonary disease[J].Scandinavian Journal of Immunology, 2017, 85(2):130-137.DOI:10.1111/sji.12498.
[6]LIU X F, HAO J L, XIE T, et al.Nrf2 as a target for prevention of age-related and diabetic cataracts by against oxidative stress[J].Aging Cell, 2017, 16(5): 934-942.DOI:10.1111/acel.12645.
[7]TANTAVISUT S, TANAVALEE A, HONSAWEK S, et al.Effect of vitamin E on oxidative stress level in blood, synovial fluid, and synovial tissue in severe knee osteoarthritis: a randomized controlled study[J].BMC Musculoskeletal Disorders, 2017, 18(1): 281.DOI:10.1186/s 12891-017-1637-7.
[8]CHANG Y T, CHANG W N, TSAI N W, et al.The roles of biomarkers of oxidative stress and antioxidant in Alzheimer's disease:a systematic review[J].Biomed Research International, 2014, 2014:1-14.DOI:10.1155/2014/182303.
[9]ANDRISIC L, DUDZIK D, BARBAS C, et al.Short overview on metabolomics approach to study pathophysiology of oxidative stress in cancer[J].Redox Biology, 2018, 14: 47-58.DOI:10.1016/j.redox.2017.08.009.
[10]KARIMIAN M S, PIRRO M, MAJEED M, et al.Curcumin as a natural regulator of monocyte chemoattractant protein-1[J].Cytokine & Growth Factor Reviews, 2017, 33: 55-63.DOI:10.1016/j.cytogfr.2016.10.001.
[11]ABDOLLAHI E, MOMTAZI A A, JOHNSTON T P, et al.Therapeutic effects of curcumin in inflammatory and immune-mediated diseases:a nature-made jack-of-all-trades?[J].Journal of Cellular Physiology,2017, 233(2): 830-848.DOI:10.1002/jcp.25778.
[12]SAHEBKAR A, CICERO A F G, SIMENTAL-MENDIA L E, et al.Curcumin downregulates human tumor necrosis factor-α levels: a systematic review and meta-analysis ofrandomized controlled trials[J].Pharmacological Research, 2016, 107: 234-242.DOI:10.1016/j.phrs.2016.03.026.
[13]TEYMOURI M, PIRRO M, JOHNSTON T P, et al.Curcumin as a multifaceted compound against human papilloma virus infection and cervical cancers: a review of chemistry, cellular, molecular, and preclinical features[J].Biofactors, 2017, 43(3): 331-346.DOI:10.1002/biof.1344.
[14]PANAHI Y, KHALILI N, SAHEBI E, et al.Antioxidant effects of curcuminoids in patients with type 2 diabetes mellitus: a randomized controlled trial[J].Inflammopharmacology, 2016, 25(1): 1-7.DOI:10.1007/s10787-016-0301-4.
[15]WANG Y J, PAN M H, CHENG A L, et al.Stability of curcumin in buffer solutions and characterization of its degradation products[J].Journal of Pharmaceutical and Biomedical Analysis, 1997, 15(12):1867-1876.DOI:10.1016/s0731-7085(96)02024-9.
[16]HEGER M, VAN GOLEN R F, BROEKGAARDEN M, et al.The molecular basis for the pharmacokinetics and pharmacodynamics of curcumin and its metabolites in relation to cancer[J].Pharmacological Reviews, 2014, 66(1): 222-307.DOI:10.1124/pr.110.004044.
[17]WU B, KAUSTUBH K, SUMIT B, et al.First-pass metabolism via UDP-glucuronosyltransferase: a barrier to oral bioavailability of phenolics[J].Journal of Pharmaceutical Sciences, 2011, 100(9):3655-3681.DOI:10.1002/jps.22568.
[18]PAN M H, HUANG T M, LIN J K.Biotransformation of curcumin through reduction and glucuronidation in mice[J].Drug Metabolism &Disposition, 1999, 27(4): 486-494.DOI:10.2466/PMS.96.1.113-126.
[19]JARUKAMJORN K, CHATUPHONPRASERT W, JEARAPONG N,et al.Tetrahydrocurcumin attenuates phase I metabolizing enzymetriggered oxidative stress in mice fed a high-fat and high-fructose diet[J].Journal of Functional Foods, 2019, 55: 117-125.DOI:10.1016/j.jff.2019.02.021.
[20]PAN M H, LIN-SHIAU S Y, LIN J K.Comparative studies on the suppression of nitric oxide synthase by curcumin and its hydrogenated metabolites through down-regulation of IκB kinase and NFκB activation in macrophages[J].Biochemical Pharmacology, 2000,60(11): 1665-1676.DOI:10.1016/S0006-2952(00)00489-5.
[21]NAKAGAWA K, ZINGG J M, KIM S H, et al.Differential cellular uptake and metabolism of curcuminoids in monocytes/macrophages:regulatory effects on lipid accumulation[J].British Journal of Nutrition, 2014, 112(1): 8-14.DOI:10.1017/S0007114514000567.
[22]OSAWA T, SUGIYAMA Y, INAYOSHI M, et al.Antioxidative activity of tetrahydrocurcuminoids[J].Journal of the Agricultural Chemical Society of Japan, 1995, 59(9): 1609-1612.DOI:10.1271/bbb.59.1609.
[23]SOMPARN P, PHISALAPHONG C, NAKORNCHAI S, et al.Comparative antioxidant activities of curcumin and its demethoxy and hydrogenated derivatives[J].Biological & Pharmaceutical Bulletin,2007, 30(1): 74-78.DOI:10.1248/bpb.30.74.
[24]PAL A, SUNG B, PRASAD B A B, et al.Curcumin glucuronides:assessing the proliferative activity against human cell lines[J].Bioorganic & Medicinal Chemistry, 2014, 22(1): 435-439.DOI:10.1016/j.bmc.2013.11.006.
[25]YANG Bobo, YIN Changsheng, ZHOU Yun, et al.Curcumin protects against methylmercury-induced cytotoxicity in primary rat astrocytes by activating the Nrf2/ARE pathway independently of PKCδ[J].Toxicology, 2019, 425: 152248.DOI:10.1016/j.tox.2019.152248.
[26]LI F, NITTERANON V, TANG X, et al.In vitro antioxidant and anti-inflammatory activities of 1-dehydro-[6]-gingerdione, 6-shogaol,6-dehydroshogaol and hexahydrocurcumin[J].Food Chemistry, 2012,135(2): 332-337.DOI:10.1016/j.foodchem.2012.04.145.
[27]KARAKASHEV P, PETROV L, ALEXANDROVA A.Paraquat-induced lipid peroxidation and injury in Ehrlich ascites tumor cells[J].Neoplasma, 2000, 47(2): 122-124.DOI:10.1007/BF00391604.
[28]GILL S S, ANJUM N A, GILL R, et al.Superoxide dismutase-mentor of abiotic stress tolerance in crop plants[J].Environmental Science and Pollution Research, 2015, 22(14): 10375-10394.DOI:10.1007/s11356-015-4532-5.
[29]HAO M, LIU R.Molecular mechanism of CAT and SOD activity change under MPA-CdTe quantum dots induced oxidative stress in the mouse primary hepatocytes[J].Spectrochimica Acta Part A, 2019,220: 117104.DOI:10.1016/j.saa.2019.05.009.
[30]ESPINOSADIEZ C, MIGUEL V, MENNERICH D, et al.Antioxidant responses and cellular adjustments to oxidative stress[J].Redox Biology, 2015, 6: 183-197.DOI:10.1016/j.redox.2015.07.008.
[31]FU C Y, CHEN J, LU X Y, et al.Dimethyl fumarate attenuates lipopolysaccharide-induced mitochondrial injury by activating Nrf2 pathway in cardiomyocytes[J].Life Science, 2019, 235: 116863.DOI:10.1016/j.lfs.2019.116863.
[32]GAO Shuang, DUAN Xiaoxu, WANG Xin, et al.Curcumin attenuates arsenic-induced hepatic injuries and oxidative stress in experimental mice through activation of Nrf2 pathway, promotion of arsenic methylation and urinary excretion[J].Food & Chemical Toxicology,2013, 59(3): 739-747.DOI:10.1016/j.fct.2013.07.032.
[33]DHAKSHINAMOORTHY S, LONG D J, JAISWAL A K.Antioxidant regulation of genes encoding enzymes that detoxify xenobiotics and carcinogens[J].Current Topics in Cellular Regulation,2001, 36: 201-216.DOI:10.1016/s0070-2137(01)80009-1.
[34]KROON P A, CLIFFORD M N, ALAN C, et al.How should we assess the effects of exposure to dietary polyphenols in vitro?[J].American Journal of Clinical Nutrition, 2004, 80(1): 15-21.DOI:10.1093/ajcn/80.1.15.
[35]HOLDER G M, PLUMMER J L, RYAN A J.The metabolism and excretion of curcumin (1,7-bis-(4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione) in the rat[J].Xenobiotica, 1978, 8(12): 761-768.DOI:10.3109/00498257809069589.
[36]HOEHLE S I, ERIKA P, SOLYOM A M, et al.Metabolism of curcuminoids in tissue slices and subcellular fractions from rat liver[J].Journal of Agricultural and Food Chemistry, 2006, 54(3): 756-764.DOI:10.1021/jf058146a.
[37]SHOJI M, NAKAGAWA K, WATANABE A, et al.Comparison of the effects of curcumin and curcumin glucuronide in human hepatocellular carcinoma HepG2 cells[J].Food Chemistry, 2014,151(20): 126-132.DOI:10.1016/j.foodchem.2013.11.021.