在人和动物肠道内寄居有大量细菌、病毒等复杂的微生物群体[1],宿主肠道和这些微生物建立起密不可分的共生关系,宿主肠道为微生物群体提供营养和生存场所[2-3],同时这些微生物也对宿主的营养、代谢和免疫功能调节发挥重要作用[4-5]。因此,它们之间的相互作用研究成为逐渐兴起的热点。伴随着美国“人类微生物组计划”和欧盟“MetaHit计划”的完成,人们已对寄居在远端肠道内的复杂微生物生态系统有了更深入的了解[6],近年来,越来越多的证据表明,肠道微生物的关键生理作用与机体之间有着密切关系[7-9],特别是在宿主健康和疾病中发挥着重要作用[10-12],如Lee等[13]发现人体中菌群的改变与人乳头瘤病毒的感染有关。
肠道微生物是指寄居在机体消化道的数以万亿计的微生物[14-15]。它们按照一定比例组合在一起,相互依存、制约、共生,形成相对稳定的肠道微生态[16-19]。个体之间菌群数量、结构、丰度及生理状态均存在差异[20]。在正常肠道微生物菌群中,拟杆菌门及厚壁菌门最多,约占90%[21],其他较少的门类菌群有放线菌门[22]、变形菌门[23]等。肠道菌群可寄居于不同部位,通过特定菌群结构、活动、代谢产物等共同影响机体的代谢,维持内环境稳态。但是肠道菌群与宿主之间存在密切的互利共生关系,菌群的稳定与宿主年龄、遗传背景、饮食、生活环境等相关,反过来,宿主能影响肠道菌群的结构和功能,而肠道菌群也可通过其特有的功能属性,影响宿主的生长代谢[24],Chaplin等[25]通过分析在高脂肪饮食下接受钙补充的C57BL/6J小鼠中的肠道微生物群,并确定其与宿主代谢的关系。
结直肠是人体中重要的消化器官,具有消化、营养物质代谢以及贮存食物残渣的作用。但是,由于食物残渣以及代谢产生的一些酸类、酚类等致癌物,使得肠屏障的完整性、免疫系统等受到了侵袭和破坏,增加了结直肠癌的患病风险。结直肠癌是常见的一类以体质量减轻、严重腹泻以及腹痛为典型性特征的慢性和复发性消化道疾病[26-27],一般发生在回肠、结肠和直肠处。
目前结直肠癌的详细致病机制尚不清楚,肠道微生物[28-30]、肠上皮屏障以及肠免疫系统构成的稳态失调可能是影响结直肠癌发生的关键因素[31]。前期实验发现,鲟鱼硫酸软骨素具有抑制结直肠癌肿瘤细胞增殖的作用[32]。因此,本实验以结直肠癌小鼠为模型,通过对小鼠肠道内容物的细菌菌群多样性进行分析,探究鲟鱼硫酸软骨素对结直肠癌患病小鼠肠道菌群的影响,研究结果为开发以鲟鱼软骨素为基础的膳食营养补充剂以预防和降低结直肠癌发生风险提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
鲟鱼硫酸软骨素由中国农业大学食品科学与营养工程学院应用微生物实验室制备;雄性BALB/c裸鼠(生产许可证号:SCXK(京)2016-0006) 北京维通利华实验动物技术有限公司;琼脂糖 美国Sigma公司;DNA DL2000 Marker 北京艾德莱生物科技有限公司;氯仿、异丙醇、乙醇 北京化学工业集团有限公司;粪便基因组提取试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
超低温冰箱 海尔集团公司;SCL-1300垂直流洁净工作台 北京赛伯乐实验仪器有限公司;GB303电子天平梅特勒-托利多(上海)集团;4200型凝胶成像系统 上海天能科技有限公司;BG-power300电泳仪 北京百晶生物科技有限公司;GL-206低速离心机 湖南平凡仪器仪表有限公司;1658001型垂直电泳槽 美国伯乐公司;HiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 动物的分组和处理
SPF级健康的5 周龄雄性BALB/c裸鼠饲养于北京市实验动物中心,按照SPF级实验动物的要求在屏障环境中进行饲养和管理。
饲养条件:动物房温度为(22±2)℃,相对湿度为(50±10)%,严格按照12 h光照/黑暗循环,实验鼠进行自由采食和进水。
BALB/c裸鼠适应性喂养一周后,随机分为6 组,每组10 只,采用皮下注射结直肠癌细胞的方法建立结直肠癌模型小鼠,注射两周后,瘤组织体积约为30 mm3,之后每天定时灌胃不同剂量的待测样品,连续灌胃4 周。具体分组为:1)正常对照组:未注射结直肠癌细胞,灌胃生理盐水;2)模型组:注射结直肠癌细胞,灌胃生理盐水;3)阳性处理组:注射结直肠癌细胞,灌胃5-氟尿嘧啶;4)低剂量组:注射结直肠癌细胞,灌胃低剂量鲟鱼硫酸软骨素(100 μg/g);5)中剂量组:注射结直肠癌细胞,灌胃中剂量鲟鱼硫酸软骨素(200 μg/g);6)高剂量组:注射结直肠癌细胞,灌胃高剂量鲟鱼硫酸软骨素(400 μg/g)。
1.3.2 小鼠肿瘤组织体积、质量的测定
小鼠肿瘤组织体积的测定:皮下注射结直肠癌细胞HCT-116后,使用游标卡尺每4 d测量一次各组小鼠肿瘤长度、宽度,肿瘤体积(V)按下式计算。
小鼠肿瘤组织质量的测定:实验结束后,对各组实验鼠进行取材处理,剖取各组小鼠肿瘤组织并称质量/g,记录各组小鼠肿瘤组织质量。
1.3.3 粪便的采集
在实验结束前,采用压迫挤压法采集各组实验小鼠的新鲜粪便,左手抓紧并固定好小鼠,右手轻轻挤压小鼠直肠,无菌离心管收集新鲜的粪便样本,将采集好的样本贮藏于-80 ℃冰箱、备用,避免反复冻融。
1.3.4 粪便中DNA的提取
取-80 ℃贮藏的粪便样本,参照粪便DNA提取试剂盒说明书对各实验组中小鼠的粪便进行总DNA的提取。
1.3.5 肠道菌群16S rRNA V3区PCR扩增
基于肠道菌群的16S rRNA基因V3~V4区域合成相关引物为515F(5'-ACTCCTCCGGGAGGCAGCAG-3')和806R(5'-GGACTACGCGGGTATCTAAT-3')。扩增体系包括2×Phanta Max缓冲液12.5 μL、10 mmol dNTP Mix 0.5 μL、10 μmol引物-F 1.0 μL、10 μmol引物-R 1.0 μL、1 U/μL DNA聚合酶0.5 μL、模板DNA 20.0 ng,加水补充至25.0 μL。聚合酶链式反应程序为95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共23 个循环;72 ℃延伸5 min,4 ℃保存。扩增后进行混样、建库并做相应的检测,使用设定的标签序列进行样本区分。检测合格的扩增子文库将采用Illumina HiSeq 2500高通量测序平台对样品进行测序。
1.4 数据处理与分析
1.4.1 数据预处理和序列质量优化统计
对Illumina HiSeq 2500测序得到的原始数据,利用软件FastQC进行数据质量评估和数据过滤,并利用Pandaseq软件进行序列优化统计。实验数据均是将低、中、高剂量组与正常对照组、模型组和阳性处理组进行比较分析。实验结果以平均值±标准差表示。用SPSS 20软件分析数据,显著性分析采用单因素方差分析和Duncan's多重检验,P<0.05表示存在显著性差异。
1.4.2 操作分类单元聚类分析
根据97%的序列相似性水平,利用QIIME软件包中的uclust聚类方法将移除嵌合体后的序列归为多个操作分类单元(operational taxonomic units,OTUs),得到OTU聚类结果。然后基于SILVA参考数据库,利用RDP Classifier软件对每个样品的OTUs进行分类学注释。
1.4.3 稀释曲线和物种相对丰度分析
对OTU的序列进行随机抽样,分析序列数与OTU数目的关系,构建稀释曲线并做多样性分析。
1.4.4 肠道微生物菌落组成分析
使用Qiime软件,并根据OTU分类结果对各组小鼠肠道微生物组成进行分析,分别从门、科和属等不同分类水平上了解各组肠道微生物组成和结构的变化特点。
1.4.5 组间相似性分析
主坐标分析(principal co-ordinates analysis,PCoA)是一种通过分析数据距离、矩阵来研究数据间相似性或差异性的可视化方法。通过UniFrac分析得到所有样品的距离、矩阵数据,然后进行PCoA,了解各组小鼠肠道微生物群落间的相似性。
2 结果与分析
2.1 鲟鱼硫酸软骨素对结直肠癌荷瘤小鼠中肿瘤组织体积与质量的影响
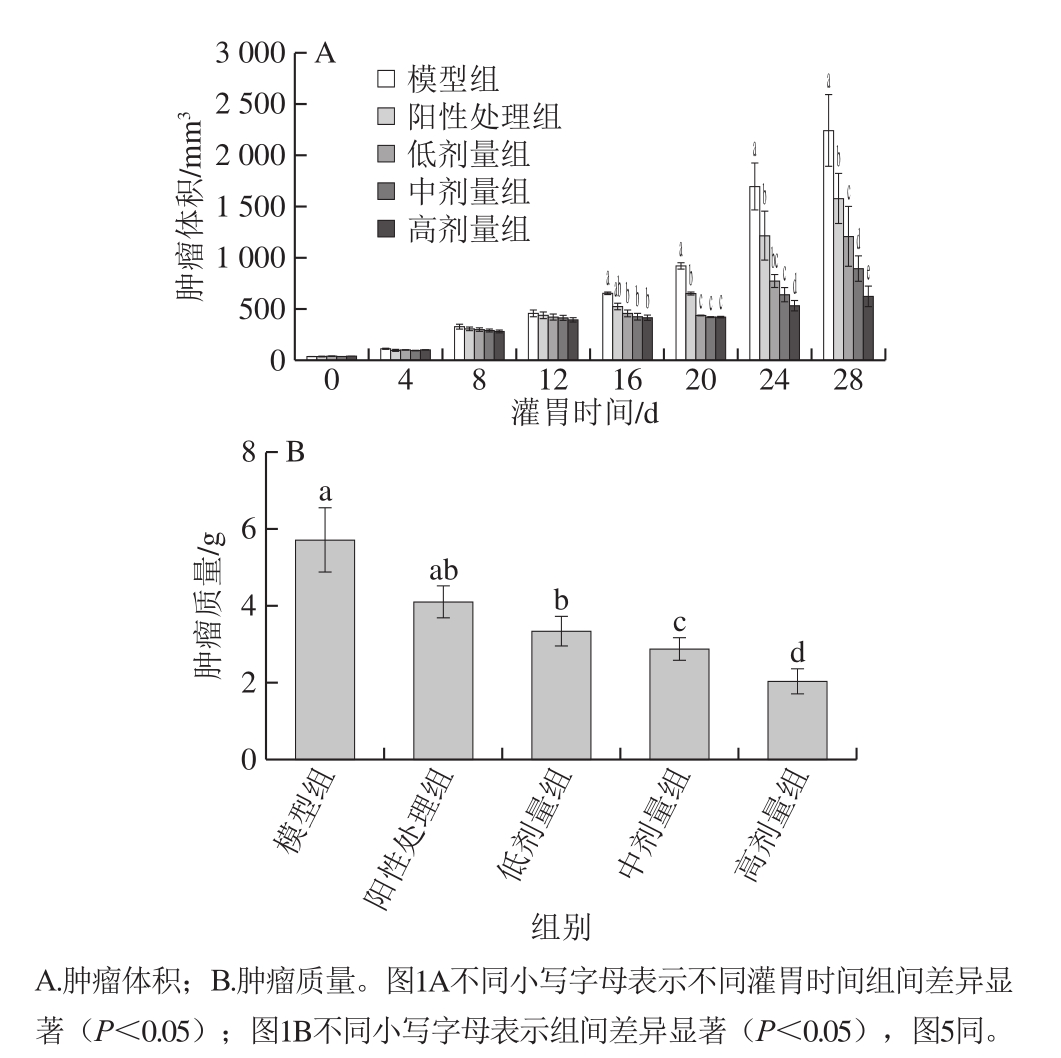
图1 各组小鼠肿瘤组织体积及质量
Fig.1 Tumor volume and mass
由图1A可知,与模型组相比,低、中、高剂量组实验小鼠的结直肠肿瘤组织体积的增长速率随口服剂量的增加而下降,呈现剂量依赖性,与模型组的体积相比差异显著(P<0.05)。同时,肿瘤组织质量结果显示(图1B),与模型组比较,随灌胃鲟鱼硫酸软骨素剂量的增加,肿瘤质量显著降低(P<0.05),表明对于已经形成结直肠癌的小鼠,口服鲟鱼硫酸软骨素可以减缓肿瘤的生长发展,起到治疗的作用。
2.2 物种相对丰度结果分析
2.2.1 稀释曲线分析
稀释性曲线是指采用随机抽样的方法,从样本中随机抽取一定数量的个体,统计出这些个体所代表物种数目,并以个体数与物种数来构建的曲线,它可以用来比较不同的样本之间的物种丰富度,还能够直观地反映样本的取样大小是否合理。稀释曲线(图2)结果表明,当测序量增多时,样本中物种多样性的增长幅度较低,说明测序量对样本中物种多样性的贡献率较小,当前所选的样本测序量足够多,可以较好地反映样品中的微生物物种信息。
图2 各组样本Shannon指数曲线
Fig.2 Shannon exponential curves of the samples
2.2.2 相对丰度分布曲线分析
图3 各组样本相对丰度分布曲线
Fig.3 Relative abundance curves of the samples
OTU是在系统发生分析或群体遗传研究中的一个假定的分类单元。对于样本的微生物组成研究,目前常用分类单元主要有门、纲、目、科、属、种6 个水平。通常以阈值序列相似性为97%为同一类,每一个类就是一个OTU,代表一个种。Rank-Abundance曲线可以同时用于反映测序样品中所含物种的丰富程度和均匀程度,其中曲线越长,说明物种组成越丰富,曲线越平滑,则表明物种组成的均匀程度越高。
丰度分布曲线(图3)中的每条曲线分别对应一个测序样本,横坐标表示OTU相对丰度按等级降序排列,纵坐标表示该OTU中序列数的相对丰度,结果显示,测序样本的物种序列数主要分布在100~700,且组成分布均匀。
2.2.3 多样性分析
为了更好地了解每个样本本身的生物多样性情况,通常会通过多个指标来表示,俗称多样性分析。本实验以Chao1指数、ACE值、Shannon指数和Goods's coverage指数来反映各组样品的物种相对丰度和群落多样性,数值与物种的丰度呈正相关。其中,Goods's coverage指数可以反映测序深度,数值越高,样本中没有被检出的概率越低。如表1所示,各组小鼠的测序深度均为0.98以上、渐近1,且无显著性差异(P>0.05),表明各组样本的序列基本均被检出。
表1 各组小鼠肠道菌群的多样性分析
Table 1 Diversity analysis of intestinal flora in mice from each group
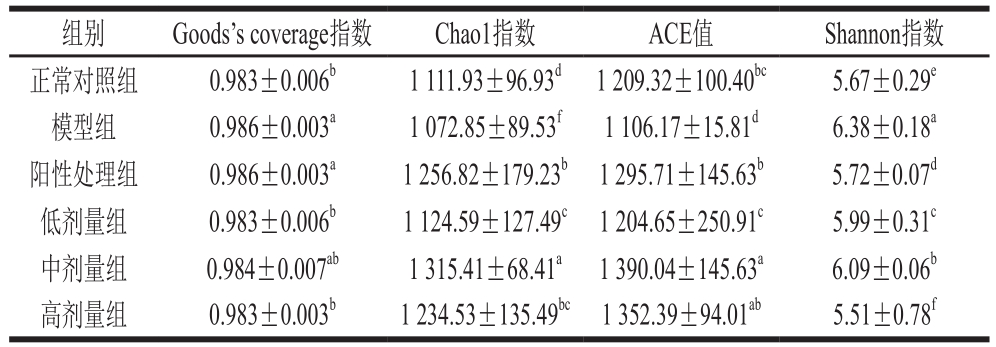
注:同行肩标小写字母不同表示差异显著(P<0.05)。
组别 Goods's coverage指数 Chao1指数 ACE值 Shannon指数正常对照组 0.983±0.006b 1 111.93±96.93d 1 209.32±100.40bc 5.67±0.29e模型组 0.986±0.003a 1 072.85±89.53f 1 106.17±15.81d 6.38±0.18a阳性处理组 0.986±0.003a 1 256.82±179.23b 1 295.71±145.63b 5.72±0.07d低剂量组 0.983±0.006b 1 124.59±127.49c 1 204.65±250.91c 5.99±0.31c中剂量组 0.984±0.007ab 1 315.41±68.41a 1 390.04±145.63a 6.09±0.06b高剂量组 0.983±0.003b 1 234.53±135.49bc 1 352.39±94.01ab 5.51±0.78f
人和动物肠道内定植着庞大的微生物群体,这些微生物在代谢膳食营养、促进免疫系统发育、抵抗病原微生物入侵等方面发挥重要作用[33]。近年来研究发现,许多的肠道基本疾病可能与肠道微生物多样性或者相对丰度的降低有关。结果表明,模型组样本的Chao1指数、ACE值均低于正常对照组,说明肠炎疾病可以引起小鼠肠道菌群中物种数量的改变及降低物种数量。同时,模型组的Shannon指数显著高于正常对照组(P<0.05),说明患结直肠癌可以使小鼠肠道菌群的多样性发生改变并降低。灌胃不同剂量的鲟鱼硫酸软骨素,可以使患病模型小鼠肠道微生物的Shannon指数降低,且逐渐趋于正常组,其中高剂量组的Shannon指数低于阳性对照组。由此可见,灌胃鲟鱼硫酸软骨素能够一定程度上增加结直肠癌患病模型小鼠肠道内的菌群多样性,起到调节肠道微生物菌群的作用。
2.3 肠道微生物菌落组成结果分析
2.3.1 基于门水平的微生物菌落结构分析
由图4可知,各组小鼠肠道菌群检测中,样品共注释到14 个细菌门类,分别为产古菌门(Euryarchaeota)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻细菌门(Cyanobacteria)、脱铁杆菌门(Deferribacteres)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、糖化菌门(Saccharibacteria)、螺旋菌门(Spirochaetae)、互养菌门(Synergistetes)、柔膜菌门(Tenericutes)和疣微菌门(Verrucomicrobia)。其中,拟杆菌门和厚壁菌门为主要的优势菌门。
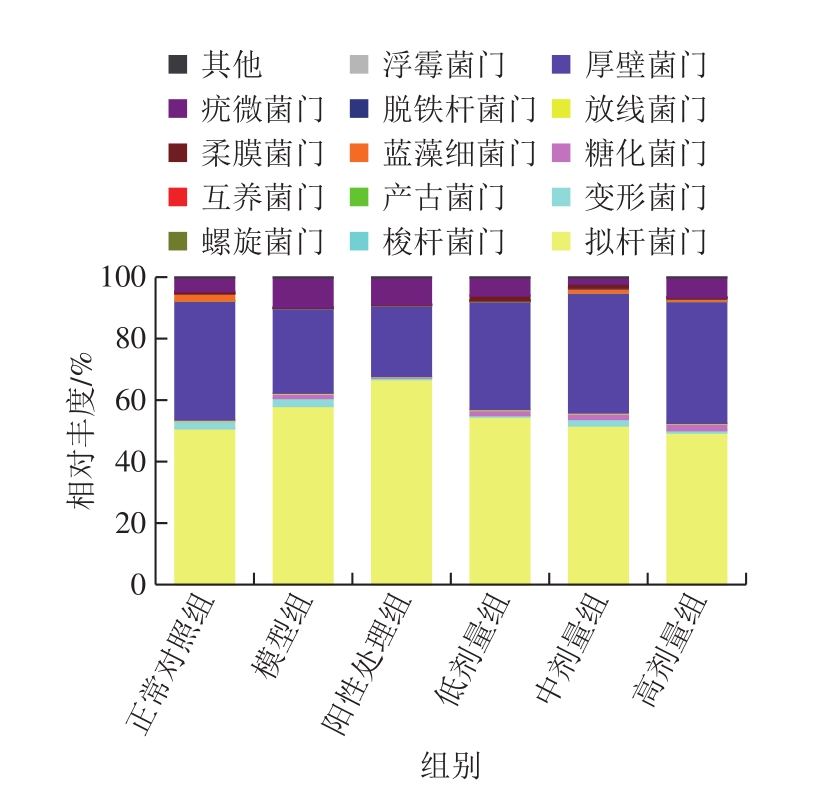
图4 各组小鼠肠道菌群在门水平上的注释结果
Fig.4 Annotation results of intestinal microflora at the phylum level in mice from each group
关于肠道疾病与肠道菌群的关系近年来受到了广泛的关注。已有文献和研究证明,肠道中厚壁菌门和拟杆菌门的比例对肠道健康影响不大[34],但梭杆菌门是主要的肠道致病菌,与癌症等多种疾病相关,尤其在结直肠癌中,具核梭杆菌作为共生致病菌是目前较为明确的与癌症有密切关系的菌[35],其可以促进癌细胞的发育、生长、传播以及影响癌症治疗的响应[36]。结果表明,模型组中的梭杆菌门相对丰度(0.008 5%)显著高于正常对照组(0.001 3%)(P<0.05),经灌胃鲟鱼硫酸软骨素处理后,小鼠肠道中的梭杆菌门相对丰度降低并且趋于正常对照组,其中高剂量组中的梭杆菌门相对丰度约为0.001 4%,表明鲟鱼硫酸软骨素可以改变结直肠癌患病小鼠肠道中的梭杆菌门相对丰度,进而起到对结直肠的调节作用(图5A)。
糖化菌门的主要作用是将多糖转化为简单的双糖和单糖,利于人体的吸收[37]。结果发现,灌胃鲟鱼硫酸软骨素后,小鼠中的糖化菌门相对丰度显著增高(P<0.05),明显高于正常对照组(0.15%)、模型组(0.47%)、阳性处理组(0.33%),且随着灌胃剂量的增加,肠道中糖化菌门的相对丰度增加,其中低剂量组为1.65%,中剂量组为1.85%,高剂量组可达2.10%,说明鲟鱼硫酸软骨素灌胃后能够增加糖化菌门含量,促进多糖的吸收,改变肠道菌群的结构(图5B)。
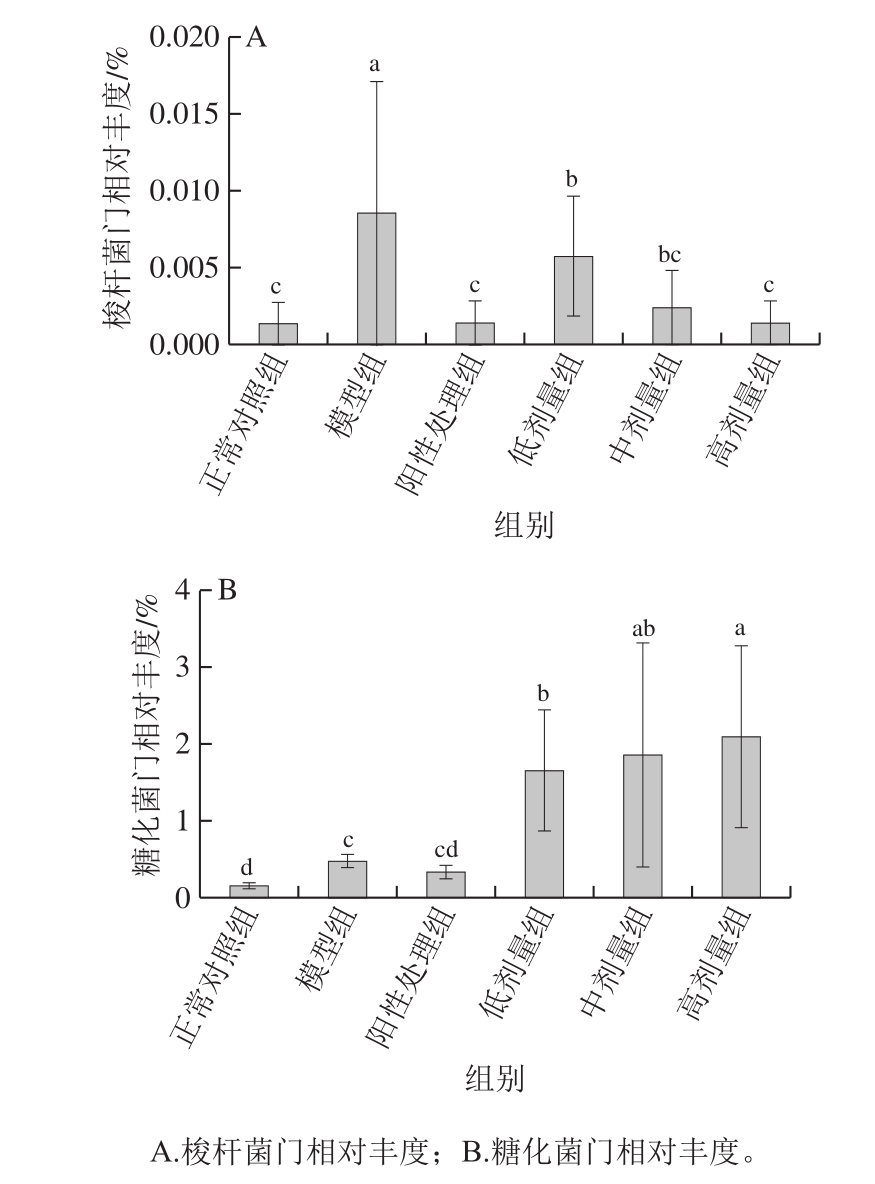
图5 各组小鼠肠道内糖化菌门的相对丰度
Fig.5 Relative abundance of intestinal microflora in mice from each group
2.3.2 基于科水平的微生物菌落结构分析
肠道菌群的平衡和稳定有利于肠道及机体的健康,而肠道菌群的多样性受到了生活方式以及自身的影响。为了进一步探究鲟鱼硫酸软骨素对结直肠癌小鼠肠道菌群的影响,本实验在门水平基础上,进一步分析了科水平上的变化。由表2可知,正常对照组小鼠和灌胃鲟鱼硫酸软骨素高剂量组小鼠中肠道的优势菌均为类杆菌科(Bacteroidaceae)、拟杆菌目S27科(Bacteroidales S24-7 group)和瘤胃菌科(Ruminococcaceae),与正常对照组相比,模型组中的Ruminococcaceae相对丰度由15%降至12%,同时Bacteroidales S24-7 group相对丰度由30%降至18%,且患病模型组小鼠肠道内科水平的优势菌发生了改变,变为Bacteroidales S24-7 group 18%、Lachnospiraceae 18%以及Ruminococcaceae 12%。
近年来,拟杆菌属对癌症的调节作用受到了研究者的关注和证明,Vetizou等[38]研究发现,CTLA-4作为一种新的免疫抑制药物,具有抗肿瘤作用,并且CTLA-4的抗肿瘤作用取决于不同的拟杆菌菌属,在小鼠和患者中,Bacteroidales或脆弱拟杆菌特异性的T细胞应答与抗癌药物对癌细胞增殖的阻断功效相关,同时已证实,脆拟杆菌具有抗癌特性[39]。进一步研究发现,一些糖类物质能够促进拟杆菌属中的某些细菌的生长[40]。实验结果也显示出,灌胃鲟鱼硫酸软骨素后,随灌胃剂量的增加,小鼠中Bacteroidales S24-7 group相对丰度总体呈增加趋势,其中低剂量组仅为31%,高剂量组则可达40%,说明鲟鱼硫酸软骨素可以提高Bacteroidales S24-7 group的相对丰度;与模型组(18%)相比,说明鲟鱼硫酸软骨素可能通过提高拟杆菌属的相对丰度,抑制结直肠癌的发展。灌胃鲟鱼硫酸软骨素后,小鼠肠道菌群中的科水平微生物含量逐渐趋于正常组小鼠,结合在灌胃鲟鱼硫酸软骨素素治疗的过程,以及前期细胞实验的结果[32],说明鲟鱼硫酸软骨素可以通过调节肠道菌群的平衡,改善肠道炎症的病变。
表2 各组优势菌科水平
Table 2 Distribution of dominant bacteria in samples at the family level

组别 优势菌科 相对丰度/%正常对照组Bacteroidales S24-7 group 30 Bacteroidaceae 16 Ruminococcaceae 15 Lachnospiraceae 10模型组Bacteroidales S24-7 group 18 Lachnospiraceae 18 Bacteroidaceae 12 Ruminococcaceae 12阳性处理组Bacteroidales S24-7 group 25 Lachnospiraceae 26 Bacteroidaceae 17 Ruminococcaceae 14低剂量组Bacteroidales S24-7 group 31 Ruminococcaceae 20 Lachnospiraceae 16 Bacteroidaceae 13中剂量组Bacteroidales S24-7 group 28 Ruminococcaceae 15 Lachnospiraceae 15 Bacteroidaceae 10高剂量组Bacteroidales S24-7 group 40 Bacteroidaceae 18 Ruminococcaceae 12 Lachnospiraceae 8
2.3.3 基于属水平的微生物菌落结构分析
选取相对丰度在前15%的菌进行属水平的菌落组成分析,结果如图6所示。正常组肠道内相对丰度在2%以上的属水平菌分别为拟杆菌属(16.47%)、Bacteroidales S24-7 group(24.56%)、阿利斯泰伯属(8.48%)、嗜胃气杆菌属(2.21%)、Lachnospiraceae NK4A136 group(3.39%)、Ruminococcaceae UCG-014(9.54%)、Akkermansia(8.48%),与结直肠癌患病小鼠模型组对比发现,Ruminiclostridium 5在患病小鼠的肠道内相对丰度明显升高,由正常组的0.92%升高到2.05%。已有研究发现,Ruminiclostridium 5主要与肠道、肝脏等慢性疾病相关,具有促进炎症发生的作用[41],结果显示,当灌胃鲟鱼硫酸软骨素后,小鼠肠道内的Ruminiclostridium 5相对丰度随着灌胃剂量的增加而降低,在高剂量组中,相对丰度为0.41%,基本接近正常组,说明鲟鱼硫酸软骨素具有一定的抗炎作用。
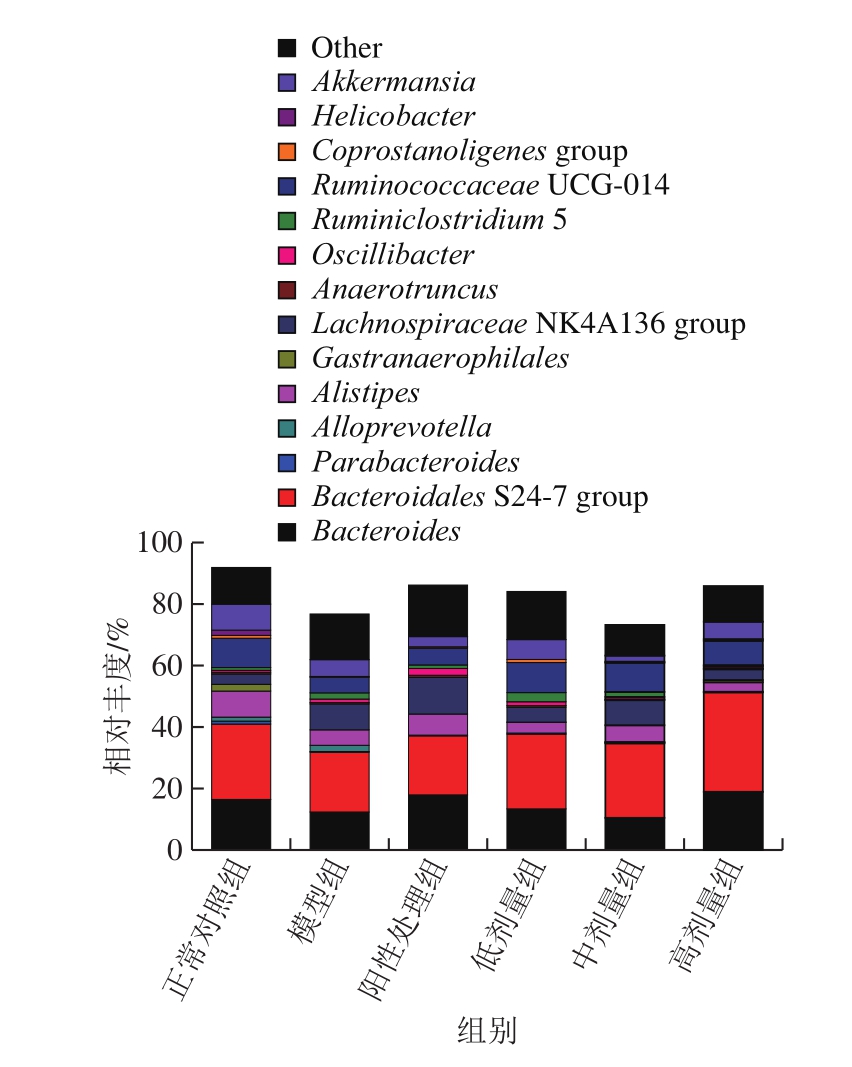
图6 各组小鼠肠道菌群在属水平上的注释结果
Fig.6 Taxonomic composition and distribution in samples at the genus level
Lachnospiraceae NK4A136 group、Oscillibacter都与机体的炎症反应相关,二者含量的增加能够加重机体的炎症,增加机体患病风险。Li Jun等[42]通过使用新得到的益生元混合物灌胃模型小鼠,发现可以减缓肿瘤的生长,与正常对照组相比显著降低肿瘤大小约40%,说明益生元改变了肠道微生物群落中有益细菌的优势,其中包括Prevotella和Oscillibacter,它们可以产生抗炎代谢物。结果发现,患病模型组中的Lachnospiraceae NK4A136 group、Oscillibacter相对丰度增加,且明显高于正常组;在治疗组中,灌胃不同剂量的鲟鱼硫酸软骨素后,体内两种菌在属水平上的相对丰度都降低,其中高剂量组由模型组的Lachnospiraceae NK4A136 8.45%、Oscillibacter 1.1%分别降低至3.49%和0.68%,恢复至正常组水平(3.39%和0.61%)。因此,鲟鱼硫酸软骨素可通过抑制促炎菌的生长改变肠道中菌群的数量,促进抗炎代谢产物的产生,进而增加抗炎能力,抑制癌细胞的增殖,最终起到缓解癌症的作用。
2.4 组间相似性结果分析
PCoA将多维数据进行降维,是一种研究数据相似性或差异性的可视化方法。为了更好地比较各组之间的微生物群落结构的多样性和各组肠道微生物组成间的相似性,本实验采用样品聚类的方法进行PCoA(图7)。
PCoA中样本点之间的距离越靠近,表明对应的样品间的肠道微生物组成越相似。各组小鼠肠道菌群PCoA二维图中可以看出,两种主坐标分别贡献了11.84%和9.66%的差异。李敏[43]通过构建急性结肠炎小鼠模型,发现在不同处理后的小鼠肠道菌群PCoA中,两种主坐标贡献率为17.7%和13.2%;同时,张任帅[44]通过对葡聚糖硫酸钠诱导的肠炎小鼠模型灌胃松花多糖后发现,PCO1和PCO2是两个主坐标成分,PCO1表示尽可能最大解释数据变化的主坐标成分,PCO2为解释余下的变化度中占比例最大的主坐标成分,分别为15.2%和11.93%,贡献率相对较小,与本实验结果相似,这可能是由于肠道微生物的构成、改变是多方面、多因素的,也可能是由于实验处理样本相对较少。
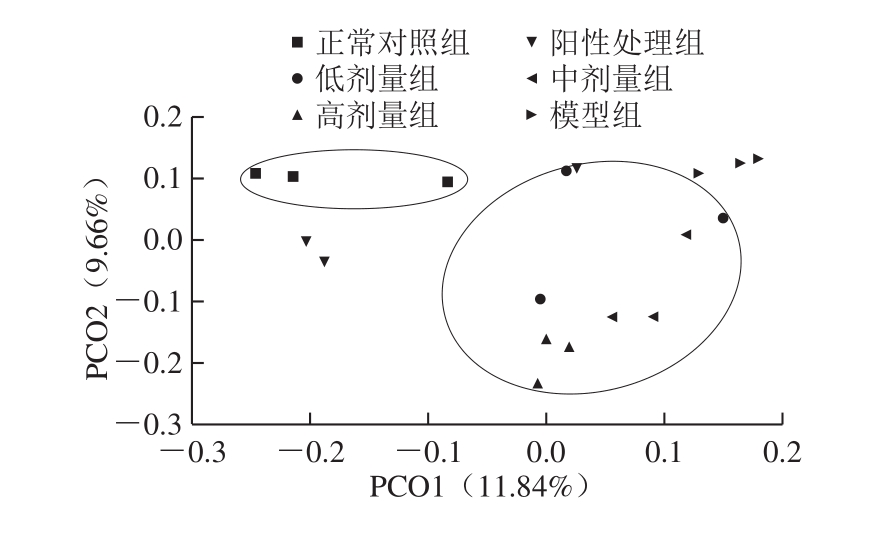
图7 各组小鼠肠道菌群PCoA主成分分析
Fig.7 Principal co-ordinates analysis of intestinal flora of mice from each group
但是,与正常组相比,阳性对照组各样本间的分散程度较高,说明5-氟尿嘧啶可以能会造成肠道菌群的紊乱,与上文中门水平的注释结果一致。正常对照组、模型组、阳性处理组和灌胃低、中、高剂量的鲟鱼硫酸软骨素各组的菌相组成存在差异。其中,灌胃鲟鱼硫酸软骨素的各组样本之间比较分散,可能是由于样本本身的个体存在差异,且低剂量组和中剂量组与模型组也存在着部分的相似性,而高剂量组则与模型组差异较大,结合之前鲟鱼硫酸软骨素灌胃处理后,小鼠肠道菌群在门、科以及属水平的变化,可以说明鲟鱼硫酸软骨素可以引起小鼠肠道菌群组成的改变。
3 结 论
本实验利用皮下注射结直肠癌细胞的方法,构建了结直肠癌患病小鼠模型,探究了灌胃鲟鱼硫酸软骨素对结直肠癌小鼠肠道菌群组成的影响。结果显示,鲟鱼硫酸软骨素可以改变小鼠肠道微生物的数量和多样性,结直肠癌患病小鼠中Bacteroidales S24-7 group、毛螺菌科以及瘤胃菌科相对丰度明显优于其他组,为主要的优势菌科,具有增加结直肠癌的患病风险。同时,灌胃鲟鱼硫酸软骨素后,小鼠肠道中的优势菌属发生改变,且部分菌属相对丰度改变,Lachnospiraceae NK4A136 group和Oscillibacter相对丰度明显降低,逐渐趋于正常对照组小鼠,说明鲟鱼硫酸软骨素可通过抑制促炎菌的生长改变肠道中菌群的数量,进而增加抗炎能力,抑制癌细胞的增殖,最终起到缓解癌症的作用。
[1]HOOPER L V, GORDIN J I.Commensal host-bacterial relationships in the gut[J].Science, 2001, 292: 1115-1118.DOI:10.1126/science.1058709.
[2]ZIJLMANS M A, KORPELA K, RIKSEN-WALRAVEN J M, et al.Maternal prenatal stress is associated with the infant intestinal microbiota[J].Psychoneuroendocrinology, 2015, 53: 233-245.DOI:10.1016/j.psyneuen.2015.01.006.
[3]PALMER C, BIK E M, DIGIULIO D B, et al.Development of the human infant intestinal microbiota[J].PLoS Biology, 2007, 5(7): e177.DOI:10.1371/journal.pbio.0050177.
[4]REYES A, HAYNES M, HANSON N, et al.Viruses in the faecal microbiota of monozygotic twins and their mothers[J].Nature, 2010,466: 334-338.DOI:10.1038/nature09199.
[5]VAN DAELE E, KNOL J, BELZER C.Microbial transmission from mother to child: improving infant intestinal microbiota development by identifying the obstacles[J].Critical Reviews in Microbiology,2019, 45(5/6): 613-648.DOI:10.1080/1040841X.2019.1680601.
[6]HUTTENHOWER, CURTIS G, DIRK K, et al.Structure, function and diversity of the healthy human microbiome[J].Nature, 2012, 486:207-214.DOI:10.1038/nature11234.
[7]BROWNE H P, FORSTER S C, ANONYE B O, et al.Culturing of‘unculturable' human microbiota reveals novel taxa and extensive sporulation[J].Nature, 2016, 533: 543-546.DOI:10.1038/nature17645.
[8]KINTSES B, MEHI O, ARI E, et al.Phylogenetic barriers to horizontal transfer of antimicrobial peptide resistance genes in the human gut microbiota[J].Nature Microbiology, 2019, 4(3): 447-458.DOI:10.1038/s41564-018-0313-5.
[9]刘瑞雪, 李勇超, 张波.肠道菌群微生态平衡与人体健康的研究进展[J].食品工业科技, 2016, 37(6): 383-387.DOI:10.13386/j.issn1002-0306.2016.06.068.
[10]HALATCHEV I G, O'DONNELL D, HIBBERD M C, et al.Applying indirect open-circuit calorimetry to study energy expenditure in gnotobiotic mice harboring different human gut microbial communities[J].Microbiome, 2019, 7(1): 1-8.DOI:10.1186/s40168-019-0769-4.
[11]LIU H, HAN M, LI S C, et al.Resilience of human gut microbial communities for the long stay with multiple dietary shifts[J].Gut,2019, 68(12): 2254-2255.DOI:10.1136/gutjnl-2018-317298.
[12]蒋海寅.人类肠道微生物群落菌群多样性变化与抑郁症的相关性研究[D].杭州: 浙江大学, 2015.
[13]LEE J E, LEE S, LEE H, et al.Association of the vaginal microbiota with human papillomavirus infection in a Korean twin cohort[J].PLoS ONE, 2013, 8(5): e63514.DOI:10.1371/journal.pone.0063514.
[14]GONG Y, DONG R, GAO X, et al.Neohesperidin prevents colorectal tumorigenesis by altering the gut microbiota[J].Pharmacological Research, 2019, 148: 104460.DOI:10.1016/j.phrs.2019.104460.
[15]TANG M L.Probiotics and prebiotics: immunological and clinical effects in allergic disease[J].Nestle Nutrition Workshop Series Paediatric Programme, 2009, 64(5): 219-235.DOI:10.1159/000235793.
[16]WANG Z, KLIPFELL E, BENNETT B J, et al.Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease[J].Nature,2011, 472: 57-63.DOI:10.1038/nature09922.
[17]SPRINGER N L, IYENGAR N M, BAREJA R, et al.Obesity-associated extracellular matrix remodeling promotes a macrophage phenotype similarto tumor-associated macrophages[J].The American Journal of Pathology, 2019, 189(10): 2019-2035.DOI:10.1016/j.ajpath.2019.06.005.
[18]ZHAO L.The gut microbiota and obesity: from correlation to causality[J].Nature Reviews Microbiology, 2013, 11(9): 639-647.DOI:10.1038/nrmicro3089.
[19]SENDER R, FUCHS S, MILO R.Revised estimates for the number of human and bacteria cells in the body[J].PLoS Biology, 2016, 14(8):e1002533.DOI:10.1371/journal.pbio.1002533.
[20]PYLKAS A M, JUNEJA L R, SLAVIN J L.Comparison of different fibers for in vitro production of short chain fatty acids by intestinal microflora[J].Journal of Medicinal Food, 2005, 8(1): 113-116.DOI:10.1089/jmf.2005.8.113.
[21]DE MUINCK E J, LUNDIN K, TROSVIK P.Linking spatial structure and community-level biotic interactions through cooccurrence and time series modeling of the human intestinal microbiota[J].mSystems,2017, 2(5): e00086-17.DOI:10.1128/mSystems.00086-17.
[22]QIN J, LI R, RAES J, et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature, 2010, 464: 59-65.DOI:10.1038/nature08821.
[23]SEBAK M, SAAFAN A E, ABDELGHANI S, et al.Bioassay- and metabolomics-guided screening of bioactive soil actinomycetes from the ancient city of Ihnasia, Egypt[J].PLoS ONE, 2019, 14(12):e226959.DOI:10.1371/journal.
[24]ALBUQUERQUE I, SILVA A R, CARREIRA M S, et al.Proteus mirabilis endocarditis[J].BMJ Case Reports, 2019, 12(8): 1-3.DOI:10.1136/bcr-2019-230575.
[25]CHAPLIN A, PARRA P, LARAICHI S, et al.Calcium supplementation modulates gut microbiota in a prebiotic manner in dietary obese mice[J].Molecular Nutrition and Food Research, 2016, 60(2):468-480.DOI:10.1002/mnfr.201500480.
[26]YANG F, ZENG X, NING K, et al.Saliva microbiomes distinguish caries-active from healthy human populations[J].ISME Journal, 2012,6(1): 1-10.DOI:10.1038/ismej.2011.71.
[27]LASSIGER-HERFURTH A, PONTAROLLO G, GRILL A, et al.The gut microbiota in cardiovascular disease and arterial thrombosis[J].Microorganisms, 2019, 7(12): 691.DOI:10.1186/s12896-019-0580-0.
[28]SPINDLER K G, DEMUTH C, SORENSEN B S, et al.Total cell-free DNA, carcinoembryonic antigen, and C-reactive protein for assessment of prognosis in patients with metastatic colorectal cancer[J].Tumor Biology, 2018, 40(11): 1-8.DOI:10.1177/1010428318811207.
[29]LIANG P S, DOMINITZ J A.Colorectal cancer screening: is colonoscopy the best option?[J].The Medical Clinics of North America, 2019, 103(1): 111-123.DOI:10.1016/j.mcna.2018.08.010.
[30]王生, 黄晓星, 余鹏飞, 等.肠道菌群失调与结肠癌发生发展之间关系的研究进展[J].中国药理学通报, 2014, 30(8): 1045-1049.DOI:10.3969/j.issn.1001-1978.
[31]CORTES-MARTIN A, GARCIA-VILLALBA R, GONZALEZ-SARRIAS A,et al.The gut microbiota urolithin metabotypes revisited: the human metabolism of ellagic acid is mainly determined by aging[J].Food &Function, 2018, 9(8): 4100-4106.DOI:10.1039/C8FO00956B.
[32]武瑞赟, 刘蕾, 张金兰, 等.鲟鱼硫酸软骨素对结直肠癌细胞抑制作用[J].食品科学, 2017, 38(21): 223-229.DOI:10.7506/spkx1002-6630-201721036.
[33]LI Y, YANG Y, SHEN F, et al.Partitioning biochar properties to elucidate their contributions to bacterial and fungal community composition of purple soil[J].The Science of the Total Environment,2019, 648: 1333-1341.DOI:10.1016/j.scitotenv.2018.08.222.
[34]ZHANG M, MA W, ZHANG J, et al.Analysis of gut microbiota profiles and microbe-disease associations in children with autism spectrum disorders in China[J].Scientific Reports, 2018, 8(1): 13981.DOI:10.1038/s41598-018-32219-2.
[35]XI Y, YUEFEN P, WEI W, et al.Analysis of prognosis, genome,microbiome, and microbial metabolome in different sites of colorectal cancer[J].Journal of Translational Medicine, 2019, 17(1): 353.DOI:10.1186/s12967-019-2102-1.
[36]BURNS M B, MONTASSIER E, ABRAHANTE J, et al.Colorectal cancer mutational profiles correlate with defined microbial communities in the tumor microenvironment[J].PLoS Genetics, 2018,14(6): e1007376.DOI:10.1371/journal.pgen.1007376.
[37]COATSWORTH H, CAICEDO P A, VAN ROSSUM T, et al.The composition of midgut bacteria in Aedes aegypti (Diptera: Culicidae)that are naturally susceptible or refractory to dengue viruses[J].Journal of Insect Science, 2018, 18(6): 1-7.DOI:10.1093/jisesa/iey118.
[38]VETIZOU M, PITT J M, DAILLERE R, et al.Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota[J].Science, 2015, 350: 1079-1084.DOI:10.1126/science.aad1329.
[39]LÜ J, JIA Y, LI J, et al.Gegen Qinlian decoction enhances the effect of PD-1 blockade in colorectal cancer with microsatellite stability by remodelling the gut microbiota and the tumour microenvironment[J].Cell Death & Disease, 2019, 10(6): 415.DOI:10.1038/s41419-019-1638-6.
[40]ORMEROD K L, WOOD D L, LACHNER N, et al.Genomic characterization of the uncultured Bacteroidales family S24-7 inhabiting the guts of homeothermic animals[J].Microbiome, 2016,4(1): 36.DOI:10.1186/s40168-016-0181-2.
[41]WIERZBICKA-WOS A, HENNEBERGER R, BATISTA-GARCIA R A, et al.Biochemical characterization of a novel monospecific endo-beta-1,4-glucanase belonging to GH family 5 from a rhizosphere metagenomic library[J].Front Microbiol, 2019, 10: 1342.DOI:10.3389/fmicb.2019.01342.
[42]LI Jun, SUNG C Y J, LEE N, et al.Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J].Proceedings of the National Academy of Sciences, 2016, 113(9):E1306-E1315.DOI:10.1073/pnas.1518189113.
[43]李敏.肠道菌群对葡聚糖硫酸钠诱导的急性结肠炎小鼠模型的影响[D].上海: 上海交通大学, 2017: 35.
[44]张任帅.松花粉与松花粉多糖对小鼠菌群代谢及相关代谢影响的研究[D].济南: 山东师范大学, 2019: 38-39.