新疆是远近闻名的瓜果之乡。香梨是新疆的特色果品之一,主产区位于新疆巴音郭楞蒙古自治州和阿克苏地区。其果实营养丰富,并具有皮薄肉脆、汁多渣少、含糖量高、清甜可口、耐贮藏等优良品质,深受国内外广大消费者的喜爱[1]。香梨果实表面覆有较厚的连续疏水性表皮层,该表皮层由角质层和蜡质层组成[2]。蜡质层渗透或沉积在角质矩阵中,是植物抵抗外部环境的最主要部分[3-4]。蜡质的主要作用是防止水分散失[5-6]、机械损伤和微生物入侵[7-8]等。植物表皮蜡质成分复杂,主要由碳原子数在20~34之间的特长链脂肪酸及其衍生物(包括烷烃、醇类、醛类、脂肪酸和酯类等)组成,其成分和分布因物种、组织及器官的不同而存在差异[9]。
乙烯(C2H4)是一种结构简单的不饱和烃,在跃变型果实成熟衰老过程中发挥着重要作用,被认为是果实成熟衰老的启动因子[10]。乙烯利(2-氯乙基膦酸)作为一种人工合成的释放乙烯气体的低毒有机磷植物生长调节剂农药,能促进呼吸跃变型果实成熟过程中内源乙烯的产生[11],已应用于苹果[12]、软儿梨[13]等果蔬的采后催熟处理。香梨是典型的呼吸跃变型果实,在贮藏期内有两个呼吸峰[14-15],且由于其采收季节正值高温时节,采后品质极易发生不良变化,对乙烯敏感,各项生理活动在一定程度上受到乙烯的调控作用[10]。
乙烯利能显著提高呼吸跃变型果实的乙烯释放量并促使其呼吸高峰提前发生[16]。贾晓辉等[17]对软肉梨施用乙烯利并在低温下贮藏,发现乙烯利有效提高了乙烯释放量,并使呼吸跃变提前。李志强等[18]对成熟度不一致的菊水梨施用乙烯利,观察其贮藏品质与生理变化,发现梨果的呼吸作用发生改变,其CO2释放量以及乙烯释放速率先快速增长,随后又呈现显著下降趋势。而高质量浓度的外源乙烯会起到反作用,抑制内源乙烯的生成[16]。乙烯利还能够改善果蔬的质地与风味,并且不会对其产生任何不良影响,可以用于增加其商品价值和食用品质。Zhang Lihua等[19]发现外源乙烯可加速猕猴桃CO2的产生,但对果实的肉色无任何不良影响。
一些研究报道了乙烯会影响表皮蜡质组分的变化。Cajuste等[20]研究发现,采后乙烯利处理能使柑橘果实表皮总蜡质提取量升高,且诱导表皮蜡质结构的改变。Ju Zhiguo等[21]发现用200 mg/L乙烯利对苹果进行采前处理会增加其内部乙烯产生,并提高蜡质提取量和α-法呢烯的积累。Li Fujun等[22]的研究表明乙烯利能够调节苹果果实冷藏期间的总蜡质提取量及醇类、烯烃、烷烃和脂肪酸相对含量。综上,乙烯利可以改善果蔬后熟过程中的品质、色泽、风味等,也可以改变呼吸跃变型果实的乙烯释放量,并使其呼吸高峰提前发生,加速果蔬成熟衰老。然而鲜有研究建立果蔬成熟过程中生理代谢、品质属性变化与表皮蜡质变化关系的重要数据,本研究通过测定不同质量浓度乙烯利处理的香梨在冷藏条件下生理变化和表皮蜡质变化,分析外源乙烯加速香梨成熟的过程中对表皮蜡质的影响,进而为探究表皮蜡质对香梨贮藏保鲜的作用机理提供依据。
1 材料与方法
1.1 材料与试剂
实验采用的香梨摘自新疆生产建设兵团第二师第28团(北纬41°45',东经86°8')。在9月中旬采摘,选择果形整齐、色泽均匀、无机械损伤、无病虫害的香梨单果包装(考白纸包裹,放入网袋),立即送至实验室。
质量分数40%乙烯利水剂 石河子农药市场;三氯甲烷、二氯甲烷、正庚烷、体积分数14%三氟化硼-甲醇(均为色谱纯) 天津市光复精细化工研究所。
1.2 仪器与设备
BZY-1精密电子天平 德国赛多利斯科技有限公司;Multifuge X1R高速冷冻离心机 北京金业德祥科技有限公司;HH-8型电热恒温水浴锅 国华电器有限公司;PHS-3C pH计、DDS-320型电导率仪 上海仪电科学仪器股份有限公司;DM-5毛细管柱 北京迪马科技有限公司;UV-2600紫外-可见分光光度计、GC-16A气相色谱(gas chromatography,GC)仪 日本岛津公司;7890A GC-5975质谱(mass spectrometry,MS)仪美国安捷伦公司。
1.3 方法
1.3.1 原料处理
乙烯利处理香梨参考王文娟[23]的方法,并稍作修改。将乙烯利用蒸馏水分别配成250、500 mg/L和1 000 mg/L的溶液对香梨果实进行分组浸泡处理(料液比为1∶2.5),常温下浸泡3 min后取出,自然晾干,以未经处理的香梨作为对照(CK)。冷藏(0 ℃、相对湿度(85±5)%)120 d,每20 d测定香梨表皮总蜡质提取量、组分变化及其生理指标,生理指标包括相对电导率、水溶性果胶(water soluble pectin,WSP)质量分数、纤维素质量分数、多聚半乳糖醛酸酶(polygalacturonase,PG)和纤维素酶(cellulase,CX)活力(以上指标均能表征香梨外表皮细胞壁的变化情况,而蜡质作为紧贴表皮细胞外壁的角质膜[24],其变化可能会影响细胞壁的变化)以及呼吸强度和乙烯释放速率。
1.3.2 呼吸强度测定
香梨呼吸强度采用静置法[25]测定,以每小时每千克果实释放的CO2质量表示呼吸强度。取香梨样品1 kg,与装有20 mL 0.4 mol/L氢氧化钠溶液的培养皿中一并密封静置于干燥器中1 h。然后用0.1 mol/L的草酸溶液滴定氢氧化钠溶液(滴定前加5 mL饱和氯化钡溶液),以酚酞为指示剂,记录指示剂变色时消耗草酸溶液的体积(V2/mL)。依照上述方法做空白实验(只放置20 mL 0.4 mol/L氢氧化钠溶液的干燥器),记录空白组滴定草酸溶液的用量(V1/mL)。呼吸强度按式(1)计算。
式中:c表示草酸溶液浓度/(mol/L);m表示库尔勒香梨质量/kg;t表示放置时间/h;22表示测定中氢氧化钠与CO2的质量转换数。
1.3.3 乙烯释放量测定
香梨乙烯释放量测定参考王甲水等[26]的方法,条件设置略作修改。采用毛细管柱气相色谱法测定,以外标法峰面积定量,以保留时间定性。色谱条件:进样口温度100 ℃;色谱柱温度120 ℃;氢火焰离子化检测器温度150 ℃;载气He流速60 mL/min;燃气H2流速30 mL/min;空气流速400 mL/min,不分流进样。香梨乙烯释放量用释放速率(式(2))表示。
式中:c表示待测香梨释放的乙烯体积浓度/(μL/L)(由峰面积带入标准曲线求得);V表示标本缸密闭的空间体积与待测香梨体积之差(排水法测定)/L;m表示香梨的质量/kg;t表示测定时间/h。
1.3.4 WSP、纤维素质量分数测定
香梨WSP、纤维素质量分数分别采用曹建康等[25]的咔唑比色法、称质量法测定。
1.3.5 PG、CX活力测定
PG、CX活力测定采用曹建康等[25]的比色法,PG活力以每小时每克果蔬组织样品37 ℃催化多聚半乳糖醛酸水解生成半乳糖醛酸的质量表示;CX活力以每小时每克果蔬组织样品在37 ℃催化羧甲基纤维素水解形成还原糖的质量表示。以上单位均为μg/(h·g)。
1.3.6 相对电导率测定
通过DDS-320电导率仪在室温下测定香梨活组织的电导率C1/(S/m)和煮沸灭活(30 min)后组织的电导率C2/(S/m)。相对电导率按公式(3)进行计算。
1.3.7 香梨表皮蜡质测定
1.3.7.1 蜡质提取
取各组梨果实3 个,用蒸馏水清洗干净后,按料液比1∶2.5全部浸没于提取溶剂(160 mL三氯甲烷+80 mL二氯甲烷)中,保持75 s,此过程不可破坏梨果表面。将提取后的溶液自然风干,得到蜡质,按公式(4)计算总蜡质提取量。
1.3.7.2 香梨蜡质组分检测
对提取的蜡质进行甲酯化后测定其组分,甲酯化方法:取约50 mg蜡样于50 mL磨口三角瓶,连接冷凝回流装置,加入5 mL、体积分数14%三氟化硼-甲醇溶液,70 ℃水浴回流5 min,使甲酯化完全。从冷凝器上端加入5 mL正庚烷继续回流1 min,取出冷却,加入一定量的饱和氯化钠溶液(用超纯水配制),静置分层,吸取上层正庚烷相于装有0.4 g无水硫酸钠(预先50 ℃烘干)的具塞比色管中,待用。
蜡质组分检测:参照李珍慈等[27]的方法。GC条件:采用石英毛细管色谱柱HP-5(30 m×0.25 mm,0.25 μm);载气:He,流速1.1 mL/min,线速率40 cm/s;进样量:1.0 μL,不分流进样;进样口温度:250 ℃;检测室温度:300 ℃;程序升温:初始温度80 ℃,以4 ℃/min 升温至290 ℃,恒温20 min。MS条件:电离方式:电子电离;离子源温度:230 ℃;传输线温度220 ℃;四极杆温度150 ℃;电子轰击能量:70 eV;质量扫描范围35~600 m/z。
1.4 数据处理与分析
每个处理组均设3 个平行实验,采用SPSS 24.0软件进行统计分析,结果表示为平均值±标准差,利用Duncan氏多重比较进行差异显著性分析,P<0.05表示差异显著,相关性分析选择皮尔逊系数法。采用Origin 2017软件作图。
2 结果与分析
2.1 乙烯利处理对冷藏香梨生理变化的影响
2.1.1 呼吸强度和乙烯释放量的变化
呼吸强度和乙烯释放量是反映果蔬采后贮藏保鲜效果的重要指标。果蔬呼吸作用其实是将自身有机物氧化为CO2等无机物并生成ATP的过程。因此,果蔬的呼吸作用越强烈,其氧化衰老的速率越快。如图1A、B所示,与CK相比,不同质量浓度的乙烯利均使香梨在贮藏40 d时的CO2释放速率和贮藏60 d时的乙烯释放速率显著增加(P<0.05),使呼吸高峰和乙烯释放高峰提前,其中质量浓度为1 000 mg/L时效果最突出。有研究发现,乙烯利可以提高秋香梨果实的呼吸速率[28]和‘金冠’苹果果实乙烯释放量[29],这与本实验研究结果一致。
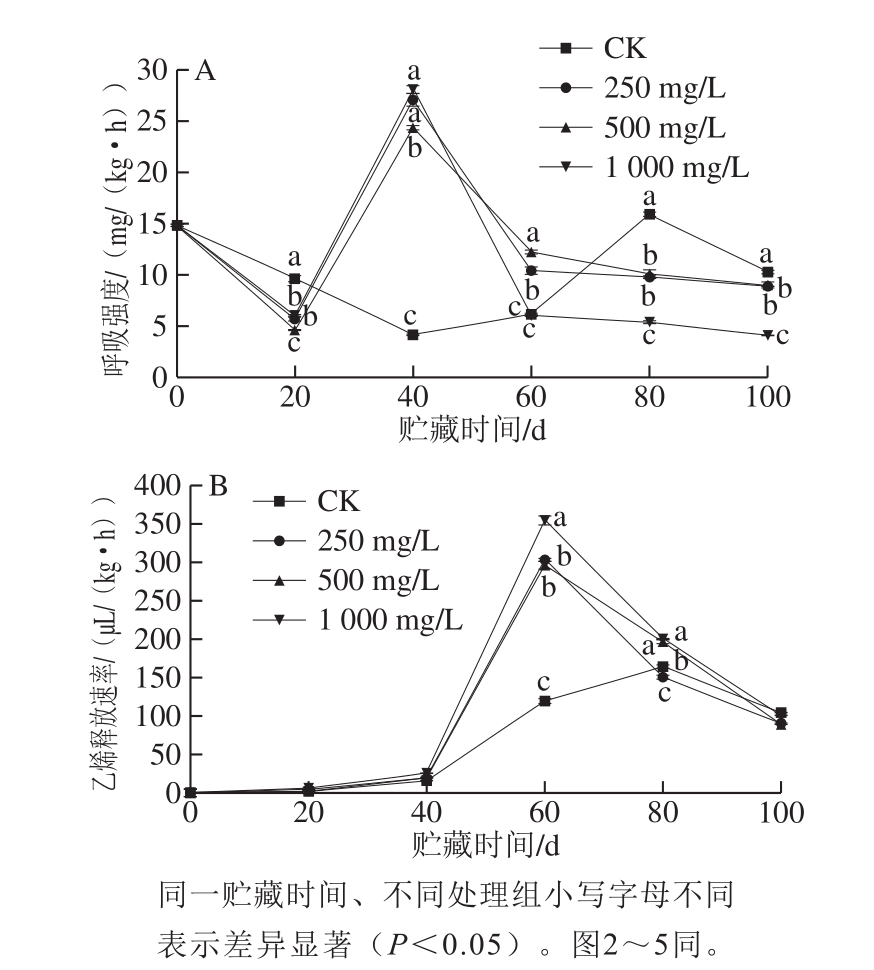
图1 不同质量浓度乙烯利对冷藏香梨呼吸强度(A)和乙烯释放速率(B)的影响
Fig.1 Effects of different concentrations of ethephon on the respiratory rate (A) and ethylene release rate (B) of refrigerated Korla fragrant pear
2.1.2 WSP和纤维素质量分数的变化
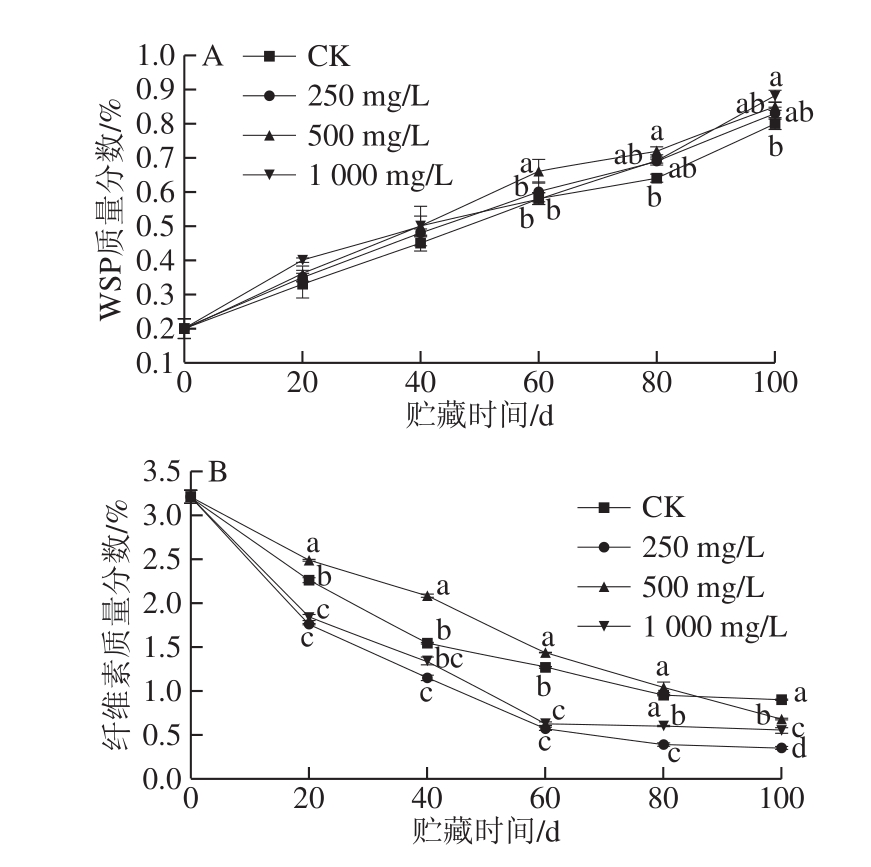
图2 不同质量浓度乙烯利对冷藏香梨WSP(A)和纤维素(B)质量分数的影响
Fig.2 Effects of different concentrations of ethephon on WSP (A) and cellulose (B) contents of refrigerated Korla fragrant pear
细胞壁降解是影响果实软化和质地变化的主要因素[30-31]。WSP是典型的在体内溶解但保留在质外体中的壁聚合物,可以通过水提取纯化的细胞壁获得,通常在果实软化期间,细胞壁多糖的解聚伴随着WSP水平的增加[32-33]。由图2A可知,在整个贮藏过程,4 组中WSP质量分数均缓慢增加。贮藏60 d时,500 mg/L组WSP质量分数显著高于其他3 组(P<0.05);贮藏80 d时,500 mg/L乙烯利处理组WSP质量分数显著高于CK组(P<0.05);贮藏100 d时,1 000 mg/L乙烯利处理组WSP质量分数显著高于CK组(P<0.05)。综上结果,贮藏后期乙烯利对WSP的生成起到促进作用,进而加速了香梨的软化。
纤维素是植物体中最广泛的骨架多糖,占植物细胞壁的50%左右,常与木质、角质、栓质以及果胶等组成复合纤维素,对果实起保护作用,因此纤维素的降解通常伴随着果实的后熟软化[34]。由图2B看出,随着贮藏时间的延长,4 组香梨果实中纤维素质量分数均迅速降低。与CK相比,在贮藏0~60 d期间,500 mg/L乙烯利处理显著抑制了纤维素质量分数的降低(P<0.05)。在整个贮藏过程中,250、1 000 mg/L乙烯利处理则显著促进了香梨纤维素降解(P<0.05),其中质量浓度为250 mg/L时促进降解的效果更明显,这与邵远志等[35]对番木瓜的研究结论一致。以上结果说明乙烯利处理对香梨纤维素质量分数降低有促进或抑制作用,与乙烯利质量浓度有关。
2.1.3 PG和CX活力变化
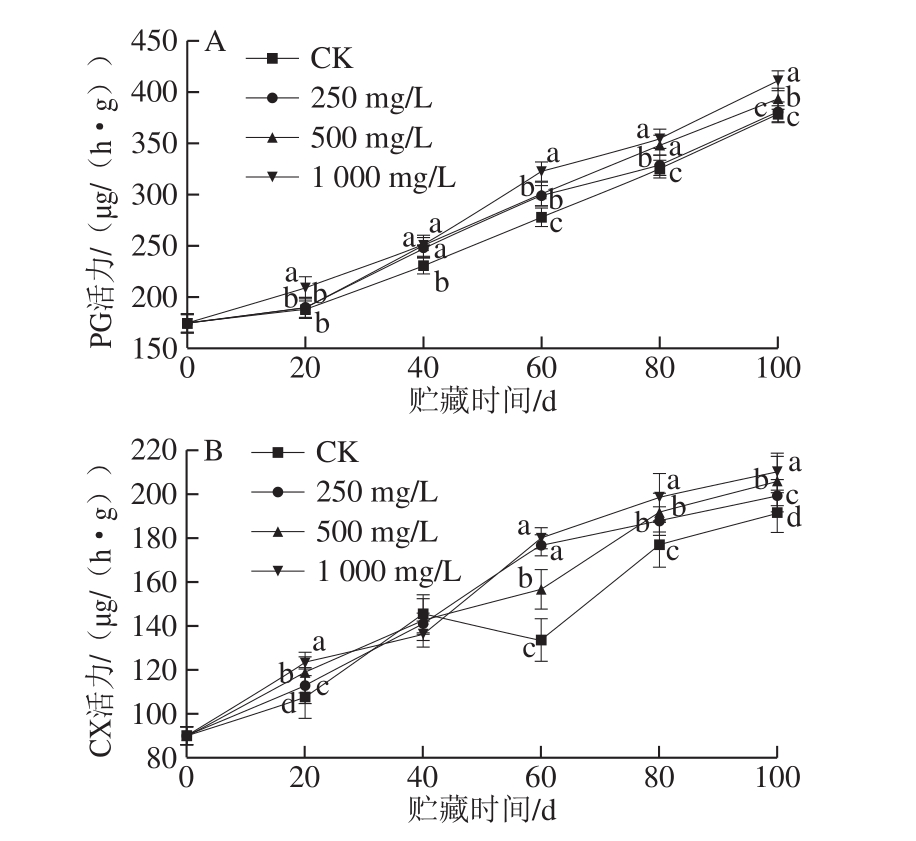
图3 不同质量浓度乙烯利对冷藏香梨PG(A)和CX(B)活力的影响
Fig.3 Effects of different concentrations of ethephon on PG (A) and CX (B) activities of refrigerated Korla fragrant pear
PG是一类重要的水解酶,对果实软化起着决定作用,是影响果实成熟的关键酶[36]。如图3所示,4 组香梨的PG和CX活力在贮藏期间均呈上升趋势;1 000 mg/L乙烯利处理组在贮藏过程中PG和CX活力整体上显著高于其他3 组(P<0.05)。贮藏40 d后,250、500 mg/L乙烯利处理组PG活力均高于CK组;贮藏60 d后,250、500 mg/L处理组的CX活力均显著高于CK组(P<0.05)。以上结果说明乙烯利对香梨中PG和CX活力的维持有积极作用,1 000 mg/L效果最为显著。
2.1.4 相对电导率变化
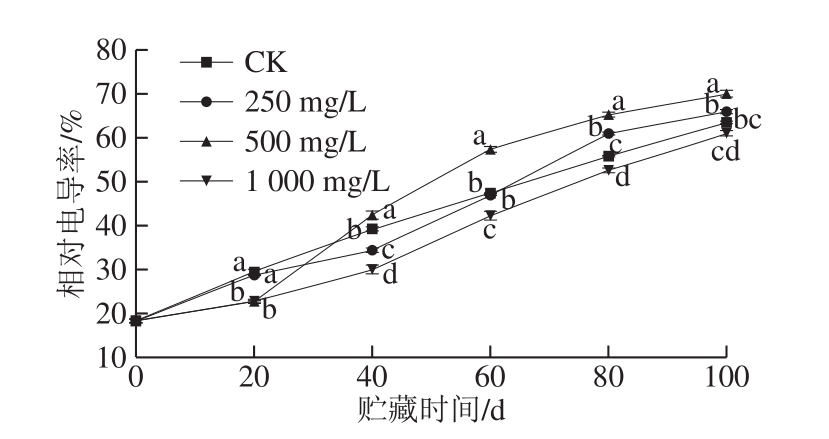
图4 不同质量浓度乙烯利对冷藏香梨相对电导率的影响
Fig.4 Effects of different concentrations of ethephon on the relative conductivity of refrigerated Korla fragrant pear
相对电导率是反映果实细胞渗透性的指标[1],细胞渗透性越大即相对电导率也越大,说明果实的细胞壁在慢慢被降解。由图4可知,4 组香梨果实的相对电导率均随贮藏时间的延长呈现上升趋势。贮藏40 d后,500 mg/L乙烯利处理组相对电导率显著高于其他3 组(P<0.05),说明500 mg/L乙烯利对香梨相对电导率的升高有促进作用。而在整个贮藏过程中,与CK相比,1 000 mg/L乙烯利处理显著抑制了香梨相对电导率的增大,与500 mg/L对香梨相对电导率的影响相反。
2.2 乙烯利对香梨表皮总蜡质提取量及组分变化的影响
2.2.1 总蜡质提取量变化
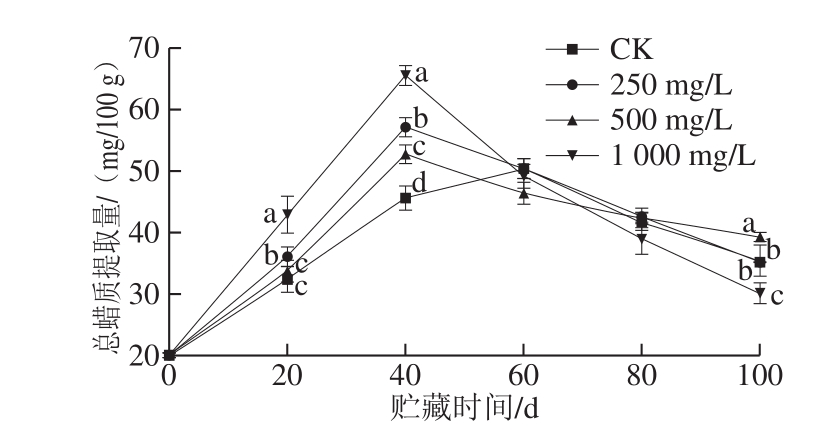
图5 不同质量浓度乙烯利对冷藏香梨总蜡质提取量的影响
Fig.5 Effects of different concentrations of ethephon on the extraction yield of total wax from refrigerated Korla fragrant pear
如图5所示,4 组香梨总蜡质提取量均呈现先增后减趋势,与Veraverbeke等研究的苹果总蜡质提取量在贮藏期间下降[37]不一致,可能与水果种类有关。在贮藏0~40 d之间,与CK相比,不同质量浓度乙烯利处理均显著增加了蜡质产量(P<0.05)。乙烯利处理的香梨蜡质提取量在贮藏40 d达到峰值,且峰值从大到小排列顺序为:1 000 mg/L乙烯利处理组>250 mg/L乙烯利处理组>500 mg/L乙烯利处理组(P<0.05),而CK组在贮藏60 d时达到峰值。
2.2.2 蜡质组分及其物质相对含量变化
烷烃对于果蔬表皮结晶蜡质结构的形成是必不可少的[38-39]。由图6可知,烷烃是香梨蜡质组分中占比最高的物质。与CK相比,1 000 mg/L乙烯利处理抑制了贮藏前期烷烃相对含量的增加,在整个贮藏过程中其占比呈下降趋势,且均低于其他3 组。250、500 mg/L乙烯利处理组烷烃相对含量分别在贮藏20、40 d时出现峰值后缓慢降低,CK组则是在贮藏40 d时出现峰值后缓慢下降,但整个贮藏过程中,这3 组烷烃相对含量无明显差异。
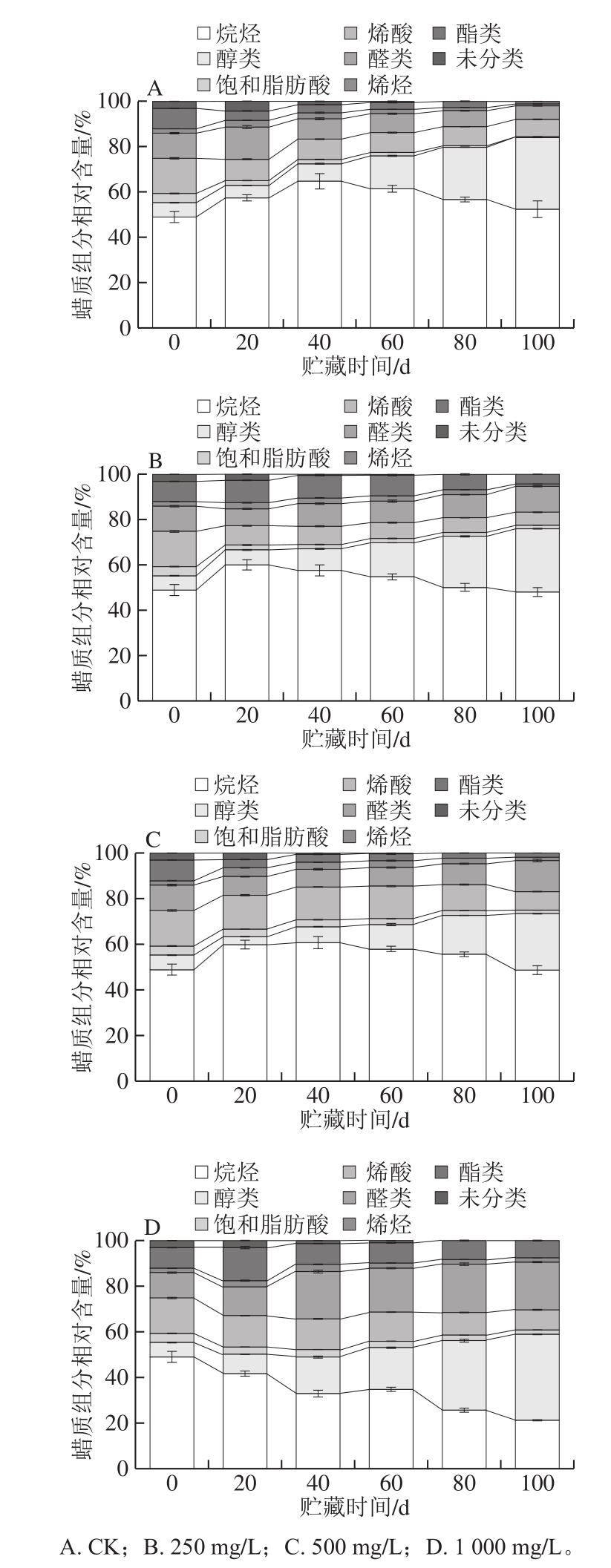
图6 不同质量浓度乙烯利对冷藏香梨蜡质组分相对含量的影响
Fig.6 Effects of different concentrations of ethephon on the relative contents of waxy components in refrigerated Korla fragrant pear
研究表明,二十九烷-10-醇相对含量的增加可能会促进某些苹果品种的光泽度和油腻感[40]。贮藏过程中,香梨醇类相对含量呈上升趋势。与CK组相比,1 000 mg/L乙烯利处理促进了醇类相对含量的上升,而500 mg/L乙烯利处理抑制了醇类相对含量的上升。并且观察到1 000 mg/L乙烯利处理组香梨表皮油腻感比CK组更早出现,也许与某种醇类物质性对含量增加相关。
脂肪酸是表皮蜡的丰富成分,并且大多数表皮脂肪酸源自C16和C18游离脂肪酸链的延长[41]。香梨蜡质组分中的脂肪酸分为饱和脂肪酸和烯酸,二者相对含量均随贮藏时间的延长而降低。与CK相比,500 mg/L和1000 mg/L乙烯利处理均抑制了饱和脂肪酸和不饱和脂肪酸(烯酸)相对含量的降低;贮藏40 d后,250 mg/L乙烯利处理组烯酸相对含量低于CK组。
香梨蜡质组分中检测到的醛类物质由饱和醛、萜烯醛和缩醛组成。萜烯醛是指萜类化合物的一种;缩醛是一类有机化合物的统称,是由一分子醛与两分子醇类缩合的产物。在贮藏后期,乙烯利处理组香梨中醛类相对含量增加,也高于CK组;贮藏20 d后,1 000 mg/L乙烯利处理组醛类相对含量高于其他3 组。在整个贮藏过程,香梨蜡质组分中烯烃相对含量先增加后减少,乙烯利处理对烯烃的生成均有一定促进作用,贮藏至100 d时,500、1 000 mg/L乙烯利处理组烯烃相对含量高于CK组。
与CK组相比,1 000 mg/L和250 mg/L乙烯利处理促进了香梨蜡质组分中酯类物质的相对含量,1 000 mg/L乙烯利处理组酯类在贮藏20 d时出现峰值,且在整个贮藏过程中,其相对含量高于其他3 组,保持在较高水平。香梨蜡质组分中还有少量未分类的物质,这些物质存在于贮藏的前60 d,并且随着贮藏时间的延长其相对含量逐渐降低。
表1 不同质量浓度乙烯利对冷藏香梨蜡质组分相对含量的影响
Table 1 Effects of different concentrations of ethephon on the relative contents of wax components in refrigerated Korla fragrant pear
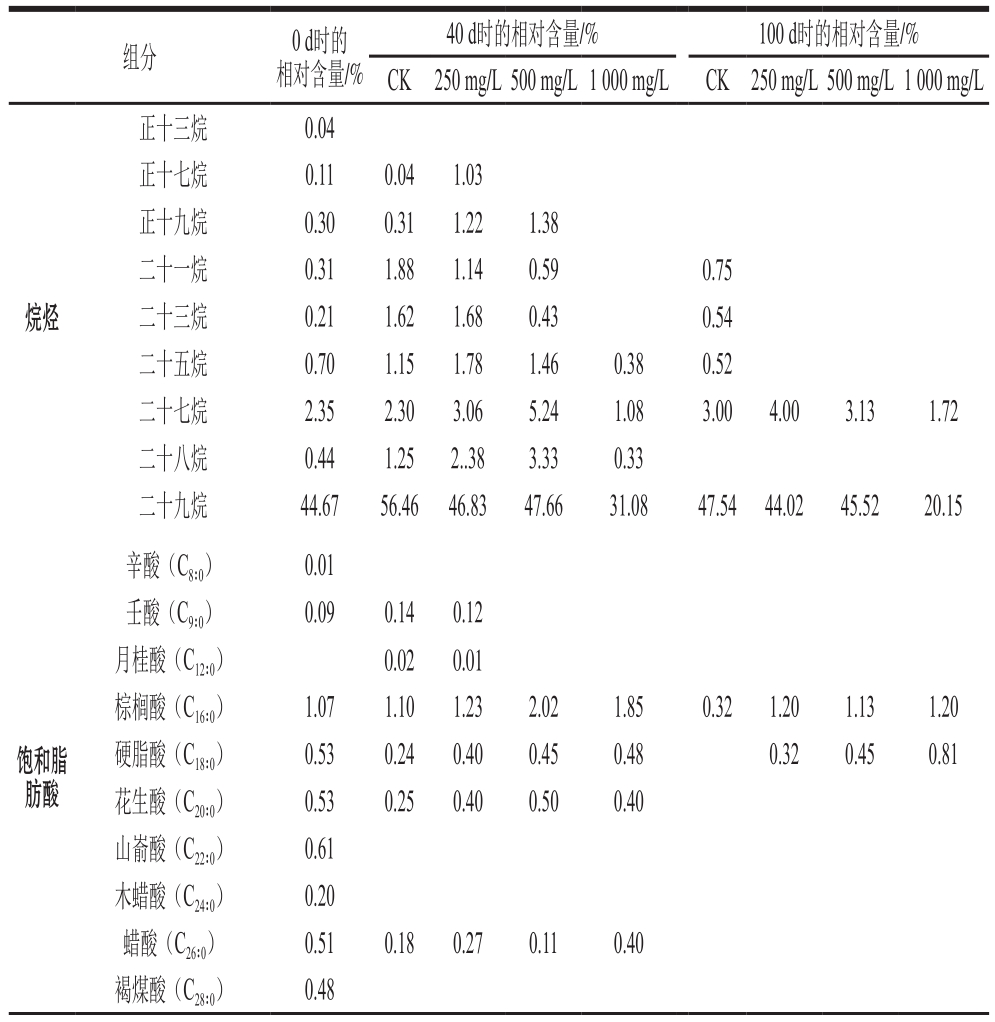
组分 0 d时的相对含量/%40 d时的相对含量/% 100 d时的相对含量/%CK 250 mg/L500 mg/L1 000 mg/L CK 250 mg/L500 mg/L1 000 mg/L烷烃正十三烷 0.04正十七烷 0.11 0.04 1.03正十九烷 0.30 0.31 1.22 1.38二十一烷 0.31 1.88 1.14 0.59 0.75二十三烷 0.21 1.62 1.68 0.43 0.54二十五烷 0.70 1.15 1.78 1.46 0.38 0.52二十七烷 2.35 2.30 3.06 5.24 1.08 3.00 4.00 3.13 1.72二十八烷 0.44 1.25 2..38 3.33 0.33二十九烷 44.67 56.46 46.83 47.66 31.08 47.54 44.02 45.52 20.15饱和脂肪酸辛酸(C8∶0) 0.01壬酸(C9∶0) 0.09 0.14 0.12月桂酸(C12∶0) 0.02 0.01棕榈酸(C16∶0) 1.07 1.10 1.23 2.02 1.85 0.32 1.20 1.13 1.20硬脂酸(C18∶0) 0.53 0.24 0.40 0.45 0.48 0.32 0.45 0.81花生酸(C20∶0) 0.53 0.25 0.40 0.50 0.40山嵛酸(C22∶0) 0.61木蜡酸(C24∶0) 0.20蜡酸(C26∶0) 0.51 0.18 0.27 0.11 0.40褐煤酸(C28∶0) 0.48
续表1
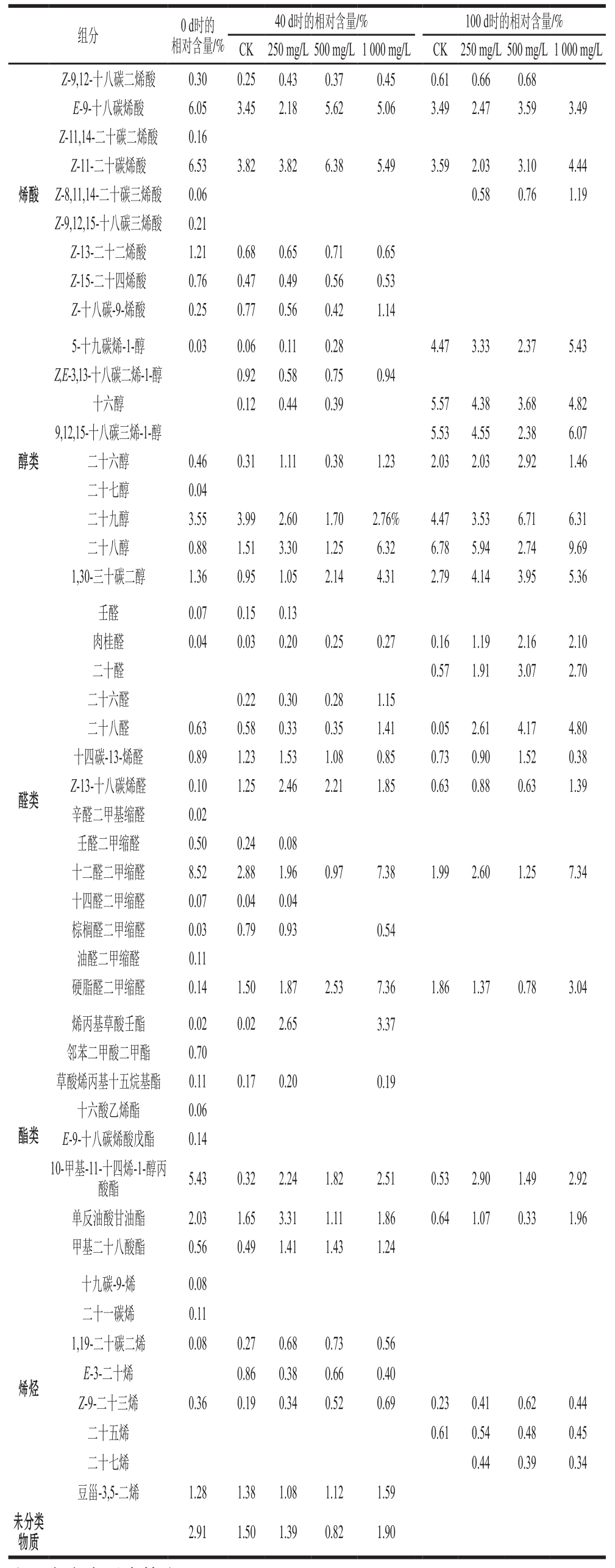
注:空白表示未检出。
组分 0 d时的相对含量/%40 d时的相对含量/% 100 d时的相对含量/%CK 250 mg/L500 mg/L1 000 mg/L CK 250 mg/L500 mg/L1 000 mg/L Z-9,12-十八碳二烯酸 0.30 0.25 0.43 0.37 0.45 0.61 0.66 0.68 E-9-十八碳烯酸 6.05 3.45 2.18 5.62 5.06 3.49 2.47 3.59 3.49 Z-11,14-二十碳二烯酸 0.16 Z-11-二十碳烯酸 6.53 3.82 3.82 6.38 5.49 3.59 2.03 3.10 4.44 Z-8,11,14-二十碳三烯酸 0.06 0.58 0.76 1.19 Z-9,12,15-十八碳三烯酸 0.21 Z-13-二十二烯酸 1.21 0.68 0.65 0.71 0.65 Z-15-二十四烯酸 0.76 0.47 0.49 0.56 0.53 Z-十八碳-9-烯酸 0.25 0.77 0.56 0.42 1.14烯酸醇类5-十九碳烯-1-醇 0.03 0.06 0.11 0.28 4.47 3.33 2.37 5.43 Z,E-3,13-十八碳二烯-1-醇 0.92 0.58 0.75 0.94十六醇 0.12 0.44 0.39 5.57 4.38 3.68 4.82 9,12,15-十八碳三烯-1-醇 5.53 4.55 2.38 6.07二十六醇 0.46 0.31 1.11 0.38 1.23 2.03 2.03 2.92 1.46二十七醇 0.04二十九醇 3.55 3.99 2.60 1.70 2.76% 4.47 3.53 6.71 6.31二十八醇 0.88 1.51 3.30 1.25 6.32 6.78 5.94 2.74 9.69 1,30-三十碳二醇 1.36 0.95 1.05 2.14 4.31 2.79 4.14 3.95 5.36醛类壬醛 0.07 0.15 0.13肉桂醛 0.04 0.03 0.20 0.25 0.27 0.16 1.19 2.16 2.10二十醛 0.57 1.91 3.07 2.70二十六醛 0.22 0.30 0.28 1.15二十八醛 0.63 0.58 0.33 0.35 1.41 0.05 2.61 4.17 4.80十四碳-13-烯醛 0.89 1.23 1.53 1.08 0.85 0.73 0.90 1.52 0.38 Z-13-十八碳烯醛 0.10 1.25 2.46 2.21 1.85 0.63 0.88 0.63 1.39辛醛二甲基缩醛 0.02壬醛二甲缩醛 0.50 0.24 0.08十二醛二甲缩醛 8.52 2.88 1.96 0.97 7.38 1.99 2.60 1.25 7.34十四醛二甲缩醛 0.07 0.04 0.04棕榈醛二甲缩醛 0.03 0.79 0.93 0.54油醛二甲缩醛 0.11硬脂醛二甲缩醛 0.14 1.50 1.87 2.53 7.36 1.86 1.37 0.78 3.04酯类烯丙基草酸壬酯 0.02 0.02 2.65 3.37邻苯二甲酸二甲酯 0.70草酸烯丙基十五烷基酯 0.11 0.17 0.20 0.19十六酸乙烯酯 0.06 E-9-十八碳烯酸戊酯 0.14 10-甲基-11-十四烯-1-醇丙酸酯 5.43 0.32 2.24 1.82 2.51 0.53 2.90 1.49 2.92单反油酸甘油酯 2.03 1.65 3.31 1.11 1.86 0.64 1.07 0.33 1.96甲基二十八酸酯 0.56 0.49 1.41 1.43 1.24十九碳-9-烯 0.08二十一碳烯 0.11 1,19-二十碳二烯 0.08 0.27 0.68 0.73 0.56 E-3-二十烯 0.86 0.38 0.66 0.40 Z-9-二十三烯 0.36 0.19 0.34 0.52 0.69 0.23 0.41 0.62 0.44二十五烯 0.61 0.54 0.48 0.45二十七烯 0.44 0.39 0.34豆甾-3,5-二烯 1.28 1.38 1.08 1.12 1.59未分类物质 2.91 1.50 1.39 0.82 1.90烯烃
表1为不同质量浓度乙烯利处理下香梨表皮蜡质各个组分在贮藏0、40 d和100 d时的相对含量变化。碳氢化合物、脂肪酸、仲醇和酮类代表了‘红富士’角质蜡的成分[40]。对梨的研究表明,烷烃和伯醇是主要的蜡组分[42]。由表1可知,香梨蜡质中烷烃主要以13~29奇数碳的正构烷烃为主,其中二十九烷是香梨蜡质中相对含量最高的物质。在贮藏过程中乙烯利处理组中二十九烷相对含量较低,1 000 mg/L乙烯利处理组中最低。与CK组相比,乙烯利处理还减少了碳原子数较少烷烃的相对含量,贮藏100 d时,25碳以内的烷烃组分在乙烯利处理组中均未检测到。饱和脂肪酸中相对含量最高的为棕榈酸(C16∶0),烯酸相对含量最高的为E-9-十八碳烯酸和Z-11-二十碳烯酸。醇类以伯醇为主,相对含量最高的为二十九醇。贮藏过程中,与CK组相比,各乙烯利处理组醇类物质中二十八醇和1 000 mg/L乙烯利处理组中1,30-三十碳二醇相对含量明显增加。醛类以十二醛二甲缩醛相对含量最高;酯类和烯烃相对含量最高的分别是10-甲基-11-十四烯-1-醇丙酸酯和豆甾-3,5-二烯。
2.3 香梨表皮蜡质组分相对含量变化与生理变化的相关性分析
表2 香梨蜡质组分相对含量变化与生理变化相关系数
Table 2 Correlation coefficients between changes in relative contents of wax components in Korla fragrant pear and its physiological indexes
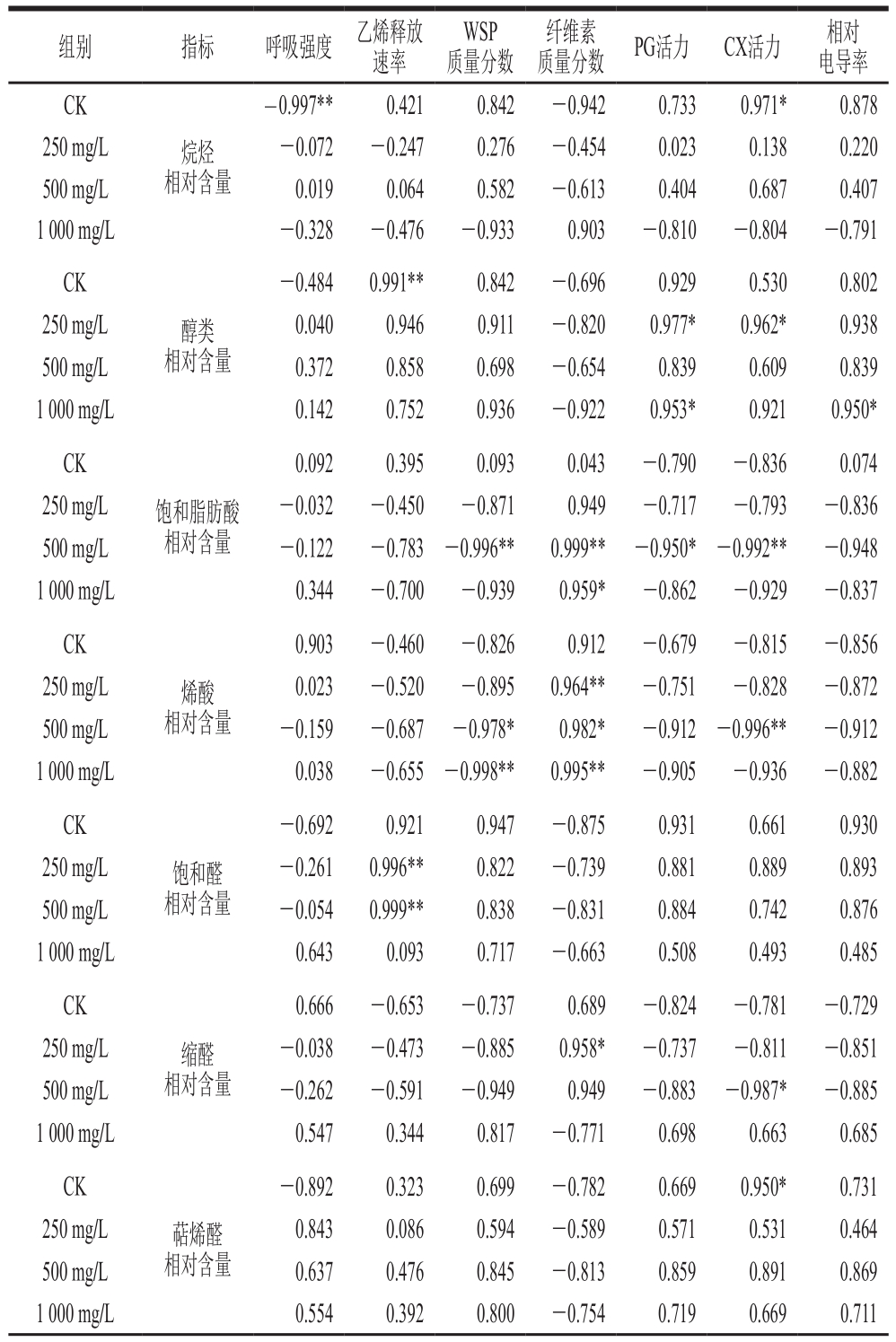
组别 指标 呼吸强度 乙烯释放速率WSP质量分数纤维素质量分数 PG活力 CX活力 相对电导率CK烷烃相对含量-0.997** 0.421 0.842 -0.942 0.733 0.971* 0.878 250 mg/L -0.072 -0.247 0.276 -0.454 0.023 0.138 0.220 500 mg/L 0.019 0.064 0.582 -0.613 0.404 0.687 0.407 1 000 mg/L -0.328 -0.476 -0.933 0.903 -0.810 -0.804 -0.791 CK醇类相对含量-0.484 0.991** 0.842 -0.696 0.929 0.530 0.802 250 mg/L 0.040 0.946 0.911 -0.820 0.977* 0.962* 0.938 500 mg/L 0.372 0.858 0.698 -0.654 0.839 0.609 0.839 1 000 mg/L 0.142 0.752 0.936 -0.922 0.953* 0.921 0.950*CK饱和脂肪酸相对含量0.092 0.395 0.093 0.043 -0.790 -0.836 0.074 250 mg/L -0.032 -0.450 -0.871 0.949 -0.717 -0.793 -0.836 500 mg/L -0.122 -0.783 -0.996** 0.999** -0.950* -0.992** -0.948 1 000 mg/L 0.344 -0.700 -0.939 0.959* -0.862 -0.929 -0.837 CK烯酸相对含量0.903 -0.460 -0.826 0.912 -0.679 -0.815 -0.856 250 mg/L 0.023 -0.520 -0.895 0.964** -0.751 -0.828 -0.872 500 mg/L -0.159 -0.687 -0.978* 0.982* -0.912 -0.996** -0.912 1 000 mg/L 0.038 -0.655 -0.998** 0.995** -0.905 -0.936 -0.882 CK饱和醛相对含量-0.692 0.921 0.947 -0.875 0.931 0.661 0.930 250 mg/L -0.261 0.996** 0.822 -0.739 0.881 0.889 0.893 500 mg/L -0.054 0.999** 0.838 -0.831 0.884 0.742 0.876 1 000 mg/L 0.643 0.093 0.717 -0.663 0.508 0.493 0.485 CK缩醛相对含量0.666 -0.653 -0.737 0.689 -0.824 -0.781 -0.729 250 mg/L -0.038 -0.473 -0.885 0.958* -0.737 -0.811 -0.851 500 mg/L -0.262 -0.591 -0.949 0.949 -0.883 -0.987* -0.885 1 000 mg/L 0.547 0.344 0.817 -0.771 0.698 0.663 0.685 CK萜烯醛相对含量-0.892 0.323 0.699 -0.782 0.669 0.950* 0.731 250 mg/L 0.843 0.086 0.594 -0.589 0.571 0.531 0.464 500 mg/L 0.637 0.476 0.845 -0.813 0.859 0.891 0.869 1 000 mg/L 0.554 0.392 0.800 -0.754 0.719 0.669 0.711
续表2
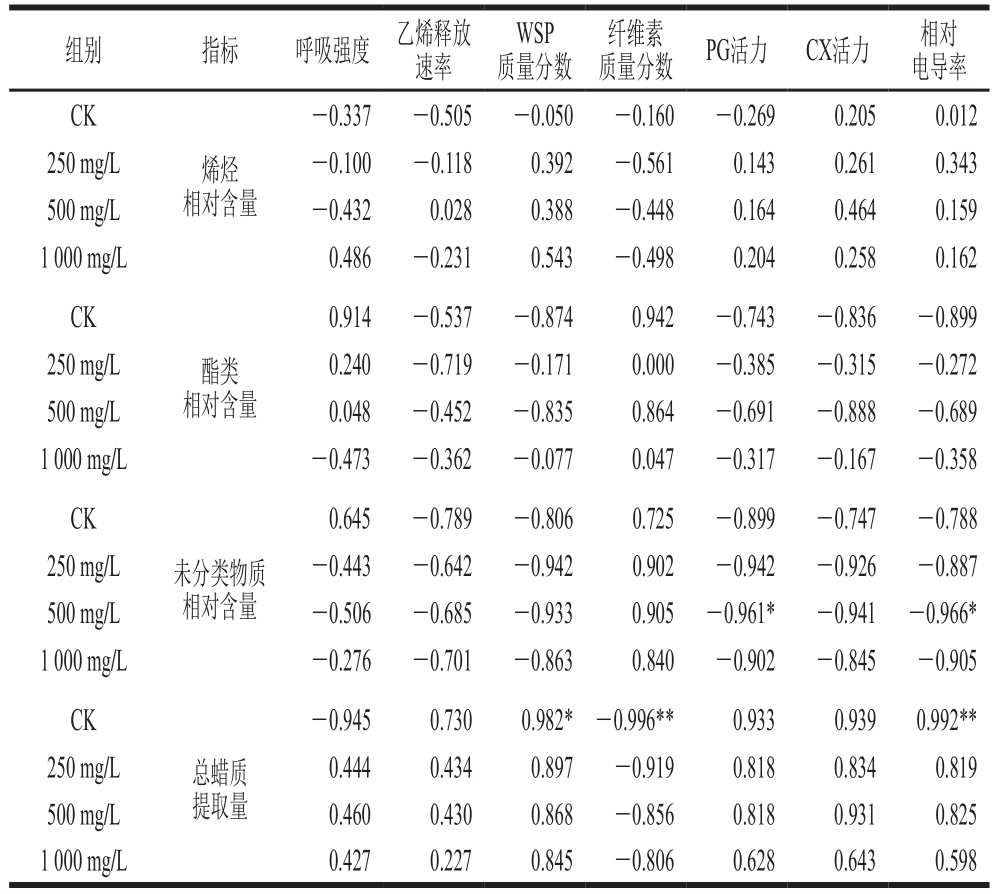
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
组别 指标 呼吸强度 乙烯释放速率WSP质量分数纤维素质量分数 PG活力 CX活力 相对电导率CK烯烃相对含量-0.337 -0.505 -0.050 -0.160 -0.269 0.205 0.012 250 mg/L -0.100 -0.118 0.392 -0.561 0.143 0.261 0.343 500 mg/L -0.432 0.028 0.388 -0.448 0.164 0.464 0.159 1 000 mg/L 0.486 -0.231 0.543 -0.498 0.204 0.258 0.162 CK酯类相对含量0.914 -0.537 -0.874 0.942 -0.743 -0.836 -0.899 250 mg/L 0.240 -0.719 -0.171 0.000 -0.385 -0.315 -0.272 500 mg/L 0.048 -0.452 -0.835 0.864 -0.691 -0.888 -0.689 1 000 mg/L -0.473 -0.362 -0.077 0.047 -0.317 -0.167 -0.358 CK未分类物质相对含量0.645 -0.789 -0.806 0.725 -0.899 -0.747 -0.788 250 mg/L -0.443 -0.642 -0.942 0.902 -0.942 -0.926 -0.887 500 mg/L -0.506 -0.685 -0.933 0.905 -0.961* -0.941 -0.966*1 000 mg/L -0.276 -0.701 -0.863 0.840 -0.902 -0.845 -0.905 CK总蜡质提取量-0.945 0.730 0.982* -0.996** 0.933 0.939 0.992**250 mg/L 0.444 0.434 0.897 -0.919 0.818 0.834 0.819 500 mg/L 0.460 0.430 0.868 -0.856 0.818 0.931 0.825 1 000 mg/L 0.427 0.227 0.845 -0.806 0.628 0.643 0.598
由表2可知,在CK组香梨中,呼吸强度与烷烃相对含量呈极显著负相关(P<0.01);乙烯释放速率与醇类相对含量呈极显著正相关(P<0.01);总蜡质提取量与WSP质量分数呈显著正相关(P<0.05),与纤维素质量分数呈极显著负相关(P<0.01),与电导率呈极显著正相关(P<0.01)。在250 mg/L乙烯处理组香梨中,乙烯释放速率与饱和醛相对含量呈极显著正相关(P<0.01);纤维素质量分数与烯酸相对含量呈极显著正相关(P<0.01),与缩醛相对含量呈显著正相关(P<0.05)。在500 mg/L乙烯利处理组香梨中,乙烯释放速率与饱和醛相对含量呈极显著正相关(P<0.01);WSP、纤维素质量分数与饱和脂肪酸相对含量分别呈极显著负相关(P<0.01)和极显著正相关(P<0.01),与烯酸相对含量变化分别呈显著负相关(P<0.05)与显著正相关(P<0.05);相对电导率与未分类物质相对含量变化呈显著负相关(P<0.05)。在1 000 mg/L乙烯利处理组香梨中,WSP、纤维素质量分数分别与烯酸相对含量呈极显著负相关(P<0.01)与极显著正相关(P<0.01);纤维素质量分数与饱和脂肪酸相对含量呈显著正相关(P<0.05);相对电导率与醇类物质相对含量呈显著正相关(P<0.05)。
3 讨 论
香梨经不同质量浓度乙烯利处理后,在冷藏20 d后,CO2和乙烯释放量增加,并使呼吸高峰和乙烯释放高峰提前,Li Fujun等[22]的研究结果也表明,乙烯利处理能增加呼吸强度和乙烯释放量的峰值,加速CO2和乙烯的释放。在本研究中,1 000 mg/L作用效果更明显。与CK组相比,250 mg/L和1 000 mg/L乙烯利处理能促进香梨贮藏过程中纤维素的降解,在贮藏后期,乙烯利处理提高了WSP的质量分数,500 mg/L质量浓度条件下促进了香梨果实相对电导率的升高,而这三者变化均伴随着细胞壁的降解。细胞壁降解是果实软化和品质改变的主要因素[43]。果实成熟软化过程中,伴随着纤维素、半纤维素含量不断降低,WSP含量不断增加,且在果实硬度快速下降时变化明显[31]。乙烯利处理能明显破坏细胞形态完整性,促使薄壁细胞溶解破裂[35]。乙烯利处理能促进香梨PG和CX活力的升高,其中质量浓度为1 000 mg/L时效果最为显著。有研究证明,乙烯利不仅可以诱导油桃[44]和番茄[45]果实中PG、CX等软化相关酶活力高峰的提前,而且能增加其峰值,说明乙烯利对软化相关酶活力有促进作用,与本实验研究结果一致。
乙烯利处理影响香梨蜡质代谢,这意味着表皮蜡质合成途径受乙烯影响。贮藏40 d之前,不同质量浓度乙烯利均促进香梨总蜡质提取量增加。对玉米幼苗的研究表明,乙烯利调节了蜡质相关生物合成基因的表达,促进了角质层蜡的积累[46]。CK组香梨中,总蜡质提取量变化分别与WSP质量分数(正相关)、纤维素质量分数(负相关)及相对电导率(正相关)相关性显著或极显著,但鲜有文献提及相关论述;因此香梨表皮蜡质变化与其贮藏生理之间的关系有待深入研究。与CK相比,1 000 mg/L乙烯利处理明显降低了香梨蜡质中烷烃相对含量,而在CK组香梨中,呼吸强度与烷烃相对含量变化呈极显著负相关,推测乙烯利可能通过影响香梨的呼吸模式进而对烷烃的生成产生影响。有类似研究结果显示,苹果梨经乙烯利处理后,贮藏期间蜡质中烷烃相对含量低于或接近CK组,且蜡质中脂肪酸相对含量也低于CK组[47]。而在香梨冷藏过程中,与CK组相比,500 mg/L和1 000 mg/L乙烯利处理的果实蜡质中饱和脂肪酸和烯酸相对含量均显著增加,250 mg/L乙烯利处理中二者相对含量降低,这可能是不同质量浓度乙烯利对蜡质化学组分的种类、含量存在剂量效应[47]。在贮藏后期,乙烯利处理增加了醛类相对含量,类似的结果也表明,乙烯利增加了苹果蜡质中醛类相对含量,并且推测这可能是乙烯利处理促进了苹果蜡质中极长链脂肪酸(very long-chain fatty acids,VLCFAs)向醛的转化,提高了蜡质中酯类的相对含量,并在水果冷藏60 d后将其保持在较高水平[22]。角质层蜡来自内质网中的VLCFAs,蜡质的形成主要是通过VLCFAs的两种不同途径,一种是VLCFAs产生醛、烷烃、仲醇和酮的脱羰途径;另一种是VLCFAs产生伯醇和酯的酰基还原途径[48]。通过脱羰途径产生的醛除了分泌到表皮外,还可以转化为烷烃[49]。关于乙烯对角质层组成、结构、形态和功能的调节途径机制的细节将是未来研究的一个方向。
4 结 论
250、500 、1 000 mg/L乙烯利处理对冷藏香梨均有催熟效应,与CK相比,能促使WSP质量分数增加,正向调节PG和CX活力,使贮藏40 d时的呼吸强度和贮藏60 d时的乙烯释放量显著增加,呼吸高峰和乙烯释放高峰提前,1 000 mg/L乙烯利作用最显著,同时250、1 000 mg/L乙烯利处理在整个贮藏过程中促进纤维素降解,500 mg/L乙烯利对相对电导率的升高有促进作用。
与CK相比,采后乙烯利处理对香梨总蜡质提取量、化学组分相对含量均有一定影响,且存在剂量效应。在贮藏0~40 d之间,乙烯利处理显著提高了香梨总蜡质提取量,其中1 000 mg/L乙烯利处理作用最显著。乙烯利处理对蜡质中醇类、饱和脂肪酸、醛类、酯类和烯烃的生成均起促进作用,但降低了烷烃相对含量,使二十九烷相对含量较低,同时减少了短碳链烷烃的种类,500、1 000 mg/L乙烯利对烯酸的生成也有促进作用。不同质量浓度乙烯利处理的香梨生理变化与蜡质组分相对含量变化的相关性存在较大差异。
[1]杭博, 王文辉, 贾晓辉, 等.贮藏环境乙烯对不同低温下库尔勒香梨果实品质的影响[J].保鲜与加工, 2015, 15(3): 28-32.
[2]董晓庆, 饶景萍, 朱守亮, 等.气调包装与1-MCP结合抑制苹果蜡质成分降低[J].农业工程学报, 2013, 29(16): 269-277.DOI:10.3969/j.issn.1002-6819.2013.16.034.
[3]CURRY E.Effects of 1-MCP applied postharvest on epicuticular wax of apples (Malus domestica Borkh.) during storage[J].Journal of the Science of Food & Agriculture, 2008, 88(6): 996-1006.DOI:10.1002/jsfa.3180.
[4]VERARDO G, PAGANI E, GEATTI P, et al.A thorough study of the surface wax of apple fruits[J].Analytical and Bioanalytical Chemistry,2003, 376(5): 659-667.DOI:10.1007/s00216-003-1945-7.
[5]RIEDERER M, SCHREIBER L.Protecting against water loss: analysis of the barrier properties of plant cuticles[J].Journal of Experiment Botany, 2001, 52: 2023-2032.DOI:10.1093/jexbot/52.363.2023.
[6]LEIDE J, HILDEBRANDT U, REUSSING K, et al.The developmental pattern of tomato fruit wax accumulation and its impact on cuticular transpiration barrier properties: effects of a deficiency in β-ketoacyl-coenzyme a synthase (LeCER6)[J].Plant Physiology, 2007,144(3): 1667-1679.DOI:10.1104/pp.107.099481.
[7]MARCELL L M, BEATTIE G A.Effect of leaf surface waxes on leaf colonization by Pantoea agglomerans and Clavibacter michiganensis[J].Molecular Plant-Microbe Interaction, 2002, 15(12):1236-1244.DOI:10.1094/mpmi.2002.15.12.1236.
[8]MARKSTÄDTER C, FEDERLE W, JETTER R, et al.Chemical composition of the slippery epicuticular wax blooms on Macaranga(Euphorbiaceae) ant-plants[J].Chemoecology, 2000, 10(1): 33-40.DOI:10.1007/s000490050005.
[9]JETTER R, SCHÄFFER S, RIEDERER M.Leaf cuticular waxes are arranged in chemically and mechanically distinct layers: evidence from Prunus laurocerasus L.[J].Plant Cell and Environment, 2000, 23(6):619-628.DOI:10.1046/j.1365-3040.2000.00581.x.
[10]TONUTTI P, BONGHI C, RAMINA A.Fruit firmness and ethylene biosynthesis in three cultivars of peach (Prunus persica L.Batsch)[J].Journal of Horticultural Science, 1996, 71(1): 141-147.DOI:10.1080/1 4620316.1996.11515390.
[11]饶景萍, 任小林.园艺产品贮运学[M].陕西: 陕西人民出版社, 2003:37-38.
[12]YANG X T, SONG J, CAMPBELL-PALMER L, et al.Effect of ethylene and 1-MCP on expression of genes involved in ethylene biosynthesis and perception during ripening of apple fruit[J].Postharvest Biology and Technology, 2013, 78: 55-66.DOI:10.1016/j.postharvbio.2012.11.012.
[13]张忠, 马朝玲, 丁若珺, 等.采后乙烯利处理对软儿梨果实后熟期生理及品质的影响[J].食品科学, 2017, 38(21): 252-258.DOI:10.7506/spkx1002-6630-201721040.
[14]赵晓梅, 叶凯, 李文慧, 等.采前喷钙对库尔勒香梨贮藏效果的影响[J].新疆农业科学, 2011, 48(6): 1021-1027.DOI:10.6048/j.issn.1001-4330.2011.06.008.
[15]张婷, 车凤斌, 李萍, 等.气调指标对库尔勒香梨果实贮藏质量的影响[J].安徽农业科学, 2009, 37(30): 14566-14568.DOI:10.13989/j.cnki.0517-6611.2009.30.109.
[16]RZEWUSKI G, SAUTER M.Ethylene biosynthesis and signaling in rice[J].Plant Science, 2008, 175(1/2): 32-42.DOI:10.1016/j.plantsci.2008.01.012.
[17]贾晓辉, 张文江, 夏玉静, 等.不同温度和外源乙烯处理对软肉梨后熟的作用效果研究[J].保鲜与加工, 2014, 14(3): 25-28; 36.DOI:10.3969/j.issn.1009-6221.2014.03.006.
[18]李志强, 乔玉山, 徐长宝, 等.不同后熟期菊水梨果实对外源乙烯和1-MCP处理的生理响应[J].西北植物学报, 2008(9): 1862-1867.
[19]ZHANG Lihua, LI Shunfeng, LIU Xinghua, et al.Effects of ethephon on physicochemical and quality properties of kiwifruit during ripening[J].Postharvest Biology and Technology, 2012, 65: 69-75.DOI:10.1016/j.postharvbio.2011.11.004.
[20]CAJUSTE J F, GONZÁLEZ-CANDELAS L, VEYRAT A.Epicuticular wax content and morphology as related to ethylene and storage performance of “Navelate” orange fruit[J].Postharvest Biology and Technology, 2010, 55(1): 29-35.DOI:10.1016/j.postharvbio.2009.07.005.
[21]JU Zhiguo, BRAMLAGE W J.Developmental changes of cuticular constituents and their association with ethylene during fruit ripening in “Delicious” apples[J].Postharvest Biology and Technology, 2001,21(3): 257-263.DOI:10.1016/s0925-5214(00)00156-3.
[22]LI Fujun, MIN Dedong, SONG Baicheng, et al.Ethylene effects on apple fruit cuticular wax composition and content during cold storage[J].Postharvest Biology and Technology, 2017, 134: 98-105.DOI:10.1016/j.postharvbio.2017.08.011.
[23]王文娟.采后1-MCP和乙烯利处理对苹果梨表皮蜡质和Alternaria alternata侵染的影响[D].兰州: 甘肃农业大学, 2013: 8.
[24]BERNARD A, JOUBÈS J.Arabidopsis cuticular waxes: advances in synthesis, export and regulation[J].Progress in Lipid Research, 2013,52(1): 110-129.DOI:10.1016/j.plipres.2012.10.002.
[25]曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京: 中国轻工业出版社, 2007: 123-124.
[26]王甲水, 贾彩红, 张建斌, 等.香蕉果实乙烯释放量GC的测定方法及其不同处理下的变化趋势[J].热带作物学报, 2013, 34(6): 1188-1191.DOI:10.3969/j.issn.1000-2561.2013.06.034.
[27]李珍慈, 江英, 秦婕, 等.库尔勒香梨表皮蜡质提取条件研究及成分分析[J].中国酿造, 2016, 35(4): 158-162.DOI:10.11882/j.issn.0254-5071.2016.04.035.
[28]张敏, 程建军, 韩建春, 等.秋香梨在自然催熟和人工催熟条件下的成熟特性[J].东北农业大学学报, 2001(4): 360-366.DOI:10.19720/j.cnki.issn.1005-9369.2001.04.009.
[29]吕静祎, 周影, 葛永红, 等.1-MCP和乙烯利处理对采后‘金冠'苹果常温贮藏过程中生理变化及活性氧代谢的影响[J].食品工业科技,2017, 38(5): 339-344.DOI:10.13386/j.issn1002-0306.2017.05.056.
[30]BENNETT A B, LABAVITCH J M.Ethylene and ripeningregulated expression and function of fruit cell wall modifying proteins[J].Plant Science, 2008, 175(1/2): 130-136.DOI:10.1016/j.plantsci.2008.03.004.
[31]BILLY L, MEHINAGIC E, ROYER G, et al.Relationship between texture and pectin composition of two apple cultivars during storage[J].Postharvest Biology and Technology, 2008, 47(3): 315-324.DOI:10.1016/j.postharvbio.2007.07.011.
[32]VICENTE A R, SALADIÉ M, ROSE J K C, et al.The linkage between cell wall metabolism and fruit softening: looking to the future[J].Journal of the Science of Food and Agriculture, 2007, 87(8):1435-1448.DOI:10.1002/jsfa.2837.
[33]CARRINGTON C, GREVE L C, LABAVITCH J M.Cell wall metabolism in ripening fruit (VI.effect of the antisense polygalacturonase gene on cell wall changes accompanying ripening in transgenic tomatoes)[J].Plant Physiology, 1993, 103(2): 429-434.DOI:10.1104/pp.103.2.429.
[34]李鹏鹤.乙烯调控后熟甜瓜果实细胞壁代谢及其结构变化[D].郑州: 河南农业大学, 2015: 7; 34.
[35]邵远志, 高毫杰, 贾志伟, 等.1-MCP和乙烯利处理对番木瓜果实软化生理的影响[J].中国食品学报, 2013, 13(2): 143-148.DOI:10.16429/j.1009-7848.2013.02.028.
[36]段学武, 张昭其, 季作梁.PG酶与果实的成熟软化[J].果树学报,2001, 18(4): 229-233.DOI:10.3969/j.issn.1009-9980.2001.04.011.
[37]VERAVERBEKE E A, LAMMERTYN J, SAEVELS S, et al.Changes in chemical wax composition of three different apple (Malus domestica Borkh.) cultivars during storage[J].Postharvest Biology and Technology,2001, 23(3): 197-208.DOI:10.1016/s0925-5214(01)00128-4.
[38]CURRY E.Ultrastructure of epicuticular wax aggregates during fruit development in apple (Malus domestica Borkh.)[J].Journal of Horticultural Science and Biotechnology, 2005, 80(6): 668-676.DOI:10.1080/14620316.2005.11511996.
[39]VAN MAARSEVEEN C, JETTER R.Composition of the epicuticular and intracuticular wax layers on Kalanchoe daigremontiana (Hamet et Perr.de la Bathie) leaves[J].Phytochemistry, 2009, 70(7): 899-906.DOI:10.1016/j.phytochem.2009.04.011.
[40]DONG X Q, RAO J P, HUBER D J, et al.Wax composition of‘Red Fuji' apple fruit during development and during storage after 1-methylcyclopropene treatment[J].Horticulture, Environment, and Biotechnology, 2012, 53(4): 288-297.DOI:10.1007/s13580-012-0036-0.
[41]POST-BEITTENMILLER D.Biochemistry and molecular biology of wax production in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology, 1996, 47(1): 405-430.DOI:10.1146/annurev.arplant.47.1.405.
[42]WU X, YIN H, CHEN Y Y, et al.Chemical composition, crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J].Postharvest Biology and Technology,2017, 132: 71-80.DOI:10.1016/j.postharvbio.2017.05.007.
[43]庄军平, 林焕章, 陈维信.香蕉果实成熟软化过程中细胞壁物质的变化[J].热带亚热带植物学报, 2006, 14(3): 218-221.DOI:10.3969/j.issn.1005-3395.2006.03.008.
[44]王俊宁, 饶景萍, 任小林, 等.1-甲基环丙烯(1-MCP)对油桃果实软化的影响[J].植物生理学通讯, 2005(2): 153-156.DOI:10.13592/j.cnki.ppj.2005.02.004.
[45]寇晓虹, 朱本忠, 罗云波, 等.番茄果实中乙烯与多聚半乳糖醛酸酶的关系[J].植物生理与分子生物学学报, 2004(6): 675-680.DOI:10.3321/j.issn:1671-3877.2004.06.012.
[46]YU H Y, ZHANG Y S, XIE Y, et al.Ethephon improved drought tolerance in maize seedlings by modulating cuticular wax biosynthesis and membrane stability[J].Journal of Plant Physiology, 2017, 214:123-133.DOI:10.1016/j.jplph.2017.04.008.
[47]唐瑛, 王文娟, 李永才, 等.采后乙烯利、1-MCP处理对苹果梨蜡质组分的影响[J].食品科学, 2016, 37(18): 223-229.DOI:10.7506/spkx1002-6630-201618036.
[48]KUNST L, SAMUELS A L.Biosynthesis and secretion of plant cuticular wax[J].Progress in Lipid Research, 2003, 42(1): 51-80.DOI:10.1016/s0163-7827(02)00045-0.
[49]GREER S, WEN M, BIRD D, et al.The cytochrome P450 enzyme CYP96A15 is the midchain alkane hydroxylase responsible for formation of secondary alcohols and ketones in stem cuticular wax of Arabidopsis[J].Plant Physiology, 2007, 145(3): 653-667.DOI:10.1104/pp.107.107300.