马铃薯营养丰富,块茎中含有大量淀粉、蛋白质、多种维生素及矿物质,还含有人体必需的氨基酸,是一种用途广泛的农作物[1-2]。2015年初,我国政府提出了马铃薯“主粮化”的发展战略,随着“主粮化”战略的推进,人们对马铃薯的消费正从传统的鲜食、饲用和淀粉加工向主食食品转变[3-5]。因此,绿色安全的贮藏方式将成为推进马铃薯主食化的重要保证。然而在贮藏过程中,马铃薯休眠后的发芽及由此而导致的品质劣变是马铃薯贮藏中存在的最大问题[6-7]。为了保持马铃薯的良好品质、延长贮藏期及货架期,收获的块茎通常在4 ℃的低温条件下贮藏,但低温贮藏会使马铃薯块茎中的糖代谢平衡被打破,过多的淀粉分解造成还原糖的积累,发生低温糖化现象[8-10]。这种糖化现象给马铃薯加工业带来了非常严重的问题,低温贮藏后的马铃薯块茎在高温加工(油炸、烘焙、烧烤)过程中,块茎中的还原糖与游离氨基酸发生美拉德反应,导致产品褐变,产生苦涩味,影响商品价值。除此之外,美拉德反应可产生丙烯酰胺,其是一种潜在的神经毒素和致癌物质,潜在影响消费者的身体健康[11-14]。
研究者发现2.5 kPa的低氧环境贮藏可降低马铃薯块的呼吸速率,减弱块茎的糖化[15],说明低氧贮藏有利于保持马铃薯良好的加工特性。另有研究表明,提高贮藏环境中的CO2浓度可延长马铃薯的绿变时间,从而降低马铃薯块茎中糖苷生物碱的含量[16]。而适当增加贮藏环境中CO2含量对抑制块茎中还原糖含量的上升也有积极的影响[17]。因此可将高CO2贮藏作为保证马铃薯食用安全的一种有效措施。
本研究采用低氧结合高二氧化碳环境贮藏马铃薯,为明确这种贮藏环境对马铃薯品质的影响,设置贮藏环境中的O2体积分数为5%,CO2体积分数分别为2%、4%、6%、8%、10%,贮藏温度为4、10 ℃,研究贮藏过程中马铃薯营养品质、外观品质及生理品质的变化规律。探讨低氧高二氧化碳贮藏环境对马铃薯贮藏品质的影响,为加工型马铃薯的安全贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
供试马铃薯品种为‘陇薯7号’,由定西市农科院试验站提供。采收后挑选成熟度一致、大小均匀、无病虫害的薯块进行实验。
三元混合气体(O2、CO2、N2) 兰州裕隆气体有限公司;碘、碘化钾、乙醇、乙酸钠、聚乙烯吡咯烷酮、邻苯二酚、柠檬酸 天津市光复科技展有限公司;硫代巴比妥酸 上海科丰化学试剂有限公司;三氯乙酸天津市大茂化学试剂厂。
1.2 仪器与设备
气调保鲜箱 北京恒青园科技有限公司;PBI-200616-I手持O2/CO2分析仪 丹麦Dansensor公司;Cary100紫外-可见分光光度计 美国瓦里安有限公司;CR-10PLUS色差仪 日本柯尼卡美能达公司;BT224S电子天平 德国赛多利斯公司;TGL-16M型台式高速冷冻离心机 湖南湘仪离心机有限公司;移液器 德国Eppendorf公司;DDS-307A电导率仪 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 原料处理与分组
马铃薯采收后置于黑暗通风条件下(10~12 ℃)愈伤15 d。愈伤结束后,将马铃薯装入12 个气调保鲜箱(尺寸50 cm×30 cm×30 cm)中,每箱马铃薯的质量约为10 kg,分别贮藏于4 ℃和10 ℃,每个贮藏温度设置5 个实验组(CA1:5%(体积分数,下同)O2+2% CO2;CA2:5% O2+4% CO2;CA3:5% O2+6%CO2;CA4:5% O2+8% CO2;CA5:5% O2+10% CO2及1 个CK组(同温度自然条件贮藏)),各组气体组分除O2、CO2外其余组分用N2平衡,控制箱内相对湿度为90%左右。用PBI-200616-I手持O2/CO2分析仪对箱内气体体积分数进行监测,自贮藏之日起,每30 d取样1 次进行相关指标测定。
1.3.2 营养品质测定
马铃薯营养指标的测定均用去皮薯肉进行测定,其中粗淀粉、还原糖、VC及蛋白质的含量均以鲜质量计。粗淀粉含量测定参照GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》[18],还原糖含量测定参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》[19],VC含量测定参照GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》[20],干物质含量测定采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[21],蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[22]。
1.3.3 外观品质测定
每个处理随机选取30 个块茎,分为3 组,进行质量损失率[23]、发芽率[24]、腐烂率[25]的测定,其分别按公式(1)~(3)计算。

薯皮亮度测定:每个处理随机选取5 个块茎,清洗晾干后,取每个薯块上光滑平整的部位用记号笔进行标记,用色差仪测定标记部位的L*值[26]。
1.3.4 生理指标测定
1.3.4.1 多酚氧化酶活力测定
多酚氧化酶(polyphenol oxidase,PPO)活力的测定参照曹建康等[27]的方法,取5 g马铃薯薯肉置于研钵中,加入5 mL 0.1 mol/L pH 5.5的乙酸-乙酸钠缓冲液(含聚乙二醇6000和聚乙烯吡咯烷酮)冰浴研磨,4 ℃、12 000 r/min离心30 min,取上清液进行酶活力测定。
取4 mL 50 mmol/L pH 5.5的乙酸-乙酸钠缓冲液,加入1.0 mL 50 mmol/L邻苯二酚,最后加入100 μL酶提取液,反应15 s后每1 min记录420 nm波长处的吸光度,连续记录5 min。以每克样品每分钟在420 nm波长处的吸光度增加1为1 个酶活力单位(U),PPO活力单位以U/g表示。
1.3.4.2 相对电导率测定
相对电导率测定参考白友强等[28]的方法,并稍加修改,采用直径1 cm的打孔器打取马铃薯薯肉,用锋利的刀片将所取薯肉切取30 片厚度约2 mm的薄片,置于100 mL烧杯中,加入50 mL去离子水(去离子水的电导率计为P0/(μS/cm)),将烧杯置于转速150 r/min、温度为25 ℃的恒温摇床振荡1 h后测定电导率(P1/(μS/cm)),然后在沸水浴中煮沸10 min,冷却至室温后再次测定电导率(P2/(μS/cm)),相对电导率按公式(4)进行计算。
1.3.4.3 丙二醛含量测定
丙二醛(malondialdehyde,MDA)含量的测定参照姜红[29]的方法,并稍加修改,取1 g马铃薯薯肉,加入5 mL 100 g/L三氯乙酸溶液,研磨匀浆后,于4 ℃、12 000 r/min离心20 min,取上清液备用。
取4 mL上清液,加入4 mL 6.7 mg/mL的硫代巴比妥酸溶液,摇匀后沸水浴中煮沸20 min,冷却至室温后再次离心,取上清液测定450、532 nm及600 nm波长处的吸光度。按公式(5)计算MDA含量,结果以鲜质量计。
式中:m表示样品质量/g。
1.4 数据处理与分析
数据采用Excel 2016软件计算,结果以平均值±标准差表示,用SPSS 20.0软件进行数据统计分析,采用Duncan法进行数据差异显著分析比较。采用Origin 9.0软件作图。
2 结果与分析
2.1 不同处理对马铃薯营养品质的影响
2.1.1 干物质和粗淀粉含量
干物质含量是衡量马铃薯块茎营养成分的重要指标。由图1A1、A2可知,随贮藏时间的延长,块茎中的干物质含量呈先上升后下降的趋势,贮藏至120 d时的干物质含量与初始相比总体更高。干物质含量的变化主要是马铃薯在贮藏过程中仍然进行着呼吸、蒸腾作用等一系列生化反应,导致薯块水分含量降低,干物质含量上升。相同处理组的马铃薯块茎在10 ℃贮藏时的干物质含量较4 ℃高,主要原因是马铃薯在较高温度贮藏时水分消耗较快,所以导致薯块质量损失大。同温度的不同处理组在贮藏至120 d时干物质含量无明显差异。
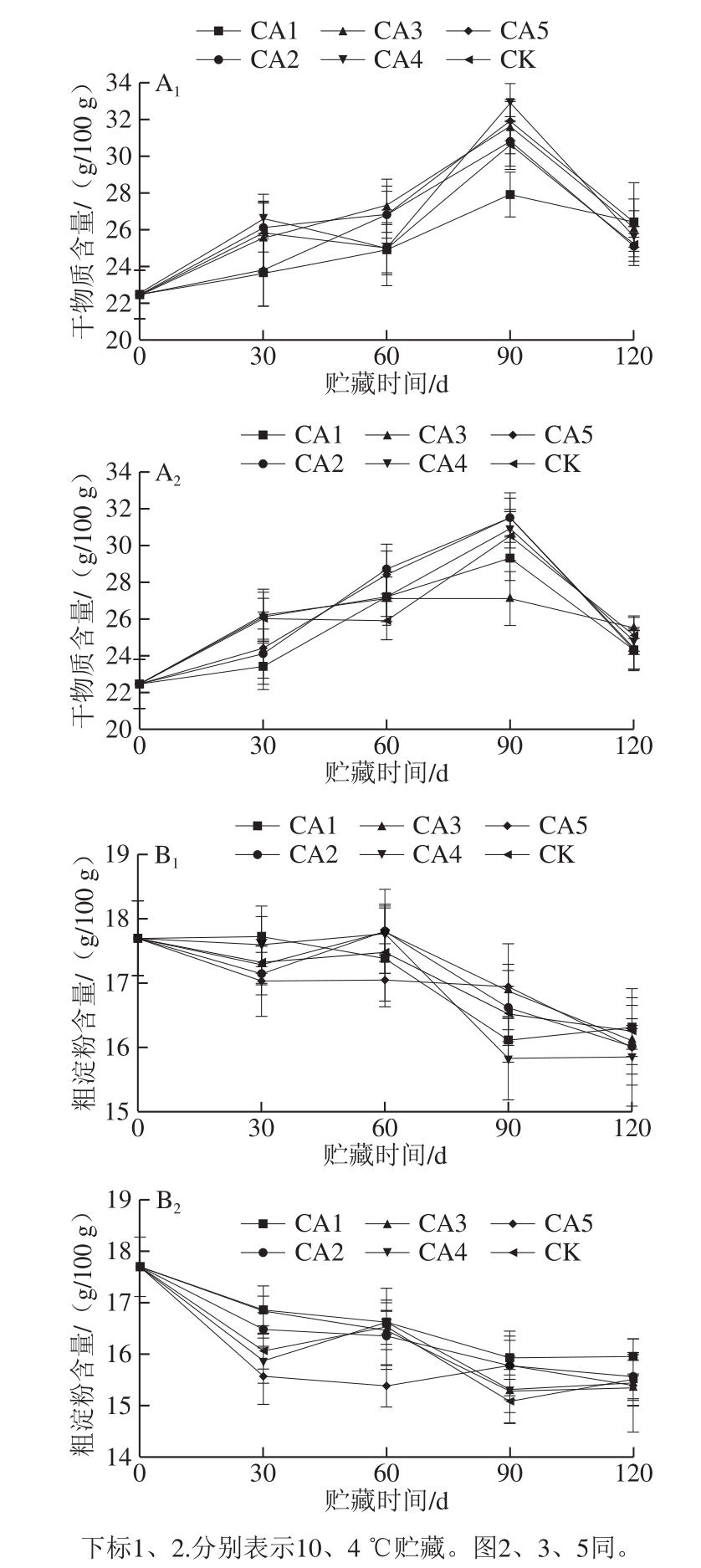
图1 不同处理对马铃薯块茎干物质含量(A)及粗淀粉含量(B)的影响
Fig.1 Effect of different treatments on dry matter content (A) and crude starch content (B) of potato tubers
淀粉是马铃薯块茎中的主要能量来源,贮藏期间淀粉含量的变化情况反映马铃薯食用品质的变化。由图1B1、B2可知,马铃薯块茎中的粗淀粉含量在两个温度贮藏过程中呈先降再升后降的变化趋势,主要原因是在贮藏前期,淀粉作为马铃薯的主要营养物质在贮藏过程中会因呼吸、蒸腾作用消耗,随着贮藏的进行,块茎中的还原糖部分转化为淀粉导致其含量上升,贮藏后期随着休眠的解除淀粉含量消耗加快。贮藏期间相同气体处理组的马铃薯块茎在10 ℃贮藏时较4 ℃贮藏的粗淀粉含量高,主要原因是马铃薯在低温贮藏时块茎内的淀粉-糖代谢途径会受影响,导致淀粉降解[30]。同温度贮藏的不同气体处理组块茎内的粗淀粉含量虽有差异,但差异不明显。
2.1.2 VC、还原糖、蛋白质含量
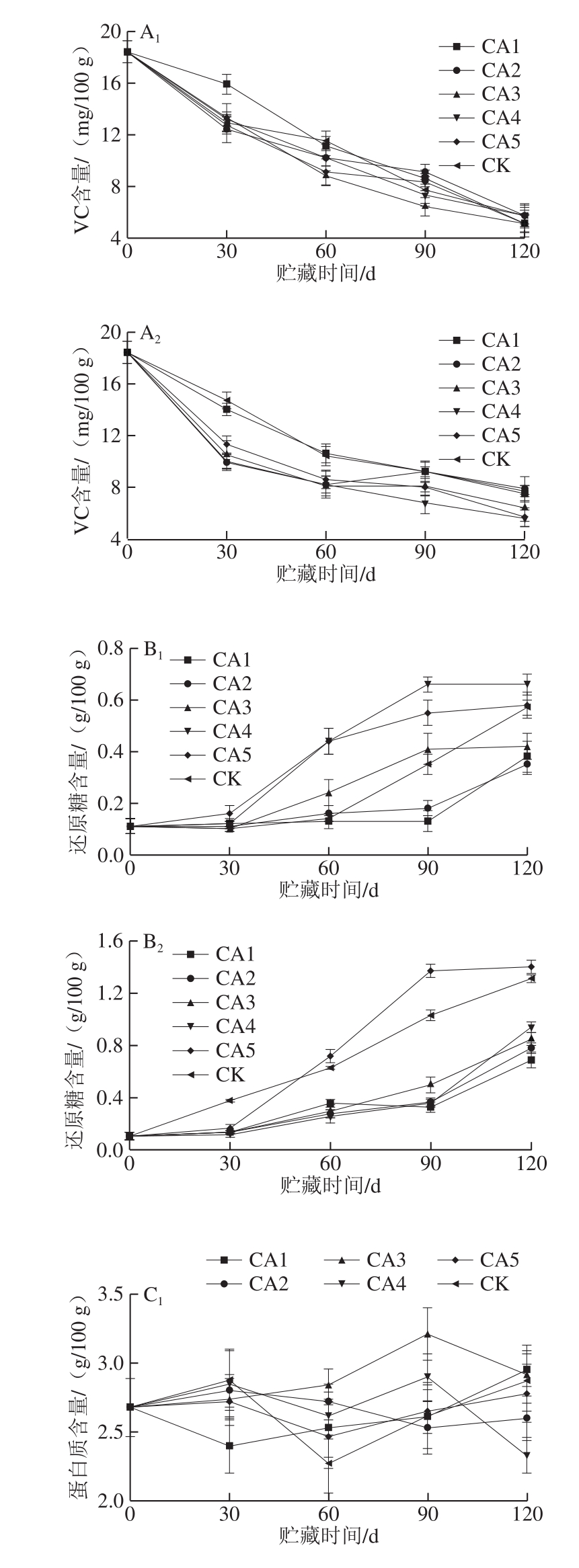
图2 不同处理对马铃薯块茎VC(A)、还原糖(B)及蛋白质(C)含量的影响
Fig.2 Effect of different treatments on vitamin C (A), reducing sugar (B)and protein (C) contents in potato tubers
马铃薯块茎中含有丰富的维生素类物质,其中VC含量最高,VC是很好的抗氧化剂,能有效清除自由基,对人体的健康十分有益,因此VC含量也作为衡量马铃薯品质一项重要的指标。由图2A1、A2可知,马铃薯块茎中的VC含量随贮藏时间的延长呈下降趋势。不同气体环境贮藏对马铃薯块茎中VC含量并无明显影响,不同处理组之间无明显差异。
低温环境可抑制马铃薯块茎水分的蒸发、衰败、发芽以及致病微生物的侵染,但同时还会造成块茎中还原糖含量的增加,从而影响其加工品质,因此适宜的贮藏环境是保证马铃薯良好加工品质的基础。由图2B1、B2可知,随贮藏时间的延长,马铃薯块茎还原糖含量呈上升趋势,不同温度和不同处理的块茎还原糖含量上升幅度有差异,相同气体处理的块茎在10 ℃贮藏时还原糖含量的上升较4 ℃贮藏慢,贮藏至120 d时,10 ℃贮藏的CA1和CA2实验组的块茎还原糖含量明显低于CA5和CK组,4 ℃贮藏时CA1~CA4处理均能够延缓贮藏过程中块茎还原糖含量的上升。由以上结果可得出,改变贮藏环境中的气体组分可改变贮藏过程中块茎中的还原糖含量。但贮藏环境中过高的CO2体积分数反而会引起块茎中还原糖含量的快速积累,如CA5实验组块茎中的还原糖含量在贮藏后期明显高于对照组。有研究表明,马铃薯在7 ℃贮藏时将环境中的CO2含量提高20%,贮藏90 d后,块茎中的还原糖含量比对照高出3~4 倍。结合已有研究结果得出,适宜的低氧高CO2贮藏环境能够延缓马铃薯在低温贮藏过程中还原糖含量的快速积累,延缓马铃薯在低温贮藏过程中的“低温糖化”现象的出现。出现这种现象的原因可能是这种贮藏环境选择性地调节了块茎中的转化酶及其他酶的活性[15]。
马铃薯块茎中的蛋白质属于优质蛋白,可被人体很好地消化吸收,其赖氨酸含量高于谷物,可与谷物互补,作为弥补“赖氨酸”缺乏症患者的优质食物[31]。由图2C1、C2可知,贮藏期间马铃薯块茎中的蛋白质含量虽有变化,但变化幅度不大且没有明显的规律,由此可见温度和贮藏环境中的气体比例对马铃薯块茎中蛋白质含量并无太大影响。
2.2 不同处理对马铃薯外观品质的影响
2.2.1 质量损失率、发芽率和腐烂率
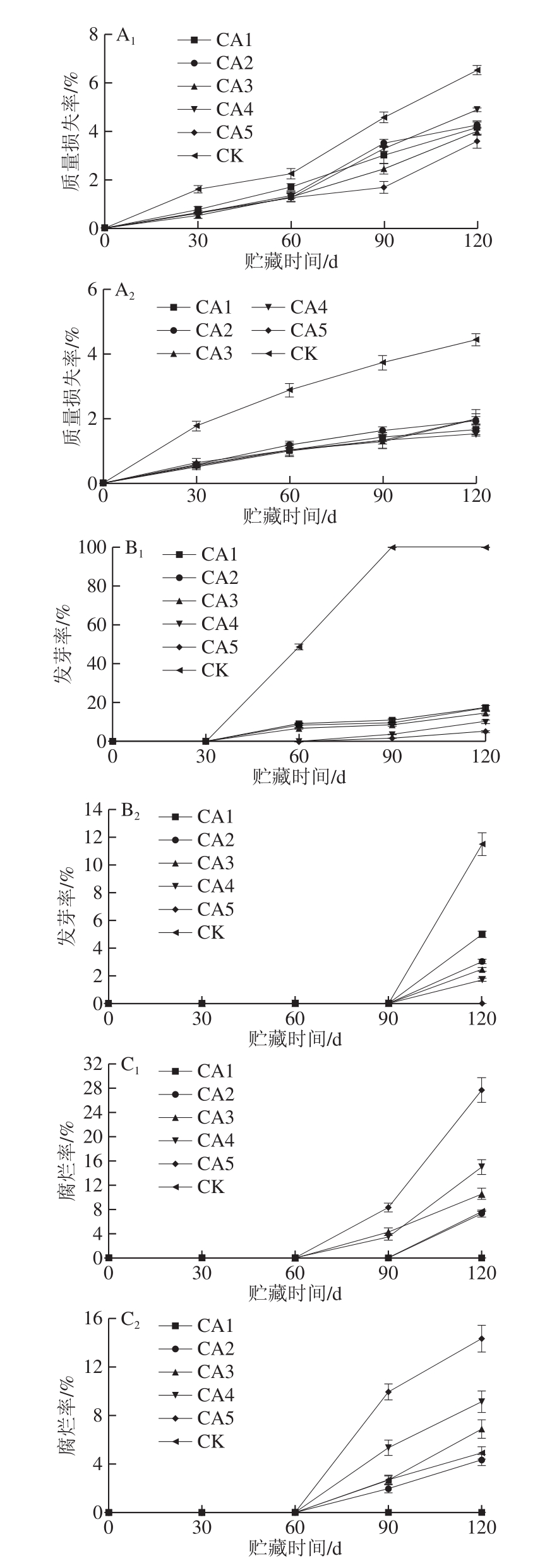
图3 不同处理对马铃薯块茎质量损失率(A)、发芽率(B)及腐烂率(C)的影响
Fig.3 Effect of different treatments on mass loss rate (A), germination rate (B) and rot rate (C) of potato tubers
水分含量是影响果蔬新鲜度的重要指标,过度失水会造成果蔬正常生理代谢紊乱,加速果蔬腐败,造成营养品质及外观品质的下降[32]。由图3A1、A2可知,马铃薯块茎质量损失率随贮藏时间的延长呈上升趋势。贮藏至120 d时,10 ℃贮藏的对照组块茎的质量损失率为6.51%,而CA1实验组块茎的质量损失率仅为4.15%。4 ℃贮藏时CK组块茎的质量损失率为4.43%,明显高于各实验组,各实验组之间无明显差异。说明低氧高二氧化碳的贮藏环境可以降低马铃薯因为呼吸作用引起的营养物质的消耗及蒸发作用引起的失水,这与张敏欢等[23]的研究结果一致。
发芽率和腐烂率也是评价马铃薯贮藏品质的重要指标,由图3B1、B2可知,发芽率随贮藏时间的延长呈先基本不变后上升的趋势,相同处理组贮藏于10 ℃的发芽率明显高于4 ℃贮藏时的发芽率。贮藏至120 d时两个温度贮藏的CK组发芽率明显高于同温度的实验组。与其他各实验组相比,CA5实验组的发芽率最低。说明高CO2体积分数可抑制马铃薯块茎的发芽,Khanbari等[33]的研究也呈现相似的结果。马铃薯在贮藏过程中,适当降低贮藏环境中的O2体积分数并提高CO2体积分数可有效抑制块茎的呼吸作用,延长马铃薯的休眠期,利于马铃薯的贮藏。但过高的CO2和过低的O2会使马铃薯产生内部变色、生理病害等腐烂现象[23,34],这与本研究的结果一致。
如图3C1、C2所示,贮藏至120 d时,两个温度贮藏的CA5实验组块茎的腐烂率均明显高于同温度的CK组及CA1实验组。所以,高体积分数CO2实验组在抑制发芽的同时会导致块茎腐烂率的升高,长时间高CO2处理可能会对马铃薯品质造成伤害[35]。
2.2.2 薯皮亮度
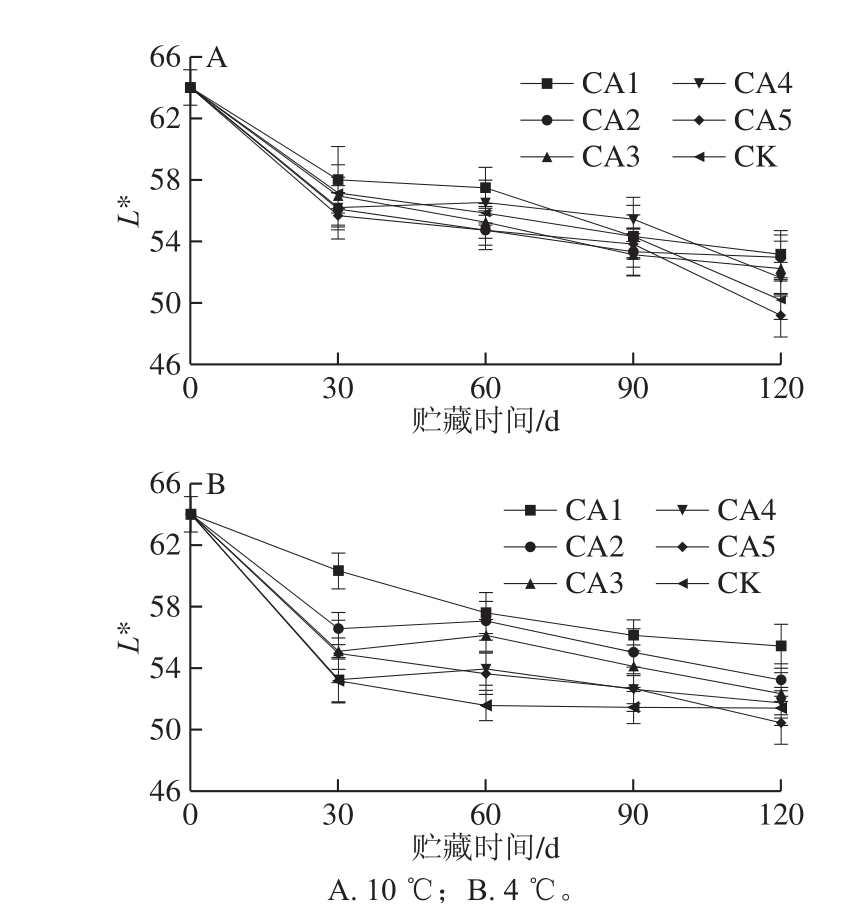
图4 不同处理对马铃薯薯皮亮度的影响
Fig.4 Effect of different treatments on L* value of potato tubers
在马铃薯的采后贮藏过程中,马铃薯的薯皮色泽也会因贮藏环境的差异发生不同程度的变化。通常以L*值代表薯皮的亮暗,L*值越大说明薯皮越亮,反之则越暗。由图4可知,随贮藏时间的延长,薯皮的L*值呈下降趋势,L*值下降说明薯皮色泽会随着贮藏时间的延长变暗。10 ℃贮藏至120 d时,实验组中除CA5组的L*值低于CK组,其他实验组的L*值均高于CK组,CA5实验组块茎薯皮的L*值明显低于CA1实验组,4 ℃贮藏至120 d时也呈现出相同的现象。由此可见,适宜的低氧高二氧化碳贮藏环境有利于保持块茎良好的薯皮色度,但过高CO2体积分数反而会导致薯皮褐变。
2.3 不同处理对马铃薯生理品质的影响
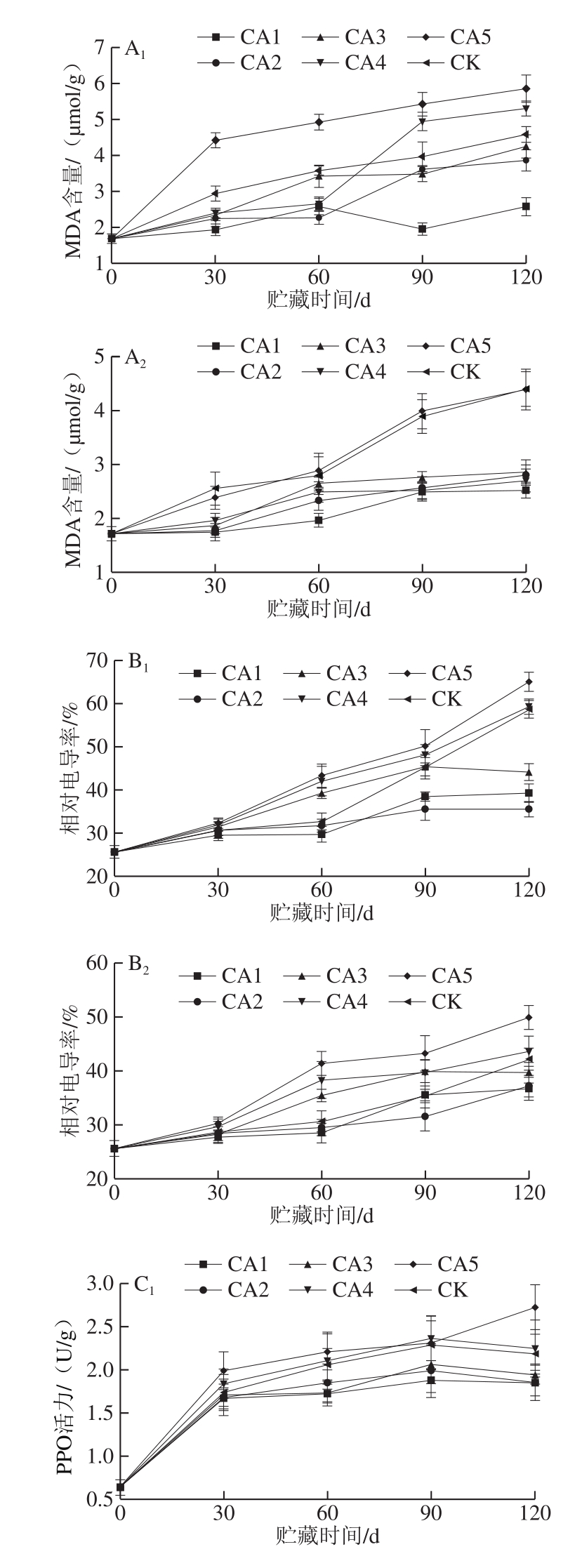
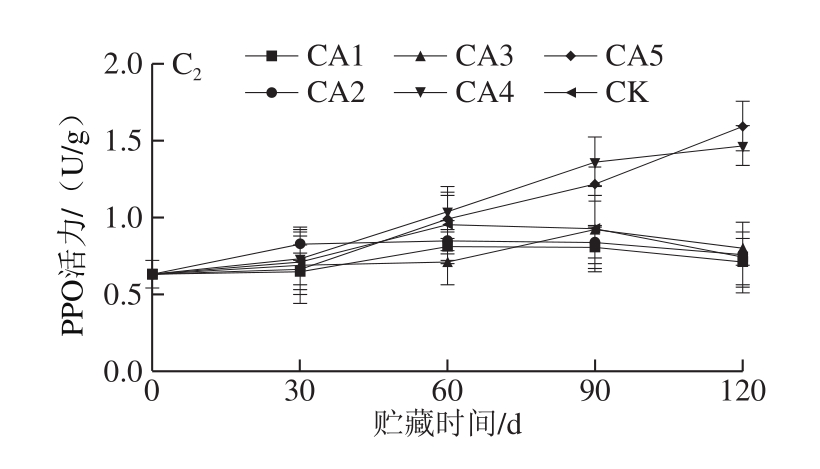
图5 不同处理对马铃薯MDA含量(A)、相对电导率(B)及PPO活力(C)的影响
Fig.5 Effect of different treatments on malondialdehyde content (A),relative conductivity (B) and PPO activity (C) of potato tubers
MDA是膜脂过氧化物作用的主要产物,其含量能反映细胞膜的过氧化程度,可用来衡量果蔬衰老与膜伤害的程度[29]。由图5A1、A2可知,MDA含量在整个贮藏过程中整体呈上升趋势,MDA含量的上升说明马铃薯膜脂过氧化程度增强,细胞膜透性增大。贮藏至120 d时,10 ℃贮藏的CA1实验组的MDA含量最低,且明显低于CK组;4 ℃贮藏的CA1实验组的MDA含量明显低于CA5和CK组,实验组中除CA5外,其他实验组之间无明显差异。由此可以得出,马铃薯块茎贮藏于CA1(5% O2+2% CO2)环境时能够抑制膜脂过氧化作用,保护膜系统的相对完整性。
电导率可反映电解质的渗透量,进而反映细胞膜的透性,电导率越大表明电解质的渗透量越大,细胞膜受损害的程度越严重[28]。如图5B1、B2所示,各实验组和CK组马铃薯块茎的相对电导率随贮藏时间的延长呈上升趋势,贮藏至120 d时,两个温度贮藏的CA5实验组的相对电导率明显高于CK组和其他实验组,各实验组之间相比,CA1和CA2实验组块茎的相对电导率处于较低水平,说明马铃薯贮藏于5% O2+2% CO2和5% O2+4% CO2环境时可降低细胞膜受破坏的程度,而环境中CO2体积分数过高时反而不利于马铃薯的贮藏。
PPO是马铃薯块茎休眠期间分生组织呼吸作用的末端氧化酶,也是引发果蔬褐变的关键酶之一,能催化酚类物质分解,其活力在一定程度上能反映马铃薯块茎的衰老程度。如图5C1、C2所示,不同温度和不同处理的马铃薯PPO活力在贮藏过程中均有不同程度的上升,贮藏至120 d时,两个温度贮藏的CA5实验组马铃薯块茎的PPO活力均明显高于CA1组,而CA1实验组的PPO活力与CK和各处理组相比,均处于最低水平。因此,可认为马铃薯块茎贮藏于5% O2+2% CO2环境可延缓PPO活力的升高,从而延缓马铃薯块茎的衰老,本结果与陈磊等[36]的结果一致。
3 结 论
本实验对马铃薯在4 ℃和10 ℃低氧高二氧化碳环境贮藏120 d过程中的主要营养、外观及生理品质进行综合分析,研究低氧高二氧化碳贮藏环境对马铃薯品质的影响。结果表明,马铃薯在4 ℃贮藏时所有实验组贮藏的块茎质量损失率明显低于CK组,当贮藏环境的O2体积分数为5%,CO2体积分数低于10%(CA1~CA4处理)时均能够延缓贮藏过程中块茎还原糖含量的上升,并且保持薯皮良好的色泽及块茎良好的生理品质。贮藏环境中O2的体积分数为5%、CO2的体积分数为10%(CA5)时反而加速了块茎在贮藏过程中还原糖含量的上升,及块茎腐烂率的升高和生理品质劣变,但明显降低了发芽率。比较几个实验组发现,贮藏环境中的气体体积分数为5% O2+2% CO2(CA1)能够对抑制马铃薯块茎中还原糖含量的上升、保持薯皮色泽、抑制膜脂过氧化、保护膜系统的相对完整性、延缓PPO活力升高的效果最好,从而延缓马铃薯块茎的衰老。
[1]NAYAK B, BERRIOS J D F, TANG J.Impact of food processing on the glycemic index (GI) of potato products[J].Food Research International, 2014, 56: 35-46.DOI:10.1016/j.foodres.2013.12.020.
[2]文国宏, 李高峰, 李建武, 等.陇薯系列马铃薯品种营养品质评价及相关性分析[J].核农学报, 2018, 32(11): 2162-2169.DOI:10.11869/j.issn.100-8551.2018.11.21.
[3]鞠栋, 木泰华, 孙红男, 等.不同工艺马铃薯粉物化特性及氨基酸组成比较[J].核农学报, 2017, 31(6): 1100-1109.DOI:10.11869/j.issn.100-8551.2017.06.1100.
[4]王玉萍, 隋景航, 梁延超, 等.甘肃省两个生态区马铃薯加工品质差异和加工品质筛选[J].甘肃农业大学学报, 2016, 51(11): 39-45.DOI:10.13432/j.cnki.jgsau.2016.05.007.
[5]杨炳南, 张小燕, 赵凤敏, 等.不同马铃薯品种的不同加工产品适宜性评价[J].农业工程学报, 2015, 31(20): 301-308.DOI:10.3969/j.issn.1002-6819.2015.20.042.
[6]ADEDEJI A A, NGADI M.Impact of freezing method, frying and storage on fat absorption kinetics and structural changes of parfried potato[J].Journal of Food Engineering, 2018, 218(2): 24-32.DOI:10.1016/j.jfoodeng.2017.08.024.
[7]SANLI A, KARADOGON T, TONGUC M, et al.Effects of caraway(Carum carvi L.) seed on sprouting of potato (Solanum tuberosum L.)tubers under different temperature conditions[J].Turkish Journal of Field Crops, 2010, 15(1): 54-58.DOI:10.3906/tar-0911-59.
[8]FRIEDMAN M.Chemistry, biochemistry, and safety of acrylamide.a review[J].Journal of Agricultural and Food Chemistry, 2003, 51:4504-4526.DOI:10.1021/jf030204+.
[9]ZOMMICK D H, KNOWLES L O, PAVEK M J, et al.In-season heat stress compromises postharvest quality and low-temperature sweetening resistance in potato (Solanum tuberosum L.)[J].Planta,2014, 239(6): 1243-1263.DOI:10.1007/s00425-014-2048-8.
[10]ZOMMICK D H, KNOWLES L O, KNOWLES N R.Tuber respiratory profiles during low temperature sweetening (LTS) and reconditioning of LTS-resistant and susceptible potato (Solanum tuberosum L.) cultivars[J].Postharvest Biology and Technology, 2014,92: 128-138.DOI:10.1016/j.postharvbio.2014.01.020.
[11]SILVEIRA A C, OYARZÚN D, SEPÚLVED A, et al.Effect of genotype, raw-material storage time and cut type on native potato suitability for fresh-cut elaboration[J].Postharvest Biology and Technology, 2017, 128(6): 1-10.DOI:10.1016/j.postharvbio.2017.01.011.
[12]刘勋, 林原, 柳俊, 宋波涛, 等.马铃薯StInvInh2在块茎低温糖化中的作用机制[C]// 马铃薯产业与农村区域发展.重庆: 哈尔滨地图出版社, 2013: 149-163.
[13]HERMAN D J, KNOWLES L O, KNOWLES N R.Heat stress affects carbohydrate metabolism during cold-induced sweetening of potato(Solanum tuberosum L.)[J].Planta, 2017, 245: 563-582.DOI:10.1007/s00425-016-2626-z.
[14]HALFORD N G, CURTIS T Y, MUTTUCUMARU N, et al.The acrylamide problem: a plant and agronomic science issue[J].Journal of Experimental Botany, 2012, 63(8): 2841-2851.DOI:10.1093/jxb/ers011.
[15]HERMAN D J, KNOWLES L O, KNOWLES N R.Low oxygen storage modulates invertase activity to attenuate cold-induced sweetening and loss of process quality in potato (Solanum tuberosum L.)[J].Postharvest Biology and Technology, 2016, 121: 106-117.DOI:10.1016/j.postharvbio.2016.07.017.
[16]孟卫芹, 王庆国.高二氧化碳处理对马铃薯绿变和龙葵素含量的影响[J].农学学报, 2012, 2(8): 13-16.
[17]威廉·F·塔尔伯特, 奥拉·史密斯.马铃薯生产与食品加工[M].上海:上海科学技术出版社, 2017: 149.
[18]国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品中淀粉的测定: GB 5009.9—2016[S].北京: 中国标准出版社, 2016: 1-2.
[19]国家卫生和计划生育委员会.食品安全国家标准 食品中还原糖的测定: GB 5009.7—2016[S].北京: 中国标准出版社, 2016: 1-4.
[20]国家卫生和计划生育委员会.食品安全国家标准 食品中抗坏血酸的测定: GB 5009.86—2016[S].北京: 中国标准出版社, 2016: 7-8.
[21]国家卫生和计划生育委员会.食品安全国家标准 食品中水分的测定: GB 5009.3—2016[S].北京: 中国标准出版社, 2016: 1-2.
[22]国家食品药品监督管理局, 国家卫生和计划生育委员会.食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2016[S].北京: 中国标准出版社,2016: 1-3.
[23]张敏欢, 王莉梅, 王治洲, 等.静电场结合自发气调包装对马铃薯贮藏期间的保鲜效果[J].食品科学, 2019, 40(9): 269-275.DOI:10.7506/spkx1002-6630-20180429-390.
[24]MAHTO R, DAS M.Effect of gamma irradiation on the physicomechanical and chemical properties of potato (Solanum tuberosum L.), cv.‘Kufri Sindhuri', in non-refrigerated storage conditions[J].Postharvest Biology and Technology, 2014, 92: 37-45.DOI:10.1016/j.postharvbio.2014.01.011.
[25]SELCUK N, ERKAN M.The effects of modified and palliflex controlled atmosphere storage on postharvest quality and composition of ‘Istanbul' medlar fruit[J].Postharvest Biology and Technology,2015, 99: 9-19.DOI:10.1016/j.postharvbio.2014.07.004.
[26]刘娟, 梁延超, 隋景航, 等.马铃薯块茎蒸煮品质、质构特性及加工型品系筛选[J].中国农业科学, 2016, 49(21): 4074-4084.DOI:10.3864/j.issn.0578-1752.2016.21.002.
[27]曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京: 中国轻工业出版社, 2007: 103.
[28]白友强, 廖亮, 许建, 等.不同臭氧处理对甜瓜采后生理影响[J].食品工业科技, 2017, 38(23): 256-261.DOI:10.13386/jissn1002-0306.2017.23.047.
[29]姜红.采后BTH处理对马铃薯块茎愈伤的促进[D].兰州: 甘肃农业大学, 2017: 17.
[30]田甲春, 田世龙, 程建新, 等.马铃薯贮藏期间呼吸强度与营养品质的变化[C]// 马铃薯产业与精准扶贫.毕节: 哈尔滨地图出版社,2017: 397-402.
[31]吕巨智, 染和, 姜建初.马铃薯的营养成分及保健价值[J].中国食物与营养, 2009(3): 51-52.
[32]李菁雯.鲜切果蔬包装内环境对其品质的影响[D].西安: 西安理工大学, 2017: 2.
[33]KHANBARI O S, THOMPSON A K.The effect of controlled atmosphere storage at 4 ℃ on crisp colour and on sprout growth,rotting and weight loss of potato tubers[J].Potato Research, 1994, 37:291-300.DOI:10.1007/BF02360522.
[34]TEIXEIRA G H A, DURIGAN J F.Effect of controlled atmospheres with low oxygen levels on extended storage of guava fruit(Psidiumguajava L.‘Pedro Sato')[J].Hortscience: A Publication of the American Society for Horticultural Science, 2010, 45(6): 918-924.DOI:10.1007/BF02360522.
[35]孟卫芹.马铃薯采后绿变控制及品质保持技术研究[D].泰安: 山东农业大学, 2012: 22.
[36]陈磊, 郭玉蓉, 白鸽, 等.低温和气调对不同色泽‘红富士'苹果贮藏期间果皮褪色现象的影响[J].食品科学, 2015, 36(22): 210-215.DOI:10.7506/spkx1002-6630-201522040.