豆浆中的Bowman-Birk胰蛋白酶抑制剂(Bowman-Birk inhibitor,BBI)是一种热稳定性极高的双头抑制剂,可抑制胰蛋白酶和胰凝乳蛋白酶[1-2]。在100 ℃、15 min的条件下,豆浆中的Kunitz胰蛋白酶抑制剂(Kunitz trypsin inhibitor,KTI)几乎全部失活,但只有不到5%的BBI失活[3]。研究表明:KTI和BBI分别贡献豆浆中约75%和25%的胰蛋白酶抑制活性(trypsin inhibitor activity,TIA)[4-5]。有报道指出,TIA降低90%后,也就是大约60%的BBI失活后,豆浆具有最高的营养价值[6-7]。
20世纪80年代开始,有很多研究表明,BBI浓缩物(BBI纯度70%以上)具有抗癌的效果[8],尤其是结肠癌[9]、乳腺癌[10]和前列腺癌[11]。1992年,美国食品药品监督管理局批准了大豆BBI浓缩物可用于临床研究。临床研究发现,BBI浓缩物对于口腔白斑病、溃疡性结肠炎和良性前列腺增生具有较好的效果[12-17]。但在临床研究中,BBI的最大剂量为800 U/(d·人),相当于3.86 mg活性BBI[12]。在此剂量下,BBI不会对人体产生副作用。按照BBI占大豆总体蛋白的1%,豆浆蛋白质量分数为2.4%计算,100 mL未加热豆浆中含有24 mg BBI,该含量远大于推荐剂量。这说明在保证人体安全的条件下,应该破坏BBI活性。这也侧面解释了中国的传统豆腐工艺要进行压制去黄浆水的原因(含有许多活性BBI)。
随着研究深入,有研究者提出BBI浓缩物中具有抗癌效果的并不是BBI,而是伴随蛋白成分lunasin[18-20]。在进入消化系统后,BBI起到保护lunasin不受胃蛋白酶和胰蛋白酶水解的作用。不过也有研究者提出BBI能够抑制体内变异的丝氨酸蛋白酶[21],从而抑制癌症发展。
基于上述研究结果,对BBI进行一定程度的热失活是必要的。文献报道BBI热失活原因可归结为以下3大类:1)热诱导BBI构象变化[22];2)BBI与大豆蛋白的相互作用(巯基/二硫键交换反应和蛋白质聚集体形成)[23];3)与还原糖(如葡萄糖和果糖)发生美拉德反应[24]。然而,目前还没有文献报道上述3大类原因对于BBI热失活的贡献程度。本研究通过建立模型体系研究豆浆成分中的还原糖和大豆蛋白对BBI活性的影响,并分析BBI热失活的贡献程度,旨在为通过添加还原糖和调节豆浆蛋白含量调控胰蛋白酶抑制活性和指导豆制品生产提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
有机大豆,产地黑龙江,2015年收获,购于优谷坊。
盐酸、95%乙醇溶液、氢氧化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、硫酸铵、甲醇、氯化钠、冰乙酸、二水氯化钙、二甲亚砜、丙酮、考马斯亮蓝G-250、甘油、β-巯基乙醇(β-mercaptoethanol,β-ME)、三氯乙酸、三羟甲基氨基甲烷(Tris)、溴酚蓝国药集团化学试剂有限公司;胰蛋白酶 美国Worthington公司;α-胰凝乳蛋白酶、N-苯甲酰-L-酪氨酸酰对硝基苯胺(N-benzoyl-L-tyrosine p-nitroanilide,BTpNA)、丙烯酰胺、N,N,-甲叉双丙烯酰胺、N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(N-benzoyl-DL-arginine 4-nitroanilide hydrochloride,BAPA))、N-三(羟甲基)甲基(Tricine)、ι-卡拉胶(ι-carrageenan,ι-CG)美国Sigma-Aldrich公司;精确分子质量双色预染蛋白标准品 美国Bio-Rad公司。
1.2 仪器与设备
MOS-450圆二色谱仪 法国BioLogic公司;Gel Doc-It TS凝胶成像仪 美国UVP公司;电脑恒温层析柜上海沪西分析仪器厂;CR 21G II型冷冻离心机 日本Hitachi公司;UV-1500紫外-可见分光光度计 翱艺仪器(上海)有限公司;基质辅助激光解析飞行时间质谱仪德国Bruker Daltonics公司;DYY-8C型垂直电泳仪北京六一仪器厂;1100液相色谱仪 美国安捷伦公司;等电聚焦仪 美国Bio-Rad公司。
1.3 方法
1.3.1 BBI的分离
按照He Hui等[22]的方法进行制备。称量100 g黄豆于4 ℃浸泡18 h,加水至1 000 g,磨浆1 min。4 层纱布过滤除去豆渣,调节豆浆pH 4.5,10 000×g离心30 min,收集上清液。加入硫酸铵至40%饱和度,15 000×g离心30 min,收集沉淀并溶解于去离子水中,调节pH 7.0。采用截留分子质量3 500 Da的透析袋于4 ℃透析48 h。稀释透析完蛋白质溶液质量浓度(BCA方法测定)至0.4 g/100 mL,并调节pH 7.0。同时准备0.4 g/100 mL的ι-CG溶液。按照蛋白与多糖质量比5∶1,将以上蛋白溶液和多糖溶液混合均匀,调节pH 3.85;5 000×g离心20 min,收集上清液。将上清液用1.0 mol/L NaOH溶液调至pH 7.0,利用截留分子质量100 kDa的超滤装置进行超滤去除卡拉胶,收集滤过液。将滤过液再次使用3 500 Da透析袋4 ℃透析48 h后,冷冻干燥,收集样品,贮藏于-20 ℃备用。所得样品的BBI纯度超过70%[22],以下称其为BBI。
1.3.2 大豆蛋白制备
20 g大豆于4 ℃浸泡18 h,加去离子水至200 g,磨浆1 min,4 层纱布过滤除去豆渣。豆浆中加入20%的蔗糖,25 000×g高速离心30 min,得到上浮、清液和沉淀,利用注射器吸取清液。用2 mol/L盐酸将清液pH值调至4.5,3 000×g离心5 min,得到清液和沉淀,倒去清液,加入300 g去离子水,搅拌均匀,调pH值至4.5,3 000×g离心5 min,得到清液和沉淀,倒去清液,加入300 g去离子水,搅拌均匀,调pH值调4.5,3 000×g离心5 min,得到清液和沉淀。以上过程是为了除去大豆清蛋白,尤其是其中的KTI和BBI,这是因为它们在pH 4.5时具有良好的水溶性[25]。向沉淀里加入20 g去离子水,搅拌均匀,用2 mol/L氢氧化钠溶液调pH 7.0,用3 500 Da透析袋4 ℃透析48 h后,冷冻干燥得到大豆蛋白样品。
1.3.3 还原糖对BBI热失活的影响
制备2 mg/mL的BBI溶液,称取一定量的葡萄糖或果糖,添加至BBI溶液中,使溶液体系中的葡萄糖质量浓度为0.05、0.1、0.3、0.5、0.7、1、2 mg/mL和3 mg/mL,或果糖质量浓度为2 mg/mL。混合均匀后,沸水浴加热。
1.3.4 大豆蛋白对BBI热失活的影响
制备质量浓度均为4 mg/mL的BBI和大豆蛋白溶液,等体积混合均匀,沸水浴加热。
1.3.5 TIA测定
参考Lu Lu等[26]的方法。对1.3.3节和1.3.4节的反应体系进行稀释,使得稀释后的1 mL样品可以抑制40%~60%的胰蛋白酶。将1 mL稀释样品和1 mL去离子水加入到试管中5 min,加入5 mL的0.04 g/100 mL BAPA(pH 8.2 Tris-盐酸缓冲液,0.02 mol/L CaCl2)为底物,再加入2 mL的0.012 g/100 mL胰蛋白酶(0.04 mmol/L盐酸)。10 min之后,加入1 mL的体积分数30%乙酸溶液终止反应。混合均匀后,利用紫外分光光度计在410 nm波长处测定吸光度。试剂空白:按稀释样品、乙酸溶液、去离子水、胰蛋白酶溶液和BAPA顺序加入试管;样品空白:按去离子水、乙酸溶液、去离子水、胰蛋白酶溶液和BAPA顺序加入试管。原始样品需要稀释至1 mL,稀释样品可以抑制40%~60%的胰蛋白酶。上述操作在37 ℃水浴中进行。
1.3.6 胰凝乳蛋白酶抑制活性(chymotrypsin inhibitor activity,CIA)测定
参考Lu Lu等[26]的方法。将1 mL稀释样品、1 mL去离子水和4.2 mL的0.05 mol/L Tris-盐酸缓冲液(pH 8.2,0.01 mol/L CaCl2)加入到试管中。10 min后,加入2 mL的0.02%胰凝乳蛋白酶(溶于0.002 mol/L盐酸),再加入0.04 g/100 mL BTpNA(溶于丙酮),混合均匀。10 min后,加入30%乙酸溶液终止反应。利用紫外分光光度计在385 nm波长处测定吸光度。试剂空白:按稀释样品、乙酸溶液、去离子水、Tris-盐酸、胰蛋白酶溶液和BTpNA顺序加入试管;样品空白:按去离子水、乙酸溶液、去离子水、Tris-盐酸、胰凝乳蛋白酶溶液和BTpNA顺序加入试管。原始样品需要稀释到1 mL,稀释样品可以抑制30%~40%的胰凝乳蛋白酶。上述操作在37 ℃水浴中进行。
1.3.7 Tricine-SDS-PAGE分析
参考Schagger[27]的方法。2 mg/mL的蛋白样品与等体积的样品溶解液混合。10 μL加入电泳胶,在恒定电压(30 mV)下直到所有样品进入浓缩胶,再在恒定电压(100 mV)下直到结束。
1.3.8 对角线电泳实验
参考Zhao Luping等[28]的方法,按照1.3.7节方法进行第一向电泳实验。结束后,将目标泳道切下,浸入体积分数2% β-ME溶液中。沸水浴5 min后,静置在水浴中10 min(还原二硫键)。将还原后的胶条放置于电泳夹板中,灌入提前配好的分离胶溶液,使胶液没过预先装入的胶条,左右晃动,反复3 次后,水封,静置等待分离胶凝固。注意灌入同时不要产生气泡。凝固后,在恒定电压(100 mV)下进行电泳测定。
1.3.9 圆二色谱测定
采用远紫外光谱法分析样品的二级结构,在室温下进行实验,对照为去离子水。石英比色皿厚度为0.2 cm,光谱分辨率为0.5 nm,比色皿厚度为1.0 nm,响应时间为0.125 s。扫描波长为190~250 nm,扫描速率为2 s/nm。重复扫描9 次后取平均值。
采用近紫外光谱法分析样品的三级结构,对照为去离子水。石英比色皿厚度为1.0 cm,扫描波长为250~300 nm,扫描速率为2 s/nm。重复扫描9 次后取平均值。
1.4 数据分析及图表绘制
每个样品的TIA和CIA至少测定3 次取平均值,使用Microsoft Excel 2007软件计算标准偏差。BBI条带强度利用Image Lab Software(Bio-Rad,Hercules,CA)进行分析。利用Microsoft Excel 2007软件绘制图。
2 结果与分析
2.1 未加热条件下还原糖对BBI活性影响
豆浆含有葡萄糖和果糖等还原糖,有研究报道美拉德反应的发生会影响BBI活性[24]。首先,考察在没有加热的情况下葡萄糖和果糖对BBI活性的影响(图1a)。结果显示,葡萄糖可以增强BBI的TIA和CIA,而果糖不影响BBI活性。该实验重复3 次,显示同样的结果。因此,将BBI与不同比例的葡萄糖混合(图1b),结果显示:随着葡萄糖质量浓度增大,TIA和CIA先增大后减小;当葡萄糖质量浓度达到0.3 mg/mL时,TIA最大;葡萄糖质量浓度达到0.5 mg/mL时,CIA最大。上述结果说明葡萄糖可以增强BBI和胰蛋白酶/胰凝乳蛋白酶之间的相互作用,而果糖不影响。对于该现象,利用圆二色谱考察葡萄糖对于BBI二级结构和三级结构的影响。

图1 未加热条件下还原糖对BBI(22 mmgg/mL)活性的影响
Fig. 1 Effects of glucose and fructose on BBI activity without heating
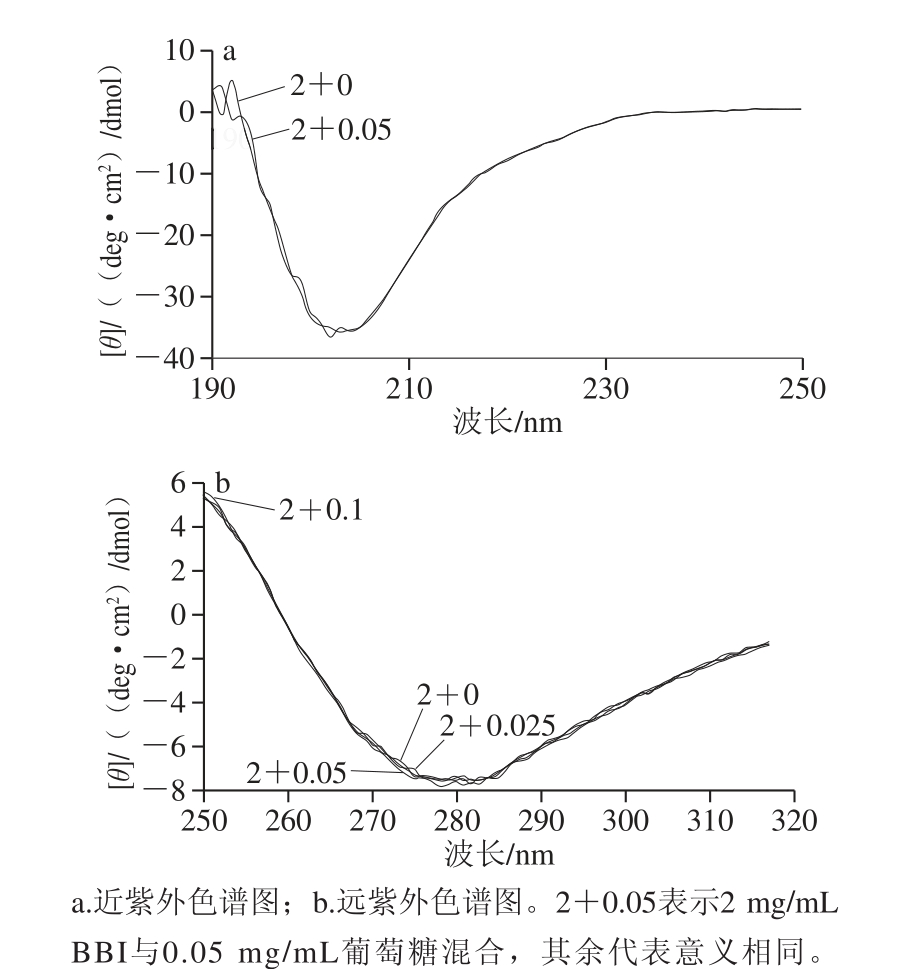
图2 BBI与葡萄糖的混合体系的圆二色谱图
Fig. 2 CD spectra of mixture of BBI and glucose
圆二色谱(图2)显示,葡萄糖可轻微地改变BBI的空间构象。对BBI与葡萄糖混合后,样品的TIA、CIA增大。推测此现象的可能原因是:高亲水性的葡萄糖分子与BBI分子抑制中心的某些氨基酸残基形成氢键,使得BBI分子抑制中心发生变化,从而导致其抑制剂活性增加。具体原因有待进一步研究。
2.2 加热条件下还原糖对BBI活性的影响

图3 沸水浴加热条件下葡萄糖和果糖对BBI的TIAA( aa)和CIA(b)残留率的影响
Fig. 3 Effects of glucose and fructose on the TIA (a) and CIA (b) of BBI in boiling water bath
图3 a显示:随着加热时间的延长,BBI单纯体系和BBI+还原糖的TIA逐渐减小;热处理0.5 h后,果糖+BBI与BBI单纯体系中TIA残留率相差不大,此后,两类样品的差距加大,差距保持在13%左右;热处理3 h后,BBI单纯体系的TIA残留率最高(约81%),而葡萄糖+BBI和果糖+BBI的TIA残留率分别约为58%和69%;葡萄糖+BBI的TIA一直保持着最快的下降速率,但下降速率逐渐趋于缓慢。图3b显示:还原糖对BBI的CIA影响不大,这与BBI的TIA和CIA活性中心的氨基酸残基组成密切相关。TIA的活性中心包含一个赖氨酸残基,可与还原糖发生美拉德反应,而CIA的活性中心没有赖氨酸残基和精氨酸残基。由以上结果可知,在葡萄糖+BBI体系中,3 h热处理后TIA降低了42%,其中热诱导构象改变贡献了19%,而2 mg/mL葡萄糖贡献了23%;在果糖+BBI体系中,3 h热处理降低了31%的TIA,其中热诱导构象改变贡献了19%,而2 mg/mL果糖贡献了12%。
2.3 加热条件下大豆蛋白对BBI活性影响
豆浆在热处理过程中形成蛋白质聚集体,会将BBI包裹在聚集体内部从而使这部分BBI失去活性[21]。图4a和4b显示大豆蛋白对TIA的影响不大,对CIA的影响程度随时间延长逐渐增大。在沸水浴3 h条件下,大豆蛋白+BBI体系的TIA下降了23%,而BBI单纯体系下降了20%,说明大豆蛋白贡献了3%的下降率;大豆蛋白+BBI体系的CIA下降了50%,而BBI单纯体系下降了23%,说明大豆蛋白贡献了27%的下降率。

图4 加热条件下大豆蛋白对BBI(22 mmgg/mL)活性的影响
Fig. 4 Effects of SP on BBI activity under heating condition
图4 c、d显示,大豆蛋白质量浓度越大,对于TIA,尤其是CIA,影响越大。这与BBI的结构密切相关,BBI的胰蛋白酶抑制活性中心的稳定性强于胰凝乳蛋白酶抑制活性中心[29-30]。因此,胰凝乳蛋白酶抑制活性中心空间构象较易发生变化,与大豆蛋白发生相互作用,从而影响胰凝乳蛋白酶抑制中心活性的表达;而胰蛋白酶抑制活性中心空间结构不易被破坏,与大豆蛋白相互作用弱,从而促进TIA失活比较慢。上述结果说明大豆蛋白对BBI的CIA影响较大,对TIA影响较小;蛋白质量浓度增大,也会加快TIA失活,尤其是CIA。
BBI与大豆蛋白发生相互作用有两种方式,一种是非共价键相互作用,另一种是共价键相互作用。一个BBI分子含有7 个二硫键,而大豆蛋白含有游离巯基,由此可推测BBI可能会与大豆蛋白发生巯基/二硫键交换反应。基于此,可通过非还原电泳考察BBI与大豆蛋白之间的二硫键连接,通过对角线电泳考察BBI与哪些蛋白成分之间产生了二硫键连接。图5a显示加热对大豆蛋白+BBI和BBI单纯体系的影响(非还原电泳),随着加热时间延长,BBI条带强度逐渐减弱。对图5a中的BBI条带强度进行分析(图5b),结果显示大豆蛋白+BBI体系的BBI条带强度减弱速率快于BBI单纯体系,这说明BBI与大豆蛋白发生了巯基/二硫键交换反应。通过对角线电泳(图5c),结果显示BBI不但可以与大豆球蛋白的酸性肽链和碱性肽链等蛋白成分形成多聚体,还可与碱性肽链形成二聚体;另外,BBI还可形成BBI二聚体。

图5 加热条件下BBI与大豆蛋白之间二硫键连接
Fig. 5 Disul fide bond linkage between BBI and SP under heating condition
3 结 论
本研究利用模型体系考察豆浆成分对BBI活性的影响。首先考察豆浆中的还原糖对BBI活性的影响,结果显示:在未加热条件下,葡萄糖有增强BBI活性的作用,而果糖则没有;在加热条件下,还原糖对BBI的TIA影响很大,而对CIA影响非常小;葡萄糖对BBI的TIA影响程度比果糖大。葡萄糖+BBI(2 mg/mL葡萄糖、2 mg/mL BBI)体系中,沸水浴3 h后TIA降低了42%,其中热诱导构象改变贡献了19%,葡萄糖贡献了23%;果糖+BBI体系中,3 h热处理降低了31%的TIA,其中热诱导构象改变贡献了19%,而2 mg/mL果糖贡献了12%。
考察大豆蛋白对BBI活性的影响,结果显示:大豆蛋白对BBI的CIA影响程度大于TIA;BBI可与大豆球蛋白的碱性肽链形成二聚体,也可与大豆球蛋白形成多聚体;BBI可形成二聚体。沸水浴3 h条件下,大豆蛋白+BBI体系(2 mg/mL大豆蛋白、2 mg/mL BBI)的TIA下降了23%,而BBI单纯体系下降了20%,大豆蛋白贡献了3%;大豆蛋白+BBI体系的CIA下降了50%,而BBI单纯体系下降了23%,大豆蛋白贡献了27%。
[1] LIU C, LUO L J, WU Y, et al. Inactivation of soybean Bowman-Birk inhibitor by stevioside: interaction studies and application to soymilk[J]. Journal of Agricultural and Food Chemistry, 2019, 67(8):2255-2264. DOI:10.1021/acs.jafc.8b05609.
[2] 程芬芬, 刘春, 杨晓泉. 大豆胰蛋白酶抑制剂的制备及性质[J]. 食品科学, 2017, 38(3): 37-44. DOI:10.7506/spkx1002-6630-201703007.
[3] CHEN Y M, XU Z C, ZHANG C M, et al. Heat-induced inactivation mechanisms of Kunitz trypsin inhibitor and Bowman-Birk inhibitor in soymilk processing[J]. Food Chemistry, 2014, 154: 108-116.DOI:10.1016/j.foodchem.2013.12.092.
[4] VAN DEN HOUT R, POUW M, GRUPPEN H, et al. Inactivation kinetics study of the Kunitz soybean trypsin inhibitor and the Bowman-Birk inhibitor[J]. Journal of Agricultural and Food Chemistry, 1998,46: 281-285. DOI:10.1021/jf970506+.
[5] DIPIETRO C M, LIENER I E. Heat inactivation of the Kunitz and Bowman-Birk soybean protease inhibitors[J]. Journal of Agricultural and Food Chemistry, 1989, 37(1): 39-44. DOI:10.1021/jf00085a010.
[6] ROUHANA A, ADLER N J, COGAN U, et al. Heat inactivation kinetics of trypsin inhibitors during high temperature-short time processing of soymilk[J]. Journal of Food Science, 1996, 61(2):265-269. DOI:10.1111/j.1365-2621.1996.tb14173.x.
[7] KWOK K C, LIANG H H, NIRANJAN K. Optimizing conditions for thermal processes of soy milk[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4834-4838. DOI:10.1021/jf020182b.
[8] KENNEDY A R. The Bowman-Birk inhibitor from soybeans as an anticarcinogenic agent[J]. The American Journal of Clinical Nutrition,1998, 68(6): 1406-1412. DOI:10.1093/ajcn/68.6.1406s.
[9] FEREIDUNIAN A, SADEGHALVAD M, OSCOIE M O, et al.Soybean Bowman-Birk protease inhibitor (BBI): identification of the mechanisms of BBI suppressive effect on growth of two adenocarcinoma cell lines: AGS and HT29[J]. Archives of Medical Research, 2014, 45(6): 455-461. DOI:10.1016/j.arcmed.2014.07.001.
[10] MEHDAD A, BRUMANA G, SOUZA A A, et al. A Bowman-Birk inhibitor induces apoptosis in human breast adenocarcinoma through mitochondrial impairment and oxidative damage following proteasome 20S inhibition[J]. Cell Death Discovery, 2016, 2: 15067. DOI:10.1038/cddiscovery.2015.67.
[11] KENNEDY C W, DONAHUE J J, WAN X S. Effects of the Bowman-Birk protease inhibitor on survival of fibroblasts and cancer cells exposed to radiation and cis-platinum[J]. Nutrition and Cancer, 1996,26(2): 209-217. DOI:10.1080/01635589609514477.
[12] ARMSTRONG W B, KENNEDY A R, WAN X S, et al. Single-dose administration of Bowman-Birk inhibitor concentrate in patients with oral leukoplakia[J]. Cancer Epidemiology Biomarkers & Prevention,2000, 9(1): 43-47. DOI:10.1016/0010-7824(89)90053-x.
[13] MAKI P A, PATERSON Y, KENNEDY A R. Studies related to the potential antigenicity of the Bowman-Birk inhibitor, an anticarcinogenic protease inhibitor isolated from soybeans[J]. Nutrition &Cancer, 1994, 22(2): 185-193. DOI:10.1080/01635589409514343.
[14] KENNEDY A R. The Bowman-Birk inhibitor from soybeans as an anticarcinogenic agent[J]. American Journal of Clinical Nutrition,1998, 68(Suppl 6): 1406S-1412S. DOI:10.1093/ajcn/68.6.1406s.
[15] FANG E F, WONG J H, NG T B. Thermostable Kunitz trypsin inhibitor with cytokine inducing, antitumor and HIVJ.H-1 reverse transcriptase inhibitory activities from Korean large black soybeans[J].Journal of Bioscience and Bioengineering, 2010, 109(3): 211-217.DOI:10.1016/j.jbiosc.2009.08.483.
[16] DITTMANN K, LOFFLER H, BAMBERG M, et al. Bowman-Birk protease inhibitor (BBI) modulates radiosensitivity and radiationinduced differentiation of human fibroblasts in culture[J]. Radiotherapy and Oncology, 1995, 34(2): 137-143. DOI:10.1016/0167-8140(94)01494-n.
[17] YAVELOW J, COLLINS M, BIRK Y, et al. Nanomolar concentrations of Bowman-Birk soybean protease inhibitor suppress X-ray-induced transformation in vitro[J]. Proceedings of the National Academy of Sciences of the United States of America, 1985, 82(16): 5395-5399.DOI:10.1073/pnas.82.16.5395.
[18] CRUZ-HUERTA E, FERNANDEZ-TOME S, ARQUES M C, et al.The protective role of the Bowman-Birk protease inhibitor in soybean lunasin digestion: the effect of released peptides on colon cancer growth[J]. Food & Function, 2015, 6: 2626-2635. DOI:10.1039/C5FO00454C.
[19] PRICE S J, PANGLOLI P, KRISHNAN H B, et al. Kunitz trypsin inhibitor in addition to Bowman-Birk inhibitor influence stability of lunasin against pepsin-pancreatin hydrolysis[J]. Food Research International, 2016, 90: 205-215. DOI:10.1016/j.foodres.2016.10.051.
[20] PRICE S J, PANGLOLI P, DIA V P. Pepsin-pancreatin hydrolysis reduced the ability of lunasin-enriched material to inhibit activation of the inflammasomes in THP-1 human macrophages[J]. Food &Function, 2017, 8: 4449-4458. DOI:10.1039/C7FO00992E.
[21] HERNANDEZ-LEDESMA B, HSIEH C C. Chemopreventive role of food-derived proteins and peptides: a review[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(11): 2358-2376. DOI:10.1080/1 0408398.2015.1057632.
[22] HE H, LI X F, KONG X Z, et al. Heat-induced inactivation mechanism of soybean Bowman-Birk inhibitors[J]. Food Chemistry, 2017, 232:712-720. DOI:10.1016/j.foodchem.2017.04.061.
[23] XU Z C, CHEN Y M, ZHANG C M, et al. The heat-induced protein aggregate correlated with trypsin inhibitor inactivation in soymilk processing[J]. Journal of Agricultural and Food Chemistry, 2012, 60:8012-8019. DOI:10.1021/jf3021249.
[24] ARQUES M C, PASTORIZA S, DELGADO-ANDRADE C, et al.Relationship between glycation and polyphenol content and the bioactivity of selected commercial soy milks[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 1823-1830. DOI:10.1021/acs.jafc.6b00181.
[25] LI X, HUA Y, CHEN Y, et al. Two-step complex behavior between Bowman-Birk protease inhibitor and ι-carrageenan: effect of protein concentration, ionic strength and temperature[J]. Food Hydrocolloids,2017, 62: 1-9. DOI:10.1016/j.foodhyd.2016.07.029.
[26] LU L, ZHAO L P, ZHANG C M, et al. Comparative effects of ohmic,induction cooker, and electric stove heating on soymilk trypsin inhibitor inactivation[J]. Journal of Food Science, 2015, 80(3): 495-503. DOI:10.1111/1750-3841.12773.
[27] SCHAGGER H. Tricine-SDS-PAGE[J]. Nature Protocols, 2006, 1:16-22. DOI:10.1038/nprot.2006.4.
[28] ZHAO L P, KONG X Z, ZHANG C M, et al. Soybean P34 probable thiol protease probably has proteolytic activity on oleosins[J].Journal of Agricultural and Food Chemistry, 2017, 65: 5741-5750.DOI:10.1021/acs.jafc.7b02190.
[29] HE H, LI X F, KONG X Z, et al. Effects of disul fide bond reduction on the conformation and trypsin/chymotrypsin inhibitor activity of soybean Bowman-Birk inhibitor[J]. Journal of Agriculture and Food Chemistry, 2017, 65: 2461-2467. DOI:10.1021/acs.jafc.6b05829.
[30] VOSS R, ERMLER U, ESSEN L O, et al. Crystal structure of the bifunctional soybean Bowman-Birk inhibitor at 0.28 nm resolution[J].European Journal of Biochemistry, 1996, 242(1): 122-131.DOI:10.1111/j.1432-1033.1996.0122r.x.