甜瓜作为一种重要的经济作物,广泛分布于热带和亚热带地区[1],其中,中国的甜瓜产量占全球产量的40%[2]。甜瓜因其对土壤和气候有较好的适应,且具有丰富的营养成分和宜人的风味特征而备受种植户和消费者的青睐[3]。然而甜瓜多种植在南北疆偏远地区,运距长,外加甜瓜水分含量大且低酸高糖,易造成腐烂和变质等现象[4],严重制约了甜瓜产业的健康发展。因此,亟需对甜瓜进行深加工。
热处理技术,如高温瞬时杀菌技术,因其可以提高食品安全性和延长货架期而广泛应用于果蔬等农产品加工中;但甜瓜作为热敏性水果的典型代表,超过58 ℃会产生明显的挥发性异味,香气劣变严重[5-6]。实验室前期通过稀释嗅闻技术、计算香气活性值、异味模拟体系重组和缺失实验等感官组学技术对热处理甜瓜汁异味贡献组分进行了精确解析验证,明确了热处理甜瓜汁的12 种关键异味贡献组分,分别为硫醚类化合物二甲基硫醚、二甲基三硫醚、二甲基二硫醚、三甲硫基丙醛、甲硫醇,及一些小分子醛酮化合物包括乙醛、2-甲基丙醛、异戊醛、2-甲基丁醛、庚醛和2,3-丁二酮、2,3-戊二酮[7-9]。
甜瓜的热异味现象已经严重影响了其深加工的发展和自身营养及商品价值的体现,因此,对甜瓜进行异味控制措施的研究意义重大。然而现有相关研究多是对甜瓜热处理异味的定性描述或仅仅是对挥发物的分析[10-12],关于异味成分的控制措施鲜有报道。仅有少数文献报道,以儿茶素为代表的天然多酚可以有效抑制牛奶、豆乳热处理过程中异味物质的形成[13-15],鉴于食品基质的不同,多酚对热处理甜瓜汁中挥发性异味是否同样可以有效抑制以及抑制的效果如何等问题尚需系统深入研究。本研究以上述12 种关键挥发性异味组分为主要目标化合物,通过添加5 种多酚化合物——儿茶素、染料木黄酮、黄豆苷元、海藻多酚、邻苯三酚,以无多酚添加的热处理甜瓜汁为对照(CK),综合利用感官评价和仪器分析并结合统计方法,比较不同多酚的异味抑制作用效果,研究不同种类多酚添加前后热处理甜瓜汁中主要异味物质种类、浓度的变化和作用特点,以寻求抑制异味的最佳多酚化合物,为设计更有效的多酚类异味抑制剂提供借鉴和理论指导。
1 材料与方法
1.1 材料与试剂
86号品种的厚皮网纹甜瓜购于新疆吐鲁番地区,空运抵达后洗净去皮去种,切块,液氮冷冻,混匀后采用铝塑复合薄膜袋密封包装,于-80 ℃保藏备用。
2-甲基-3-庚酮、二甲基硫醚(dimethyl sulfide-D6,D6-DMS)、甲醇(色谱纯) 德国Sigma-Aldrich公司;儿茶素(纯度99%)、染料木黄酮(纯度99%)、黄豆苷元(纯度98%)、邻苯三酚(纯度99.8%)、海藻多酚(纯度95%) 北京百灵威科技有限公司。
1.2 仪器与设备
榨汁机 德国博朗公司;50/30 μm DVB/CAR/PDMS固相萃取头 美国Supelco公司;磁力搅拌加热器大龙兴创实验仪器有限公司;7890B-5977A气相色谱-质谱联用(gas chromatography-mass spectrometry,GCMS)仪 美国Agilent公司。
1.3 方法
1.3.1 样品的制备
从-80 ℃冰箱中随机取出甜瓜样品,放置于4 ℃冰箱过夜解冻,榨汁,200 目绢布过滤去除浮沫后待用。
1.3.2 原汁和多酚添加组果汁样品的制备
将甜瓜汁平均分装到6 个螺旋盖(聚四氟乙烯密封垫)玻璃瓶中,每个玻璃瓶均加入30 mL甜瓜汁,取其中1 个样品作CK,向另外5 个玻璃瓶中分别加入等质量的儿茶素、染料木黄酮、黄豆苷元、邻苯三酚和海藻多酚,质量浓度为0.1 mg/mL,充分搅拌混匀后待用。
1.3.3 果汁样品的热处理
分别取6 组不同处理的甜瓜汁(1 组为未添加多酚的新鲜甜瓜汁;5 组为各添加不同种类的多酚甜瓜汁)各8 mL,置于20 mL顶空瓶中,每组设置3 个重复,加入磁力转子后置于带有磁力搅拌功能的金属浴中进行加热处理,磁力搅拌加热器温度设置为135 ℃,当甜瓜汁温度升至135 ℃时,开始计时,15 s后取出,冰水浴迅速冷却并放置室温待测[16]。
1.3.4 挥发性异味组分的固相微萃取(solid-phase microextraction,SPME)
取8 mL热处理甜瓜汁于20 mL顶空瓶中,加入5 μL浓度为6.61×10-5 mg/mL的2-甲基-3-庚酮和10 μL质量浓度为4.99×10-5 mg/mL的稳定同位素D6-DMS作为内标,加入磁力搅拌转子,密封、充分混匀后置于SPME加热平台,于温度40 ℃、磁力搅拌转速280 r/min条件下平衡20 min,萃取针顶空萃取20 min后插入GC-MS进样口热解吸5 min。其他萃取条件同Luo Dongsheng等[10]方法。
1.3.5 GC-MS分析
GC条件:DB-5MS石英毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气(氦气)流速1.6 mL/min,压力12.8 psi,采用不分流进样模式;升温程序:起始温度40 ℃,保持2 min,8 ℃/min升温至260 ℃,保持10 min。
MS条件:采用全扫描模式采集信号;扫描速度1 562 u/s;电子电离源;离子源温度230 ℃;传输线温度250 ℃;四极杆温度150 ℃;电子轰击能量70 eV;扫描质量范围m/z 33~325。
1.3.6 关键挥发性异味组分定性
结合文献报道对比物质的保留指数(rentation index,RI),NIST14标准谱图库检索以及标准物质加入(standard,Std)3 种方法对12 种目标异味组分进行精确定性。
1.3.7 甜瓜热处理异味组分的精确定量
参照Pang Xueli等[17]的方法,以与热加工果汁具有相同可溶性固形物(total soluble solid,TSS)和pH值的水溶液为模拟基质,以甲醇为溶剂,配制7 级不同浓度梯度的异味组分混合系列标准溶液,分别取50 μL系列混合标准溶液、5 μL质量浓度为6.61×10-5 mg/mL的2-甲基-3-庚酮和10 μL质量浓度为4.99×10-5 mg/mL的稳定同位素D6-DMS加入8 mL模拟基质中,充分旋涡混匀后,加入转子,采用SPME提取以及GC-MS/选择离子扫描模式(selected ion monitor,SIM)结合内标法,建立标准曲线并对异味化合物进行精确定量分析。SPME和GC条件分别与1.3.4和1.3.5节相同。用于各挥发性异味组分的特征离子(m/z)、对应内标、相对校正因子以及标准曲线相关系数(R2)如表1所示。
表1 热处理甜瓜汁挥发性异味组分特征离子
Table 1 Characteristic ions of off-odors in thermally processed muskmelon juuiiccee
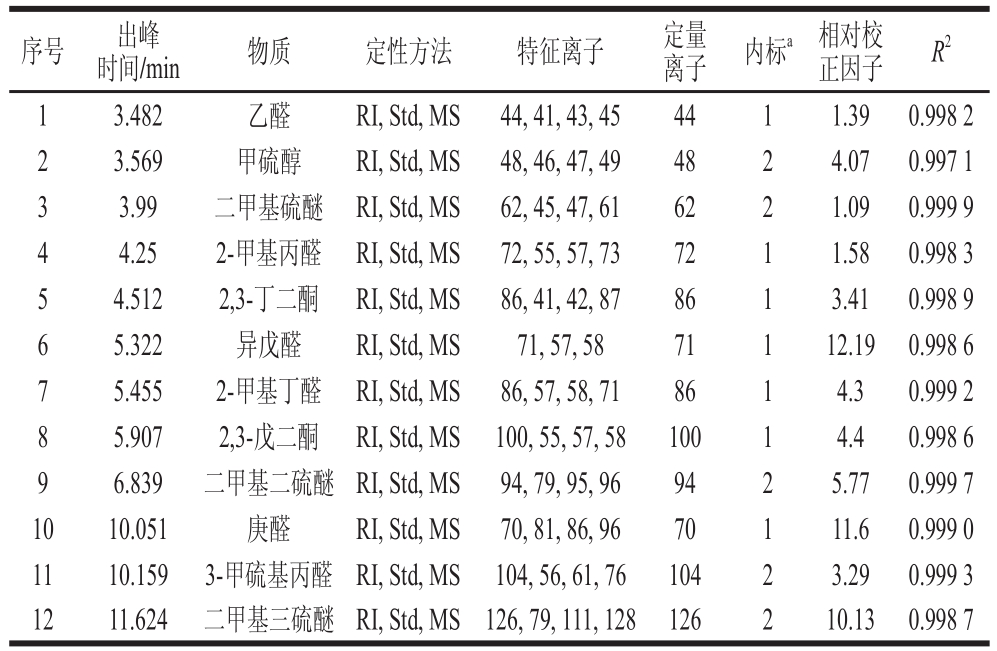
注:a. 1为2-甲基-3-庚酮;2为稳定同位素D6-DMS。
序号 出峰时间/min 物质 定性方法 特征离子 定量离子 内标a 相对校正因子 R2 1 3.482 乙醛 RI, Std, MS 44, 41, 43, 45 44 1 1.39 0.998 2 2 3.569 甲硫醇 RI, Std, MS 48, 46, 47, 49 48 2 4.07 0.997 1 3 3.99 二甲基硫醚 RI, Std, MS 62, 45, 47, 61 62 2 1.09 0.999 9 4 4.25 2-甲基丙醛 RI, Std, MS 72, 55, 57, 73 72 1 1.58 0.998 3 5 4.512 2,3-丁二酮 RI, Std, MS 86, 41, 42, 87 86 1 3.41 0.998 9 6 5.322 异戊醛 RI, Std, MS 71, 57, 58 71 1 12.19 0.998 6 7 5.455 2-甲基丁醛 RI, Std, MS 86, 57, 58, 71 86 1 4.3 0.999 2 8 5.907 2,3-戊二酮 RI, Std, MS 100, 55, 57, 58 100 1 4.4 0.998 6 9 6.839 二甲基二硫醚 RI, Std, MS 94, 79, 95, 96 94 2 5.77 0.999 7 10 10.051 庚醛 RI, Std, MS 70, 81, 86, 96 70 1 11.6 0.999 0 11 10.159 3-甲硫基丙醛 RI, Std, MS 104, 56, 61, 76 104 2 3.29 0.999 3 12 11.624 二甲基三硫醚 RI, Std, MS 126, 79, 111, 128 126 2 10.13 0.998 7
1.3.8 感官评价
为验证比较不同多酚对挥发性异味组分的抑制效果,由17 名具有感官评价经验的专业人员组成感官评价小组,年龄介于20~40 岁之间。采用感官分析中的排序检测法,依据GB/T 12315—2008《感官分析方法学》[18],对5 种不同多酚添加组热处理果汁和热处理原汁共6 组果汁样品的异味强度按照由低到高进行排序,并参照Eisinga等[19]方法对排序结果进行统计分析。首先,采用Friedman检验这种非参数分析统计方法利用秩和和秩次检验所有处理组间是否存在显著性整体差异,然后通过临界值r(I, α)对存在显著性整体差异的样品进行多重比较和分组,以确定不同多酚添加组与CK组以及不同多酚添加组间差异的显著性。
其中Friedman检验的计算公式如下:
式中:P为样品数,J为品评人员数,R1、R2......RP为每种样品的秩和。
r(I, α)计算公式如下:
式中:I=1, 2, 3, ... P;α为显著性水平。q(I, α)值可查相应的表。
1.3.9 5 种多酚对12 种异味组分的抑制率比较
为直接比较不同种类多酚添加对热处理后甜瓜汁中12 种挥发性异味组分的抑制效果,计算抑制率。不同多酚对各异味组分的抑制率计算公式如下:
式中:I为抑制率/%;Cck为直接热处理甜瓜汁中挥发性异味组分的浓度;Cit为添加多酚热处理后的甜瓜汁中挥发性异味组分的浓度。
1.4 数据处理
采用SPSS软件、Friedman检验及多重比较分析感官评价相关数据;通过SPSS软件、OriginLab OriginPro 2017作图、SIMCA-P13.0软件对仪器分析相关数据进行正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。
2 结果与分析
2.1 多酚添加组热处理甜瓜汁与CK热处理原汁的感官分析
如表2所示,得到P=6,J=17,R1=44,R2=49,R3=51,R4=64,R5=68,R6=81,带入式(1)计算F值为13.27,大于自由度为P -1=5时显著性为0.05的c2分布临界值(11.07),表明6 个不同处理果汁样品间有显著性整体差异,且不同样品的异味强度排序为儿茶素添加组<海藻多酚添加组<黄豆苷元添加组<邻苯三酚添加组<染料木黄酮添加组<热处理原汁。
表2 异味强度排序法中不同处理热加工甜瓜汁样品的秩和和秩次
Table 2 Rank sum and rank order of thermally processed melon juice samples with and without added polyphenols in off-odor intensity ranking method
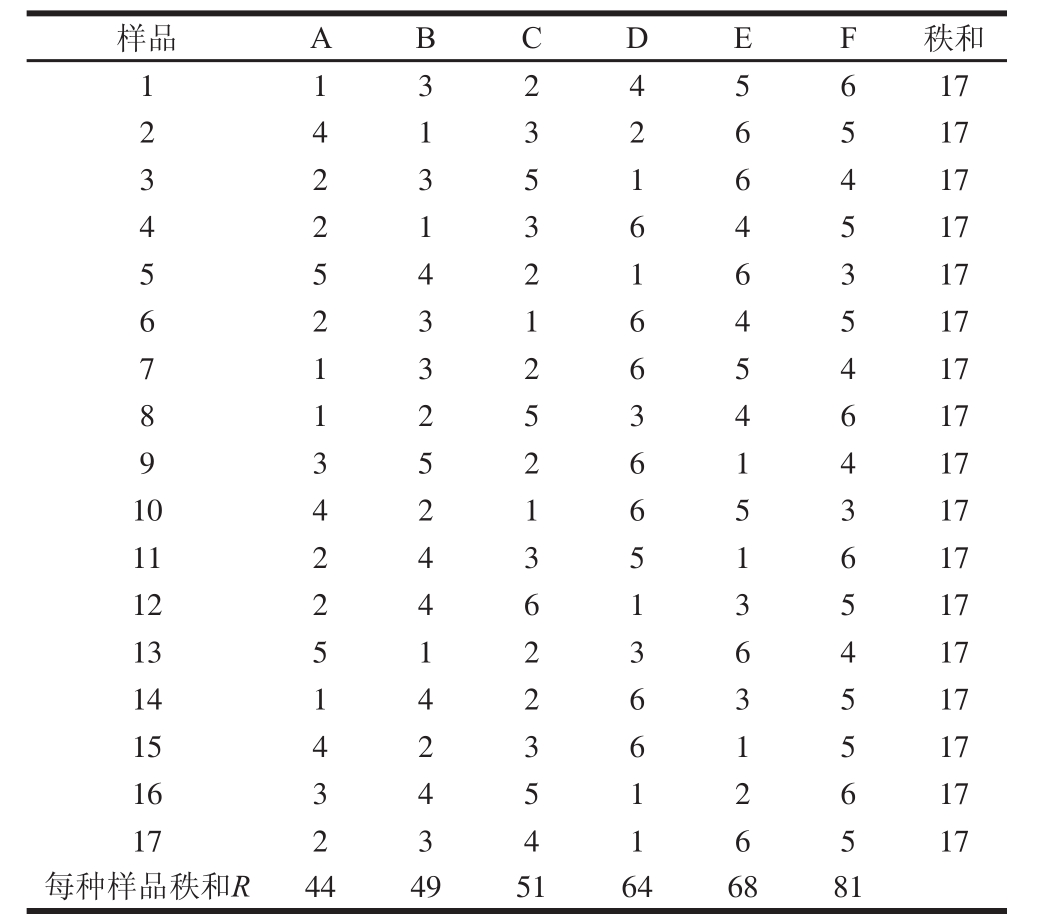
注:A.儿茶素添加组;B.海藻多酚添加组;C.黄豆苷元添加组;D.邻苯三酚添加组;E.染料木黄酮添加组;F.热处理原汁。下同。
样品 A B C D E F 秩和1 1 3 2 4 5 6 17 2 4 1 3 2 6 5 17 3 2 3 5 1 6 4 17 4 2 1 3 6 4 5 17 5 5 4 2 1 6 3 17 6 2 3 1 6 4 5 17 7 1 3 2 6 5 4 17 8 1 2 5 3 4 6 17 9 3 5 2 6 1 4 17 10 4 2 1 6 5 3 17 11 2 4 3 5 1 6 17 12 2 4 6 1 3 5 17 13 5 1 2 3 6 4 17 14 1 4 2 6 3 5 17 15 4 2 3 6 1 5 17 16 3 4 5 1 2 6 17 17 2 3 4 1 6 5 17每种样品秩和R 44 49 51 64 68 81
表3 不同处理热加工甜瓜汁异味强度多重比较
Table 3 Multiple comparisons of odor intensity of thermally processed muskmelon juices with and without added polyphenols

样品间秩和差 r(I, α)值RF-RA=37 31.09 RF-RB=32 29.77 RF-RC=30 28.00 RF-RD=17 25.53 RE-RA=24 29.77
6 个不同处理热加工果汁样品异味强度分组检验结果如表3所示。由差异显著性统计结果可知,按照异味强度,可将所有果汁样品分为3 组,其中儿茶素添加组、海藻多酚添加组和黄豆苷元添加组同处于一组,异味强度最低;邻苯三酚添加组和染料木黄酮添加组同处于一组,异味强度次之,热处理原汁单独为一组,异味强度最高;儿茶素、海藻多酚和黄豆苷元均能显著降低热加工甜瓜汁中的异味强度(P<0.05)。
2.2 多酚添加组热处理甜瓜汁与CK热处理原汁中关键异味组分的OPLS-DA
为了直观评价添加不同种类多酚的热处理甜瓜汁与无添加热处理甜瓜汁(CK)之间的整体差异,通过OPLS-DA建模分析了不同热处理果汁样品中异味组分构成变化,并利用得分图(图1A)和载荷图(图1B)进一步明确了异味构成差异组分。从图1A可以看出,添加黄豆苷元、海藻多酚及邻苯三酚热处理的甜瓜汁样品均位于CK所在的第1象限周围且所处象限均有交叉,差异较小;其次是添加染料木黄酮热处理的甜瓜汁样品,虽与CK处理组相距较远,但2 组均位于坐标的右侧;相反,添加儿茶素后热处理的甜瓜汁与CK在异味组分构成上具有较大差异。由此可知,相比其他多酚处理,儿茶素的添加对异味组分的构成以及浓度有较大程度的影响。此外,结合图1B可以发现,儿茶素添加组只有乙醛出现,说明儿茶素的添加在一定程度上抑制了其他11 种热异味组分,而对乙醛则没有起到抑制作用。海藻多酚添加组与二甲基三硫醚、甲硫醇等异味组分均位于第2象限偏右区域,说明海藻多酚的添加对其没有抑制效果。邻苯三酚添加组与2,3-丁二酮、2,3-戊二酮、3-甲硫基丙醛等异味组分同位于第4象限偏左区域,说明邻苯三酚的添加对这些物质没有抑制效果。黄豆苷元添加组与异戊醛、2,3-丁二酮、3-甲硫基丙醛同位于第4象限偏上区域,则说明黄豆苷元的添加对这些物质没有抑制效果。通过OPLS-DA可知,样本之间差异显著,具有统计学意义。但这种模型分析只能判断添加多酚后的热处理甜瓜汁与CK异味组分构成的整体差异,无法准确解析量化多酚添加对每种异味组分的抑制效果,因此后续实验从“抑制浓度”和“抑制异味种类”2 个尺度,对不同多酚的异味抑制效果进行定量分析。
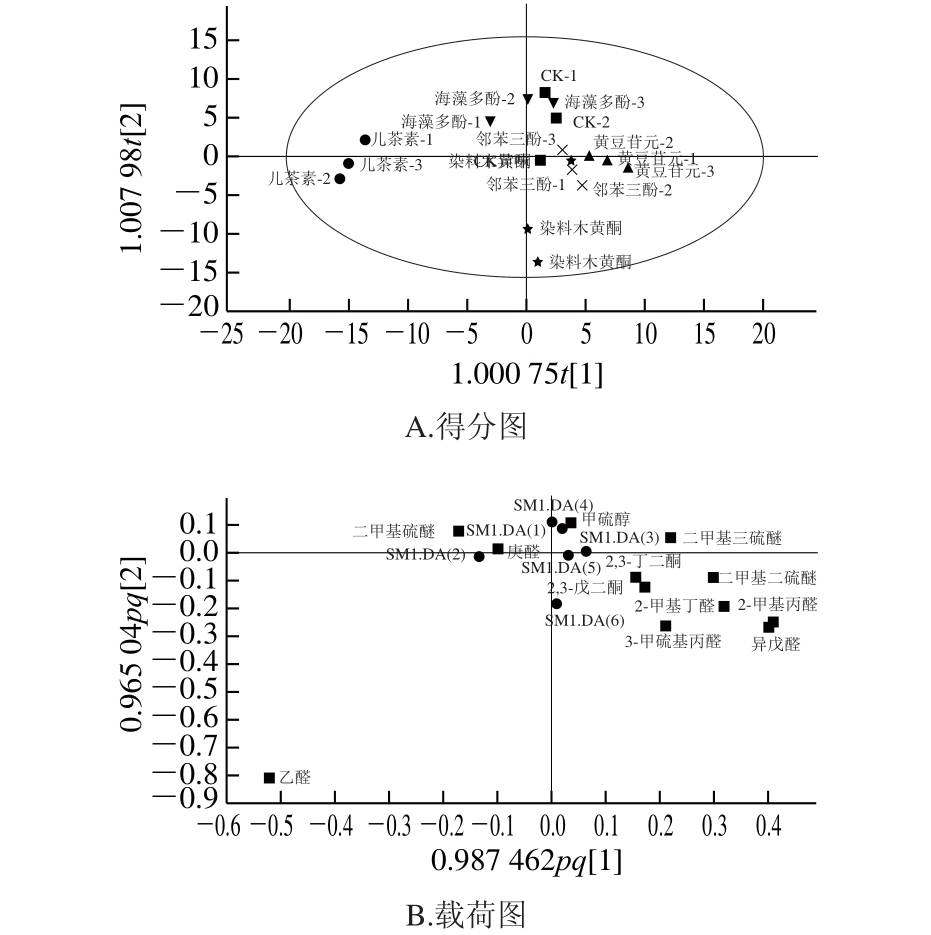
图1 热处理后多酚处理组甜瓜汁与热处理原汁中异味组分的OPLLSS--DDAA
Fig. 1 OPLS-DA of off-odors in thermally processed muskmelon juices with and without added polyphenols
2.3 多酚添加对热处理甜瓜汁中关键异味组分抑制效果的定量评价
2.3.1 儿茶素添加对关键异味组分构成的影响

图2 热处理儿茶素添加组甜瓜汁和热处理原汁中关键热异味组分的质量浓度变化
Fig. 2 Concentrations of off- flavor markers in thermally processed muskmelon juices with and without added catechin
由图2可知,儿茶素添加组中11 种异味组分(甲硫醇、二甲基硫醚、2-甲基丙醛、2,3-丁二酮、异戊醛、2-甲基丁醛、2,3-戊二酮、二甲基二硫醚、庚醛、3-甲硫基丙醛、二甲基三硫醚)质量浓度降低,表明儿茶素对其有抑制作用;其中,对2-甲基丙醛、异戊醛、2-甲基丁醛、3-甲硫基丙醛、二甲基三硫醚具有显著抑制作用(P<0.05),对二甲基二硫醚具有极显著抑制作用(P<0.01)。2-甲基丙醛和2-甲基丁醛均可以通过α-氨基酸与羰基化合物的美拉德反应产生,推测儿茶素的添加在一定程度上通过结合前体物或中间产物阻碍了这2 种物质的生成途径[20-21];异戊醛的前体物质是丙氨酸,推测儿茶素的添加抑制了丙氨酸的降解。但儿茶素的添加对乙醛没有抑制作用,有文献报道乙醛是亮氨酸通过Strecker降解产生[22],推测可能是儿茶素的添加产生了某种中间产物参与促进了乙醛的生成。
2.3.2 黄豆苷元添加对关键异味组分构成的影响
由图3可知,相比CK组,添加黄豆苷元组中异味组分质量浓度降低的有甲硫醇、二甲基硫醚、二甲基二硫醚、庚醛、二甲基三硫醚5 种化合物;含硫化合物中甲硫醇可通过蛋氨酸或者蛋氨酸亚砜自动热氧化降解生成[23],二甲基硫醚则是S-甲基蛋氨酸热处理过程中的降解产物,二甲基二硫醚和二甲基三硫醚主要由蛋氨酸产生[24],这些异味组分的质量浓度降低可能由于多酚的添加抑制了前体物质的降解或结合了中间产物从而阻断了异味生成途径。但黄豆苷元的添加对乙醛、2-甲基丙醛、异戊醛、2-甲基丁醛没有抑制作用,这4 类小分子醛类化合物均可以由美拉德反应产生,推测在加热过程中黄豆苷元没有结合这4 种异味组分生成的中间产物或者其自身降解产物可作为异味物质生成的中间产物,最终导致这4 种醛类化合物浓度的增加。同样2 种酮类化合物的浓度也没有降低,有文献报道具有较低阈值的2,3-丁二酮可源于以下3 种途径:1)硫胺素热降解[25];2)谷胱甘肽和葡萄糖反应生成的呋喃酮进一步氧化分解[26];3)D-葡萄糖和L-丙氨酸的美拉德反应[27],黄豆苷元的添加可能促进了甜瓜汁中硫胺素的降解或葡萄糖与氨基酸的反应,也可能是以上3 种途径共同参与造成了2,3-丁二酮浓度的增加。

图3 热处理黄豆苷元添加组甜瓜汁和热处理原汁中关键热异味组分的质量浓度变化
Fig. 3 Concentrations of off- flavor markers in thermally processed muskmelon juices with and without added daidzein
2.3.3 海藻多酚添加对关键异味组分构成的影响

图4 热处理海藻多酚添加组甜瓜汁和热处理原汁中关键热异味组分的质量浓度变化
Fig. 4 Concentrations of off- flavor markers in thermally processed muskmelon juices with and without added phlorotannins
由图4可知,添加海藻多酚样品中2-甲基丙醛、异戊醛、2-甲基丁醛、庚醛、2,3-丁二酮、2,3-戊二酮、甲硫醇、二甲基硫醚、二甲基二硫醚、3-甲硫基丙醛质量浓度降低。其中二甲基二硫醚的质量浓度显著降低(P<0.05),二甲基二硫醚主要由蛋氨酸产生[24],其浓度降低可能由于多酚的添加阻碍了前体物质的降解[28]。二甲基硫醚则是S-甲基蛋氨酸热处理过程中的降解产物[24]。添加海藻多酚的热处理甜瓜汁中二甲基三硫醚浓度比CK高;二甲基三硫醚的生成途径主要是部分二甲基三硫醚可通过甲硫氨酸产生的甲硫醇氧化降解产生;蛋白质的Strecker降解起次要作用[29]。由此可推测海藻多酚的添加可能促进了甲硫醇的氧化降解,致使二甲基三硫醚含量的增加。
2.3.4 邻苯三酚添加对热处理甜瓜汁中关键异味组分构成的影响

图5 热处理邻苯三酚添加组甜瓜汁和热处理原汁中关键热异味组分的质量浓度变化
Fig. 5 Concentrations of off- flavor markers in thermally processed muskmelon juices with and without added pyrogallol
由图5可知,添加邻苯三酚样品中异味组分浓度降低的有甲硫醇、二甲基硫醚、二甲基二硫醚、庚醛。邻苯三酚的添加对2,3-丁二酮和2,3-戊二酮均没有抑制作用。含硫化合物3-甲硫基丙醛、二甲基三硫醚的质量浓度均高于CK组,3-甲硫基丙醛可以蛋氨酸为前体通过一系列生物化学转化产生[30]或蛋氨酸亚砜自动热氧化降解产生[31],因此推测邻苯三酚的添加对这2 种生成途径均起到了促进作用。
2.3.5 染料木黄酮添加对关键异味组分构成的影响
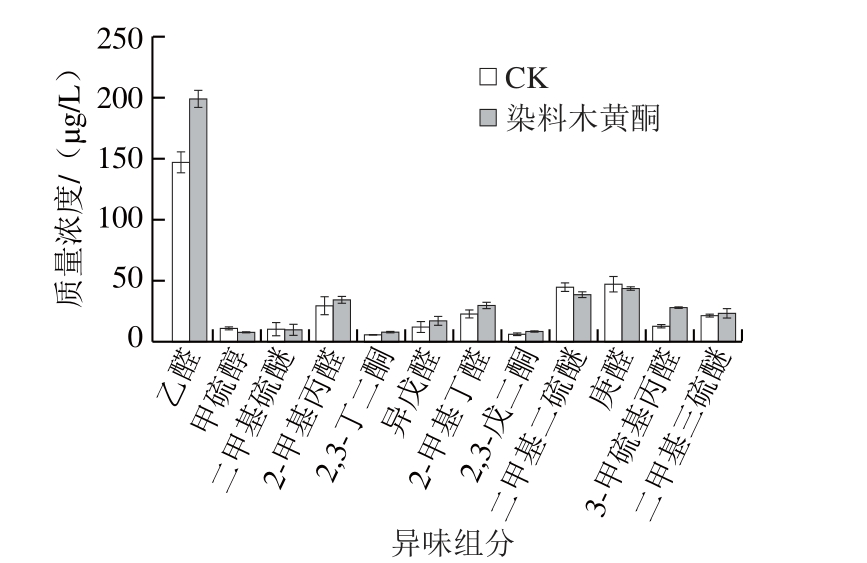
图6 热处理染料木黄酮添加组甜瓜汁和热处理原汁中关键热异味组分的质量浓度变化
Fig. 6 Concentrations of off- flavor markers in thermally processed muskmelon juices with and without added genistein
由图6可知,添加染料木黄酮后对甲硫醇、二甲基硫醚、二甲基二硫醚、庚醛的质量浓度有抑制作用。对乙醛、2-甲基丙醛、异戊醛、2-甲基丁醛没有抑制作用,推测在热处理过程中染料木黄酮的添加对这4 种异味组分的前体物质亮氨酸、缬氨酸、丙氨酸、异亮氨酸降解没有抑制作用。此外含硫化合物3-甲硫基丙醛、二甲基三硫醚质量浓度均高于CK,这与邻苯三酚添加后对异味的抑制效果一致。
2.4 5 种多酚对12 种关键异味组分的抑制作用比较
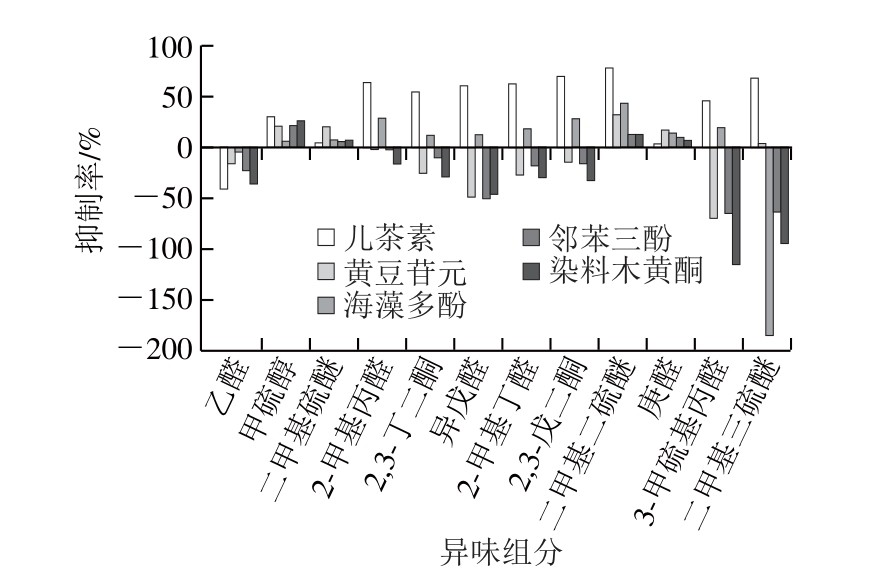
图7 不同多酚对热处理甜瓜汁中关键异味组分的作用效果
Fig. 7 Inhibition effect of different polyphenols on off-odors in thermally processed melon juice
由图7可知,除乙醛外,其他11 种异味组分均可被5 种多酚化合物中的一种或多种抑制;此外,儿茶素、黄豆苷元、海藻多酚、邻苯三酚、染料木黄酮添加组中可被抑制的异味组分数量分别是11、5、10、4、4 种。对2-甲基丙醛、异戊醛、2-甲基丁醛这3 种醛类物质具有最佳抑制效果的多酚是儿茶素,抑制率分别为64.20%、60.77%、62.46%。对庚醛表现出最佳抑制效果的多酚为黄豆苷元,抑制率可达17.9%,其次为海藻多酚14.94%。对于2 种酮类化合物2,3-丁二酮和2,3-戊二酮而言,儿茶素对其抑制率最高,分别为55.20%、70.26%,其次是海藻多酚;值得指出的是,5 种多酚处理中仅有这2 种多酚对这2 种酮类化合物有抑制作用。对于含硫化合物中甲硫醇、二甲基二硫醚、3-甲硫基丙醛和二甲基三硫醚,儿茶素抑制率最高,分别达30.05%、78.66%、46.75%、69.06%;黄豆苷元对二甲基硫醚的抑制效果最佳,达21.16%。邻苯三酚和染料木黄酮在抑制异味组分的数量上是一致的,但就甲硫醇、二甲基硫醚、二甲基二硫醚的抑制率而言,染料木黄酮均高于邻苯三酚。综合不同多酚抑制异味组分种类数量和异味浓度抑制率可以看出,儿茶素对热处理甜瓜汁的抑制效果最佳,其次是海藻多酚、黄豆苷元、染料木黄酮和邻苯三酚。此外,从抑制异味的种类互补层面看,儿茶素与黄豆苷元可以作为最佳多酚组合用于热处理甜瓜汁中异味抑制效果的深入研究中。
3 讨 论
在添加5 种多酚的甜瓜汁中均检测到乙醛含量增大,乙醛作为一种重要的斯特勒克醛,可通过亮氨酸美拉德反应产生[31-32];多酚的添加可能在一定程度上促进了亮氨酸的降解。实验中其他4 种醛类化合物中2-甲基丙醛、异戊醛、2-甲基丁醛、3-甲硫基丙醛的前体物质分别为缬氨酸、丙氨酸、异亮氨酸和蛋氨酸,不同多酚种类对这4 种异味组分的抑制效果不同,儿茶素和海藻多酚均表现为抑制作用,黄豆苷元、邻苯三酚和染料木黄酮均为促进作用,可能是由于不同结构的氨基酸,美拉德反应的中间产物也不同,多酚对不同产物的作用结果也不同。
热处理的甜瓜汁中含硫化合物二甲基硫醚可由S-甲基蛋氨酸、蛋氨酸、二甲基亚砜和二甲基磺酸丙酯转化生成[33];二甲基二硫醚和二甲基三硫醚在热处理过程中主要经过蛋氨酸的美拉德反应途径产生,此外还可通过S-甲基半胱氨酸亚砜、甲硫醇和3-甲硫基丙醛经热降解或氧化等反应形成[27,33-34]。3-甲硫基丙醛同样可由蛋氨酸在美拉德反应过程中形成,并且反应的中间产物是甲硫醇[35]。不同多酚添加后甜瓜基质组分构成和性质发生变化,含硫化合物的生成途径较为复杂,在一定程度上导致不同种类多酚添加对含硫化合物的影响均有不同,抑制效果也大不相同。黄豆苷元、邻苯三酚和染料木黄酮的添加对3-甲硫基丙醛的浓度没有抑制效果,推测可能是在热处理过程中它们的加入一定程度上促进了蛋氨酸的降解。甲硫醇质量浓度降低也可能由于其部分作为蛋氨酸反应的中间产物,而二甲基二硫醚和二甲基三硫醚的生成仅有一小部分来源于蛋氨酸,添加多酚改变了基质环境也导致这2 种硫醚化合物的其他生成途径受到黄豆苷元的抑制,发生质量浓度降低的现象。
与CK相比,添加多酚的热处理甜瓜汁中异味组分均发生了不同程度的质量浓度变化。儿茶素对12 种关键异味组分的抑制效果和抑制数量优于其他4 种多酚,但儿茶素对二甲基硫醚和庚醛的抑制率较低,而黄豆苷元对这两种异味组分的抑制率最大,因此在后续实验中可以将这两种多酚结合,实现抑制作用上的互补。5 种多酚的添加对乙醛并没有抑制效果,可以在后续实验中在多酚安全添加范围内增加浓度研究对乙醛浓度的作用效果。此外,在今后的研究中还可以尝试更多的抑制剂种类,如生物酶类、VC及其他物理抑制手段,从而寻求对挥发性异味组分具有更佳抑制效果的综合抑制措施。
本研究综合利用感官评价和仪器分析并结合统计分析方法,比较评价了不同多酚对热加工甜瓜汁异味的抑制作用和作用特征。感官评价和仪器分析结果相一致,均表明0.1 mg/mL的儿茶素、染料木黄酮、黄豆苷元、海藻多酚及邻苯三酚处理能够不同程度地抑制热处理甜瓜汁异味的生成;不同多酚处理组中异味强度顺序为儿茶素添加组<海藻多酚添加组<黄豆苷元添加组<染料木黄酮添加组<邻苯三酚添加组,且儿茶素、海藻多酚、黄豆苷元均具有明显的异味抑制效果;研究还发现儿茶素和黄豆苷元可作为抑制异味的最佳组合;本研究采用的GC-MS结合OPLS-DA方法能够为研究不同多酚对热处理甜瓜汁异味影响的定性定量效果评价提供了有力支撑,研究结果能为甜瓜的深加工综合利用以及其他热敏性果蔬热处理异味问题的攻克提供重要的理论借鉴和指导。
[1] JIN X, LIU T, XU J, et al. Exogenous GABA enhances muskmelon tolerance to salinity-alkalinity stress by regulating redox balance and chlorophyll biosynthesis[J]. BMC Plant Biology, 2019, 19(1): 19-48.DOI:10.1186/s12870-019-1660-y.
[2] NING X F, XIONG L M, WANG X L, et al. Genetic diversity among Chinese Hami melon and its relationship with melon germplasm of diverse origins revealed by microsatellite markers[J]. Biochemical Systematics & Ecology, 2014, 57: 432-438. DOI:10.1016/j.bse.2014.09.020.
[3] PRIYANKA D, SINDHOORA S, VIJAYANAND P, et al. In fluence of thermal processing on the volatile constituents of muskmelon puree[J]. Journal of Food Science and Technology, 2015, 52(5): 3111-3116. DOI:10.1007/s13197-014-1294-x.
[4] KHURNPOON L, SIRISOMBOON P. Rapid evaluation of the texture properties of melon (Cucumis melo L. var. reticulata cv. Green net)using near infrared spectroscopy[J]. Journal of Texture Studies, 2018,49(3): 387-394. DOI:10.1111/jtxs.12329.
[5] NATH N, RANGANNA S. Evaluation of a thermal process for acidified canned muskmelon (Cucumis melo L.)[J]. Journal of Food Science, 2010, 42(5): 1306-1310. DOI:10.1111/j.1365-2621.1977.tb14484.x.
[6] SUN X X, BALDWIN E A, PLOTTO A, et al. Effects of thermal processing and pulp filtration on physical, chemical and sensory properties of winter melon juice[J]. Journal of the Science of Food and Agriculture, 2017, 97: 543-550. DOI:10.1002/jsfa.7761.
[7] 罗东升. 热加工甜瓜汁蒸煮异味形成与调控机制[D]. 北京: 中国农业大学, 2019: 164.
[8] 庞雪莉. 热加工厚皮甜瓜汁关键异味组分鉴定及形成机理初探[D].北京: 中国农业大学, 2015: 181.
[9] KOKKINIDOU S, PETERSON D G. Control of Maillard-type offflavor development in ultrahigh-temperature-processed bovine milk by phenolic chemistry[J]. Journal of Agricultural and Food Chemistry,2014, 62(32): 8023-8033. DOI:10.1021/jf501919y.
[10] LUO D S, PANG X L, XU X, et al. Identification of cooked off- flavor components and analysis of their formation mechanisms in melon juice during thermal processing[J]. Journal of Agricultural and Food Chemistry, 2018, 66(22): 5612-5620. DOI:10.1021/acs.jafc.8b01019.
[11] GALEB A D S, WROLSTAD R E, MCDANIEL M R. Composition and quality of clarified cantaloupe juice concentrate[J]. Journal of Food Processing and Preservation, 2002, 26(1): 39-56. DOI:10.1111/j.1745-4549.2002.tb00476.x.
[12] CHEN J, ZHANG J, FENG Z, et al. In fluence of thermal and densephase carbon dioxide pasteurization on physicochemical properties and flavor compounds in Hami melon juice[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5805-5808. DOI:10.1021/jf900752b.
[13] KOKKINIDOU S. Inhibition of Maillard reaction pathways and offflavor development in UHT milk: structure reactivity of phenolic compounds[J]. Dissertations & Theses-Gradworks, 2013, 35(1):21-46. DOI:10.2466/pms.1972.35.1.210.
[14] SCHWAMBACH S L, PETERSON D G. Reduction of stale flavor development in low-heat skim milk powder via epicatechin addition[J].Journal of Agricultural and Food Chemistry, 2006, 54(2): 502-508.DOI:10.1021/jf0519764.
[15] TROISE A D, FIORE A, COLANTUONO A, et al. Effect of olive mill wastewater phenol compounds on reactive carbonyl species and Maillard reaction end-products in ultrahigh-temperature-treated milk[J]. Journal of Agricultural and Food Chemistry, 2014, 62(41):10092-10100. DOI:10.1021/jf503329d.
[16] PANG X L, ZHANG Y Z, QIU J, et al. Coupled multidimensional GC and odor activity value calculation to identify off-odors in thermally processes muskmelon juice[J]. Food Chemistry, 2019, 301(15): 7.DOI:10.1016/j.foodchem.2019.125307.
[17] PANG X L, GUO X F, QIN Z H, et al. Identification of aromaactive compounds in Jiashi muskmelon juice by GC-O-MS and OAV calculation[J]. Journal of Agricultural and Food Chemistry, 2012,60(17): 4179-4185. DOI:10.1021/jf300149m.
[18] 赵镭, 刘文, 汪厚银. 感官分析方法学[M]. 北京: 中国质检出版社,2008, 1: 12.
[19] EISINGA R, HESKES T, PELZER B, et al. Exact P-values for pairwise comparison of Friedman rank sums, with application to comparing classifiers[J]. BMC Bioinformatics, 2017, 18(1): 68-86.DOI:10.1186/s12859-017-1486-2.
[20] KEBEDE B T, GRAUWET T, MUTSOKOTI L, et al. Comparing the impact of high pressure high temperature and thermal sterilization on the volatile fingerprint of onion, potato, pumpkin and red beet[J].Food Research International, 2014, 56(2): 218-225. DOI:10.1016/j.foodres.2013.12.034.
[21] BEZMAN Y, ROUSEFF R L, NAIM M. 2-Methyl-3-furanthiol and methional are possible off-flavors in stored orange juice:aroma-similarity, NIF/SNIF GC-O, and GC analyses[J]. Journal of Agricultural and Food Chemistry, 2001, 49(11): 5425-5432.DOI:10.1021/jf010724+.
[22] SCHONBERG A, MOUBACHER R. The strecker degradation of α-amino acids[J]. Chemical Reviews, 1952, 50(2): 261-277.DOI:10.1021/cr60156a002.
[23] YU T H, HO C T. Volatile compounds generated from thermal reaction of methionine and methionine sulfoxide with or without glucose[J].Journal of Agricultural and Food Chemistry, 1995, 43(6): 1641-1646.DOI:10.1021/jf00054a043.
[24] HUANG Y R, TIPPMANN J, BECKER T. Non-isothermal kinetic models of degradation of S-methylmethionine[J]. Journal of Food Process Engineering, 2015, 39(6): 573-580. DOI:10.1111/jfpe.12250.
[25] HARTMAN G J, CARLIN J T, SCHEIDE J D, et al. Volatile products formed from the thermal degradation of thiamin at high and low moisture levels[J]. Journal of Agricultural and Food Chemistry, 1984,32(5): 1015-1018. DOI:10.1021/jf00125a016.
[26] ZHENG Y, BROWN S, LEDIG W O, et al. Formation of sulfurcontaining flavor compounds from reactions of furaneol and cysteine,glutathione, hydrogen sulfide, and alanine/hydrogen sulfide[J].Journal of Agricultural and Food Chemistry, 1997, 45(3): 894-897.DOI:10.1021/jf960624h.
[27] YAYLAYAN V A, KEYHANI A. Origin of 2,3-pentanedione and 2,3-butanedione in D-glucose/L-alanine maillard model systems[J].Journal of Agricultural and Food Chemistry, 1999, 47(8): 3280-3284.DOI:10.1021/jf9902292.
[28] OHTSUKI K, KAWABATA M, TAGUCHI K, et al. Determination of S-methylmethionine, vitamin U, in various teas[J]. Agricultural and Biological Chemistry, 1984, 48(10): 2471-2475. DOI:10.1271/bbb1961.48.2471.
[29] ISOGAI A, KANDA R, HIRAGA Y, et al. Screening and Identification of precursor compounds of dimethyl trisulfide (DMTS) in Japanese sake[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 189-195. DOI:10.1021/jf802582p.
[30] HOMATIDOU V I, KARVOUNI S S, DOURTOGLOU V G, et al.Determination of total volatile components of Cucumis melo L. variety cantaloupensis[J]. Journal of Agricultural and Food Chemistry, 1992,40(8): 1385-1388. DOI:10.1021/jf00020a019.
[31] WYLLIE S G, FELLMAN J K. Formation of volatile branched chain esters in bananas (Musa sapientum L.)[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3493-3496. DOI:10.1021/jf0001841.
[32] MARTIN, FIONA L, JENNIFER M. Formation of Strecker aldehydes and pyrazines in a fried potato model system[J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 3885-3892. DOI:10.1021/jf010310g.
[33] MORISAKI A, YAMADA N, YAMANAKA S, et al. Dimethyl sul fide as a source of the seaweed-like aroma in cooked soybeans and correlation with its precursor, S-methylmethionine (vitamin U)[J].Journal of Agricultural and Food Chemistry, 2015, 62(33): 8289-8294.DOI:10.1021/jf501614j.
[34] ISOGAI A, KANDA R, HIRAGA Y, et al. Contribution of 1,2-Dihydroxy-5-(methylsulfinyl) pentan-3-one (DMTS-P1) to the formation of dimethyl trisulfide (DMTS) during the storage of Japanese Sake[J]. Journal of Agricultural and Food Chemistry, 2010,58(13): 7756-7761. DOI:10.1021/jf100707a.
[35] PRENTICE R D M, MCKERNAN G, BRYCE J H. Source of dimethyl disul fide and dimethyl trisul fide in grain spirit produced with a Coffey still[J]. Journal of the American society of Brewing Chemists, 1998,56(3): 99-103. DOI:10.1094/asbcj-56-0099.