坛紫菜(Porphyra haitanensis),隶属红藻门(Rhodophyta)、原红藻纲(Rhodophyceae)、红毛菜目(Porphyridiales)、红毛菜科(Porphyridiaceae)、紫菜属(Porphyra)[1],其主要分布在福建、浙江和广东沿岸,生长于沿海潮间带中高潮区的岩礁或筏架上,是我国特有的大型经济海藻之一[2-3]。中国是世界紫菜的主要生产国和出口国,2018年其养殖面积达7.62万 公顷,年产量高达20.17万 t[4],具有巨大的碳汇潜力[5]和经济开发价值。我国紫菜品种包括坛紫菜、条斑紫菜、甘紫菜等,其中坛紫菜是主要养殖种类,占我国紫菜总产量的50%以上[2]。紫菜的采收期一般分为4~5 次,即头水、二水、三水、四水紫菜和末水紫菜,营养品质和市场价格随着采收期的变化逐渐降低[6],其中末水紫菜价格低廉,大多养殖户不予采收。末水紫菜作为一种高蛋白的海洋生物资源,其经济效益有待开发。
紫菜具有高蛋白、低脂肪的特点,其蛋白质含量为25%~50%(以干质量计),是制备生物活性肽的理想蛋白源[7]。研究表明,紫菜多肽具有降血压[8]、抗氧化[9]、降血脂[10]、抗肿瘤[2]、抗菌[11]等生理功能,在食品、药品、化妆品等领域具有升值空间和推广价值。何荣海等[12]通过对条斑紫菜蛋白酶解获得了血管紧张素转换酶抑制肽,对原发性高血压大鼠灌胃后有显著降血压效果。姚兴存等[13]使用木瓜蛋白酶、胰蛋白酶、胃蛋白酶水解条斑紫菜蛋白制备抗氧化肽,其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基具有一定的清除能力。
自由基不仅与食品腐败变质有关,还与人体衰老、氧化应激引发的各类疾病有关,如冠心病、糖尿病、高血压、高血脂、脑血栓等慢性疾病[14-15]。研究表明,抗氧化剂既能阻止食品脂质过氧化产物的形成,还能预防或减轻人体氧化应激引发的各类疾病[16]。由于人工合成抗氧化剂存在致畸、致癌和致突变的安全性问题,使得人工合成抗氧化剂的应用和推广受到限制。因此,人们致力于制备天然、无毒的抗氧化剂以取代人工合成抗氧化剂[17-18]。其中,抗氧化肽可作为抗氧化剂应用于功能性食品、蛋白质补充剂和药剂的生产制备[19]。本研究采用响应面法优化末水坛紫菜蛋白的酶解工艺,并对酶解产物进行分离纯化,同时以自由基清除活性与H2O2诱导HepG2细胞氧化应激损伤模型对末水坛紫菜抗氧化肽活性予以评价,旨在为末水坛紫菜的精深加工与开发利用提供理论依据及参考。
1 材料与方法
1.1 材料与试剂
末水坛紫菜样品由汕头市澄海区培隆紫菜养殖区提供,末水坛紫菜蛋白粉由中国水产科学研究院南海水产研究所自制,蛋白纯度为75%。
酸性蛋白酶(5 0 0 0 0 U/g)、胃蛋白酶(3 000 000 U/g)、中性蛋白酶(100 000 U/g)、木瓜蛋白酶(200 000 U/g)、碱性蛋白酶(200 000 U/g)、胰蛋白酶(250 000 U/g) 合肥博美生物科技有限责任公司;抑肽酶(6 511.83 Da)、细胞色素C(12 400 Da)上海麦克林生化科技有限公司;L-氧化型谷胱甘肽(612.63 Da) 美国Sigma公司;还原性谷胱甘肽(307.3 Da)、杆菌肽(1 422.69 Da) 广州齐云生物技术有限公司;葡萄糖凝胶(Sephadex)G-15 北京酷尔化学科技有限公司;HepG2人肝癌细胞系 广州烨善生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛试剂盒 碧云天生物技术研究所;三氟乙酸、乙腈均为色谱纯,其他试剂为分析纯。
1.2 仪器与设备
3K30台式高速冷冻离心机 德国Sigma公司;TDZ4-WS台式低速离心机 上海卢湘仪离心机仪器公司;Delta320精密pH计 梅特勒-托利多仪器(上海)公司;EYELAN-1000旋转蒸发仪 日本Eyela公司;MILLI-Q超纯水机 美国Millipore公司;倒置显微镜 上海光密仪器有限公司;电热压力蒸汽灭菌锅 上海申安医疗器械厂;THZ-82型恒温水浴振荡箱 常州金坛精达仪器制造有限公司;Alpha1-4冷冻干燥机 德国Christ公司;全自动酶标仪 美国BioTek公司。
1.3 方法
1.3.1 末水坛紫菜蛋白酶解工艺流程
末水坛紫菜蛋白→酶解→灭酶→离心→酶解液→透析→冷冻干燥→粗多肽
1.3.2 末水坛紫菜蛋白水解蛋白酶的选择
取1.0 g末水坛紫菜蛋白,加入50 mL蒸馏水充分混合,调节最适pH值,以4 000 U/g的加酶量分别加入酸性蛋白酶、胃蛋白酶、中性蛋白酶、木瓜蛋白酶、碱性蛋白酶、胰蛋白酶,调节温度至最适温度,水解4 h后95 ℃灭酶10 min,离心取上清液,测定水解度。不同蛋白酶水解实验条件见表1。
表1 不同蛋白酶水解实验条件
Table 1 Hydrolysis conditions of different proteases

(U/g)pH时间/h温度/℃底物质量浓度/(g/100 mL)酸性蛋白酶 4 000 3.0 4 50 2胃蛋白酶 4 000 1.5 4 37 2中性蛋白酶 4 000 7.0 4 50 2木瓜蛋白酶 4 000 6.5 4 55 2碱性蛋白酶 4 000 8.0 4 50 2胰蛋白酶 4 000 8.0 4 40 2蛋白酶 加酶量/
1.3.3 酸性蛋白酶水解末水坛紫菜蛋白响应面试验设计
本实验在水解时间4 h条件下,分别考察底物质量浓度、加酶量、pH值和温度对末水坛紫菜蛋白水解度的影响,确定水解条件的最适范围。依据Design-Expert 8.0.5软件,采用Box-Behnken响应面试验优化显著影响水解度的因素。根据单因素试验结果,以加酶量、pH值、温度3 个关键因素为自变量,以1、0、-1分别代表自变量的高、中、低水平,共设立17 个处理组。响应面试验因素与水平见表2。
表2 响应面试验因素与水平
Table 2 Factors and levels used in Box-Behnken design

因素 水平-1 0 1 A加酶量/(U/g) 3 000 4 000 5 000 B pH 2.0 3.0 4.0 C温度/℃ 50 55 60
1.3.4 末水坛紫菜蛋白水解度与酶解产物抗氧化活性关系
在最佳工艺条件下,将末水坛紫菜蛋白分别用酸性蛋白酶水解2、4、6、8、10 h,离心取上清液,测定水解度;取酶解液于100 Da的透析袋中透析24 h脱盐,冷冻干燥24 h即得到粗多肽,测定酶解产物的抗氧化活性。通过水解时间的调节以控制水解度,探讨水解度与抗氧化活性的关系。
1.3.5 末水坛紫菜蛋白水解度的测定
原料总氮含量采用凯氏定氮法测定;酶解液中氨基酸态氮含量采用甲醛电位滴定法[20-21]测定。蛋白质水解度的计算见式(1):
式中:DH为蛋白质水溶解度/%;m1为酶解液中的氨态氮含量/mg;m2为原料总氮含量/mg。
1.3.6 酶解产物抗氧化活性的测定
参照Chi Changfeng[22]、王海凤[23]等的方法测定DPPH自由基清除率。取0.1 g酶解物冻干粉溶解于不同体积的超纯水中,配成不同浓度多肽溶液;取1 mL多肽溶液加入1 mL 0.20 mmol/L的DPPH溶液(用95%乙醇溶液配置),混匀后在室温条件下避光反应30 min,在517 nm波长处测定吸光度As;空白组为1 mL 95%乙醇溶液代替DPPH溶液,加入1 mL样液混合,测定吸光度Ab;对照组为1 mL DPPH溶液,加入95%乙醇溶液混合,测定吸光度A0。DPPH自由基清除率按式(2)计算:
参照Ajibola等[24]的方法测定羟自由基清除率。取0.3 mL 5 mmol/L邻氮二菲的无水乙醇溶液,加入0.2 mL 0.15 mol/L的磷酸盐缓冲液(pH 7.4)和0.3 mL 0.75 mmol/L的FeSO4溶液,加入质量浓度为2 mg/mL的多肽溶液混匀,加入0.2 mL体积分数为0.1% H2O2溶液摇匀,37 ℃条件下水浴加热60 min,在510 nm波长处测定吸光度As;以去离子水代替样品和H2O2溶液重复上述操作,在510 nm波长处测定吸光度Ab;以去离子水代替样品重复上述操作,在510 nm波长处测定吸光度A0。羟自由基清除率按式(3)计算:
1.3.7 末水坛紫菜蛋白酶解产物分子质量测定
参照朱晓连等[25]的方法,并略作修改。采用高效体积排阻色谱法,测定酶解产物分子质量分布。色谱柱为TSK-GELG2000SWXL(7.8 mm×300 mm),流动相为0.1%三氟乙酸的乙腈和0.1%三氟乙酸的双蒸水,检测波长为214 nm,进样体积为10 μL,流速为0.5 mL/min,全部洗脱时长为60 min。将还原性谷胱甘肽(307.3 Da)、L-氧化型谷胱甘肽(612.63 Da)、杆菌肽(1 422.69 Da)、抑肽酶(6 511.83 Da)、细胞色素C(12 400 Da)用流动相溶解并配制成质量浓度为0.2 mg/mL的混合标准溶液。
1.3.8 凝胶色谱层析
酶解产物冷冻干燥后,将多肽溶于去离子水中,制备质量浓度为25 mg/mL的溶液,过0.22 μm的微孔滤膜后备用。采用紫外检测仪在214 nm波长处检测,根据电脑软件记录数据作图。经过多次对层析条件的分析,确定最佳层析条件:上样量2 mL,洗脱液为去离子水,洗脱温度为室温,流速0.6 mL/min。收集并浓缩各洗脱峰,冷冻干燥24 h。使用完毕后,用至少2 倍柱体积的去离子水平衡色谱柱,洗脱至基线平稳。以DPPH自由基清除率、羟自由基清除率为指标测定不同洗脱峰的抗氧化活性。
1.3.9 细胞实验
1.3.9.1 细胞培养
将液氮罐中的HepG2细胞取出,置于37 ℃的温水浴中解冻,将细胞转移到25 cm2组织培养瓶,加入12 mL DMEM高糖培养基(含有10% FBS、100 μg/mL链霉素和100 U/mL青霉素),混匀后1 500 r/min低速离心5 min。置于CO2培养箱中培养(37 ℃,5% CO2),每隔2 d更换一次培养基。
1.3.9.2 细胞模型的建立
在一般的药物筛选实验中,通常选择存活率为50%至70%的诱导浓度作为最佳浓度,考虑到细胞存活率过低,细胞易受诱导物过度损伤,不利于细胞的后期修复作用,因此存活率为60%左右较为合适。经前期研究,采用不同浓度(50、100、200、400、600、800 μmol/L)的H2O2溶液对HepG2细胞处理4 h,以细胞存活率为指标,得到存活率为60%的最适诱导条件为:H2O2诱导浓度259 μmol/L,诱导时间4 h。其中,细胞存活率的测定采用MTT法。
1.3.9.3 末水坛紫菜抗氧化肽(Porphyra haitanensis antioxidant peptide,PHAP)对H2O2诱导HepG2细胞氧化损伤的影响
细胞培养至贴壁稳定,PHAP处理24 h后,再用诱导浓度为259 μmol/L的H2O2溶液诱导4 h,即为治疗组1;GSH处理24 h后,再用诱导浓度为259 μmol/L的H2O2溶液诱导4 h,即为治疗组2;检测治疗组中HepG2细胞的存活率、SOD活性和MDA浓度。
表3 实验设计
Table 3 Experimental grouping

因素 对照组 模型组 治疗组1 治疗组2肽质量浓度/(μg/mL) 0 0 200 200 H2O2浓度/(μmol/L) 0 259 259 259
1.3.9.4 细胞活力、SOD活性和MDA浓度的测定
将对数生长期的HepG2细胞以1×105每孔接种到96 孔板中,在含有5% CO2的湿式培养箱中37 ℃培养24 h,向各孔中加入20 μL 5 mg/mL噻唑基MTT溶液,在37 ℃下培养4 h,含有5% CO2的培养箱,在小心地丢弃孔中的上清液后,向每个孔中加入200 μL DMSO二甲基亚磺酸,并在微孔板振荡器上振荡15 min,在酶标仪波长为490 nm处检测其吸光度,并根据吸光度计算出细胞存活率。SOD活性和MDA浓度的测定参考SOD试剂盒、丙二醛试剂盒说明书进行。
1.4 数据分析
所得数据为3 次平行实验的平均值,单因素试验结果采用SPSS 20.0软件进行显著性差异(P<0.05)分析,采用Design-Expert 8.0.5软件进行响应面试验设计分析,并采用OriginPro 8作图。
2 结果与分析
2.1 末水坛紫菜蛋白水解酶选择
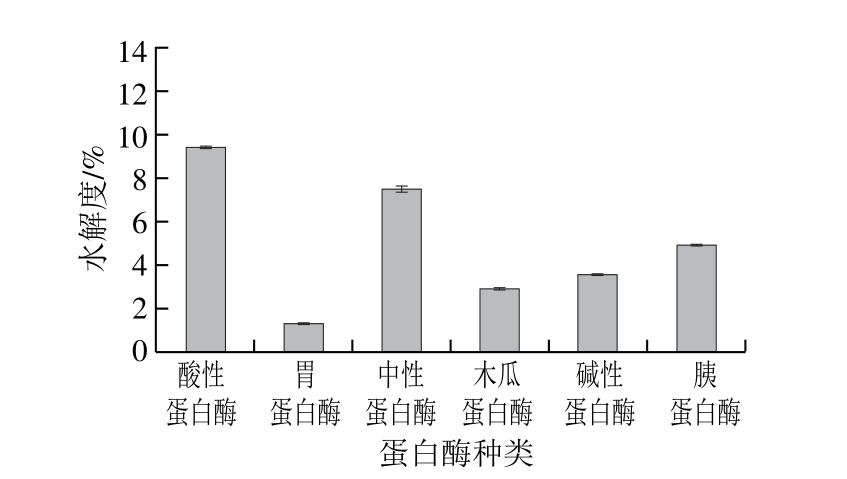
图1 不同种类蛋白酶对坛紫菜蛋白的水解度的影响
Fig. 1 Effect of different proteases on the DH of P. haitanensis protein
由图1可知,酸性蛋白酶的对末水坛紫菜蛋白的水解度最高,其次分别是中性蛋白酶、胰蛋白酶、碱性蛋白酶、木瓜蛋白酶和胃蛋白酶,这表明酸性蛋白酶对末水坛紫菜蛋白的水解更充分。
2.2 单因素试验结果
影响蛋白酶解的因素主要包括酶的种类、加酶量、酶解时间、pH值、温度、底物质量浓度等。实验以水解度为指标,分别考察底物质量浓度、加酶量、pH值、温度对水解度的影响。由图2可知,随着底物质量浓度的增加,水解度呈现先快速上升后又趋于平缓的趋势,在底物质量浓度为2 g/100 mL时水解度达到最大,继续增大底物质量浓度其水解度并无显著变化,这可能是由于较低的底物质量浓度会影响酶与底物分子的结合。另一方面,较高的底物质量浓度会引起底物抑制和酶失活现象[26],因此底物质量浓度选择2 g/100 mL较为合适。随着加酶量的增加,末水坛紫菜蛋白水解度不断上升,当加酶量达到5 000 U/g时,水解度达到最大,但其增长速率减小,加酶量过多可能降低酶与底物的传质效率,降低反应效率。同时在一定酶活力条件下,过高的加酶量不仅增加了生产成本,还增加了酶解产物中杂质的含量,对后续的活性测定有一定的干扰作用,因此选择加酶量为4 000 U/g较为合适。随着pH值的升高,末水坛紫菜蛋白水解度呈现迅速增大后下降的趋势,在pH 3.0时水解度达到最大,这与酸性蛋白酶的最适pH值范围2.5~5.0相符合,因此pH值选择3.0较为合适。随着温度的升高,末水坛紫菜蛋白水解度呈现先增大后又下降的趋势,在55 ℃时水解度达到最大。温度过低会影响酶和底物分子在溶液中的扩散,温度过高会引起酶分子的结构变化,从而使酶部分失活[27],因此温度选择55 ℃较合适。
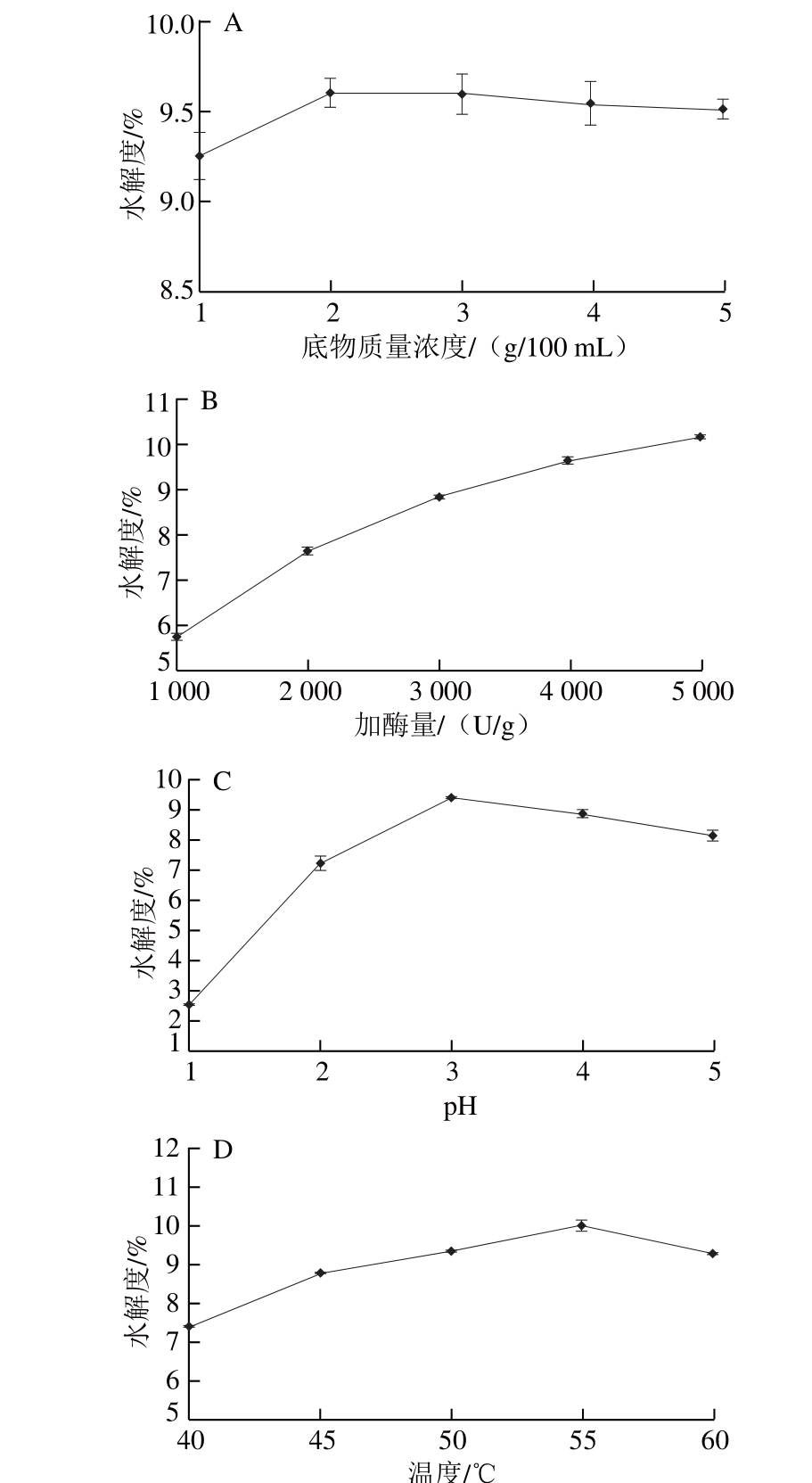
图2 底物质量浓度(A)、加酶量(B)、pH值(C)和温度(DD)对末水坛紫菜蛋白水解度的影响
Fig. 2 Effects of substrate concentration (A), enzyme to substrate ratio (B),pH (C) and temperature (D) on the DH of P. haitanensis protein
2.3 响应面分析
2.3.1 数学模型的建立与显著性分析
经Design-Expert 8.0.5.0软件对表4结果进行分析,得到末水紫菜蛋白水解度的二次回归模型:Y/%=10.57+0.48A+2.35B-0.83C-0.29AB-0.32AC+0.26BC-0.68A2-1.67B2-2.87C2。
末水紫菜蛋白水解度的方差分析和显著性分析见表5。末水紫菜蛋白水解度模型P<0.000 1,失拟项P=0.0849>0.05,表明该回归模型极显著;模型![]() 表明回归模型与试验结果的拟合度高,可用于末水紫菜蛋白水解度的分析和预测。一次项系数A、B、C和二次项系数A2、B2、C2的P<0.05,表明这些因素对末水紫菜蛋白水解度的影响显著。由A、B、C的F值大小可以推断出,3 个因素对末水紫菜蛋白水解度影响主次顺序为B>C>A。
表明回归模型与试验结果的拟合度高,可用于末水紫菜蛋白水解度的分析和预测。一次项系数A、B、C和二次项系数A2、B2、C2的P<0.05,表明这些因素对末水紫菜蛋白水解度的影响显著。由A、B、C的F值大小可以推断出,3 个因素对末水紫菜蛋白水解度影响主次顺序为B>C>A。
表4 响应面试验设计及结果
Table 4 Experimental design and corresponding results for respond surface analysis
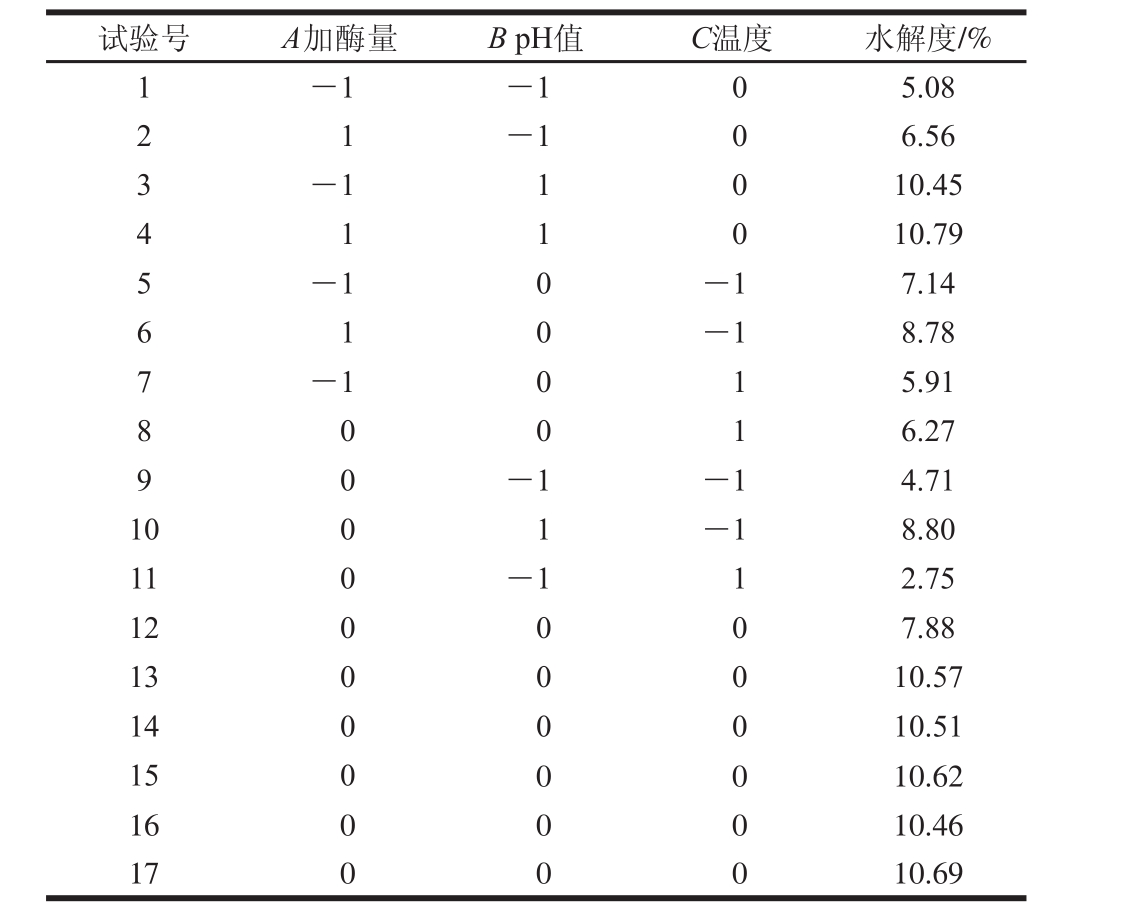
试验号 A加酶量 B pH值 C温度 水解度/%1-1 -1 0 5.08 2 1-1 0 6.56 3-1 1 0 10.45 4 1 1 0 10.79 5-1 0 -1 7.14 6 1 0-1 8.78 7-1 0 1 5.91 8 0 0 1 6.27-1 -1 4.71 10 0 1 -1 8.80 11 0 -1 1 2.75 12 0 0 0 7.88 13 0 0 0 10.57 14 0 0 0 10.51 15 0 0 0 10.62 16 0 0 0 10.46 17 0 0 0 10.69 9 0
表5 回归方程的方差分析
Table 5 Analysis of variance for the fitted regression model

注:**. P<0.01,差异极显著。
方差来源 平方和 自由度 均方 F值 P值 显著性模型 104.82 9 11.65 554.03 <0.000 1 **A加酶量 1.82 1 1.82 86.77 <0.000 1 **B pH值 44.27 1 44.27 2 106.14 <0.000 1 **C温度 5.48 1 5.48 260.59 <0.000 1 **AB 0.32 1 0.32 15.46 0.005 7 **AC 0.41 1 0.41 19.48 0.003 1 **BC 0.27 1 0.27 12.86 0.008 9 **A2 1.95 1 1.95 92.62 <0.000 1 **B2 11.74 1 11.74 558.61 <0.000 1 **C2 34.56 1 34.56 1 644.08 <0.000 1 **残差 0.15 7 0.021失拟项 0.11 3 0.038 4.69 0.084 9纯误差 0.033 4 0.008总变异 104.97 16
2.3.2 交互作用的响应面和等高线图
经过Design-Expert 8.0.5软件处理,得到加酶量、pH值、温度交互作用的响应面和等高线图。如图3所示,加酶量和pH值(AB)、加酶量和温度(AC)、pH值和温度(BC)交互作用对末水紫菜蛋白水解度的影响显著,与显著性分析结果相符。
根据所得到的响应面模型,经Design-Expert 8.0.5软件处理得到最优工艺为加酶量4 239.64 U/g、pH 3.67、温度54.36 ℃,在此条件下末水紫菜蛋白水解度为11.47%。考虑到实际可操作性,调整工艺参数为加酶量4 240 U/g、pH 3.7、温度54 ℃,在此条件下进行3 组验证实验,末水紫菜蛋白水解度为11.44%、11.35%、11.42%,取平均值为11.40%,与理论值较为接近,表明响应面模型对优化末水紫菜蛋白水解度的制备工艺可行。

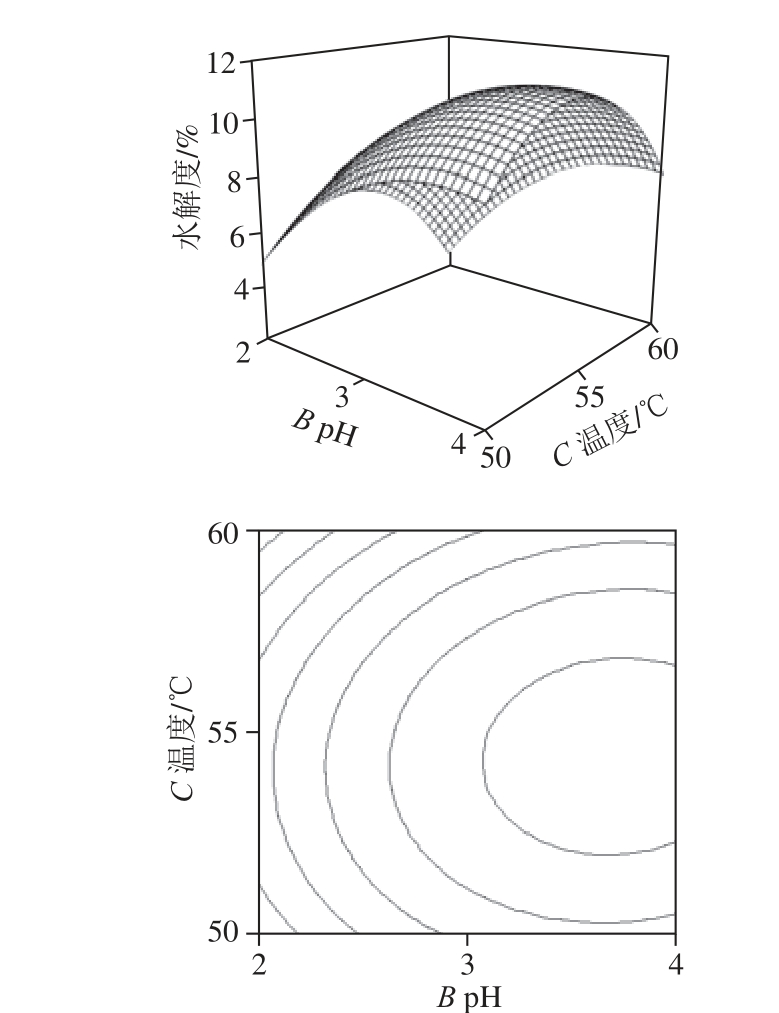
图3 加酶量、pH值和温度交互作用的响应面和等高线图
Fig. 3 Response surface and contour plots indicating the interactive effects of three hydrolysis parameters on DH
2.4 末水紫菜蛋白水解度与抗氧化活性的关系

图4 酶解产物水解度与抗氧化活性的关系
Fig. 4 Relationship between DH and antioxidant activities of hydrolysates
由图4可知,随着水解时间的延长,水解度呈现出逐渐升高的趋势,但其升高速率逐渐降低,当水解时间为10 h时,水解度最高为14.89%。随着水解度的逐渐升高,末水坛紫菜蛋白酶解产物对DPPH自由基清除率均呈现先增加后降低的趋势。水解时间为4 h,水解度为11.40%时,酶解产物对DPPH自由基的清除活性达到最大值,其半抑制率浓度(half maximal inhibitory concentration,IC50)为0.68 mg/mL;随着酶解时间持续延长,具有抗氧化活性的肽段被降解为分子质量更小的片段,导致DPPH自由基清除率下降。Zhuang Yongliang等[28]从水母酶解产物中分离出3 种分子质量分别为<2 kDa、2~6 kDa和6~10 kDa的多肽,通过体外抗氧化活性实验发现分子质量较小的多肽具有较高的还原能力和超氧阴离子自由基清除活性。因此,有待对末水坛紫菜蛋白酶解产物进行进一步的纯化,分离出PHAP,评价其活性。
2.5 末水坛紫菜蛋白酶解产物分子质量分布
表6 末水坛紫菜蛋白酶解产物分子质量分布
Table 6 Molecular mass distribution of P. haitanensis protein hydrolysates
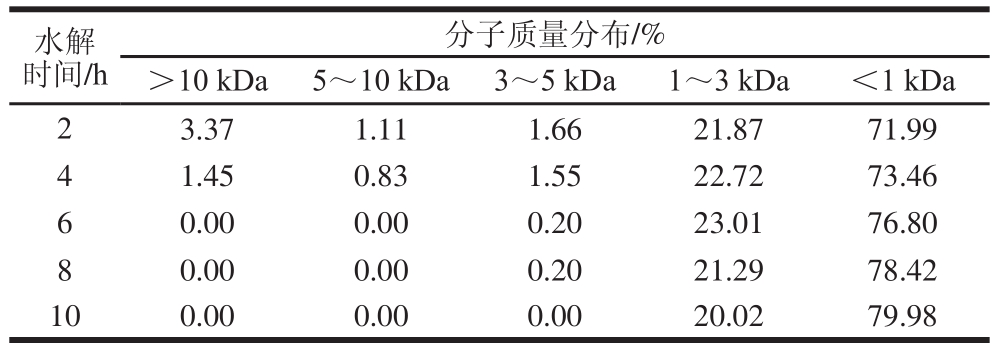
水解时间/h分子质量分布/%>10 kDa 5~10 kDa 3~5 kDa 1~3 kDa <1 kDa 2 3.37 1.11 1.66 21.87 71.99 4 1.45 0.83 1.55 22.72 73.46 6 0.00 0.00 0.20 23.01 76.80 8 0.00 0.00 0.20 21.29 78.42 10 0.00 0.00 0.00 20.02 79.98
由表6可知,酶解初期,3~5、5~10 kDa和>10 kDa的大分子组分占比逐渐下降,而1~3、<1 kDa的小分子组分占比逐渐上升;酶解后期,3~5、5~10 kDa和>10 kDa的大分子组分被降解完,1~3 kDa的组分继续被降解,因此1~3 kDa的组分占比逐渐下降,而<1 kDa的组分占比逐渐上升。
2.6 酶解产物的分离纯化
凝胶过滤色谱可用于分离水溶性的物质,如多糖、蛋白、多肽等化合物,还可用于脱盐。由于当酶解时间为4 h时,末水坛紫菜蛋白酶解产物中小于1 kDa的小分子肽占比73.46%,因此根据Sephadex的分子质量分离范围,选择Sephadex G-15对该酶解产物进行分离纯化较为合适。如图5所示,从Sephadex G-15中主要洗脱出3 个峰组分,分别记为A1、A2和A3,根据各组分的洗脱时间可知其分子质量大小为A1>A2>A3。由图6可知,A3组分的抗氧化活性最高,其质量浓度为1 mg/mL时的DPPH自由基清除率为73.32%,羟自由基清除率为30.15%。A3是通过凝胶过滤层析分离出来的分子质量相近的小分子肽混合物,将其收集、浓缩、干燥后即得坛紫菜PHAP。目前采用酶解法从水产蛋白制备分离得到的PHAP大多以分子质量小于1 000 Da的寡肽为主,Wang Yonggang等[29]从鲑鱼中制备分离得到分子质量为271.3 Da的PHAP(Pro-Arg),Sampath Kumar等[30]从竹荚鱼中制备分离得到分子质量为518.5 Da的PHAP(Ala-Cys-Phe-Leu)。此外,还有研究从红藻蛋白酶解物中分离鉴定出高活性抗氧化寡肽[31]。

图5 末水坛紫菜蛋白酶解产物的凝胶色谱图
Fig. 5 Chromatogram of P. haitanensis hydrolysates puri fied on gel filtration column

图6 末水坛紫菜蛋白酶解产物不同分离组分的DPH自由基和羟自由基清除活性
Fig. 6 DPPH and hydroxyl radical scavenging activity of different fractions in P. haitanensis hydrolysates
2.7 细胞抗氧化活性
2.7.1 细胞形态观察
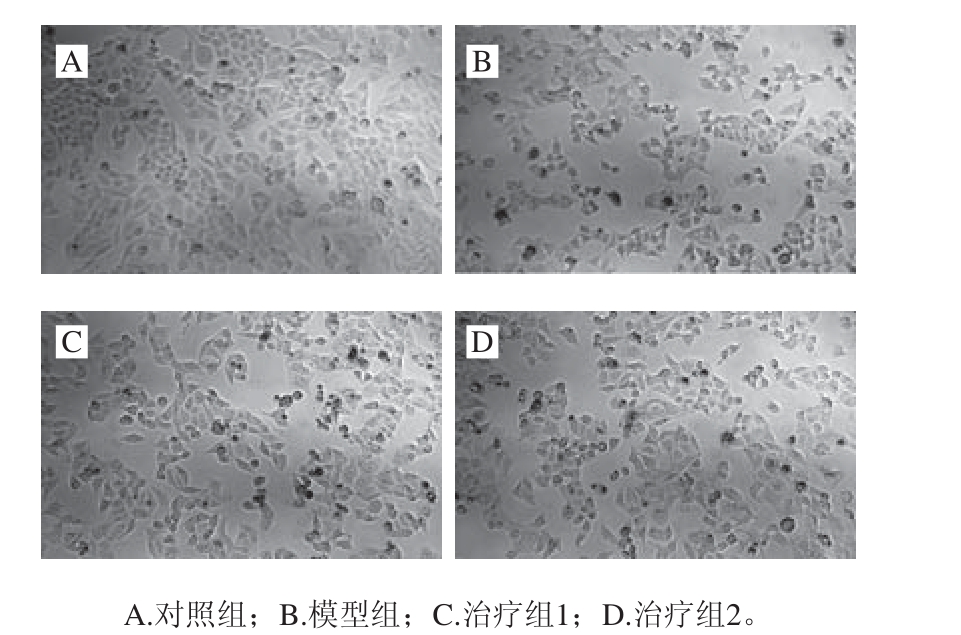
图7 PHAP、GSH对HepG2损伤细胞形态的影响
Fig. 7 Effects of PHAP and GSH on the morphology of injured HepG2 cells
如图7所示,通过倒置显微镜下观察模型组中人肝癌HepG2细胞形态,与对照组相比,人肝癌HepG2细胞数量明显减少,出现边缘不清晰,形态变圆,细胞黏连等现象,表明H2O2成功诱导了氧化损伤模型。分别采用质量浓度为200 μg/mL的PHAP和GSH处理HepG2细胞,发现治疗组细胞数量明显增加,细胞生长趋于良好,排列紧密,表明PHAP和GSH对HepG2细胞的氧化损伤具有一定的保护作用。
2.7.2 细胞活力、SOD活性和MDA浓度的测定结果
表7 PHAP、GSH对人肝癌HepG2氧化损伤细胞活力、SOD性和MDA含量的影响
Table 7 Effects of PHAP and GSH on cell viability, SOD activity and MDA content in injured HepG2 cells
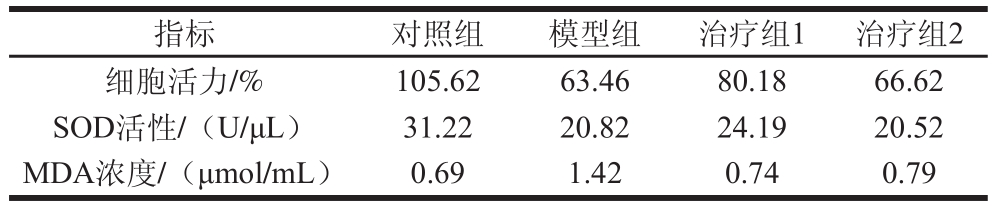
指标 对照组 模型组 治疗组1 治疗组2细胞活力/% 105.62 63.46 80.18 66.62 SOD活性/(U/μL) 31.22 20.82 24.19 20.52 MDA浓度/(μmol/mL) 0.69 1.42 0.74 0.79
如表7所示,与模型组对比,治疗组1与治疗组2的细胞活力均有提升,表明PHAP和GSH能增强模型组中人肝癌HepG2细胞活力,同时PHAP提升细胞活力的效果更为显著。为进一步探讨其作用机理,测定治疗组中SOD活性和MDA浓度。由表7可知,模型组的SOD活性为20.82 U/μL,治疗组1中SOD活性升至24.19 U/μL,治疗组2中SOD活性无明显增强。与GSH相比,PHAP能显著增强模型组中人肝癌HepG2细胞中的SOD活性;模型组的MDA浓度为1.42 μmol/mL,治疗组1中MDA浓度降至0.74 μmol/ mL,治疗组2中MDA浓度降至0.79 μmol/mL。与GSH相比,PHAP能显著降低模型组中人肝癌HepG2细胞中的MDA浓度。
由此可知,PHAP对H2O2氧化损伤后的人肝癌HepG2细胞具有修复作用,其既能增强SOD活性,还能降低脂肪氧化产物MDA的含量。
3 结 论
单因素方差分析结果表明加酶量、pH值和温度对末水坛紫菜蛋白水解度的影响具有显著性,而底物质量浓度不具备显著性。采用Box-Behnken试验设计及响应面试验优化显著影响水解度的因素,结果表明水解时间4 h、底物质量浓度2 g/100 mL、加酶量4 240(U/g)、pH 3.7、温度54 ℃的条件下,水解度最高为11.40%。通过水解时间的调节以控制水解度,探讨水解度与抗氧化活性的关系,发现当水解时间为4 h时,酶解产物的水解度为11.40%,其对DPPH自由基清除活性最强。采用Sephadex G-15对酶解物进行分离纯化,发现组分A3抗氧化活性最高,其1 mg/mL时DPPH自由基清除率为73.32%,羟自由基清除率为30.15%。通过建立H2O2诱导人肝癌HepG2细胞的氧化应激评价模型,发现末水坛紫菜PHAP能显著提升HepG2细胞的细胞活力,增强其SOD活性,并降低脂质氧化产物MDA的含量,具有明显修复HepG2细胞氧化损伤的能力,是一种高活性抗氧化肽。
[1] 张忠山. 坛紫菜多糖的化学结构修饰及其构效关系研究[D]. 青岛:中国科学院研究生院(海洋研究所), 2010.
[2] 白露. 坛紫菜多肽的分离纯化及其抗肿瘤活性研究[D]. 广州: 华南理工大学, 2016.
[3] 张晗晗, 徐燕, 纪德华, 等. 坛紫菜谷胱甘肽过氧化物酶基因的克隆及表达特征[J]. 中国水产科学, 2016, 23(4): 791-799.
[4] 农业农村部渔业渔政管理局. 2019年中国渔业统计年鉴[M]. 北京:中国农业出版社, 2019: 23-50.
[5] 齐占会, 王珺, 黄洪辉, 等. 广东省海水养殖贝藻类碳汇潜力评估[J].南方水产科学, 2012, 8(1): 30-35.
[6] 陈美珍, 徐景燕, 潘群文, 等. 末水残次坛紫菜的营养成分及多糖组成分析[J]. 食品科学, 2011, 32(20): 230-234.
[7] 王治. 紫菜生物活性成分研究进展[J]. 食品研究与开发, 2017,38(10): 215-218.
[8] LIU S J, WANG Y, WU C Y, et al. Isolation, purification and molecular weight determination of antihypertensive peptides derived from porphyra haitanesis[J]. Food Science, 2011, 32(2): 213-217.DOI:10.1016/S1671-2927(11)60313-1.
[9] 刘冬冬, 田亚平. 酶解条斑紫菜制备抗氧化肽及综合利用[J]. 食品与生物技术学报, 2016, 35(2): 166-172.
[10] 王茵, 苏永昌, 吴靖娜, 等. 紫菜多肽降血脂及抗氧化作用的研究[J].食品工业科技, 2013, 34(16): 334-337.
[11] 刘冬冬, 周锋, 周楠迪, 等. 条斑紫菜蛋白酶解产物中抗菌肽的纯化及特征[J]. 天然产物研究与开发, 2014, 26(12): 1921-1925.
[12] 何荣海, 马海乐. 条斑紫菜ACEI肽结构鉴定与性能试验[J]. 江苏大学学报(自然科学版), 2012, 33(4): 430-434.
[13] 姚兴存, 蒋卉, 舒留泉, 等. 条斑紫菜活性肽的抗氧化作用[J]. 食品科学, 2011, 32(7): 104-108.
[14] 李致瑜, 张翀, 田玉庭, 等. 大黄鱼内脏抗氧化肽的稳定性研究[J].现代食品科技, 2016(1): 151-158.
[15] JIN D X, LIU X L, ZHENG X Q, et al. Preparation of antioxidative corn protein hydrolysates, Purification and evaluation of three novel corn antioxidant peptides[J]. Food Chemistry, 2016, 204: 427-436.DOI:10.1016/j.foodchem.2016.02.119.
[16] NAJAFIAN L, BABJI A S. A review of fish-derived antioxidant and antimicrobial peptides: their production, assessment, and applications[J]. Peptides, 2012, 33(1): 178-185. DOI:10.1016/j.peptides.2011.11.013.
[17] BREWER M S. Natural antioxidants: sources, compounds,mechanisms of action, and potential applications[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(4): 221-247.DOI:10.1111/j.1541-4337.2011.00156.x.
[18] WATTANASIRITHAM L, THEERAKULKAIT C, WICKRAMASEKARA S,et al. Isolation and identification of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J]. Food Chemistry, 2016,192: 156-162. DOI:10.1016/j.foodchem.2015.06.057.
[19] JANG H L, LICEAGA A M, YOON K Y. Purification, characterisation and stability of an antioxidant peptide derived from sandfish(Arctoscopus japonicus) protein hydrolysates[J]. Journal of Functional Foods, 2016, 20: 433-442. DOI:10.1016/j.jff.2015.11.020.
[20] 刘丽莉, 王焕, 李丹, 等. 鸡蛋清卵白蛋白酶解工艺优化及其结构性质[J]. 食品科学, 2016, 37(10): 54-61. DOI:10.7506/spkx1002-6630-201610010.
[21] 赵静, 王燕. 辣椒粕分离蛋白酶解工艺条件的优化[J]. 食品与机械,2016(1): 162-166.
[22] CHI C F, HU F Y, WANG B, et al. Antioxidant and anticancer peptides from the protein hydrolysate of blood clam (Tegillarca granosa) muscle[J]. Journal of Functional Foods, 2015, 15: 301-313.DOI:10.1016/j.jff.2015.03.045.
[23] 王海凤, 王常青, 吕鹏, 等. 葵花籽分离蛋白不同酶解产物清除自由基活性的研究[J]. 中国粮油学报, 2011, 26(3): 56-59.
[24] AJIBOLA C F, FASHAKIN J B, FAGBEMI T N, et al. Effect of peptide size on antioxidant properties of african yam bean seed (Sphenostylis stenocarpa) protein hydrolysate fractions[J].International Journal of Molecular Sciences, 2011, 12(12): 6685-6702.DOI:10.3390/ijms12106685.
[25] 朱晓连, 陈华, 蔡冰娜, 等. 具有结合胆酸盐作用卵形鲳鲹蛋白酶解物的制备和分子量分布研究[J]. 南方水产科学, 2017, 13(2): 101-108.
[26] 郭浩楠, 杨荣华, 袁晓晴, 等. 鲢鱼蛋白的酶解及其酶解物功能性质的研究[J]. 中国食品学报, 2010, 10(4): 106-112.
[27] ZHU Y, ZHAO G, LIU Y, et al. Optimization of enzymatic hydrolysis of chicken bone protein for production of antioxidant peptides using nutrase[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(12): 309-314. DOI:10.11975/j.issn.1002-6819.2016.12.044.
[28] ZHUANG Y L, SUN L P, ZHAO X, et al. Investigation of gelatin polypeptides of jelly fish (Rhopilema esculentum) for their antioxidant activity in vitro[J]. Food Technology and Biotechnology, 2010, 48(2):222-228. DOI:10.1177/1082013210366788.
[29] WANG Y G, ZHU F R, HAN F S, et al. Purification and characterization of antioxidative peptides from salmon protamine hydrolysate[J]. Journal of Food Biochemistry, 2008, 32(5): 654-671.DOI:10.1111/j.1745-4514.2008.00190.x.
[30] SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R.Purification and biochemical characterization of antioxidant peptide from horse mackerel (Magalaspis cordyla) viscera protein[J]. Peptides,2011, 32(7): 1496-1501. DOI:10.1016/j.peptides.2011.05.020.
[31] HARNEDY P A, O'KEEFFE M B, FITZGERALD R J. Fractionation and identification of antioxidant peptides from an enzymatically hydrolysed Palmaria palmate protein isolate[J]. Food Research International, 2017, 100: 416-422. DOI:10.1016/j.foodres.2017.07.037.