腌制能够提高原料肉的感官品质,是肉制品最为常见的加工技术之一,通过腌制可以增强肉制品的风味、改善肉制品质构特性[1],从而提高肉制品的加工特性。食盐是一种最为常见的腌制剂,相比于其他腌制剂在加工技术、保藏和感官属性等方面具有明显的优势[2],被广泛应用于肉制品的加工,对肉制品保藏和风味的形成起至关重要的作用。食盐的作用可以包括以下几个方面[3]:1)通过促进肌原纤维蛋白的溶解提高肉制品的持水力,改善肉的质地;2)降低肉制品的水分活度,抑制微生物的生长,避免因微生物生长而引起的腐败和安全问题;3)调节肉制品成熟过程中的生物化学反应和酶反应,影响最终的产品风味;4)通过提供咸味和改善挥发性香气化合物从食物基质中的释放影响肉制品最终的感官特性。
氧化是肉类最重要的非微生物降解途径之一,会导致肉制品颜色、香气和风味等感官特性的退化和营养价值的降低[4]。肉类富含丰富的脂质和蛋白质,但由于脂质和蛋白质自身结构的特点,容易受到活性氧(reactive oxygen species,ROS)的攻击,导致自身结构发生改变,引起脂质和蛋白质的氧化。脂质氧化一直以来被认为是影响肉制品品质的主要反应,由于肉类富含不饱和脂肪酸,容易受到ROS的攻击而引发自由基链式反应,生成初级产物氢过氧化物和次级产物羰基化合物、酮类、醇类和醛类等。而关于蛋白质氧化的研究相对较晚,有研究表明蛋白质也是活性氧的攻击目标,蛋白质氧化也会发生类似于脂质氧化反应的自由基链式反应,活性氧对肌肉蛋白的攻击导致氨基酸残基被破坏和羰基化合物的生成[5-7]。脂质氧化会促进芳香化合物的产生,影响肉的味道和风味;蛋白质氧化不仅会导致颜色和质地的恶化,还会导致必需氨基酸等营养物质的流失,降低蛋白质的消化率。有研究[8]表明动物肌肉中的脂质氧化会促进蛋白质氧化:脂质氧化产生的过氧化氢自由基易被蛋白质中的氢原子吸收,形成蛋白质自由基,并转化为有助于烷氧自由基和羟基衍生物生成的烷氧基过氧化物;此外,脂质氧化反应产生的次级产物(醛类化合物)易与蛋白质发生反应[9-10],影响其感官和营养特性。
目前,关于蛋白质和脂质氧化对肉制品品质影响的研究相对较多,Li Binbin等[11]用4 种不同氧化程度的猪肉背部脂肪混合猪瘦肉制作川味香肠,结果表明在发酵过程中较高的脂质氧化组其蛋白质氧化程度更高;Wang Zhaoming等[12]用脂质氧化副产物丙二醛处理兔肉的肌肉匀浆,结果表明丙二醛可以与肌原纤维蛋白形成加合物并影响ROS生成系统,导致肌原纤维蛋白氧化加剧。现阶段有关食盐、蛋白质氧化、脂质氧化及肉制品品质之间的相互作用关系的文献研究相对较少,Wen Rongxin等[13]研究发现30%的NaCl替代(70% NaCl、20% KCl、4%赖氨酸、1%丙氨酸、0.5%柠檬酸、1%乳酸钙和3.5%麦芽糖糊精)可以降低哈尔滨风干肠的脂质和蛋白质氧化水平,且有助于风味的形成。许多研究表明[14-19],食盐主要的成分NaCl对脂质氧化具有一定的促进作用,本实验以鸡肉为原材料,探究不同食盐添加量腌制对鸡肉脂质氧化、蛋白质氧化和食用品质的影响,并对三者之间的联系和影响机制进行分析。
1 材料与方法
1.1 材料与试剂
鸡胸肉购自湖南湘佳牧业股份有限公司,鸡肉品种为三黄鸡,平均质量为(203.78±5.78)g,平均厚度(从其最厚处测)为(21.25±1.41)mm;食盐 重庆市购;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)试剂盒 北京索莱宝科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
BSA323S电子分析天平 赛多利斯科学仪器有限公司;S25涡旋混合器 德国IKA集团;5810型台式高速离心机德国Eppendorf公司;UV-16001紫外-可见分光光度计日本岛津仪器有限公司;Avanti J-30I冷冻离心机 美国贝克曼库尔特公司;DW-86W100超低温冰箱 青岛海尔集团;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;XHF-D内切式匀浆机 宁波新芝生物科技股份有限公司;Elix10纯水机 美国密理博公司;TA.XT.Plus物性测定仪 英国Stable Micro System公司;Mini-PROTEAN Tetra Cell电泳系统 美国Bio-Rad公司;UltraScan PRO测色仪 美国HunterLab公司。
1.3 方法
1.3.1 鸡肉腌制处理
将冷冻的鸡胸肉在4 ℃解冻24 h,洗净后剔除多余的脂肪、结缔组织和肌膜,使其表面平整,体积为10 cm×5 cm×2 cm,质量约为150 g。将鸡胸肉分为6 组,按照质量比1∶1.5加入食盐质量分数为0%、3%、6%、9%、12%、15%的腌制液中,置于4 ℃腌制36 h。腌制完成后进行取样,并测定指标。
1.3.2 食用品质分析
1.3.2.1 水分含量的测定
参照GB 5009.3—2016《食品中水分的测定》[20]。
1.3.2.2 pH值的测定
参照GB 5009.237—2016《食品pH值的测定》[21]。
1.3.2.3 蒸煮损失率的测定
参照农业部行业标准NY/T 2793—2015《肉的食用品质客观评价方法》[22]并略作修改。将鸡肉沿平行于肌纤维方向切成2 cm×2 cm×3 cm的肉块,称质量并编号,再加入72 ℃的恒温水浴锅中至肉块中心温度70 ℃,取出冷却至室温后再称质量计算蒸煮损失率,如式(1)所示:
1.3.2.4 色差的测定
参照NY/T 2793—2015[22]并略作修改。将腌制完成后的鸡肉的肌肉横断面垂直置于经过校正的测色仪镜头,使肉面紧扣镜口不漏光,同一食盐质量分数梯度取5 个样品,选择不同的部位测定5 次,记录亮度值(L*)、红度值(a*)和黄度值(b*)。
1.3.2.5 质构的测定
参照Du Lei等[23]并略作修改。将鸡肉切割成体积为3 cm×3 cm×2 cm的立方体,滤干表面水分后置于载物台上,测定其硬度、胶黏性、弹性,每个样品重复6 次,取平均值。质构测定参数:采用TA.XT.Plus物质测试仪,P/36R型探头,压缩模式(texture pro file analysis,TPA),测试前速率2.0 mm/s,测试速率1.0 mm/s,测试后速率2.0 mm/s,出发点力5 g,压缩程度40%,两次压缩间隔时间为5.00 s。平行测定7 次,去掉最小值和最大值,最终结果取剩余5 个值的平均值。
1.3.2.6 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值的测定
参考Lan Yang等[24]的方法。取10 g绞碎鸡肉样品,加入20 mL三氯乙酸溶液(0.2 g/mL),在3 000 r/min均质处理60 s。随后4 ℃、3 500×g离心15 min,过滤离心上清液后取5 mL于比色管中,加入相同体积的硫代巴比妥酸溶液(20 mmol/L)。将上述混合液在沸水浴中加热处理20 min,冷却至室温后在532 nm波长处测定吸光度。
1.3.2.7 蛋白质溶解度的测定
肌浆蛋白溶解度测定参照扶庆权等[25]的方法并略作修改。1 g碎肉加入10 mL的0.02 mol/L(pH 7.2)预冷的磷酸盐缓冲液,匀浆机以最低速匀浆1 min,放入摇床固定于4 ℃匀速振荡过夜,取出匀浆液5 000×g离心10 min,上清液肌浆蛋白溶解度采 用双缩脲方法进行测定。
总蛋白溶解度测定:1 g碎肉加入20 mL 0.1 mol/L(含1.1 mol/L碘化钾,pH 7.2)预冷的磷酸盐缓冲液,按肌浆蛋白同样的方法和程序进行匀浆、振荡、离心和测定。
肌原纤维蛋白的溶解度为总蛋白溶解度和肌浆蛋白溶解度的差值。
1.3.3 蛋白质氧化分析
蛋白质的提取参照Wang Zhaoming等[26]的方法并略作修改。将解冻的鸡肉样品切成小块并用绞肉机搅碎,取25 g搅碎的鸡肉样品与100 mL含有100 mmol/L NaCl、2 mmol/L MgCl2和1 mmol/L EDTA-2Na的磷酸盐缓冲液(pH 7.0)混合,随后进行均质处理。均质完成后,4 ℃、2 500×g离心15 min,离心后的上清液即为肌浆蛋白。移除上清液后,再次加入100 mL上述提取液,并重复均质和离心步骤。上述操作重复3 次后,加入100 mL含有100 mmol/L NaCl的磷酸盐缓冲液(pH 6.25)并均质处理。随后4 ℃、2 500×g离心15 min,移除上清液后,加入100 mL磷酸盐缓冲液(pH 6.0)并均质。将均质液用双层纱布过滤以除去结缔组织,4 ℃、2 500×g离心15 min,所得的沉淀即为肌原纤维蛋白样品。提取的肌原纤维蛋白置于4 ℃并在12 h内使用。
1.3.3.1 羰基的测定
参照Wang Zhaoming等[26]的方法并略作修改。将肌原纤维蛋白样品分别用磷酸盐缓冲液(20 mmol/L,pH 6.0)稀释到质量浓度为5 mg/mL,从每一组样品中分别取2 份蛋白质溶液(0.4 mL)于2 mL的离心管中。其中一份用800 μL的2 mol/L HCl溶液(含有0.002 g/mL的2,4-二硝基苯肼)处理,记为处理组;另一份用800 μL的2 mol/L HCl溶液处理,记为空白组。将处理组和空白组样品在室温下反应30 min后,加入400 μL的三氯乙酸(0.4 g/mL)沉淀蛋白质。随后4 ℃、5 000×g离心5 min,并移除上清液。加入1 mL乙醇-乙酸乙酯混合液(1∶1,V/V)洗涤沉淀以除去未反应的2,4-二硝基苯肼,随后4 ℃、5 000×g离心5 min。上述洗涤过程重复3 次后,加入1.5 mL的磷酸盐缓冲液(20 mmol/L,pH 6.5,含有6 mol/L盐酸胍)溶解沉淀。放置过夜后,在370 nm波长处测定吸光度,蛋白质羰基含量根据摩尔消光系数(22 000 L/(mol·cm))计算求得。肌浆蛋白羰基的测定同上。
1.3.3.2 巯基的测定
参照Wang Zhaoming等[26]的方法并略作修改。用磷酸盐缓冲液(20 mmol/L,pH 6.0)将肌原纤维蛋白稀释到5 mg/mL,吸取1 mL肌原纤维蛋白悬浮液,用9 mL的磷酸盐缓冲液(50 mmol/L,pH 7.0,包含8 mol/L尿素,0.6 mol/L NaCl,10 mmol/L EDTA-2Na)稀释。取3 mL的稀释液于试管中,加入0.4 mL 0.1%的5,5’-二硝基(2-硝基苯甲酸),随后在40 ℃避光放置25 min。冷却至室温后在412 nm波长处测定吸光度。巯基含量根据摩尔消光系数(13 600 L/(mol·cm))计算求得。肌浆蛋白巯基的测定同上。
1.3.3.3 表面疏水性的测定
参照Wang Zhaoming等[26]的方法并略作修改。肌原纤维蛋白用磷酸盐缓冲液(20 mmol/L,pH 6.0)稀释至5 mg/mL,取1 mL的稀释液与0.2 mL质量浓度为1 mg/mL的溴酚蓝(bromophenol blue,BPB)溶液混合。同时制备对照组样品,即取1 mL磷酸盐缓冲液加入0.2 mL的溴酚蓝溶液。所有样品在25 ℃振荡10 min后4 ℃、2 000×g离心15 min。取0.4 mL上清液,加入3.6 mL磷酸盐缓冲液(20 mmol/L,pH 6.0)稀释,在595 nm波长处测定吸光度。两分子的BPB会和一分子的蛋白质会产生强相互作用,而这种捆绑作用与BPB的表面疏水性有关,因此用BPB结合量表示肌原纤维蛋白和肌浆蛋白的表面疏水性。肌浆蛋白表面疏水性的测定同上。肌原纤维蛋白质表面疏水性计算如式(2)所示:
1.3.3.4 SDS-PAGE分析
参照Wang Zhaoming等[26]的方法并略作修改。肌原纤维蛋白溶液用磷酸盐缓冲液(20 mmol/L,pH 6.0)稀释为1.5 mg/mL,取1 mL的蛋白质稀释液加入4 mL的buffer缓冲液,在沸水条件下加热3 min。冷却至室温后3 000×g离心5 min,取10 μL上清液上样。在30 mA的条件下进行电泳。肌浆蛋白溶液同上。
1.4 数据处理
采用SPSS 17.0软件对数据进行分析,Origin 9.0软件进行绘图。
2 结果与分析
2.1 食用品质的变化
2.1.1 pH值
表1 食盐添加量对鸡肉理化特性的影响
Table 1 Effect of different NaCl levels on physical and chemical properties of chicken meat

注:同行小写字母不同表示差异显著(P<0.05)。
食盐添加量/%理化指标 0 3 6 9 12 15 pH 6.10±0.10ab 6.25±0.03c 6.15±0.08bc6.16±0.04bc 5.98±0.03d 6.02±0.04ad水分质量分数/% 72.27±0.21a77.12±0.02b76.88±0.02b72.85±1.20a72.63±0.23a72.29±0.52a蒸煮损失率/% 29.03±0.43a28.50±1.19ab25.44±1.29bc22.03±3.07d23.10±2.19cd27.48±1.36ab L* 58.36±2.71a45.14±1.83b42.72±1.09b42.00±1.39b33.36±2.18c37.62±1.52d a* -1.43±0.28a1.22±0.39b 1.14±0.29b 0.70±0.24b 0.81±0.13b 0.91±0.22b b* 5.29±0.71ab 7.67±1.73c 3.92±1.41b 5.50±1.68a 5.12±1.43ab4.56±1.02ab
微生物和酶的活动所产生的代谢分子会对肉的pH值产生影响,因此可以根据pH值对肉的新鲜程度进行初步判断。由表1可知,食盐添加量对鸡肉的pH值影响显著(P<0.05),在低食盐添加量的腌制条件下,鸡肉的pH值有一定程度的增大,在高食盐添加量的腌制条件下,鸡肉的pH值有一定程度的减小。这可能与微生物的生长以及食盐溶液呈弱酸性有关,随着食盐添加量的增加,其对微生物活动及蛋白酶活性的抑制作用逐渐增强,所以鸡肉的pH值逐渐降低,而对于食盐添加量为0%的样品,腌制液的pH值呈中性,并非微生物生长的最适pH值,微生物的生长速率在短时间内会小于食盐添加量为3%的样品,所以空白组的pH值也相对较低。
2.1.2 水分含量
从表1可以看出,食盐添加量对鸡肉的水分含量有显著影响(P<0.05),鸡肉水分含量随着食盐添加量的增加先升高后降低,在食盐添加量为3%和6%的腌制条件下,鸡肉的水分含量显著高于另外4 种(0%、9%、12%和15%)腌制条件,这表明低食盐添加量可以促进水与鸡肉更紧密的结合。低食盐添加量会促进肌原纤维蛋白溶解度、水结合能力和蛋白质基质保水能力的增加,引起鸡肉的水分含量上升[27-28];在高质量分数的食盐中,蛋白质发生变性会对肌肉的持水力产生影响;此外,较高的渗透压使肌肉收缩,导致肌肉中的水分向腌制液中转移[29]。
2.1.3 蒸煮损失率
蒸煮损失率与肉的保水性有关,可以在一定程度上反映肉的加工特性,由表1可知,食盐添加量显著影响鸡肉的蒸煮损失率(P<0.05),在食盐添加量小于12%的腌制条件下,鸡肉的蒸煮损失率随着食盐添加量的增加而降低,而在食盐添加量为15%时,鸡肉的蒸煮损失率出现突然的上升。NaCl可以提高肌原纤维蛋白溶解度,因此肌原纤维蛋白的水合作用以及与水的结合能力会增强,所以在食盐添加量小于12%时鸡肉的蒸煮损失率下降[27],Villamonte等[30]也发现在较低食盐添加量腌制时猪肉的蒸煮损失率随NaCl添加量的增加而降低;而在高食盐添加量时,肌原纤维蛋白会发生更为严重变性和聚集,蛋白质之间的疏水相互作用增强,产生“盐析”效应,导致水合作用以及与水的结合能力下降,蒸煮损失率增大[31]。
2.1.4 色泽
从表1可知,食盐添加量显著影响鸡肉的L*、a*和b*(P<0.05),这与Holownia[32]和Fernández[33]等的研究类似。随着食盐添加量的增加,L*整体呈现下降趋势,说明食盐可以显著降低鸡肉的L*,这可能与NaCl促进肌红蛋白氧化生成褐色的高铁肌红蛋白有关[34]。与未添加食盐的鸡肉相比,添加食盐可以显著增加鸡肉的a*,但食盐添加量对鸡肉a*的影响并不显著。a*的增加可能与肌原纤维蛋白的溶解度增加有关,NaCl促进肌原纤维蛋白的溶解,导致肌原纤维蛋白与亚铁血红素反应,使肉的a*上升[35]。此外,由表1可知,在食盐添加量为3%时,鸡肉的b*最高。
2.2 质构特性的变化
由图1可知,鸡肉的硬度、弹性和黏着性均受到食盐添加量的影响,随着食盐添加量的增加,鸡肉的硬度和弹性显著上升(P<0.05),而黏着性则显著下降(P<0.05)。这可能是鸡肉表面食盐添加量的差异引起,高食盐添加量腌制的鸡肉在其表面具有较高的盐添加量,导致更严重的蛋白质变性与交联,造成保水性降低,使产品质地较硬,在质构分析中得出较高的值。NaCl对蛋白酶的水解活性有抑制作用,所以在食盐添加量较少时,蛋白酶的活性较强使肌肉被水解,导致肉的质地柔软;而在高添加量食盐的渗透压作用下,蛋白酶活性被抑制,肉的硬度会上升。除此之外,高盐浓度下肌肉收缩和水分流失也可能会对鸡肉的硬度、弹性和黏着性造成影响。Ros-Polski等[34]同样也发现鸡肉的硬度和弹性随着食盐添加量的增加而增大。相似的结论也出现在鸭肉腌制过程中,Du Lei等[23]也发现腌制时食盐添加量增加会增大鸭肉的硬度和弹性,降低鸭肉黏着性。
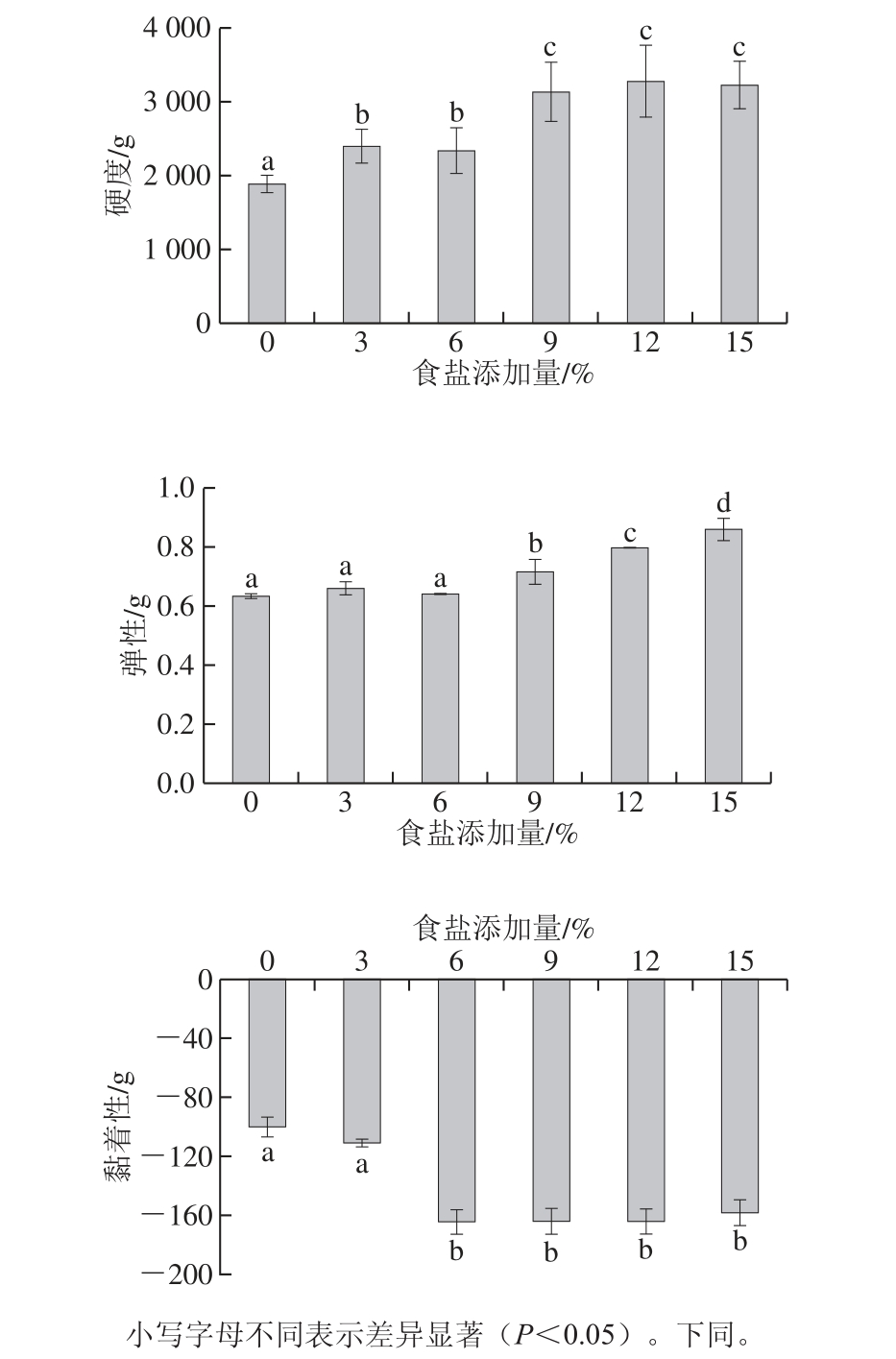
图1 食盐添加量对鸡肉质构特性的影响
Fig. 1 Effect of different NaCl levels on texture characteristics of chicken meat
2.3 TBARS值的变化
从图2可以看出,食盐添加量对TBARS值影响显著(P<0.05),与未添加食盐的腌制组相比,添加食盐后鸡肉的TBARS值显著较高,这表明食盐对脂质氧化有促进作用;有研究[14-18]也发现NaCl对脂质氧化有促进作用。目前部分研究将食盐促进脂质氧化可能的机理归因于如下4 种[1,3]:1)NaCl可以破坏细胞膜完整性,促进氧化剂进入脂质底物;2)NaC l促进含铁分子中铁离子的释放,加速氧化循环,如血红素蛋白;3)NaCl抑制过氧化氢酶、谷胱甘肽过氧化物酶和超氧化物歧化酶等内源性抗氧化酶的活性;4)食盐中存在痕量的氧化性重金属污染物。在本实验中,随着食盐添加量的增加,TBARS值先增大后减小,在食盐添加量为9%达到最大值(0.33 mg/kg)。在食盐添加量为12%和15%的腌制液中,食盐对脂质氧化的促进作用减弱,这种现象可能是由于氧在高离子强度溶液中溶解度降低,造成ROS数量减少[36]。
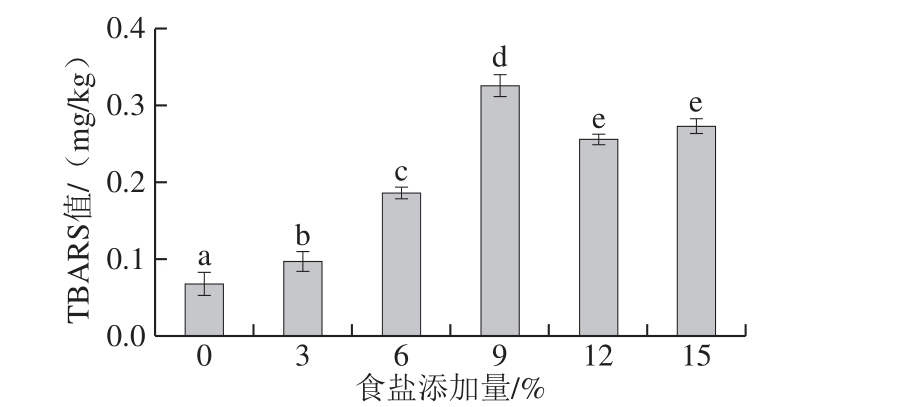
图2 食盐添加量对鸡肉TBARS值的影响
Fig. 2 Effect of different NaCl levels on TBARS of chicken meat
2.4 蛋白质溶解度的变化
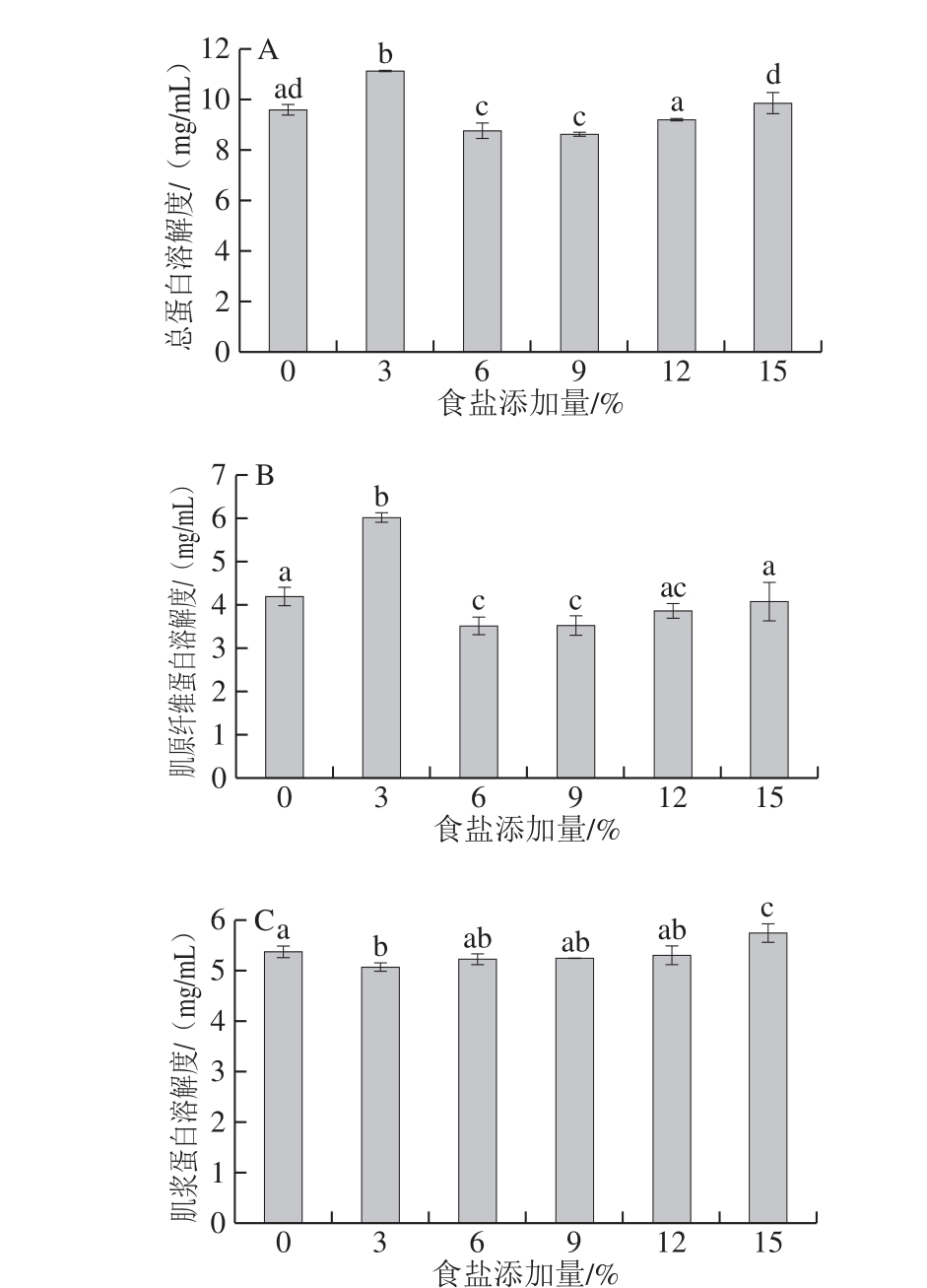
图3 食盐添加量对总蛋白溶解度(A)、肌原纤维蛋白溶解度(BB)和肌浆蛋白溶解度(C)的影响
Fig. 3 Effects of different NaCl levels on total protein solubility (A),myo fibrillar protein solubility (B) and sarcoplasmic protein solubility (C)
由图3可知,食盐添 加量显著影响鸡肉的蛋白质溶解度(P<0.05),其中影响最大的为肌原纤维蛋白。肌浆蛋白是水溶性蛋白,其溶解度受食盐添加量影响较小;肌原纤维蛋白是盐溶性蛋白,随着食盐添加量的增加,肌原纤维蛋白溶解度整体上呈现先增大后减小的趋势。当食盐添加量较少时,由于“盐溶”效应,蛋白质与NaCl之间的静电相互作用阻止了蛋白质的凝聚和沉淀,蛋白质的溶解度会上升[37]。然而,食盐添加量进一步升高,大量带负电荷的氯离子与带正电荷的蛋白质分子相互作用,导致静电斥力降低,疏水相互作用增强,此时溶质-溶质反应强于溶质-溶液反应,导致蛋白质沉淀和溶解度下降[38]。
2.5 羰基、巯基和表面疏水性的变化
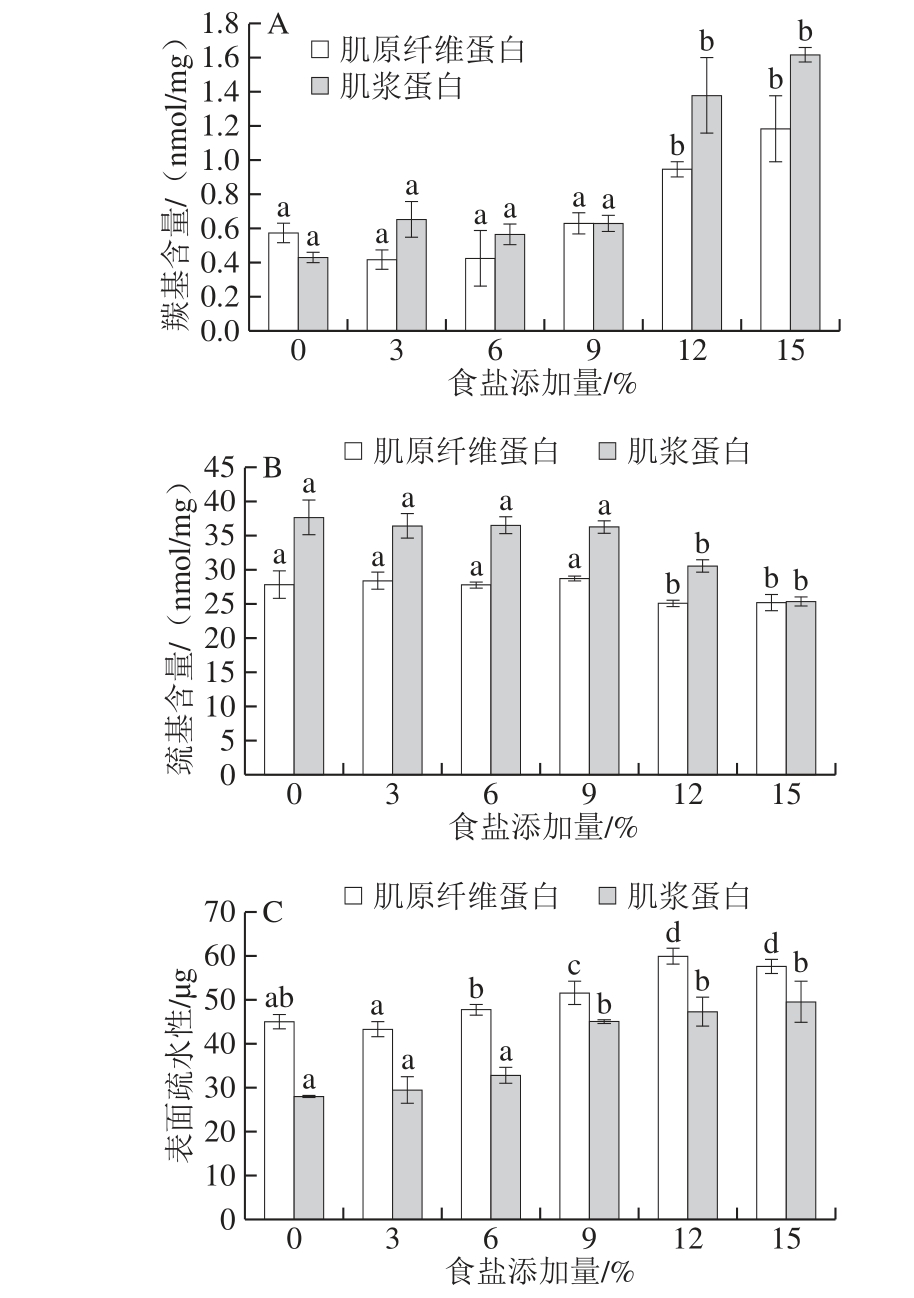
图4 食盐添加量对肌原纤维蛋白和肌浆蛋白羰基含量(AA)、巯基含量(B)和表面疏水性(C)的影响
Fig. 4 Effects of different NaCl levels on carbonyl content (A),sulfhydryl content (B) and surface hydrophobicity (C) of myo fibrillar protein and sarcoplasmic protein
蛋白质容易受到ROS的攻击,使氨基酸残基羰基化并形成交联。这些氧化修饰使蛋白质失去巯基、形成羰基,导致蛋白质的聚合和聚集,改变蛋白质的二级和三级结构,从而改变蛋白质的物理性质,如表面疏水性[39-40]。所以羰基含量、巯基含量、表面疏水性和蛋白质的裂解与交联聚合程度等都可以作为蛋白质氧化的评估指标[41]。从图4可以看出,在复杂的肉类体系中,不添加食盐和较低食盐添加量(0%、3%和6%)对蛋白质的羰基含量、巯基含量及表面疏水性的影响差异并不显著(P>0. 05),而在高食盐添加量(9%、12%和15%)的腌制条件下,肌原纤维蛋白和肌浆蛋白的羰基含量和表面疏水性显著上升(P<0.05),而巯基含量显著下降(P<0.05)。
蛋白质羰基化是蛋白质氧 化最显著的改变和直接氧化攻击的主要来源[5,42],图4A中羰基含量随着食盐添加量的增加显著上升(P<0.05),当食盐添加量为15%时,肌原纤维蛋白和肌浆蛋白的羰基含量都达到最大值,分别为1.16 nmol/mg和1.61 nmol/mg,表明高盐腌制对蛋白质羰基化有显著的促进作用。Feng Xianchao等[43]的研究也发现NaCl浓度越高,蛋白质表面的赖氨酸残基ε-NH2更易受到攻击,导致蛋白质羰基含量上升。
相反地,随着食盐添加量的增大,肌原纤维蛋白和肌浆蛋白的巯基含量显著下降(P<0.05),在食盐添加量为15%达到最小值,分别为25.22 nmol/mg和25.36 nmol/mg。蛋白质富含丰富的巯基,易受ROS的攻击形成分子内和分子间二硫键[40,44]。在较高的食盐添加量中,肌肉的溶胀暴露出更多的位点使自由基与蛋白质表面的巯基更容易结合,导致巯基含量下降(图4B)[45]。
从图4C可知,蛋白质表面疏水性随着食盐添加量的增加显著增加(P<0.05),食盐添加量为9%、12%和15%时,肌原纤维蛋白和肌浆蛋白表面疏水性显著高于食盐添加量为0%、3%和6%。蛋白质表面疏水性反映了蛋白质的展开程度,是与蛋白质功能特性相关的重要分子特性。图4表明高浓度的食盐腌制可能会导致蛋白质构象的改变和氨基酸的氧化修饰,使肌原纤维蛋白展开而暴露出蛋白表面的非极性氨基酸,引起表面疏水性的增加[1]。
综上所述,食盐添加量的增加会促进蛋白质的氧化,这可能与食盐对脂质的促氧化作用有关。结合图2与图4的结果可知,食盐的增加使脂质氧化的次级产物(丙二醛)显著增加,而脂质氧化产生的过氧化氢自由基易被蛋白质中的氢原子吸收,形成蛋白质自由基,并转化为有助于烷氧自由基和羟基衍生物生成的烷氧基过氧化物[8]。同外,脂质氧化反应产生的次级产物(醛类化合物)易与蛋白质发生反应使蛋白质发生氧化[9-10]。Soladoye等[46]的研究还发现NaCl可能参与Fe从Fe2+到Fe3+的氧化循环,并因此促进过度金属元素参与类似于“芬顿反应”的化学反应,导致更多的ROS自由基产生。
2.6 SDS-PAGE分析
肌原纤维蛋白主要包含肌球蛋白重链、肌动蛋白、原肌球蛋白和少量尚不明了的调节性结构蛋白。在不添加β-巯基乙醇的条件下(非还原条件,图5A),肌球蛋白重链、肌动蛋白和原肌球蛋白条带随着食盐添加量的增加逐渐变浅,且浓缩胶顶部的聚集物逐渐增多,说明NaCl可能导致蛋白质交联的生成。在添加β-巯基乙醇后(还原条件,图5B),浓缩胶顶部的聚集物随着食盐添加量的增加明显减少,产生交联的得以还原,表明肌球蛋白主要是通过分子间二硫键进行交联。
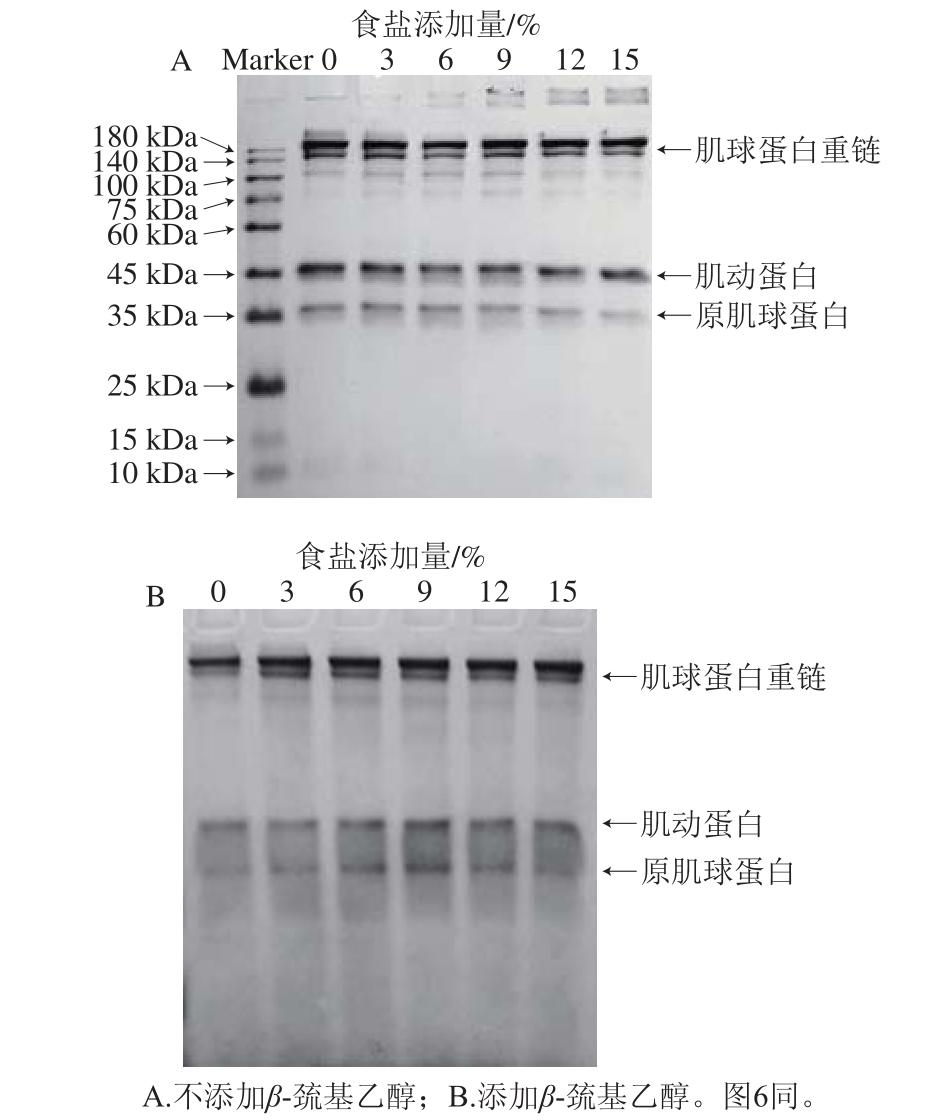
图5 不同食盐添加量腌制后肌原纤维蛋白的SDS-PAAGGEE图谱
Fig. 5 SDS-PAGE patterns of myo fibrillar proteins in chicken meat cured with different NaCl levels
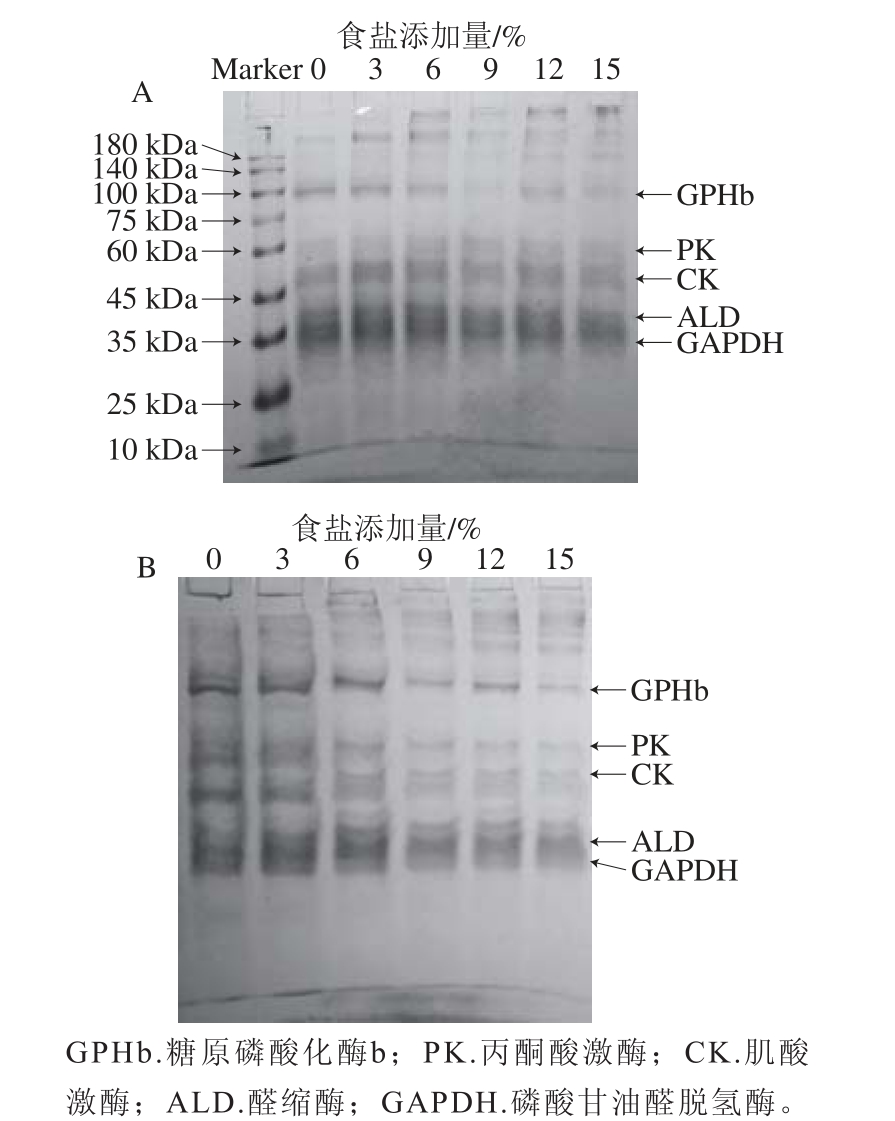
图6 不同食盐添加量腌制后肌浆蛋白的SDS-PAGE图谱
Fig. 6 SDS-PAGE patterns of sarcoplasmic proteins in chicken meat cured with different NaCl levels
肌浆蛋白是水溶性蛋白,包含糖酵解途径的大部分酶、肌酸激酶和肌红蛋白等[47]。由图6可知,在鸡肉肌浆蛋白电泳条带中主要包括糖原磷酸化酶b、丙酮酸激酶、磷酸葡萄糖异构酶、肌酸激酶、醛缩酶、甘油醛磷酸脱氢酶、磷酸甘油酸变位酶、三磷酸异构酶和肌红蛋白等。与肌原纤维蛋白类似,在不含有β-巯基乙醇的情况下(非还原条件,图6A),肌浆蛋白的条带浓度随着食盐添加量的增加逐渐减弱,并且在浓缩胶顶部以及较高分子质量区域有聚集物生成,这说明食盐可能会引起肌浆蛋白交联的发生。在β-巯基乙醇存在的条件下(还原条件,图6B),部分消失的肌浆蛋白组分可以复原,表明这些组分主要是通过二硫键产生蛋白质交联。此外,在还原条件下,肌浆蛋白条带随着食盐添加量的增加而变淡,表明高添加量食盐可能使肌浆蛋白发生降解。
由图6可知,高添加量的食盐能促进肌原纤维蛋白和肌浆蛋白以二硫键的方式形成分子间交联,这从侧面证实高食盐添加量的腌制过程可能会引起肌肉中蛋白质的氧化修饰,导致羰基含量和表面疏水性上升,巯基含量下降(图4)。
3 结 论
食盐添加量的增加对鸡肉的脂质氧化和蛋白质氧化有明显促进作用(P<0.05)。随着食盐添加量的增加,TBARS值基本呈现上升趋势,鸡肉蛋白质的羰基含量和表面疏水性增大,蛋白质溶解度先增大后减小,根据SDS-PAGE图谱结果发现,由于食盐的添加,肌原纤维蛋白和肌浆蛋白均发生不同程度的氧化,且主要以二硫键的形式形成交联。同时,食盐添加量的改变对鸡肉的食用品质影响显著(P<0.05)。随着食盐添加量的增加,水分含量和蒸煮损失率呈现先上升后下降趋势,鸡肉的pH值和L*呈下降趋势,食盐的添加会显著增大鸡肉的a*,但食盐添加量的改变没有对a*产生显著影响。综上所述,食盐添加量的增加会促进鸡肉腌制过程中的脂质和蛋白质的氧化,并且对鸡肉的食用品质产生影响。
[1] SHAREDEH D, GATELLIER P, ASTRUC T, et al. Effects of pH and NaCl levels in a beef marinade on physicochemical states of lipids and proteins and on tissue microstructure[J]. Meat Science, 2015, 110:24-31. DOI:10.1016/j.meatsci.2015.07.004.
[2] RUUSUNEN M, PUOLANNE E. Reducing sodium intake from meat products[J]. Meat Science, 2005, 70(3): 531-541. DOI:10.1016/j.meatsci.2004.07.016.
[3] LOBO F, VENTANAS S, MORCUENDE D, et al. Underlying chemical mechanisms of the contradictory effects of NaCl reduction on the redox-state of meat proteins in fermented sausages[J]. LWTFood Science and Technology, 2016, 69: 110-116. DOI:10.1016/j.lwt.2016.01.047.
[4] GUYON C, MEYNIER A, DE L M. Protein and lipid oxidation in meat: a review with emphasis on high-pressure treatments[J]. Trends in Food Science & Technology, 2016, 50: 131-143. DOI:10.1016/j.tifs.2016.01.026.
[5] ESTÉVEZ M. Protein carbonyls in meat system: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[6] SCHAICH K M. Free radical initiation in proteins and amino acids by ionizing and ultraviolet radiations and lipid oxidation-Part I: ionizing radiation[J]. CRC Critical Reviews in Food Technology, 1980, 13(2):89-129. DOI:10.1080/10408398009527286.
[7] MORTENSEN A, SKIBSTED L H, DECKER E, et al. Antioxidant activity of carotenoids in muscle foods[M]. New York: IEEE Computer Society Press, 2000: 61-83.
[8] FALOWO A B, FAYEMI P O, MUCHENJE V. Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products: a review[J]. Food Research International, 2014, 64: 171-181.DOI:10.1016/j.foodres.2014.06.022.
[9] ESTÉVEZ M. Oxidative damage to poultry: from farm to fork[J].Poultry Science, 2015, 94(6): 1368-1378. DOI:10.3382/ps/pev094.
[10] ESTÉVEZ M, LUNA C. Dietary protein oxidation: a silent threat to human health?[J]. Critical Reviews in Food Science and Nutrition,2016, 57(17): 3781-3793. DOI:10.1080/10408398.2016.1165182.
[11] LI B B, XU Y, LI J, et al. Effect of oxidized lipids stored under different temperatures on muscle protein oxidation in Sichuan-style sausages during ripening[J]. Meat Science, 2019, 147: 144-154.DOI:10.1016/j.meatsci.2018.09.008.
[12] WANG Z M, HE Z F, EMARA A M, et al. Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J]. Food Chemistry, 2019, 288: 405-412. DOI:10.1016/j.foodchem.2019.02.126.
[13] WEN R X, HU Y Y, ZHANG L, et al. Effect of NaCl substitutes on lipid and protein oxidation and flavor development of Harbin dry sausage[J]. Meat Science, 2019, 156: 33-43. DOI:10.1016/j.meatsci.2019.05.011.
[14] SHIMIZU Y, KIRIAKE S, OHTUBO S, et al. Effect of NaCl on protein and lipid oxidation in frozen yellowtail meat[J]. Bioscience Biotechnology &Biochemistry, 2009, 73(4): 923-925. DOI:10.1271/bbb.80574.
[15] GHEISARI H R, MOTAMEDI H. Chloride salt type/ionic strength and refrigeration effects on antioxidant enzymes and lipid oxidation in cattle, camel and chicken meat[J]. Meat Science, 2010, 86(2): 377-383. DOI:10.1016/j.meatsci.2010.05.020.
[16] MARIUTTI L R B, NOGUEIRA G C, BRAGAGNOLO N. Lipid and cholesterol oxidation in chicken meat are inhibited by sage but not by garlic[J]. Journal of Food Science, 2011, 76(6): C909-C915.DOI:10.1111/j.1750-3841.2011.02274.x.
[17] LIN C, TOTO C, WERE L. Antioxidant effectiveness of ground roasted coffee in raw ground top round beef with added sodium chloride[J]. LWT-Food Science and Technology, 2015, 60(1): 29-35.DOI:10.1016/j.lwt.2014.08.010.
[18] OVERHOLT M F, MANCINI S, GALLOWAY H O, et al. Effects of salt purity on lipid oxidation, sensory characteristics, and textural properties of fresh, ground pork patties[J]. LWT-Food Science and Technology, 2015, 65: 890-896. DOI:10.1016/j.lwt.2015.08.067.
[19] MARIUTTI L R B, BRAGAGNOLO N. Influence of salt on lipid oxidation in meat and seafood products: a review[J]. Food Research International, 2017, 94: 90-100. DOI:10.1016/j.foodres.2017.02.003.
[20] 国家卫生和计划生育委员会. 食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社, 2016: 1-2.
[21] 国家卫生和计划生育委员会. 食品pH值的测定: GB 5009.44—2016[S]. 北京: 中国标准出版社, 2016: 1-4.
[22] 农业部. 肉的食用品质客观评价方法: NY/T 2793—2015[S]. 北京:中国标准出版社, 2015: 8-11.
[23] DU L, ZHOU G H, XU X L, et al. Study on kinetics of mass transfer in water-boiled salted duck during wet-curing[J]. Journal of Food Engineering, 2010, 100(4): 578-584. DOI:10.1016/j.jfoodeng.2009.08.034.
[24] LAN Y, SHANG Y B, SONG Y, et al. Changes in the quality of superchilled rabbit meat stored at different temperatures[J]. Meat Science, 2016, 117: 173-181. DOI:10.1016/j.meatsci.2016.02.017.
[25] 扶庆权, 张万刚, 宋尚新, 等. 包装方式对牛肉贮藏过程中蛋白质氧化及降解的影响[J]. 农业工程学报, 2018, 34(18): 308-314.DOI:10.11975/j.issn.1002-6819.2018.18.038.
[26] WANG Z M, HE Z F, GAN X, et al. Effect of peroxyl radicals on the structure and gel properties of isolated rabbit meat myofibrillar proteins[J]. International Journal of Food Science and Technology,2018, 53(12): 2587-2696. DOI:10.1111/ijfs.13878.
[27] DESMOND E. Reducing salt: a challenge for the meat industry[J]. Meat Science, 2006, 74(1): 188-196. DOI:10.1016/j.meatsci.2006.04.014.
[28] GROSSI A, SOLTOFT-JENSEN J, KNUDSEN J C, et al. Reduction of salt in pork sausages by the addition of carrot fibre or potato starch and high pressure treatment[J]. Meat Science, 2012, 92(4): 481-489.DOI:10.1016/j.meatsci.2012.05.015.
[29] NGUYEN M V, ARASON S, THORARINSDOTTIR K A, et al.In fluence of salt concentration on the salting kinetics of cod loin (Gadus morhua) during brine salting[J]. Journal of Food Engineering, 2010,100(2): 225-231. DOI:10.1016/j.jfoodeng.2010.04.003.
[30] VILLAMONTE G, SIMONIN H, DURANTON F , et al. Functionality of pork meat proteins: impact of sodium chloride and phosphates under high-pressure processing[J]. Innovative Food Science & Emerging Technologies, 2013, 18(2): 15-23. DOI:10.1016/j.ifset.2012.12.001.
[31] JIANG Q Q, RU J, NAHO N, et al. Changes in protein properties and tissue histology of tuna meat as affected by salting and subsequent freezing[J]. Food Chemistry, 2018, 271: 550-560. DOI:10.1016/j.foodchem.2018.07.219.
[32] HOLOWNIA K, CHINNAN M, REYNOLDS A, et al. Evaluation of induced color changes in chicken breast meat during simulation of pink color defect[J]. Poultry Science, 2003, 82(6): 1049-1059.DOI:10.1093/ps/82.6.1049.
[33] FERNÁNDEZ P P, SANZ P D, MOLINA-GARCÍA A D, et al.Conventional freezing plus high pressure-low temperature treatment:physical properties, microbial quality and storage stability of beef meat[J]. Meat Science, 2007, 77(4): 616-625. DOI:10.1016/j.meatsci.2007.05.014.
[34] ROS-POLSKI V, KOUTCHMA T, HUE J, et al. Effects of high hydrostatic pressure processing parameters and NaCl concentration on the physical properties, texture and quality of white chicken meat[J].Innovative Food Science & Emerging Technologies, 2015, 30(6):31-42. DOI:10.1016/j.ifset.2015.04.003.
[35] AHN D U, MAURER A J. Effects of added nitrite, sodium chloride,and phosphate on color, nitrosoheme pigment, total pigment, and residual nitrite in oven-roasted turkey breast[J]. Poultry Science, 1989,68(1): 100-106. DOI:10.3382/ps.0680100.
[36] MABROUK A F, DUGAN L R. A kinetic study of the autoxidation of methyl linoleate and linoleic acid emulsions in the presence of sodium chloride[J]. Journal of the American Oil Chemists' Society, 1960,37(10): 486-490. DOI:10.1007/BF02630511.
[37] YULIANA M, TRUONG T C, HUYNH L H, et al. Isolation and characterization of protein isolated from defatted cashew nut shell:in fluence of pH and NaCl on solubility and functional properties[J].LWT-Food Science and Technology, 2015, 55(2): 621-626.DOI:10.1016/j.lwt.2013.10.022.
[38] ZIDANI S, FAHLOUL D, BACHA A. Effects of pH, NaCl, ethanol,and drying methods on the solubility of Saccharomyces cerevisiae proteins[J]. CYTA-Journal of Food, 2012, 10(1): 42-47. DOI:10.1080/19476337.2010.543472.
[39] CHEN L, LI C, ULLAH N, et al. Different physicochemical, structural and digestibility characteristics of myo fibrillar protein from PSE and normal pork before and after oxidation[J]. Meat Science, 2016, 121:228-237. DOI:10.1016/j.meatsci.2016.06.010.
[40] FENG X C, LI C Y, ULLAH N, et al. Potential biomarker of myo fibrillar protein oxidation in raw and cooked ham: 3-nitrotyrosine formed by nitrosation[J]. Journal of Agricultural and Food Chemistry,2015, 63(51): 10957-10964. DOI:10.1021/acs.jafc.5b04107.
[41] 袁凯, 张龙, 谷东陈, 等. 肉品中的蛋白质氧化机制及其影响因素[J].食品科学, 2018, 39(5): 329-335. DOI:10.7506/spkx1002-6630-201805048.
[42] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition & Food Research,2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[43] FENG X C, CHEN L, LEI N, et al. Emulsifying properties of oxidatively stressed myo fibrillar protein emulsion gels prepared with(-)-epigallocatechin-3-gallate and NaCl[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2816-2826. DOI:10.1021/acs.jafc.6b05517.
[44] JIA N, WANG L, SHAO J H, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J]. Meat Science, 2017, 127: 45-50. DOI:10.1016/j.meatsci.2017.01.004.
[45] ZHOU F B, SUN W Z, ZHAO M M. Controlled formation of emulsion gels stabilized by salted myo fibrillar protein under malondialdehyde(MDA)-induced oxidative stress[J]. Journal of Agricultural and Food Chemistry, 2015, 63(14): 3677-3777. DOI:10.1021/jf505916f.
[46] SOLADOYE O P, JUÁREZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2): 106-122. DOI:10.1111/1541-4337.12127.
[47] BENJAKUL S, SEYMOUR T A, MORRISSEY M T, et al.Physicochemical changes in pacific whiting muscle proteins during iced storage[J]. Journal of Food Science, 1997, 62(4): 729-733.DOI:10.1111/j.1365-2621.1997.tb15445.x.