植物多酚是植物中具有多个酚羟基结构的化合物的总称,通常分为可溶性多酚与不可溶性-结合态多酚,其中可溶性多酚易于用有机溶剂直接提取,结合态多酚类通常与植物细胞壁中的纤维素、蛋白质、木质素、糖基、有机酸结合成共价复合物而难以提取[1-4]。
近年来,微生物固态发酵技术逐渐应用于植物酚类物质提取研究中,通过微生物发酵产生的复合酶系(纤维素水解酶、木质素水解酶和果胶水解酶等)的水解作用,破坏细胞壁纤维成分的致密结构或者切除多酚物质与其他物质之间交联的共价键,从而促进酚类物质的释放和转化,进而影响其生物活性的变化[5]。有学者利用黑曲霉和少孢根霉固态发酵果汁加工后副产品果渣,发酵后果渣中多酚、黄酮的含量有较大增加,自由基清除活性显著上升[6-7]。Bei Qi等[8]研究表明,燕麦经红曲固态发酵后,游离型和共轭型酚类物质的含量显著增加,并且有效提升了燕麦的生物活性。Saharan等[9]利用真菌对5 种谷物原料进行固态发酵,发酵后谷物酚类物质含量的增加与发酵过程中的木聚糖酶和β-葡萄糖苷酶酶活性呈显著相关;Wang Lu等[10-11]研究发现,使用混合真菌发酵番石榴叶后其总酚和槲皮素含量比发酵前增加了2.06 倍和3.02 倍,发酵过程中产生的总纤维素酶活力、木聚糖酶活力与α-淀粉酶活力相对较高,能有效切除番石榴多酚与细胞壁上纤维素、半纤维素、多糖组分之间的化学键,释放出更多的可溶性多酚。
甘蔗叶是甘蔗制糖产业中主要的副产品,产量非常大。研究表明,甘蔗叶中含有一定量的酚类物质,主要是黄酮[12-14]、酚酸类[15-16],在不同甘蔗品种(系)叶片中含量差异较大[17],大致在0.5%~2%范围内[17],具有抗氧化[18]、抗突变[19]、抗炎[20]、降血糖[21]等生理功能。但甘蔗叶中大部分酚酸都以结合态的形式存在[22],为更有效提取甘蔗叶中的酚类物质,本研究利用黑曲霉对甘蔗叶进行固态发酵,探讨发酵过程对甘蔗叶中多酚、黄酮的释放及抗氧化性能的影响,旨在为甘蔗叶的深度开发利用提供理论支持。
1 材料与方法
1.1 材料与试剂
甘蔗叶,采摘自广西大学农学院试验田,取甘蔗茎顶上嫩节及青绿色叶片,自然干燥后粉碎过20 目筛;黑曲霉GXU003,广西大学生命科学与技术学院实验室分离保藏;斜面培养基:马铃薯葡萄糖琼脂培养基;种子培养基:马铃薯200 g/L,葡萄糖20 g/L,自然pH值,水1 000 mL。
福林-酚(分析纯) 北京普博欣生物科技有限责任公司;芦丁标准品(分析纯) 生工生物工程(上海)有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、对硝基苯酚(p-nitrophenol,p-NP)、对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenylβ-D-glucopyranoside,p-NPG)(均为分析纯) 美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
超声波破碎仪 美国SONIC & MATERKALS公司;3-18K高速冷冻离心机 德国Sigma公司;全自动酶标仪Elx80 美国BioTek Instruments公司;UVmini-1240紫外分光光度计 岛津企业管理(中国)有限公司。
1.3 方法
1.3.1 黑曲霉种子液的制备
取马铃薯葡萄糖琼脂培养基上培养的黑曲霉斜面2 支,在无菌条件下,各用5 mL无菌水洗下孢子液,将黑曲霉菌悬液全部接种到50 mL的种子培养液中,在30 ℃、180 r/min条件下培养8 h。
1.3.2 甘蔗叶培养基制备
称取3.5 g甘蔗叶于250 mL的三角瓶中,加入1 g麸皮及1 g豆粕,调节培养基含水量,于121 ℃灭菌20 min,冷却后备用。
1.3.3 甘蔗叶固态发酵单因素试验
接种量的选择:分别以7、14、21、28、35 mL/100 g的接种量将黑曲霉种子液接入甘蔗叶固态发酵培养基,培养基含水量为60%,30 ℃培养3 d。每天手动摇瓶2 次,发酵结束后,产品置于60 ℃的烘箱中烘干,保存于干燥器中。以未接菌的甘蔗叶培养基为对照组。
培养基含水量的选择:控制培养基的初始含水量分别为40%、50%、60%、70%,按28 mL/100 g接种量将黑曲霉种子接入不同含水量培养基中,30 ℃培养3 d。
发酵时间的选择:以28 mL/100 g的接种量接入黑曲霉,控制培养基的初始含水量60%,在30 ℃恒温培养箱中培养2、3、4、5、6 d。
1.3.4 甘蔗叶固态发酵正交试验设计
以发酵基质中黄酮和多酚含量为综合指标,选取接种量、培养基含水量和发酵时间,进行L9(34)3因素3水平正交试验,试验设计与结果见表1。
表1 L9(334)正交试验因素与水平
Table 1 Coded levels for independent variables used in orthogonal array desiiggnn

水平 因素A接种量/(mL/100 g) B含水量/% C发酵时间/d 1 21 40 3 2 28 50 4 3 35 60 5
1.3.5 甘蔗叶发酵产物中多酚、黄酮含量测定
1.3.5.1 活性成分的提取
取一定量的发酵和未发酵产品,以料液比1∶20(g/mL)加入60%乙醇溶液,在功率为300 W条件下超声提取35 min,超声结束后抽滤,收集滤液进行黄酮和多酚含量测定。
1.3.5.2 多酚含量测定
按照GB/T 8313—2008《茶叶中茶多酚和儿茶素类含量的检测方法》进行测定。根据没食子酸标准曲线回归方程y=11.425x+0.024 9(R2=0.999 8),计算样品中多酚含量。总酚含量表示为没食子酸干基当量(mg/g)。
1.3.5.3 黄酮含量测定
使用硝酸铝络合分光光度法测定总黄酮含量[23]。按照芦丁标准曲线回归方程计算样品中总黄酮含量,具体为:y=11.831x-0.038 4(R2=0.999 6)。黄酮含量表示为芦丁干基当量(mg/g)。
1.3.6 发酵过程中酶活力测定
1.3.6.1 粗酶液的提取
取一定量的研磨后的发酵产物,按料水比1∶10(g/mL)加入蒸馏水,置于120 r/min、40 ℃恒温摇床1 h,随后4 ℃、8 000 r/min离心10 min取上清液,即为粗酶液。
1.3.6.2 纤维素酶(羧甲基纤维素酶)活力测定
参照郝建宇等[24]的方法,略作修改。在20 mL刻度试管中加入粗酶液0.5 mL和羧甲基纤维素钠悬浮液(0.05 mol/L柠檬酸缓冲液配制)1 mL,50 ℃水浴30 min后,立即加入3 mL 3,5-二硝基水杨酸试剂,沸水浴5 min。冷却后定容到20 mL,于540 nm波长处测定吸光度。根据葡萄糖标准方程计算葡萄糖质量(以加入灭活0.5 mL粗酶液为空白对照)。1 g发酵基质(干质量),在酶最适反应条件下,每小时分解纤维素产生1 μmol葡萄糖所需的酶量定义为1 个酶活力单位,用U/g表示。
1.3.6.3 β-葡萄糖苷酶活力测定
取160 μL的缓冲液和20 μL 20 mmol/L的p-NPG溶液混匀后,30 ℃预热2 min,加入20 μL的粗酶液,反应20 min,加入50 μL 2 mol/L Na2CO3溶液终止酶反应,测定OD405 nm。采用p-NP为标准品绘制标准曲线(以加入20 μL已失活的酶液作为空白对照)。1 g发酵基质(干质量),在酶最适反应条件下,每小时水解p-NPG释放1 μmol p-NP所需的酶量定义为1 个酶活力单位,用U/g表示。1.3.7 羟自由基清除率测定
参照郭丽等[25]的方法,略作修改。试管中依次加入0.75 mmol/L邻二氮菲-无水乙醇溶液1 mL、0.2 mol/L pH 7.40的磷酸缓冲液2 mL和去离子水1 mL,摇匀后加入0.75 mmol/L硫酸亚铁溶液1 mL,混匀后加入0.01%双氧水溶液1 mL,37 ℃恒温水浴60 min,536 nm波长下测定反应体系吸光度AP。1 mL去离子水代替1 mL 0.01%双氧水溶液,其他操作方法同上,测定其吸光度AB。加入一定浓度样液1 mL,代替1 mL去离子水,其他操作方法同上,测定其吸光度AS。羟自由基清除率计算如式(1)所示:
1.3.8 DPPH自由基清除测定
参照陈树俊等[26]的方法,略作修改。取一定浓度的发酵产物待测样液2 mL,加入0.3 mmol/L DPPH-乙醇溶液2 mL,摇匀后避光放置30 min,517 nm波长处测定吸光度。DPPH自由基清除率计算如式(2)所示:
式中:A为DPPH溶液吸光度;As为DPPH混合样液的吸光度;Ar为样液+60%乙醇溶液的吸光度。
1.4 数据处理
数据表示为 ,结果利用单因素方差分析进行显著性分析,P<0.05,差异显著。
,结果利用单因素方差分析进行显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 接种量对发酵甘蔗叶多酚、黄酮含量的影响
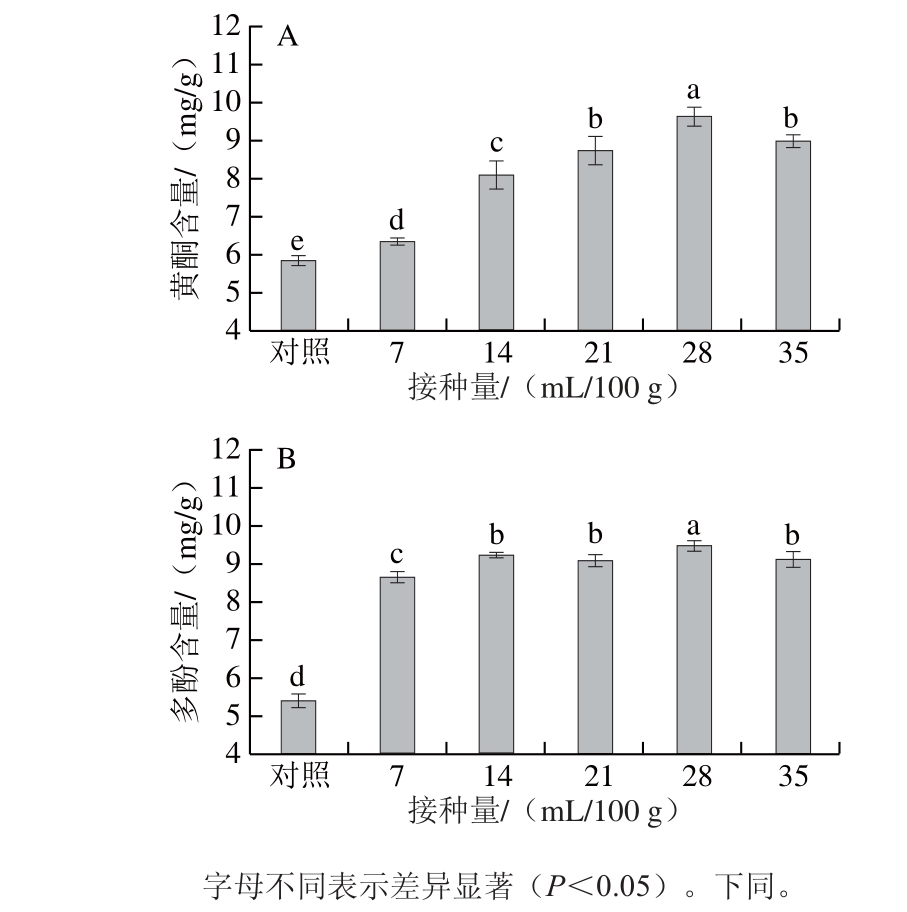
图1 接种量对黄酮(A)和多酚(B)含量的影响
Fig. 1 Effect of inoculum volume on the release of flavonoids (A) and polyphenols (B)
从图1可以看出,经不同接种量的黑曲霉发酵处理3 d后,发酵甘蔗叶中黄酮和多酚的释放量均显著高于对照组(P<0.05)。在接种量为7~28 mL/100 g的范围内,黄酮和多酚含量随接种量的增加而提高,当接种量为28 mL/100 g时黄酮和多酚释放量均达到最高,分别为9.65 mg/g和9.47 mg/g,而接种量增加至35 mL/100 g时,黄酮和多酚的释放量反而有所下降。原因可能是当接种量过大时,培养基中营养物质不能满足菌体生长需要,一些酚类化合物被微生物当作碳源利用[27]。
2.1.2 培养基含水量对发酵甘蔗叶多酚、黄酮含量的影响

图2 培养基含水量对黄酮(A)和多酚(B)含量的影响
Fig. 2 Effect of initial water content of culture medium on the release of flavonoids (A) and polyphenols (B)
由图2可知,当培养基含水量为40%时,由于基质中的自由水不足以维持黑曲霉菌体生长所需,进而影响细胞代谢,导致黄酮、多酚的释放量较低;而含水量达到70%时,培养基出现结块,传质困难,也影响了发酵效果。当含水量为50%时黄酮释放效果最好,达到9.90 mg/g,含水量为60%时多酚含量达到最大,为10.35 mg/g。
2.1.3 发酵时间对发酵甘蔗叶多酚、黄酮含量的影响
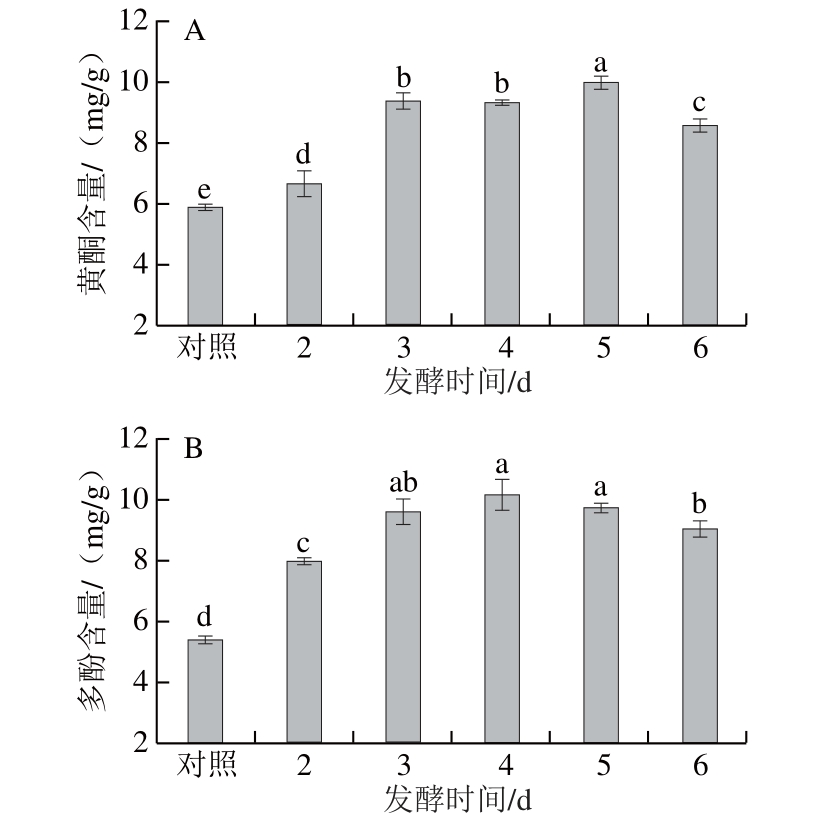
图3 发酵时间对黄酮(A)和多酚(B)含量的影响
Fig. 3 Effect of fermentation time on the release of flavonoids (A) and polyphenols (B)
从图3可以看出,与对照组相比,甘蔗叶经过黑曲霉发酵处理的2~6 d内,黄酮和多酚含量逐渐增高,且均比未发酵对照组有显著提高(P<0.05),这是因为固态发酵过程中黑曲霉代谢产生的复合水解酶系的作用,改变了甘蔗叶纤维的致密结构,促进了黄酮和多酚的释放。其中在第3~5天酚类物质均保持较高含量,变化幅度不大,但第6天后,黄酮和多酚含量则显著下降(P<0.05),这可能与在发酵后期产生的水解酶系的活力下降有关,也可能与一些酚类化合物在发酵后期被真菌菌株代谢产生的氧化酶催化氧化成了酚类物质聚合物[28],或者与酚类化合物被微生物利用有关[27]。Saharan[9]、Wang Lu[10]、Lin Sen[29]等的相关研究也均发现发酵后基质中多酚与黄酮含量在发酵初期增加明显,发酵成熟期含量保持基本不变,随后减少的现象。
2.2 正交试验优化发酵条件
在单因素试验基础上,选择接种量、培养基含水量、发酵时间为正交试验因素,每个因素3 个水平,正交试验设计按L9(34)正交表进行。试验设计及结果见表2。
表2 正交试验设计及结果
Table 2 Orthogonal array design with experiment results
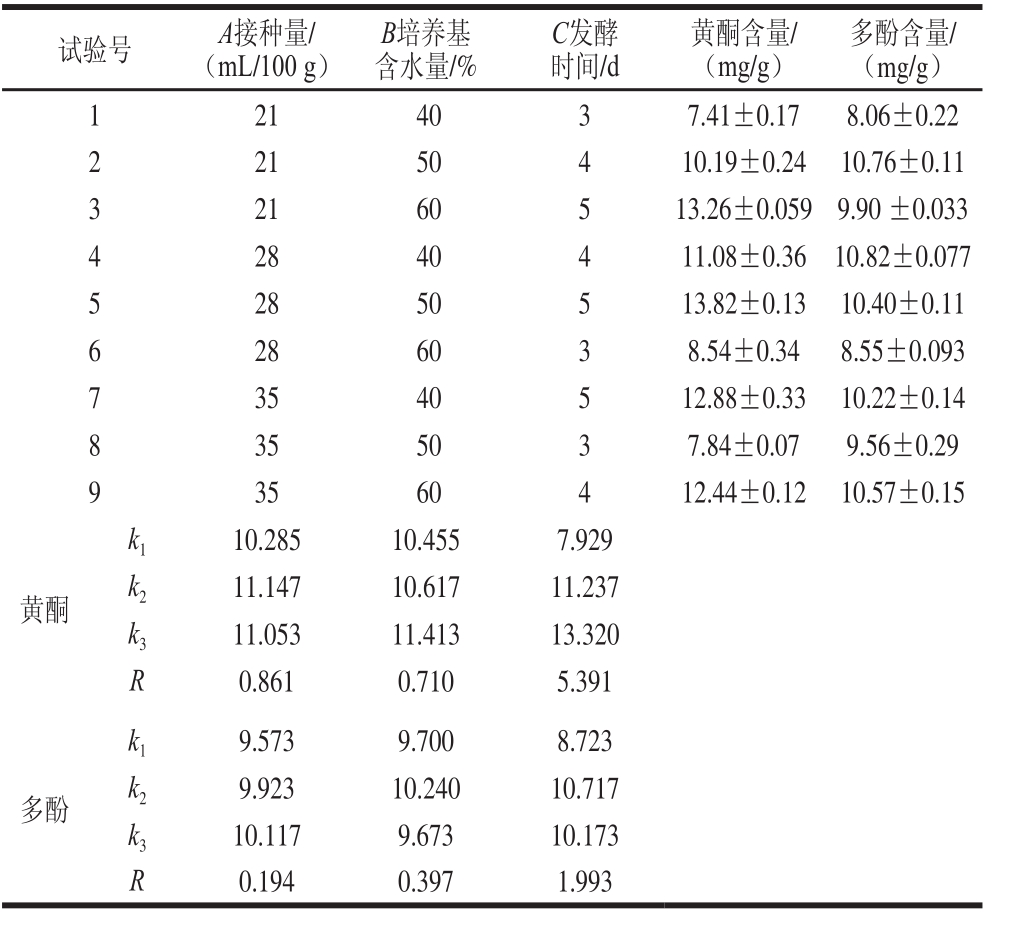
试验号 A接种量/(mL/100 g)黄酮含量/(mg/g)B培养基含水量/%C发酵时间/d多酚含量/(mg/g)1 21 40 3 7.41±0.17 8.06±0.22 2 21 50 4 10.19±0.24 10.76±0.11 3 21 60 5 13.26±0.059 9.90 ±0.033 4 28 40 4 11.08±0.36 10.82±0.077 5 28 50 5 13.82±0.13 10.40±0.11 6 28 60 3 8.54±0.34 8.55±0.093 7 35 40 5 12.88±0.33 10.22±0.14 8 35 50 3 7.84±0.07 9.56±0.29 9 35 60 4 12.44±0.12 10.57±0.15黄酮k1 10.285 10.455 7.929 k2 11.147 10.617 11.237 k3 11.053 11.413 13.320 R 0.861 0.710 5.391多酚k1 9.573 9.700 8.723 k2 9.923 10.240 10.717 k3 10.117 9.673 10.173 R 0.194 0.397 1.993
表3 正交试验方差分析
Table 3 Analysis of variance for the experimental results of orthogonal array design

因素 偏差平方和 自由度 F值 F0.05(2,2)黄酮 多酚 黄酮 多酚A接种量 1.35 0.455 2 1.81 1.73 B培养基含水量 1.58 0.613 2 2.12 2.32 19 C发酵时间 44.38 6.371 2 59.46 24.14误差 0.746 0.264 2总和 48.06 7.703 8
表3方差分析可知,发酵时间在各个水平上有显著差异,但培养基含水量和接种量的水平差异不显著。以黄酮含量为指标,优化后的发酵最佳工艺为接种量28 mL/100 g、培养基含水量60%、发酵时间5 d;以多酚含量为指标,最佳条件为接种量35 mL/100 g、培养基含水量50%、发酵时间4 d。
根据3 个因素的极差大小以及表3方差分析的显著性差异情况,综合考虑,选择接种量28 mL/100 g、培养基含水量50%、发酵时间5 d,测得发酵甘蔗叶中黄酮含量为13.82 mg/g,多酚含量为10.40 mg/g,比未发酵甘蔗叶中可溶性黄酮和多酚含量分别提高了135%和92%(P<0.05)。
2.3 甘蔗叶发酵过程中相关水解酶活力的变化与酚类物质释放的关系
2.3.1 发酵过程中水解酶活力的变化
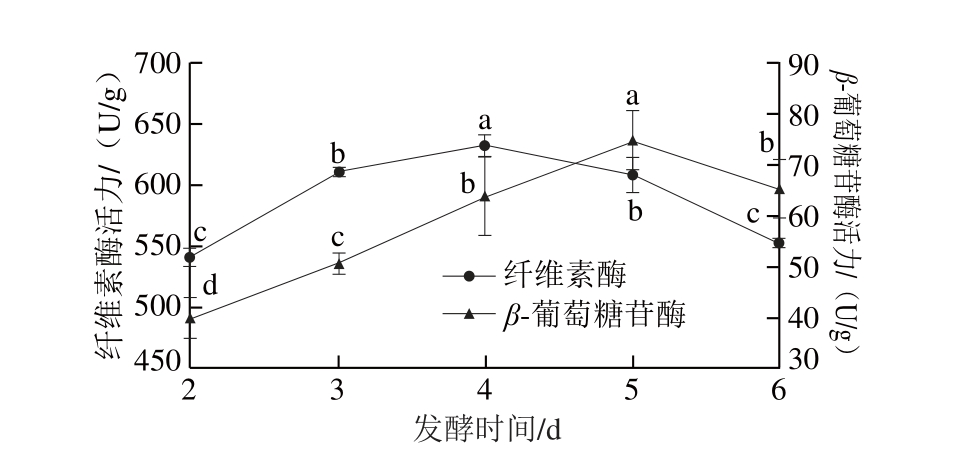
图4 发酵过程中水解酶活力变化
Fig. 4 Changes in the activity of hydrolytic enzymes during fermentation
为阐明甘蔗叶发酵过程中,黑曲霉产生的 相关碳水化合物水解酶与甘蔗叶多酚、黄酮释放的关系,对发酵过程中产生的纤维素酶活力和β-葡萄糖苷酶活力进行了跟踪测定,结果如图4所示。黑曲霉固态发酵过程中能够产生一定量的纤维素酶和β-葡萄糖苷酶,而且纤维素酶活力明显比β-葡萄糖苷酶活力高,2 种水解酶活力均呈现先增加后降低的变化趋势。纤维素酶活力在发酵第4天达到最大值,为632.17 U/g,β-葡萄糖苷酶活力在发酵第5天时达到了顶峰,为75.02 U/g,随后活力显著下降。与图3进行比较可知,发酵过程中产生的水解酶系与酚类物质释放的变化趋势基本保持一致,均是在发酵第4~5天,产量达到最大,进一步说明甘蔗叶酚类物质的释放与微生物发酵过程中产生的水解酶系有密切的关系。
2.3.2 酚类物质释放量与酶活力变化的相关性分析
为进一步探究黑曲霉发酵甘蔗叶的过程中酚类物质含量与纤维素酶和β-葡萄糖苷酶活力的关系,分别以黑曲霉发酵后甘蔗叶多酚和黄酮含量为横坐标,以两种酶活力为纵坐标,检验酚类物质的释放量与酶活力变化的相关性。
从图5可知,酚类物质的释放量与纤维素酶和β-葡萄糖苷酶活力呈显著正相关。其中多酚和黄酮含量与纤维素酶活力的相关系数R2分别为0.856 3和0.678 9,与β-葡萄糖苷酶活力的相关系数R2分别为0.510 0和0.622 6,说明酶活力越强,越有利于甘蔗叶中酚类物质的释放。分析原因,首先纤维素酶破坏甘蔗叶细胞壁纤维素的致密结构,有助于暴露出酚类物质与其他物质之间结合的化学键,然后纤维素酶、β-葡萄糖苷酶等水解酶系断裂结合态多酚与植物纤维素、半纤维素、木质素以及一些多糖结构连接的共价键,释放出甘蔗叶中结合态酚类物质,从而使可溶性酚类物质含量增加。

图5 酚类物质含量与纤维素酶、β-葡萄糖苷酶活力的相关性
Fig. 5 Correlations between the amount of released phenolics and cellulase and β-glucosidase activity
2.4 抗氧化能力
从图6可知,在一定质量浓度范围内,甘蔗叶提取液中黄酮与羟自由基清除率有良好的量效关系,清除率随黄酮质量浓度的增大而上升。发酵甘蔗叶提取液黄酮质量浓度在200 μg/mL和400 μg/mL时,羟自由基清除率分别为29.61%和91.73%,其IC50值为268.93 μg/mL;而未发酵甘蔗叶黄酮质量浓度在270 μg/mL和450 μg/mL时,羟自由基清除率仅为18.18%和82.78%,IC50值为366.06 μg/mL,说明经过黑曲霉发酵后的甘蔗叶提取液具有较强的羟自由基清除能力,但低于对照组VC(IC50=158.34 μg/mL)。
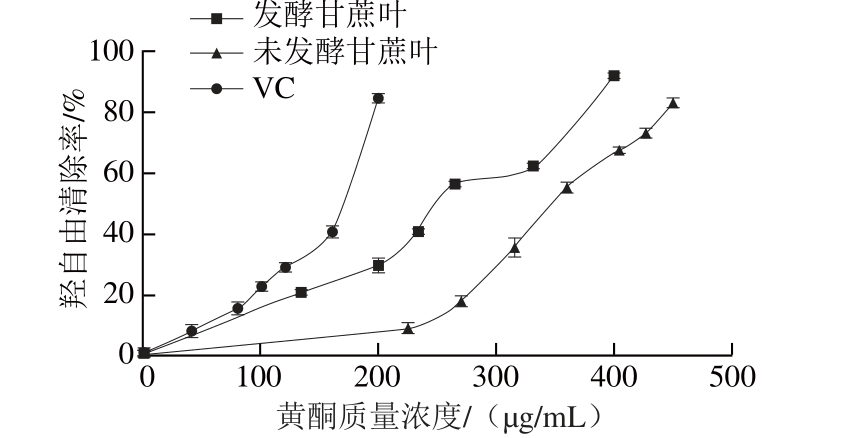
图6 发酵甘蔗叶黄酮质量浓度对羟自由基的清除效果
Fig. 6 Scavenging effect of flavonoids from fermented sugarcane leaves on hydroxyl radicals

图7 发酵甘蔗叶黄酮质量浓度对DPPH自由基的清除效果
Fig. 7 Scavenging effect of flavonoids from fermented sugarcane leaves on DPPH radical
图7 显示,发酵甘蔗叶提取液中黄酮对DPPH自由基清除能力(IC50=21.25 μg/mL)和对照组VC的清除能力差别不大(IC50=20.13 μg/mL),而且明显强于未发酵甘蔗叶(IC50=39.44 μg/mL),在黄酮质量浓度为40 μg/mL时,发酵甘蔗叶的DPPH自由基清除率达到了79.18%,而未发酵甘蔗叶在黄酮质量浓度为45 μg/mL时,清除率仅为54.01%。
酚类物质抗氧化能力取决于酚类化合物的化学结构、芳香环上的羟基数目、羟基位置以及羟基结构糖基化[30]。已有研究表明,甘蔗叶组织中游离态酚酸对DPPH自由基清除活性优于结合态酚酸[22]。通过微生物发酵过程中产生的复合酶系的水解作用,甘蔗叶中的酚类物质与其他物质(糖类、蛋白质、有机酸)之间的共价作用或非共价作用解除,使甘蔗叶中的酚酸,如没食子酸、阿魏酸、咖啡酸、绿原酸、香草酸向游离态转化,增加了可提取和可利用酚类物质的含量,而这些酚酸已被证实为具有高抗氧化能力[8,31-33]。此外,通过β-葡萄糖苷酶的水解作用,黄酮糖苷分子去糖基化降解为黄酮苷元,研究已证实黄酮苷元清除人体氧自由基的生物活性明显优于黄酮糖苷[34]。
3 结 论
利用黑曲霉对甘蔗叶进行固态发酵,经60%乙醇溶液提取后,提取液中多酚含量和黄酮含量均比未发酵甘蔗叶样品显著上升。在接种量28 mL/100 g、培养基含水量50%、发酵时间5 d条件下,甘蔗叶中黄酮和多酚含量分别为13.82 mg/g和10.40 mg/g,比未发酵甘蔗叶中可溶性黄酮和多酚含量提高了135%和92%(P<0.05)。
测定发酵过程中微生物代谢产生的纤维素酶活力和β-葡萄糖苷酶活力的变化,发现这2 种水解酶活力均呈现先增加后降低的变化趋势,而且酶活力的变化趋势与酚类物质(黄酮、多酚)含量的变化趋势基本一致;通过相关性分析可知,发酵过程中酚类物质的释放量与纤维素酶和β-葡萄糖苷酶活力呈良好正相关,说明甘蔗叶酚类物质的释放与微生物发酵过程中产生的水解酶系有密切关系。
发酵前后的甘蔗叶黄酮提取液均对自由基具有一定的清除能力,但发酵后甘蔗叶黄酮提取液对DPPH自由基和羟自由基清除能力均比发酵前有明显提高。
[1] NACZK M, SHAHIDI F. Phenolics in cereals, fruits and vegetables:occurrence, extraction and analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(5): 1523-1542. DOI:10.1016/j.jpba.2006.04.002.
[2] PINELO M, ARNOUS A, MEYER A S. Upgrading of grape skins:significance of plant cell-wall structural components and extraction techniques for phenol release[J]. Trends in Food Science &Technology, 2006, 17(11): 579-590. DOI:10.1016/j.tifs.2006.05.003.
[3] MADHUJITH T, SHAHIDI F. Antioxidant potential of barley as affected by alkaline hydrolysis and release of insoluble-bound phenolics[J]. Food Chemistry, 2009, 117(4): 615-620. DOI:10.1016/j.foodchem.2009.04.055.
[4] DEY T B, CHAKRABORTY S, JAIN K K, et al. Antioxidant phenolics and their microbial production by submerged and solid state fermentation process: a review[J]. Trends in Food Science &Technology, 2016, 53: 60-74. DOI:10.1016/j.tifs.2016.04.007.
[5] AJILA C M, GASSARA F, BRAR S K, et al. Polyphenolic antioxidant mobilization in apple pomace by different methods of solid-state fermentation and evaluation of its antioxidant activity[J]. Food and Bioprocess Technology, 2012, 5(7): 2697-2707. DOI:10.1007/s11947-011-0582-y.
[6] DULF F V, VODNAR D C, SOCACIU C. Effects of solid-state fermentation with two filamentous fungi on the total phenolic contents,flavonoids, antioxidant activities and lipid fractions of plum fruit(Prunus domestica L.) by-products[J]. Food Chemistry, 2016, 209: 27-36. DOI:10.1016/j.foodchem.2016.04.016.
[7] DULF F V, VODNAR D C, DULF E H, et al. Total phenolic contents,antioxidant activities, and lipid fractions from berry pomaces obtained by solid-state fermentation of two Sambucus species with Aspergillus niger[J]. Journal of Agricultural and Food Chemistry, 2015, 63(13):3489-3500. DOI:10.1021/acs.jafc.5b00520.
[8] BEI Q, LIU Y, WANG L, et al. Improving free, conjugated, and bound phenolic fractions in fermented oats (Avena sativa L.) with Monascus anka and their antioxidant activity[J]. Journal of Functional Foods,2017, 32: 185-194. DOI:10.1016/j.jff.2017.02.028.
[9] SAHARAN P, SADH P K, DUHAN J S. Comparative assessment of fermentation on phenolics, flavanoids and free radical scavenging activity of commonly used cereals[J]. Biocatalysis and Agricultural Biotechnology, 2017, 12: 236-240. DOI:10.1016/j.bcab.2017.10.013.
[10] WANG L, WEI W H, TIAN X F, et al. Improving bioactivities of polyphenol extracts from Psidium guajava L. leaves through cofermentation of Monascus anka GIM 3.592 and Saccharomyces cerevisiae GIM 2.139[J]. Industrial Crops and Products, 2016, 94:206-215. DOI:10.1016/j.indcrop.2016.08.043.
[11] WANG L, WU Y N, LIU Y, et al. Complex enzyme assisted extraction releases antioxidative phenolic compositions from guava leaves[J]. Molecule, 2017, 22(10): 1648-1663. DOI:10.3390/molecules22101648.
[12] 阎欲晓, 黄玥. 甘蔗叶黄酮分离纯化工艺及生理活性研究[J]. 食品工业科技, 2011, 32(3): 149-152. DOI:10.13386/j.issn1002-0306.2011.03.034.
[13] 侯小涛, 马丽娜, 邓家刚, 等. 甘蔗叶总黄酮提取工艺及抗炎活性的研究[J]. 中成药, 2013, 35(9): 2047-2050. DOI:10.3969/j.issn.1001-1528.2013.09.055.
[14] 周宁, 赵晓路, 屈潇毅, 等. 超声辅助提取甘蔗叶总黄酮与还原力的测定[J]. 应用化工, 2016, 45(10): 1883-1886. DOI:10.16581/j.cnki.issn1671-3206.20160705.033.
[15] 阎欲晓, 吴国燕, 杨龙, 等. 甘蔗叶多酚物质的超声提取及生理活性研究[J]. 食品研究与开发, 2012, 33(4): 63-66. DOI:10.3969/j.issn.1005-6521.2012.04.017.
[16] 唐云仙, 杨丽涛, 杨柳, 等. 甘蔗多酚类物质研究进展[J]. 中国糖料,2015, 37(3): 62-64. DOI:10.13570/j.cnki.scc.2015.03.023.
[17] 石景雨, 何丽莲, 王先宏, 等. 不同甘蔗品种叶片中总黄酮含量与提取工艺的优化研究[J]. 作物杂志 , 2016(5): 19-24. DOI:10.16035/j.issn.1001-7283.2016.05.004.
[18] ABBAS S R, SABIR S M, AHMAD S D, et al. Phenolic profile,antioxidant potential and DNA damage protecting activity of sugarcane(Saccharum officinarum)[J]. Food Chemistry, 2014, 147: 10-16.DOI:10.1016/j.foodchem.2013.09.113.
[19] LEE CP, CHEN Z T, YU P Y, et al. Comparison of protective effects of three varieties of sugarcane leaves on oxidative stress in Clone 9 cells[J].Journal of Function Foods, 2013, 5(2): 878-887. DOI:10.1016/j.jff.2013.01.037.
[20] WANG B S, DUH P D, WU S C, et al. Effects of the aqueous extract of sugarcane leaves on antimutation and nitricoxide generation[J]. Food Chemistry, 2011, 124: 495-500. DOI:10.1016/j.foodchem.2010.06.060.
[21] 郝二伟, 何耀涛, 侯小涛, 等. 甘蔗叶提取物对链脲佐菌素诱导1型糖尿病大鼠降血糖作用机制初探[J]. 中药药理与临床, 2018, 34(6):112-116. DOI:10.13412/j.c nki.zyyl.2018.06.027.
[22] 扶雄, 周惠芳, 李超, 等. 甘蔗不同组织中游离态和结合态酚酸的分布及抗氧化活性[J]. 现代食品科技, 2014, 30(11): 17-22.DOI:10.13982/j.mfst.1673-9078.2014.11.004.
[23] 白生文, 汤超, 田京, 等. 沙棘果渣总黄酮提取工艺及抗氧化活性分析[J]. 食品科学, 2015, 36(10): 59-64. DOI:10.7506/spkx1002-6630-201510012.
[24] 郝建宇, 侯红萍, 郑渊洁. 微生物混合对纤维素酶活的影响[J].山西农业大学学报(自然科学版), 2016, 36(7): 510-513; 518.DOI:10.13842/j.cnki.issn1671-8151.2016.07.011.
[25] 郭丽, 王鹏. 食用蕈菌固态发酵蓝莓果渣代谢产物及其抗氧化特性[J].食品科学, 2015, 36(7): 137-142. DOI:10.7506/spkx1002-6630-201507025.
[26] 陈树俊, 苏静, 刘诚, 等. 老陈醋生产过程中总多酚、总黄酮含量及清除自由基能力的分析[J]. 食品科学, 2009, 30(17): 158-162.DOI:10.3321/j.issn:1002-6630.2009.17.037.
[27] WANG J H, CAO F L, SU E Z, et al. Improving flavonoid extraction from ginkgo biloba leaves by prefermentation processing[J]. Journal of Agricultural and Food Chemistry, 2013, 61(24): 5783-5791.DOI:10.1021/jf400712n.
[28] VATTEM D A, LIN Y T, LABBE R G, et al. Phenolic antioxidant mobilization in cranberry pomace by solid-state bioprocessing using food grade fungus Lentinus edodes and effect on antimicrobial activity against select food borne pathogens[J]. Innovative Food Science & Emerging Technologies, 2004, 5(1): 81-91. DOI:10.1016/j.ifset.2003.09.002.
[29] LIN S, ZHU Q Q, WEN L R, et al. Production of quercetin,kaempferol and their glycosidic derivatives from the aqueousorganic extracted residue of litchi pericarp with Aspergillus awamori[J]. Food Chemistry, 2014, 145: 220-227. DOI:10.1016/j.foodchem.2013.08.048.[30] SÁNCHEZ-MORENO C, LARRAURI J A, SAURA-CALIXTO F.A procedure to measure the antiradical ef ficiency of polyphenols[J].Journal of the Science of Food and Agriculture, 1998, 76(2): 270-276. DOI:10.1002/(SICI)1097-0010(199802)76:2<270::AIDJSFA945>3.0.CO;2-9.
[31] 张华, 周志钦, 席万鹏, 等. 15 种柑橘果实主要酚类物质的体外抗氧化活性比较[J]. 食品科学, 2015, 36(11): 64-70. DOI:10.7506/spkx1002-6630-201511013.
[32] 何雪梅, 孙健, 李丽, 等. 蔗梢多酚类化合物抗氧化与抗肿瘤活性研究[J]. 食品工业科技, 2015, 36(23): 343-347. DOI:10.13386/j.issn1002-0306.2015.23.063.
[33] DULF F V, VODNAR D C, DULF E H, et al. Liberation and recovery of phenolic antioxidants and lipids in chokeberry (Aronia melanocarpa) pomace by solid-state bioprocessing using Aspergillus niger and Rhizopus oligosporus strains[J]. LWT-Food Science and Technology, 2018, 87: 241-249. DOI:10.1016/j.lwt.2017.08.084.
[34] HEIM K E, TAGLIAFERRO A R, BOBILYA D J. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships[J]. The Journal of Nutritional Biochemistry, 2002,13(10): 572-584. DOI:10.1016/S0955-2863(02)00208-5.