抗坏血酸即水溶性VC,是人体必需的营养物质,在各种生理和病理过程中起着不可或缺的作用。由于其特殊的理化特性,被广泛应用于各种食品相关行业[1-4]。因此,建立一种简便、可靠、快速和高选择性的检测和定量抗坏血酸的方法十分必要。近年来,人们提出了许多检测抗坏血酸的方法,如比色法、色谱法、光谱法和电化学传感器等[5-7]。其中,电化学传感检测法因其具有灵敏度高、操作简单、响应速度快和检出限低等优点不断进入人们的视野。电化学酶生物传感器将酶与底物相互作用和电化学分析功能相结合,是目前最常用的生物传感平台,但其同时也存在稳定性差、信号较弱、酶促反应时间较长和基底效应等缺陷。与此相比,引入纳米模拟酶与电化学分析相结合的方法具有高稳定性、高灵敏度、高选择性和低成本等优势[8-9]。
天然酶稳定性差且成本较高等诸多固有缺点限制了其应用[10-11]。无机纳米材料作为酶模拟材料,由于其稳定性好、成本低等优点而受到越来越多的关注,并在医药、农业、化学工业和食品加工等领域有着重要的应用[12-13]。Fe3O4纳米粒子作为一种功能材料,具有良好的过氧化物模拟酶的活性[14]。此外,Fe3O4纳米粒子还具有无毒和良好的生物相容性,因而被广泛应用于有害物质去除、光热反应、目标物质分离富集、生物传感分析和工业催化等领域[15-17]。金纳米粒子(AuNPs)被报道同样具有过氧化物模拟酶活性,且因其良好的生物相容性,易于合成和结合,已在生物传感[18]、生物成像[19]、医学诊断学和治疗学[20]中得到了成功的应用。同时,它是一种非常有效的保护磁性纳米粒子的涂层材料,在表面改性、高催化性能及其独特的生物化合物方面也具有广泛的用途[21-22]。
本实验采用自组装方法制备出金磁微粒(Fe3O4@Au),见图1。基于Fe3O4@Au模拟过氧化物酶活性,构建出一种针对抗坏血酸的高灵敏度无酶增强型电化学检测方法。Fe3O4@Au模拟过氧化物酶中的Fe3+和Au0可以分别催化H2O2反应产生具有氧化活性的自由基[7,23-24],可进一步催化抗坏血酸在电极表面失电子发生氧化还原反应,进而氧化为脱氢抗坏血酸。该氧化反应过程中电极表面会积累大量电子,增大电流响应,从而可以改善抗坏血酸电化学检测的灵敏度。这种将模拟酶与电化学相结合的检测方法无需修饰电极即可增强整体电化学信号的有效输出。该研究结果将为拓宽纳米材料模拟酶在不同食品电化学检测方法中的应用提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
六水氯化铁、乙酸钠、PEG-4000、抗坏血酸、过氧化氢 天津市科密欧化学试剂有限公司;3-氨丙基-3-乙氧基硅烷(3-aminopropyltriethoxysilane,APTES)淮安和元化工有限公司;HAuCl4 国药集团化学试剂有限公司;VC泡腾片(2.25 mg/g) 哈尔滨市人民同泰药店;本实验所用试剂均为分析纯。
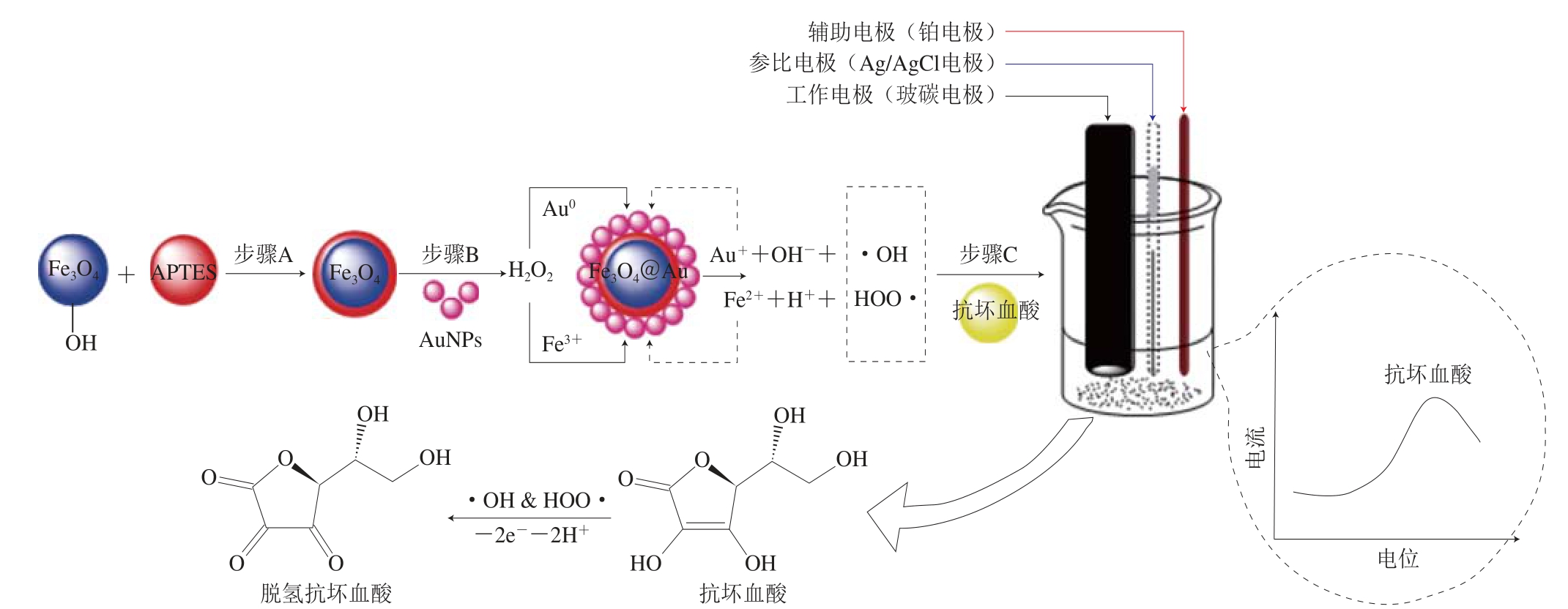
图1 基于FFee3O4@Au电化学检测抗坏血酸示意图
Fig. 1 Schematic illustration of the electrochemical detection of ascorbic acid based on the Fe3O4@Au
1.2 仪器与设备
CHI660E型电化学工作站 上海辰华仪器有限公司;85-2数显恒温磁力搅拌器 常州越新仪器制造有限公司;水热合成釜 西安洪辰仪器厂;DK-98-1电热恒温水浴锅天津泰斯特仪器有限公司;恒温振荡摇床 金坛市精工仪器设备有限公司;MAGNA-IR560E.S.P型傅里叶变换红外光谱仪 美国Nicolet公司;Phi-5000Versaprobe型X射线光电子能谱仪 美国ULVCA-PHI公司;JEM 2100型透射电子显微镜 日本电子株式会社;LDJ 9600型振动磁强计 美国LDJ Electronics公司。
1.3 方法
1.3.1 Fe3O4@Au的制备与表征
将4.2 g的NaAc·3H2O和1.2 g的PEG-4000依次加入到含有2.0 g FeCl3·6H2O的60 mL乙二醇溶液中,搅拌后使其形成均匀溶液。再将溶液倒入水热合成釜中,180 ℃反应10 h后冷却至室温,所得产物依次用乙醇和水洗涤后备用。
取80 g葡萄皮在200 mL 80 ℃的蒸馏水中浸泡20 min,将浸泡液于3 000 r/min离心5 min,取上清液作为母液。在使用去离子水稀释母液获得200 mL浓度为母液30%的葡萄皮工作液。将6 mL的葡萄皮工作液迅速加入到盛有25 mL HAuCl4溶液(4 ℃预冷)的烧杯中,在恒温磁力搅拌器的均匀搅拌下,观察溶液颜色变化,当溶液颜色出现酒红色时,加快搅拌速度,30 min后结束反应,将反应液置于4 ℃条件下保存。
取4 g制备的Fe3O4纳米微粒超声分散在60 mL 20%乙醇溶液中,逐滴加入2 mL APTES,将其置于150 r/min的恒温振荡摇床中充分振荡10 h后得到带有细小颗粒的浅棕色悬浊液,产物即为氨基化Fe3O4磁性纳米微粒。所得纳米微粒采用0.1 mol/L的HCl-乙醇溶液分离清洗3 次,烘干备用。取上述制备的氨基化改性的Fe3O4纳米微粒3 g于室温下边搅拌边加入30 mL所制备的AuNPs溶液,充分混合低速搅拌反应10 h后,分离烘干,获得Fe3O4@Au复合磁性纳米微粒。
1.3.2 Fe3O4@Au模拟酶活性验证
本实验采用循环伏安(cyclic voltammetry,CV)法评估Fe3O4@Au对抗坏血酸的电化学响应行为。所有电化学实验采用CHI660E型电化学工作站三电极系统完成,其中,玻碳电极(glassy carbon electrode,GCE)为工作电极,Ag/AgCl电极为参比电极,铂电极为辅助电极。
制备5 种不同的反应体系验证Fe3O4@Au在电化学体系中的过氧化物模拟酶活性:1)H2O2+抗坏血酸体系:向盛有10 mL HAc-NaAc缓冲液(pH 5)的小烧杯中加入200 μL的H2O2标准溶液(50 mmol/L),采用电热恒温水浴锅将反应体系加热至恒定20 ℃(加热过程中每隔1 min温和摇晃一次,下同),最后加入200 μL抗坏血酸标准溶液(10 mmol/L)。2)单独抗坏血酸体系:将盛有10 mL HAc-NaAc缓冲液(pH 5)的小烧杯加热至恒定20 ℃后加入200 μL抗坏血酸标准溶液(10 mmol/L)。3)H2O2+Fe3O4@Au体系:将0.01 g的纳米Fe3O4@Au粉末加入到盛有10 mL HAc-NaAc缓冲液(pH 5)的小烧杯中,将反应体系加热至恒定20 ℃后加入200 μL H2O2标准溶液(50 mmol/L)。4)抗坏血酸+Fe3O4@Au体系:将0.01 g的纳米Fe3O4@Au粉末加入到盛有10 mL HAc-NaAc缓冲液(pH 5)的小烧杯中,将反应体系加热至恒定20 ℃后加入200 μL抗坏血酸标准溶液(10 mmol/L)。5)H2O2+抗坏血酸+Fe3O4@Au体系:将0.01 g的纳米Fe3O4@Au粉末加入到盛有10 mL HAc-NaAc缓冲液(pH 5)的小烧杯中,再加入200 μL H2O2标准溶液(50 mmol/L),混匀后,将反应体系加热至恒定20 ℃充分反应15 min后,加入200 μL抗坏血酸标准溶液(10 mmol/L)。调节电化学工作站扫描速率为100 mV/s。利用CV法监测1)~5)氧化峰电流并取其绝对值,将其作为体系指标,指标越大越好,重复实验3 次。
1.3.3 单因素试验优化抗坏血酸电化学检测体系
将不同质量的纳米Fe3O4@Au粉末(0.002 5、0.005、0.007 5、0.01 g和0.012 5 g)分别加入到盛有不同pH值(pH 4、5、6、7、8和9)10 mL HAc-NaAc缓冲液的烧杯中,再加入200 μL H2O2标准溶液(50 mmol/L),混匀后,采用电热恒温水浴锅将反应体系加热至不同恒定温度(20、30、40、50 ℃和60 ℃)充分反应15 min后(加热过程中每隔1 min温和摇晃一次),加入200 μL抗坏血酸标准溶液(10 mmol/L)。调节电化学工作站不同扫描速率(20、40、60、80 mV/s和100 mV/s)。采用三电极系统,利用CV法检测体系中的抗坏血酸,监测氧化峰电流绝对值,将其作为体系指标,指标越大越好,重复实验3 次。
1.3.4 正交试验设计优化抗坏血酸电化学检测体系
选择L9(34)正交试验设计,分别考察反应温度(A)、Fe3O4@Au添加量(B)、扫描速率(C)和pH值(D)对整个实验体系的影响,每种因素设计3 个水平(根据单因素试验优化得出),采用电化学工作站三电极系统,利用CV法检测体系中的抗坏血酸浓度,监测氧化峰电流绝对值的变化,重复实验3 次,并确定因素影响的主次顺序及优选方案。
1.3.5 抗坏血酸检测体系的电化学响应
按照优化实验得出的最适电化学检测体系考察抗坏血酸检测的电化学响应特性,根据不同浓度抗坏血酸和氧化峰电流绝对值绘制工作曲线,计算检出限。选择2.5 mmol/L和10 mmol/L抗坏血酸标准溶液加入到电化学检测体系中,监测氧化峰电流绝对值,重复实验3 次,结果取平均值带入工作曲线回归方程,测定其回收率。为验证传感体系在检测过程中的抗干扰性能,在最优实验条件下向电化学检测体系中分别加入浓度为0.25 mol/L的K2SO4、NaCl、蔗糖、乳糖、酪氨酸和甘氨酸这些食品样品中常见的物质,观察氧化峰电流绝对值的变化,对其抗干扰性能进行评估。
1.3.6 实际样品检测
为了验证该电化学方法在实际样品中的可行性,选择VC含量为2.25 mg/g的泡腾片作为样品,将其研磨成均匀粉末。分别准确称取45、90 mg和180 mg样品配制成100 mL样品溶液,并转移至100 mL容量瓶中待用。按照抗坏血酸最优电化学检测体系分别监测3 种不同浓度样品溶液的氧化峰电流绝对值,重复实验3 次,测定其回收率并评价检测体系的精确度。
2 结果与分析
2.1 Fe3O4@Au的表征
图2分别显示了AuNPs、Fe3O4磁性纳米颗粒和Fe3O4@Au复合纳米粒子的透射电镜(transmission electron microscope,TEM)图像。图2a显示了AuNPs大小及分布,平均粒径为3~6 nm。图2b所示的Fe3O4磁粉团簇由表面粗糙的分散球组成,Fe3O4团簇的平均直径约为85 nm。由图2c可以看出,AuNPs均匀吸附在Fe3O4表面,且与Fe3O4纳米粒子相比,镀金后Fe3O4@Au纳米粒子的粒径增大,约为150 nm。采用超导量子干涉装置磁强计对Fe3O4磁粉团簇和Fe3O4@Au进行磁滞测量,磁学性质分析表明,在300 K时,Fe3O4团簇的饱和磁化强度为65 emu/g,在AuNPs的作用下,Fe3O4@Au的饱和磁化强度降低到46 emu/g。说明AuNPs包覆会导致复合微粒磁化强度的轻微降低,对其超顺磁性性质有轻微的影响。

图2 AuNPs(a)、Fe3O4(b)和Fe 3O4@Au(c)团簇的TEM图像
Fig. 2 TEM images of AuNPs (a), Fe 3O4(b) and Fe3O4 @Au (c) clusters
2.2 Fe3O4@Au模拟酶电化学增强活性验证
采用电化学分析法对Fe3O4@Au复合纳米微粒的模拟酶活性进行验证。由图3可知,在Fe3O4@Au存在条件下,低浓度H2O2不能产生氧化电流峰,说明在裸电极条件下,Fe3O4@Au与低浓度H2O2体系的灵敏度不足以产生电流响应[23];与此同时,H2O2和Fe3O4@Au却可以分别与抗坏血酸在电位为0.5 V左右处产生氧化电流峰,说明两者皆可以与抗坏血酸单独发生氧化还原反应,需要强调的是,Fe3O4@Au是催化溶液中的氧与抗坏血酸发生反应,体现出了过氧化物模拟酶的活性;而当H2O2和Fe3O4@Au同时存在时,体系中出现抗坏血酸,氧化峰电流得到较大提升,说明H2O2和Fe3O4@Au合作可以极大促进抗坏血酸电催化氧化为脱氢抗坏血酸产生明显的电荷转移[24],进而增强抗坏血酸的检测灵敏度。综上所述,论证了Fe3O4@Au模拟酶起到增强体系电化学信号的作用。同时,也借此推断Fe3O4@Au具有过氧化物模拟酶活性。

图3 FFee3O4@Au模拟酶活性验证
Fig. 3 Veri fication of the peroxidase-like activity of Fe3O4@Au
2.3 单因素试验设计优化电化学检测抗坏血酸体系
2.3.1 反应温度对电化学检测体系的影响
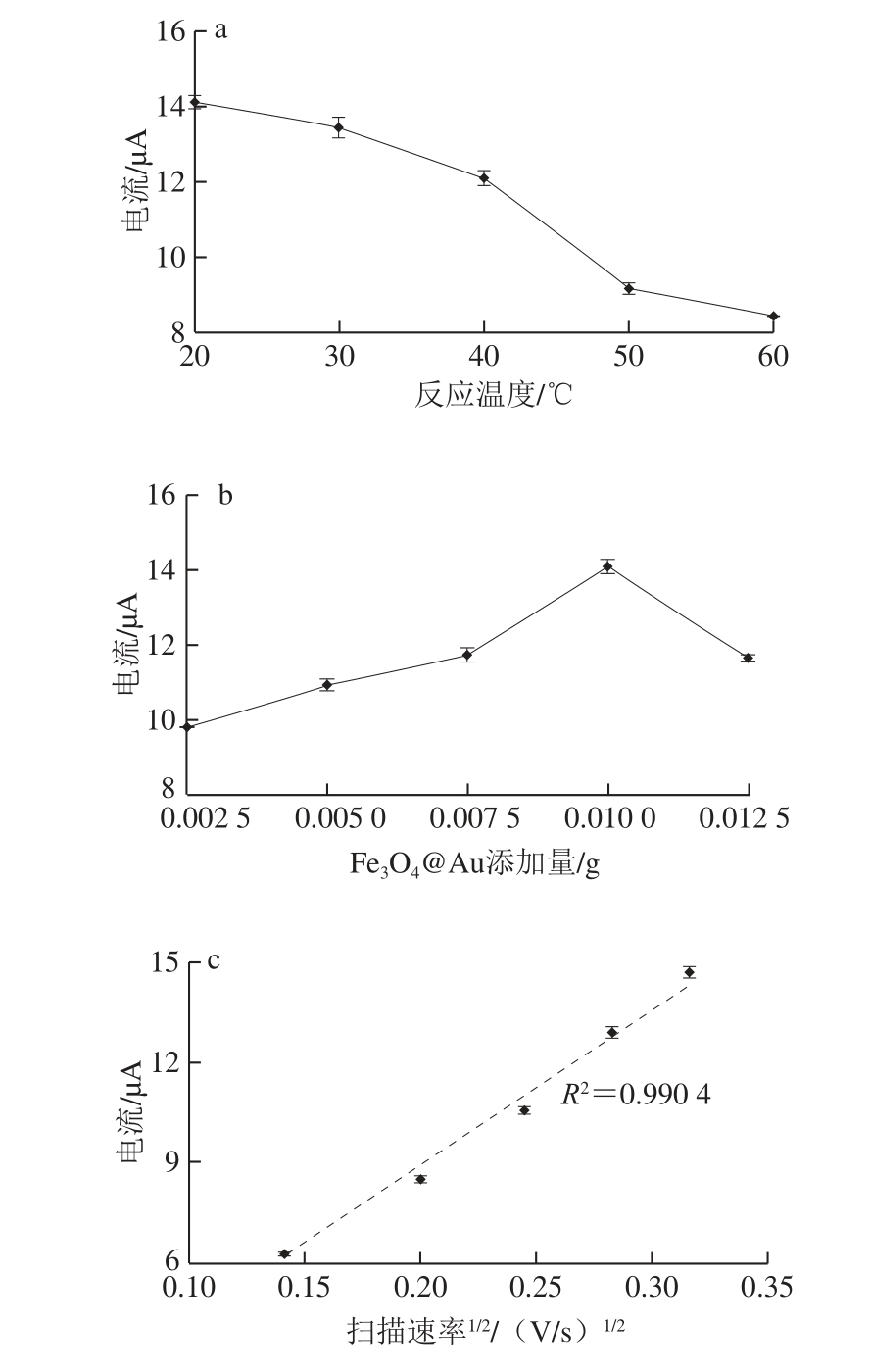
图4 电化学检测的单因素试验优化
Fig. 4 Optimization of electrochemical detection conditions
由图4a可知,反应温度在20~30 ℃之间,反应速率减小,电极表面的电子转移数目减少,电化学信号减弱,氧化峰电流绝对值呈缓慢下降趋势,30~50 ℃范围内,随温度升高,Fe3O4@Au模拟酶的催化活性降低导致反应速率减小,电极表面的电子转移数目减少,氧化峰电流绝对值随之降低。反应温度在50~60 ℃范围内时,氧化峰电流绝对值下降速率开始变缓,这可能是由于温度升高,在一定程度上加快了抗坏血酸的电氧化,增强了电化学响应。鉴于此,选取20、30 ℃和40 ℃作为反应温度的不同水平参与正交试验设计优化。
2.3.2 Fe3O4@Au添加量对电化学检测体系的影响
由图4b可知,电化学检测体系中Fe3O4@Au添加量在0.002 5~0.005 g范围内,氧化峰电流绝对值平稳上升。添加量在0.005~0.007 5 g区间内,反应速率略微减小,但氧化峰电流绝对值仍呈稳定上升趋势。当添加量处于0.007 5~0.01 g范围内时,反应速率迅速上升,氧化峰电流绝对值随之大幅度增加,这可能是由于随着电化学检测体系中Fe3O4@Au添加量的增加,一方面增大了体系中模拟酶活性,促进抗坏血酸电氧化产生电子转移;另一方面,有微量Fe3O4@Au附着于电极表面,增大了电极灵敏度,电子转移速率显著提高。而添加量在0.01~0.012 5 g范围时,反应速率迅速下降,氧化峰电流绝对值也迅速降低,原因是随着检测体系中Fe3O4@Au的增加,纳米粒子产生团聚现象,导致催化效果大大降低[25]。由此可知,Fe3O4@Au添加量在0.01 g时电化学检测效果最优。因此,Fe3O4@Au添加量选取0.007 5、0.01 g和0.012 5 g参与正交试验设计优化。
2.3.3 扫描速率对电化学检测体系的影响
在考察扫描速率对检测体系影响的过程中,本实验不仅要筛选出合适的水平,还要鉴定其与电流的线性关系。由图4c可知,不同扫描速率下抗坏血酸氧化峰电流绝对值随着扫描速率的增加而增加。且氧化峰电流绝对值|ipa|(μA)与扫描速率平方根v1/2(V/s)1/2之间呈良好的线性关系,回归方程为:|ipa|=48.706v1/2-0.964 4,R2=0.990 4。这种线性关系表明抗坏血酸的氧化反应为扩散控制,更有利于安培传感,产生更强的电化学信号。抗坏血酸的电催化氧化通过双电子双质子途径进行[26-28]。实验结果表明,当扫描速率大于0.1 V/s时会影响抗坏血酸电化学检测体系的稳定性,不利于氧化电流峰的监测。因此,在正交试验优化选择扫描速率为0.06、0.08 V/s和0.1 V/s最为适合。
2.3.4 pH值对电化学检测体系的影响
如图4d所示,检测体系pH 5时,氧化峰值电流强度最大,这是由于在pH 5的介质中,质子数量较少,抗坏血酸释放出的2 个电子很容易转移到电极上,以产生更强的电化学信号。而当电解质溶液pH 4时,会有大量的质子,这些质子会覆盖从抗坏血酸释放出来的电子,从而阻碍电子流动。电解质溶液pH值在5~9范围内,介质中均含有大量负离子,不利于电子向电极的流动,电子迁移率逐渐降低[29-30]。由此可知,检测体系pH值选取5、6、7参与正交试验。
2.4 正交试验设计优化电化学检测体系
通过正交试验设计优化极差分析结果可知(表1),各因素对抗坏血酸电化学检测体系影响的主次顺序为:C>D>A>B,即扫描速率>pH值>反应温度>Fe3O4@Au添加量。根据极差分析可以确定最优方案组合为A3B2C3D3,即反应温度20 ℃、Fe3O4@Au添加量0.01 g、扫描速率0.1 V/s、电解液pH 5。综合以上分析可知,影响抗坏血酸电化学检测体系的主要因素是扫描速率、反应温度、Fe3O4@Au添加量和pH值对检测体系也有相应影响。由于该检测电极未经修饰,仅用乙醇和超纯水冲洗即可很容易地再生检测系统,具有较高的便捷性和稳定性。以正交结果最优方案对10 mmol/L抗坏血酸进行独立的3 次平行电化学检测,氧化峰电流绝对值的平均值为14.12 μA,相对标准偏差(relative standard deviation,RSD)为2.08%。表明该电化学检测体系具有良好的精密度。
表1 正交试验设计及结果
Table 1 Orthogonal array design with experimental results
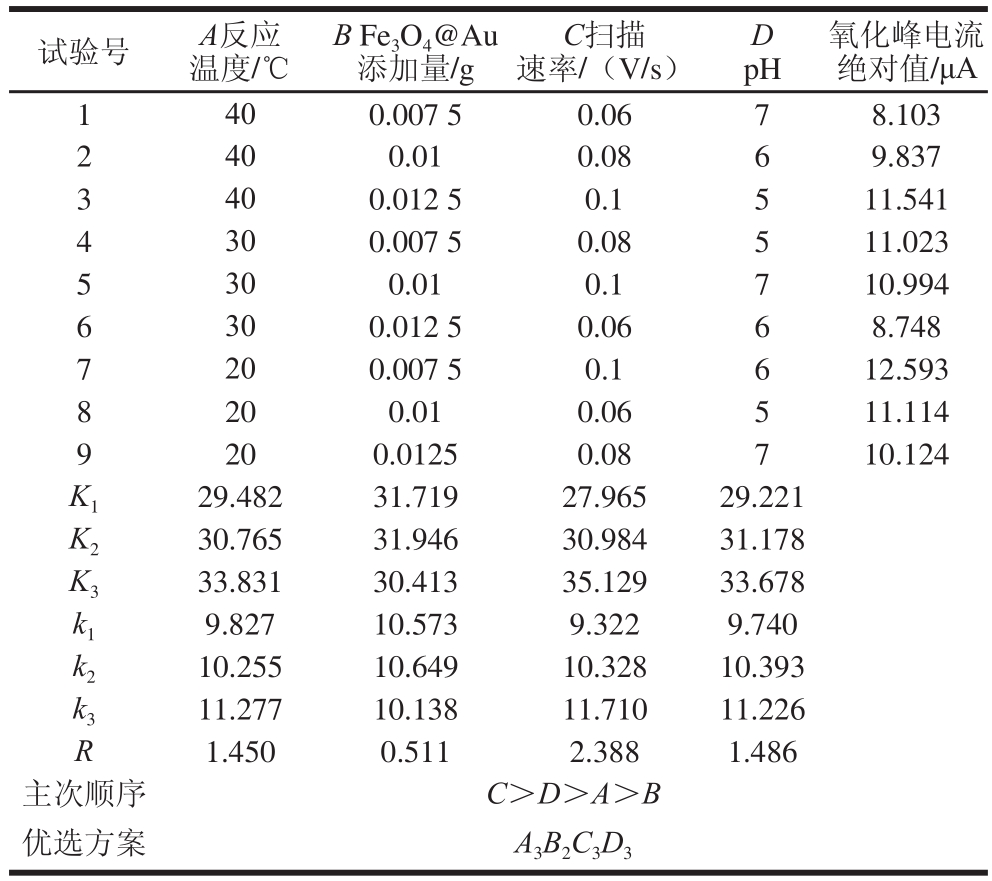
氧化峰电流绝对值/μA 1 40 0.007 5 0.06 7 8.103 2 40 0.01 0.08 6 9.837 3 40 0.012 5 0.1 5 11.541 4 30 0.007 5 0.08 5 11.023 5 30 0.01 0.1 7 10.994 6 30 0.012 5 0.06 6 8.748 7 20 0.007 5 0.1 6 12.593 8 20 0.01 0.06 5 11.114 9 20 0.0125 0.08 7 10.124 K1 29.482 31.719 27.965 29.221 K2 30.765 31.946 30.984 31.178 K3 33.831 30.413 35.129 33.678 k1 9.827 10.573 9.322 9.740 k2 10.255 10.649 10.328 10.393 k3 11.277 10.138 11.710 11.226 R 1.450 0.511 2.388 1.486主次顺序 C>D>A>B优选方案 A3B2C3D3试验号 A反应温度/℃B Fe3O4@Au添加量/g C扫描速率/(V/s)D pH
2.5 抗坏血酸检测体系的电化学响应效果
2.5.1 电化学检测体系的工作曲线、检出限和回收率测定
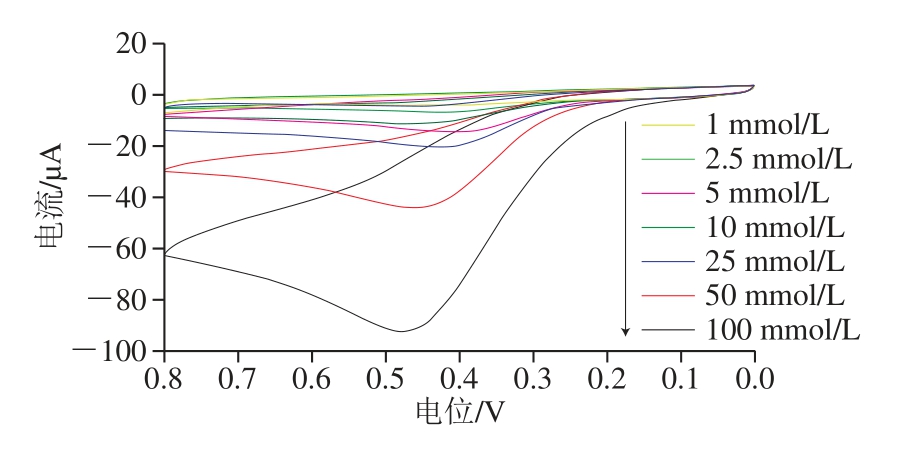
图5 不同浓度抗坏血酸标准溶液的CCVV曲线
Fig. 5 CV curves of AA at different concentrations
如图5可知,在1~100 mmol/L范围内,随着抗坏血酸标准溶液浓度的增加,氧化峰电流绝对值逐渐增大。同时,对不同浓度的抗坏血酸标准溶液作工作曲线,抗坏血酸在1~100 mmol/L范围内呈良好的线性关系,工作曲线回归方程为y=867.81x+3.860 8(R2=0.991 9),其中y代表CV的氧化峰电流绝对值(μA),x代表抗坏血酸的浓度(mmol/L)。根据方程计算检出限(RSN=3)为0.011 7 mg/L。在相同电化学检测体系下检测2.5 mmol/L和10 mmol/L的抗坏血酸标准溶液的氧化峰电流绝对值,根据工作曲线回归方程,评价该催化检测体系回收率分别为92.6%和105.8%。将Fe3O4@Au在本研究中检测性能与先前报道的基于其他纳米材料的检测抗坏血酸方法进行比较。由表2可知,本研究与其他文献报道检测抗坏血酸方法相比具有相对较低的检出限,说明此基于Fe3O4@Au电化学检测抗坏血酸的方法具有良好的灵敏度。
表2 基于不同纳米材料的抗坏血酸电化学检测方法的比较
Table 2 Comparison of different nanomaterial-based methods for electrochemical detection of AA
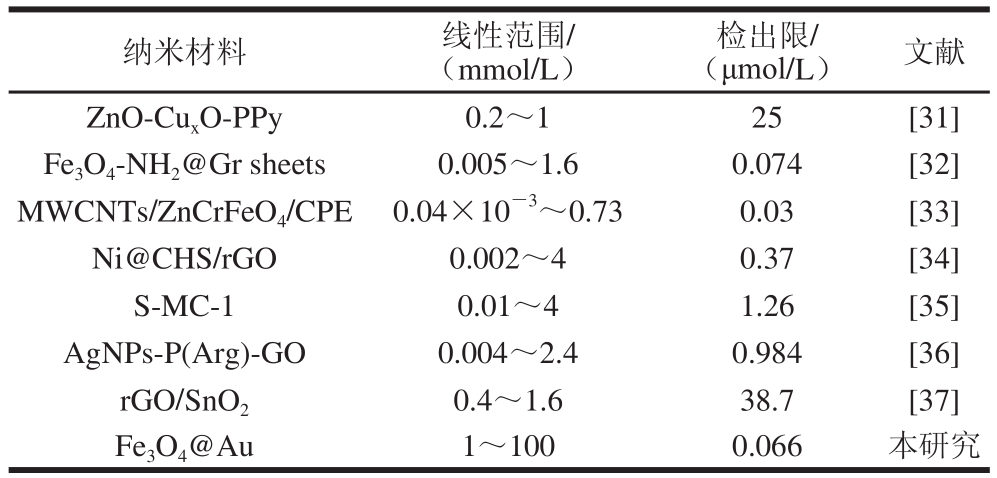
纳米材料 线性范围/(mmol/L)检出限/(μmol/L) 文献ZnO-CuxO-PPy 0.2~1 25 [31]Fe3O4-NH2@Gr sheets 0.005~1.6 0.074 [32]MWCNTs/ZnCrFeO4/CPE 0.04×10-3~0.73 0.03 [33]Ni@CHS/rGO 0.002~4 0.37 [34]S-MC-1 0.01~4 1.26 [35]AgNPs-P(Arg)-GO 0.004~2.4 0.984 [36]rGO/SnO2 0.4~1.6 38.7 [37]Fe3O4@Au 1~100 0.066 本研究
2.5.2 电化学检测体系抗干扰性能
为了评估该电化学检测方法的抗干扰性能,分别将浓度为0.25 mol/L的K2SO4、NaCl、蔗糖、乳糖、酪氨酸和甘氨酸加入到电化学检测体系中,选择2.5 mmol/L抗坏血酸的体系作为参照进行对比研究。每种添加物的浓度均为抗坏血酸浓度的100 倍。从图6可以看出,该电化学检测体系对0.25 mol/L的K2SO4、NaCl、蔗糖、乳糖、酪氨酸和甘氨酸没有表现出明显的电流响应。然而,2.5 mmol/L抗坏血酸具有明显的电流响应。综上所述,该方法对抗坏血酸具有较高的选择性。

图6 抗坏血酸检测体系的选择性
Fig. 6 Selectivity of AA detection system
2.6 实际样品检测结果
为了探讨构建电化学检测体系在实际样品中的应用,在相同体系下检测含有0.45、0.9 g/L和1.8 g/L质量浓度抗坏血酸的VC泡腾片溶液的氧化峰电流绝对值,带入工作曲线回归方程,对检测体系进行回收率评价。结果(表3)表明,该检测体系回收率分别为95.4%、91.9%和103.8%。重复测定3 次,RSD分别为3.97%、4.51%和3.18%,说明该电化学检测体系对VC泡腾片具有良好的回收率和精密度。
表3 检测实际样品加标回收率和精密度
Table 3 Recovery rates and precision of real samples spiked with different concentrations of AA
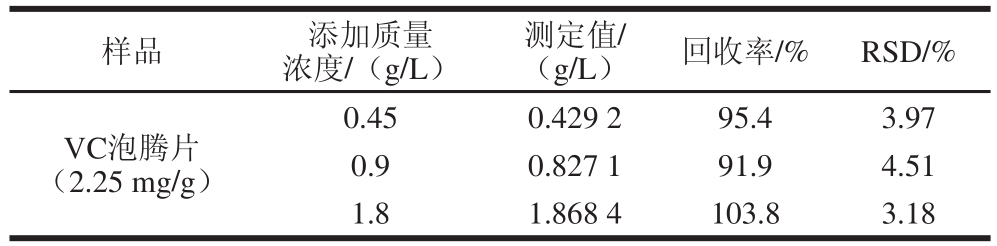
样品 添加质量浓度/(g/L)测定值/(g/L) 回收率/% RSD/%VC泡腾片(2.25 mg/g)0.45 0.429 2 95.4 3.97 0.9 0.827 1 91.9 4.51 1.8 1.868 4 103.8 3.18
3 结 论
本实验基于复合纳米模拟酶构建一种无酶电化学传感器,以实现对食品中抗坏血酸含量的高灵敏度和高选择性电化学检测。结果表明,所制备的Fe3O4@Au具有良好的过氧化物模拟酶活性,本研究与其他文献报道的检测方法相比具有相对较低的检出限。另一方面,该电化学检测体系表现出较高的敏感性,对共存分子具有优异的抗干扰能力,且无需对电极进行修饰,可获得良好的稳定性和便捷性。实际样品分析中抗坏血酸的电化学检测性能良好,说明所构建的电化学传感器具有较高的实用性。相关研究结果将为食品中抗坏血酸电化学检测方法的改良积累基础资料。
[1] ABELLÁN-LLOBREGAT A, VIDAL L, RODRÍGUEZ-AMARO R,et al. Au-IDA microelectrodes modified with Au-doped graphene oxide for the simultaneous determination of uric acid and ascorbic acid in urine samples[J]. Electrochimica Acta, 2017, 227: 275-284.DOI:10.1016/j.electacta.2016.12.132.
[2] ZHU Q, BAO J, HUO D Q, et al. 3D Graphene hydrogel-gold nanoparticles nanocomposite modified glassy carbon electrode for the simultaneous determination of ascorbic acid, dopamine and uric acid[J]. Sensors & Actuators B Chemical, 2017, 238: 1316-1323.DOI:10.1016/j.snb.2016.09.116.
[3] LIU H Y, GU C C, HOU C, et al. Plasma-assisted synthesis of carbon fibers/ZnO core-shell hybrids on carbon fiber templates for detection of ascorbic acid and uric acid[J]. Sensors and Actuators B: Chemical,2016, 224: 857-862. DOI:10.1016/j.snb.2015.11.027.
[4] TANG W Z, WU J, YING Y B, et al. Writing sensors on solid agricultural products for in situ detection[J]. Analytical Chemistry,2015, 87(21): 10703-10707. DOI:10.1021/acs.analchem.5b02558.
[5] LIU H, LI N, ZHANG H Q, et al. A simple and convenient fluorescent strategy for the highly sensitive detection of dopamine and ascorbic acid based on graphene quantum dots[J]. Talanta, 2018, 189: 190-195.DOI:10.1016/j.talanta.2018.05.014.
[6] WANG Y L, RUI Y P, LI F J, et al. Electrodeposition of nickel hexacyanoferrate/layered double hydroxide hybrid film on the gold electrode and its application in the electroanalysis of ascorbic acid[J]. Electrochimica Acta, 2014, 117: 398-404. DOI:10.1016/j.electacta.2013.11.141.
[7] XU T Q, ZHANG Q L, NING J N, et al. Simultaneous determination of dopamine and uric acid in the presence of ascorbic acid using Pt nanoparticles supported on reduced graphene oxide[J]. Electrochimica Acta, 2014, 115(3): 109-115. DOI:10.1016/j.electacta.2013.10.147.
[8] KURBANOGLU S, OZKAN S A, MERKOÇI A. Nanomaterialsbased enzyme electrochemical biosensors operating through inhibition for biosensing applications[J]. Biosensors and Bioelectronics, 2017,89(2): 886-898. DOI:10.1016/j.bios.2016.09.102.
[9] RAHIMI P, JOSEPH Y. Enzyme-based biosensors for choline analysis: a review[J]. Trends in Analytical Chemistry, 2019, 110:367-374. DOI:10.1016/j.trac.2018.11.035.
[10] 钟青梅, 黄欣虹, 覃庆敏, 等. 以碳量子点为过氧化物模拟酶的葡萄糖测定方法[J]. 分析化学, 2018, 46(7): 1062-1068. DOI:10.11895/j.issn.0253-3820.171396.
[11] CHENG H J, WANG X Y, WEI H. Ratiometric electrochemical sensor for effective and reliable detection of ascorbic acid in living brains[J].Analytical Chemistry, 2015, 87(17): 8889-8895. DOI:10.1021/acs.analchem.5b02014.
[12] 王鸿, 刘旭挺, 黄园, 等. 抗生素功能化金磁纳米探针的制备及其过氧化物模拟酶性能研究[J]. 中国科学: 化学, 2019, 49(2): 391-398.DOI:10.1360/N032018-00157.
[13] 李铸衡, 高晶清, 简明红, 等. 构建金纳米粒子标记的凝集素芯片应用于抗生素与金黄色葡萄球菌相互作用研究[J]. 分析化学,2018(12): 1904-1912. DOI:10.11895/j.issn.0253-3820.181570.
[14] ZAREI S, NIAD M, RAANAEI H. The removal of mercury ion pollution by using Fe3O4-nanocellulose: synthesis, characterizations and DFT studies[J]. Journal of Hazardous Materials, 2018, 344:258-273. DOI:10.1016/j.jhazmat.2017.10.009.
[15] 曹小吉, 周婷, 徐家辉, 等. 磁性四氧化三铁氮掺杂石墨烯磁性固相萃取测定水样中的6 种醛酮化合物[J]. 分析化学, 2019, 47(3): 394-402.DOI:10.19756/j.issn.0253-3820.181653.
[16] BASKAKOV A O, SOLOV'EVA A Y, IONI Y V, et al. Magnetic and interface properties of the core-shell Fe3O4/Au nanocomposites[J].Applied Surface Science, 2017, 422: 638-644. DOI:10.1016/j.apsusc.2017.06.029.
[17] XING Y, JIN Y Y, SI J C, et al. Controllable synthesis and characterization of Fe3O4/Au composite nanoparticles[J]. Journal of Magnetism & Magnetic Materials, 2015, 380(3): 150-156.DOI:10.1016/j.jmmm.2014.09.060.
[18] LIU Y M, YANG J J, CAO J T, et al. An electrochemiluminescence aptasensor based on CdSe/ZnS functionalized MoS2 and enzymatic biocatalytic precipitation for sensitive detection of immunoglobulin E[J]. Sensors and Actuators B Chemical, 2016, 232: 538-544.DOI:10.1016/j.snb.2016.03.165.
[19] SHEN G Y, ZHANG S B, SHEN G L, et al. Development of an electrochemical aptasensor for thrombin based on aptamer/Pd-AuNPs/HRP conjugates[J]. Analytical Methods, 2016, 8(10): 2150-2155.DOI:10.1039/C6AY00032K.
[20] AFSHARAN H, KHALILZADEH B, TAJALLI H, et al.A sandwich type immunosensor for ultrasensitive electrochemical quantification of p53 protein based on gold nanoparticles/graphene oxide[J]. Electrochimica Acta, 2016, 188: 153-164. DOI:10.1016/j.electacta.2015.11.133.
[21] 付宇, 李晓东, 李铸衡, 等. 表面电荷对聚乙二醇修饰金纳米粒子生物行为的影响[J]. 分析化学, 2017, 45(7): 1038-1044. DOI:10.11895/j.issn.0253-3820.170085.
[22] 王婷婷, 李元, 唐旻奕, 等. 纳米金修饰的碳纤维超微电极在高浓度抗坏血酸体系中选择性测定多巴胺[J]. 分析试验室, 2019, 38(1):19-24. DOI:10.13595/j.cnki.issn1000-0720.2018.042805.
[23] HUANG Y, XUE Y W, ZENG J X, et al. Non-enzymatic electrochemical hydrogen peroxide biosensor based on reduction graphene oxide-persimmon tannin-platinum nanocomposite[J].Materials Science and Engineering: C, 2018, 92: 590-598.DOI:10.1016/j.msec.2018.07.021.
[24] PISOSCHI A M, POP A, SERBAN A I, et al. Electrochemical methods for ascorbic acid determination[J]. Electrochimica Acta,2014, 121: 443-460. DOI:10.1016/j.electacta.2013.12.127.
[25] OMIDVAR A, JALEH B, NASROLLAHZADEH M, et al.Fabrication, characterization and application of GO/Fe3O4/Pd nanocomposite as a magnetically separable and reusable catalyst for the reduction of organic dyes[J]. Chemical Engineering Research &Design, 2017, 46(2): 271-298. DOI:10.1007/s13158-014-0112-y.
[26] PUANGJAN A, CHAIYASITH S, WICHITPANYA S, et al.Electrochemical sensor based on PANI/MnO2-Sb2O3 nanocomposite for selective simultaneous voltammetric determination of ascorbic acid and acetylsalicylic acid[J]. Journal of Electroanalytical Chemistry,2016, 782: 192-201. DOI:10.1016/j.jelechem.2016.09.019.
[27] ZHANG J J, WANG P, YAN R Q, et al. Long short-term memory for machine remaining life prediction[J]. Journal of Manufacturing Systems, 2018, 48: 78-86. DOI:10.1016/j.jmsy.2018.05.011.
[28] ARABALI V, EBRAHIMI M, ABBASGHORBANI M, et al.Electrochemical determination of vitamin C in the presence of NADH using a CdO nanoparticle/ionic liquid modi fied carbon paste electrode as a sensor[J]. Journal of Molecular Liquids, 2016, 213: 312-316.DOI:10.1016/j.molliq.2015.10.001.
[29] KHALEGHI F, ARAB Z, GUPTA V K, et al. Fabrication of novel electrochemical sensor for determination of vitamin C in the presence of vitamin B9 in food and pharmaceutical samples[J].Journal of Molecular Liquids, 2016, 221: 666-672. DOI:10.1016/j.molliq.2016.06.061.
[30] LI Q, HUO C R, YI K, et al. Preparation of flake hexagonal BN and its application in electrochemical detection of ascorbic acid, dopamine and uric acid[J]. Sensors and Actuators B: Chemical, 2018, 260:346-356. DOI:10.1016/j.snb.2017.12.208.
[31] GHANBARI K, HAJHEIDARI N. ZnO-CuxO/polypyrrole nanocomposite modi fied electrode for simultaneous determination of ascorbic acid, dopamine, and uric acid[J]. Analytical Biochemistry,2015, 473: 53-62. DOI:10.1016/j.ab.2014.12.013.
[32] WU D, LI Y Y, ZHANG Y, et al. Sensitive electrochemical sensor for simultaneous determination of dopamine, ascorbic acid, and uric acid enhanced byamino-group functionalized mesoporous Fe3O4@graphene sheets[J]. Electrochimica Acta, 2014, 116(2): 244-249. DOI:10.1016/j.electacta.2013.11.033.
[33] TAEI M, SALAVATI H, HASANPOUR F, et al. Simultaneous determination of ascorbic acid, acetaminophen and codeine based on multi-walled carbon nanotubes modi fied with magnetic nanoparticles paste electrode[J]. Materials Science and Engineering: C, 2016, 69:1-11. DOI:10.1016/j.msec.2016.06.014.
[34] ZHANG L, ZHANG J. 3D hierarchical bayberry-like Ni@carbon hollow nanosphere/rGO hybrid as a new interesting electrode material for simultaneous detection of small biomolecules[J]. Talanta, 2018,178: 608-615. DOI:10.1016/j.talanta.2017.09.086.
[35] EMRAN M Y, SHENASHEN M A, MORITA H, et al. One-step selective screening of bioactive molecules in living cells using sulfurdoped microporous carbon[J]. Biosensors & Bioelectronics, 2018, 109:237-245. DOI:10.1016/j.bios.2018.03.026.
[36] TIĞ G A. Development of electrochemical sensor for detection of ascorbic acid, dopamine, uric acid and L-tryptophan based on Ag nanoparticles and poly(L-arginine)-graphene oxide composite[J].Journal of Electroanalytical Chemistry, 2017, 807: 19-28.DOI:10.1016/j.jelechem.2017.11.008.
[37] SHA R, BADHULIKA S. Facile green synthesis of reduced graphene oxide/tin oxide composite for highly selective and ultra-sensitive detection of ascorbic acid[J]. Journal of Electroanalytical Chemistry,2018, 816: 30-37. DOI:10.1016/j.jelechem.2018.03.033.