枸杞(Lycium)属于茄科(Solanaceae)枸杞属(Lycium L.)的落叶灌木植物[1],研究表明枸杞具有丰富的营养价值,除了可以正常食用之外,在中药中的使用时间长达几个世纪,属于中国传统药食同源的食物[2-3]。其中宁夏枸杞(Lycium barbarum L.)是唯一被载入《中国药典》的品种[4]。枸杞中含有多种生物活性成分,主要有多糖、类胡萝卜素、类黄酮、甜菜碱等[5],其中最主要的活性物质为枸杞多糖,是一种水溶性、以—O—连接的高分子糖蛋白[6],大量研究表明,枸杞多糖可以补充肾脏和肝脏的阴虚[7-8],抗氧化、抗衰老、抗肿瘤等[9-11],还参与免疫调节[12]、神经保护、辐射防护[13]等。
近年来,国内对枸杞多糖的研究多集中于测定枸杞干果粗多糖的含量、组成及解释生理药理功能和对枸杞粗多糖的活性评价,同时也取得了一定的成果。但关于枸杞在不同生长期的多糖动态研究最近几年才有所增多,有关枸杞不同成熟期的枸杞多糖系统的理化特性和结构分析鲜见报道。房想[14]将不同生长期和成熟期的枸杞果实,即青果、黄果、头茬果、普通夏果和秋果进行干制后,对多糖进行提取、纯化,并测定含量和其单糖组成,结果显示各个时期的多糖含量都是呈现先增加后降低的趋势。朱彩平[15]对干燥的枸杞成熟果实的结构和生物活性进行了分析和评价,结果表明枸杞多糖中含有—COOH、—OH、—NH2,糖链中含有吡喃糖,有较长的侧链和分支,不具有三股螺旋结构,且呈松散的碎片聚集状态。
本研究将枸杞整个发育成熟期分为5 个阶段,即幼果期、青果期、黄变初期、黄变后期、盛果期,所用枸杞样品分别是采集这5 个阶段的枸杞鲜果,经过多糖提取、除蛋白、纯化得到提取率高且变化稳定的酸性多糖,再通过高效液相色谱(high performance liquid chromatography,HPLC)法、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪、傅里叶红外光谱仪、综合热力分析仪和扫描电子显微镜,分别测定各时期枸杞多糖的分子质量、单糖组成、糖链结构、热力学性质和微观结构。旨在为研究不同生长期枸杞多糖更深层次的生理特性以及超微结构提供理论和实验依据。
1 材料与方法
1.1 材料与试剂
从宁夏银川市西夏区同心北街枸杞种植园采摘5 a生宁杞1号枸杞,从开花到成熟,根据枸杞的生理生长变化共分为5 个阶段进行标记采样,分别是幼果期(7 d)、青果期(14 d)、黄变初期(21 d)、黄变后期(28 d)、红果期(35 d)。田间收集的样品迅速放到液氮中,送回实验室立即贮存至超低温冰箱备用,样品如图1所示。
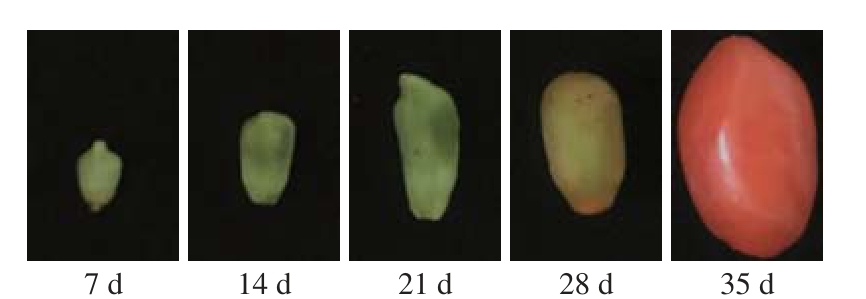
图1 不同生长时期的枸杞
Fig. 1 L. barbarum fruit at different growth stages
半乳糖醛酸(纯度≥97%) 广州市乐试生物科技有限公司;葡聚糖标准品(纯度≥99%)、单糖标准品(纯度≥98%) 美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AL204电子天平 梅特勒-托利多仪器(上海)有限公司;BGZ-146电热鼓风干燥箱 上海博迅实业有限公司;JDG-0.2T真空冷冻干燥机 兰州科近真空冻干技术有限公司;BT-50EA蠕动泵 重庆杰恒蠕动泵有限公司;TH-300梯度混合器、BSZ-100自动部份收集器 上海青浦沪西仪器厂;RE-52AA型旋转蒸发仪上海亚荣生化仪器厂;GCMS-QP2010 GC-MS联用仪、LC-20A HPLC仪、RID-20A荧光检测器 日本岛津公司;JSM-7500F场发射扫描电子显微镜 日本电子株式会社;SETARAM SETSYS16综合热分析仪 法国塞塔拉姆公司;Spectrum Two傅里叶变换红外光谱仪 美国PerkinElmer公司;AR1500ex流变仪 美国TA仪器公司。
1.3 方法
1.3.1 枸杞多糖理化测定
枸杞多糖的提取参考文献[16]并稍作修改。Sevag法[17]脱蛋白,苯酚-硫酸法[18]测定枸杞多糖质量浓度,样品溶液中枸杞粗多糖含量按下式计算:
式中:ρ为多糖质量浓度/(mg/mL);d为稀释倍数;V为溶液体积/mL;m为原料干物质/g。
硫酸-咔唑法[19]测定枸杞多糖中半乳糖醛酸含量,Bradford法[20]测定蛋白质含量。
1.3.2 枸杞多糖的分离与纯化
DEAE-650M柱层析[21]对脱蛋白多糖进行分离,苯酚-硫酸法在490 nm和紫外分光光度法在280 nm波长处隔管测定多糖溶液的吸光度,绘制洗脱曲线。根据洗脱曲线合并同一色谱峰洗脱液,脱盐后冷冻干燥,得到初步纯化后产品。
用葡聚糖凝胶色谱柱[22]对枸杞多糖进一步纯化。苯酚-硫酸法在490 nm波长处测定多糖溶液的吸光度,绘制洗脱曲线。合并同一色谱峰洗脱液,冷冻干燥。
1.3.3 不同生长期枸杞多糖结构分析
1.3.3.1 多糖分子质量测定
将各单糖标准品分别配成0.01 g/mL的标准溶液,枸杞多糖配成0.01 g/mL样品溶液待用。色谱条件:流动相是水,流量1.0 mL/min,进样量20 μL,色谱柱为Shodex 804HQ(300 mm×7.8 mm),柱温30 ℃,Shodex RI-20A折光检测器。
1.3.3.2 单糖组成分析
根据得到的多糖水解物[23],采用三甲基硅烷化法衍生化单糖[24],进行GC-MS[25]鉴定。
GC条件:HP-5 MS气相色谱柱(60 m×0.25 mm,0.25 μm),进样量0.3 μL,分流比30∶1,延迟时间3 min,进口温度230 ℃,检测器温度240 ℃,色谱柱采用程序升温,起始温度130 ℃,以3 ℃/min速率升至180 ℃,保持2 min,再以5 ℃/min升至220 ℃,保持3 min。
1.3.3.3 傅里叶红外光谱分析
枸杞多糖样品用KBr压片,在4 000~400 cm-1区间内进行扫描[26]。
1.3.3.4 热重分析
用综合热分析仪测定,加热速率100 ℃/min,测试范围30~800 ℃,得到微分扫描量热(differential scanning calorimeter,DSC)、热重分析(thermogravimetric,TG)曲线[27]。
1.3.3.5 多糖扫描电子显微镜的测定
取多糖样品粘于样品台上,置于离子溅射仪中镀一层导电金膜后,采用场发射扫描电子显微镜观察[28]。
1.4 数据处理
采用SPSS 20.0统计分析实验数据,数据结果以 表示;方差分析多重比较,采用t检验,P<0.05,差异显著,Origin 2017制图。所有实验重复3 次以上。
表示;方差分析多重比较,采用t检验,P<0.05,差异显著,Origin 2017制图。所有实验重复3 次以上。
2 结果与分析
2.1 枸杞多糖的理化性质
2.1.1 枸杞不同生长期粗多糖含量测定结果
表1 枸杞在不同生长期粗多糖含量
Table 1 Polysaccharide contents of L. barbarum fruit at different growth stages
注:不同小写字母表示差异显著,P<0.05;不同大写字母表示差异极显著,P<0.01。下同。
生长期/d 7 14 21 28 35粗多糖质量分数/%34.41±0.05bA37.27±0.03aA41.19±0.01cB34.90±0.04bA39.32±0.04cB
由表1可知,在枸杞整个发育成熟过程中各个时期的粗多糖含量由大到小依次为21 d>35 d>14 d>28 d>7 d,变化范围为34%~42%,整体呈现先增加后降低的趋势。7 d的糖含量最低,与其他各时期均有显著差异(P<0.05),7 ~21 d的粗多糖含量一直持续缓慢增加,并在第21天达到峰值,在这之后又开始逐渐降低,且降低的幅度大于增加的幅度,生长期为28 d的粗多糖含量甚至接近7 d,到成熟期时又出现上升的趋势,含量仅次于积累高峰期,差异性也表明,21 d和35 d的粗多糖含量与其他3 个时期有极显著差异(P<0.01)。出现这种趋势的原因是幼果期枸杞质体中的多糖以淀粉形式存在,淀粉在枸杞整个发育成熟过程中的变化趋势是先增加后降低,第14天时到达峰值,之后淀粉酶活性逐渐增强,淀粉颗粒大幅降解[29],果实内部结构发生变化,但己糖逐渐被合成,所以枸杞多糖含量增幅较小,到达色变初期时,主要以能量代谢和糖代谢为主,所以此阶段大量糖类物质积累,多糖含量达到峰值,色变后期果实颜色叶绿素降解,类胡萝卜素和花青素积累,糖作为色素合成的前期原料被大幅降解,因此多糖含量降低,随后果实内各种代谢产物被合成,转化酶活性增强,将光合作用产生的蔗糖转化成果糖和葡萄糖[30],因此在成熟期时枸杞多糖含量又出现上升趋势。
2.1.2 糖醛酸含量测定结果
表2 枸杞不同生长期糖醛酸含量
Table 2 Uronic acid contents of L. barbarum fruit at different growth stages
生长期/d 7 14 21 28 35糖醛酸质量浓度/(mg/mL) 5.18±0.04bB 5.45±0.02bB 5.08±0.02bB 3.64±0.03aA 3.08±0.08aA
糖醛酸是糖苷配基结合的糖醛酸苷形式或聚糖醛酸的形式成为果胶、半纤维素等细胞壁的主要成分,因此它的含量与果实质地有紧密的联系。由表2可知,枸杞不同生长期糖醛酸质量浓度由高到低依次为14 d>7 d>21 d>28 d>35 d,变化范围为3.0~5.5 mg/mL,整体呈现先增高后降低的趋势。7~14 d糖醛酸含量缓慢增长,在第14天达到顶峰,之后又缓慢下降,21 d后出现快速下降的趋势且色变初期之前的3 个阶段与之后到成熟的两个阶段存在极显著差异。青果期时,细胞间的黏着作用主要靠果胶维持,因此糖醛酸的含量会在第14天达到峰值,之后,随着果实逐渐成熟,果胶脱酯降解,胞间胶黏作用降低,细胞壁结构崩塌,果实软化,导致糖醛酸含量急剧下降[31]。
2.1.3 蛋白含量测定结果
表3 枸杞不同生长期蛋白含量
Table 3 Protein contents of L. barbarum fruit at different growth stages
生长期/d 7 14 21 28 35蛋白质量分数/% 6.39±0.03a 6.52±0.03a 6.72±0.01ab 7.76±0.05b 6.91±0.04ab
由表3可知,不同生长期的枸杞可溶性蛋白含量从大到小依次为28 d>35 d>21 d>14 d>7 d,增长趋势与多糖和糖醛酸含量一致,只是蛋白含量在第28天达到峰值,之前一直是缓慢增加,达到峰值后降低。研究表明随着枸杞果实成熟,基质聚糖会发生解聚,而扩展蛋白会使解聚速率增加,从而加速果实软化,同时,辅助蛋白作为在生物质处理中潜在的辅助蛋白质膨胀素,通过降低纤维素的结晶度,也能促进果实软化,因此蛋白含量在第28天达到最高,之后又降低[32]。
2.2 枸杞多糖的分离与纯化
2.2.1 枸杞多糖的离子交换柱层析分离
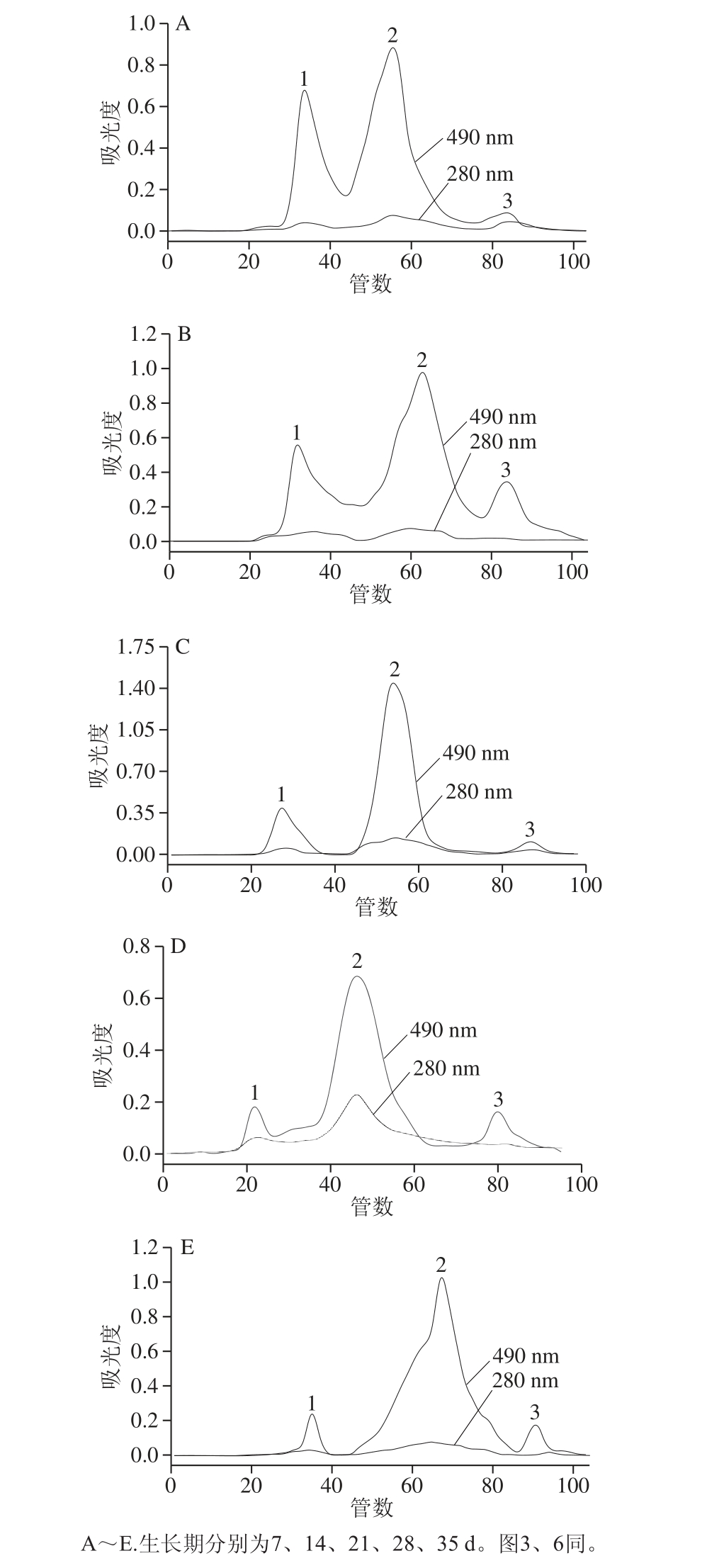
图2 DEAE-650M柱层析洗脱曲线
Fig. 2 Elution curves of polysaccharides from L. barbarum fruit at different growth stages by DEAE-650M column chromatography
分别用0.1、0.3、0.5 mol/L的NaCl磷酸盐缓冲溶液进行梯度洗脱,以管数为横坐标、以吸光度为纵坐标绘制洗脱曲线,分别在280、490 nm波长处测其中蛋白质、多糖的洗脱情况,结果如图2所示。
由图2可知,经该柱层析分离蛋白和多糖均可得到3 个峰,说明它们均由3 种不同的组分构成,分别命名为1、2、3,其中多糖的峰形较蛋白对称良好,蛋白的洗脱峰不是特别明显,但依然可以看出5 个时期的蛋白和多糖几乎在相同的位置出现峰,且峰的形状相似,由此也可验证前面的枸杞多糖是一种蛋白聚糖,也说明采用的梯度洗脱液能较好分离枸杞多糖。同时根据洗脱时的离子强度可知,40 管以前出现的组分1为中性多糖,以后出现的两种多糖组分2、3均为酸性多糖。
2.2.2 枸杞多糖的凝胶柱层析分离
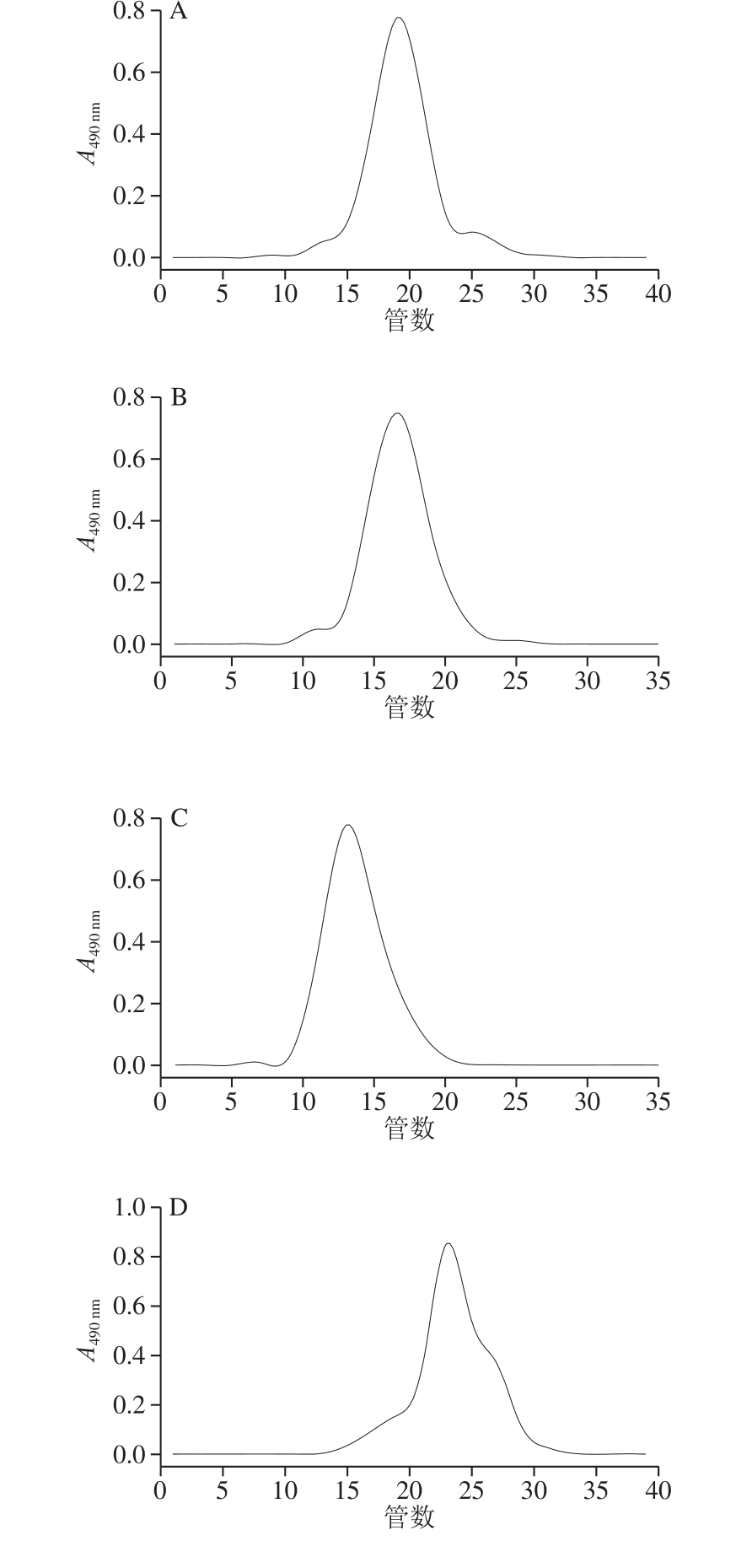
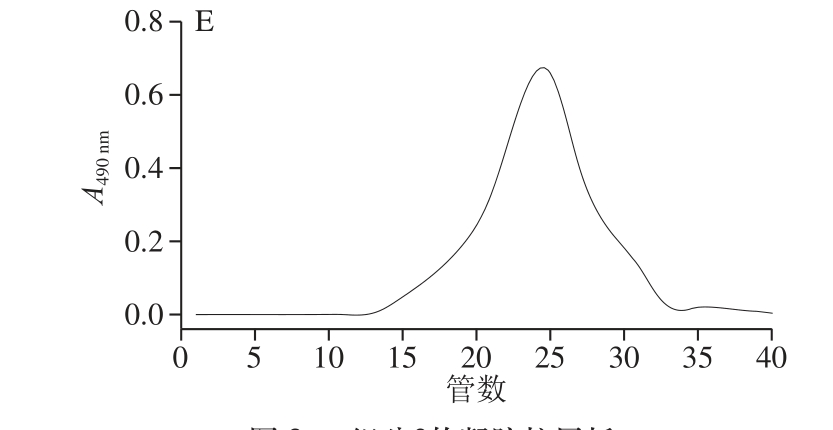
图3 组分2的凝胶柱层析
Fig. 3 Elution curves of component 2 by gel column chromatography
枸杞多糖是一种酸性杂多糖,由于组分3的提取率相对较低,结构分析效果差,且在枸杞整个发育阶段变化不稳定,所以最后将组分2经过浓缩,脱盐,冻干后进行凝胶层析柱纯化(后面全是针对组分2展开实验),如图3所示。发现流出的曲线均呈单一对称峰,说明已纯化为相对分子质量均一的多糖组分。
2.3 多糖的结构分析
2.3.1 不同生长期枸杞多糖分子质量测定结果
结果测得各时期的分子质量依次为10.23、10.59、35.85、6.52 、6.43 kDa,大约分布在6~40 kDa之间,分子质量随枸杞生长发育总体呈现先增高后降低的趋势,起初从幼果期到青果期的增幅不大,到第21天,分子质量激增,并达到最高值,之后又急剧下降。
2.3.2 不同生长期枸杞多糖单糖组成分析结果
将各单糖标准品进行衍生化,以浓度为横坐标,峰面积为纵坐标绘制标准曲线,得到回归方程。将多糖水解样品和单糖混合标准硅烷化后进行GC-MS测定,单糖组成结果如图4所示。
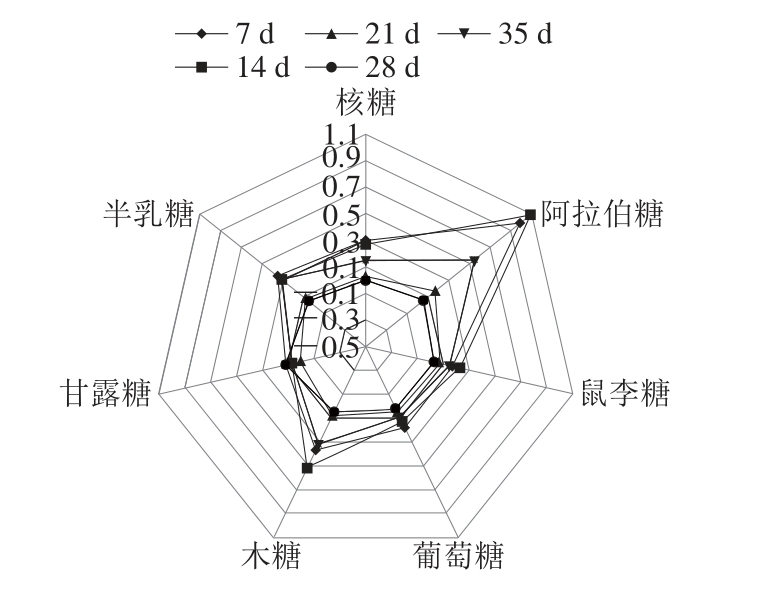
图4 不同生长期枸杞多糖单糖组成物质的量比
Fig. 4 Monosaccharide composition of polysaccharides from L. barbarum fruit at different growth stages
由图4可以看到,各个时期7 种单糖的分布和变化情况,第14天这7 种单糖含量整体最高,其次是7 d,然后是35、21 d,含量最少的是在第28天,但28 d以甘露糖为主,且含量与7 d的持平,其中阿拉伯糖在7、14、21 d和35 d时期均占最大的比例,总体来说甘露糖、葡萄糖和核糖在各个时期含量均较小,从整个生长周期看,各单糖在升高至第14天时出现下降情况,第28天时又升高,基本遵循升高-降低-再升高的趋势。
2.3.3 不同生长期枸杞多糖傅里叶红外光谱测定结果
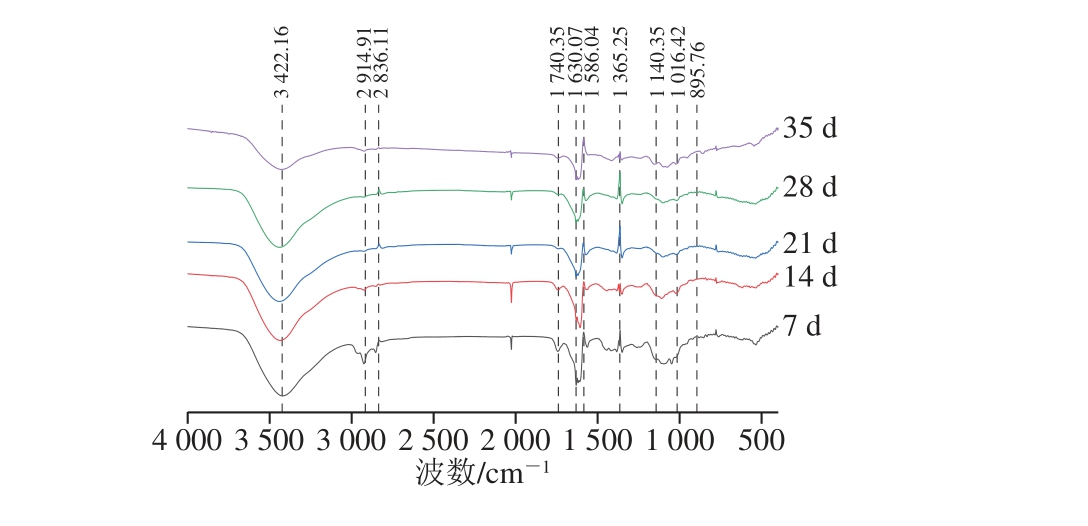
图5 不同生长期枸杞多糖傅里叶红外光谱图
Fig. 5 Infrared spectra of L. barbarum polysaccharides at different growth stages
研究表明在3 600~500 cm-1处具有多糖的特征吸收峰,由图5可以看出,各个时期多糖的分子结构相似,均在3 422.16 cm-1处出现宽而强的—OH伸缩振动吸收峰,是多糖分子上的—OH,也包括分子内或分子间氢键,2 914.91、2 836.11 cm-1为—CH2—或—CH3的C—H伸缩振动,1 740.35 cm-1处有一明显吸收峰,是醛基,为糖上的乙酰基,1 630.07、1 586.04 cm-1为—COOH的C=O伸缩振动吸收峰,1 365.25 cm-1为C—H的变形振动吸收峰,和C—H的伸缩振动都是糖类物质的特征吸收峰,1 140.35 cm-1为C—O—C醚键C—O的伸缩振动,1 016.42 cm-1处的吸收峰为吡喃糖苷,895.76 cm-1处为U-D吡喃糖特征吸收峰,由此可知是该纯化后的多糖为β-吡喃型的酸性多糖,这也验证了离子交换柱层析分离时根据离子强度判断组分2为酸性多糖。
2.3.4 不同生长时期枸杞多糖的热特性
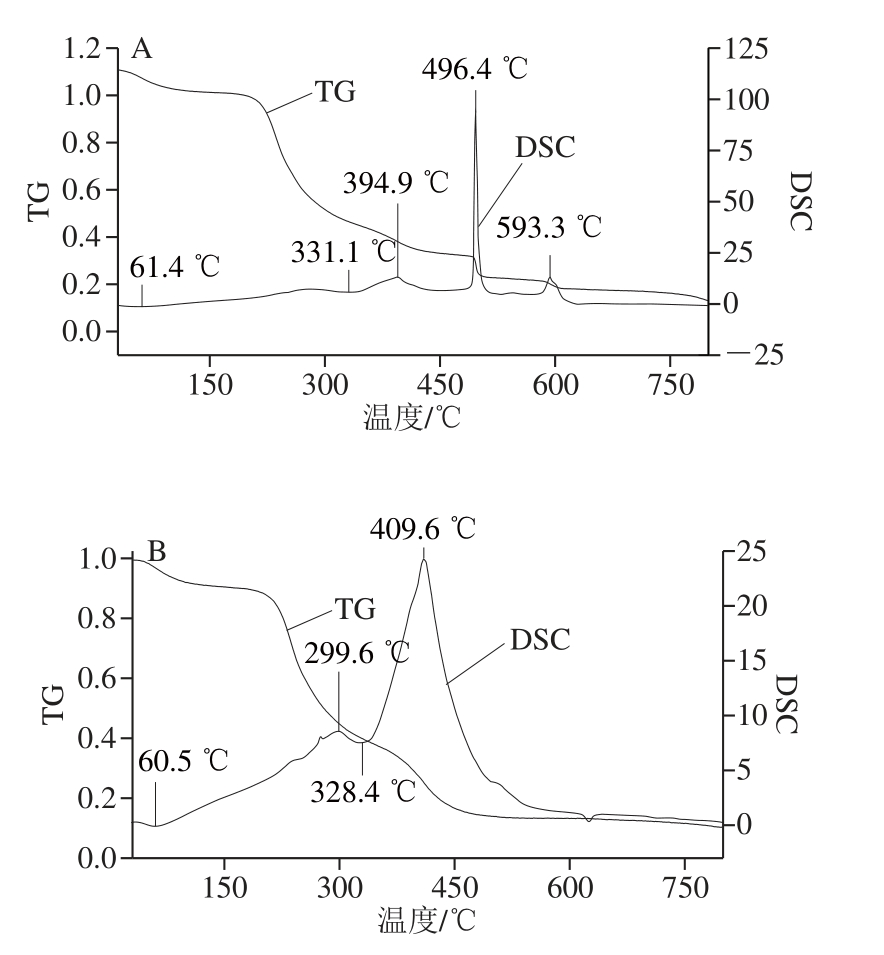

图6 枸杞不同生长期的多糖热分析
Fig. 6 Thermal analysis of L. barbarum polysaccharides at different growth stages
如图6所示,结合TG和DSC曲线可知,各个时期多糖均在390~500 ℃之间有一次大的质量损失,在此温度范围之前和之后各个时期又略有不同,7、14、28、35 d多糖均在50~65 ℃之间有一次小的质量损失,21 d多糖变化不明显,这可能与实验过程中的操作有关系,这次质量损失主要是水分的损失,其中7 d多糖在500 ℃以后也有质量损失,21、28、35 d多糖在700 ℃以后都有较大的质量损失,这主要是多糖结构开始变化造成的损失。各个时期的放热峰均集中在200~500 ℃之间,对应的失重曲线均有较大变化,其中7 d多糖在500 ℃以后还有一个放热峰,35 d多糖在700 ℃以后也存在一个放热峰,吸热峰大多集中在300~400 ℃之间,但7、14、28、35 d多糖均在60 ℃左右多一个吸热峰,14、21、28、35 d多糖又在700 ℃以后还有吸热峰。由此可知各个时期多糖的热特性存在差异,但随着枸杞不断成熟,多糖开始降解,结构发生变化,这与前面的结论一致。
2.3.5 不同生长时期枸杞多糖扫描电子显微镜观察结果由图7可知,多糖结构在各个时期不同,随着枸杞生长发育不断变化,由最初的致密片层逐步变化至松散山峰状直至完全崩塌。第7天时多糖的片层比较完整、致密,表面有卷曲状,放大之后,多糖结构呈卷曲状紧紧的缠绕在一起,卷曲中间都有孔状结构,但表面平整,说明这个时期多糖结构还很完整,第14天时多糖片状表面出现大小不一的孔状,高倍镜下呈现的是一圆柱状,表面致密,卷中孔状缩小,即多糖结构的分子间作用力逐渐增强,第21天时,明显看到片层状开始瓦解,形成的圆柱状表面孔隙变大,开始松散,第28天时,表面片层结构已消失,瓦解成山峰状,高倍镜下,表面结构极其松散,柱状结构开始逐渐消失,到第35天时,多糖结构进一步裂解,以小小的片状聚集体存在。

图7 不同生长时期枸杞多糖扫描电子显微镜
Fig. 7 Scanning electron microscopy images of L. barbarum polysaccharides at different growth stages
3 结 论
本实验通过传统水提法、Sevag法提取各生长时期多糖并脱蛋白后测定粗多糖含量、糖醛酸含量及可溶性蛋白含量,结果表明它们都呈现先增长后降低的趋势,并采用离子交换柱对枸杞多糖进行分离,最终各时期均得到3 种多糖,且都为蛋白聚糖,其中选取提取率高变化稳定的酸性多糖2进行凝胶层析柱纯化,结果显示均为单一对称峰,分离良好。
HPLC结果显示不同生长时期枸杞多糖均为小分子多糖,GC-MS结果显示枸杞多糖主要由阿拉伯糖、鼠李糖、葡萄糖、木糖、甘露糖和半乳糖组成。傅里叶红外光谱结果表明纯化的枸杞多糖是β-吡喃型的酸性多糖。热分析得知各个生长期的多糖热特性相似又各有差异,整体可看作是有2 次质量损失,先是水分脱出造成的,然后是多糖结构裂解。扫描电子显微镜观察多糖结构在各个时期不同,由最初的致密片层逐步变化至松散山峰状直至完全崩塌。这为将来研究枸杞多糖更深层次的性质和结构提供理论参考价值。
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1978, 67(1): 8-18.
[2] 苏宇静, 贺海明, 孙兆军. 中国枸杞资源及其在食品工业中的应用现状和开发前景[J]. 食品科学, 2002, 23(8): 292-294.
[3] 王旭芳. 药食两用的宁夏枸杞[J]. 中国农村科技, 2016(3): 36-38.
[4] 国家药典委员会. 中华人民共和国药典: 一部[S]. 2015版. 北京:中国医药科技出版社, 2015: 249.
[5] 高凯. 宁夏枸杞子的活性成分研究和应用开发[D]. 西安: 第四军医大学, 2014.
[6] ZHANG X R, LI T J, CHENG J P, et al. Immune activities comparison of polysaccharide and polysaccharide-protein complex from Lycium barbarum L.[J]. International Journal of Biological Macromolecules,2014, 65: 441-445. DOI:10.1016/j.ijbiomac.2014.01.020.
[7] WU D T, GUO H, LIN S, et al. Review of the structural characterization, quality evaluation, and industrial application of Lycium barbarum polysaccharides[J]. Trends in Food Science &Technology, 2018, 79: 171-183. DOI:10.1016/j.tifs.2018.07.016.
[8] 王亚军, 安巍, 石志刚, 等. 枸杞药用价值的研究进展[J].安徽农业科学, 2008(30): 13213-13214; 13218. DOI:10.13989/j.cnki.0517-6611.2008.30.092.
[9] AMAGASE H, FARNSWORRTH N R. A review of botanical characteristics, phytochemistry, clinical relevance in efficacy and safety of Lycium barbarum fruit (Goji)[J]. Food Research International, 2011, 44(7): 1702-1717. DOI:10.1016/j.tifs.2018.07.016.
[10] 侯学谦, 祝婉芳, 曲玮. 枸杞化学成分及药理活性研究进展[J]. 海峡药学, 2016, 28(8): 17.
[11] ALESSANDRA M, SIMONE C, MARIA A C, et al. Lycium barbarum polysaccharides: extraction, purification, structural characterisation and evidence about hypoglycaemic and hypolipidaemic effects:a review[J]. Food Chemistry, 2018, 254: 377-389. DOI:10.1016/j.foodchem.2018.01.176.
[12] GONG G P, DANG T T, DENG Y N, et al. Physicochemical properties and biological activities of polysaccharides from Lycium barbarum prepared by fractional precipitation[J]. International Journal of Biological Macromolecules, 2018, 109: 611-618. DOI:10.1016/j.ijbiomac.2017.12.017.
[13] JIN M L, HUANG Q S, ZHAO K, et al. Biological activities and potential health bene fit effects of polysaccharides isolated from Lycium barbarum L.[J]. International Journal of Biological Macromolecules,2013, 54: 16-23. DOI:10.1016/j.ijbiomac.2012.11.023.
[14] 房想. 不同采收期枸杞多糖含量及单糖组成的研究[D]. 银川: 宁夏大学, 2016.
[15] 朱彩平. 枸杞多糖的结构分析及生物活性评价[D]. 武汉: 华中农业大学, 2006.
[16] 高洪霞, 刘军海, 李广录. 枸杞多糖提取工艺的研究[J]. 食品与机械,2008(5): 60-62; 72. DOI:10.13652/j.issn.1003-5788.2008.05.002.
[17] 方积年. 多糖的分离纯化及其纯度鉴别与分子质量测定[J]. 中国药学杂志, 1984(10): 46-49.
[18] DUBIOS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017.
[19] 刘玉明, 钱甜甜, 何颖, 等. 方格星虫多糖中糖醛酸的含量测定[J].时珍国医国药, 2012, 23(5): 1100-1101. DOI:1008-0805(2012)05-1100-02.
[20] 孟宪军, 常瑜, 孙希云, 等. 微波辅助法提取蓝莓多糖BBP0-2的分离纯化及组分分析[J]. 食品科学, 2013, 34(12): 119-124. DOI:10.7506/spkx1002-6630-201312025.
[21] 董文霞, 刘萍, 张京声, 等. DEAE-52纤维素静态法分离纯化桦褐孔菌多糖的工艺优化[J]. 食品工业科技, 2018, 39(4): 154-158; 165.DOI:10.13386/j.issn1002-0306.2018.04.029.
[22] CHEN Z S, TAN B K H, SOO M Y, et al. Activation of macrophages by polysaccharide-protein complex from Lycium barbarum L.[J].Phytotherapy Research, 2008, 8(12): 1663-1671. DOI:10.1002/ptr.2757.
[23] 芮光伟, 李维, 蒙英. 川芎多糖提取及GC-MS法测定其单糖含量及结构分析[J]. 食品科技, 2013, 38(9): 150-152. DOI:10.13684/j.cnki.spkj.2013.09.008.
[24] 刘振华, 王如伟, 何厚洪, 等. 三甲基硅烷衍生化GC-MS研究延胡索中水溶性非生物碱类化学成分[J]. 中国中药杂志, 2012, 3(4): 2108-2112. DOI:10.4268/cjcmm20121416.
[25] 杨永晶, 韩丽娟, 索有瑞. 树莓多糖中单糖组成的GC-MS分析[J].分析试验室, 2015, 34(6): 688-691. DOI:10.13595/j.cnki.issn1000-0720.2015.0149.
[26] 蒋挺大. 糖的红外光谱法[M]//糖复合物生化研究技术. 2版. 杭州:浙江大学出版社, 1999: 193-198.
[27] 倪德江, 陈玉琼, 谢笔钧, 等. 乌龙茶多糖OTPS 2-1的光谱特性、形貌特征及热特性研究[J]. 高等学校化学学报, 2004(12): 2263-2268.
[28] 李珺, 钟耀广, 刘长江. 香菇多糖的纯化及电镜分析[J]. 山西农业科学, 2010, 38(3): 6-9. DOI:1002-2481(2010)03-0006-04.
[29] 郑国琦, 刘根红, 张磊, 等. 宁夏枸杞果实发育过程中淀粉代谢和质体超微结构研究[J]. 西北植物学报, 2014(9): 1782-1788.DOI:10.7606/j.issn.1000-4025.2014.09.1782.
[30] 赵建华, 李浩霞, 尹跃, 等. 不同果色枸杞果实糖积累特征及其与蔗糖代谢酶活性的关系[J]. 西北植物学报, 2016, 36(4): 706-714.DOI:10.7606/j.issn.1000-4025.2016.04.0706.
[31] MOHNEN D. Pectin structure and biosynthesis[J]. Current Opinion in Plant Biology, 2008, 11(3): 266-277. DOI:10.1016/j.bi.2008.03.006.
[32] NIKOLAOS G, NIKOLAOS N, DANIEL J, et al. Biochemical analysis of expansin-like proteins from microbes[J]. Carbohydrate Polymers, 2014, 100: 17-23. DOI:10.1016/j.carbpol.2013.04.094.