草果(Amomum tsaoko Crevost et Lemaire)属于姜科豆蔻属多年生草本植物,主产国为中国和越南;在中国主要种植于云南、广西、贵州等省,其中云南省的种植面积和产量最大,占我国的90%以上[1],而云南省中又以怒江州的种植面积最大,据州政府提供的资料显示到2017年全州草果种植面积达到103万 亩,草果鲜果年产量达2.96万 t;在越南主要种植于越南北部,如老街、安培、莱州等传统产区。
干草果在外形上与拟草果和草豆蔻相似,容易混淆;草果与拟草果为同科同属植物,但是二者新鲜的果实颜色不同,新鲜成熟的草果果实为红色,而新鲜成熟的拟草果果实为白绿色带少许红色[2];从显微结构和薄层层析看,草果与草豆蔻的区别比较明显[3]。草果既是中草药,也是香料植物;作为中药材,由于它具有多种多酚类成分[4],具有抑菌、抗氧化等生物活性[5-6],属于药食同源的品种[7]。香气是草果的重要感官指标之一,1971年日本对草果精油的成分进行了研究,从中只鉴定出了1,8-桉叶素和壬酸,从1975年开始我国的科研人员开始研究草果精油中的化学成分[8]。
提取草果中香气成分的方法主要有水蒸气蒸馏法[9]、溶剂萃取法[10]、超临界二氧化碳萃取法[11]、固相微萃取法[12],在定性方面多数都只采用质谱一种方法进行定性,在定量方面多数采用面积归一化法进行定量,且相关文献大都分析干草果中的挥发性成分,关于新鲜草果中的挥发性成分分析较少[13]。目前国际上公认的提取挥发性成分比较好的方法是溶剂萃取结合溶剂辅助风味成分蒸发[14-15],本实验采用该方法提取新鲜草果的挥发性成分,利用气相色谱-质谱-嗅觉(gas chromatographymass spectrometry-olfactometry,GC-MS-O)检测器联用仪对提取物进行分析,鉴定新鲜草果中的香气活性成分,采用内标法对香气活性成分进行定量,利用定量结果和文献报道的香气活性成分的阈值计算出它们的香气活性值,鉴定新鲜草果中的关键香气成分,旨在为评价草果等级、对比新鲜草果与干草果香气差别以及确定草果较佳干燥方法提供参考。
1 材料与方法
1.1 材料与试剂
新鲜草果采自云南怒江,采摘后空运到实验室,冷藏。
(+)-α-蒎烯(98%)、正己醛(97%)、月桂烯(>90%)、β-蒎烯(≥95%) 上海麦克林生化科技有限公司;柠檬烯(95%)、芳樟醇(98%)、α-松油醇(97%)、(-)-4-萜品醇(97%) 北京百灵威科技有限公司;桉叶油醇(99%)、橙花醛(99%)、反-橙花叔醇(99%) 北大正元科技有限公司;反-2-辛烯醛(>95%)、(R,R)-(-)-2,3-丁二醇(>97%)、β-石竹烯(>90%)、反-2-癸烯醛(>93%)、萜品油烯(>90%) 梯希爱化成工业发展有限公司;3-羟基-2-丁酮(97%) 上海阿达玛斯试剂有限公司;C6~C30正构烷烃(色谱纯) 美国Supelco公司;二氯甲烷、氯化钠、无水硫酸钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
7890B型气相色谱仪、5977A型质谱仪 美国安捷伦公司;Sniffer3000型嗅觉检测器 德国Gerstel公司;JYL-CO12型粉碎机 九阳股份有限公司;EDWARDS涡轮分子泵 英国Edwards公司;溶剂辅助风味成分蒸发所用玻璃仪器 莘县京兴玻璃器皿有限公司;SYC型超级恒温水槽 巩义市予华仪器有限责任公司。
1.3 方法
1.3.1 样品前处理
将新鲜草果壳与草果种仁分开,把新鲜草果种仁放入250 mL烧杯中,向烧杯中加入液氮,待液氮挥发完后,使用粉碎机将冷冻过的新鲜草果种仁粉碎。取25 g粉碎后的新鲜草果种仁和60 mL二氯甲烷放入250 mL玻璃瓶中,在摇床上于室温下以180 r/min萃取40 min,萃取结束后,进行过滤,得到滤液I和新鲜草果种仁滤饼;将新鲜草果种仁滤饼再加入玻璃瓶中,向玻璃瓶中加入60 mL重蒸的二氯甲烷,重复上面操作,过滤后得到滤液II,合并滤液I和滤液II得到新鲜草果种仁萃取液。
采用溶剂辅助风味成分蒸发将得到的新鲜草果种仁萃取液中挥发性成分与非挥发性成分分离;其中蒸发瓶一侧使用40 ℃水浴进行加热,接收瓶一侧采用液氮冷凝,控制真空泵的压力在10-5 mbar左右。实验结束后,取下接收瓶,恢复到室温,向接收瓶中加入无水硫酸钠,对得到的溜出物进行干燥。用韦氏蒸馏柱将干燥后的溜出物浓缩至5 mL左右,然后用氮吹浓缩至0.5 mL,用于分析。
采用同样的处理方法处理新鲜草果壳,得到新鲜草果壳中的挥发性成分提取物。
1.3.2 GC-MS-O分析条件
气相色谱条件:采用HP-5MS(30.0 m×250 μm,0.25 μm)和DB-WAX(30.0 m×250 μm,0.25 μm)型2 种极性不同的毛细管色谱柱对得到的提取物进行分析;采用程序升温,DB-WAX色谱柱起始温度为35 ℃(保持2 min),以10 ℃/min升至230 ℃(保持30 min);HP-5MS色谱柱起始温度为35 ℃(保持2 min),以8 ℃/min升至225 ℃(保持20 min);采用流量为1.0 mL/min的氦气作为载气,进样口和传输线温度均为250 ℃,进样量1 μL,使用不分流模式进样;萃取物中的组成成分经过毛细管色谱柱分离后以1∶2的比例分别进入质谱检测器和嗅觉检测器。
质谱条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;使用Scan扫描模式;质量扫描范围33~350 u。
嗅觉检测条件:嗅闻口温度220 ℃,为保证质谱与嗅觉检测器同时检测挥发性成分,使用氮气作为补充气;嗅闻口通入湿空气,以免嗅闻人员的鼻黏膜脱水,减轻嗅觉疲劳,保持嗅觉灵敏度。经过训练的嗅闻人员对从嗅觉检测器流出的成分进行嗅闻,记录保留时间和嗅闻到的香气特征。
1.3.3 定性与定量
定性分析:采用与标准品的香气特征、质谱和保留指数进行比对的方法对挥发性组分进行肯定定性;如果标准品不易市购,则采用香气特征、质谱或保留指数与文献报道的数据相比对,对成分进行尝试性定性。
定量分析:采用内标法,以2-辛醇、2-异丙基苯酚为内标,对鉴定出的香气活性物质进行定量。
1.3.4 香气活性值的计算
香气活性值(odor activity value,OAV)指香气活性成分在样品中的浓度是其自身阈值的倍数,即新鲜草果中鉴定出的香气活性物质浓度与其阈值的比值;OAV大于1的物质被认为是对新鲜草果香气贡献大的关键香气成分。
2 结果与分析
2.1 新鲜草果提取物的香气评价
用评香条蘸取1~2 cm新鲜草果种仁和草果壳提取物,嗅闻其香气特征,发现各自提取物的香气特征与原料的香气接近(其中新鲜草果种仁提取物的香气强度大于草果壳提取物的香气强度),证明通过溶剂直接萃取结合溶剂辅助风味成分蒸发,已经将样品中的重要香气成分提取出来。
2.2 新鲜草果中鉴定出的香气活性物质分析
使用GC-MS-O对得到的提取物进行分析,虽然质谱可以检测到的成分有46 种,但是采用香气特征、质谱、保留指数和标准品只对能够嗅闻到香气的成分进行定性,从新鲜草果壳和新鲜草果种仁中共鉴定出28 种香气活性成分,其中新鲜草果壳中27 种,新鲜草果种仁中24 种,二者共有成分21 种,结果见表1。
表1 在新鲜草果壳和新鲜草果种仁中鉴定出的香气活性成分
Table 1 Odor-active compounds identifified in the pericarps and seed kernels of fresh A. tsaoko
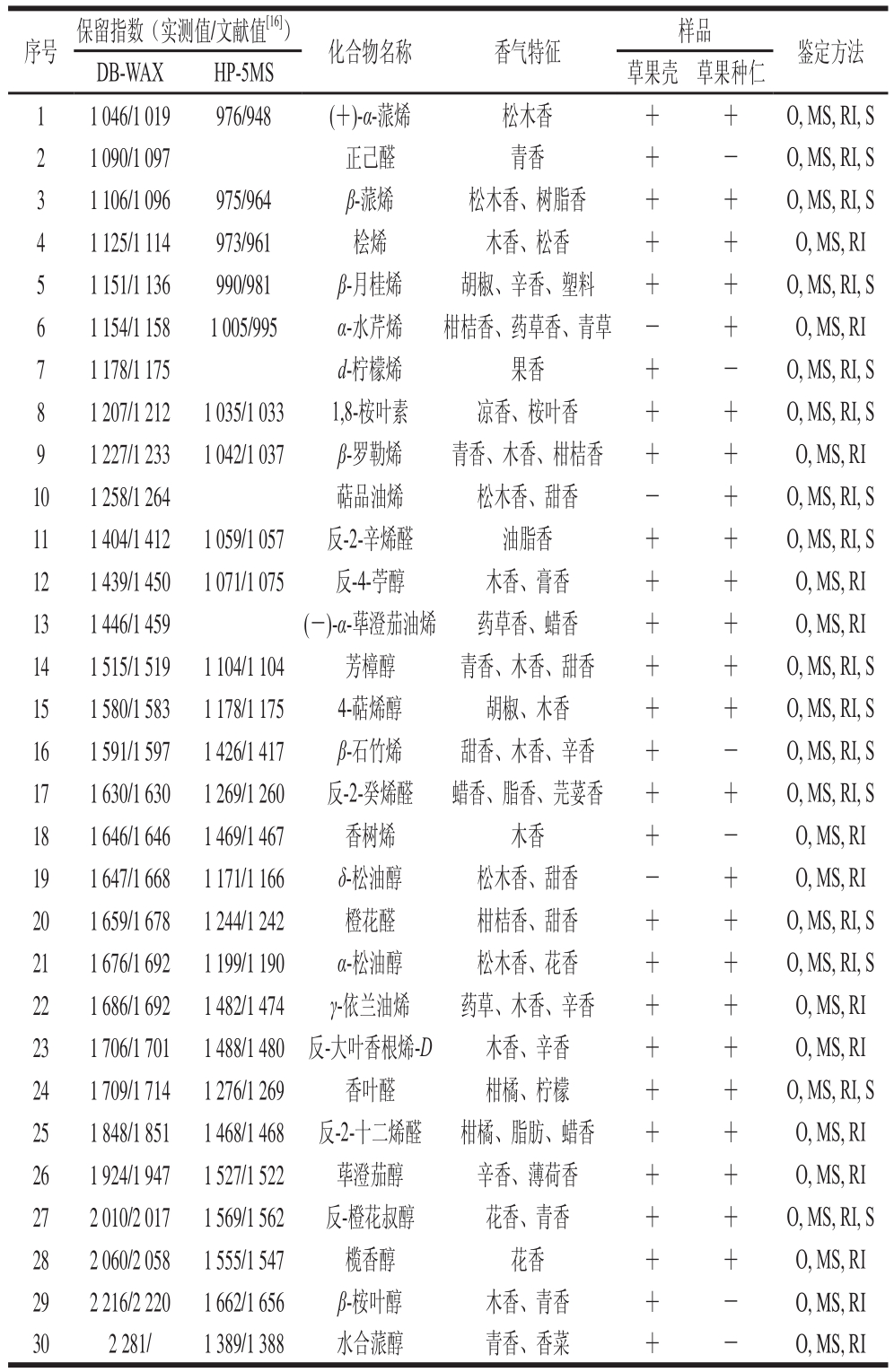
注:+.鉴定出;-.未鉴定出;MS.质谱测定;O.香气特征测定;S.标准品测定。
序号 保留指数(实测值/文献值[16]) 化合物名称 香气特征 样品 鉴定方法DB-WAX HP-5MS 草果壳 草果种仁1 1 046/1 019 976/948 (+)-α-蒎烯 松木香 + + O, MS, RI, S 2 1 090/1 097 正己醛 青香 + - O, MS, RI, S 3 1 106/1 096 975/964 β-蒎烯 松木香、树脂香 + + O, MS, RI, S 4 1 125/1 114 973/961 桧烯 木香、松香 + + O, MS, RI 5 1 151/1 136 990/981 β-月桂烯 胡椒、辛香、塑料 + + O, MS, RI, S 6 1 154/1 158 1 005/995 α-水芹烯 柑桔香、药草香、青草 - + O, MS, RI 7 1 178/1 175 d-柠檬烯 果香 + - O, MS, RI, S 8 1 207/1 212 1 035/1 033 1,8-桉叶素 凉香、桉叶香 + + O, MS, RI, S 9 1 227/1 233 1 042/1 037 β-罗勒烯 青香、木香、柑桔香 + + O, MS, RI 10 1 258/1 264 萜品油烯 松木香、甜香 - + O, MS, RI, S 11 1 404/1 412 1 059/1 057 反-2-辛烯醛 油脂香 + + O, MS, RI, S 12 1 439/1 450 1 071/1 075 反-4-苧醇 木香、膏香 + + O, MS, RI 13 1 446/1 459 (-)-α-荜澄茄油烯 药草香、蜡香 + + O, MS, RI 14 1 515/1 519 1 104/1 104 芳樟醇 青香、木香、甜香 + + O, MS, RI, S 15 1 580/1 583 1 178/1 175 4-萜烯醇 胡椒、木香 + + O, MS, RI, S 16 1 591/1 597 1 426/1 417 β-石竹烯 甜香、木香、辛香 + - O, MS, RI, S 17 1 630/1 630 1 269/1 260 反-2-癸烯醛 蜡香、脂香、芫荽香 + + O, MS, RI, S 18 1 646/1 6461 469/1 467 香树烯 木香 + - O, MS, RI 19 1 647/1 668 1 171/1 166 δ-松油醇 松木香、甜香 - + O, MS, RI 20 1 659/1 678 1 244/1 242 橙花醛 柑桔香、甜香 + + O, MS, RI, S 21 1 676/1 692 1 199/1 190 α-松油醇 松木香、花香 + + O, MS, RI, S 22 1 686/1 692 1 482/1 474 γ-依兰油烯 药草、木香、辛香 + + O, MS, RI 23 1 706/1 701 1 488/1 480 反-大叶香根烯-D 木香、辛香 + + O, MS, RI 24 1 709/1 714 1 276/1 269 香叶醛 柑橘、柠檬 + + O, MS, RI, S 25 1 848/1 851 1 468/1 468 反-2-十二烯醛 柑橘、脂肪、蜡香 + + O, MS, RI 26 1 924/1 947 1 527/1 522 荜澄茄醇 辛香、薄荷香 + + O, MS, RI 27 2 010/2 017 1 569/1 562 反-橙花叔醇 花香、青香 + + O, MS, RI, S 28 2 060/2 058 1 555/1 547 榄香醇 花香 + + O, MS, RI 29 2 216/2 220 1 662/1 656 β-桉叶醇 木香、青香 + - O, MS, RI 30 2 281/ 1 389/1 388 水合蒎醇 青香、香菜 + - O, MS, RI
在鉴定出的30 种香气活性成分中有烯烃13 种、醇10 种、醛6 种、醚1 种。13 种烯烃化合物分别为(+)-α-蒎烯、β-蒎烯、桧烯、β-月桂烯、α-水芹烯、d-柠檬烯、β-罗勒烯、萜品油烯、(-)-α-荜澄茄油烯、β-石竹烯、香树烯、γ-依兰油烯、反-大叶香根烯-D,它们都是萜烯类化合物,其中(+)-α-蒎烯、β-蒎烯、桧烯、β-月桂烯、α-水芹烯、d-柠檬烯、β-罗勒烯和萜品油烯(α-蒎烯、β-蒎烯、桧烯、α-水芹烯和d-柠檬烯曾在新鲜的草果中被鉴定出来[13])是一萜烯类化合物,互为同分异构体,分子式都为C10H16;(-)-α-荜澄茄油烯、β-石竹烯、香树烯、γ-依兰油烯和反-大叶香根烯-D都为倍半萜烯类化合物,也都为同分异构体,分子式都为C15H24。萜烯类化合物广泛存在于植物中,由植物自身合成,一般有2 种合成途径,一种是甲羟戊酸途径,以乙酰辅酶A为原料合成异戊二烯焦磷酸和二甲烯丙基焦磷酸的一条代谢途径,最终可以合成倍半萜和三萜;另一种是2-C-甲基-D-赤藓糖醇-4-磷酸途径,以丙酮酸和3-磷酸甘油醛为起始原料,最终可以合成出半萜、单萜、二萜、四萜和多萜[17]。这些萜烯类化合物都具有一定的生物活性,对其正常生长与代谢具有保护作用,如柠檬烯具有广谱抗菌性,可显著抑制革兰氏阳性菌、革兰氏阴性菌及真菌的活性,其中对容易污染食品的金黄色葡萄球菌、大肠杆菌、假单胞菌和枯草芽孢杆菌等细菌均有较好的抑制作用,d-柠檬烯对真菌的抑制作用比精油更强[18];α-蒎烯或β-蒎烯具有抑菌、抗肿瘤、抗病毒、抗炎症、抗胃溃疡、抗郁抑症、抗氧化、镇痛等生物及医药活性[19];反-大叶香根烯-D、蒎烯和β-石竹烯都具有一定的清除自由基的能力[20]。
鉴定出的10 种醇类香气活性化合物分别为反-4-苧醇、芳樟醇、4-萜烯醇、δ-松油醇、α-松油醇、荜澄茄醇、反-橙花叔醇、榄香醇、β-桉叶醇和水合蒎醇,其中反-4-苧醇、芳樟醇、4-萜烯醇、δ-松油醇和α-松油醇为同分异构体,分子式都为C10H18O,由焦磷酸异戊烯醇酯和二磷酸-3-甲基-2-丁烯醇酯在生物体内在酶的作用下发生分子间缩合得到中间体二磷酸香叶酯,它是形成很多萜烯类化合物的前体物[21-22],柠檬烯和芳樟醇在生物体内在酶的作用下可以转化成α-松油醇[23],在一定条件下这些萜烯醇之间会发生相互转化。荜澄茄醇、反-橙花叔醇、榄香醇和β-桉叶醇是同分异构体,分子式都为C15H26O。鉴定出的6 种醛类香气活性化合物分别为正己醛、反-2-辛烯醛、反-2-癸烯醛、橙花醛、香叶醛和反-2-十二烯醛,其中脂肪醛的产生与不饱和脂肪酸的降解有关,如亚油酸发生自动氧化反应可生成正己醛和反-2-辛烯醛[24];香叶醛和橙花醛为顺反异构体,香叶醛可以由类胡萝卜素(如番茄红素)通过自氧化反应产生[25]。只鉴定出了1,8-桉叶素一种醚类香气活性化合物,它可由焦磷酸香叶醇酯在1,8-桉叶素环化酶的催化作用下生成[26]。
2.3 新鲜草果中鉴定出香气活性物质的定量结果
以2-辛醇和2-异丙基苯酚作内标,对从新鲜草果壳和草果种仁中鉴定出的香气活性物质进行定量,结果见表2。只对27 种香气活性成分进行定量,其中对新鲜草果壳中23 种成分进行定量,对种仁中16 种成分进行定量;因为在进行GC-MS-O分析时,没有被定量的成分能够通过嗅觉检测器被人的嗅觉感知到,但是它们在质谱检测器上的响应较低,得不到明显的色谱峰,所以无法对其进行定量。虽然对新鲜草果壳中定量的香气成分数量多(23 种),但是新鲜种仁中香气活性成分的总含量(16 997.80 mg/kg)大于新鲜果壳中所含香气活性成分的总含量(255.08 mg/kg),这可能是新鲜种仁的香气强度大于新鲜果壳的香气强度的原因(嗅闻整个新鲜的草果时,香气很弱)。在烯烃类香气活性成分中,果壳中含量最高的为β-蒎烯(48.91 mg/kg,占总含量的19.17%),种仁中含量最高的为(+)-α-蒎烯(1 860.79 mg/kg,占总含量的10.95%),与何俏明等[27]分析云南和广西南宁产干草果果仁及果壳中挥发性成分结果相同。果壳和种仁含量最高的醇类香气成分均为α-松油醇,其中在果壳中含量为8.46 mg/kg,在种仁中的含量为843.51 mg/kg,约为果壳的100 倍。在醛类香气活性成分中,果壳中含量最高的为反-2-十二烯醛(14.67 mg/kg,占总含量的5.75%),而它在种仁中含量较低,它的形成与不饱和脂肪酸的氧化有关,果壳中含量高可能与果壳和空气直接接触有一定关系;种仁中含量最高的为香叶醛(2 649.98 mg/kg,占总含量的15.59%),而它在果壳中含量较低,可能主要在草果内部组织形成。1,8-桉叶素在新鲜果壳和种仁中的含量均最高,与文献报道的其他产地的草果果仁及果壳中挥发性成分的分析结果相同[22]。在实际应用中,为将草果的香气成分释放出来,建议粉碎后使用。
表2 新鲜草果壳和种仁中的香气活性成分含量
Table 2 Concentrations of odor-active compounds in the pericarps and seed kernels of fresh A. tsaoko
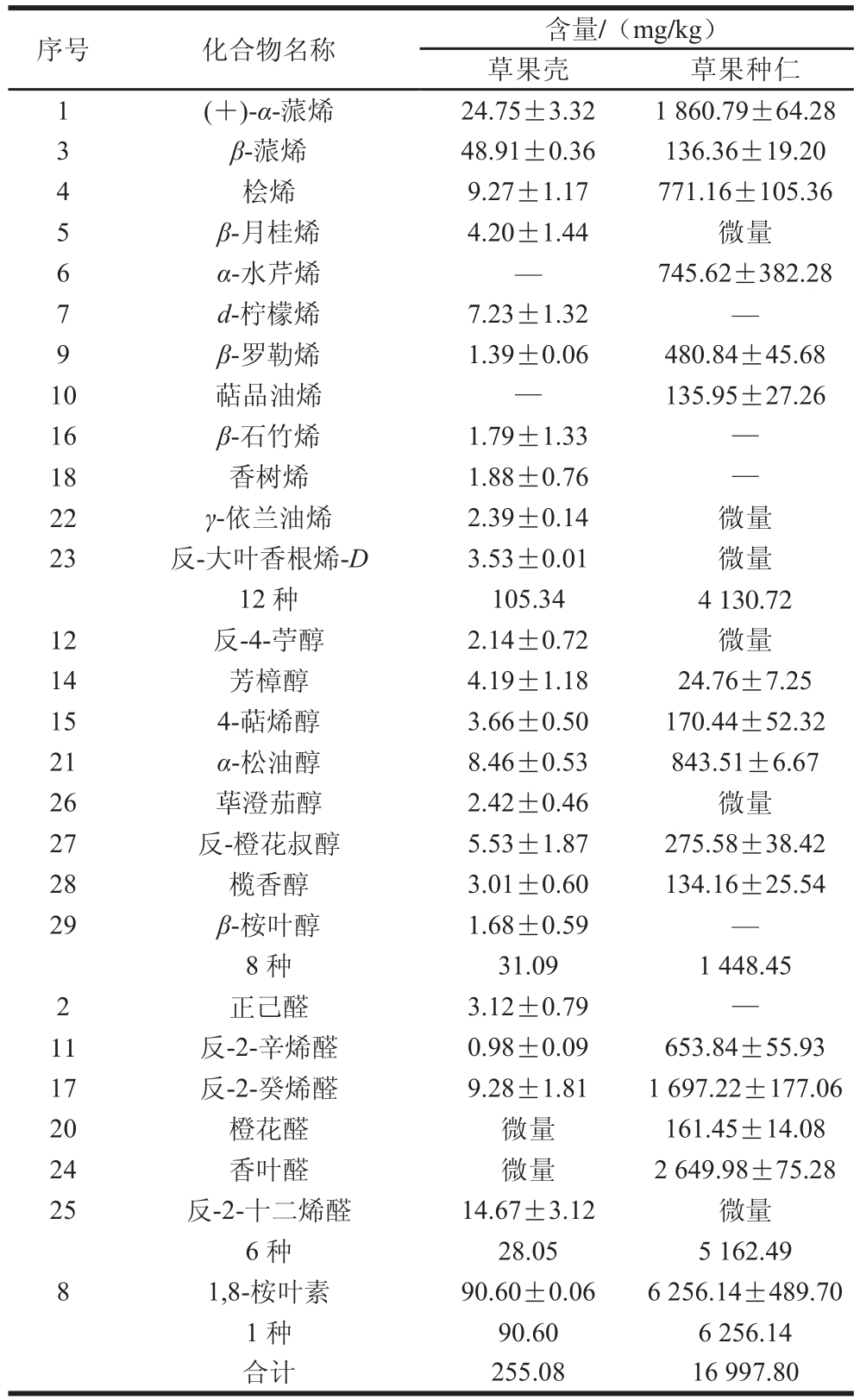
注:微量表示香气活性成分能够被人的嗅觉所感知,但在质谱检测器上响应较低,没有给出明显的色谱峰,无定量;—.未鉴定出。
序号 化合物名称 含量/(mg/kg)草果壳 草果种仁1(+)-α-蒎烯 24.75±3.32 1 860.79±64.28 3 β-蒎烯 48.91±0.36 136.36±19.20桧烯 9.27±1.17 771.16±105.36 5 β-月桂烯 4.20±1.44 微量6 α-水芹烯 — 745.62±382.28 7 d-柠檬烯 7.23±1.32 —9 β-罗勒烯 1.39±0.06 480.84±45.68 10 萜品油烯 — 135.95±27.26 16 β-石竹烯 1.79±1.33 —18 香树烯 1.88±0.76 —22 γ-依兰油烯 2.39±0.14 微量23 反-大叶香根烯-D 3.53±0.01 微量12 种 105.34 4 130.72 12 反-4-苧醇 2.14±0.72 微量14 芳樟醇 4.19±1.18 24.76±7.25 15 4-萜烯醇 3.66±0.50 170.44±52.32 21 α-松油醇 8.46±0.53 843.51±6.67 26 荜澄茄醇 2.42±0.46 微量27 反-橙花叔醇 5.53±1.87 275.58±38.42 28 榄香醇 3.01±0.60 134.16±25.54 29 β-桉叶醇 1.68±0.59 —8 种 31.09 1 448.45 2正己醛 3.12±0.79 —11 反-2-辛烯醛 0.98±0.09 653.84±55.93 17 反-2-癸烯醛 9.28±1.81 1 697.22±177.06 20 橙花醛 微量 161.45±14.08 24 香叶醛 微量 2 649.98±75.28 25 反-2-十二烯醛 14.67±3.12 微量6 种 28.05 5 162.49 8 1,8-桉叶素 90.60±0.06 6 256.14±489.70 1 种 90.60 6 256.14合计 255.08 16 997.80 4
2.4 新鲜草果中香气活性成分的OAV
OAV常被用来判断一种香气活性成分对样品的香气贡献大小,为了确定新鲜草果壳和种仁中的香气活性成分对样品的香气贡献,根据定量结果和它们各自的阈值,计算OAV,结果见表3。
表3 新鲜草果壳和种仁中的香气活性成分的OOAAVV
Table 3 Odor activity values of odor-active compounds in the pericarps and seed kernels of freshA. tsaaookkoo
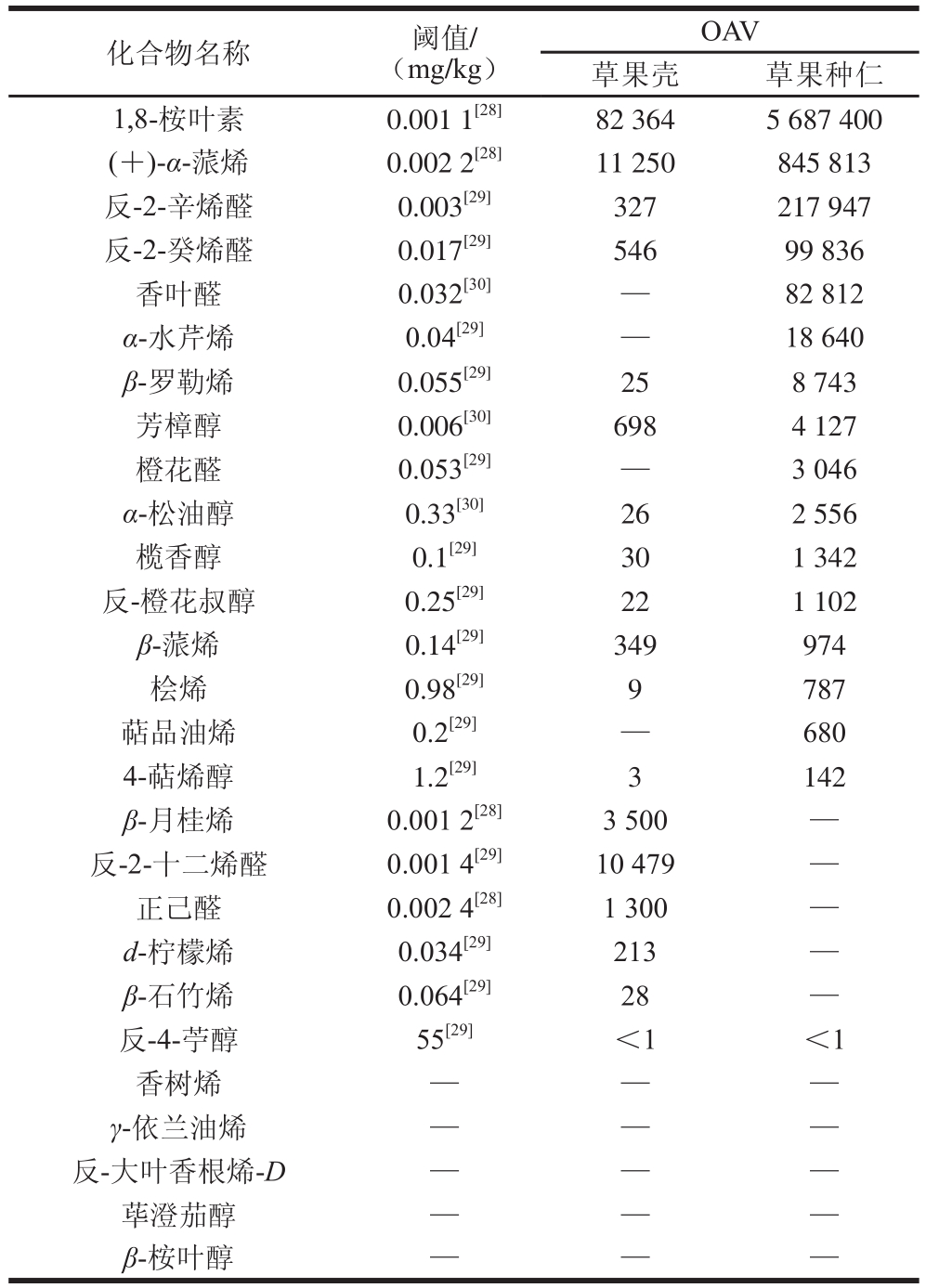
注:—.未查到或无法计算。
OAV草果壳 草果种仁1,8-桉叶素 0.001 1[28] 82 364 5 687 400(+)-α-蒎烯 0.002 2[28] 11 250 845 813反-2-辛烯醛 0.003[29] 327 217 947反-2-癸烯醛 0.017[29] 546 99 836香叶醛 0.032[30] — 82 812 α-水芹烯 0.04[29] — 18 640 β-罗勒烯 0.055[29] 25 8 743芳樟醇 0.006[30] 698 4 127橙花醛 0.053[29] — 3 046 α-松油醇 0.33[30] 26 2 556榄香醇 0.1[29] 30 1 342反-橙花叔醇 0.25[29] 22 1 102 β-蒎烯 0.14[29] 349 974桧烯 0.98[29] 9 787萜品油烯 0.2[29] — 680 4-萜烯醇 1.2[29] 3 142 β-月桂烯 0.001 2[28] 3 500 —反-2-十二烯醛 0.001 4[29] 10 479 —正己醛 0.002 4[28] 1 300 —d-柠檬烯 0.034[29] 213 —β-石竹烯 0.064[29] 28 —反-4-苧醇 55[29] <1 <1香树烯 — — —γ-依兰油烯 — — —反-大叶香根烯-D — — —荜澄茄醇 — — —β-桉叶醇 — — —化合物名称 阈值/(mg/kg)
由表3可知,共计算22 种香气活性成分的OAV,其中新鲜草果壳中20 种,新鲜草果种仁中19 种;由于香树烯、γ-依兰油烯、反-大叶香根烯-D、荜澄茄醇和β-桉叶醇的阈值未见文献报道,它们的标准品无法市购,在实验室也很难合成,无法测定它们的阈值,所以没有计算这5 种香气活性成分的OAV;反-4-苧醇在草果壳和种仁中的OAV都小于1。
在新鲜草果壳中OAV大于1的香气活性成分有17 种,它们是新鲜草果壳的关键香气成分;其中OAV>10 000为1,8-桉叶素、(+)-α-蒎烯和反-2-十二烯醛3 种,10 000>OAV>1 000为β-月桂烯和正己醛2 种,1 000>OAV>100为芳樟醇、反-2-癸烯醛、β-蒎烯、反-2-辛烯醛和d-柠檬烯5 种,100>OAV>10为榄香醇、β-石竹烯、α-松油醇、β-罗勒烯和反-橙花叔醇5 种,10>OAV>1为桧烯和4-萜烯醇2 种。
在新鲜草果种仁中OAV大于1的香气活性成分有16 种,它们是新鲜草果种仁的关键香气成分;其中OAV>10 000为1,8-桉叶素、(+)-α-蒎烯、反-2-辛烯醛、反-2-癸烯醛、香叶醛和α-水芹烯6 种,10 000>OAV>1 000为β-罗勒烯、芳樟醇、橙花醛、α-松油醇、榄香醇和反-橙花叔醇6 种,1 000>OAV>100为β-蒎烯、桧烯、萜品油烯和4-萜烯醇4 种。
对比新鲜草果壳和种仁中的关键香气成分发现二者共有的香气活性成分有12 种,它们使得新鲜草果壳和种仁的香气具有相同之处,而它们在种仁中的OAV都大于果壳,这应该是新鲜草果种仁的香气强度大于果壳的香气强度的原因。然而果壳和种仁中各自都有一些OAV大于1的特征成分(如香叶醛、α-水芹烯、橙花醛和萜品油烯在种仁中的OAV大于1,而在果壳中的OAV小于1;反-2-十二烯醛、β-月桂烯、正己醛、d-柠檬烯和β-石竹烯在果壳中的OAV大于1,而在种仁中的OAV小于1),这些成分使得它们的香气又有所不同;如在新鲜草果壳中OAV为1 300的正己醛没有在种仁中鉴定出来,这也是新鲜草果壳具有明显青香的原因之一。
结合OAV和关键香气成分的香气特征可知,新鲜草果壳的香气主要由1,8-桉叶素、(+)-α-蒎烯、反-2-十二烯醛、β-月桂烯和正己醛赋予,新鲜草果种仁的香气主要由1,8-桉叶素、(+)-α-蒎烯、反-2-辛烯醛、反-2-癸烯醛、香叶醛、α-水芹烯、β-罗勒烯、芳樟醇、橙花醛、α-松油醇、榄香醇和反-橙花叔醇赋予;其中1,8-桉叶素、(+)-α-蒎烯和不饱和烯醛对它们的香气贡献都较大,而1,8-桉叶素具有强烈的桉树叶气息,(+)-α-蒎烯具有松木香,在某种程度上限制了新鲜草果在食品中的直接应用。1,8-桉叶素和(+)-α-蒎烯既是重要的香料,也可以用作中间体合成其他重要香料和药品。作为挥发性成分,这些重要的香气活性成分都曾在干草果中被鉴定出来;谷风林等[31]对产自云南不同地区的13 种干草果中的挥发性成分进行了分析,虽然不同地区的干草果中挥发性成分有所不同,但相对含量比较高的均为1,8-桉叶素、香叶醛、橙花醛、反-2-癸烯醛、反-2-十二烯醛。胡剑等[32]研究了采用自然晾干、55 ℃烘干、冷冻干燥以及煤火熏干4 种处理方式干燥的怒江干草果中果壳和种仁中的挥发性成分,在4 种干燥方法中,与其他3 种处理方法相比,熏干处理的果壳和种仁中挥发性成分种类偏多,但对应化合物的含量偏低;同一化合物在种仁中的相对含量明显高于在果壳中的含量,在鉴定出的成分中1,8-桉叶素和反-2-十二烯醛的相对含量较高。由于生长环境有所不同,草果的果实形态、果长、果宽、平均单果质量等方面会有所不相同,但是经过研究发现其中的主要的挥发性香气成分均为1,8-桉叶素、香叶醛、橙花醛、反-2-癸烯醛、反-2-十二烯醛[12]。根据研究结果和相关文献报道可知草果的主要香气成分为1,8-桉叶素和醛类化合物,为了拓展草果及其制品在食品中的应用,可考虑通过精深加工提高草果的香气质量。
3 结 论
采用溶剂直接萃取结合溶剂辅助风味成分蒸发的方法提取了产自云南怒江的新鲜草果壳和新鲜草果种仁中的挥发性成分,利用GC-MS-O对所得提取物进行分析,通过与标准品的香气特征、质谱和保留指数进行比对的方法对香气活性成分进行定性,共鉴定出30 种香气活性成分,其中烯烃13 种、醇10 种、醛6 种、醚1 种。
利用2-辛醇、2-异丙基苯酚为内标对鉴定出的27 种香气活性物质进行定量分析,定量结果表明香气活性成分在新鲜草果种仁中的含量高于在新鲜草果壳中的含量。
根据定量结果和阈值,计算22 种香气活性成分的OAV,在新鲜草果壳中有17 种香气活性成分的OAV大于1,在新鲜草果种仁中有16 种香气活性成分的OAV大于1,它们是新鲜草果的关键香气物质。其中1,8-桉叶素、(+)-α-蒎烯、反-2-辛烯醛、反-2-癸烯醛、β-罗勒烯、芳樟醇、α-松油醇、榄香醇、反-橙花叔醇、β-蒎烯、桧烯和4-萜烯醇是新鲜草果壳和种仁共有的关键香气物质,其使二者香气具有相似之处;而香叶醛、α-水芹烯、橙花醛、萜品油烯、反-2-十二烯醛、β-月桂烯、正己醛、d-柠檬烯和β-石竹烯是导致二者香气有所不同的主要成分。
[1] 杨志清, 徐绍忠, 张薇, 等. 云南草果茎叶挥发油含量及主要化学成分分析[J]. 中药材, 2019, 42(2): 339-343. DOI:10.13863/j.issn1001-4454.2019.02.022.
[2] 黄云峰, 覃兰芳, 胡琦敏, 等. 广西红草果与白草果挥发油的GC-MS分析[J]. 现代中药研究与实践, 2014, 28(2): 22-24. DOI:10.13728/j.1673-6427.2014.02.011.
[3] 余南才, 叶明波. 草果与草豆蔻的鉴别比较[J]. 中国医院药学杂志,1994, 14(4): 183-184.
[4] 李志君, 万红焱, 顾丽莉, 等. 草果多酚物质提取及LC-MS/MS分析[J]. 食品工业科技, 2017, 38(8): 294-299. DOI:10.13386/j.issn1002-0306.2017.08.049.
[5] 彭美芳, 陈文学, 仇厚援. 草果抑菌活性物质的分离纯化[J]. 中国调味品,2015, 40(4): 107-109. DOI:10.3969/j.issn.1000-9973.2015.04.025.
[6] 郭淼, 宋江峰, 豆海港. 超声波辅助提取草果精油及其抗氧化活性研究[J]. 食品研究与开发, 2017, 38(16): 58-60. DOI:10.3969/j.issn.1005-6521.2017.16.013.
[7] 周景春, 朱福典. 药食同源的草果[J]. 首都食品与医药, 2015, 19(13):53-52.
[8] 李世诚, 丁靖凯, 易元芬. 草果精油化学成分的研究[J]. 云南植物研究, 1975, 1(2): 27-32.
[9] WANG Y, YOU C X, WANG C F, et al. Chemical constituents and insecticidal activities of the essential oil from Amomum tsaoko against two stored-product insects[J]. Journal of Oleo Science, 2014, 63(10):1019-1026. DOI:10.5650/jos.ess14087.
[10] STARKENMANN C, MAYENZET F, BRAUCHLI R, et al. Structure elucidation of a pungent compound in black cardamom: Amomum tsaoko Crevost et Lemarie (Zingiberaceae)[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10902-10907. DOI:10.1021/jf072707b.
[11] 万红焱, 顾丽莉, 刘文婷, 等. 超临界流体萃取草果挥发油的工艺研究及成分分析[J]. 现代化工, 2015, 35(12): 96-100. DOI:10.16606/j.cnki.issn 0253-4320.2015.12.025.
[12] 胡彦, 张志信, 张铁, 等. 草果不同栽培品种挥发性成分的GC-MS分析[J]. 文山学院学报, 2018, 31(6): 15-31.
[13] 杨庆宽, 周铁生, 孔繁浩, 等. 鲜、干草果精油化学成分及香气味的研究[J]. 香料香精化妆品, 1994, 22(1): 1-5.
[14] ZHANG Y, LIU Y, YANG W, et al. Characterization of the potent aroma compounds in preserved egg yolk by gas chromatographyolfactometry, quantitative measurements, and odor activity value[J].Journal of Agricultural and Food Chemistry, 2018, 66(24): 6132-6141.DOI:10.1021/acs.jafc.8b01378.
[15] YANG W, CADWALLADER K, LIU Y, et al. Characterization of typical potent odorants in raw and cooked Toona sinensis (A. Juss.)M. Roem. by instrumental-sensory analysis techniques[J]. Food Chemistry, 2019, 282: 153-163. DOI:10.1016/j.foodchem.2018.12.112.
[16] National Istitute of Standards and Technology-US Department of Commerce[DB/OL]. [2019-08-10]. http://webbook.nist.gov/chemistry/cas-ser.html.
[17] 冯桂蓉, 谢姣, 邓丽莉, 等. 柑橘果实萜烯类挥发性物质研究进展[J]. 食品与机械, 2017, 33(10): 200-204. DOI:10.13652/j.issn.1003-5788.2017.10.043.
[18] 郝静梅, 盛冉, 孙志高, 等. 柠檬烯抗菌性研究进展[J]. 食品与发酵工业, 2017, 43(2): 274-278. DOI:10.13995/j.cnki.11-1802/ts.201702046.
[19] 廖圣良, 商士斌, 沈明贵, 等. 蒎烯及其衍生化合物药物活性的研究进展[J]. 化学试剂, 2016, 38(3): 219-223. DOI:10.13822/j.cnki.hxsj.2016.03.007.
[20] 范文来, 徐岩. 白酒中重要的功能化合物萜烯综述[J]. 酿酒, 2013,40(6): 11-16.
[21] APROTOSOAIE A, HANCIANU M, COSTACHE I, et al. Linalool: a review on a key odorant molecule with valuable biological properties[J].Flavour & Fragrance Journal, 2014, 29(4): 193-219. DOI:10.1002/ffj.3197.
[22] BANTHORPE D, BUCKNALL G, DOONAN H, et al. Terpene biosynthesis. Part 12. Biosynthesis of geraniol and nerol in cell-free extracts of Tanacetum vulgare[J]. Hytochemistry, 1976, 15(1): 91-100.DOI:10.1016/S0031-9422(00)89061-5.
[23] HALEVA-TOLEDO E, NAIM M, ZEHAVI U, et al. Formation of α-terpineol in citrus juices, model and buffer solutions[J]. Journal of Food Science, 1999, 64(5): 838-841. DOI:10.1111/j.1365-2621.1999.tb15923.x.
[24] UILRICH F, GROSCH W. Identification of the most intense volatile flavour compounds formed during autoxidation of linoleic acid[J].Zeitschrift fur Lebensmittel-untersuchung und-Forschung a-Food Research and Technology, 1987, 184(2): 277-282. DOI:10.1007/BF01027663.
[25] KOBORI C, WAGNER R, PADULA M, et al. Formation of volatile compounds from lycopene by autoxidation in a model system simulating dehydrated foods[J]. Food Research International, 2014,63(Part A): 49-54. DOI:10.1016/j.foodres.2014.04.029.
[26] CROTEAU R, ALONSO W, KOEPP A, et al. Biosynthesis of monoterpenes: partial purification, characterization, and mechanism of action of 1,8-cineole synthase[J]. Archives of Biochemistry and Biophysics, 1994, 309(1): 184-192. DOI:10.1006/abbi.1994.1101.
[27] 何俏明, 覃洁萍, 黄艳, 等. 草果果仁及果壳挥发油化学成分的GC-MS分析[J]. 中国实验方剂学杂志, 2013, 19(14): 112-117.DOI:10.11653/syfj2013140112.
[28] CZERNY M, CHRISTLBAUER M, CHRISTLBAUER M, et al.Re-investigation on odour thresholds of key food aroma compounds and development of an aroma language based on odour qualities of defined aqueous odorant solutions[J]. European Food Research and Technology, 2008, 228(2): 265-273. DOI:10.1007/s00217-008-0931-x.
[29] VAN GEMERTL J. Odour thresholds[M]. The Netherlands: Oliemans Punter & Partners B V, 2011: 100-354.
[30] BUTTERY R, TERANISHI R, LING L, et al. Quantitative and sensory studies on tomato paste volatiles[J]. Journal of Agricultural and Food Chemistry, 1990, 38(1): 336-340. DOI:10.1021/jf00091a074.
[31] 谷风林, 张林辉, 房一明, 等. 云南不同地区草果物理性状、精油含量及组成分析[J]. 热带作物学报, 2018, 39(7): 1440-1446.DOI:10.3969/j.issn.1000-2561.2018.07.026.
[32] 胡剑, 凌瑞枚, 黎平, 等. 4 种不同的干燥处理对草果挥发性成分的影响[J]. 热带作物学报, 2019, 40(4): 773-780. DOI:10.3969/j.issn.1000-2561.2019.04.023.