亚麻又称胡麻,主要产于加拿大、阿根廷、美国、中国和印度,亚麻籽含油35%~45%,属高含油油料作物[1]。亚麻籽油中富含植物来源n-3不饱和脂肪酸α-亚麻酸,其含量最高达65%[2]。此外,亚麻籽油还是多种脂质伴随物的主要来源,包括生育酚[3]、多酚[4]、植物甾醇[5]、类胡萝卜素[6]等,这些脂质伴随物不仅对亚麻籽油的品质有重要影响,还可能与α-亚麻酸协同提高亚麻籽油的生物活性。
目前关于亚麻籽油制取工艺的研究主要包括冷榨法、常规溶剂提取、微波预处理+溶剂提取、加速溶剂萃取、超临界CO2萃取、亚临界流体萃取等。其中,冷榨法制油因压榨温度低且仅通过冷析法精炼,能最大限度地降低亚麻籽油脂质氧化和保留活性脂质伴随物,但出油率和脂质伴随物的油相迁移率均较低。微波作为一种新型的预处理方式,正逐步应用于亚麻籽油的提质制取过程。李媛媛等[7]研究表明微波预处理+浸提与常规浸提相比出油率提高了9.4%,并使亚麻籽油中总酚、黄酮、类胡萝卜素分别增加了75.0%、37.3%和83.9%。加速溶剂萃取作为一种新型萃取技术,是在高温高压下使用有机溶剂萃取目标组分,该方法萃取高效且溶剂消耗显著降低,已应用于小麦胚芽油和亚麻籽油的提取[8-9]。超临界CO2萃取主要通过调节超临界温度和压力控制CO2的密度、黏度和扩散系数,从而实现提高油脂萃取率或萃取选择性,已有研究结果表明,超临界CO2萃取对亚麻籽油中的α-亚麻酸具有特异性富集作用,并能够显著提高亚麻籽油中酚酸含量[8,10]。亚临界流体萃取技术是一种新型的提取植物油脂的技术,基本工作原理是利用萃取流体(如丙烷、丁烷)在不同压力和温度下的两相变化,完成油脂萃取和脱溶过程,具有产量高、对压力和温度要求低、易于工业化的优势[11]。Zanqui等[12]研究表明,亚临界丙烷萃取对亚麻籽油中β-生育酚和豆甾醇具有较好的富集作用,分别是传统溶剂萃取油脂的1.34 倍和3.23 倍。以上研究表明,不同制油工艺对亚麻籽油的品质特性尤其是活性脂质伴随物富集可能具有特异性影响。但目前研究多集中在制取工艺对油脂得率和理化特性影响方面,而对亚麻籽油中典型活性脂质伴随物油相迁移规律尚缺乏系统的比较研究。
基于此,本研究系统评价冷榨、微波辅助冷榨、加速溶剂萃取、超临界CO2萃取、亚临界流体萃取5 种制油工艺对亚麻籽油理化特性和典型活性脂质伴随物油相迁移规律的影响。在此基础上,基于多变量分析探讨制取工艺-典型活性脂质伴随物-油脂氧化稳定性和体外抗氧化活性之间的联动关系,以期为亚麻籽油的提质制取和高值化加工利用提供理论依据。
1 材料与方法
1.1 材料与试剂
陇亚9号亚麻籽,由甘肃省农科院提供。
无水乙醇、盐酸、无水乙醚、石油醚、氢氧化钠、氢氧化钾、无水硫酸钠、硝酸钠、硝酸铝、碳酸钠(均为分析纯) 国药集团化学试剂有限公司;甲醇、异丙醇、正己烷、二氯甲烷(均为色谱纯) 德国Merck KGaA公司;37 种脂肪酸甲酯化混标、芦丁(≥98.2%)上海安谱实验科技股份有限公司;β-生育酚(≥98%)、γ-生育酚(≥96%)、5α-胆甾醇(≥97%)、福林-酚、芥子酸(≥99.9%)、2,4,6-三吡啶基三嗪(≥99%)、水溶性VE(≥97%)、1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrylhydrazyl,DPPH,≥95%)美国Sigma公司;正丁烷(纯度≥99.90%) 武汉纽瑞德特种气体有限公司;二氧化碳(纯度≥99.99%)武汉市明辉气体科技有限公司。
1.2 仪器与设备
FW80高速万能粉碎机 天津市泰斯特仪器有限公司;CA59G冷榨机 德国Komet公司;MARSXpress密闭式微波消解仪 美国CEM公司;ASE100加速溶剂萃取仪 美国戴安公司;HA211-50-06超临界萃取装置南通市华安超临界萃取有限公司;PLE-5L亚临界萃取装置由中国农业科学院油料作物研究所定制;7890A气相色谱仪、6890N气相色谱仪、7890A/5975C气相色谱-质谱联用仪 美国Agilent公司;DU800紫外-可见光分光光度计 美国贝克曼库尔特公司;RV10D旋转蒸发仪德国IKA集团;XS205电子分析天平 瑞士梅特勒-托利多公司;Rancimat743氧化诱导仪 瑞士万通公司;Q2000差示扫描量热(differential scanning calorimeter,DSC)仪 美国TA公司;LC-6AD型半制备液相色谱仪日本岛津公司。
1.3 方法
1.3.1 亚麻籽油的制取
亚麻籽原料经高速万能粉碎机粉碎,过40 目筛,密封放置4 ℃冰箱中待用。
冷榨:采用CA59G榨油机压榨亚麻籽得到亚麻籽毛油,5 000 r/min离心10 min,取上层油脂,放置-20 ℃冰箱中保存待检测。
微波辅助冷榨:采用CEM密闭式微波消解仪对亚麻籽进行微波预处理,参考曹伟伟等[13]的方法,稍作修改。将亚麻籽原料水分质量分数调节至15%,密封置于4 ℃冰箱中24 h,使水分分布均匀。将400 g样品分别平铺于8 个直径为85 mm的平皿中,放置在微波炉转盘上,微波功率800 W,微波时间7 min,微波处理后经榨油机获得亚麻籽油,5 000 r/min离心10 min,取上层油脂,放置-20 ℃冰箱中保存待检测。
加速溶剂萃取:采用ASE100型加速溶剂萃取仪制取亚麻籽油,参考Khattab等[8]的方法,稍作修改。准确称取13.00 g亚麻籽粉末于加速溶剂萃取仪的萃取釜中,设置实验参数为萃取温度100 ℃、萃取时间6 min、萃取次数3 次。将萃取仪炉温升至所设萃取温度,放入装有原料的萃取釜,吸取一定体积的溶剂(正己烷),静态萃取一定时间,然后将收集瓶中经萃取釜滤膜过滤所得提取液转移至圆底烧瓶,经旋转蒸发及氮吹挥干溶剂获得亚麻籽油,放置-20 ℃冰箱中保存待检测。
亚临界流体萃取:采用CBE-5L型亚临界设备制取亚麻籽油,参考Piva等[14]的方法,稍作修改。实验参数为萃取温度45 ℃,萃取压力0.38 MPa,料液比1∶8(g/mL),萃取时间1 h。称取300.00 g粉末置于网兜中,系口后把网兜放入萃取罐中,加盖密封;将萃取系统加热到实验所需温度并抽真空后,导入2.4 L的正丁烷,静态浸泡萃取特定时间;将萃取液置于分离罐后与萃取罐隔离,开启压缩机分别对两罐进行减压和溶剂回收,当两罐中绝对压力降至0.15 MPa以下时,开启真空泵与压缩机串联工作,直至两罐绝对压力降为0.01 MPa后,脱溶结束。从分离罐底部放出萃取的亚麻籽油,称量并记录,放入-20 ℃冰箱中保存待检测。
超临界CO2萃取:采用HA221-50-06型超临界设备制取亚麻籽油,参考Pradhan等[10]的方法,稍作修改。准确称量300.00 g亚麻籽粉末置于萃取罐中,设置萃取温度42 ℃,萃取压力30 MPa,萃取时间1.5 h,CO2流速18 L/h,分离I(压力10 MPa,温度60 ℃),分离II(压力为CO2储罐压力;温度35 ℃)。萃取过程中用离心杯每隔30 min从分离I和分离II中收集萃取物,3 次收集结束后,将萃取物5 000 r/min离心10 min,取上层油脂,放置-20 ℃冰箱中保存待检测。
1.3.2 油脂得率
按式(1)计算油脂得率:
式中:m1为亚麻籽油质量/g;m2为亚麻籽质量/g。
1.3.3 理化指标的测定
酸价测定:参照GB 5009.229—2016《食品中酸价的测定》;过氧化值测定:参照GB 5009.227—2016《食品中过氧化值的测定》;水分含量测定:参照GB 5009.236—2016《动植物油脂 水分及挥发物的测定》;K232、K270值的测定:参照GB/T 22500—2008《动植物油脂紫外吸光度的测定》;色泽测定:参照GB/T 22460—2008《动植物油脂 罗维朋色泽的测定》;脂肪酸组成的测定:参照GB 5009.168—2016《食品中脂肪酸的测定》。
1.3.4 典型脂质伴随物的测定
1.3.4.1 非极性脂质伴随物的测定
生育酚:参照AOCS Official Method Ce 8-89。称取约2.000 g油样于25 mL容量瓶内,正己烷定容,旋涡混匀,过0.22 μm滤膜,滤液用于高效液相色谱分析,流动相为正己烷-异丙醇(99.5∶0.5,V/V),进样量20 μL,流速1.0 mL/min。采用外标法定量,β-生育酚标准曲线Y=9 967.2X-6 676.9,R2=0.999 7,γ-生育酚标准曲线Y=9 374.2X-7 484.9,R2=0.999 6。
类胡萝卜素:参照李媛媛等[7]的方法,稍作修改,采用紫外分光光度法测定;称取油样0.200 g于10 mL的比色管中,以石油醚(30~60 ℃)溶解并定容,在1 cm的比色皿中测定其在波长450 nm处的吸光度,并以石油醚作空白。按式(2)计算类胡萝卜素含量:
式中:E为吸光度;A为类胡萝卜素的平均消光系数,2 500;m为样品质量/g。
叶绿素:参照AOCS Official Method Ch 4-91。称取一定量样品于25 mL容量瓶中,二氯甲烷定容。采用紫外分光光度计,以二氯甲烷作空白,分别在波长630、670、710 nm处测定吸光度,确保样品在每个波长下测定的吸光度在0.3~0.8范围内。按式(3)计算叶绿素含量:
式中:C为叶绿素含量/(mg/100 g);A为吸光度;L为样品池长度/cm;F为校准因子。
1.3.4.2 极性脂质伴随物的测定
总酚:参照Parry等[15]的方法提取,并稍作修改。准确称取1.25 g油样于10 mL离心管中,加入1.5 mL正己烷和1.5 mL 80%甲醇溶液后于室温下旋涡5 min,5 000 r/min离心10 min,将上层液体转移至另一个塑料离心管,并按上述步骤重复萃取3 次,将3 次下层提取液合并。参照Folin-Ciocaileu比色法[16],测定总酚含量。吸取0.5 mL总酚提取液于10 mL比色管中,然后加入5 mL蒸馏水和0.5 mL福林-酚试剂,混合均匀放置3 min后,再加入1 mL澄清的饱和Na2CO3溶液,并用蒸馏水定容至10 mL,旋涡5 s后于室温反应1 h,在波长765 nm处测定样品的吸光度,结果用芥子酸当量表示,单位为mg/100 g。芥子酸标准曲线为Y=0.003 4X+0.077 4,R2=0.999 6。
黄酮:测定参照易志[17]方法,并稍作修改。1 mL提取液加入5% NaNO2溶液0.7 mL,摇匀,放置6 min,再加入10% Al(NO3)3溶液0.7 mL,6 min后再加入1 mol/L的NaOH溶液5 mL,混匀,再用60%乙醇溶液定容至刻度,摇匀,放置15 min后在波长510 nm处测定吸光度,结果以芦丁当量表示,单位为mg/100 g。
1.3.4.3 两亲性脂质伴随物的测定
植物甾醇:参考黄颖等[18]的方法,并稍作修改。称取0.2 mg样品(精确到0.000 1)于50 mL离心管内,加入0.5 mL配制好的5α-胆甾醇内标溶液(0.5 mg/mL),超声水浴处理5 min加入10 mL 2 mol/L乙醇氢氧化钾,密封离心管,放入60 ℃水浴摇床反应60 min(转速100 r/min)。取出后振荡2 min,加入4 mL水和10 mL正己烷。振荡2 min后5 000 r/min离心3 min。将上层有机液层转移到另一只50 mL离心管中,加入10 mL正己烷。振荡3 min后5 000 r/min离心5 min。将上层有机液相转移到离心管中。重复2 次。加入1.5 g无水硫酸钠,静置澄清。将15 mL提取液转移到样品瓶中,在80~85 ℃烘箱中烘干。加入100 μL双(三甲基硅)三氟乙酰胺(含三甲基氯硅烷)硅烷化试剂,用烘箱在105 ℃加热反应15 min。取出冷却至室温后,加入1 mL正己烷,振荡30~60 s,进入气相色谱仪进行分析。
气相色谱条件:DB-5HT色谱柱(30.0 m×220 μm,0.10 μm);进样量1 μL,进样口和检测器温度320 ℃;程序升温:柱箱温度60 ℃保持1 min,40 ℃/min升到310 ℃,保持时间10 min;载气为氦气,流量2.0 mL/min,分流比25∶1,分流流量50 mL/min。
磷脂:参照GB/T 5537—2008《粮油检验 磷脂含量的测定》的第一法钼蓝比色法测定。
1.3.5 油脂的体外抗氧化活性
1.3.5.1 DPPH自由基清除能力
参考Szydlowska-Czerniak等[19]的方法,稍作修改。吸取0.5 mL总酚提取物,加入2.5 mL DPPH-甲醇溶液(38.0 μg/mL),旋涡混匀,避光静置30 min,紫外-可见分光光度计在波长515 nm处测定吸光度(以甲醇为空白)。按式(4)计算DPPH自由基清除率:
式中:Acontrol为空白样的吸光度;Asample为测定样品的吸光度。
将Trolox标准溶液质量浓度(X,μg/mL)与其对应DPPH自由基清除率(Y)进行线性回归得到方程Y=5.832 9X+0.01,R2=0.999 4。测定结果以Trolox当量计,单位为μmol/100 g。
1.3.5.2 铁离子还原能力(ferric ion reducing antioxidant power,FRAP)
参考Szydlowska-Czerniak等[20]的方法,稍作修改。FRAP工作液(2.5 mL 10 mmol/L 2,4,6-三吡啶基三嗪-盐酸溶液,2.5 mL 20 mmol/L FeCl3溶液和25 mL 0.1 mol/L醋酸缓冲液,pH 3.6),现配现用。测试前置37 ℃水浴锅温育10 min。取1.0 mL总酚提取物和2 mL温育后的FRAP工作液于10 mL比色管中,双蒸水定容,旋涡混匀,避光静置20 min,紫外-可见分光光度计在波长593 nm处测定吸光度。将Trolox标准溶液质量浓度(X,μg/mL)与其对应的吸光度(Y)进行线性回归得到方程Y=0.008 8X-0.017 9,R2=0.995。测定结果以Trolox当量计,单位为μmol/100 g。
1.3.6 油脂的氧化稳定性
1.3.6.1 氧化诱导时间
采用氧化诱导仪测定亚麻籽油的氧化诱导时间。称取3.00 g亚麻籽油样品于玻璃反应试管中,样品在恒温110 ℃条件下,向油脂中以恒定速率通干燥空气,空气流量为20 L/h,油脂中易氧化的物质被氧化成小分子易挥发的酸,被空气带入盛水的电导率测量池中,在线测定测量池中的电导率,记录电导率对反应时间的氧化曲线,对曲线求二阶导数,记录油脂加速氧化的诱导时间。
1.3.6.2 氧化起始温度
测定参照Oomah等[21]方法,稍作修改。氮气流速为100 mL/min,称取8 mg亚麻籽油样品置于铝盒中,空铝盒作为参考。样品和参考铝盒同时置于热量计中,样品从室温降低到10 ℃维持10 min。升温程序:初始温度10 ℃,以2 ℃/min加热到350 ℃,测定重复3 次。
1.4 数据处理
采用Excel 2013处理数据,以 表示。以Origin 9.0作图及主成分分析,SPSS 18.0进行ANOVA显著性分析和Pearson相关性分析。
表示。以Origin 9.0作图及主成分分析,SPSS 18.0进行ANOVA显著性分析和Pearson相关性分析。
2 结果与分析
2.1 制油工艺对亚麻籽油基本理化指标的影响
表1 不同制油工艺亚麻籽油的基本理化指标
Table 1 Physicochemical properties of flaxseed oils produced by different techniques
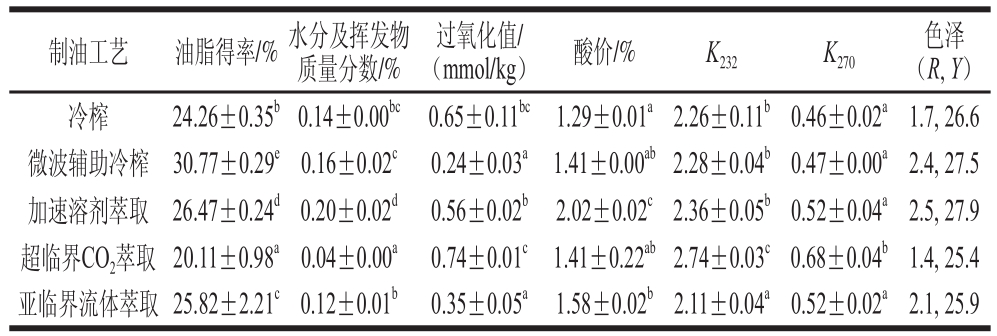
注:同列字母不同表示差异显著(P<0.05)。
色泽(R, Y)冷榨 24.26±0.35b0.14±0.00bc 0.65±0.11bc 1.29±0.01a2.26±0.11b0.46±0.02a1.7, 26.6微波辅助冷榨 30.77±0.29e0.16±0.02c 0.24±0.03a1.41±0.00ab2.28±0.04b0.47±0.00a2.4, 27.5加速溶剂萃取 26.47±0.24d0.20±0.02d 0.56±0.02b 2.02±0.02c2.36±0.05b0.52±0.04a2.5, 27.9超临界CO2萃取 20.11±0.98a0.04±0.00a 0.74±0.01c 1.41±0.22ab2.74±0.03c0.68±0.04b1.4, 25.4亚临界流体萃取 25.82±2.21c0.12±0.01b 0.35±0.05a 1.58±0.02b2.11±0.04a0.52±0.02a2.1, 25.9制油工艺 油脂得率/% 水分及挥发物质量分数/%过氧化值/(mmol/kg) 酸价/% K232 K270
由表1可以看出,不同制油工艺亚麻籽油得率存在显著性差异(P<0.05),其中微波辅助冷榨亚麻籽油的得率最高,与其他工艺相比增加了4.3%~10.66%。这是由于微波辐射对水分子发生作用,使水分子加快振动频率,分子间产生摩擦使温度升高,进而促进油籽胚乳细胞壁及所含的油脂体膜结构破裂[22],油脂得率增加。加速溶剂萃取亚麻籽油中水分及挥发物含量最高,与其他工艺相比增加了0.04%~0.16%。各工艺亚麻籽油的过氧化值在0.24~0.74 mmol/kg范围内,酸价在1.29%~2.02%范围内,其中超临界CO2萃取亚麻籽油的过氧化值最高,是其他工艺油脂的1.1~3.1 倍。加速溶剂萃取亚麻籽油的酸价最高,是其他工艺油脂的1.3~1.6 倍。这是因为该工艺提取过程处于高温高压的环境,并且油脂中水分含量较高,使得甘三酯更易于水解产生较多的游离脂肪酸。虽然不同提取工艺对亚麻籽油的水分及挥发物、过氧化值和酸价的影响不同,但提取的亚麻籽油均满足GB/T 8235—2019《亚麻籽油》要求。
K232和K270分别代表油脂初级氧化产物共轭二烯和次级氧化产物共轭三烯的积累量,各工艺亚麻籽油的K232值在2.11~2.74范围内,K270值在0.46~0.68范围内,整体差异不大。
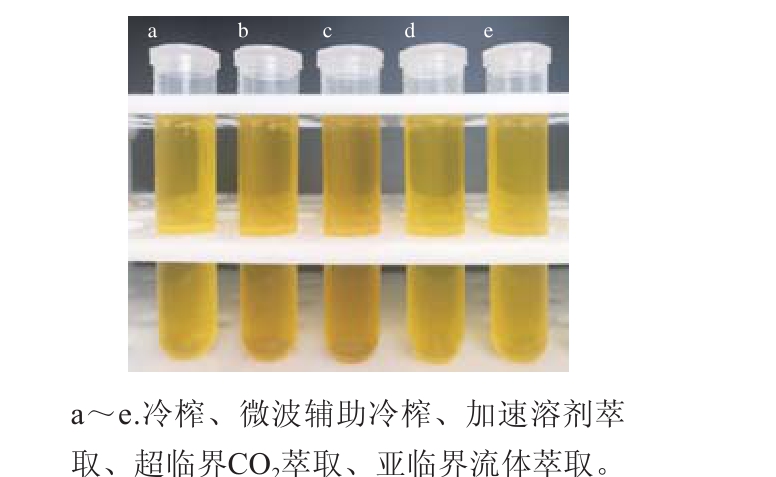
图1 不同制油工艺亚麻籽油的外观
Fig. 1 Appearance of flaxseed oils produced by different techniques
由图1可看出,微波辅助冷榨和加速溶剂萃取亚麻籽油的色泽较深为黄棕色,而其他工艺油脂色泽较浅,均为黄色。采用全自动罗维朋比色仪测定油脂色泽,结果表明,微波辅助冷榨和加速溶剂萃取亚麻籽油的红黄值较高,而其余各工艺油脂的红黄值差异较小。
2.2 制油工艺对亚麻籽油中主要脂肪酸组成的影响
表2 不同制油工艺亚麻籽油的主要脂肪酸组成
Table 2 Main fatty acid composition of flaxseed oils produced by different techniques
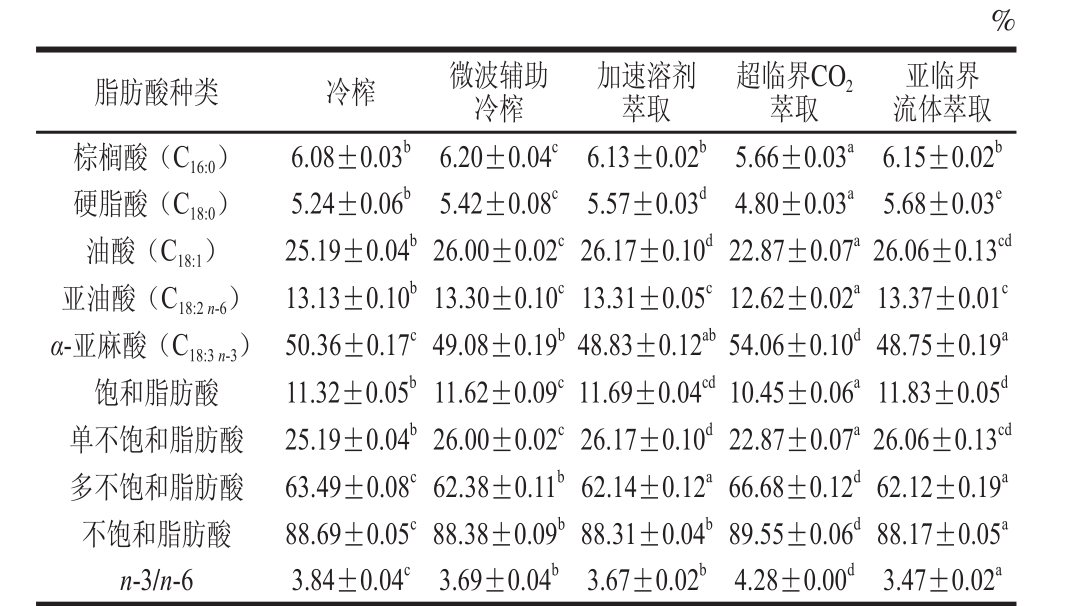
注:同行不同字母表示差 异显著(P<0.05)。
%亚临界流体萃取棕榈酸(C16:0) 6.08±0.03b 6.20±0.04c 6.13±0.02b 5.66±0.03a 6.15±0.02b硬脂酸(C18:0) 5.24±0.06b 5.42±0.08c 5.57±0.03d 4.80±0.03a 5.68±0.03e油酸(C18:1) 25.19±0.04b26.00±0.02c26.17±0.10d22.87±0.07a26.06±0.13cd亚油酸(C18:2 n-6) 13.13±0.10b13.30±0.10c13.31±0.05c12.62±0.02a13.37±0.01c α-亚麻 酸(C18:3 n-3) 50.36±0.17c49.08±0.19b48.83±0.12ab54.06±0.10d48.75±0.19a饱和脂肪酸 11.32±0.05b11.62±0.09c11.69±0.04cd10.45±0.06a11.83±0.05d单不饱和脂肪酸 25.19±0.04b26.00±0.02c26.17±0.10d22.87±0.07a26.06±0.13cd多不饱和脂肪酸 63.49±0.08c62.38±0.11b62.14±0.12a66.68±0.12d62.12±0.19a不饱和脂肪酸 88.69±0.05c88.38±0.09b88.31±0.04b89.55±0.06d 88.17±0.05a n-3/n-6 3.84±0.04c 3.69±0.04b 3.67±0.02b 4.28±0.00d 3.47±0.02a脂肪酸种类 冷榨 微波辅助冷榨加速溶剂萃取超临界CO2萃取
由表2可知,冷榨、微波辅助冷榨、加速溶剂萃取、亚临界流体萃取4 种工艺亚麻籽油的脂肪酸组成差异不大,主要包括棕榈酸、硬脂酸、油酸、亚油酸、α-亚麻酸,质量分数分别为6.08%~6.20%、5.24%~5.68%、25.19%~26.17%、12.26%~13.37%、48.75%~50.36%。超临界CO2萃取油脂的脂肪酸组成与其他工艺相比具 有显著差异(P<0.05),其中α-亚麻酸的含量与其他工艺油脂相比增加了3.70%~5.31%。相关研究得到了类似的结果。Khattab等[8]报道超临界CO2萃取亚麻籽油中α-亚麻酸质量分数为57.08%,与常规溶剂萃取和加速溶剂溶剂萃取油脂相比分别增加了0.80%和0.66%。Pradhan等[10]报道超临界CO2萃取亚麻籽油中α-亚麻酸质量分数为55.0%,分别比索氏提取和冷榨油脂增加了5.0%和1.2%。综上表明超临界CO2萃取工艺对亚麻籽油中α-亚麻酸具有较好的富集效果。此外,与其他工艺油脂相比,超临界CO2萃取亚麻籽油的饱和脂肪酸和单不饱和脂肪酸含量相对较低,仅为10.45%和22.87%,而多不饱和脂肪酸含量较高,相比于其他工艺增加了5.02%~7.34%。相关研究表明,随着油脂中脂肪酸的不饱和度增加,油脂的氧化稳定性下降,因此超临界CO2萃取油脂可能会更容易氧化。
世界卫生组织推荐植物油的脂肪酸n-3/n-6合理摄入比例为4∶1~6∶1,这有利于预防心脑血管疾病、高血压和其他慢性疾病。由表2可知,5 种制油工艺提取的亚麻籽油n-3/n-6在3.47∶1~4.28∶1范围内,比例较为合理,符合推荐标准。
2.3 制油工艺对亚麻籽油中典型脂质伴随物的影响
2.3.1 制油工艺对亚麻籽油中生育酚的影响
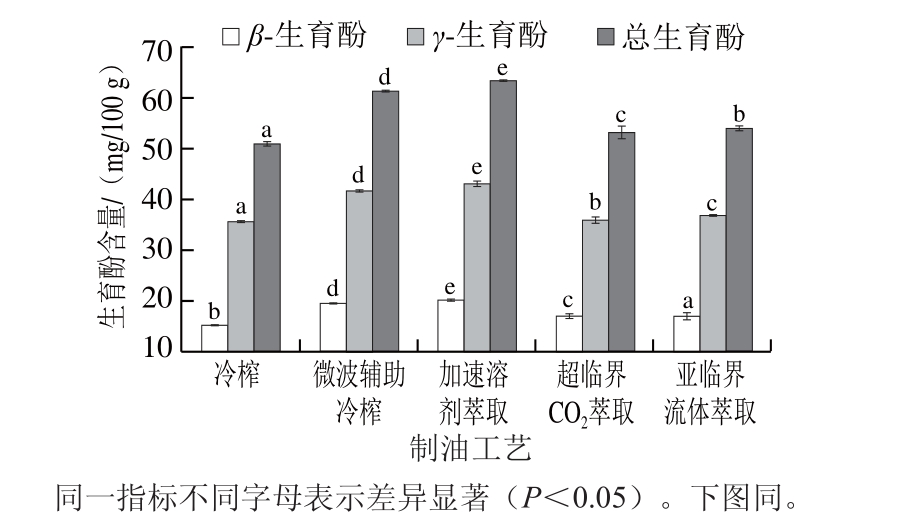
图2 不同工艺亚麻籽油中生育酚含量
Fig. 2 Tocopherol content of flaxseed oils produced by different techniques
由图2所示,亚麻籽油中主要有β-生育酚、γ-生育酚,且以γ-生育酚为主(70%左右),含量为35.74~43.24 mg/100 g。Barroso等[23]报道了棕色和黄色冷榨亚麻籽油中生育酚总量分别为60.3 mg/100 g和47.9 mg/100 g,其中γ-生育酚含量分别为38.9 m g/100 g和25.5 mg/100 g, 与本实验测定结果相似。不同制油工艺对亚麻籽油中生育酚含量具有显著影响(P<0.05),其中微波辅助冷榨和加速溶剂萃取亚麻籽油中生育酚总量较高,分别为63.40 mg/100 g和61.29 mg/100 g,而亚临界流体萃取、超临界CO2萃取和冷榨亚麻籽油相对较低,分别为54.1、53.1 mg/100 g和51.08 mg/100 g。相关研究得到类似的结果,任我行等[24]研究表明,正己烷浸提亚麻籽油中生育酚总量最高(1 047.6 mg/kg),高于冷榨(1 009.7 mg/kg)、热榨(839.2 mg/kg)和精炼亚麻籽油(537.0 mg/kg)。这可能是由于生育酚色满环上连接了一个长碳链,使得生育酚的极性相对较弱,与正己烷亲和力较强,有利于生育酚迁移至油中。Azadmard-Damirchi等[25]研究发现微波预处理+冷榨菜籽油中生育酚总量达924 μg/g,相比于冷榨菜籽油增加了81.18%。这可能是由于微波预处理破坏了种子的细胞膜结构,进而增加了生育酚的释放。
2.3.2 制油工艺对亚麻籽油中色素的影响
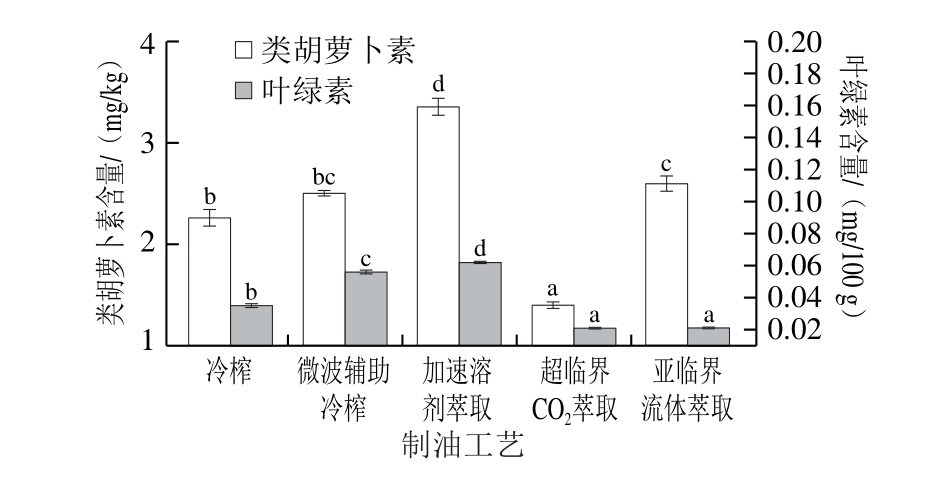
图3 不同工艺亚麻籽油的色素含量
Fig. 3 Pigment contents of flaxseed oils produced by different techniques
亚麻籽油中的色素主要以类胡萝卜素和叶绿素为主。由图3所示,不同工艺亚麻籽油中类胡萝卜素含量为1.40~3.36 mg/kg,叶绿素含量为0.021~0.062 mg/100 g。李媛媛等[7]测定了微波+溶剂浸提亚麻籽油的类胡萝卜素含量为1.20~3.09 mg/kg,与本实验测定结果相似。Choo等[26]报道了不同品种的冷榨亚麻籽油中叶绿素含量为0.080~0.576 mg/100 g,比本研究测定结果偏高,可能是品种之间存在差异。不同提取工艺对色素含量具有显著影响(P<0.05),其中加速溶剂萃取亚麻籽油的类胡萝卜含量最高(3.36 mg/kg),分别是冷榨的1.48 倍、微波辅助冷榨的1.34 倍、超临界CO2萃取的2. 4 倍、亚临界流体萃取的1.29 倍。同样,加速溶剂萃取亚麻籽油的叶绿素含量也最高(0.062 mg/100 g),分别是冷榨的1.77 倍、微波辅助冷榨的1.11 倍、超临界CO2萃取、亚临界流体萃取的2.95 倍。这是由于色素类物质偏 非极性,与正己烷互相亲和,故加速溶剂萃取工艺更有利于色素类物质迁移至油中。此外,油脂中色素含量与油脂色泽相对应,加速溶剂萃取和微波辅助冷榨亚麻籽油中色素含量较高,故表现为油脂的色泽较深。
2.3.3 制油工艺对亚麻籽油中总酚的影响
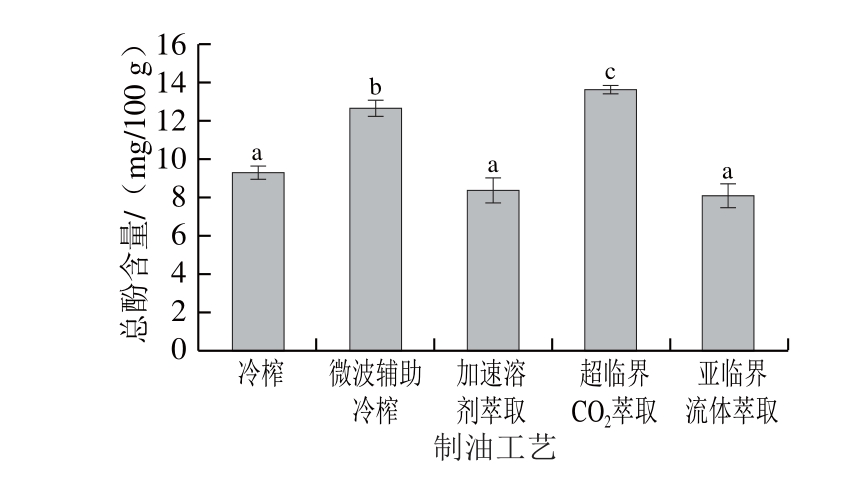
图4 不同工艺亚麻籽油中总酚含量
Fig. 4 Total phenolic contents of flaxseed oils produced by different techniques
由图4所示,不同工艺亚麻籽油中总酚含量为8.07~13.60 mg/100 g。Herchi等[27]报道了冷榨亚麻籽油中总酚含量为10.71~14.07 mg/100 g(以咖啡酸计),与本实验测定结果相似。不同提取工艺对油脂中总酚含量具有显著影响(P<0.05),其中超临界CO2萃取亚麻籽油中总酚含量最高(13.60 mg/100 g),其次是微波辅助冷榨油脂(12.62 mg/100 g),而冷榨、加速溶剂萃取、亚临界流体萃取亚麻籽油相对较低,分别为9.30、8.35 mg/100 g和8.07 mg/100 g。相关研究得到类似的结果,Khairullah等[28]报道了超临界CO2萃取的黑种草油中的总酚质量浓度达到160.51 mg/100 mL(以没食子酸计),与冷榨油相比增加了70.03%;Khattab等[8]报道超临界CO2萃取提取的亚麻籽油中酚类物质总量达47.58 μg/g,是传统溶剂浸出油的3.03 倍,表明超临界CO2萃取有利于富集酚类物质。曹伟伟等[13]报道微波辅助冷榨亚麻籽油中总酚含量是冷榨亚麻籽油的1.41 倍。这可能是由于亚麻籽中多酚类化合物主要以多聚体的形式存在于种皮细胞壁中[29],微波预处理破坏了细胞壁,诱导多聚体的解聚效应,进而促进了酚类化合物的释放和油相迁移。
2.3.4 制油工艺对亚麻籽油中黄酮的影响
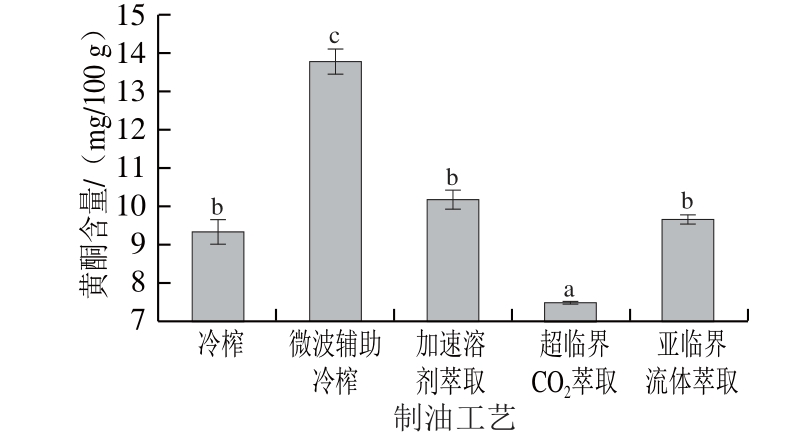
图5 不同工艺亚麻籽油中黄酮含量
Fig. 5 Flavone contents of flaxseed oils produced by different techniques
由图5所示,不同工艺亚麻籽油中黄酮含量为7.48~13.78 mg/100 g。Choo等[26]报道了不同品种亚麻籽油中黄酮含量为12.7~25.6 mg/100 g,本实验测定结果略低。不同提取工艺对其含量具有显著影响(P<0.05),其中微波辅助冷榨亚麻籽油中黄酮含量最高(13.78 mg/100 g),分别是冷榨的1.48 倍、加速溶剂萃取的1.36 倍、超临界CO2萃取的1.84 倍、亚临界流体萃取的1.43 倍。李媛媛等[7]研究得到类似的结果,微波+浸提亚麻籽油中黄酮含量达399.4 mg/kg,与常规浸提相比提高了37.3%。这主要是由于黄酮属于多酚类化合物的一种,大部分存在于种皮细胞壁中,微波预处理破坏了细胞壁,进而促进黄酮类物质的溶出。
2.3.5 制油工艺对亚麻籽油中植物甾醇的影响
由图6所示,各工艺亚麻籽油中的植物甾醇主要包括菜油甾醇、豆甾醇、β-谷甾醇、Δ5-燕麦甾醇、环阿屯醇、2,4-亚甲基环阿屯醇,且以β-谷甾醇为主,占25%左右,含量达到83.16~145.68 mg/100 g。魏晓珊等[30]报道了冷榨亚麻籽油中的植物甾醇总量为321.65~1 028.5 mg/100 g,其中β-谷甾醇含量最高,为101.02~318.7 mg/100 g,与本实验测定结果相似。不同提取工艺对亚麻籽油中植物甾醇的含量具有显著影响(P<0.05),其中亚临界流体萃取亚麻籽油中植物甾醇含量最高(429.78 mg/100 g),与冷榨、微波辅助冷榨、加速溶剂萃取、超临界CO2萃取相比分别增加了5.07%、9.34%、15.57%、30.26%。Xu Bin等[31]研究结果表明,亚临界丁烷萃取的小麦胚芽油中植 物甾醇含量为23.26 mg/g,明显高于超临界CO2萃取(13.81 mg/g)和正己烷萃取(9.21 mg/g),这与萃取溶剂的物理化学性质(介电常数、密度、扩散系数)有关,相比而言,亚临界丁烷较低的黏度和较高的扩散系数更有利于甾醇的溶出。

图6 不同工艺亚麻籽油中植物甾醇含量
Fig. 6 Phytosterol contents of flaxseed oils produced by different techniques
2.3.6 制油工艺对亚麻籽油中磷脂的影响
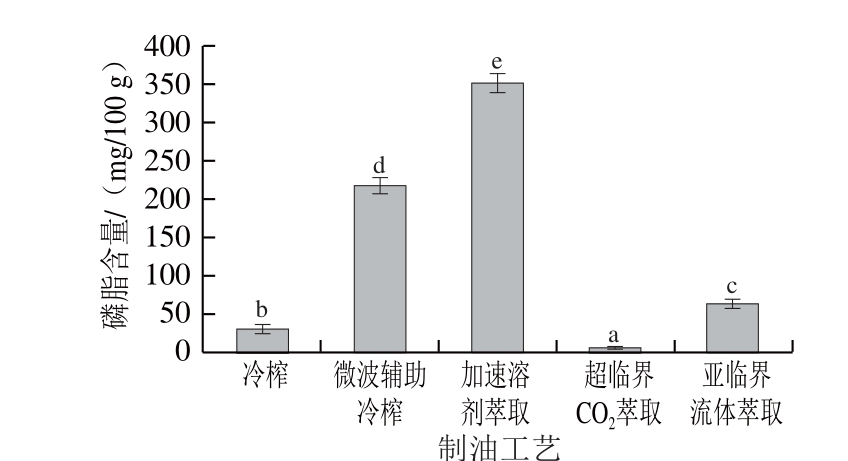
图7 不同工艺亚麻籽油中磷脂含量
Fig. 7 Phospholipid contents of flaxseed oils produced by different techniques
由图7所示,不同制油工艺对亚麻籽油中的磷脂含量具有显著影响(P<0.05),其中微波辅助冷榨和加速溶剂萃取亚麻籽油中磷脂含量较高,分别为217.36 mg/100 g和351.88 mg/100 g,而超临界CO2萃取亚麻籽油中含量最低,仅为1.05 mg/100 g。相关研究得到类似的结果,Valentová等[32]研究表明微波处理可显著提高菜籽油中的磷脂含量,最高为冷榨油中的2.41 倍。这可能是由于磷脂是构成种子胚乳细胞中油体膜的重要组成部分,微波预处理会破坏油体膜的完整性,进而促进磷脂物质的迁移。Xu Bin等[31]研究发现超临界CO2萃取小麦胚芽中磷脂含量仅为0.39 mg/g,明显低于正己烷萃取(17.78 mg/g)和亚临界丁烷萃取(12.41 mg/g),这可能是由于磷脂在超临界CO2中的溶解能力非常有限,限制了其向油相中的迁移[9]。
2.4 制油工艺对亚麻籽油体外抗氧化活性的影响
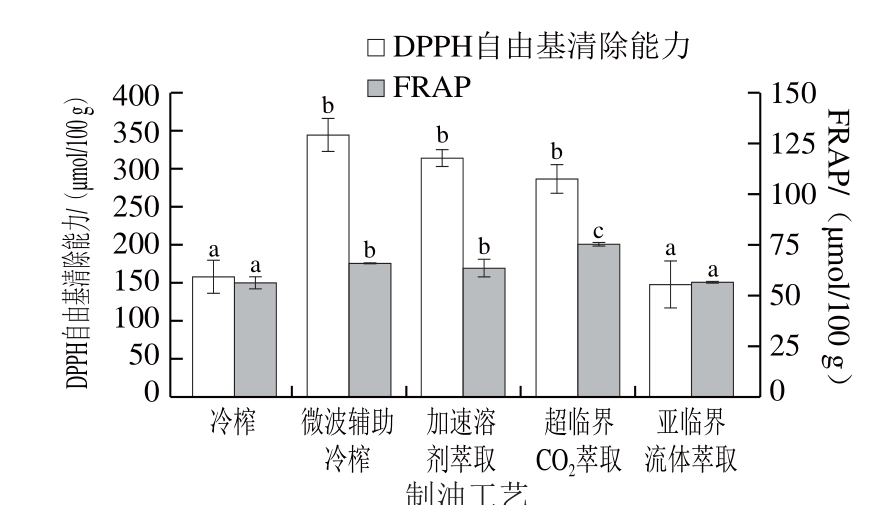
图8 不同制油工艺亚麻籽油的抗氧化能力
Fig. 8 Antioxidant capacities of flaxseed oils produced by different techniques
如图8所示,各工艺亚麻籽油极性组分的DPPH自由基清除能力在146.99~343.38 μmol/100 g范围内,FRAP在56.27~75.30 μmol/100 g范围内。周洋[33]报道了冷榨、热榨、浸出工艺亚麻籽油的DPPH自由基清除能力约在90~130 μmol/100 g范围内,低于本实验测定结果,而FRAP约在85~130 μmol/100 g范围内,略高于本实验测定结果。
不同制油工艺对亚麻籽油的DPPH和FRAP体外抗氧化能力具有显著影响(P<0.05),其中,微波辅助冷榨亚麻籽油的DPPH自由基清除能力最强(343.38 μmol/100 g),分别是冷榨的2.19 倍、加溶剂萃取的1.10 倍、 超临界CO2萃取的1.20 倍,亚临界流体萃取的2.34 倍,而FRAP最强的为超临界CO2萃取(75.30 μmol/100 g),分别是冷榨的1.34 倍、微波辅助冷榨的1.15 倍、加溶剂萃取的1.18 倍、亚临界流体萃取的1.34 倍。
2.5 制油工艺对亚麻籽油的氧化稳定性的影响
2.5.1 氧化诱导时间
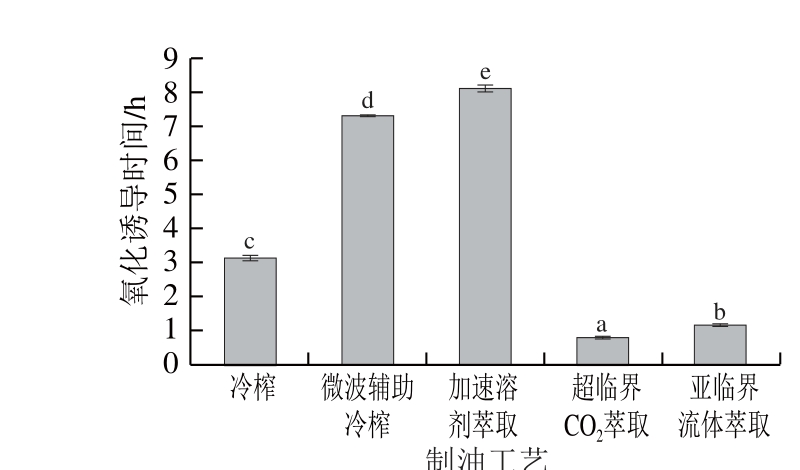
图9 不同制油工艺亚麻籽油的氧化诱导时间
Fig. 9 Oxidation induction times of flaxseed oils produced by different techniques
如图9所示,油脂在110 ℃加速氧化时,5 种制油工艺的亚麻籽油氧化诱导时间在0.80~8.15 h范围内。Bozan等[34]报道正己烷浸提亚麻籽油在110 ℃温度下的氧化诱导时间为1.57 h,本实验测定结果整体高于该值。制油工艺对亚麻籽油的氧化诱导时间存在显著影响(P<0.05)。加速溶剂萃取亚麻籽油的氧化诱导时间最长(8.15 h),其次是微波辅助冷榨油脂(7.34 h),表明这2 种工艺亚麻籽油的氧化稳定性较好。而冷榨、亚临界萃取亚麻籽油的氧化诱导时间相对较短,分别为3.15 h和1.18 h,超临界CO2萃取油脂氧化诱导时间最短(0.80 h),氧化稳定性最差。
2.5.2 氧化起始温度
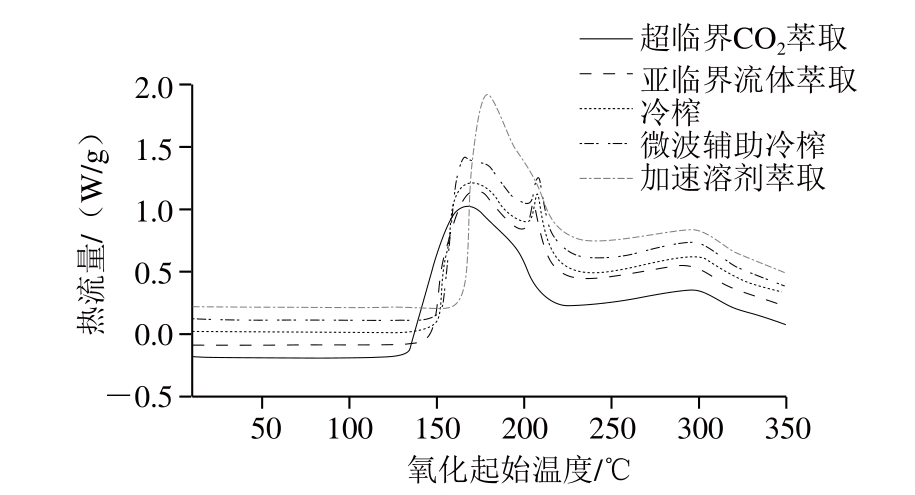
图10 不同制油工艺亚麻籽油的DSC分析图
Fig. 10 DSC analysis of flaxseed oils produced by different techniques
除氧化诱导时间外,油脂的氧化起始温度也是反映油脂氧化稳定性又一重要指标[35]。氧化起始温度是油脂在DSC仪中随着温度的上升,扫描曲线首次出现吸收峰时拐点处的温度,氧化起始温度越高,油脂的氧化稳定性越好。如图10所示,不同提取工艺亚麻籽油的DSC扫描曲线的趋势基本一致,但氧化起始温度存在显著差异(P<0.05)(表3)。Oomah等[21]报道了冷榨、溶剂提取、超临界CO2萃取亚麻籽壳油的氧化起始温度为137.7~162.5 ℃,与本实验结果基本一致。本研究中,加速溶剂萃取亚麻籽油的氧化起始温度最高(164.60 ℃),其次是微波辅助冷榨(153.68 ℃),表明这2 种工艺亚麻籽油的氧化稳定性较好,而冷榨和亚临界流体萃取亚麻籽油的氧化起始温度相对较低,超临界CO2萃取油脂的氧化起始温度最低(134.39 ℃),氧化稳定性最差。该结果与氧化诱导时间的结果一致。
表3 不同制油工艺亚麻籽油的氧化起始温度
Table 3 Oxidation onset temperatures of flaxseed oils produced by different techniques
注:同行不同字母表示差异显著(P<0.05)。
工艺 冷榨 微波辅助冷榨 加速溶剂萃取 超临界CO2萃取 亚临界流体萃取氧化起始温度/℃ 149.93±0.47c 153.68±0.32d 164.60±2.28e 134.39±0.11a 147.41±0.43b
2.6 相关性分析
如表4所示,亚麻籽油的DPPH和FRAP抗氧化活性与总酚和黄酮均呈极显著正相关(P<0.01)。其中,FRAP与总酚的相关系数(r=0.913)大于与黄酮的相关系数(r=0.731),说明总酚对油脂的FRAP抗氧化活性的贡献率较大。相关研究得到类似结果,SzydlOwska-Czerniak等[19]研究表明油菜籽中总酚与DPPH、FRAP抗氧化活性的相关系数分别为0.951 6和0.946 8,达极显著相关。禹晓等[36]研究表明亚麻籽中的黄酮与DPPH、FRAP抗氧化活性的相关系数分别为0.555和0.564,达到极显著相关。本研究中,超临界CO2萃 取亚麻籽油中总酚含量最高,故表现为FRAP值最大,微波辅助冷榨油脂中黄酮含量最高,总酚含量仅次于超临界CO2萃取,故总体表现为DPPH值最大。
表4 油脂抗氧化能力与极性提取物的相关性分析
Table 4 Correlation analysis between antioxidant capacity and polar extracts

注:**.极显著相关(P<0.01)。表5同。
极性提取物 FRAP DPPH总酚 0.913** 0.782**黄酮 0.731** 0.760**
表5 油脂氧化稳定性与脂质伴随物的相关性分析
Table 5 Correlation analysis between oxidative stability and lipid concomitants
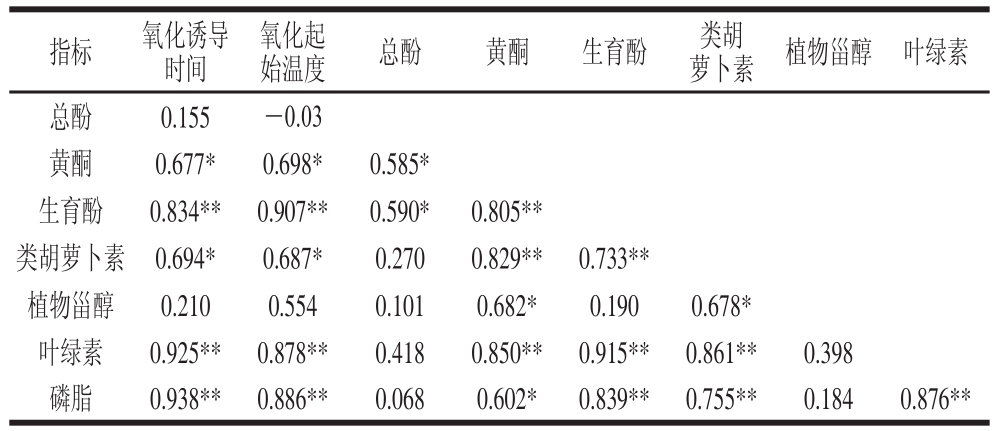
注:*.显著相关(P<0.05)。
指标 氧化诱导时间氧化起始温度 总酚 黄酮 生育酚 类胡萝卜素 植物甾醇 叶绿素总酚 0.155 -0.03黄酮 0.677* 0.698* 0.585*生育酚 0.834** 0.907** 0.590* 0.805**类胡萝卜素 0.694* 0.687* 0.270 0.829** 0.733**植物甾醇 0.210 0.554 0.101 0.682* 0.190 0.678*叶绿素 0.925** 0.878** 0.418 0.850** 0.915** 0.861** 0.398磷脂 0.938** 0.886** 0.068 0.602* 0.839** 0.755** 0.184 0.876**
如表5所示,磷脂、叶绿素、生育酚、类胡萝卜素、黄酮与氧化诱导时间和氧化起始温度均呈显著正相关,其中,与氧化诱导时间的相关系数r2分别为0.938、0.925、0.834、0.694、0.677,与氧化起始温度的相关系数r2分别为0.886、0.878、0.907、0.687、0.698。表明这些脂质伴随物对油脂的氧化稳定性发挥着积极作用。
相关研究表明磷脂可能对油脂发挥抗氧化作用,其作用机制主要是磷脂具有螯合金属离子、清除自由基的能力并且可促进美拉德反应产物的形成[37]。叶绿素是一种光敏剂,在光照下可促进三线态氧转变为单线态氧,进而促进油脂氧化[38]。但另有研究表明叶绿素及其降解产物脱镁叶绿素对避光存储的菜籽油和大豆油发挥抗氧化作用,其作用机制被认为是叶绿素及其降解产物对过氧自由基及其他自由基具有清除作用[39]。本研究中亚麻籽油的氧化诱导时间和氧化起始温度均在黑暗条件下进行测定,故叶绿素可能对亚麻籽油发挥抗氧化作用。生育酚是一种天然的抗氧化剂,可通过自身产生的酚氧基淬灭单线态氧,保护不饱和脂质免受损伤,同时还可以被超氧阴离子自由基和羟自由基氧化,使不饱和油脂免受自由基进攻,进而提高油脂的氧化稳定性[40]。类胡萝卜素是一种有效的单线态氧和光敏剂的淬灭剂,它可以通过降低激发态光敏剂和单线态氧的活性延缓油脂氧化[41]。相关研究表明,从植物中提取的天然黄酮类物质可对油脂发挥抗氧化作用[42-43],其抗氧化机制主要是清除自由基和鳌合金属离子。
加速溶剂萃取和微波辅助冷榨亚麻籽油中生育酚、类胡萝卜素、叶绿素、磷脂和黄酮含量较高,故表现为氧化稳定性较好,冷榨、亚临界流体萃取亚麻籽油中上述有益脂质伴随 物含量相对较低,氧化稳定性较差。而超临界CO2萃取油脂中除总酚外,其余各有益脂质伴随物均较低,并且该工艺亚麻籽油中多不饱和脂肪酸含量 较高,油脂更易于氧化,故总体来说超临界CO2萃取亚麻籽油的氧化稳定性最差。
2.7 主成分分析
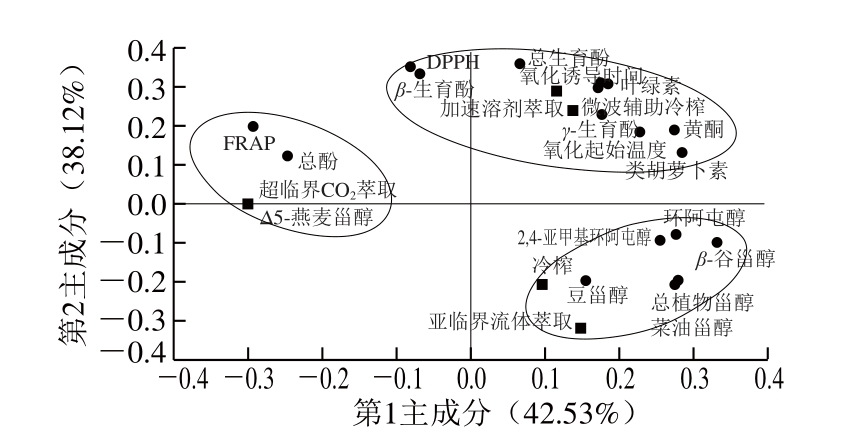
图11 不同制油工艺亚麻籽油脂质伴随物、抗氧化能力和氧化稳定性的主成分分析
Fig. 11 PCA of lipid concomitants, antioxidant capacity and oxidative stability of flaxseed oils produced by different techniques
将5 种制油工艺亚麻籽油的脂质伴随物、氧化稳定性、抗氧化能力进行主成分分析,探究油脂品质与制油工艺之间的相关性。如图11所示,第1主成分贡献率为42.53%,第2主成分贡献率为38.12%,两主成分的累计贡献率为80.65%。主成分分析将5 种制油工艺分为3 类,第1类为加速溶剂萃取和微波辅助冷榨亚麻籽油,分布在PC1的正半轴,该类油脂的生育酚、黄酮、类胡萝卜素、叶绿素、磷脂等脂质伴随物含量较高,氧化稳定性较好,DPPH自由基抗氧化活性较强。第2类为冷榨和亚临界流体萃取亚麻籽油,分布在PC2的负半轴,该类油脂中植物甾醇总量及各分量(Δ5-燕麦甾醇除外)含量较高。第3类为超临界CO2萃取亚麻籽油,分布在PC1的负半轴,该类油脂中总酚含量较高,具有较高的FRAP抗氧化活性。
3 结 论
不同制油工艺对亚麻籽油得率和基本理化品质以及典型脂质伴随物含量具有特异性影响,其中超临界CO2萃取对α-亚麻酸和总酚具有较好的富集效果,加速溶剂萃取和微波辅助冷榨工艺对生育酚、叶绿素、类胡萝卜素、黄酮、磷脂的提取效率较高,而亚临界流体萃取对植物甾醇的提取效率较高。
不同制油工艺对亚麻籽油的体外抗氧化活性和氧化稳定性具有显著性影响(P<0.05),这与油脂中典型脂质伴随物的含量密不可分。由相关性分析和主成分分分析的结果可知,加速溶剂萃取和微波辅助冷榨亚麻籽油的DPPH自由基体外抗氧化活性较强,氧化稳定性较好,这主要归因于油脂中生育酚、叶绿素、类胡萝卜素、黄酮、磷脂等脂质伴随物含量较高,而冷榨、亚临界流体萃取和超临界CO2萃取亚麻籽油的氧化稳定性相对较差,但超临界CO2萃取油脂的FRAP体外抗氧化活性较强,这主要归因于该工艺油脂中总酚含量较高。
本研究基于多变量分析探讨了制取工艺-典型活性脂质伴随物-油脂氧化稳定性和体外抗氧化活性之间的联动关系,为亚麻籽油的提质制取和高值化加工利用提供一定理论依据。
[1] 陈海华. 亚麻籽的营养成分及开发利用[J]. 中国油脂, 2004, 29(6):72-75. DOI:10.3321/j.issn:1003-7969.2004.06.023.
[2] VIJAIMOHAN K, JAINU M, SABITHA K E, et al. Beneficial effects of alpha linolenic acid rich flaxseed oil on growth performance and hepatic cholesterol metabolism in high fat diet fed rats[J]. Life Sciences, 2015, 79(3): 448-454. DOI:10.1515/ijfe-2014-0234.
[3] WADA S. Cancer preventive effects of vitamin E[J]. Current Pharmaceutical Biotechnology, 2012, 13(1): 156-164.DOI:10.2174/138920112798868656.
[4] ROOPCHAND D E, KUHN P, ROJO L E, et al. Blueberry polyphenol-enriched soybean flour reduces hyperglycemia, body weight gain and serum cholesterol in mice[J]. Pharmacological Research, 2013, 68(1): 59-67. DOI:10.1016/j.phrs.2012.11.008.
[5] SHUANG R, RUI X, WENFANG L. Phytosterols and dementia[J].Plant Foods for Human Nutrition, 2016, 71(4): 1-8. DOI:10.1007/s11130-016-0574-1.
[6] 陈晓迪, 刘飞, 徐虹. 脂溶性天然抗氧化剂的研究进展[J]. 食品科学,2017, 38(3): 299-304. DOI:10.7506/spkx1002-6630-201703047.
[7] 李媛媛, 吴雪辉, 段卓. 微波处理对亚麻籽油品质的影响[J]. 中国油脂, 2015, 40(1): 55-58. DOI:10.3969/j.issn.1003-7969.2015.01.015.
[8] KHATTAB R Y, ZEITOUN M A. Quality evaluation of flaxseed oil obtained by different extraction techniques[J]. LWT-Food Science and Technology, 2013, 53(1): 338-345. DOI:10.1016/j.lwt.2013.01.004.
[9] DUNFORD N T, ZHANG M. Pressurized solvent extraction of wheat germ oil[J]. Food Research International, 2003, 36(9/10): 909.DOI:10.1016/s0963-9969(03)00099-1.
[10] PRADHAN R C, MEDA V, ROUT P K, et al. Supercritical CO2 extraction of fatty oil from flaxseed and comparison with screw press expression and solvent extraction processes[J]. Journal of Food Engineering, 2010, 98(4): 393-397. DOI:10.1016/j.jfoodeng.2009.11.021.
[11] 陈中伟, 丁芬, 吴其飞, 等. 亚临界丙烷、超临界CO2及正己烷对米糠油提取品质的对比研究[J]. 中国粮油学报, 2017, 32(3): 36-41; 47.DOI:10.3969/j.issn.1003-0174.2017.03.007.
[12] ZANQUI A B, MORAIS D R, SILVA C M, et al. Subcritical extraction of flaxseed oil with n-propane: composition and purity[J]. Food Chemistry, 2015, 188: 452-458. DOI:10.1016/j.foodchem.2015.05.033.
[13] 曹伟伟, 黄庆德, 田光晶, 等. 微波预处理亚麻籽对其压榨饼生氰糖苷含量及压榨油品质的影响[J]. 食品工业科技, 2016, 37(9): 134-138. DOI:10.13386/j.issn1002-0306.2016.09.018.
[14] PIVA G S, WESCHENFELDER T A, FRANCESCHI E, et al.Extraction and modeling of flaxseed (Linnum usitatissimum) oil using subcritical propane[J]. Journal of Food Engineering, 2018, 228: 50-56.DOI:10.1016/j.jfoodeng.2018.02.012.
[15] PARRY J, SU L, LUTHER M, et al. Fatty acid composition and antioxidant properties of cold-pressed marionberry, boysenberry, red raspberry, and blueberry seed oils[J]. Journal of Agricultural & Food Chemistry, 2005, 53(3): 566-573. DOI:10.1021/jf048615t.
[16] KOSKI A, PSOMIADOU E, TSIMIDOU M, et al. Oxidative stability and minor constituents of virgin olive oil and cold-pressed rapeseed oil[J]. European Food Research and Technology, 2002, 214(4): 294-298. DOI:10.1007/s00217-001-0479-5.
[17] 易志. 亚麻籽油贮藏稳定性研究[D]. 广州: 华南农业大学, 2016: 15-16.
[18] 黄颖, 郑畅, 刘昌盛, 等. 催熟与微波预处理对菜籽油品质的影响[J].中国油脂, 2019, 44(7): 39-43.
[19] SZYDLOWSKA-CZERNIAK A, TROKOWSKI K, KARLOVITS G,et al. Determination of antioxidant capacity, phenolic acids, and fatty acid composition of rapeseed varieties[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7502-7509. DOI:10.1021/jf100852x.
[20] SZYDLOWSKA-CZERNIAK A, DIANOCZKI C, RECSEG K,et al. Determination of antioxidant capacities of vegetable oils by ferric-ion spectrophotometric methods[J]. Talanta, 2008, 76(4): 905.DOI:10.1016/j.talanta.2008.04.055.
[21] OOMAH B D, SITTER L. Characteristics of flaxseed hull oil[J]. Food Chemistry, 2009, 114(2): 623-628. DOI:10.1016/j.foodchem.2008.09.096.
[22] 张逸. 沙棘油的提质制取及对青紫蓝兔视网膜光损伤的预防作用研究[D]. 武汉: 中国农业科学院, 2016: 11-12.
[23] BARROSO A K M, TORRES A G, CASTELO-BRANCO V N, et al.Brown and golden flaxeed: chemical and functional properties of the seeds and the cold-pressed oils[J]. Ciência Rural, 2014, 44(1):181-187. DOI:10.1590/S0103-84782014000100029.
[24] 任我行, 刘玉兰, 徐建国. 不同工艺制取亚麻籽油的品质差异分析[J]. 粮食与食品工业, 2017, 24(1): 3-7. DOI:10.3969/j.issn.1672-5026.2017.01.002.
[25] AZADMARD-DAMIRCHI S, HABIBI-NODEH F, HESARI J, et al.Effect of pretreatment with microwaves on oxidative stability and nutraceuticals content of oil from rapeseed[J]. Food Chemistry, 2010,121(4): 1211-1215. DOI:10.1016/j.foodchem.2010.02.006.
[26] CHOO W S, BIRCH J, DUFOUR J P. Physicochemical and quality characteristics of cold-pressed flaxseed oils[J]. Journal of Food Composition and Analysis, 2007, 20(3/4): 202-211. DOI:10.1016/j.jfca.2006.12.002.
[27] HERCHI W, SAKOUHI F, ARRÁEZ-ROMÁN D, et al. Changes in the content of phenolic compounds in flaxseed oil during development[J]. Journal of the American Oil Chemists' Society, 2011,88(8): 1135-1142. DOI:10.1007/s11746-011-1783-2.
[28] KHAIRULLAH M N, YAZID A M M, PING T C, et al. The effects of different extraction methods on antioxidant properties, chemical composition, and thermal behavior of black seed (Nigella sativa L.) oil[J].Evidence-Based Complementary and Alternative Medicine, 2016:1-10. DOI:10.1155/2016/6273817.
[29] RAMSAY A, FLINIAUX O, QUÉRO A, et al. Kinetics of the incorporation of the main phenolic compounds into the lignan macromolecule during flaxseed development[J]. Food Chemistry,2016, 217: 1-8. DOI:10.1016/j.foodchem.2016.08.039.
[30] 魏晓珊, 邓乾春, 张逸, 等. 亚麻籽油中植物甾醇含量的测定[J]. 中国油脂, 2015, 40(11): 107-111. DOI:10.3969/j.issn.1003-7969.2015.11.022.
[31] XU B, HAN J, ZHOU S, et al. Quality characteristics of wheat germ oil obtained by innovative subcritical butane experimental equipment[J]. Journal of Food Process Engineering, 2016, 39(1):79-87. DOI:10.1111/jfpe.12201.
[32] VALENTOVÁ O, NOVOTNÁ Z, SVOBODA Z, et al. Influence of microwave treatment on the quality of rapeseed oil[J]. Journal of the American Oil Chemists' Society, 2002, 79(12): 1271-1272.DOI:10.1007/s11746-002-0639-7.
[33] 周洋. 加工对亚麻籽油有益脂质伴随物和抗氧化能力的影响[D].无锡: 江南大学, 2018: 27-28.
[34] BOZAN B, TEMELLI F. Chemical composition and oxidative stability of flax, safflower and poppy seed and seed oils[J].Bioresource Technology, 2008, 99(14): 6354-6359. DOI:10.1016/j.biortech.2007.12.009.
[35] OSTROWSKA-LIGEZA E, BEKAS W, KOWALSKA D, et al.Kinetics of commercial olive oil oxidation: dynamic differential scanning calorimetry and Rancimat studies[J]. European Journal of Lipid Science & Technology, 2010, 112(2): 268-274. DOI:10.1002/ejlt.200900064.
[36] 禹晓, 黄沙沙, 程晨, 等. 不同品种亚麻籽组成及抗氧化特性分析[J]. 中国油料作物学报, 2018, 40(6): 147-156. DOI:10.7505/j.issn.1007-9084.2018.06.01.
[37] KOGA T, TERAO J. Antioxidant activity of a novel phosphatidyl derivative of vitamin E in lard and its model system[J]. Journal of Agricultural and Food Chemistry, 1994, 42(6): 1291-1294.DOI:10.1021/jf00042a007.
[38] CHOE E, MIN D B. Mechanisms of antioxidants in the oxidation of foods[J]. Comprehensive Reviews in Food Science and Food Safety,2009, 8(4): 345-358. DOI:10.1111/j.1541-4337.2009.00085.x.
[39] ENDO Y, USUKI R, KANEDA T. Antioxidant effects of chlorophyll and pheophytin on the autoxidation of oils in the dark. I. Comparison of the inhibitory effects[J]. Journal of the American Oil Chemists'Society, 1985, 62(9): 1375-1378. DOI:10.1007/bf02545962.
[40] 鲁志成, 谷克仁, 邓芳. 天然维生素E的抗氧化性及其影响因素的分析与探讨[J]. 中国油脂, 2003, 28(8): 59-62.
[41] JUNG M Y, MIN D B. Effect of quenching mechanisms of carotenoids on the photosensitized oxidation of soybean oil[J]. Journal of the American Oil Chemists' Society, 1991, 68(9): 653-658. DOI:10.1007/BF02662288.
[42] 缪成贵, 韩飞园, 钟敏. 香菇总黄酮抗油脂氧化作用研究[J]. 中国林副特产, 2010(1): 13-15. DOI:10.13268/j.cnki.fbsic.2010.01.001.
[43] 杜永华, 敖光辉, 魏琴, 等. 油樟叶总黄酮含量测定及其抗油脂氧化活性[J]. 江苏农业科学, 2015, 43(8): 308-311. DOI:10.15889/j.issn.1002-1302.2015.08.102.