玛咖(Lepidium meyenii Walp)原产于海拔3 500~4 500 m的秘鲁安第斯高山地区,为十字花科(Cruciferae)独行菜属(Lepidium)草本植物的新鲜或干燥块根[1]。研究表明,玛咖是世界上发现的营养成分最丰富的药食两用植物之一[2-3]。玛咖中不仅含有多种氨基酸、多种维生素、蛋白质、多糖、还原糖、脂肪酸和不饱和脂肪酸等营养成分[1,4-5],还含有芥子油苷、异硫氰酸苄酯、玛咖酰胺、玛咖烯、生物碱、牛磺酸、甾醇、黄酮、矿物质元素等生物活性物质[1,6-8],具有提高生育力和改善性功能、抗衰老、抗氧化、调节内分泌和缓解女性更年期综合症、抗抑郁、抗疲劳和耐缺氧、提高记忆力和增强学习能力、增强免疫力、抗癌、抗炎症、抗病毒、抗贫血、降糖、降血脂、抑制骨质疏松、抗前列腺增生等功效[4-7,9-11]。因此,玛咖素有“秘鲁人参”[12]和“玛咖医生”[13]的美称,具有重要药用价值和经济价值。我国于2003年在云南丽江引种玛咖并栽培成功,并相继在四川、西藏、新疆、青海、贵州、吉林等地区引种成功[7,14],2011年玛咖被列入我国食品新资源目录并开始大面积种植[4]。云南丽江与玛咖原产地秘鲁同处于高纬度、高海拔地区,气候类似,昼夜温差大,特别适合玛咖生长,成为我国玛咖主产区,2015年玛咖种植面积突破9 333 hm2[14]。研究表明,云南丽江玛咖品质接近或优于秘鲁玛咖[2]。玛咖为高寒山区产业结构优化、农民脱贫致富提供了一条新途径。
近年来,农药已在农作物和中药材种植中广泛应用,造成了未加工原材料中的农药残留。因此,在农副产品和中药材投入使用之前,很有必要进行农药残留量的检测,以提高在国际市场上的竞争力。广谱性杀虫剂如有机氯和菊酯类农药曾在农业生产中被广泛使用。有机氯农药虽然早已被各国明令禁止使用,但由于其具有毒性大、性质稳定和降解缓慢等特点[15],能长期残留于土壤和农副产品中;菊酯类农药具有速效、低毒等特点而至今都被广泛使用[16],但其大量使用也会导致在土壤和农副产品中的积聚并通过生物链转移和富集到动物和人体内,引起人畜中毒,对生态环境和人类健康造成很大危害。鉴于有机氯和菊酯类农药都具有较大的神经毒性[17],我国制定的2015年版《中国药典》和多个农药残留量国家标准[18]对中药材和农副产品中有机氯和菊酯类农药的最高残留量进行了严格限制。目前,国内多依据农业行业标准[19-20]以及食品安全国家标准[21]测定农副产品中的有机氯和菊酯类农药残留量,但这些标准中的方法存在前处理繁琐耗时,溶剂使用量大,农药需分成多组使用双柱测试,广谱性农药无法一次性检测等问题。因此,很有必要建立一种简单、快速、经济的能同时检测多种有机氯和菊酯类农药残留量的方法。
有机氯和菊酯类农药含有卤素、 氧等电负性较大的元素以及具有高温可气化特点,通常用气相色谱(gas chromatography,GC)进行分离后,用电子捕获检测器(electronic capture detector,ECD)[22-23]或质谱(mass spectrometry,MS)[24-25]进行定性/定量检测。其中GC-MS方法中一般使用全扫模式定性,采用选择离子扫描(selective ion monitoring,SIM)方式或多反应监测(multiple reaction monitoring,MRM)模式定量,而MS的MRM模式特异性强、抗干扰能力强、灵敏度高,是目前最灵敏的MS模式,尤其适合于复杂基质中农药残留的检测。目前关于玛咖的研究主要集中在活性组分或功能性成分、营养成分、挥发性成分等化学成分的提取分离、结构鉴定、功效等方面[2],而对于玛咖中农药残留量却鲜有报道。玛咖成分复杂,首先要建立合适的样品前处理方法,使玛咖中微量的农药成分被充分提取出来,然后通过选择适当的净化方法尽量消 除基质的干扰。固相萃取柱是从层析柱发展起来的一种用于萃取、分离、浓缩的样品前处理装置,高效、高选择性的固定相可实现对干扰杂质的选择性吸附,基于固相萃取的样品前处理方法具有溶剂用量少、快速、操作简单、费用低、污染少、回收率良好等优点而受到广大研究者们的青睐[26]。本实验拟采用超声波辅助提取、固相萃取净化技术对玛咖样品进行前处理,用含中等极性固定相的毛细管单柱GC分离残留农药,以MS的全扫模式、MRM模式联合外标法分别对41 种有机氯和菊酯类农药进行定性和定量,旨在建立一种简单、快捷、准确、经济、适合大批量玛咖样品中有机氯和菊酯类农药残留的快速筛查和定量检测方法,应用推广性强。
1 材料与方法
1.1 材料与试剂
样品:玛咖干样,采样地点为云南丽江市玉龙县。
石墨化碳/氨基复合型小柱(500 mg/500 mg/6 mL)天津博纳艾杰尔科技有限公司;0.45 μm有机相滤膜天津市津腾实验设备有限公司;氦气(纯度≥99.999%)四川梅塞尔气体产品有限公司;氩气(纯度≥99.999%)梅塞尔格里斯海姆(昆明)气体产品有限公司;乙腈、甲苯、正己烷、丙酮(均为分析纯) 国药集团化学试剂有限公司;标准品:百菌清(101.4 μg/mL)、联苯菊酯(99.0 μg/mL)、25 种有机氯农药混合溶液(100 μg/mL)、23 种农药混合溶液(100 μg/mL)美国A ChemTek. Inc.公司。
1.2 仪器与设备
456-GC/SCION TQ GC-MS联用仪(配置电子电离源和质量分析器) 德国布鲁克公司;TDL-40B离心机上海安亭科学仪器厂;SB-5200DT超声波清洗机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 样品前处理
玛咖干果经粉碎后称取5 g,加入去离子水20 mL,振荡使混匀,加入乙腈25 mL,超声提取30 min,过滤,滤液收集于预先放入8 g NaCl的50 mL塑料离心管中,超声20 min促进NaCl溶解于水层并分层,静置约10 min使之彻底分层,取上层(乙腈层)10 mL,旋蒸至近干,用A液体(乙腈-甲苯(3∶1,V/V))2 mL溶解,采用石墨化碳/氨基复合型小柱净化,用6 mL A液体转出样液,再用2 次6 mL A液体洗脱,经净化后收集的液体约20 mL,浓缩至近干,用2 mL正己烷溶解,再经0.45 μm有机滤膜过滤后上机测试。
1.3.2 标准工作溶液配制及校准曲线制作
分别移取0.20 mL百菌清(101.4 μg/mL)、0.20 mL联苯菊酯(99.0 μg/mL)、0.20 mL 25 种有机氯农药混合溶液(100 μg/mL)、0.20 mL 23 种农药混合溶液(100 μg/mL)于同一个2 mL容量瓶中,用丙酮定容至刻度,得到农药质量浓度10 μg/mL的混合标准 溶液(α-六六六、五氯硝基苯、β-六六六、γ-六六六、δ-六六六的质量浓度均为20 μg/mL);再采用逐级稀释法,配制得到农药质量浓度分别为4、2、0.5、0.1、0.05、0.02 μg/mL的标准工作溶液(α-六六六、五氯硝基苯、β-六六六、γ-六六六、δ-六六六的质量浓度为其他农药质量浓度的2 倍),上机分析制作校准曲线。
1.3.3 仪器条件
1.3.3.1 GC条件
色谱柱Agilent J&W DB-17MS毛细管柱(30 m×0.25 mm,0.25 μm);载气He;载气流速1.2 mL/min;进样口温度290 ℃;分流方式:不分流;柱温(程序升温):初始温度60 ℃,保持1 min,以30 ℃/min升温至130 ℃,保持1 min,然后以5 ℃/min升温至250 ℃,保持1 min,再以8 ℃/min升温至280 ℃,保持2 min,最后以20 ℃/min升温至300 ℃,保持7 min;进样量1 μL。
1.3.3.2 MS条件
电离方式:电子电离源;电离电压:70 eV;灯丝电流:80 μA;碰撞气(Ar)压力:2.0 mTorr(相当于0.27 Pa);离子源温度:230 ℃;传输线温度:280 ℃;溶剂延迟时间:15 min;定性:全扫描方式,质量扫描范围35~550 u;定量:MRM模式。
2 结果与分析
2.1 GC条件的优化
比较弱极性的HP-5MS毛细管柱(30 m×0.250 mm,0.2 5 μ m)和中等极性的D B-1 7 M S毛细管柱(30 m×0.250 mm,0.25 μm)对41 种有机氯和菊酯类农药的分离效果。结果表明,HP-5MS毛细管柱不能较好分离β-六六六与γ-六六六、乙烯菌核利与七氯、4,4’-滴滴滴与2,4’-滴滴涕、2,4’-滴滴伊与α-硫丹;DB-17MS毛细管柱能很好地分离前3 组,但在优化条件下仍然不能有效地分离2,4’-滴滴伊与α-硫丹,不过2,4’-滴滴伊与α-硫丹的定性/定量离子都不相同,不影响离子的积分,因此选择DB-17MS毛细管柱作为分离柱。
2.2 MS条件的优化
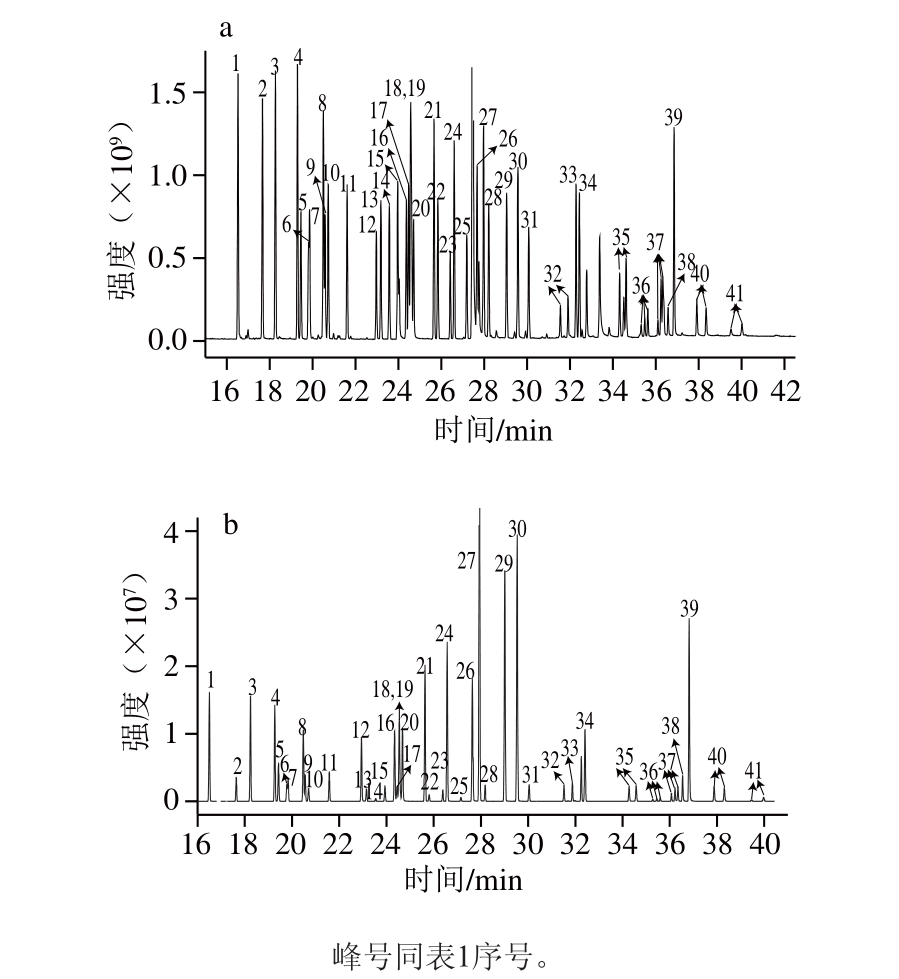
图1 41 种农药标准溶液(10 μg/mL)的SIM总离子流(aa)和MRM(b)色谱图
Fig. 1 Total ion current (a) and multiple reaction monitoring (b)chromatograms of mixed solution 41 pesticide standards (at 10 μg/mL)
表1 41 种农药的MS MS-MRM模式下检测参数
Table 1 MRM parameters for MS MS detection of the 41 pesticides
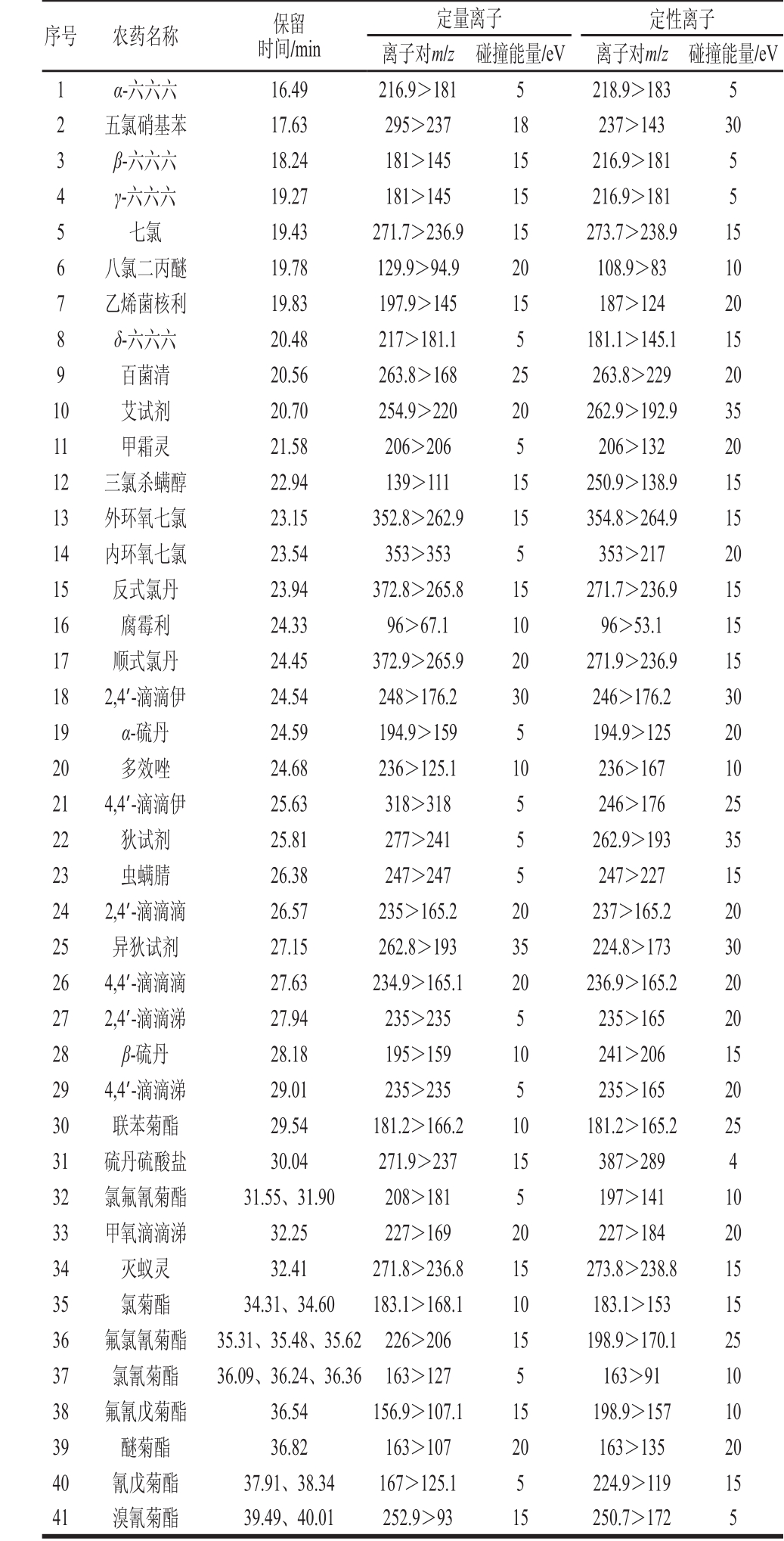
序号 农药名称 保留时间/min定量离子 定性离子离子对m/z 碰撞能量/eV 离子对m/z 碰撞能量/eV 1 α-六六六 16.49 216.9>181 5 218.9>183 5 2 五氯硝基苯 17.63 295>237 18 237>143 30 3 β-六六六 18.24 181>145 15 216.9>181 5 4 γ-六六六 19.27 181>145 15 216.9>181 5 5 七氯 19.43 271.7>236.9 15 273.7>238.9 15 6 八氯二丙醚 19.78 129.9>94.9 20 108.9>83 10 7 乙烯菌核利 19.83 197.9>145 15 187>124 20 8 δ-六六六 20.48 217>181.1 5 181.1>145.1 15 9 百菌清 20.56 263.8>168 25 263.8>229 20 10 艾试剂 20.70 254.9>220 20 262.9>192.9 35 11 甲霜灵 21.58 206>206 5 206>132 20 12 三氯杀螨醇 22.94 139>111 15 250.9>138.9 15 13 外环氧七氯 23.15 352.8>262.9 15 354.8>264.9 15 14 内环氧七氯 23.54 353>353 5 353>217 20 15 反式氯丹 23.94 372.8>265.8 15 271.7>236.9 15 16 腐霉利 24.33 96>67.1 10 96>53.1 15 17 顺式氯丹 24.45 372.9>265.9 20 271.9>236.9 15 18 2,4’-滴滴伊 24.54 248>176.2 30 246>176.2 30 19 α-硫丹 24.59 194.9>159 5 194.9>125 20 20 多效唑 24.68 236>125.1 10 236>167 10 21 4,4’-滴滴伊 25.63 318>318 5 246>176 25 22 狄试剂 25.81 277>241 5 262.9>193 35 23 虫螨腈 26.38 247>247 5 247>227 15 24 2,4’-滴滴滴 26.57 235>165.2 20 237>165.2 20 25 异狄试剂 27.15 262.8>193 35 224.8>173 30 26 4,4’-滴滴滴 27.63 234.9>165.1 20 236.9>165.2 20 27 2,4’-滴滴涕 27.94 235>235 5 235>165 20 28 β-硫丹 28.18 195>159 10 241>206 15 29 4,4’-滴滴涕 29.01 235>235 5 235>165 20 30 联苯菊酯 29.54 181.2>166.2 10 181.2>165.2 25 31 硫丹硫酸盐 30.04 271.9>237 15 387>289 4 32 氯氟氰菊酯 31.55、31.90 208>181 5 197>141 10 33 甲氧滴滴涕 32.25 227>169 20 227>184 20 34 灭蚁灵 32.41 271.8>236.8 15 273.8>238.8 15 35 氯菊酯 34.31、34.60 183.1>168.1 10 183.1>153 15 36 氟氯氰菊酯 35.31、35.48、35.62 226>206 15 198.9>170.1 25 37 氯氰菊酯 36.09、36.24、36.36 163>127 5 163>91 10 38 氟氰戊菊酯 36.54 156.9>107.1 15 198.9>157 10 39 醚菊酯 36.82 163>107 20 163>135 20 40 氰戊菊酯 37.91、38.34 167>125.1 5 224.9>119 15 41 溴氰菊酯 39.49、40.01 252.9>93 15 250.7>172 5
采用SIM和MRM两种模式对41 种农药进行检测分析。通过比较发现,采用MRM模式比采用SIM模式有更高的信噪比和灵敏度,并且MRM模式一方面能克服SIM模式中不同农药存在相同扫描离子而对定性/定量带来的困扰,另一方面能有效提高多种农药同时检测对分辨率的要求[27]。此外,MRM模式选择性更好,抗干扰能力更强,更适合于复杂基质中农药多残留的检测。因此,在MRM模式下,进行MS参数的优化。从全扫描MS图(图1a)上选择质荷比(m/z)大及丰度高的离子定为母离子,设定不同的碰撞能量对母离子进行轰击得到子离子MS/MS扫描图,从中选择响应值最高的2~3 个碎片离子作为子离子,改变碰撞电压优化各组母离子和子离子[28]。最后选择响应最好的组合,确定了41 种有机氯和菊酯类农药MRM的最佳MS条件,MRM-MS图见图1b,详细结果见表1。
2.3 样品前处理方法的优化
乙腈对大多数农药均有较好的溶解度且脂肪在乙腈中的溶解度较小[29],且乙腈具有极性大、穿透力强、提取率高等优点[30],本实验选择乙腈作为提取溶剂;而通常的提取方式有机械振荡、索氏提取、超声波辅助提取等[31]。考虑到实验室可行条件及 方法适合推广的要求,本研究采用乙腈溶解超声波辅助提取的方式。玛咖干粉中先加入一定量水是为了使玛咖充分地浸润,一方面有利于乙腈更好地渗透到玛咖颗粒内部结构中去,另一方面水可以除去玛咖中大部分多糖、还原糖、蛋白等水溶性成分[32]。提取液经过滤后加入氯化钠超声助溶使水相形成氯化钠饱和溶液,有利于水相与有机相的分离。
用于有机氯和菊酯类农药多残留样品处理的最常用的净化柱主要包括氨基固相萃取柱、弗罗里硅土柱、C18柱、石墨化碳黑柱、石墨化碳/氨基复合柱等[15,29,33]。一般认为复合净化剂比单一净化剂效果好,而由于石墨化碳/氨基复合柱处理样品较为干净、干扰峰少,有较好的回收率,在农残样品前处理方面的应用日益广泛[34]。因此,本研究选择石墨化碳/氨基复合柱净化处理 玛咖样品提取液,见图2,而洗脱液选用乙腈-甲苯(3∶1,V/V)混合溶剂。石墨化碳经过特殊表面处理,对平面结构的化合物如色素有很强的吸附能力,可以去除色素的干扰[35],氨基键合硅胶则可以除去金属离子、极性有机酸、酚类和某些糖类杂质[15]。在保证良好回收率的前提下,本研究中的样品前处理方法相对于目前大多数常见的样品前处理方法具有更简便省时、节省有机溶剂的优点,见表2。

图2 石墨化碳/氨基复合柱净化示意图
Fig. 2 Schematic of the Purification with graphite carbon/amino composite column
表2 不同检测方法和样品前处理方法的特征参数比较
Table 2 Comparison of characteristic parameters between different analytical methods with different sample pretreatments
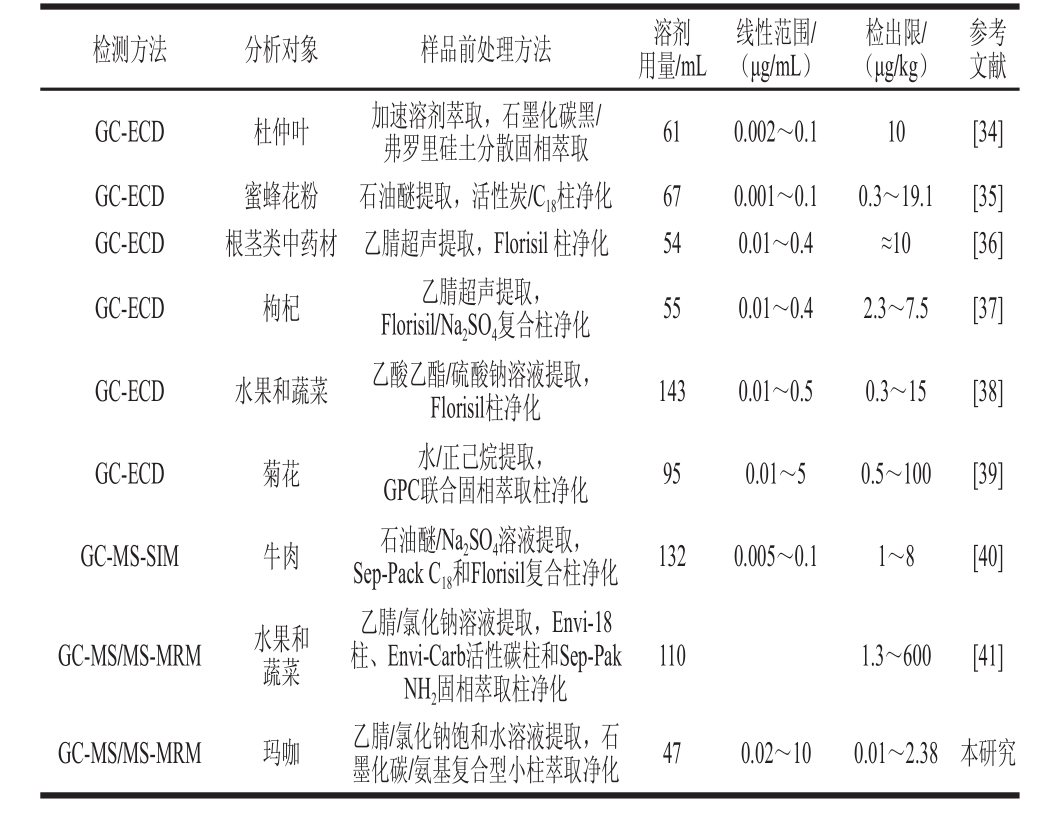
参考文献GC-ECD 杜仲叶 加速溶剂萃取,石墨化碳黑/弗罗里硅土分散固相萃取 61 0.002~0.1 10 [34]GC-ECD 蜜蜂花粉 石油醚提取,活性炭/C18柱净化 67 0.001~0.1 0.3~19.1 [35]GC-ECD 根茎类中药材 乙腈超声提取,Florisil 柱净化 54 0.01~0.4 ≈10 [36]GC-ECD 枸杞 乙腈超声提取,Florisil/Na2SO4复合柱净化 55 0.01~0.4 2.3~7.5 [37]GC-ECD 水果和蔬菜 乙酸乙酯/硫酸钠溶液提取,Florisil柱净化 143 0.01~0.5 0.3~15 [38]GC-ECD 菊花 水/正己烷提取,GPC联合固相萃取柱净化 95 0.01~5 0.5~100 [39]GC-MS-SIM 牛肉 石油醚/Na2SO4溶液提取,Sep-Pack C18和Florisil复合柱净化 132 0.005~0.1 1~8 [40]GC-MS/MS-MRM 水果和蔬菜乙腈/氯化钠溶液提取,Envi-18柱、Envi-Carb活性碳柱和Sep-Pak NH2固相萃取柱净化110 1.3~600 [41]GC-MS/MS-MRM 玛咖 乙腈/氯化钠饱和水溶液提取,石墨化碳/氨基复合型小柱萃取净化 47 0.02~10 0.01~2.38 本研究检测方法 分析对象 样品前处理方法 溶剂用量/mL线性范围/(μg/mL)检出限/(μg/kg)
2.4 线性范围和检出限
配制0.02、0.05、0.1、0.5、2、4、10 μg/mL 7 个质量浓度(其中α-六六六、五氯硝基苯、β-六六六、γ-六六六、δ-六六六的各级质量浓度皆为相应质量浓度的2 倍)的混合标准工作溶液上机测试,以农药定量离子的峰面积y为纵坐标,以质量浓度x(μg/mL)为横坐标绘制标准曲线并进行线性拟合,得到线性回归方程,以3 倍信噪比(RSN)计算检出限,结果见表3。41 种有机氯和菊酯类农药在0.02~10 μg/mL或0.04~20 μg/mL范围内线性关系良好,相关系数(R2)均大于0.99,检出限为0.01~2.38 μg/kg,此值比采用ECD的GC法以及其他GC-MS联用法检测获得的检出限整体低1~3 个数量级(表2)。
表3 41 种农药的标准曲线方程、线性范围、和检出限
Table 3 Standard curve equations, linear ranges, R2 and LODs for the 41 pesticides

序号 农药名称 标准曲线方程 线性范围/(μg/mL)系数R2检出限/(μg/kg)1 α-六六六 y=1.165 3×106x 0.04~20 0.998 3 0.01 2 五氯硝基苯 y=3.438 5×105x 0.04~20 0.999 1 0.02 3 β-六六六 y=1.121 3×106x 0.04~20 0.999 0 0.02 4 γ-六六六 y=9.624 5×105x 0.04~20 0.998 8 0.03 5 七氯 y=1.015 6×106x 0.02~10 0.999 5 0.07 6 八氯二丙醚 y=5.899 0×105x 0.02~10 0.999 7 0.41 7 乙烯菌核利 y=5.090 2×105x 0.02~10 0.999 0 0.07 8 δ-六六六 y=7.681 4×105x 0.04~20 0.999 1 0.04 9 百菌清 y=6.093 9×105x 0.02~10 0.999 6 0.22 10 艾试剂 y=2.789 7×105x 0.02~10 0.998 7 0.07 11 甲霜灵 y=6.971 9×105x 0.02~10 0.998 5 0.02 12 三氯杀螨醇 y=2.602 7×106x 0.02~10 0.999 2 0.01 13 外环氧七氯 y=3.501 2×105x 0.02~10 0.998 4 0.06 14 内环氧七氯 y=9.327 3×104x 0.02~10 0.997 4 0.44 15 反式氯丹 y=3.3752×105x 0.02~10 0.998 4 0.17 16 腐霉利 y=2.318 7×106x 0.02~10 0.999 2 0.07相关
续表3
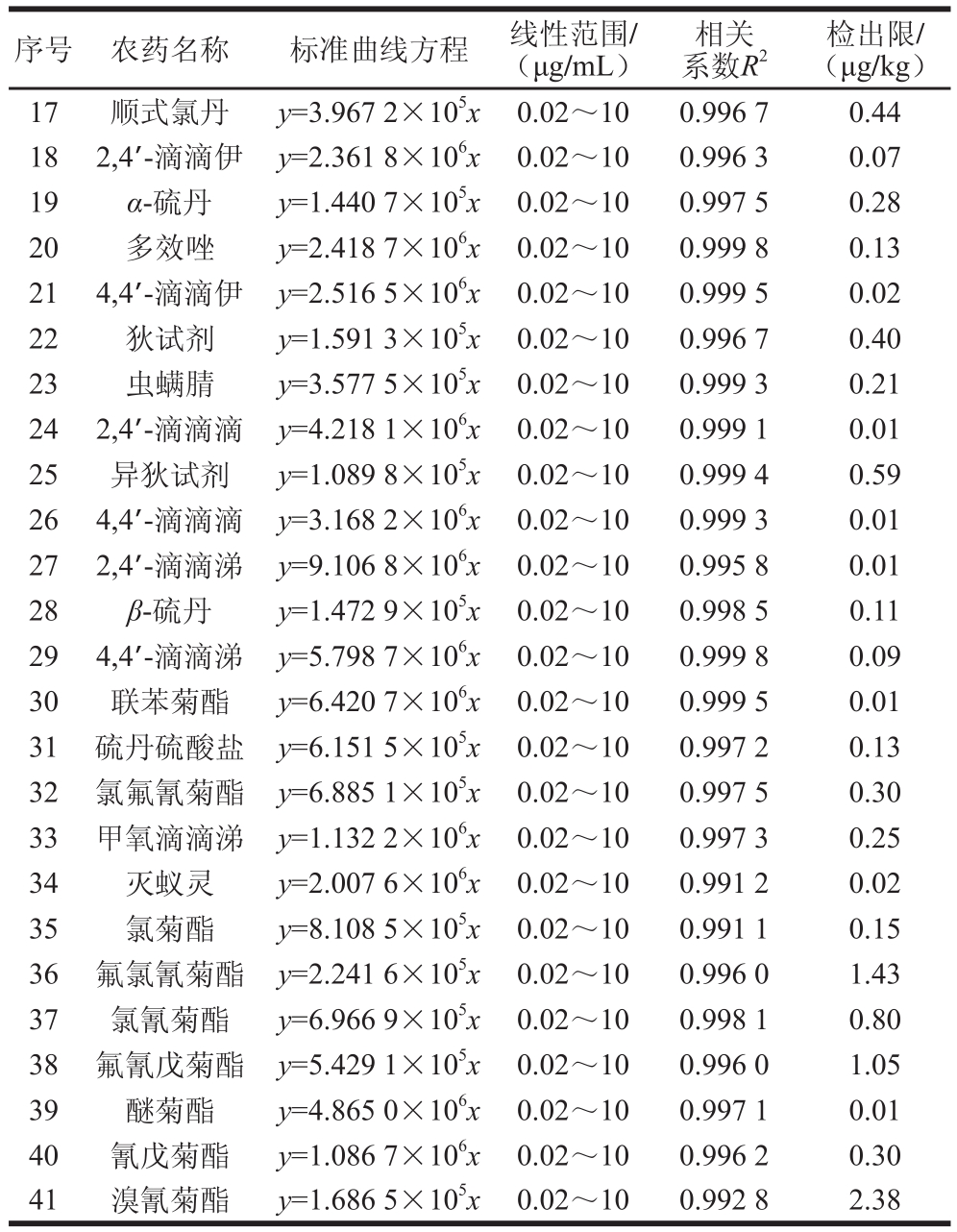
序号 农药名称 标准曲线方程 线性范围/(μg/mL)相关系数R2检出限/(μg/kg)17 顺式氯丹 y=3.967 2×105x 0.02~10 0.996 7 0.44 18 2,4’-滴滴伊 y=2.361 8×106x 0.02~10 0.996 3 0.07 19 α-硫丹 y=1.440 7×105x 0.02~10 0.997 5 0.28 20 多效唑 y=2.418 7×106x 0.02~10 0.999 8 0.13 21 4,4’-滴滴伊 y=2.516 5×106x 0.02~10 0.999 5 0.02 22 狄试剂 y=1.591 3×105x 0.02~10 0.996 7 0.40 23 虫螨腈 y=3.577 5×105x 0.02~10 0.999 3 0.21 24 2,4’-滴滴滴 y=4.218 1×106x 0.02~10 0.999 1 0.01 25 异狄试剂 y=1.089 8×105x 0.02~10 0.999 4 0.59 26 4,4’-滴滴滴 y=3.168 2×106x 0.02~10 0.999 3 0.01 27 2,4’-滴滴涕 y=9.106 8×106x 0.02~10 0.995 8 0.01 28 β-硫丹 y=1.472 9×105x 0.02~10 0.998 5 0.11 29 4,4’-滴滴涕 y=5.798 7×106x 0.02~10 0.999 8 0.09 30 联苯菊酯 y=6.420 7×106x 0.02~10 0.999 5 0.01 31 硫丹硫酸盐 y=6.151 5×105x 0.02~10 0.997 2 0.13 32 氯氟氰菊酯 y=6.885 1×105x 0.02~10 0.997 5 0.30 33 甲氧滴滴涕 y=1.132 2×106x 0.02~10 0.997 3 0.25 34 灭蚁灵 y=2.007 6×106x 0.02~10 0.991 2 0.02 35 氯菊酯 y=8.108 5×105x 0.02~10 0.991 1 0.15 36 氟氯氰菊酯 y=2.241 6×105x 0.02~10 0.996 0 1.43 37 氯氰菊酯 y=6.966 9×105x 0.02~10 0.998 1 0.80 38 氟氰戊菊酯 y=5.429 1×105x 0.02~10 0.996 0 1.05 39 醚菊酯 y=4.865 0×106x 0.02~10 0.997 1 0.01 40 氰戊菊酯 y=1.086 7×106x 0.02~10 0.996 2 0.30 41 溴氰菊酯 y=1.686 5×105x 0.02~10 0.992 8 2.38
2.5 方法的精密度和回收率
在空白基质中分别添加0.018、0.074、0.36 mg/kg三个水平的标准溶液做回收率实验,每个添加水平重复测定6 次。方法的精密度用6 次平行测定的相对标准偏差(relative standard deviation,RSD)表示。结果表明,41 种有机氯和菊酯类农药的平均加标回收率为90.2%~108.8%,RSD为2.1%~10.9%,见表4。
表4 41 种有机氯和菊酯类农药在空白基质中的平均回收率及RSD( =6)
Table 4 Average recoveries and precision of the 41 organochlorine and pyrethroid pesticides spiked into blank matrices (n = 6)

序号 农药名称回收率/% RSD/% 平均添加量0.018 mg/kg 添加量0.074 mg/kg 添加量0.36 mg/kg平均回收率/% RSD/% 平均回收率/% RSD/%1 α-六六六 107.3 10.7 104.2 8.5 104.8 7.0 2 五氯硝基苯 108.5 9.5 106.0 7.7 105.6 6.4 3 β-六六六 103.9 7.6 106.3 6.2 100.3 5.3 4 γ-六六六 104.8 9.1 96.9 7.4 101.0 6.2 5 七氯 104.2 9.4 108.5 9.6 102.9 7.8 6 八氯二丙醚 92.3 8.3 101.4 6.7 97.3 5.7 7 乙烯菌核利 92.2 4.8 99.8 3.9 98.2 3.6 8 δ-六六六 98.9 5.9 99.9 4.8 94.5 4.2 9 百菌清 90.6 10.2 92.7 8.3 90.9 6.9 10 艾试剂 97.7 6.1 97.4 5.0 92.8 2.1 11 甲霜灵 90.2 7.0 96.5 5.7 101.7 4.9 12 三氯杀螨醇 99.0 5.3 95.8 4.3 99.3 3.9 13 外环氧七氯 101.8 4.9 91.5 4.0 97.6 3.6
续表4
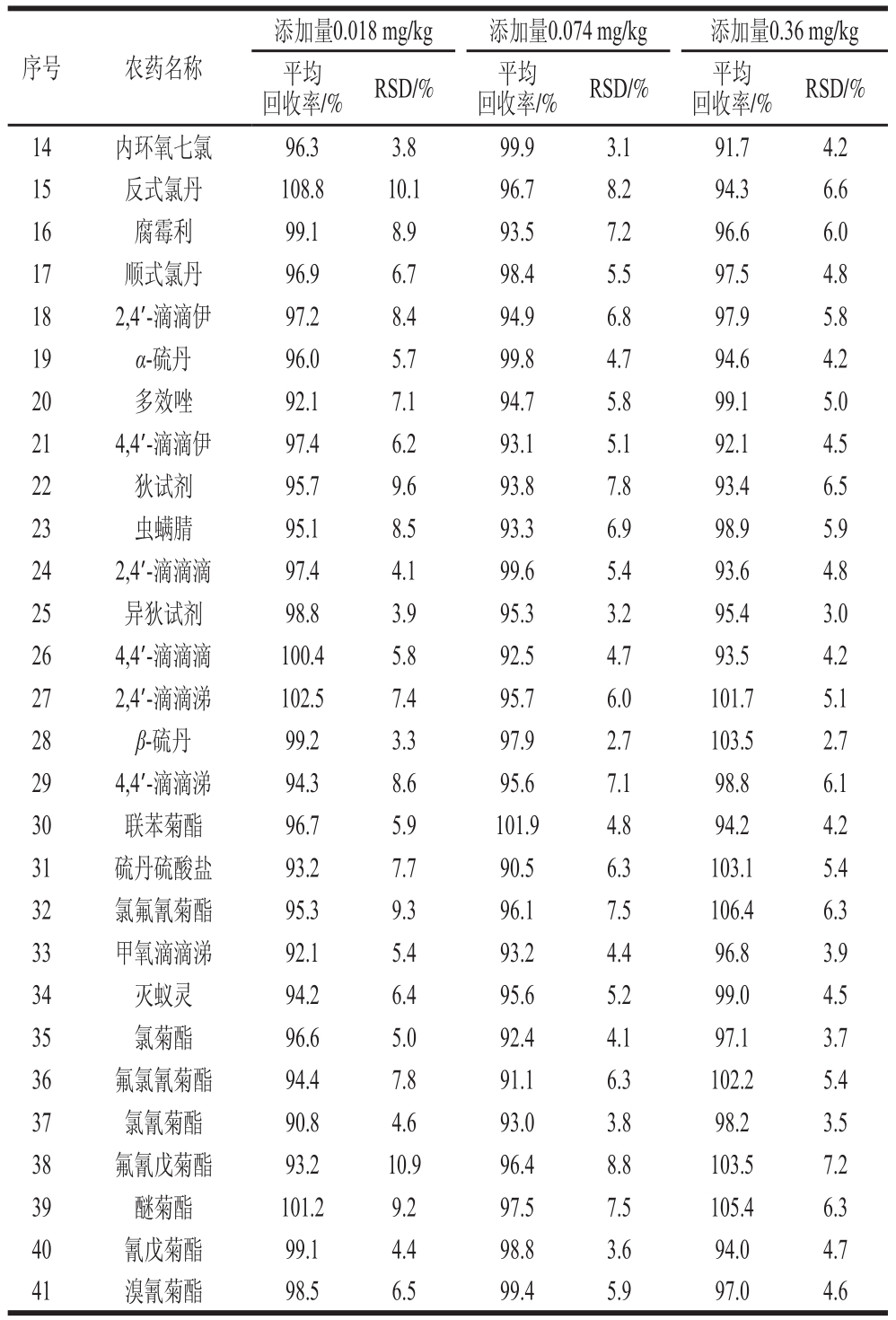
序号 农药名称回收率/% RSD/% 平均添加量0.018 mg/kg 添加量0.074 mg/kg 添加量0.36 mg/kg平均回收率/% RSD/% 平均回收率/% RSD/%14 内环氧七氯 96.3 3.8 99.9 3.1 91.7 4.2 15 反式氯丹 108.8 10.1 96.7 8.2 94.3 6.6 16 腐霉利 99.1 8.9 93.5 7.2 96.6 6.0 17 顺式氯丹 96.9 6.7 98.4 5.5 97.5 4.8 18 2,4’-滴滴伊 97.2 8.4 94.9 6.8 97.9 5.8 19 α-硫丹 96.0 5.7 99.8 4.7 94.6 4.2 20 多效唑 92.1 7.1 94.7 5.8 99.1 5.0 21 4,4’-滴滴伊 97.4 6.2 93.1 5.1 92.1 4.5 22 狄试剂 95.7 9.6 93.8 7.8 93.4 6.5 23 虫螨腈 95.1 8.5 93.3 6.9 98.9 5.9 24 2,4’-滴滴滴 97.4 4.1 99.6 5.4 93.6 4.8 25 异狄试剂 98.8 3.9 95.3 3.2 95.4 3.0 26 4,4’-滴滴滴 100.4 5.8 92.5 4.7 93.5 4.2 27 2,4’-滴滴涕 102.5 7.4 95.7 6.0 101.7 5.1 28 β-硫丹 99.2 3.3 97.9 2.7 103.5 2.7 29 4,4’-滴滴涕 94.3 8.6 95.6 7.1 98.8 6.1 30 联苯菊酯 96.7 5.9 101.9 4.8 94.2 4.2 31 硫丹硫酸盐 93.2 7.7 90.5 6.3 103.1 5.4 32 氯氟氰菊酯 95.3 9.3 96.1 7.5 106.4 6.3 33 甲氧滴滴涕 92.1 5.4 93.2 4.4 96.8 3.9 34 灭蚁灵 94.2 6.4 95.6 5.2 99.0 4.5 35 氯菊酯 96.6 5.0 92.4 4.1 97.1 3.7 36 氟氯氰菊酯 94.4 7.8 91.1 6.3 102.2 5.4 37 氯氰菊酯 90.8 4.6 93.0 3.8 98.2 3.5 38 氟氰戊菊酯 93.2 10.9 96.4 8.8 103.5 7.2 39 醚菊酯 101.2 9.2 97.5 7.5 105.4 6.3 40 氰戊菊酯 99.1 4.4 98.8 3.6 94.0 4.7 41 溴氰菊酯 98.5 6.5 99.4 5.9 97.0 4.6
2.6 实际样品检测结果
表5 玛咖样品信息
Table 5 Levels of pesticide residues in real samples determined by the GGCC--MMSS/MS metthhoodd
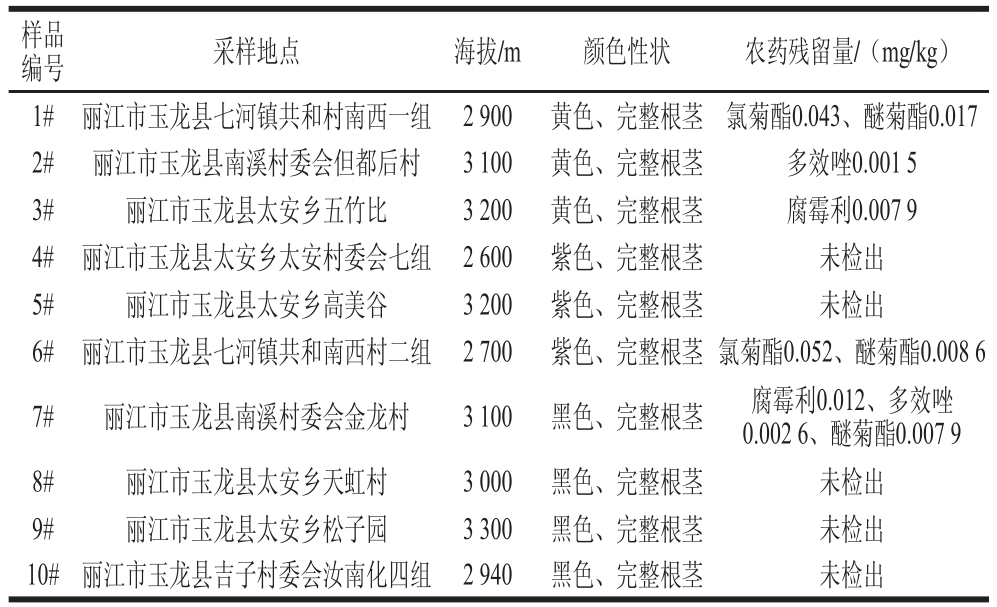
样品编号 采样地点 海拔/m 颜色性状 农药残留量/(mg/kg)1# 丽江市玉龙县七河镇共和村南西一组 2 900 黄色、完整根茎 氯菊酯0.043、醚菊酯0.017 2# 丽江市玉龙县南溪村委会但都后村 3 100 黄色、完整根茎 多效唑0.001 5 3# 丽江市玉龙县太安乡五竹比 3 200 黄色、完整根茎 腐霉利0.007 9 4# 丽江市玉龙县太安乡太安村委会七组 2 600 紫色、完整根茎 未检出5# 丽江市玉龙县太安乡高美谷 3 200 紫色、完整根茎 未检出6# 丽江市玉龙县七河镇共和南西村二组 2 700 紫色、完整根茎 氯菊酯0.052、醚菊酯0.008 6 7# 丽江市玉龙县南溪村委会金龙村 3 100 黑色、完整根茎 腐霉利0.012、多效唑0.002 6、醚菊酯0.007 9 8# 丽江市玉龙县太安乡天虹村 3 000 黑色、完整根茎 未检出9# 丽江市玉龙县太安乡松子园 3 300 黑色、完整根茎 未检出10# 丽江市玉龙县吉子村委会汝南化四组 2 940 黑色、完整根茎 未检出
为验证丽江玛咖食用的安全性,本实验测定了该产地10 种玛咖中41 种农药残留情况。由表5可知,在这10 种样品中,5 种样品未检出任何农药残留,另外5 个样品中检出了少量腐霉利、多效唑、氯菊酯、醚菊酯,但都明显低于GB 2763—2014《食品中农药最大残留限量》中对于根茎类和薯芋类蔬菜的最大残留限量。况且,腐霉利、多效唑、氯菊酯、醚菊酯等属于低毒、高效、在哺乳动物体内蓄积性很小的农药。由此可见,丽江玛咖除了品质高以外,食用安全性也很高。
3 结 论
由于玛咖样品基质的复杂性,玛咖样品中的农药残留分析通常不容易获得准确而稳定的结果。本实验通过对GC条件、MS条件、样品前处理方法等进行选择和优化,建立了超声波辅助提取-固相萃取净化-GC-MS/MS法同时测定玛咖中41 种有机氯和菊酯类农药残留的分析方法。方法简捷、快速、净化效果好、灵敏度高、选择性好、回收率好、重复性好,可满足复杂基质玛咖样品中有机氯和菊酯类农药残留的快速筛查定性和定量分析要求。
[1] 许敏, 王兆杰, 杨少杰, 等. 玛咖的化学成分和生物活性研究进展[J]. 食品研究与开发, 2017, 38(1): 193-199. DOI:10.3969/j.issn.1005-6521.2017.01.045.
[2] 胡昕, 杨万林, 杨芳, 等. 云南不同产地玛咖营养品质分析及安全性评价[J]. 西南农业学报, 2018, 31(12): 2646-2652. DOI:10.16213/j.cnki.scjas.2018.12.031.
[3] WANG S N, ZHU F. Chemical composition and health effects of maca (Lepidium meyenii)[J]. Food Chemistry, 2019, 288: 422-443.DOI:10.1016/j.foodchem.2019.02.071.
[4] 崔耀天, 赵乐荣, 于建伟, 等. 玛咖中总游离氨基酸的提取纯化工艺研究[J]. 食品科技, 2017, 42(12): 235-238. DOI:10.13684/j.cnki.spkj.2017.12.043.
[5] 刘侗, 田琳琳, 孙佳明, 等. 玛咖的化学成分及其药理作用研究进展[J]. 吉林中医药, 2015, 35(8): 820-823. DOI:10.13463/j.cnki.jlzyy.2015.08.020.
[6] 杨群擎. 丽江玛咖产业发展现状及建议[J]. 现代农业科技, 2016(14): 319.
[7] 潘明佳, 时圣明, 王文倩, 等. 玛咖的化学成分、药理作用及质量评价研究进展[J]. 现代药物与临床, 2015, 30(12): 1558-1562.DOI:10.7501/j.issn.1674-5515.2015.12.030.
[8] 郑茜, 张庆贺, 卢丹, 等. 吉林产玛咖的化学成分研究[J]. 中草药,2014, 45(17): 2457-2460. DOI:10.7501/j.issn.0253-2670.2014.17.007.
[9] 刘文星, 董淼, 张芮绮, 等. 丽江产玛咖中的1 个新玛咖酰胺[J]. 中草药, 2018, 49(19): 4491-4493. DOI:10.7501/j.issn.0253-2670.2018.19.004.
[10] 刘文星, 董淼, 张芮绮, 等. 丽江产玛咖的化学成分研究[J]. 云南大学学报(自然科学版), 2019, 41(1): 157-163. DOI:10.7540/j.ynu.20180372.
[11] 赵利清, 王勇. 发展丽江玛咖产业探讨[J]. 云南农业, 2017(9): 65-68.
[12] 芮文. 丽江玛咖产业现状和发展趋势[J]. 云南农业, 2014(5): 55-56.
[13] 余龙江, 张永忠, 金文闻, 等. 玛咖醇提取物对小鼠的抗衰老作用[J].中草药, 2006, 37(1): 81-83.
[14] 张利军. 玛咖对2型糖尿病降糖作用及机理研究[D]. 北京: 中国科学院大学, 2017: 111.
[15] 邓小娟, 李文斌, 晋立川, 等. QuEChERS-气相色谱法测定牛奶中24 种有机氯及菊酯类农药残留[J]. 食品科学, 2016, 37(18): 141-145. DOI:10.7506/spkx1002-6630-201618023.
[16] 蔡东倩. 固相萃取气相色谱串联质谱法分析水中26 种有机氯农药和菊酯类农药[J]. 环境保护与循环经济, 2016(6): 53-56.
[17] 诸思燕. 固相萃取有机氯农药及菊酯类农药气相色谱法的研究[J].食品科学, 2001, 22(8): 74-76.
[18] 国家卫生和计划生育委员会, 农业部. 食品中农药最大残留限量:GB 2763—2014[S]. 北京: 中国标准出版社, 2014: 1-224.
[19] 农业部. 蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定: NY/T 761—2008[S]. 北京: 中国农业出版社, 2008: 1-30.
[20] 农业部. 蔬菜中334 种农药多残留的测定 气相色谱质谱法和液相色谱质谱法: NY/T 1379—2007[S]. 北京: 中国农业出版社, 2007: 1-21.
[21] 国家卫生和计划生育委员会, 农业部, 国家食品药品监督管理总局.水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱-质谱法: GB 23200.8—2016[S]. 北京: 中国标准出版社, 2016: 1-60.
[22] YANG G G, HE Z Y, LIU X K, et al. Polymer-coated magnetic nanospheres for preconcentration of organochlorine and pyrethroid pesticides prior to their determination by gas chromatography with electron capture detection[J]. Microchimica Acta, 2016, 183(3):1187-1194. DOI:10.1007/s00604-015-1725-z.
[23] MALHAT F M, HAGGAG M N, LOUTFY N M, et al. Residues of organochlorine and synthetic pyrethroid pesticides in honey, an indicator of ambient environment, a pilot study[J]. Chemosphere,2015, 120: 457-461. DOI:10.1016/j.chemosphere.2014.08.032.
[24] ANAND N, KUNDA A, RAY S. A validated method for the determination of neonicotinoid, pyrethroid and organochlorine residues in human milk[J]. Chromatographia, 2018, 81(2): 315-325.DOI:10.1007/s10337-017-3436-6.
[25] MAHUGIJA J A M, KHAMIS F A, LUGWISHA E H J. Determination of levels of organochlorine, organophosphorus, and pyrethroid pesticide residues in vegetables from markets in Dar es Salaam by GC-MS[J]. International Journal of Analytical Chemistry, 2017, 2017:4676724. DOI:10.1155/2017/4676724.
[26] LOTTI M, BLEECKER M L. Handbook of clinical neurology[M]. 3rd ed. Washington: Elsevier Science Inc., 2015: 135-148. DOI:10.1016/B978-0-444-62627-1.00009-3.
[27] 赵丽, 张瑞雨, 梁志坚, 等. 全自动固相萃取-气相色谱串联质谱测定生活饮用水中16 种有机氯和菊酯农药残留[J]. 华南预防医学,2018, 44(5): 480-483. DOI:10.13217/j.scjpm.2018.0480.
[28] 范磊, 黄素华, 何日安, 等. 气相色谱-质谱法测定水中持久性有机氯污染物[J]. 中国环境监测, 2013, 29(6): 139-143. DOI:10.19316/j.issn.1002-6002.2013.06.027.
[29] 贺小雨, 陈树兵, 俞雪钧, 等. 冷冻去脂-固相萃取/气相色谱-质谱法对水产品中禾草丹、溴氰菊酯及19 种有机氯农药残留的测定[J].分析测试学报, 2009, 28(3): 306-309.
[30] 杨晓凤, 谢淋, 韩梅, 等. 凝胶渗透色谱净化-气相色谱法测定茶叶中30 种有机氯及菊酯类农药残留量[J]. 理化检验: 化学分册, 2011,47: 698-700.
[31] SUN J W, ZHANG Y, WANG S. Development of an enzyme-linked immunosorbent assay for metolcarb residue analysis and investigation of matrix effects from different agricultural products[J]. Analytical and Bioanalytical Chemistry, 2009, 394(8): 2223-2230. DOI:10.1007/s00216-009-2911-9.
[32] 李婧. 玛咖主要水溶性抗疲劳功能成分研究[D]. 无锡: 江南大学,2018: 38-39.
[33] 黄晓会, 薛健, 吴晓波, 等. 气相色谱法检测桑叶中有机氯及菊酯类农药[J]. 分析科学学报, 2012, 28(3): 328-332.
[34] 王素方, 张西安, 张东飞, 等. 气相色谱法快速测定杜仲叶中有机氯菊酯类农药残留[J]. 食品科学, 2009, 30(18): 323-326.
[35] ZHANG L, WANG Y, SUN C, et al. Simultaneous determination of organochlorine, organophosphorus, and pyrethroid pesticides in bee pollens by solid-phase extraction cleanup followed by gas chromatography using electron-capture detector[J]. Food Analytical Methods, 2013, 6(6): 1508-1514. DOI:10.1007/s12161-012-9539-7.
[36] 黄晓会, 薛健, 吴晓波, 等. 根茎类中药材有机氯及菊酯类农药多残留分析[J]. 中成药, 2012, 34(1): 100-104.
[37] HUANG X H, XUE J, WANG Y, et al. Rapid simultaneous determination of organochlorine and pyrethroid pesticide residues in Lycium barbarum L. using gas chromatography with electroncapture detector[J]. Analytical Methods, 2012, 4: 1132-1141. DOI:10.1039/c2ay05625a.
[38] SHARIF Z, MAN Y B C, HAMID N S A, et al. Determination of organochlorine and pyrethroid pesticides in fruit and vegetables using solid phase extraction clean-up cartridges[J]. Journal of Chromatography A, 2006, 1127: 254-261. DOI:10.1016/j.chr oma.2006.06.007.
[39] XUE J Y, XU Y J, LIU F M, et al. Comparison of different sample pretreatments for multi-residue analysis of organochlorine and pyrethroid pesticides in chrysanthemum by gas chromatography with electron capture detection[J]. Journal of Separation Science, 2013, 36: 1311-1316.DOI:10.1002/jssc.201201067.
[40] STEFANELLI P, SANTILIO A, CATALDI L, et al. Multiresidue analysis of organochlorine and pyrethroid pesticides in ground beef meat by gas chromatographymass spectrometry[J]. Journal of Environmental Science and Health Part B, 2009, 44: 350-356.DOI:10.1080/03601230902801000.
[41] 国家质量监督检验检疫总局, 国家标准化管理委员会. 水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱-质谱法: GB/T 19648—2006[S]. 北京: 中国标准出版社, 2006: 1-19.