 值均远小于1表明南京市猪肉产品中43 种兽药残留对人群健康不会造成危害。
值均远小于1表明南京市猪肉产品中43 种兽药残留对人群健康不会造成危害。中国是猪肉消费大国,年消耗量接近全球总量一半,是人民日常饮食中必不可少的组成部分[1]。近年来,接连曝出“瘦肉精”、“病死猪肉”等事件引起了全社会的广泛关注,肉制品监管成为了民众热切关心的话题。抗菌类药基于其广谱抗菌性和廉价性是目前最为常用的兽药,其中根据合成方式可分为微生物分泌的天然抗生素(以四环素类、大环内脂类和β-内酰胺类为代表)和合成抗生素(以磺胺类、喹诺酮类为代表)。随着 政府部门的监督管理的加强,盐酸克仑特罗等禁用药物正在逐渐减少,而抗菌类药物由于其规定的最高残留限量值较为宽松,其检出率近年来有增加的趋势,养殖户如果未能严格遵守休药期规定则会容易引起残 留量检出或超标[2-4]。养殖过程中使用兽药无法避免,但是非法使用禁用药、过量使用限量药、不遵守休药期规定、屠宰前用药的情况普遍存在。研究表明,抗菌类兽药具有致癌、致畸、致突变性,长期食用超过每日允许摄入量(acceptable daily intake,ADI)的食品,会导致各种急慢性中毒。此外,畜禽长期过量服用某类兽药会产生耐药菌株,影响其临床效果[5-7]。因此对猪肉产品中磺胺类、喹诺酮类、四环素类、大环内脂类和β-内酰胺类药物进行检测和风险评估十分必要。
QuEChERS(quick, easy, cheap, effective, rugged, and safe)方法是在分散固相萃取技术基础上开发的一种前处理技术[8-10]。该方法一般以乙腈或酸化乙腈作为提取剂,NaCl、无水Na2SO4等无机盐作为吸水剂,C18、N-丙基乙二胺(primary secondary amine,PSA)等聚合物作为吸附剂吸附干扰物[11-13]。Martínez-Villalba等[14]使用甲醇-乙腈提取,MgSO4-PSA净化,检测了饲料和动物源性食品中抗寄生虫药残留,回收率为65%~95%。León等[15]使用0.1%乙酸-乙腈作为提取剂,NaCl、MgSO4、磁性吸附剂作为净化剂,检测了饲料中77 种兽药残留,回收率达80%~120%的良好效果。QuEChERS方法省时、操作简便、提取效果好,但是该方法研发之初是以果蔬为目标基质,对于脂含量较高的动物源性食品的应用还需要进一步探索优化。目前由安捷伦公司推出的一款新型萃取盐包作为增强型脂质去除技术(enhanced matrix removal lipid,EMR-L)改进QuEChERS方法的去脂能力。Anumol等[16]在三重四极杆和飞行时间质谱平台上比较E MR-L与分散固相萃取技术,结果显示EMR-L不论处理不同样品还是在不同质谱平台检测,都具有明显优势。Zhao Limian等[17]对EMR-L进行优化,提出两步萃取法对猪肉中兽药残留进行检测,结果显示有90%以上的药物回收率在60%~120%之间。
国内外对食品安全评估方法的研究大多遵循以下4 个步骤:危害识别、危害特征描述、暴露评估和风险特征描述[18-20]。其中暴露评估是食品安全评估的关键,包括物理、化学和生物性危害风险评估[21]。决策评估法是欧洲评估膳食化学物风险的常用方法,尤其适用于单一杀虫剂,但是不适合用于整体人群的风险评估[22]。相对潜力因子评估是对膳食化合物的暴露评估、特别是杀虫剂的风险评估方法。Sharma等[23]对有机磷酯、氨基甲酸酯等进行风险评估,认为该方法只能在具有剂量累计效应时使用。本研究采用Thomas等[24]的食品安全指数(food safety index,IFS)评估模型,通过比较人体污染物实际摄入量与安全摄入量评估食品中某种化学残留对消费者健康影响。张闻娟等[25]使用IFS模型对鸡肉中磺胺类药物进行积累性暴露评估,研究表明该模型适用于整体人群的风险评估。
目前,对动物源性食品中兽药残留的研究主要集中在检测技术手段,生猪从屠宰—预冷—物流销售环节中的磺胺类、喹诺酮类、四环素类、大环内脂类和β-内酰胺类等兽药残留分析及风险评估尚属空白。本研究选取江苏南京为研究区域,随机抽检 某屠宰 场屠宰、预冷阶段肌肉、内脏等样本240 份,及南京市4 个地区480 份市售猪肉样品,采用EMR-L方法提取净化,超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole-time-of-flight mass spectrometry,UHPLC-Q-TOF/MS)分析检测,并使用IFS模型评估南京市猪肉中磺胺类、喹诺酮类、四环素类、大环内脂类和β-内酰胺类药物残留水平和风险水平,旨在为相关部门执法和监管提供科学依据和参考。
乙腈、甲醇、甲酸、正己烷(均为色谱纯)德国Merck公司;EMR-Lipid QuEChERS萃取盐包美国Agilent公司。
43 种标准品:磺胺嘧啶、磺胺甲噁唑、磺胺间二甲氧嘧啶、磺胺吡啶、磺胺甲嘧啶、磺胺二甲嘧啶、磺胺甲噻二唑、磺胺噻唑、磺胺喹恶啉、磺胺氯哒嗪、甲氧苄氨嘧啶、磺胺甲氧哒嗪、磺胺邻二甲氧嘧啶、磺胺异噁唑、磺胺苯酰、磺胺醋酰、磺胺苯吡唑、环丙沙星、克林沙星、恩诺沙星、氟甲喹、洛美沙星、诺氟沙星、氧氟沙星、沙拉沙星、恶喹酸、培氟沙星、依诺沙星、萘啶酸、西诺沙星、二氟沙星、奥比沙星、司帕沙星、吉他霉素、泰乐霉素、四环素、土霉素、金霉素、强力霉素、青霉素V、阿莫西林、氨苄西林、头孢拉定美国Sigma公司(纯度≥99%)。分别准确称取适量标准品于25 mL容量瓶中,用甲醇溶解稀释,配制成质量浓度为1 000 mg/L的单标储备液,置于-20 ℃冰箱中贮存,保存期限为1 个月。根据需要将上述储备液混合稀释成不同质量浓度的混合标准溶液,现用现配。
Triple TOF 5600+飞行时间质谱仪(配有电喷雾离子源(electron spray ionization,ESI)及Analyst1.7数据处理系统) 美国AB公司;Nexer系列UPLC仪(包括DGU-20A5R脱气机、SIL-30AC自动进样器、SPDM-20A紫外检测器、CTO-30A柱温箱及LC-30AD溶液输送单元) 日本岛津公司;Infinity Lab Poroshell 120 EC-C18色谱柱(2.1 mm×100 mm,2.7 μm) 美国Agilent公司;Milli-Q超纯水仪 美国Millipore公司;DL-5C离心机 上海安亭科学仪器厂;T18均质机德国IKA公司;XW-80A微型旋涡混合仪 上海沪西分析仪器厂;Quintix125D-1CN十万分之一天平 德国Sartorius公司。
1.3.1 样品采集
选择某屠宰场作为屠宰和预冷阶段猪肉样本采集场所,该屠宰场猪肉商品长期销往南京各区,日均屠宰量约为1 500 头。根据NY/T 1897—2010《动物及动物产品兽药残留监控抽样规范》屠宰动物计算抽样的方法,屠宰量为501~2 000 头时,抽样个数为10 份,不同部位在屠宰和预冷阶段随机抽样,抽样部位如图1所示(肌肉组织代表性内脏:猪肝、猪肾),现取现测。

图1 猪肉组织样品抽样分布图
Fig. 1 Picture for sampling distribution of porcine carcass
本实验将南京市分为4 个地区进行抽样分析,根据上述抽样部位,每个地区抽样10 份共480 份样品。具体抽样地区为:A栖霞区;B浦口区;C南京市区包括建邺区、雨花台区、白下区、玄武区、鼓楼区和秦淮区;D江宁区。
1.3.2 样品前处理
1.3.2.1 提取方法
分别称取2 g(精确至0.1 g)均质后的猪肉、猪肝和猪肾加入至含有10 mL 0.1%甲酸-乙腈溶液的50 mL离心管中。涡旋混匀5 min后40 ℃超声水浴10 min,4 000 r/min离心5 min,取上清液备用。
1.3.2.2 净化方法
将5 mL超纯水加入EMR-L dSPE管中,涡旋15 s使其充分活化。取5 mL上清液立即加入活化后的EMR-L dSPE管中,涡旋5 min,40 ℃超声水浴10 min,以4 000 r/min离心5 min,收集5 mL上清液加入EMR-L Polish管中,重复上述涡旋、超声及离心步骤,取上层清液过0.22 μm滤膜待测。
1.3.3 仪器条件
1.3.3.1 色谱条件
色谱柱:Infinity Lab Poroshell 120 EC-C18色谱柱(2.1 mm×100 mm,2.7 μm);流速:0.2 mL/min;柱温:40 ℃;进样量:5 μL。流动相A:0.1%甲酸溶液;流动相B:0.1%甲酸-乙腈溶液。梯度洗脱程序:0~2.5 min,95%~45% A,5%~55% B;2.5~5 min,45%~10% A,55%~90% B;5~7 min,10%~95% A,90%~5% B。
1.3.3.2 质谱条件
ESI正离子模式,离子源温度550 ℃;电喷雾电压5 500 V;雾化气流速40 μL/min;辅助加热气流速40 μL/min;气帘气流速20 μL/min;去簇电压100 V;离子富集时间0.05 s;扫描范围m/z 100~1 000质谱采集参数见表1。
表1 43 种兽药的质谱采集参数
Table 1 Parameters for UHPLC-MS MS analysis of the 43 veterinary drugs
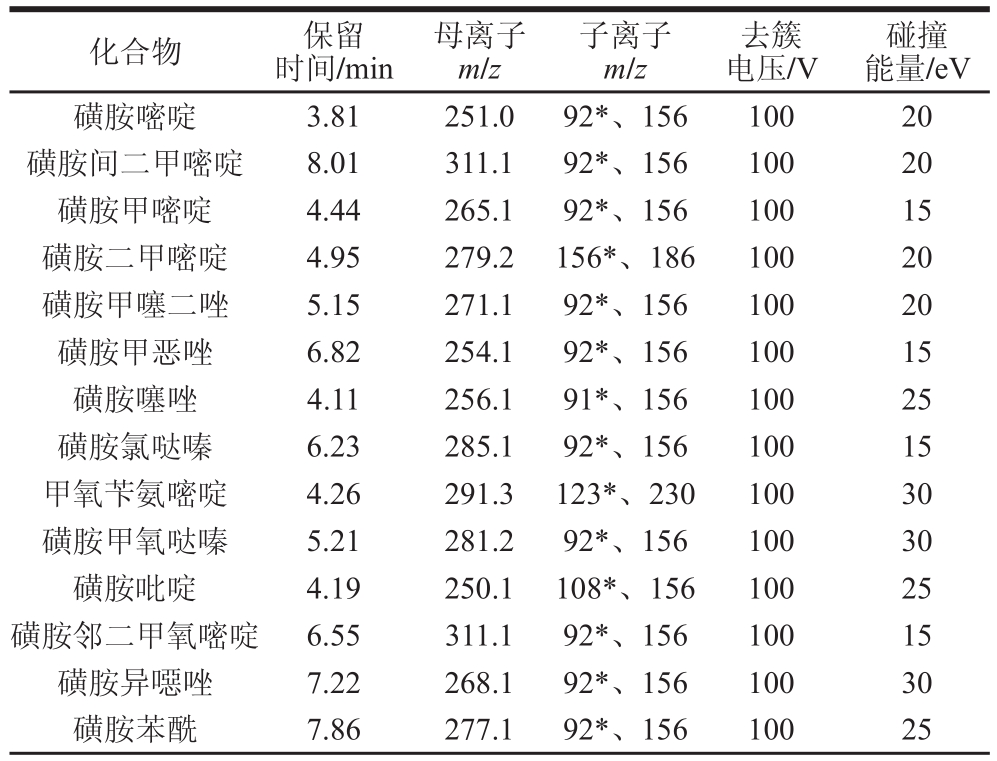
碰撞能量/eV磺胺嘧啶 3.81 251.0 92*、156 100 20磺胺间二甲嘧啶 8.01 311.1 92*、156 100 20磺胺甲嘧啶 4.44 265.1 92*、156 100 15磺胺二甲嘧啶 4.95 279.2 156*、186 100 20磺胺甲噻二唑 5.15 271.1 92*、156 100 20磺胺甲恶唑 6.82 254.1 92*、156 100 15磺胺噻唑 4.11 256.1 91*、156 100 25磺胺氯哒嗪 6.23 285.1 92*、156 100 15甲氧苄氨嘧啶 4.26 291.3 123*、230 100 30磺胺甲氧哒嗪 5.21 281.2 92*、156 100 30磺胺吡啶 4.19 250.1 108*、156 100 25磺胺邻二甲氧嘧啶 6.55 311.1 92*、156 100 15磺胺异噁唑 7.22 268.1 92*、156 100 30磺胺苯酰 7.86 277.1 92*、156 100 25化合物 保留时间/min母离子m/z子离子m/z去簇电压/V
续表1
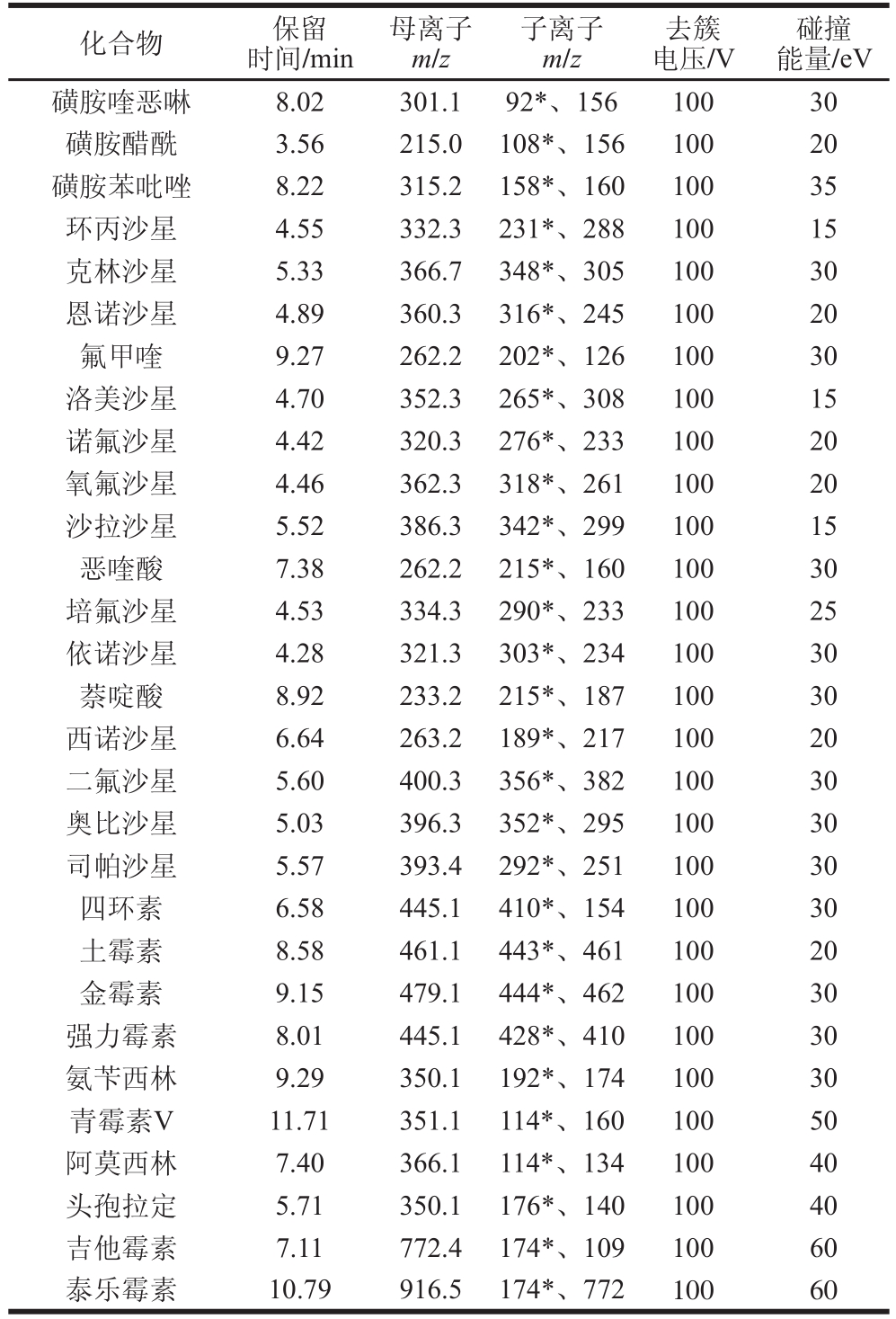
注:*.定量离子。
碰撞能量/eV磺胺喹恶啉 8.02 301.1 92*、156 100 30磺胺醋酰 3.56 215.0 108*、156 100 20磺胺苯吡唑 8.22 315.2 158*、160 100 35环丙沙星 4.55 332.3 231*、288 100 15克林沙星 5.33 366.7 348*、305 100 30恩诺沙星 4.89 360.3 316*、245 100 20氟甲喹 9.27 262.2 202*、126 100 30洛美沙星 4.70 352.3 265*、308 100 15诺氟沙星 4.42 320.3 276*、233 100 20氧氟沙星 4.46 362.3 318*、261 100 20沙拉沙星 5.52 386.3 342*、299 100 15恶喹酸 7.38 262.2 215*、160 100 30培氟沙星 4.53 334.3 290*、233 100 25依诺沙星 4.28 321.3 303*、234 100 30萘啶酸 8.92 233.2 215*、187 100 30西诺沙星 6.64 263.2 189*、217 100 20二氟沙星 5.60 400.3 356*、382 100 30奥比沙星 5.03 396.3 352*、295 100 30司帕沙星 5.57 393.4 292*、251 100 30四环素 6.58 445.1 410*、154 100 30土霉素 8.58 461.1 443*、461 100 20金霉素 9.15 479.1 444*、462 100 30强力霉素 8.01 445.1 428*、410 100 30氨苄西林 9.29 350.1 192*、174 100 30青霉素V 11.71 351.1 114*、160 100 50阿莫西林 7.40 366.1 114*、134 100 40头孢拉定 5.71 350.1 176*、140 100 40吉他霉素 7.11 772.4 174*、109 100 60泰乐霉素 10.79 916.5 174*、772 100 60化合物 保留时间/min母离子m/z子离子m/z去簇电压/V
1.3.4 风险评估
由于化学污染物的毒害作用与其进入人体的绝对量有关,所以采用IFS评价某种食品是否安全应以人体对污染物的实际摄入量与其安全摄入量比较更为科学合理[26-28]。在全面考虑研究的消费者人群饮食习惯及各种食品和化学物质的残留情况下,IFS值具备加和性。因此本研究采用IFS值评估猪肉在屠宰加工过程中磺胺类和喹诺酮类药物对人群的危害程度,采用平均值 评估消费人群的安全状态[29]。计算如式(1)~(3)所示:
评估消费人群的安全状态[29]。计算如式(1)~(3)所示:
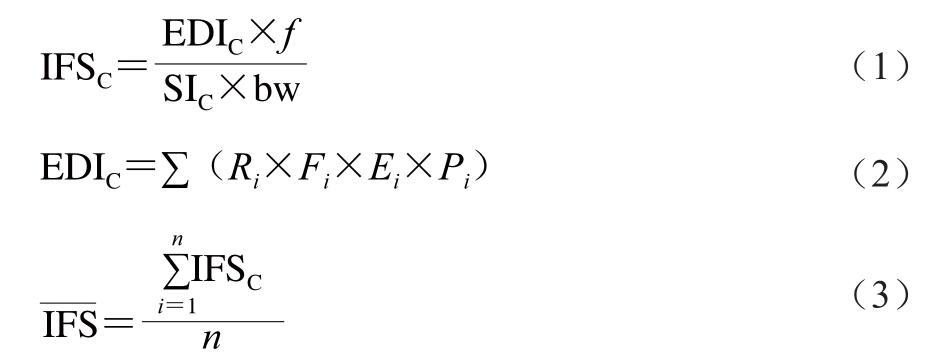
式中:EDIC为目标化合物实际摄入量的估算值;Ri为样品i中目标化合物残留量/(μg/kg);Fi为样品i估计日摄入量/(kg/(人·d));Ei为样品i的可食用部分因子;Pi为样品i的加工处理因子;SIC为目标化合物的每日允许摄入量;bw为人体平均质量/kg;f为校正因子;n为检出兽药种类。根据国际食物政策研究所2017年的统计数据显示2016年中国人均猪肉消费量约为56 kg,因此,本实验中Fi值按0.15 kg/(人·d)计算(56/365=0.153 kg),人均体质量按60 kg计算,f、Ei和Pi按1计算。
IFSC大于1表示目标化合物对食品安全的风险较高不可接受,必须采取相应预防措施;IFSC小于等于1表示目标化合物对食品安全的风险可接受;IFSC远小于1表示目标化合物对食品安全没有影响。 大于1表示消费人群的安全状态不可接受;
大于1表示消费人群的安全状态不可接受; 小于等于1表示消费人群的安全状态可接受;
小于等于1表示消费人群的安全状态可接受; 远小于1表示消费人群的安全状态良好[30]。
远小于1表示消费人群的安全状态良好[30]。
2.1.1 标准曲线和线性范围
制备基质标准曲线与对应质量浓度的溶 剂标准曲线(加标量1、5、10、20、50、100 μg/kg)。以定量离子峰面积(y)为纵坐标轴,质量浓度(x,μg/L)为横坐标绘制工作曲线,得到猪肉产品中线性回归方程的相关系数r均大于0.99,表明经过3 种方法处理过的43 种兽药在1.0~100.0 μg/L范围内线性关系良好。
2.1.2 检出限和定量限
以3 倍信噪比计算得到检出限为0.25~1.5 μg/kg,10 倍信噪比算得定量限为0.5~6.0 μg/kg,证明本方法满足对实际样品痕量分析。
2.1.3 回收率和精密度
取空白样品加入43 种兽药混合标准溶液,配制成5、10、20 μg/kg三个水平的添加样品各6 份,进行回收率实验,平均回收率为69.8%~112.4%,相对标准偏差为2.4%~14.9%,均满足残留限量检测标准。
屠宰过程猪肉产品中43 种兽药的检出情况如表2所示。240 份猪肉产品中有4 份磺胺二甲嘧啶检出,残留量为15.91 μg/kg和3.98 μg/kg(预冷:14.87、3.16 μg/kg),未超过国家规定的最高残留限量25 μg/kg。此外有2 份二氟沙星在猪肝中检出,残留量为19.03 μg/kg(预冷:15.26 μg/kg),未超过国家规定的最高残留限量800 μg/kg。在猪肉及内脏样品中,有6 份恩诺沙星检出,残留量分别为14.84、3.87 μg/kg和19.94 μg/kg(预冷:13.61、2.43 μg/kg和18.71 μg/kg),均未超过国家规定的最高残留限量100 μg/kg。本次采样中43 种兽药检出率为5%。
表2 43 种兽药检出情况
Table 2 Detection rates of 43 veterinary drugs during slaughter and pre-cooling
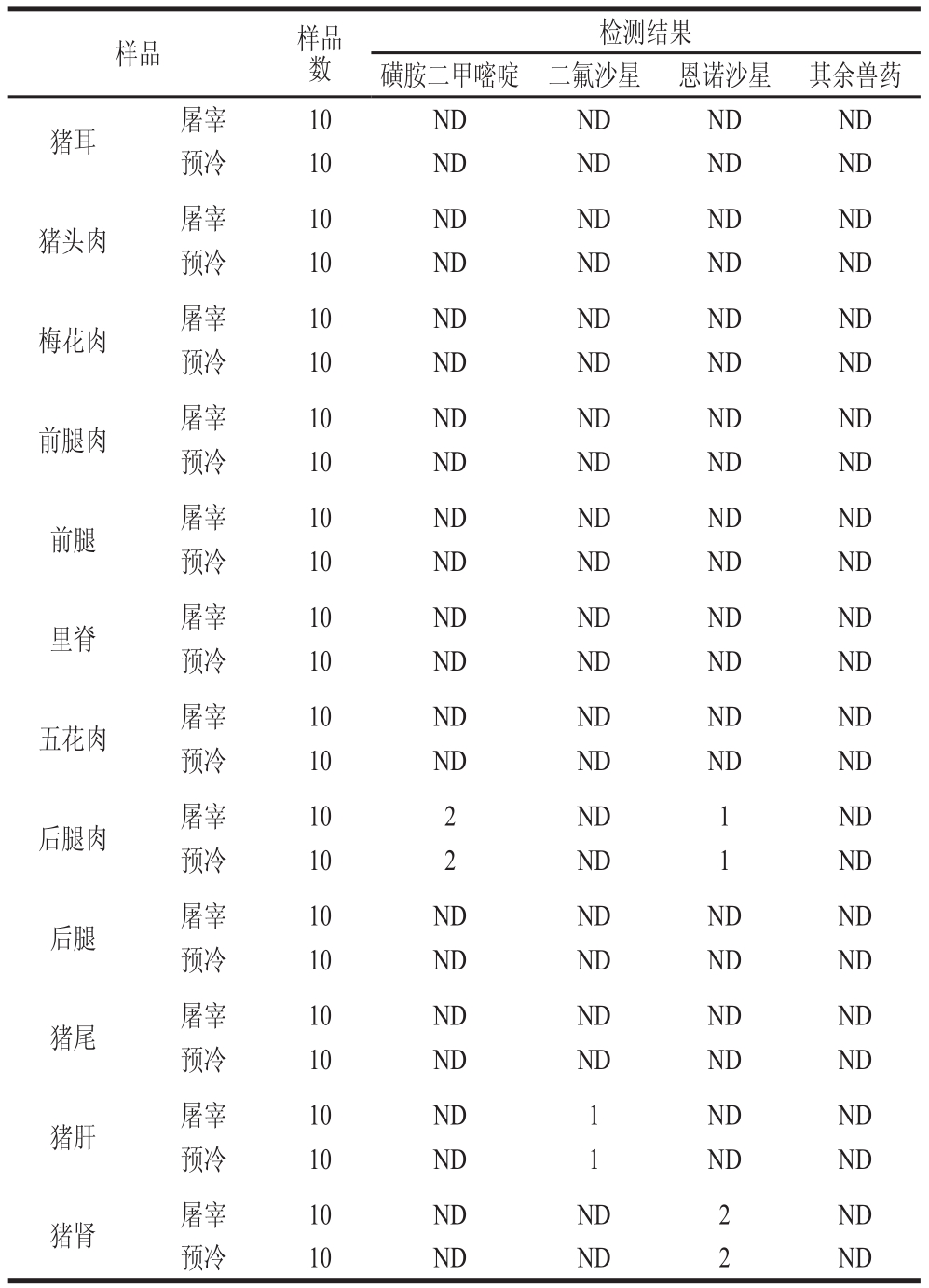
注:ND.未检出,下同。
检测结果磺胺二甲嘧啶 二氟沙星 恩诺沙星 其余兽药猪耳 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND猪头肉 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND梅花肉 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND前腿肉 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND前腿 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND里脊 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND五花肉 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND后腿肉 屠宰 10 2 ND 1 ND预冷 10 2 ND 1 ND后腿 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND猪尾 屠宰 10 ND ND ND ND预冷 10 ND ND ND ND猪肝 屠宰 10 ND 1 ND ND预冷 10 ND 1 ND ND猪肾 屠宰 10 ND ND 2 ND预冷 10 ND ND 2 ND样品 样品数
通过IFS进行残留评估,如表3所示。磺胺二甲嘧啶EDI分别为2.39、0.60 μg/(人·d)(预冷:2.23、0.47 μg/(人·d));二氟沙星EDI为2.85 μg/(人·d)(预冷:2.29 μg/(人·d));恩诺沙星EDI分别为2.23、0.58 μg/(人·d)和2.99 μg/(人·d)(预冷:2.04、0.36 μg/(人·d)和2.81 μg/(人·d))。其中有2 份恩诺沙星检出样品的EDI大于最大摄入量(2 μg/(人·d))。IFS范围为9.00×10-4~4.83×10-2,均远小于1,表明本实验研究的43 种兽药残留对南京市地区猪肉的食品安全没有影响。
表3 3 种兽药的ADI、EDI及IFS
Table 3 ADIs, EDIs and IFS for three veterinary drugs

药物 样品 ADI/(μg/(人·d))EDI/(μg/(人·d)) IFS屠宰 50 2.99 9.97×10-4预冷 50 2.70 9.00×10-4二氟沙星 屠宰 10 2.85 4.75×10-3预冷 10 2.29 3.82×10-3恩诺沙星 屠宰 2 5.80 4.83×10-2预冷 2 5.21 4.34×10-2磺胺二甲嘧啶
为了系统评估猪肉产品中43 种兽药对消费人群的影响,本实验选取南京市4 个地区的各大超市作为采样地点,按1.3.1节抽样分布图,每个区分别抽取12 种不同部位猪肉样品各10 份,共抽样480 份。如表4所示,在本次抽样中,共有磺胺二甲嘧啶、二氟沙星、氟甲喹、恩诺沙星、沙拉沙星5 种药物检出,均未超过国家规定的最高残留限量,检出率为4.4%。按1.3.3节方法计算EDI与IFS值(表5),结果显示,IFS为1.6×10-3~5.94×10-2, 为4.08×10-3~1.27×10-2,均远小于1,表明南京市4 个区市售猪肉中43 种兽药残留的安全状态可以接受。值得注意的是,对于恩诺沙星和沙拉沙星这类ADI值较低的物质,在A(栖霞区)、C(市区)和D(江宁区)检出样品中低于其EDI值。
为4.08×10-3~1.27×10-2,均远小于1,表明南京市4 个区市售猪肉中43 种兽药残留的安全状态可以接受。值得注意的是,对于恩诺沙星和沙拉沙星这类ADI值较低的物质,在A(栖霞区)、C(市区)和D(江宁区)检出样品中低于其EDI值。
表4 南京市售猪肉检出情况
Table 4 Detection rates of 43 veterinary drugs in pork samples sold in Nanjing
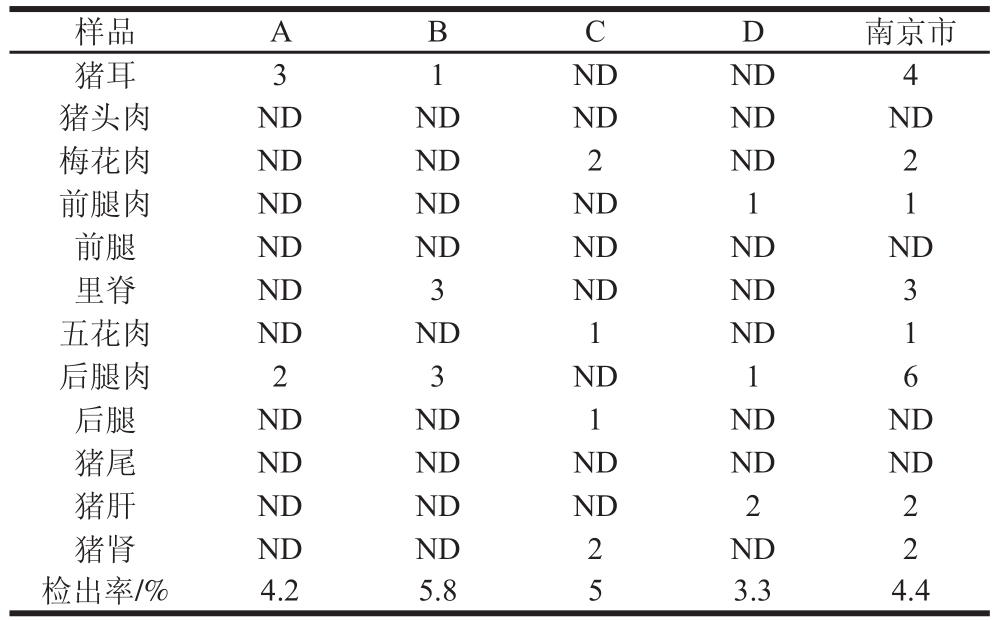
样品 A B C D 南京市猪耳 3 1 ND ND 4猪头肉 ND ND ND ND ND梅花肉 ND ND 2 ND 2前腿肉 ND ND ND 1 1前腿 ND ND ND ND ND里脊 ND 3 ND ND 3五花肉 ND ND 1 ND 1后腿肉 2 3 ND 1 6后腿 ND ND 1 ND ND猪尾 ND ND ND ND ND猪肝 ND ND ND 2 2猪肾 ND ND 2 ND 2检出率/% 4.2 5.8 5 3.3 4.4
表5 南京市售猪肉残留的ADI、EDII及IIFFSS
Table 5 ADIs, EDIs and IFS for pork residues in pork samples sold in Nanjing
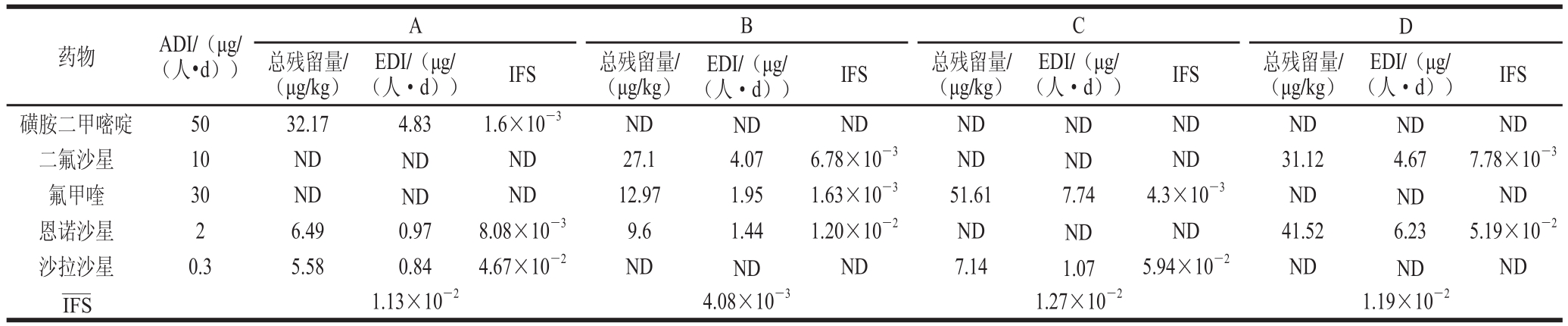
药物 ADI/(μg/(人·d))A B C D总残留量/(μg/kg) (人·d)) IFS 总残留量/(μg/kg)EDI/(μg/(人·d)) IFS 总残留量/(μg/kg)EDI/(μg/(人·d)) IFS 总残留量/(μg/kg)EDI/(μg/EDI/(μg/(人·d)) IFS磺胺二甲嘧啶 50 32.17 4.83 1.6×10-3 ND ND ND ND ND ND ND ND ND二氟沙星 10 ND ND ND 27.1 4.07 6.78×10-3 ND ND ND 31.12 4.67 7.78×10-3氟甲喹 30 ND ND ND 12.97 1.95 1.63×10-3 51.61 7.74 4.3×10-3 ND ND ND恩诺沙星 2 6.49 0.97 8.08×10-3 9.6 1.44 1.20×10-2 ND ND ND 41.52 6.23 5.19×10-2沙拉沙星 0.3 5.58 0.84 4.67×10-2 ND ND ND 7.14 1.07 5.94×10-2 ND ND ND 1.13×10-24.08×10-31.27×10-21.19×10-2
本实验根据NY/T 1897—2010随机抽取240 件样品,抽样部位包括肌肉组织和内脏组织等12 种。运用EMR-L方法提取净化,UHPLC-Q-TOF/MS检测屠宰和预冷阶段43 种磺胺类、喹诺酮类、四环素类、大环内脂类和β-内酰胺类兽药残留,并进行风险评估。结果表明,43 种兽药中有磺胺二甲嘧啶、二氟沙星和恩诺沙星检出,检出率为5%,含量为2.43~19.94 μg/kg。其中,1 份后腿肉及1 份猪肾样品中恩诺沙星每日暴露量大于最大摄入 量。本实验采用IFS评价43 种兽药对消费人群健康的影响,IFS值均远小于1,表明南京市猪肉产品中43 种兽药残留的安全状态可以接受。通过追踪抽检预冷样品发现,检出样品经尸僵、成熟后检测结果与屠宰时差异不明显,说明在屠宰和预冷阶段中没有43 种兽药的二次污染。
本实验同时对南京市4 个地区市售猪肉进行抽样检测,总计480 份,检出率为4.4%,IFS与 值均远小于1,表明南京市售猪肉产品中磺胺类、喹诺酮类、四环素类、大环内脂类和β-内酰胺类药物残留量对人群健康不会造成危害效应,监管部门不必采取风险管理程序。但值得注意的是,猪耳及后腿肉中药物检出率较高,这是由于肉猪给药方式一般为臀部肌肉注射和耳静脉注射。与此同时,恩诺沙星和沙拉沙星此类ADI较低的药物,其EDI值易高于ADI值,反映出养殖户需要进一步严格执行休药期规定,以及本市食品监管存在一定安全隐患,政府部门需要加强对此类药物监管。
值均远小于1,表明南京市售猪肉产品中磺胺类、喹诺酮类、四环素类、大环内脂类和β-内酰胺类药物残留量对人群健康不会造成危害效应,监管部门不必采取风险管理程序。但值得注意的是,猪耳及后腿肉中药物检出率较高,这是由于肉猪给药方式一般为臀部肌肉注射和耳静脉注射。与此同时,恩诺沙星和沙拉沙星此类ADI较低的药物,其EDI值易高于ADI值,反映出养殖户需要进一步严格执行休药期规定,以及本市食品监管存在一定安全隐患,政府部门需要加强对此类药物监管。
[1] YU X H, ABLER D. Where have all the pigs gone? Inconsistencies in pork statistics in China[J]. China Economic Review, 2014, 30:469-484. DOI:10.1016/j.chieco.2014.03.004.
[2] XIONG C W, LIU C H, CHEN F, et al. Performance assessment of food safety management system in the pork slaughter plants of China[J]. Food Control, 2017, 71: 264-272. DOI:10.1016/j.foodcont.2016.07.006.
[3] 孟哲, 石志红, 吕运开, 等. 超高效液相色谱-高分辨四级杆飞行时间质谱法快速筛查乳制品中磺胺类与氟喹诺酮类药物[J]. 分析化学,2014, 42(10): 1493-1500. DOI:10.11895/j.issn.0253-3820.140299.
[4] 黄子敬, 王晓玲, 杨钦沾, 等. 超高效液相色谱-串联质谱法同时测定畜禽肉中磺胺类、喹诺酮类、硝基咪唑类兽药残留[J]. 分析试验室, 2014, 33(10): 1184-1188. DOI:10.13595/j.cnki.issn1000-0720.2014.0278.
[5] 厉文辉, 史亚利, 高立红, 等. 加速溶剂萃取-高效液相色谱-串联质谱法同时检测鱼肉中喹诺酮、磺胺与大环内酯类抗生素[J]. 分析测试学报, 2010, 29(10): 987-992. DOI:10.3969/j.issn.1004-4957.2010.10.001.
[6] LI X W, GUO P, SHAN Y W, et al. Determination of 82 veterinary drugs in swine waste lagoon sludge by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2017, 1499: 57-64. DOI:10.1016/j.chroma.2017.03.055.
[7] ZHANG Y Q, LIU X, LI X, et al. Rapid screening and quanti fication of multi-class multi-residue veterinary drugs in royal jelly by ultra performance liquid chromatography coupled to quadrupole timeof-flight mass spectrometry[J]. Food Control, 2016, 60: 667-676.DOI:10.1016/j.foodcont.2015.09.010.
[8] 张元, 周伟娥, 李绍辉, 等. 动物源性食品中喹诺酮类残留前处理及分析方法的研究进展[J]. 食品工业科技, 2016, 37(5): 378-383.DOI:10.13386/j.issn.1002-0306.2016.05.069.
[9] 李娜, 张玉婷, 刘磊, 等. QuEChERS-超高效液相色谱-串联质谱法测定动物源食品中4 类29 种禁限用兽药残留[J]. 色谱, 2014,32(12): 1313-1319. DOI:10.3724/SP.J.1123.2014.07044.
[10] 曹亚飞, 康健, 常巧英, 等. QuEChERS结合液相色谱-串联质谱法快速测定奶酪中多类兽药残留[J]. 色谱, 2015, 33(2): 132-139.DOI:10.3724/SP.J.1123.2014.10022.
[11] 张科明, 梁飞燕, 邓鸣, 等. QuEChERS结合液相色谱-串联质谱法快速测定猪肉中多类兽药残留[J]. 色谱, 2016, 34(9): 860-867.DOI:10.3724/SP.J.1123.2016.06010.
[12] 臧国栋, 符靖雯, 杨钦沾, 等. QuEChERS dSPE EMR-Lipid-LCMS-MS测定鸡蛋中3 种聚醚类抗球虫药物残留[J]. 安徽农业科学,2017, 45(32): 75-76. DOI:10.13989/j.cnki.0517-6611.2017.32.024.
[13] 王杰, 裴斐, 李彭, 等. 不同前处理方法对猪组织中喹诺酮类兽药残留检测效果对比[J]. 食品科学, 2018, 39(18): 309-314. DOI:10.7506/spkx1002-6630-201818047.
[14] MARTÍNEZ-VILLALBA A, VACLAVIK L, MOYANO E, et al.Direct analysis in real time high-resolution mass spectrometry for high-throughput analysis of antiparasitic veterinary drugs in feed and food[J]. Rapid Communications in Mass Spectrometry, 2013, 27(3):467-475. DOI:10.1002/rcm.6466.
[15] LEÓN N, PASTOR A, YUSÀ V. Target analysis and retrospective screening of veterinary drugs, ergot alkaloids, plant toxins and other undesirable substances in feed using liquid chromatographyhigh resolution mass spectrometry[J]. Talanta, 2016, 149: 43-52.DOI:10.1016/j.talanta.2015.11.032.
[16] ANUMOL T, LEHOTAY S J, STEVENS J, et al. Comparison of veterinary drug residue results in animal tissues by ultra highperformance liquid chromatography coupled to triple quadrupole or quadrupole-time-of-flight tandem mass spectrometry after different sample preparation methods, including use of a commercial lipid removal product[J]. Analytical and Bioanalytical Chemistry, 2017,409(10): 2639-2653. DOI:10.1007/s00216-017-0208-y.
[17] ZHAO L M, LUCAS D, LONG D, et al. Multi-class multi-residue analysis of veterinary drugs in meat using enhanced matrix removal lipid cleanup and liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2018, 1549: 14-24. DOI:10.1016/j.chroma.2018.03.033.
[18] 田文, 裴斐, 文良, 等. 食用油中有机污染物的筛查与风险评估[J].食品科学, 2016, 37(24): 203-208. DOI:10.7506/spkx1002-6630-201624032.
[19] 关舒函, 李蕊, 金慧然, 等. 黑龙江省猪肉中磺胺类药物残留的检测与风险评估[J]. 黑龙江畜牧兽医, 2017(1): 288-290. DOI:10.13881/j.cnki.hljxmsy.2017.0193.
[20] 吴云凤, 袁宝君. 零售鸡肉中沙门氏菌的半定量风险评估研究[J].食品安全质量检测学报, 2014, 5(12): 4157-4162.
[21] 罗祎, 袁宗辉, 锡韦, 等. 食品中农药残留暴露评估的国内外研究进展[J]. 中华预防医学杂志, 2010, 44(3): 253-256. DOI:10.3760/cma.j.issn.0253-9624.2013.03.018.
[22] EFSA. Opinion of the scientific panel on plant protection products and their residues on acute dietary intake assessment of pesticide residues in fruit and vegetables[J]. The EFSA Journal, 2007, 5(8): 1-88.DOI:10.2903/j.efsa.2007.538.
[23] SHARMA M, MAHESHWARI M, MORISAWA S. Dietary and inhalation intake of lead and estimation of blood lead levels in adults and children in Kanpur, India[J]. Risk Analysis, 2005, 25(6):1573-1588. DOI:10.1111/j.1539-6924.2005.00683.x.
[24] THOMAS R, JOHN S. A simple, spreadsheet-based, food safety risk assessment tool[J]. International Journal of Food Microbiology, 2002,77(1): 39-53. DOI:10.1016/S0168-1605(02)00061-2.
[25] 张闻娟, 赵亚南, 桂红星, 等. 鸡肉中磺胺类药物的残留及其积累性暴露评估[J]. 食品科学, 2013, 34(19): 298-301. DOI:10.7506/spkx1002-6630-201319061.
[26] 李聪, 张艺兵, 李朝伟, 等. 暴露评估在食品安全状态评价中的应用[J].检验检疫科学, 2002, 12(1): 11-12.
[27] 聂文静, 李太平. 食品安全风险评估模型研究综述[J]. 食品安全质量检测学报, 2014(5): 1551-1556.
[28] 柴勇, 杨俊英, 李燕, 等. 基于食品安全指数法评估重庆市蔬菜中农药残留的风险[J]. 西南农业学报, 2010, 23(1): 98-102.DOI:10.16213/j.cnki.scjas.2010.01.009.
[29] MARTA P, ANNA G, PIOTR J, et al. Multiresidue determination of veterinary medicines in lyophilized egg albumen with subsequent consumer exposure evaluation[J]. Food Chemistry, 2017, 229: 646-652. DOI:10.1016/j.foodchem.2017.02.147.
[30] 兰珊珊, 林涛, 林昕, 等. 食品安全指数法评估西南地区食用菌中农药残留风险[J]. 江苏农业学报, 2014, 30(1): 199-204. DOI:10.3969/j.issn.1000-4440.2014.01.035.
Determination and Risk Assessment of Veterinary Drugs in Pork Meat and Viscera during Slaughter, Pre-cooling and Sale
MA Ning, WANG Jie, PEI Fei, et al. Determination and risk assessment of veterinary drugs in pork meat and viscera during slaughter, pre-cooling and sale[J]. Food Science, 2020, 41(16): 314-319. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20190606-068. http://www.spkx.net.cn