丁香酚类化合物,主要包括丁香酚与异丁香酚、甲基丁香酚与甲基异丁香酚、乙酸丁香酚酯与乙酰基异丁香酚3 组同分异构体,自20世纪70年代初被发现具有强烈的麻醉作用而被广泛用于动物运输过程[1]。近年来,人们发现鲜活水产品在运输、批发等环节添加丁香酚类物质能够有效地改变其生理状态,进入类休眠状态,大大降低生理代谢强度,有效提高在运输途中的成活率,从而增加经济效益[2-3]。然而,研究表明丁香酚类物质具有肝脏毒性[4-5];美国国家毒理学计划认为丁香酚是可疑致癌物[6];世界癌症研究机构也将丁香酚列为第3类致癌物[7];李付贵等[8]证明了丁香酚是一种强胚胎毒性化合物;孔晓军等[9]对丁香酚进行毒理学实验表明丁香酚会导致人体代谢性酸中毒,还可以导致婴幼儿患低血糖和肝功能衰竭。不同国家对丁香酚类物质的限量标准并不一致,新西兰曾规定食品中丁香酚的最高残留限量为0.1 mg/kg[10],而后在2016年撤销[11],日本规定丁香酚最高残留限量为0.05 mg/kg[12],美国和加拿大则禁止丁香酚作为食品添加剂或者麻醉剂使用[13-14],其他5 种丁香酚类物质的限量值还未有相应的规定。我国对丁香酚类的使用及限量值尚无明确规定。
目前,丁香酚的检测方法主要有紫外分光光度法、薄层色谱法、毛细管电泳法、气相色谱法、液相色谱法、气相色谱-串联质谱法、液相色谱-串联质谱法等。向英等[15]采用分光光度法测定丁香油中丁香酚的含量,不仅溶剂消耗大且灵敏度较低;Pathak等[16]采用薄层色谱法建立了丁香中丁香酚的含量测定,但该法易受干扰导致定性定量不准确,且溶剂挥发对人体危害也较大;黄先敏等[17]建立了山茱萸中丁香酚的毛细管电泳法测定,该法灵敏度高,但重现性较差,无法准确定量;色谱法[18-21]具有高分离性、高选择性以及高灵敏度成为水产品中丁香酚类物质测定的主流检测方法,但前处理仍相对复杂,步骤多,耗时长,效率低,且容易存在干扰,已无法满足大批量样品快速检测的要求。近年来,色谱-质谱联用技术具有前处理简单、灵敏度高、稳定性好、定性定量更准确等特点而被广泛用于痕量分析[22-23],已有研究者[24-28]将气相色谱-串联质谱法成功应用与水产品中6 种丁香酚类物质的测定,以及倪峥飞[29]和赵东豪[30]等采用超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法建立了丁香酚类物质的测定方法,但目前报道的采用液相色谱-串联质谱法针对的是丁香酚单一化合物或者几种化合物,同时测定6 种(3 组同分异构体)丁香酚类物质(丁香酚与异丁香酚、甲基丁香酚与甲基异丁香酚、乙酸丁香酚酯与乙酰基异丁香酚)的方法鲜见报道。因此,本研究采用UPLC-MS/MS建立同时测定水产品中6 种丁香酚类物质的方法,并对市场上实际水产样品中丁香酚类物质残留进行污染调查,以期为水产品中多种丁香酚类物质残留检测提供技术支持,也为水产品中丁香酚类物质的进一步研究提供数据支持。
1 材料与方法
1.1 材料与试剂
丁香酚(CAS号97-53-0,纯度98.95%)、异丁香酚(CAS号97-54-1,纯度98.06%)、甲基丁香酚(CAS号93-15-2,纯度98.06%)、乙酸丁香酚酯(CAS号93-28-7,纯度99.4%)、甲基异丁香酚(CAS号93-16-3,纯度99.1%)、乙酰基异丁香酚(CAS号93-29-8,纯度98.2%) 美国Stanford公司;甲酸、乙腈、甲醇(均为色谱纯) 德国Merck公司。
1.2 仪器与设备
L C-3 0 A D U P L C仪、H L B固相萃取柱(3 mL/60 mg)、Shim-pack GIST C18色谱柱(2.1 mm×50 mm,2 μm) 日本Shimadzu公司;5500三重四极杆-串联质谱仪(配有电喷雾离子源) 美国AB SCIEX公司;Aanti J-E高速冷冻离心机 美国Beckman Coulter公司;Milli-Q超纯水纯化系统 美国Millipore公司;DS-8510 DTH超声波振荡器 上海分析超声仪器有限公司;MS 3 basic旋涡混均器 德国IKA公司;C18固相萃取柱(3 mL/60 mg)、PEP固相萃取柱(3 mL/60 mg) 美国Agela公司;BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)、UPLC HSS T3色谱柱(2.1 mm×50 mm,1.8 μm)、BEH C8色谱柱(2.1 mm×50 mm,1.7 μm) 美国Waters公司。
1.3 方法
1.3.1 质谱条件
电喷雾离子源:正负离子切换模式;多反应监测;离子化电压:正离子扫描模式为5 500 V,负离子模式为-4 500 V;雾化气60 psi;辅助气55 psi;气帘气压力30 psi;雾化温度550 ℃;定性离子对、定量离子对及其他质谱参数见表1。
表1 质谱参数
Table 1 Mass spectrometric parameters

注:*.定量离子对。
序号 丁香酚类化合物碰撞能量/eV 1 丁香酚 负离子 162.9/148.0* -48 -19 162.9/121.0 -48 -40 2 异丁扫描模式离子对(m/z)去簇电压/V香酚 负离子 162.9/148.0* -48 -20 162.9/119.0 -48 -35 3 甲基丁香酚 正离子 179/138.1* 100 20 179/151.1 100 17 4 甲基异丁香酚 正离子 179/151.1* 130 21 179/138.1 130 21 5 乙酸丁香酚酯 正离子 207.1/165.1* 130 14 207.1/137 130 14 6 乙酰基异丁香酚 正离子 207.1/137.0* 100 12 207.1/165.1 100 24
1.3.2 色谱条件
色谱柱:Shim-pack GIST C18色谱柱(2.1 mm×50 mm,2 μm);柱温40 ℃;进样量2.0 μL;流速0.3 mL/min;流动相:水(A)和甲醇(B),梯度洗脱程序:0~1.00 min,90% A、10% B;1.0~2.0 min,90%~45% A、10%~55% B;2.0~2.00 min,45% A、55% B;5.0~9.0 min,45%~5% A、55%~95% B;9.0~11.0 min,5% A、95% B;11.00~11.01 min,5%~90% A、95%~10% B;11.01~13.0 min,90% A、10% B。
1.3.3 标准溶液及标准曲线的配制
分别准确称取适量6 种丁香酚类物质标准品于10 mL容量瓶中,用乙腈溶解后定容至刻度,充分混匀得到标准储备液约1.0 mg/mL,于-18 ℃冰箱中避光保存。分别移取适量标准储备液以乙腈稀释成质量浓度均为100 ng/mL的混合标准中间液,再分别移取适量混标中间液以体积分数10%乙腈溶液稀释成1.00、2.00、5.00、20.0、50.0、100、500 ng/mL的混合标准系列溶液,现配现用。
1.3.4 样品前处理
先将鱼、虾、蟹等水产品洗净,取可食肌肉部分样品于组织匀浆机搅碎混匀,放入-18 ℃冰箱保存,备用。称取匀浆后的待测样品2.0 g于50 mL聚丙烯塑料离心管中,加入2 g无水硫酸钠,涡旋混匀后加入5 mL乙腈,振荡提取10 min后,于4 500 r/min离心5 min,转移上清液至10 mL试管中,残渣再加入5 mL乙腈重复提取一次,合并2 次提取液,过HLB小柱净化(使用前用3.0 mL乙腈活化),收集流出液于10 mL刻度试管中,再加入2 mL乙腈洗脱,并收集流出液,加入100 μL二甲亚砜后于50 ℃水浴下氮吹至近干,加入10%乙腈溶液溶解定容至1.0 mL,涡旋混匀后过0.22 μm PTFE滤膜,UPLC-MS/MS分析测试。
1.4 数据统计与分析
采用Excel 2007软件进行平均值、回收率及相对标准偏差计算,采用Origin 8.0软件作图。
2 结果与分析
2.1 仪器条件的优化
2.1.1 质谱条件的优化

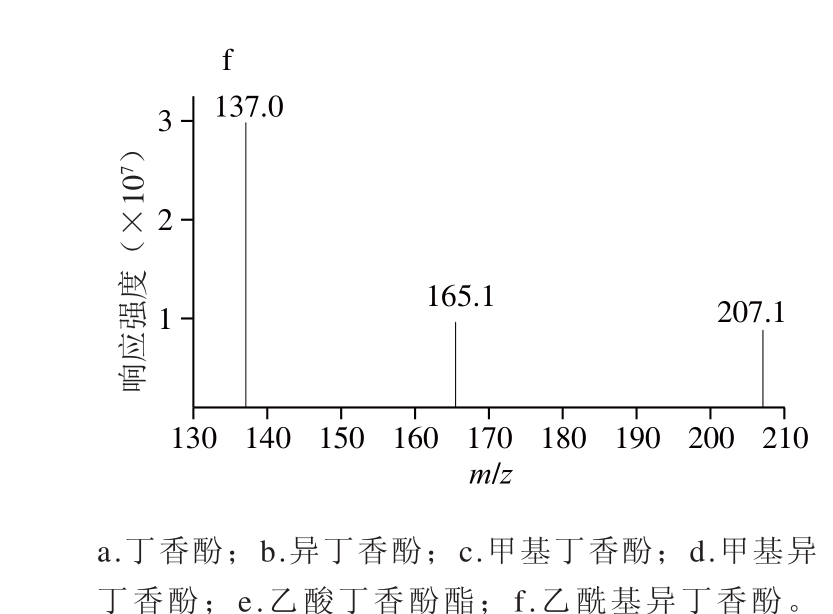
图1 丁香酚类物质产物离子扫描质谱图
Fig. 1 Product ion scanning mass spectra of eugenols
分别取适量储备液以50%乙腈稀释成质量浓度约为200 ng/mL的单标使用液,采用针泵连续进样模式进样分析(针泵速率为10 μL/min)。根据目标物的性质,丁香酚与异丁香酚含有酚羟基,较易失去一个质子得到母离子m/z 163 [M-H]-,其余4 种化合物采用正离子模式,分别得到一个质子形成母离子[M-H]+,分别继续进行产物离子扫描,并采用信号叠加模式,分别得到6 种化合物的主要碎片离子(图1),并优化各化合物相关检测参数,选择最优定量定性离子对(表1)。从图1可以看出,除丁香酚(m/z 121.0)和异丁香酚(m/z 119.0)的1 个碎片离子不同外,其余2 对同分异构体的母离子和碎片离子均相同,一部分可能的质谱解析见文献[31],因此无法单靠质谱提取分离目标物进行定性,需要通过色谱条件将3 对同分异构体完全分离,才能准确进行定性定量分析。
2.1.2 液相色谱条件的优化
2.1.2.1 色谱柱的选择


图2 丁香酚类物质的多反应监测模式色谱图
Fig. 2 Multiple response monitor chromatograms of 6 eugenols
文献[27,32]报道测定多种丁香酚类物质采用C18色谱柱,本研究选择较常见的BEH C18、BEH C8、HSS T3、Shim-pack GIST C18色谱柱,以甲醇-水作为流动相进行梯度洗脱优化实验。结果表明Shim-pack GIST C18色谱柱效果最好,在7.5 min之前能将3 对丁香酚同分异构体达到基线分离,且峰形较好(图2),因此选择Shim-pack GIST C18色谱柱作为分析柱。
2.1.2.2 流动相的选择
先对甲醇-水和乙腈-水作为流动相的效果进行比较,结果表明,采用甲醇-水作为流动相时,6 种化合物的峰形及响应均优于乙腈-水作为流动相。此外,流动相的pH值以及离子强度的大小可能对目标物响应有影响,于是对比了在水相中添加不同浓度的甲酸以及乙酸铵对结果的影响。结果显示,随着乙酸铵浓度的增大,6 种丁香酚类物质响应均逐渐降低,说明流动相中加入乙酸铵会降低6 种丁香酚类物质的响应;而只要流动相中加入甲酸,丁香酚和异丁香酚则完全被抑制,且其余4 种化合物响应没有明显变化,因此最终选择甲醇-水作为流动相,而文献[26,31]则认为采用甲醇-乙腈-0.01%甲酸作为流动相效果更佳。
2.2 前处理条件的优化
2.2.1 提取溶剂的选择

图3 提取溶剂的选择
Fig. 3 Selection of extraction solvents
丁香酚类物质属于极性或者弱极性化合物,微溶于水,文献中报道的提取溶剂有甲醇[32]、乙腈[24]、正己烷[27]、丙酮[18]等。本实验选取空白明虾样品进行加标回收实验,对比甲醇、乙腈、乙酸乙酯、正己烷、丙酮作为6 种丁香酚类物质提取溶剂的效果,后续实验按1.3.4节步骤进行,平行实验3 次。如图3所示,采用甲醇、乙腈提取时,6 种丁香酚类物质回收率均较好,分别为82.5%~95.1%、84.7%~94.7%,相对标准偏差分别为2.1%~5.2%、2.8%~4.1%;而其余3 种提取溶剂所得的回收率结果不理想;但甲醇作为提取溶剂时,溶液颜色较深;此外,在最后浓缩过程中乙腈的浓缩速度也较甲醇快,因此综合考虑选择乙腈作为提取溶剂。
2.2.2 提取溶剂体积的优化

图4 提取溶剂体积对丁香酚类物质回收率的影响
Fig. 4 Effect of extraction solution volume on recovery of eugenols
为进一步确定提取溶剂的体积,选择阴性明虾样品进行加标回收实验(加标水平为1.0 mg/kg),以20 mL乙腈分4 次进行提取,每次以5 mL乙腈提取,分别收集每次的提取溶液按1.3.4节方法进行后续实验,平行实验3 次。如图4所示,一次5 mL乙腈提取时,6 种丁香酚类物质回收率仅为52.1%~72.1%;2 次5 mL乙腈提取时,6 种丁香酚类物质回收率在84.1%~94.5%之间,相对标准偏差在2.1%~4.5%之间;而超过2 次时,结果与2 次5 mL乙腈提取时并无明显变化,综合考虑后续浓缩效率以及节约溶剂方面,最终选择采用2 次5 mL乙腈提取。
2.2.3 净化条件的优化
2.2.3.1 固相萃取柱的选择
由于水产品基质较为复杂,含有大量脂溶性杂质,若直接进样会产生基质效应以及对仪器造成一定程度的污染,因此需对提取后的溶液进行净化处理。根据6 种丁香酚类物质的性质,比较HLB小柱(可吸附极性和非极性杂质)、C18小柱(可吸附脂类等非极性杂质)、PEP小柱(可吸附极性和非极性杂质)的净化效果,以阴性明虾进行加标回收实验(加标水平为20 μg/kg),上样后再以5 mL乙腈洗脱固相萃取柱,其余步骤按1.3.4节进行,平行实验3 次。结果表明,采用HLB柱净化时,6 种丁香酚类物质平均回收率均较好,在88.5%~95.1%之间,相对标准偏差在2.2%~5.1%之间,且基线噪音低;而采用C18柱净化时,乙酸丁香酚酯平均回收率较低(67.5%);采用PEP固相萃取柱净化时,异丁香酚平均回收率较低(50.2%),因此,选择HLB柱作为净化小柱。
2.2.3.2 洗脱剂体积的优化

图5 洗脱剂体积对丁香酚类物质回收率的影响
Fig. 5 Effect of elution solvent volume on recovery of eugenols
由于采用乙腈作为提取溶剂,若经固相萃取柱净化后,溶液体积过大会影响浓缩效率,有必要进一步对洗脱剂体积进行优化。以空白明虾为基质,进行加标回收实验(加标水平为500 μg/kg),上样后以5 mL乙腈分5 次洗脱固相萃取柱,每次1 mL,并分别收集每次的洗脱溶液按1.3.4节进行后续实验,平行实验3 次。如图5所示,当洗脱溶剂达到2 mL时,6 种丁香酚类物质基本洗脱下来,平均回收率在84.5%~97.2%之间;而当洗脱溶剂继续增加时,6 种丁香酚类物质回收率与2 mL洗脱时并无明显差异,因此,选择洗脱体积为2 mL。
2.2.4 浓缩条件的优化
2.2.4.1 浓缩温度
丁香酚类物质沸点均高于180 ℃,但文献[27]认为在氮吹浓缩时,水浴温度高于45 ℃时,丁香酚类物质易挥发或者分解导致回收率降低。因此本实验考察在乙腈溶剂中加入6 种丁香酚类物质(质量浓度均为20 ng/mL),分别在温度30、40、50、60 ℃进行浓缩至近干(剩余约0.2 mL),加入10%乙腈溶液定容至1.0 mL,并涡旋混匀,过滤膜后上机测试。结果表明,浓缩温度为30~60 ℃,6 种丁香酚类物质回收率均在97.5%以上,并不存在回收率降低现象。
2.2.4.2 浓缩至干的影响
在浓缩过程中浓缩至干时,一些化合物有可能会随溶剂挥发被带走一部分,或者被氧化成其他化合物。因此,在乙腈溶剂中加入6 种丁香酚类物质,考察浓缩至干与浓缩至近干(剩余约0.2 mL)对6 种化合物回收率的影响。结果显示当浓缩至近干时,6 种丁香酚类物质的回收率均在97.2%以上;而浓缩至干时,6 种丁香酚类物质回收率均有所下降,在69.8%~87.1%之间(表2)。因此,应注意在浓缩过程中不能浓缩至干,但在实际操作过程较难控制,于是采用在浓缩前加入100 μL高沸点的二甲亚砜,从而有效避免浓缩至干对结果的影响。
表2 浓缩程度对丁香酚类物质回收率的影响
Table 2 Effect of concentration level on recovery of eugenols

浓缩程度 回收率/%甲基丁香酚 甲基异丁香酚 乙酰基异丁香酚 乙酸丁香酚酯 丁香酚 异丁香酚浓缩至近干 97.8 98.7 97.2 97.6 99.2 98.7浓缩至干 85.6 84.8 85.9 87.1 74.2 69.8
2.3 方法学考察结果
2.3.1 线性范围与定量限
以6 种丁香酚类物质的峰面积作为Y轴,质量浓度(ng/mL)作为X轴计算线性回归方程。由表3可以看出,在1.0~500 ng/mL范围内,6 种丁香酚类物质线性关系较好,相关系数(R)在0.99以上,检出限为0.1~0.3 μg/kg之间,定量限在0.3~1.0 μg/kg之间,满足分析需求。
表3 丁香酚类物质的线性关系和定量限
Table 3 Calibration curves and limits of quanti fication (LOQs) of eugenols

检出限/(μg/kg)化合物 回归方程 相关系数(R)定量限/(μg/kg)甲基丁香酚 y=2.909×104x-1.457×103 0.999 8 0.3 1.0甲基异丁香酚 y=1.048×105x-194.57 0.999 5 0.1 0.3乙酰基异丁香酚 y=1.263×105x+5.352×104 0.999 7 0.3 1.0乙酸丁香酚酯 y=7.205×104x+4.441×104 0.999 4 0.1 0.3丁香酚 y=2.842×104x-7.279×104 0.999 1 0.1 0.3异丁香酚 y=2.752×104x-6.998×104 0.998 9 0.1 0.3
2.3.2 准确度与精密度
表4 丁香酚类物质的准确度、精密度和回收率
Table 4 Accuracies, precisions, and recoveries of eugenols

化合物 加标水平/(μg/kg)明虾 鲈鱼 蟹回收率/%相对标准偏差/%效应/% 回收率/%相对标准偏差/%基质效应/% 回收率/%相对标准偏差/%基质 基质效应/%甲基丁香酚2.00 89.5 2.3 97.8 89.6 4.2 96.5 105.4 5.2 98.8 5.00 92.8 3.1 95.6 93.5 3.9 94.5 98.5 3.9 96.8 10.0 95.1 4.5 94.8 101.6 5.1 95.8 91.8 4.2 99.1甲基异丁香酚2.00 91.3 1.8 96.8 102.5 4.8 99.5 103.5 3.8 97.5 5.00 95.6 2.7 98.9 95.2 5.3 96.8 97.8 4.6 96.5 10.0 90.9 3.6 97.6 91.6 5.4 94.7 102.6 4.8 95.8乙酰基异丁香酚2.00 86.7 2.8 91.3 89.9 6.9 95.5 91.1 5.6 93.5 5.00 89.1 4.4 89.8 91.3 3.9 93.9 89.6 3.8 98.6 10.0 91.2 5.1 92.6 95.5 4.5 93.9 94.6 3.6 94.3乙酸丁香酚酯2.00 83.9 3.8 91.6 91.7 3.8 97.5 88.7 4.2 92.5 5.00 88.7 4.2 92.8 87.9 5.2 96.8 92.2 2.9 93.6 10.0 89.9 3.9 93.3 93.3 4.7 94.4 94.4 3.4 94.8丁香酚2.00 92.8 4.7 105.6 97.5 3.6 108.8 104.4 5.4 106.9 5.00 95.6 5.3 107.1 102.6 4.4 105.6 98.5 6.1 110.5 10.0 97.1 3.8 108.1 98.8 2.5 103.2 101.8 5.4 109.2异丁香酚2.00 93.8 4.5 103.6 98.5 3.1 104.5 99.3 3.6 106.8 5.00 94.5 5.3 105.8 104.2 2.9 106.8 103.6 3.8 111.6 10.0 96.8 4.2 111.2 102.8 3.8 109.9 104.1 4.5 109.9
分别以阴性明虾、鲈鱼、蟹为基质,进行添加水平为2.00、5.00、10.0 μg/kg的加标回收实验,每种加标水平平行实验6 次。如表4所示,6 种丁香酚类物质在3 种基质中平均回收率在83.9%~105.4%之间,相对标准偏差在1.8%~6.9%之间,表明该方法检测水产品中丁香酚类物质残留量准确可靠,精密度好,符合痕量分析要求。2.3.3 基质效应
分别以阴性明虾、鲈鱼、蟹为基质,得到3 种基质的空白基质溶液,分别加入混标中间液配制成质量浓度均为4.00、10.0、20.0 ng/mL的基质标准溶液,并与同质量浓度的标准溶液(10%乙腈配制)一起上机测试,标准溶液所得的各物质峰面积为A1,基质标准溶液所得各物质的峰面积为A2,基质效应/%=A2/A1×100,结果见表4,3 种基质对丁香酚和异丁香酚均表现出基质增强(基质效应>100%),而对其余4 种化合物则表现出一定程度的基质抑制(基质效应<100%),6 种化合物的基质效应在89.8%~111.6%之间,符合分析要求。
2.4 实际样品测定结果
利用本方法调查了市场上明虾、鲈鱼、蟹、罗非鱼、黄瓜鱼、丽鱼等共计68 份样品中丁香酚类物质的含量,结果发现15 份样品检出丁香酚,含量在1.2~4 574 μg/kg之间,检出率为22.1%,其余5 种化合物均未检出;按日本相关标准的限量值50 μg/kg计,有9 批次不合格,不合格率为13.2%;若按美国和加拿大相关标准计,则不合格率达到22.1%,可见我国水产品中丁香酚类物质残留问题的严重性。
3 结 论
本实验采用UPLC-MS/MS法,结合固相萃取技术,建立水产品中6 种丁香酚类物质的同时快速测定方法,外标法定量,并对相关条件进行优化。该方法简便、检出限低、重复性好、准确度高,且将所建立的方法应用于实际样品的测定,发现丁香酚检出率较高,国家相关部门应对水产品中丁香酚类物质残留进行风险监测,对水产品中丁香酚类物质残留进行污染调查研究,并进一步对丁香酚的代谢周期以及毒理学进行研究。
[1] 李晋成, 刘欢, 王群, 等. 水产品中丁香酚的残留风险评估研究进展[J].食品安全质量检测学报, 2014, 5(11): 3598-3602.
[2] COOKE S J, SUSKI C D, OSTRAND K G, et al. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handing and transporting largemouth bass (Miraopterus salmoides)[J]. Aquaclture, 2004, 239(1/2/3/4): 509-529. DOI:10.1016/j.aquaculture.2004.06.028.
[3] 李晋成, 刘欢, 吴立冬, 等. 动物体内麻醉剂残留检测技术研究进展[J].食品科学, 2014, 35(5): 251-256. DOI:10.7506/spkx1002-6630-201405049.
[4] SOUNDRAN V, NAMAGIRI T, MANONAYAKI S, et al.Hepatotoxicity of eugenol[J]. Ancient Science of Life, 1994, 13(3/4):213-217.
[5] IMAIDA K, HIROSE M, YAMAGUCHI S. Effects of naturally occurring antioxidants on combined 1,2-dimethylhydrazine- and 1-methyl-1-nitrosourea-initiated carcinogenesis in F344 male rats[J]. Cancer Letters, 1990, 55(1): 53-59. DOI:10.1016/0304-3835(90)90065-6.
[6] U.S. Department of Health and Human Services Food and Drug Administration Center for Veterinary Medicine. Guidance for industry concerns related to the use of clove oil as an anesthetic for fish[EB/OL].(2007-04-24) [2017-08-15]. http://www.fda.gov/downloads/AnimalVeterinary/GuidanceComplianceEnforceent/Guidancefor Industry/ucm052520.pdf.
[7] International Agency for Research on Cancer (IARC). Summaries &evaluations, volume 36: eugenol[EB/OL]. (1985-02-18) [2016-05-30].http://monographs.iarc.fr/ENG/Monographs/vol1-42/mono36.pdf.
[8] 李付贵, 陈京, 程伟民, 等. 丁香酚胚胎毒性评价: 应用胚胎干细胞的实验模型[J]. 中国组织工程研究, 2015, 19(19): 3017-3021.DOI:10.3969/j.issn.2095-4344.
[9] 孔晓军, 刘希望, 李剑勇, 等. 丁香酚的药理学作用研究进展[J]. 湖北农业科学, 2013, 52(3): 508-511. DOI:10.3969/j.issn.0439-8114.2013.03.003.
[10] Ministry for Primary Industries of New Zealand. Maximum residue limits of agricultural compounds[EB/OL]. (2013-06-27) [2016-05-30]. http://www.foodsafety.govt.nz/elibrary/industry/mrlagriculturalcompounds-amdt-2013.pdf.
[11] Ministry for Primary Industries of New Zealand. Food standard 2016 maximum residue limits (MRLs) for a griculturalcompounds[EB/OL].(2016-02-15)[2016-05-30]. http://www.foodsafety.govt.nz/elibrary/industry/register-list-mrl-agricultural-compounds.htm.
[12] The Japan Food Chemical Research Foundation. Revision of MRLs of agricultural chemicals, feed additives and veterinary drugs in foods[EB/OL]. (2016-04-20) [2016-05-30]. http://www.ffcr.or.jp/zaidan/ffcrhome.nsf/TrueMainE?OpenFrameSet.
[13] US Food and Drug Administration. Guideline No. 150, guidance for industry: concerns related to the use of clove oil as an anesthetic for fish[EB/OL]. (2007-04-24) [2016-05-30]. http://www.fda.gov/downloads/animalveterinary/guidancecomplianceenforcement/guidanceforindustry/ucm052520.pdf.
[14] Canadian Council on Animal Care. Guidelines for additional information on effects of euthanasia methods on research results: clove oil (eugenol)[EB/OL]. (2016-04-16) [2016-05-30]. http://www.ccac.ca/en_/standards/guidelines/additional/additional-information-oneffectsof-euthanasia-methods-on-research-results/clove-oil.
[15] 向英, 邱松山. 紫外分光光度法测定丁香油树脂中丁香酚的含量[J].香料香精化妆品, 2007(4): 5-7. DOI:10.3969/j.issn.1000-4475.2007.04.002.
[16] PATHAK S B, NIRANJAN K, PADH H, et al. TLC densitometric method for the quanti fication of eugenol and gallic acid in clove[J].Chromatographia, 2004, 60(3/4): 241-244. DOI:10.1365/s10337-004-0373-y.
[17] 黄先敏, 伍文聪, 吴银梅, 等. 高效毛细管电泳法测定山茱萸中丁香酚的含量[J]. 安徽农业科学, 2010, 38(11): 5612-5613.
[18] 陈焕, 黄和, 高平, 等. 分散固相萃取-气相色谱法同时测定水产品中六种丁香酚类麻醉剂的残留量[J]. 食品工业科技, 2015, 36(8): 88-92. DOI:10.13386/j.issn1002-0306.2015.08.009.
[19] 陈焕, 黄和, 高平, 等. 高效液相色谱法测定水产品中丁香酚类麻醉剂的残留量[J]. 食品与发酵工业, 2014, 40(12): 156-160.DOI:10.13995/j.cnki.11-1802/ts.201412030.
[20] 高平, 黄和, 刘文侠, 等. 固相萃取-高效液相色谱-荧光检测法测定水产品中4 种丁香酚类化合物[J]. 中国食品卫生杂志, 2016, 28(1):56-61. DOI:10.13590/j.cjfh.2016.01.013.
[21] 何洪健, 黄和, 高平, 等. MISPE-HPLC检测水产品5 种丁香酚麻醉剂的残留量[J]. 食品与机械, 2016, 32(11): 39-44. DOI:10.13652/j.issn.1003-5788.2016.11.009.
[22] 吴仕辉, 朱新平, 郑光明, 等. 高效液相色谱法检测水产品中的孔雀石绿和结晶紫[J]. 广东海洋大学学报, 2009, 29(1): 54-57.DOI:10.3969/j.issn.1673-9159.2009.01.011.
[23] 方晓磊. 青石斑鱼中丁香酚的残留消除特征研究[D]. 舟山: 浙江海洋大学, 2017: 35-46. DOI:CNKI:CDMD:2.1017.153625.
[24] 黄武, 李红权, 刘建芳, 等. QuEChERS-气相色谱-质谱联用法同时测定水产品中6 种丁香酚类麻醉剂的残留量[J]. 食品安全质量检测学报, 2018(2): 422-428. DOI:10.3969/j.issn.2095-0381.2018.02.033.
[25] 余颖. 气相色谱-质谱法测定鱼肉中丁香酚的残留[J]. 福州大学学报(自然科学版), 2015(2): 266-270. DOI:10.7631/issn.1000-2243.2015.02.0266.
[26] 陈焕, 黄和, 高平, 等. GC-MS法同时测定水产品中6 种丁香酚类麻醉剂的残留量[J]. 食品工业, 2017(7): 305-309.
[27] KILDEA M A, ALLAN G L, KEARNEY R E. Accumulation and clearance of the anaesthetics clove oil and AQUI-S™ from the edible tissue of silver perch (Bidyanus bidyanus)[J]. Aquaculture, 2004,232(1/2/3/4): 265-277. DOI:10.1016/S0044-8486(03)00483-6.
[28] 柯常亮, 刘奇, 陈洁文, 等. 气相色谱-串联质谱联用法测定水中丁香酚残留[J]. 中国渔业质量与标准, 2014, 4(4): 49-55.
[29] 倪峥飞, 顾晔, 冯永巍, 等. UPLC-MS/MS同时测定水产品中4 种丁香酚类麻醉剂残留量[J]. 质谱学报, 2018, 39(4): 451-458.DOI:10.7538/zpxb.2017.0160.
[30] 赵东豪, 王强, 王旭峰, 等. 超高效液相色谱-串联质谱法检测鱼肉和暂养水中丁香酚残留量[J]. 食品科学, 2016, 35(24): 259-263.DOI:10.7506/spkx1002-6630-201624040.
[31] 陈文君, 刘平, 范赛, 等. 5 种丁香酚类化合物的电喷雾质谱裂解规律研究[J]. 食品安全质量检测学报, 2017, 8(9): 3491-3498.
[32] 何洪建, 黄和, 高平, 等. MISPE-HPLC检测水产品5 种丁香酚麻醉剂的残留量[J]. 食品与机械, 2016, 32(11): 39-67.