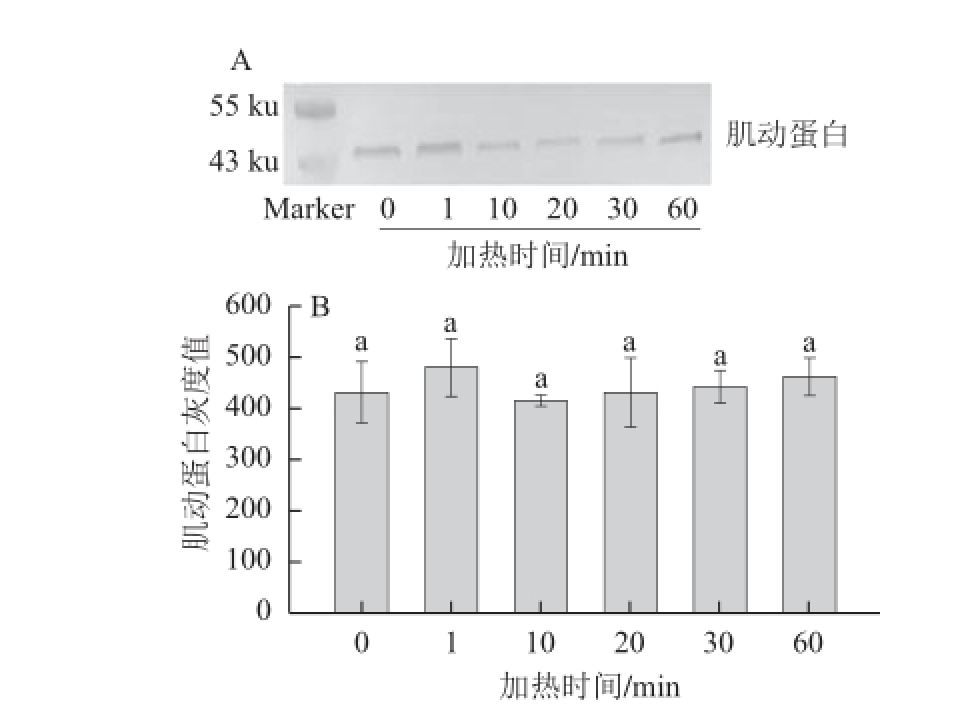
图1 45℃加热不同时间对肌动球蛋白解离的影响
Fig.1 Dissociation of actomyosin in duck meat heated at 45 ℃ for different time durations
A.Western blotting转印图;B.定量分析图。小写字母不同表示差异显著(P<0.05)。下同。
邓少颖 1,2,王道营 2,张牧焓 2,卞 欢 2,吴海虹 2,诸永志 2,耿志明 2,刘 芳 2,徐为民 2,*
(1.南京农业大学,教育部肉品加工与质量控制重点实验室,江苏 南京 210095;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
摘 要:为了解鸭胸肌肉加热过程中肌动球蛋白变化情况,本实验以鸭胸肉为材料,研究了加热温度(45、50、55、60、65、70 ℃)和加热时间(0、1、10、20、30、60 min)对肉中肌动球蛋白解离的影响。采用蛋白质免疫印迹技术测定肌动蛋白的含量。结果表明:在45 ℃加热条件下,肌动球蛋白几乎未发生解离(P>0.05);而在50、55 ℃或60 ℃加热条件下,随着加热时间的延长,肌动蛋白含量先增加后降低,但均较对照组显著性增加(P<0.05);65 ℃加热60 min,肌动蛋白含量降至对照组水平;70 ℃加热条件下,加热时间为30 min或60 min,检测不到肌动蛋白的存在。因此,加热温度为50~60 ℃,加热时间为10~30 min时能显著促进肌动球蛋白解离。
关键词:鸭胸肉;肌动蛋白;加热
对于肉及其制品,人们大多从色、香、味、嫩等几个方面进行评价,其中嫩度作为评判指标越来越被更多的消费者所关注 [1-2],对肉嫩度变化机理以及影响肉嫩度变化因素的研究逐渐成为人们研究的热点问题。热处理是一种常见的食品加工方式。加热不仅能够杀灭细菌、改善风味、熟化食物 [3],而且在一定加热条件下,肉的嫩度可以得到很大的改善。
宰后僵直期间,嫩度降低,在随后的解僵成熟过程中,嫩度逐渐得到改善。有研究者观察动物宰后成熟肉肌纤维的超微结构发现:随着肉的成熟,肌节长度较僵直期间增长 [4]。目前,普遍认为肌原纤维紧密结构弱化是肉品嫩度改善的主要原因 [5-8]。肌原纤维是由可调节的粗肌丝和细肌丝组成,粗肌丝主要是由肌球蛋白组成,细肌丝主要是由肌动蛋白组成,并结合有原肌球蛋白和肌钙蛋白 [9]。Takahashi等 [10]研究指出:成熟过程中肌节长度的增加是由于肌动蛋白和肌球蛋白结合状态以及结合程度的改变,进而弱化了肌原纤维的紧密结构。有研究者在研究鸡肉、兔肉、猪肉、牛肉时发现:将肉在60 ℃或65 ℃水浴中保留较长时间,肉的剪切力存在下降趋势,即表明低温长时间加热有助于肉嫩度的改善 [11-14]。Okitani等 [15]研究发现,在较低温度且相对较长时间加热条件下,肌动球蛋白存在明显的解离现象,即观察到肌动蛋白含量的增加,且嫩度较好。本实验拟对加热条件对肌动球蛋白的解离规律进行研究,为提高肉的嫩度、改善肉的品质提供新的研究思路及理论指导。
1.1 材料与试剂
肉用麻鸭,购自南京孝陵卫农贸市场,随机选取60 日龄左右、大小相近的健康肉用麻鸭,按工业要求宰杀前禁食、禁水。随后宰杀、放血、去毛,并迅速取出鸭胸肉,按相应的实验要求做处理。
抗兔骨骼肌肌动蛋白多克隆抗体、羊抗兔IgG、三羟甲基氨基甲烷(Tris,超纯级) 美国Sigma公司;DAB显色试剂盒 巴傲得生物科技公司;预染宽范围标准蛋白(分子质量大小范围14.4~116 ku) 加拿大Fermentas公司。
1.2 仪器与设备
M124A电子分析天平 意大利Bel Engineering Srl Bel公司;HH-8型数显恒温水浴锅 常州国华电器有限公司;伯乐Mini-PROTEAN ®Tetra Cell垂直电泳系统、Semi-Dry转印仪 美国Bio-Rad公司。
1.3 方法
1.3.1 肉样处理
将选取的麻鸭按企业工艺宰杀后,迅速取出胸大肌,置于4 ℃冰箱中成熟12 h后,去除肌膜、结缔组织、脂肪后切碎成肉糜状,待用。
1.3.2 实验设计
每份准确称取2 g经1.3.1节处理过的鸭胸肉样品,置于5号蒸煮袋中。用玻璃棒挤压肉糜使之成为厚1 mm左右的薄片。实验共设45、50、55、60、65、70 ℃ 6 个实验组,每组又设置0(对照组)、1、10、20、30、60 min 6 个不同的加热时间。将处理好的肉糜薄片置于对应的恒温水浴锅中按上述6 组实验设计分别加热到所需时间后,置于冰浴中冷却至4 ℃左右。每组设置3 个重复。
1.3.3 肌动蛋白提取方法
依据Okitani等 [16]的方法,将1.3.2节经过加热处理并冷却后的肉糜样品置于20 mL预冷的 Weber-Edsall溶液(0.6 mol/L KCl,0.01 mol/L Na 2CO 3,0.04 mol/L NaHCO 3,pH 7.2)中,于冰浴中15 000 r/min匀浆3 次(每次30 s,间隔30 s)。将匀浆液置于4 ℃恒温摇床培养箱中提取24 h后,加入40 mL蒸馏水稀释,使KCl的终浓度为0.2 mol/L,摇床振荡60 min后将溶液进行离心分离,离心条件为:4 ℃,15 000×g,20 min。取上清液制备电泳样品。
1.3.4 肌动蛋白检测方法
依据Okitani等 [15-16]的方法,通过测定肌动蛋白含量的变化来反映肌动球蛋白的解离程度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE),12%分离胶,5%浓缩胶(m(丙烯酰胺)∶m(甲叉双丙烯酰胺)=36.5∶1),每孔等体积上样20 μL,200 V恒压跑约70 min。电泳结束后,将分离胶中所需蛋白条带切割下来并在转膜液中浸泡约15 min后,转印到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。转印后的PVDF膜在TBST溶液(50 mmol/L Tris-HCl,150 mmol/L NaCl,5 mmol/L KCl,0.05%吐温-20,pH 7.4)中漂洗5 次,每次5 min。然后将带有蛋白的PVDF膜在含有5 g/100 mL脱脂奶粉的TBST溶液中室温孵育2 h。在TBST溶液漂洗3 次后,再将PVDF膜与一抗(一抗是抗兔骨骼肌肌动蛋白多克隆抗体,TBST溶液1∶1 000稀释)结合,4 ℃孵育12 h,然后膜用TBST溶液再次漂洗3 次后与二抗(二抗是辣根过氧化酶连接的羊抗兔IgG,TBST溶液1∶5 000稀释)结合,室温孵育2 h,TBST溶液漂洗3 次后,用DAB显色剂对膜进行显色处理,并使用凝胶成像仪拍照。Quantity One软件扫描蛋白免疫印迹条带,并进行数据分析。
1.4 数据分析
凝胶成像仪拍照后的图片(3 个平行),以Quantity One软件扫描蛋白免疫印迹条带,所得的数据用SPSS18.0进行One-way ANOVA分析和相关分析,不同处理间 的显著性差异比较用Duncan’s multiple range tests模型,显著水平为P<0.05。
2.1 45 ℃水浴条件下加热时间对肌动球蛋白解离程度的影响

图1 45℃加热不同时间对肌动球蛋白解离的影响
Fig.1 Dissociation of actomyosin in duck meat heated at 45 ℃ for different time durations
A.Western blotting转印图;B.定量分析图。小写字母不同表示差异显著(P<0.05)。下同。
由转印图1A可知,与对照组相比,各个处理间肌动蛋白含量均无明显的变化,即肌动球蛋白未发生明显的解离现象。通过定量分析(图1B)可知,各个处理间肌动蛋白条带灰度均无显著性差异(P>0.05),因此,在45 ℃条件下,鸭胸肉肉糜中肌动球蛋白基本上不发生解离。
2.2 50 ℃水浴加热不同时间对肌动球蛋白解离的影响
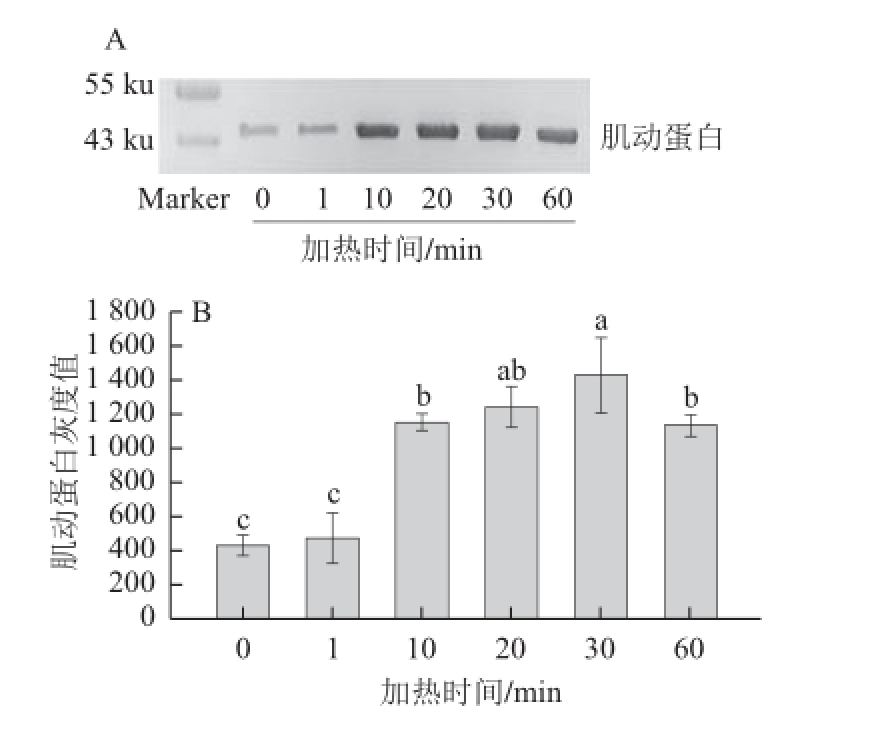
图2 50℃加热不同时间对肌动球蛋白解离的影响
Fig.2 Dissociation of actomyosin in duck meat heated 50 ℃ for different time durations
由图2A可知,在50 ℃水浴中加热后,随着加热时间的延长,鸭胸肉肉糜中的肌动球蛋白发生了明显的解离。通过定量分析(图2B)可知,加热时间为10、20、30、60 min的肌动蛋白条带灰度较对照组均显著性增加(P<0.05);加热30 min时,肌动蛋白条带灰度达到最大值,除与加热20 min时无显著性差异(P>0.05),与其他处理组相比均有显著差异。
2.3 55 ℃水浴加热不同时间对肌动球蛋白解离的影响

图3 55℃加热不同时间对肌动球蛋白解离的影响
Fig.3 Dissociation of actomyosin in duck meat heated 55 ℃for different time periods
由图3A可知,在55 ℃水浴条件下,各个处理样的肌动蛋白含量均较对照组明显增多。随加热时间的延长,肌动蛋白含量呈略微下降趋势。通过定量分析可知(图3B),不同处理组的肌动蛋白条带灰度较对照组均显著性增加(P<0.05);在加热1~20 min过程中,肌动蛋白条带灰度增加,但增幅并不显著(P>0.05),而在加热30 min后,鸭胸肉肉糜中肌动蛋白条带灰度呈逐渐降低的趋势,在加热30~60 min过程中,肌动蛋白条带灰度没有显著性差异(P>0.05)。
2.4 60 ℃水浴加热不同时间对肌动球蛋白解离的影响
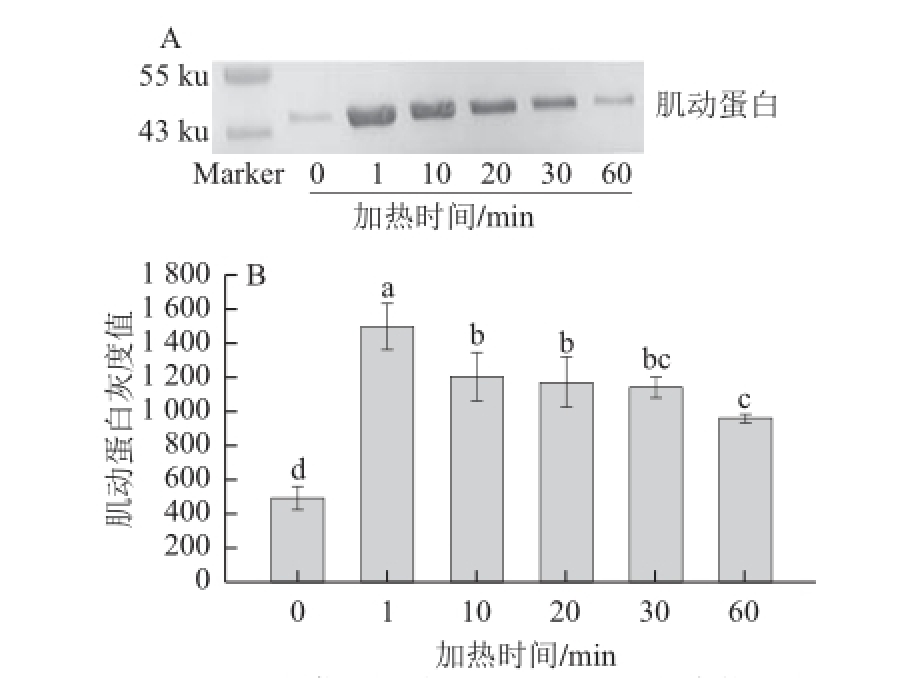
图4 60℃加热不同时间对肌动球蛋白解离的影响
Fig.4 Dissociation of actomyosin in duck meat heated 60 ℃ for different time periods
由图4A可知,各个处理组的肌动蛋白含量均较对照组明显的增加;随加热时间的延长,肌动蛋白含量有降低的趋势。通过定量分析(图4B)可知,加热1 min时肌动蛋白条带灰度达到最大值,与其他处理组均有显著差异(P<0.05);然后随加热时间的延长,肌动蛋白含量逐渐降低,加热时间为60 min的肌动蛋白条带灰度除与30 min时相比无显著性差异外(P>0.05),与其他组均有显著性差异(P<0.05)。
2.5 65 ℃水浴加热不同时间对肌动球蛋白解离的影响
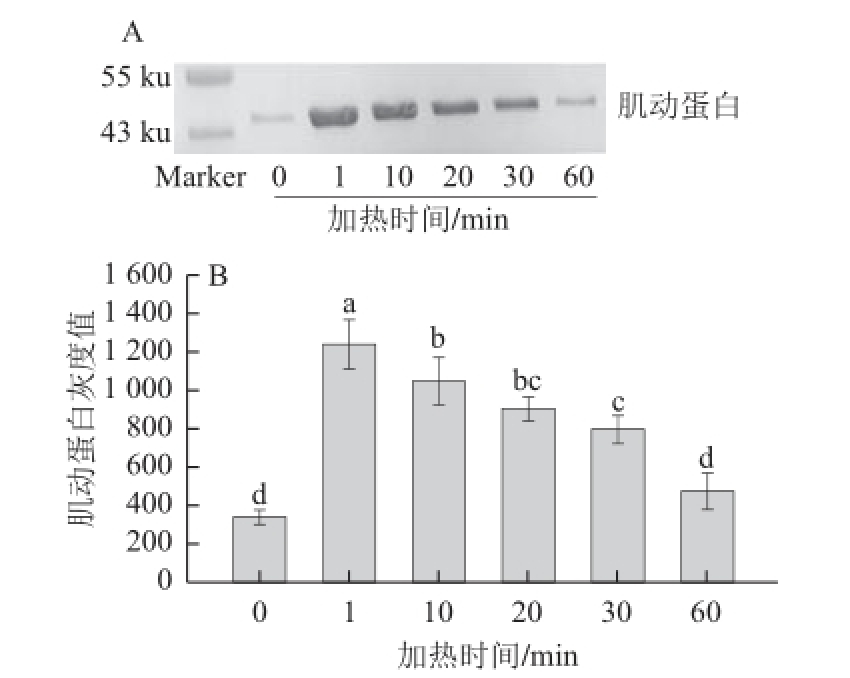
图5 65℃加热不同时间对肌动球蛋白解离的影响
Fig.5 Dissociation of actomyosin in duck meat heated 65 ℃ for different time periods
由图5A可知,加热1 min和10 min时的肌动蛋白含量要明显高于其他处理组,再随加热时间的延长,肌动蛋白条含量逐渐降低。通过定量分析(图5B)可知,加热时间为1 min时肌动球蛋白解离即达到最大,此时肌动蛋白条带灰度与其他处理组均有显著性差异(P<0.05);随加热时间的延长,肌动蛋白条带灰度呈梯级态逐渐减少,加热10 min时的肌动蛋白条带灰度与20 min时的无显著差异(P>0.05);加热20 min时的肌动蛋白条带灰度与30 min无显著性差异(P>0.05);加热60 min时,肌动蛋白条带灰度除与对照组无显著差异外(P>0.05),与其他处理组均有显著性差异(P<0.05)。
2.6 70 ℃水浴加热不同时间对肌动球蛋白解离的影响
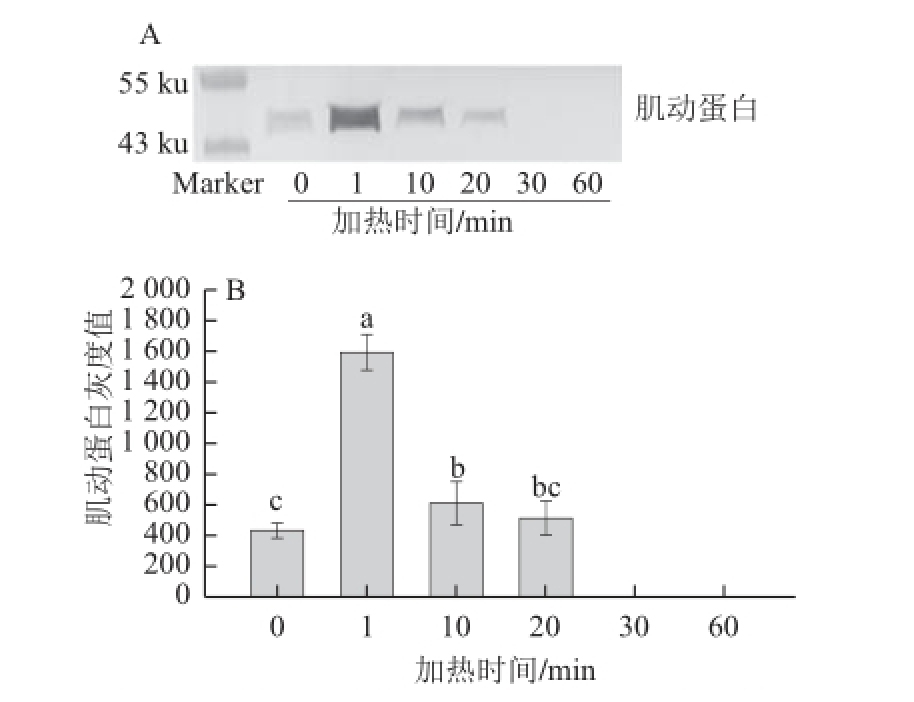
图6 70℃加热不同时间对肌动球蛋白解离的影响
Fig.6 Dissociation of actomyosin in duck meat heated 70 ℃ for different time periods
由图6A可知,在70 ℃水浴中,加热1 min时肌动蛋白含量最高;随加热时间的延长,肌动蛋白含量降低;而当加热时间延长到30 min和60 min时,则检测不到肌动蛋白。通过定量分析(图6B),加热时间为1 min时的肌动蛋白条带灰度显著高于其他处理组(P<0.05);加热时间为10 min和20 min处理组的肌动蛋白条带灰度无显著性变化(P>0.05),但与对照组相比则有显著差异(P<0.05);而加热时间为20 min时的肌动蛋白条带灰度则与对照组无显著性差异(P>0.05)。
嫩度是评价肉品品质的重要指标之一,嫩度受到宰前、宰后多种因素的影响,最终表现为肌原纤维及结缔组织的结构和生化特性对嫩度的影响 [17]。肌动蛋白和肌球蛋白丝是构成肌丝的主要蛋白。在活体肌肉中这两种蛋白是形成肌肉收缩的结构基础,肌动蛋白和肌球蛋白结合形成肌动球蛋白。鸭胸肉经过排酸成熟后,随着三磷酸腺苷(adenosine triphosphate,ATP)的不断消耗,大量的肌球蛋白和肌动蛋白结合成肌动球蛋白,在宰后成熟过程中,肌动球蛋白几乎没有发生解离 [14]。加热是肉品加工常用的方法,在加热过程中,肉结构会发生收缩,肌原纤维蛋白受热变性,使得肌原纤维蛋白间原来的相互作用力发生变化 [18]。有研究表明在终点温度为70 ℃,与常规加热方式相比,梯度加热有改善嫩度的趋势,此过程可能与肌动球蛋白的解离有关 [19]。鸭胸肉加热后,某些蛋白受热后构象首先发生改变,进而原来蛋白质分子间的各种作用力以及它们的三维空间构象遭到破坏,使得细胞骨架断裂,Z盘崩解,加速了肌原纤维蛋白的降解 [20],同时直接或间接地促进肌动球蛋白的解离。本实验发现,鸭胸肉肉糜在45 ℃加热后,肌动球蛋白未发生显著性的解离,其可能原因是在该温度下,肌原纤维的完整结构未遭到破坏,某些相关性的酶未被激活;而肉糜经过50~65 ℃加热处理后,肌动球蛋白大量解离,此结论与Okitani等 [15]研究牛肉、猪肉、鸡肉在65 ℃加热条件下肌动球蛋白发生明显的解离现象结论一致,且嫩度较好。而在70 ℃加热30 min以上,检测不到肌动蛋白,可能是因为肌动蛋白在70~80 ℃结构发生变化 [21],而肌动球蛋白的最大变性温度约在80~83 ℃ [9,22],故其可能原因是由于肌动球蛋白的热变性或肌动蛋白在较高加热温度下溶解度或结构发生了变化。此外,加热也可能影响某些酶的活性。Wang Daoying等 [23]研究发现将鸭胸肉加热到中心温度为50、60、70 ℃时鸭胸肉有较好的剪切力,而且检测到较高的酶活性,同时观察到肌动球蛋白发生了解离,此结论与本实验的研究结果相一致。本实验研究发现在50~65 ℃观察到肌动球蛋白的解离可能是由鸭肉内部环境共同作用而产生的效果。
鸭胸肉肉糜在45 ℃加热条件下,未观察到肌动球蛋白明显的解离现象;在50~65 ℃加热条件下,肌动蛋白条带灰度随加热时间的延长先增加后降低,并且随加热温度的升高,加热相对较短的时间即可使肌动球蛋白达到最大的解离效果,在65 ℃加热条件下长时间加热使得肌动蛋白条带灰度降至近似对照组水平。在70 ℃加热条件下,加热时间延长至30、60 min时,则检测不到肌动蛋白的存在。因此,促进鸭胸肉中肌动球蛋白解离的最佳工艺条件为加热温度为50~60 ℃,加热时间为10~30 min。在随后的研究中,可将此条件应用到完整的鸭胸肉中,研究肌动球蛋白的解离与鸭肉嫩度的相关性,为提高肉品嫩度研究提供理论基础。
参考文献:
[1] MILLER M F, CARR M A, RAMSEY C B, et al. Consumer thresholds for establishing the value of beef tenderness[J]. Journal of Animal Science, 2001, 79(12): 3062-3068.
[2] SHACKELFORD S D, WHEELER T L, MEADE M K, et al. Consumer impressions of tender select beef[J]. Journal of Animal Science, 2001, 79(10): 2605-2614.
[3] BOBACK S M, COX C L, OTT B D, et al. Cooking and grinding reduces the cost of meat digestion[J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2007, 148(3): 651-656.
[4] WHEELER T L, KOOHMARAIE M. Prerigor and postrigor changes in tenderness of ovine longissimus muscle[J]. Journal of Animal Science, 1994, 72(5): 1232-1238.
[5] NISHIMURA T. The role of intramuscular connective tissue in meat texture[J]. Animal Science Journal, 2010, 81(1): 21-27.
[6] HUFF L E, ZHANG W G, LONERGAN S M. Biochemistry of postmortem muscle-lessons on mechanisms of meat tenderization[J]. Meat Science, 2010, 86(1): 184-195.
[7] KOOHMARAIE M. Biochemical factors regulating the toughening and tenderization processes of meat[J]. Meat Science, 1996, 43(Suppl 1): 193-201.
[8] SIKES A, TORNBERG E, TUME R. A proposed mechanism of tenderising post-rigor beef using high pressure-heat treatment[J]. Meat Science, 2010, 84(3): 390-399.
[9] TORNBERG E. Effects of heat on meat proteins-Implications on structure and quality of meat products[J]. Meat Science, 2005, 70(3): 493-508.
[10] TAKAHASHI K F T, YASUI T. Formation of myofi brillar fragments and reversible contraction of sarcomeres in chicken pectoral muscle[J]. Journal of Food Science, 1967, 32(4): 409-413.
[11] WATTANACHANT S, BENJAKUL S, LEDWARD D A. Effect of heat treatment on changes in texture, structure and properties of thai indigenous chicken muscle[J]. Food Chemistry, 2005, 93(2): 337-348.
[12] COMBES S, LEPETIT J, DARCHE B, et al. Effect of cooking temperature and cooking time on warner-bratzler tenderness measurement and collagen content in rabbit meat[J]. Meat Science, 2003, 66(1): 91-96.
[13] CHRISTENSEN M, PURSLOW P P, LARSEN L M. The effect of cooking temperature on mechanical properties of whole meat, single muscle fi bres and perimysial connective tissue[J]. Meat Science, 2000, 55(3): 301-307.
[14] HUANG Feng, HUANG Ming, XU Xinglian, et al. Infl uence of heat on protein degradation, ultrastructure and eating quality indicators of pork[J]. Journal of the Science of Food and Agriculture, 2011, 91(3): 443-448.
[15] OKITANI A, ICHINOSE N, ITOH J, et al. Liberation of actin from actomyosin in meats heated to 65℃[J]. Meat Science, 2009, 81(3): 446-450.
[16] OKITANI A, ICHINOSE N, KOZA M, et al. AMP and IMP dissociate actomyosin into actin and myosin[J]. Bioscience, Biotechnology and Biochemistry, 2008, 72(8): 2005-2011.
[17] 李胜杰, 徐幸莲, 周光宏. 宰后肌动球蛋白解离对肉品嫩度的影响研究进展[J]. 食品科学, 2010, 31(21): 442-445.
[18] BRUNTON N P, LYNG J G, ZHANG L, et al. The use of dielectric properties and other physical analyses for assessing protein denaturation in beef biceps femoris muscle during cooking from 5 to 85℃[J]. Meat Science, 2006, 72(2): 236-244.
[19] LI Chao, WANG Daoying, DONG Han, et al. Effects of different cooking regimes on the microstructure and tenderness of duck breast muscle[J]. Journal of the Science of Food and Agriculture, 2013, 93(8): 1979-1985.
[20] 李超, 徐为民, 王道营. 加热过程中肉嫩度变化的研究[J]. 食品科学, 2009, 30(11): 262-265.
[21] KRYSTYNA P, HENRYK D. Changes in texture, cooking losses, and myofi brillar structure of bovine M. semitendinosus during heating[J]. Meat Science, 1999, 51(3): 237-243.
[22] WRIGHT D J, LEACH I B, WILDING P. Differential scanning calorimetric studies of muscle and its constituent proteins[J]. Journal of the Science of Food and Agriculture, 1977, 28(6): 557-564.
[23] WANG Daoying, DONG Han, ZHANG Muhan, et al. Changes in actomyosin dissociation and endogenous enzyme activities during heating and their relationship with duck meat tenderness[J]. Food Chemistry, 2013, 141(2): 675-679.
Heat-Induced Dissociation of Actomyosin in Duck Breast Muscle
DENG Shaoying
1,2, WANG Daoying
2, ZHANG Muhan
2, BIAN Huan
2, WU Haihong
2, ZHU Yongzhi
2, GENG Zhiming
2, LIU Fang
2, XU Weimin
2,*
(1. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China; 2. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract:The present study was performed to illustrate the change of actomyosin in duck breast muscle upon heat treatment. We examined the effects of heating temperature (45, 50, 55, 60, 65 and 70 ℃) and heating time (0, 1, 10, 20, 30 and 60 min) on the dissociation of actomyosin in duck muscle as evaluated by Western blotting on the basis of the change in its content. Results showed no dissociation of actomyosin was observed when muscles were heated at 45 ℃ (P > 0.05). With the extension of heating time, the actin content increased at the early stages and then declined when muscles were heated at 50, 55 or 60 ℃, but it was signifi cantly higher when compared with that in the control group (P < 0.05). After heating at 65 ℃ for 60 min, the actin content decreased to a level identical to that in the control group; however, after heating at 70 ℃ for 30 or 60 min, the presence of actin was not detected. The results suggested that the dissociation of actomyosin was signifi cantly improved when the muscle was heated at a temperature of 50–60 ℃ for 10–30 min.
Key words:duck breast; actin; heating
中图分类号:TS251.68
文献标志码:A
文章编号:1002-6630(2015)01-0001-05
doi:10.7506/spkx1002-6630-201501001
收稿日期:2014-03-06
基金项目:国家自然科学基金青年科学基金项目(31101312)
作者简介:邓少颖(1992—),女,硕士研究生,研究方向为肉品质量与安全。E-mail:shaoyinglucky@163.com
*通信作者:徐为民(1969—),男,研究员,博士,研究方向为肉品加工与质量控制。E-mail:weiminxu2002@aliyun.com